Universidad de los Andes Facultad de Ciencias Departamento de Biología Investigaciones Parasitológicas J.F.Torrealba Mérida- Venezuela.
|
|
|
- Antonio Vega Serrano
- hace 8 años
- Vistas:
Transcripción
1 Universidad de los Andes Facultad de Ciencias Departamento de Biología Investigaciones Parasitológicas J.F.Torrealba Mérida- Venezuela. Universidad Experimental Sur del Lago Dirección de Investigación y Postgrado Santa Bárbara del Zulia Venezuela. Utilización de la Reacción en Cadena de la Polimerasa (PCR) para el diagnóstico de tripanosomiasis y anaplasmosis en muestras de sangre de animales domésticos Santa Bárbara Zulia 2007
2 TALLER TEORICO-PRACTICO UTILIZACION DE LA REACCION EN CADENA DE LA POLIMERASA (PCR) PARA EL DIAGNOSTICO DE TRIPANOSOMIASIS Y ANAPLASMOSIS EN MUESTRAS DE SANGRE DE ANIMALES DOMESTICOS de junio 2007 PROGRAMA Martes 26. Llegada, instalación de equipos y arreglo de material en el laboratorio de biotecnología. Miércoles 27. AM: Bienvenida a los participantes del primer curso en laboratorio de biotecnología de UNESUR. Prof. Víctor Márquez. Conferencia Introductoria: Necesidad de un diagnóstico preciso en la detección de hemoparásitos. Prof. Néstor Añez, ULA. Colecta de muestras sanguíneas en animales sospechosos (Finca UNESUR) PM: Conferencia: Uso de la PCR como herramienta molecular para el diagnóstico de hemoparásitos. Fundamentos Teóricos. Lic. Gladys Crisante, ULA. Inicio procesamiento de las muestras colectadas. Jueves 28. AM: Conferencia: Aplicación de la técnica de PCR en el diagnóstico de Trypanosoma vivax y Anaplasma marginale en muestras sanguíneas de bovinos y bufalinos. Lic. Ana María Bolívar, ULA. PM: Procesamiento de las muestras y obtención de resultados. Lic. Ana María Bolívar, Lic. Gladys Crisante, Lic. Néstor Añez-Rojas Viernes 29. AM: Finalización de procesamiento de muestras, obtención de resultados. Discusión de resultados Lic. Ana María Bolívar, Lic. Gladys Crisante, Lic. Néstor Añez-Rojas, Prof. Néstor Añez PM: Entrega de Certificados 2
3 CONTENIDO Programa 2 Lista de autores 4 Editado por 5 Agradecimientos 6 A Manera de Presentación 7 Título: Utilización de la Reacción en Cadena de la Polimerasa (PCR) para el diagnóstico de tripanosomiasis y anaplasmosis en muestras de sangre de animales domésticos I.- INTRODUCCIÓN 9 II.- PRINCIPIO DEL METODO Reacción en cadena de la polimerasa Preparación de la muestra para la ejecución de la técnica de PCR: extracción de ADN Corrida electroforética en gel de agarosa y visualización de la reacción 14 III.- MEDIDAS DE SEGURIDAD PARA LA EJECUCION DE LA TECNICA DE PCR 15 IV.- ALCANCE DE LA TECNICA DE PCR DURANTE EL CURSO 16 V.- INFRAESTRUCTURA NECESARIA PARA LA EJECUCION DE LA TECNICA DE PCR 16 VI.- REACTIVOS 17 VII.- PREPARACION DE SOLUCIONES 19 VIII.- PROCEDIMIENTO DE ANALISIS 21 IX.- REFERENCIAS 27 3
4 LISTA DE AUTORES NESTOR AÑEZ, M.V., M.Sc., D.I.C., Ph.D., FRES. Investigaciones Parasitológicas J.F.Torrealba, Departamento de Biología, Facultad de Ciencias, Universidad de Los Andes, Mérida, Venezuela. GLADYS CRISANTE, BIOL. PARASITOL. Investigaciones Parasitológicas J.F.Torrealba, Departamento de Biología, Facultad de Ciencias, Universidad de Los Andes, Mérida, Venezuela. ANA MARIA BOLIVAR, BIOANAL., M.Sc. Investigaciones Parasitológicas J.F.Torrealba, Departamento de Biologia, Facultad de Ciencias, Universidad de Los Andes, Mérida, Venezuela. NESTOR AÑEZ-ROJAS, BIOL., M.Sc. Laboratorio de Biotecnología, Universidad Experimental del Sur del Lago (UNESUR), Santa Bárbara del Zulia, Venezuela. 4
5 EDITADO POR: NESTOR AÑEZ, M.V., M.Sc., D.I.C., Ph.D., FRES. COORDINADOR GLADYS CRISANTE, BIOL., PARASITOL. ASISTENTE Investigaciones Parasitológicas J.F.Torrealba Departamento de Biología, Facultad de Ciencias, Universidad de Los Andes Mérida, 5101, Venezuela VICTOR E. MARQUEZ, Ing., M.Sc. DIRECTOR INVESTIGACION Y POSTGRADO Universidad Nacional Experimental del Sur del Lago (UNESUR) Santa Bárbara del Zulia, Zulia, Venezuela
6 AGRADECIMIENTOS Los autores desean expresar su reconocimiento por el apoyo recibido de la Dirección de Investigación y Postgrado de la UNESUR en la persona del Prof. Víctor E. Márquez Pérez. Asimismo, agradecemos la colaboración del Lic. Néstor Añez- Rojas por la coordinación del curso en el laboratorio de Biotecnología de la UNESUR. Al Departamento de Biología, Facultad de Ciencias, Universidad de Los Andes, por autorizar a los miembros de Investigaciones Parasitológicas J.F.Torrealba para llevar a cabo el presente intercambio científico. Se agradece el apoyo de los proyectos CDCHT-ULA-C EM y UNESUR
7 A MANERA DE PRESENTACION El presente curso-taller titulado Utilización de la Reacción en Cadena de la Polimerasa (PCR) para el diagnóstico de tripanosomiasis y anaplasmosis en muestras de sangre de animales domésticos, presentado en la modalidad teórico-práctico, es el primero de una serie que se intenta programar en los espacios del recientemente creado laboratorio de Biotecnología de la Universidad Experimental del Sur del Lago (UNESUR), aprovechando la asociación o preconvenio entre el Laboratorio de Investigaciones Parasitológicas J.F.Torrealba, Facultad de Ciencias, Universidad de Los Andes, Mérida y la Dirección de Investigación y Postgrado de la UNESUR en Santa Bárbara del Zulia. Este taller ha sido diseñado con la deliberada intención de transferir tecnologías estandarizadas y suficientemente aplicadas desde un laboratorio, con una cierta experiencia acumulada durante los últimos 35 años, hasta una naciente unidad de investigación, donde justamente esta actividad todavía no se ha convertido en una tradición. Sin embargo, nuestro más caro deseo es que además de captarse los principios y fundamentos de las metodologías que se explicarán durante este intercambio científico, logremos motivar a los jóvenes participantes para que se adentren en el quehacer científico sin rubor y, para que con la conjunción del talento y la irreverencia propia de la juventud, puedan pronto llegar a hacer buena ciencia espontáneamente. Asimismo, nos satisfaría enormemente la posibilidad de llegar a sensibilizar a este grupo de talentosos participantes sobre las problemáticas presentes en el área de influencia de la UNESUR, a las que pudiera dársele soluciones por la vía de la investiga3ción científica. Por esta razón hemos considerado pertinente en el presente curso trabajar sobre una problemática real que se vive a diario en las explotaciones ganaderas de la zona donde está enclavado el nuevo laboratorio, donde la tripanosomiasis y la anaplasmosis constituyen factores que pudieran estar interfiriendo sobre el desarrollo ganadero, transformándose en potenciales pérdidas o cantidades apreciables que se dejan de percibir en la actividad. De la misma manera, se pretende con la introducción de técnicas producto 7
8 de la nueva biotecnología dotar a los participantes de herramientas científicas lo suficientemente sólidas como para responder a tales retos. En este caso particular ofrecer la posibilidad de un diagnóstico certero, específico, altamente sensible y en corto tiempo, ensayando la técnica, quizás más utilizada en el presente, dada su alto grado de especificidad y sensibilidad. Una herramienta como esta podría permitir un diagnóstico en la población de animales explotados en el área, ofreciendo un conocimiento pleno sobre la prevalencia real de las infecciones mencionadas en grandes rebaños, sin interferencia diagnóstica como suele suceder cuando se aplican otros métodos parasitológicos y/o serológicos. De la misma manera, podría ser de gran utilidad a la hora de hacer un despistaje clínico de infecciones en animales de alta valía, ayudando a los médicos veterinarios a obtener un buen diagnóstico diferencial. Por otra parte, la amplitud de la aplicación de las técnicas ensayadas permite su aplicación en otros campos diferentes a los meramente médicos, incluyendo identificación en vegetales, aspectos de fitopatología u otras aplicaciones en el campo agronómico, dada la similitud de los principios de las mismas. Las pretensiones anteriormente esbozadas, nos permite ser optimistas al pensar que una unidad como la que hoy se estrena en la UNESUR, pueda lograr la plena integración entre la institución y su entorno, deseo genuino de todo el que transita el camino de la ciencia a través de la investigación, quien suele expresarse con júbilo cuando sus resultados llegan hasta el sitio donde el problema existe, dándole solución. Finalmente, debo expresar mi reconocimiento a las autoridades de la UNESUR, quienes a través de la Dirección de Investigación y Postgrado hicieron posible la realización de este primer curso. Asimismo, agradezco el tesón de los colaboradores que me acompañan en esta oportunidad, quienes no han escatimado esfuerzos para que el curso sea recordado con afecto Néstor Añez Coordinador Junio,
9 Utilización de la Reacción en Cadena de la Polimerasa (PCR) para el diagnóstico de tripanosomiasis y anaplasmosis en muestras de sangre de animales domésticos I.- INTRODUCCION Las infecciones por hemoparásitos en explotaciones animales de las regiones tropicales del mundo, en general, y de Venezuela, en particular, son causas de pérdidas inestimables en el sector pecuario por el impacto que sobre la salud y reproductividad de los animales domésticos explotados ejercen estas parasitosis. No obstante esta realidad, la detección de tales infecciones se basa fundamentalmente en criterios clínicos y métodos diagnósticos clásicos de baja sensibilidad y especificad, lo cual dificulta tener idea cierta de la prevalencia e incidencia reales de las dolencias ocasionadas en los rebaños. Entre las hemoparasitosis más comunes en rebaños ganaderos se encuentran la tripanosomiasis causada por Trypanosoma vivax y la anaplasmosis producida por Anaplasma marginale, las cuales se reconocen entre las entidades nosológicas de mayor importancia económica en nuestro medio rural. Lo anterior pareciera justificar la necesidad de llevar a cabo estudios científicos de relevancia que permitan el desarrollo de investigaciones cuyo producto coadyuve al control de las infecciones referidas. Uno de los aspectos indispensables para cumplir con este objetivo es obtener un diagnóstico certero y efectivo que supere la baja sensibilidad y especificidad de los métodos convencionales empleados hasta el presente (García y Mendoza-León, 2000; Tamasaukas y col., 2000). Trypanosoma (Duttonella) vivax Ziemann (1905), es el agente causal de una de las más importantes hemoparasitosis detectadas en animales ungulados silvestres y domésticos entre los que destacan bovinos, búfalos, cabras, ovejas, camellos y ciervos de países tropicales y subtropicales de Asia, África y América (Sandoval y col., 1996; Tamasaukas y Roa, 1996). A pesar de la amplia gama de hospedadores, es en el bovino donde el curso de la infección ha sido mayoritariamente estudiado 9
10 fundamentado quizás en las implicaciones económicas que ocasiona, entre las que se mencionan infertilidad en el ganado y pérdidas basadas en el número de animales afectados por finca, duración del brote, mortalidad, abortos, gastos por tratamiento, asistencia veterinaria, diagnóstico de laboratorio, retardo en el crecimiento y pérdidas en la producción (Guillen y col., 2001). Las manifestaciones clínicas producidas por T. vivax son muy variables, observándose desde accesos febriles, emaciación y anemia que pueden ocasionar la muerte hasta infecciones totalmente asintomáticas o subclínicas (Silva y col., 1996). En la transmisión vectorial de T. vivax, se incriminan principalmente dípteros hematófagos de los géneros Glossina, Tabanus y Stomoxys (Otte y Abuabara, 1991), aunque la transmisión puede ser llevada a cabo por especies de los géneros Boophilus, Culicoides y Psilopelmia (Rodríguez-Vivas y col., 2003), habiéndose documentado además, transmisión transplacentaria (Meléndez y col., 1993; González y Espinoza, 1994). Los medios más comunes para detectar infecciones por T. vivax incluyen los métodos parasitológicos y serológicos. Los primeros, confrontan como inconveniente principal la baja sensibilidad en la medida que la infección tiende a la cronicidad o la parasitemia se mantiene en bajos niveles (De Almeida y col., 1997). Por su parte, los métodos serológicos presentan como principales deficiencias no poder discriminar entre infecciones recientes y pasadas y no diferenciar entre reacciones cruzadas con otros patógenos con los que T. vivax comparte similitud antigénica como Trypanosoma evansi y Trypanosoma theileri (Desquesnes, 1997; Morlais y col., 2001). Recientemente, las técnicas de biología molecular, particularmente la Reacción en Cadena de la Polimerasa (PCR, por sus siglas en inglés), ha permitido revelar infecciones en animales sintomáticos o asintomáticos sin parasitemia detectable (Dirie y col., 1993). Diferentes secuencias de ADN y ARN han sido diseñadas a partir de aislados africanos y americanos a fin de obtener mayor sensibilidad y especificidad en el diagnóstico (Ventura y col., 2001). En relación con la prevalencia de la tripanosomiasis bovina por T. vivax en Venezuela, durante la última década se han venido detectando valores de 20,8% al 57,8% por exámenes serológicos e infecciones activas de 1% a 3,9% por exámenes 10
11 parasitológicos directos (Toro, 1990; Perrone y col., 1991; Tamasaukas y col., 1996). A pesar de estos hallazgos, el interés por la investigación sobre T. vivax es escaso, circunstancia que ha traído como consecuencia que en muchas zonas ganaderas la comprensión de su verdadera epizootiología y el verdadero papel que juega como limitante de la producción bovina sean restringidos (Rivera, 1996). Esto, por supuesto, incluye la región del sur del Lago de Maracaibo, área de influencia de la UNESUR, donde se conoce de la presencia de la dolencia en rebaños de ganado, pero se ignora la prevalencia e incidencia reales en los mismos. Anaplasma marginale Theiler (1910) es un microorganismo rickettsial causante de la condición patológica denominada anaplasmosis que afecta principalmente a bovinos, bufalinos, camélidos, bisontes, antílopes y venados de las regiones tropicales y sub-tropicales del mundo (Díaz y col.; 2003). A. marginale puede ser transmitido biológicamente por garrapatas o mecánicamente en las piezas bucales de insectos hematófagos o por inoculación directa de eritrocitos infectados a animales susceptibles a través de agujas hipodérmicas contaminadas e instrumentos quirúrgicos y, en algunos casos, por vía transplacentaria (Coronado, 1997). Las pérdidas económicas causadas por la anaplasmosis son cuantiosas en la mayoría de los países afectados, atribuibles tanto a factores de morbilidad como de mortalidad (Toro, 1997). En Venezuela, su presencia ha sido señalada en diferentes regiones, representando junto con babesiosis y tripanosomiasis, la triada hemotrópica de mayor importancia que obstaculiza el desarrollo de la industria ganadera (Monsalve, 1997). Los síntomas clínicos son variables, y pueden incluir fiebre, perdida de peso, descenso en la producción láctea, aborto, letargo, ictericia y palidez de las mucosas; en los casos más graves se observan síntomas nerviosos por anoxia cerebral y tendencia al decúbito que pueden llevar a la muerte (Melman, 2004). En nuestro país, la anaplasmosis es considerada como una enfermedad parasitaria enzootica de amplia distribución, existiendo las condiciones edafoclimáticas para el desarrollo y evolución de sus vectores naturales en casi todas las regiones geográficas. En este 11
12 sentido, el status epizootiológico de los rebaños puede variar desde una condición de inestabilidad enzootica (bajo porcentaje de animales infectados con alta susceptibilidad a la infección clínica) hasta una condición de estabilidad enzootica (alto porcentaje de animales infectados y baja susceptibilidad del rebaño a enfermar clínicamente) (Toro, 1997). La detección de A. marginale empleando métodos parasitológicos directos y serológicos se dificulta por la baja sensibilidad y especificidad que algunas de estas técnicas presentan, situación demostrada con el desarrollo de la PCR y las sondas de ácidos nucleicos (Melman, 2004). El objetivo fundamental del presente curso es entrenar a los participantes para la detección de ADN circulante de Trypanosoma vivax y Anaplasma marginale en sangre venosa de bovinos y/o bufalinos obtenida bajo condiciones de campo. El método consiste en utilizar la técnica molecular de PCR con oligonucleótidos especie-específicos para ambos microorganismos, con la esperanza de lograr un diagnóstico de alta sensibilidad y especificidad. II.- PRINCIPIO DEL METODO 1. REACCION EN CADENA DE LA POLIMERASA La Reacción en Cadena de la Polimerasa (PCR), implica una síntesis continua de ADN in vitro combinando en un tubo de ensayo una muestra de ADN problema, oligonucleótidos específicos (o primers), desoxirribonucleótidos trifosfatos (dntps), una polimerasa (enzima Taq polimerasa) en un tampón apropiado (buffer y MgCl 2 ) para la elongación de los oligonucleótidos por la polimerasa. Este proceso consta de 3 pasos, con temperaturas y tiempos diferentes repetidos sucesivamente que le permiten a la polimerasa actuar en una sucesión de ciclos sin inactivarse, los cuales se describen a continuación y se pueden apreciar en la Figura Desnaturalización: En este paso el templado es sometido a altas temperaturas permitiendo la exposición de la secuencia de ADN blanco de amplificación. 12
13 2. Alineamiento: Durante esta etapa, la temperatura es disminuida con el fin de que los oligonucleótidos iniciadores (primers) reconozcan y se apareen con sus secuencias complementarias presentes en el blanco de la reacción, proporcionando un extremo hidroxilo 3 libre como sustrato para la enzima sintetizadora de ADN (ADN polimerasa). 3. Extensión, síntesis o elongación: En esta fase se formará una molécula de ADN por cada oligonucleótido apareado, cuya secuencia es idéntica a la del ADN blanco de amplificación (Fig.1). Figura 1. Esquema diagramático de la Técnica de Reacción en Cadena de la Polimerasa (PCR) La PCR como técnica molecular, posee características especiales que la hace útil en la identificación y diagnóstico debido a su especificidad, sensibilidad, versatilidad, rapidez y accesibilidad. Es eficiente en la detección de un patógeno a nivel de género; caracterización de la especie, complejo o serotipo del organismo presente en una muestra determinada y en la identificación individual de un organismo. 13
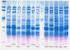
14 2. PREPARACION DE LA MUESTRA PARA LA EJECUCION DE LA TECNICA DE PCR: EXTRACCION DE ADN Una vez seleccionada la fuente de ADN, la muestra debe ser sometida a un proceso de extracción de ácidos nucleicos con el fin de preservarlos y evitar la acción degradativa de enzimas u otros compuestos presentes en la misma, además de eliminar sustancias que interfieran o inhiban de alguna manera la reacción de amplificación. En general, los métodos de preparación de muestras buscan separar proteínas y extraer ADN. Las extracciones de ADN de todos los organismos guardan cierta similitud y consisten en romper las células para liberar su contenido y separar el ADN liberado del resto de los componentes celulares. 3. CORRIDA ELECTROFORETICA EN GEL DE AGAROSA Y VISUALIZACION DE LA REACCION Una vez terminada la PCR, se realiza una técnica conocida como electroforesis horizontal en gel de agarosa para visualizar los millones de fragmentos de ADN de interés. Esta técnica consiste en armar un gel de agarosa, polisacárido ramificado de unidades D-galactosa y 3,6-anhidro-1-galactosa altamente hidrofóbico, con pequeños huecos en un extremo donde se deposita el contenido del tubo de PCR. El gel es sometido a corriente eléctrica de modo que el ADN, una molécula cargada negativamente, se desplaza por el gel hacia el polo positivo. La matriz formada por la agarosa ofrece una resistencia al movimiento. De esta manera, las moléculas de mayor tamaño tendrán dificultad para pasar por los poros de la matriz, quedándose en la región superior del gel, mientras que los fragmentos de menor tamaño se movilizarán con facilidad, alcanzando su parte inferior (Figura 2). Dependiendo de la concentración de agarosa, la matriz formada permitirá la separación efectiva de diferentes tamaños de ADN. Una vez concluida la electroforesis, se agrega al gel bromuro de etidio, colorante que se intercala entre las bases del ADN y permite 14
15 visualizarlo al ser iluminado con luz ultravioleta (UV). Las bandas luminosas corresponden a los fragmentos de ADN amplificados. Figura 2. Electroforesis en gel de agarosa para separar y visualizar el fragmento de ADN de interés III.- MEDIDAS DE SEGURIDAD PARA LA EJECUCION DE LA TECNICA DE PCR Las diferentes actividades a ejecutar durante el desarrollo de la técnica de PCR, deben ser realizadas en áreas específicas preferiblemente separadas físicamente, con el fin de minimizar el riesgo de contaminación de una reacción previa a la amplificación con ADN o ARN de una muestra o con el producto de amplificación de otra. Estas precauciones son absolutamente necesarias para evitar resultados que pudieran interpretarse como falsos positivos. En la mayoría de los laboratorios que desarrollan pruebas de amplificación de ADN por la técnica de PCR, se designan tres áreas de trabajo: 1. Área de preparación de muestra 2. Área de preparación de reactivos 3. Área de corrida de electroforesis Es de suma importancia respetar la ubicación de reactivos, muestras y pipetas en cada una de estas áreas. El éxito de las pruebas y la pulcritud de los resultados dependerá del cuidado que se tenga en evitar la contaminación de las muestras. 15
16 Una vez preparadas las muestras como lo indican los protocolos, según sea el caso en el área de preparación de muestra, se procederá a montar la reacción de amplificación utilizando los reactivos y las concentraciones descritas para cada ensayo. El montaje de la reacción se hará en el área de preparación de reactivos. Dependiendo del perfil del laboratorio, el manejo de la muestra con pipetas escogidas para tal fin deberá efectuarse en una campana de flujo laminar estéril. En su defecto en campanas de extracción con las debidas precauciones. IV.- ALCANCE DE LA TECNICA DE PCR DURANTE EL CURSO Se pretende la detección de ADN específico de Trypanosoma vivax y Anaplasma marginale en sangre venosa de rumiantes empleando los oligonucleótidos TviSL1/TviSL2 y BAP-2/AL34S respectivamente, en un intento por establecer un medio diagnóstico altamente confiable dada su especificidad y sensibilidad. V.- INFRAESTRUCTURA NECESARIA PARA LA EJECUCION DE LA TECNICA DE PCR ESPACIO FISICO: Como se indica arriba con red eléctrica de 110v. EQUIPOS: Micropipetas 2µl - 200µl Centrifuga Microcentrifuga Balanza ph-metro Vortex Congelador -20ºC Estufas 65ºC Nevera 4ºC Horno microondas 16
17 Termociclador Fuente de poder Cámara para electroforesis (pequeña, para peine de10pozos) Transiluminador MATERIALES: Jeringas de 20ml Agujas 19Gx1½ Tubos plásticos de centrífuga 15ml Tubos plásticos estériles 1,5ml Tubos plásticos para mezcla de reacción PCR (200µl) Puntas para micropipetas 10µl y 200µl Fiolas Vasos de precipitado Cilindros graduados MATERIAL BIOLOGICO: Sangre venosa de rumiantes recolectada bajo condiciones de campo Aislados de T. vivax y A. marginale VI.- REACTIVOS Anticoagulante: Citrato de sodio al 3,8% Extracción ADN: Kit de Purificación ADN Wizard Genomic DNA Purification Kit (Promega) Isopropanol 100% Etanol 70% 17
18 Protocolo Buffer de lisis-proteinasa K Buffer de lisis Tris base 10mM NaCl 150 mm ph 7,5 Proteinasa K Fenol Cloroformo Alcohol isoamílico Etanol 100% Etanol 70% Mezcla de reacción PCR: Agua destilada megapura estéril (H 2 Od) Buffer 5X MgCl 2 25mM dntps 10mM Oligonucleótido TviSL1 61,0 nmoles [5 -GCT CTC CAA TCT TAA CCC TA - 3 ] Oligonucleótido TviSL2 42,4nmoles [5 -GTT CCA GGC GTG CAA ACG TC - 3 ] Oligonucleótido BAP-2 37,4 nmoles [5 -GTA TGG CAC GTA GTC TTG GGA TCA-3 ] Oligonucleótido AL34S 40,3 nmoles [5 -CAG CAG CAG CAA GAC CTT CA- 3 ] Taq polimerasa 5U/µl Corrida electroforética: Agarosa Tampón tris-borato EDTA (TBE) 10X 18
19 Tris base Acido bórico EDTA 0,5M ph 8,0 Acido acético glacial Marcador de peso molecular 100pb Bromuro de etidio (BrEt) VII.- PREPARACION DE SOLUCIONES 1. Buffer de lisis REACTIVO CANTIDAD CONCENTRACIÓN FINAL Tris base 5ml 10 mm NaCl 4.35g 150 mm H 2 0d 500ml - Una vez medidos y pesados los reactivos, disolver los componentes en H 2 0d y ajustar el ph a 7,5. 2. Tampón tris-borato EDTA (TBE) 10X REACTIVO CANTIDAD CONCENTRACIÓN FINAL Tris base 108g 0.045M Acido bórico 55g - EDTA 0,5M ph 8,0 40ml 0.001M H 2 0d 1000ml - Una vez medidos y pesados los reactivos, disolver los componentes en H 2 0d y ajustar el ph a 7,4 con ácido acético glacial. Esta solución será empleada como 19
20 stock. Para preparar los geles de agarosa y realizar la corrida electroforética, se empleará TBE 1X preparado con 50 ml TBE 10X y 450 ml H 2 Od. 3. Agarosa 3.1. Agarosa al 2% REACTIVO CANTIDAD CONCENTRACION FINAL Agarosa 1.0g 2% Tampón tris-borato EDTA (TBE) 1X 50ml Agarosa al 1.5% REACTIVO CANTIDAD CONCENTRACION FINAL Agarosa 0.75g 1.5% Tampón tris-borato EDTA (TBE) 1X 50ml - Pesar los gramos de agarosa señalados y agregar en fiola. Añadir el volumen de buffer de corrida TBE 1X especificado para cada caso, mezclar y llevar a horno microondas potencia 4 durante 3 minutos evitando la evaporación tapando el envase con un tapón de algodón. Agitar levemente a fin de homogeneizar la solución. Dejar enfriar la solución hasta alcanzar aproximadamente 55ºC. Preparar el molde de la cámara electroforética con su respectivo peine y servir la agarosa en el molde. Dejar gelificar sobre superficie lisa a temperatura ambiente (aproximadamente 15 minutos). Llevar a nevara 4ºC y mantener almacenada hasta el momento de realizar la corrida electroforética. 20
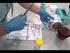
21 4. Bromuro de etidio (BrEt) REACTIVO CANTIDAD CONCENTRACIÓN FINAL Bromuro de etidio 50mg 0,5g/ml H 2 Od 100ml - Almacenar a 4ºC, protegido de la luz. El reactivo de trabajo para la coloración de los geles debe tener una concentración de 0,5μg/ml, por lo que al momento de su uso debe realizarse una dilución 1:1000 en H 2 Od. El BrEt es mutagénico y debe ser manipulado cuidadosamente. VIII.- PROCEDIMIENTO DE ANALISIS 1. Toma y conservación de la muestra problema La muestra de ADN problema para el ensayo de PCR será tomada a partir de la sangre venosa de un rumiante bajo condiciones de campo, para ello, previa inmovilización del animal, se procede a realizar asepsia de la región yugular con alcohol 70%. Seguidamente, se realiza la punción venosa utilizando aguja 19Gx1½ e inyectadora de 20ml para luego recoger la sangre en tubo plástico de centrifuga de 15ml, en dilución 1:9 con el anticoagulante. La muestra debidamente rotulada es trasportada en frío con la mayor prontitud al laboratorio para el análisis respectivo*. *: Otras formas de toma de muestra incluyendo papel de filtro, láminas portaobjetos y tubos capilares, serán analizadas durante el curso. 2. Control positivo y negativo ADN de muestras de animales que han resultado positivos o negativos a cada hemoparásito de interés mediante el empleo de técnicas parasitológicas directas y moleculares son empleados como controles para la reacción de PCR. 21
22 3. Preparación de muestras biológicas para ensayos de amplificación 3.1. Extracción del ADN de muestras Extracción de ADN para el diagnóstico de Trypanosoma vivax Cada muestra problema anticoagulada mantenida en frío es sometida a un proceso de centrifugación a 800g durante 10min para lograr la separación de las capas celulares del plasma sanguíneo. Seguidamente se procede a tomar 400µl de la interfase sanguínea y depositarlos en un tubo de centrifuga de 1,5ml para proceder a la extracción del ADN de cada muestra empleando el kit de purificación siguiendo las especificaciones descritas a continuación: Añadir 900µl de solución de lisis celular al tubo conteniendo la muestra y mezclar por inversión 5-6 veces Incubar 10 min a temperatura ambiente, invirtiendo 2-3 veces los tubos durante la incubación Centrifugar a 1400g durante 2 min a temperatura ambiente Separar el sobrenadante sin interferencias del sedimento (aprox µl de líquido) Vortex vigoroso del tubo hasta resuspender (10-15 seg) Añadir 300µl de solución nucleótido al tubo conteniendo las células resuspendidas y pipetear la solución 5-6 veces hasta lograr la lisis de las células blancas. La solución puede ser muy viscosa. Si cúmulos de células son muy visibles deshacerlos incubando a 37ºC hasta que desaparezcan Añadir 100µl de solución de precipitación de proteínas y vortex durante seg. Después de esto, pueden ser visibles pequeños cúmulos de proteínas Centrifugar 1400g durante 3 min. Un pellet marrón puede ser visible Transferir el sobrenadante a otro tubo conteniendo 300µl de isopropanol 100% Mezclar por inversión hasta que sea visible la masa de ADN. 22
23 Centrifugar a 1400g durante 1 min. El ADN es visible Descartar el isopropanol y añadir 1 volumen de etanol 70%. Invertir el tubo suavemente hasta lavar el ADN Centrifugar como en Aspirar el etanol con pipeta con mucho cuidado para no aspirar el ADN Invertir el tubo en papel absorbente y dejar secar a temperatura ambiente min Añadir 100µl de solución de rehidratación de ADN y almacenar toda la noche en nevera a 4ºC Extracción de ADN para el diagnóstico de Anaplasma marginale De la muestra problema centrifugada en el paso 3.1.1, tomar 500µl del concentrado celular rojo y depositarlos en un tubo de centrifuga de 1,5ml para proceder a la extracción del ADN de la muestra empleando el proceso de purificación descrito a continuación: Añadir 500µl de buffer de lisis y 5µl de proteinasa K al tubo de centrifuga. Mezclar por inversión e incubar durante 2 horas en estufa a 65ºC Transcurrido el tiempo, inactivar la proteinasa K, calentando la muestra a 100ºC Centrifugar a 1500g durante 15 min y trasvasar el sobrenadante a otro tubo de centrifuga de 1,5ml Añadir 1 volumen de fenol-cloroformo-alcohol isoamílico (25:24:1). Mezclar por inversión, reposar durante 2 min y centrifugar a 1500g durante 3 min Tomar con pipeta automática el sobrenadante y pasarlo a otro tubo de centrifuga de 1,5ml. Repetir el paso en caso de ser necesario Añadir 2,5 volúmenes de etanol 100%, mezclar por inversión e incubar durante 12 horas a temperatura de -20ºC. 23
24 Centrifugar a 1500g durante 10 min. Luego de este tiempo es observado el pellet de ADN. Descartar cuidadosamente el sobrenadante y dejar secar el tubo en posición investida durante 10 min Añadir 2,5 volúmenes de etanol 70%, centrifugar durante 5 min a 1500g. Transcurrido este tiempo, descartar cuidadosamente el sobrenadante y dejar secar como en Añadir 80µl de H 2 Od, disolver y dejar en nevera 4ºC durante 12 horas antes de montar la reacción. 4. Mezcla de reacción y condiciones de ciclaje 4.1. MEZCLA DE REACCION PARA T. vivax (Ventura y col; 2001) REACTIVO CONCENTRACION INICIAL VOLUMEN POR REACCION (µl) H 2 Od Buffer MgCl2 dntps Oligo TviSL1 Oligo TviSL2-5X 1,5mM 200µM 20µM 20µM 18,25 2,5 1,5 0,5 1,0 1,0 Taq polimerasa Templado 2,5U/µl - 0,25 5,0 Total 25,0 24
25 4.2. MEZCLA DE REACCION PARA A. marginale (Stich y col; 1993) REACTIVO CONCENTRACION INICIAL VOLUMEN POR REACCION (µl) H 2 O d Buffer MgCl2 dntps Oligo BAP-2 Oligo AL34S - 1X 3,5mM 0,8µM 1,8µM 1,8µM 12,25 5,0 3,5 2,0 1,0 1,0 Taq polimerasa Templado 2,5U/µl - 0,25 5,0 Total 25,0 Realizar cálculos matemáticos de volumen por reacción de PCR para un total de 4 reacciones para cada microorganismo, incluyendo muestra problema, control positivo, control negativo y control de reacción (blanco sin ADN). CONDICIONES DE CICLAJE CONDICIONES DE CICLAJE PARA T. vivax PASO TEMPERATURA desnaturalización inicial 94 DESNATURALIZACION 94 ALINEAMIENTO 65 EXTENSION 72 extensión final 72 TOTAL TIEMPO 1min 1min 2min 3min 10min 35 ciclos 25
26 CONDICIONES DE CICLAJE PARA A. marginale PASO TEMPERATURA desnaturalización inicial 94 DESNATURALIZACION 94 ALINEAMIENTO 60 EXTENSION 72 extensión final 72 TOTAL TIEMPO 3min 1min 1min 0,5min 3min 32 ciclos 5. Corrida electroforética y visualización de la reacción Para visualizar los productos de PCR después de la amplificación, se emplea la electroforesis en gel de agarosa al 2% y 1,5% para los productos de TviSL1/TviSL2 y BAP-2/AL34S respectivamente y luz ultravioleta, que permiten corroborar que el producto amplificado corresponde al peso molecular esperado Para ello, el gel de agarosa es sacado de refrigeración y colocado en la cámara electroforética conteniendo buffer TBE 1X. Retirar cuidadosamente el peine Tomar 10µl de cada amplificado y depositarlo en los pozos del gel en el siguiente orden: peso molecular, control positivo, ADN muestra problema, ADN control negativo y control de reacción Conectar a fuente de poder y correr a un voltaje constante de 100 voltios por 35 min aproximadamente, tiempo en el que el primer frente alcanza las ¾ partes del gel Colorear con BrEt por 5 min seguido de una decoloración en H 2 0d por 20 min Colocar el gel sobre el transiluminador que permite visualizarlo bajo UV. El fragmento amplificado debe corresponder a una banda aproximada de 210 pb, para el control positivo de T. vivax y 409 pb para A. marginale, empleando como referencia, la banda de 500 pb del marcador de peso molecular. 26
27 IX. REFERENCIAS 1. Bolívar A.M; García-Lugo P.; Crisante G.; Rojas A.; Teixeira M.M.G.; Añez, N Detección de infecciones subclínicas por Trypanosoma vivax en bovinos de fincas ganaderas de Mérida, Venezuela. Boletín de Malariología y Salud Ambiental XLVI(1): Bolívar, A.M.; Reyna-Bello A.; García, F.; García-Lugo, P.; Crisante, G.; Rojas, A.; Añez, N Uso de proteínas como alternativa diagnóstica para discriminar infecciones entre Trypanosoma vivax y Trypanosoma evansi. Boletín de Malariología y Salud Ambiental XLVII(1): Coronado, A Transmisión de Anaplasma Marginale, Theiler, Memorias. ASODEGAA. El Vigía-Venezuela. 4. Crisante, G Pruebas confirmatorias para el diagnóstico de la Enfermedad de Chagas. En: La Enfermedad de Chagas. Innovaciones diagnósticas para el nuevo milenio. Ed. Añez, N. & Crisante, G. Universidad de Los Andes, Mérida. Venezuela. 5. De Almeida, P.; Ndao, M.; Van Meirvenne, N.; Geets, S Diagnostic evaluation of PCR in goats experimentally infected with Trypanosoma vivax. Acta Tropica, 66: Desquesnes, M Evaluation of a simple PCR technique for the diagnosis of Trypanosoma vivax infection in the serum of cattle in comparison to parasitological techniques and antigen-enzyme-linked immuno sorbent assay. Acta Tropica, 65: Díaz, D.; Valera, Z.; de Andrade E.; Parra O.; Escalona, F.; Ramirez, R Prevalencia de Anaplasma marginale en bovinos del sector La Piñata, Municipio La Cañada de Urdaneta, Estado Zulia, Venezuela. Rev. Cientif. FCV-LUZ. XIII(3): Dirie, M.; Otte, M.; Thatthi, R.; Gardiner, P Comparative studies of Trypanosoma (Duttonella) vivax isolates from Colombia. Parasitol. 106: García, H.; Mendoza-León, A Diagnóstico molecular en protozoarios Kinetoplastida. Principios y aplicaciones. Rev. Fac. Cs. Vets. UCV. 41: González, N.; Espinoza, E Transmisión transplacentaria del Trypanosoma vivax y su efecto sobre la descendencia de hembras gestantes infectadas experimentalmente. Vet. Trop. 19:
28 11. Guevara, P Diagnóstico molecular de Leishmania, Trypanosoma cruzi y Trypanosoma rangeli En: Programa especial XX Aniversario Centro J.W.T. Trujillo. Venezuela. 12. Guillén, A.; León, E.; Aragot, W.; Silva, M Diagnóstico de hemoparásitos en el Instituto de Investigaciones Veterinarias Periodo Vet. Trop. 26(1): Identificación y diagnóstico molecular de microorganismos. Manual de laboratorio Proyecto Iniciativa Científica del Milenio. Red de Innovación Tecnológica IDMM. 14. Meléndez, R.; Forlano, M.; Figueroa, W Perinatal infection with Trypanosma vivax in a calf in Venezuela. J. Parasitol. 79: Melman S.; Hartt, Y.; Giardina, S El uso de la biología molecular en el diagnóstico de Anaplasma marginale. Laboratorio de Bioquímica e Inmunología de Hemoparásitos. Departamento de Biología Celular, Universidad Simón Bolívar. Caracas-Venezuela. 16. Monsalve, F Conductas a seguir frente a un brote de hemoparásitos y aportes farmacológicos para el tratamientote la babesiosis, anaplasmosis y tripanosomiasis en Venezuela. Memorias. ASODEGAA. El Vigía-Venezuela. 17. Morlais, I.; Ravel, S.; Grébaut, P.; Dumas, V.; Cuny, G New molecular market for Trypanosoma (Duttonella) vivax identification. Acta Tropica, 80: Otte, M.; Abuabara, J Transmision of South America Trypanosoma vivax by the neotropical horsefly Tabanus nebulosus. Acta Tropica. 49: Perrone, T.; Lesseur, C.; Reveron, I.; Espinoza, E.; Aso, P Análisis seroepidemiológico de la tripanosomiasis bovina en la zona de Santa María de Ipire. Acta Cient. Venezol. 42(Supl.1): Rivera, M Hemoparasitosis bovinas: tripanosomiasis. UCV-Venezuela. Consejo de Desarrollo Científico y Humanístico pag. 21. Rodríguez-Vivas, R.; Quiñónez-Avila, F.; Ramírez-Cruz, G; Ruiz-Piña, H Presencia del género Trypanosoma en la garrapata Boophilus microplus en el trópico mexicano. Rev. Biomed. 14:
29 22. Sandoval, E.; Espinoza, E.; Valle, A Leucopenia y trombocitopenia en ovejas infectadas experimentalmente con Trypanosoma vivax. Vet. Trop. 21: Silva, R.; Da Silva, J.; Schneider, R.; Freitas, J.; Mesquita, D.; Mesquita, T.; Ramirez, L.; Rivera, A.; Barbosa, M Outbreak of Trypanosomiasis due to Trypanosoma vivax (Ziemann, 1905) in Bovines of the Pantanal, Brazil. Mem. Inst. Oswaldo Cruz, 91: Stich R.; Bantle J.; Kocan K.; Fekete A Detection of Anaplasma marginale (Rickettsiales: Anaplasmataceae) in Hemolymph of Dermacentor andersoni (Acari: Ixodidae) with the Polymerase Chain Reaction. Journal of Medical Entomology. 30(4): Tamasaukas, R.; Aguirre A., Ron J., Roa N.; Cobo M Tetralogía hemoparasitaria en algunas fincas bovinas del Municipio Santa Rita, Estado Guárico, Venezuela. Rev. Fac. Cs. Vets. UCV. 41: Tamasaukas, R.; Roa, N Trypanosomiasis bovina (T. vivax): una revisión. Maracay. Venezuela. Fondo Nacional de Investigaciones Agropecuarias. 64 pag. 27. Tamasaukas, R.; Ruiz, H.; Baldizan, A.; Gonzalez, A.; Aguirre, A Seroprevalencia relativa general debida al Trypanosoma vivax en fincas de la región central de Venezuela. Acta Cient. Venezol. 48(Supl.1): Toro, M Seroepidemiología de las hemoparasitosis en Venezuela. Curso sobre técnicas de inmunodiagnóstico de enfermedades causadas por hemoparásitos. USB-FCV-UCV. Mimeo. 12 pag. 29. Toro, M Epizootiología y métodos de control de la anaplasmosis. En: Taller sobre agentes hemotrópicos tripanosomiasis-babesiosis-anaplasmosis. Memorias. ASODEGAA. El Vigia-Venezuela. 30. Ventura, R.M; Paiva F.; Silva R.A.M.; Takeda G.; Buck G.; Teixeira M.M.G Trypanosoma vivax: Characterization of the spliced-leader gene 1 of a brazilian stock and species-specific detection by PCR amplification of a intergenic spacer sequence. Exper. Parasitol., 99:
APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS
 Prácticas docentes en la COD: 10-71 APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS FUNDAMENTO TEÓRICO La PCR es una técnica que permite llevar a cabo la síntesis in vitro de fragmentos de ADN. Está basada
Prácticas docentes en la COD: 10-71 APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS FUNDAMENTO TEÓRICO La PCR es una técnica que permite llevar a cabo la síntesis in vitro de fragmentos de ADN. Está basada
DETECCIÓN DE C. jejuni EN HAMBURGUESA DE POLLO POR PCR TRADICIONAL PRT-712.04-082
 Página 1 de 5 1. OBJETIVO Detectar la presencia de Campylobacter jejuni en hamburguesa de pollo mediante técnica de PCR. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a muestras de hamburguesa
Página 1 de 5 1. OBJETIVO Detectar la presencia de Campylobacter jejuni en hamburguesa de pollo mediante técnica de PCR. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a muestras de hamburguesa
CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL
 LIBRO DE MEMORIAS 2 CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL Santiago de Cali, 23 al 28 de agosto de 2010 3 Libro de memorias
LIBRO DE MEMORIAS 2 CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL Santiago de Cali, 23 al 28 de agosto de 2010 3 Libro de memorias
DANAGENE SALIVA KIT. Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones
 DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION DANAGENE SALIVA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras
DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION DANAGENE SALIVA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras
velocidades de movimiento mediante la aplicación de un campo eléctrico a través de una matriz porosa
 INTRODUCCIÓN En general, la electroforesis es una técnica que separa las moléculas en base a sus diferentes velocidades de movimiento mediante la aplicación de un campo eléctrico a través de una matriz
INTRODUCCIÓN En general, la electroforesis es una técnica que separa las moléculas en base a sus diferentes velocidades de movimiento mediante la aplicación de un campo eléctrico a través de una matriz
ELABORACIÓN N DE MEZCLA PARA PCR. Raquel Asunción Lima Cordón
 ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
3. COMPONENTES. Tampón de electroforesis concentrado 2 x 50 ml 10 X (2 envases 500ml)
 PCR SIMULADA Ref.PCR Simulada (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
PCR SIMULADA Ref.PCR Simulada (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
ELECTROFORESIS AVANZADA
 Ref.ELECAVANZADA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref.ELECAVANZADA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
DETERMINACIÓN DEL FACTOR Rh por PCR
 Ref.PCRRh DETERMINACIÓN DEL FACTOR Rh por PCR 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Ref.PCRRh DETERMINACIÓN DEL FACTOR Rh por PCR 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Módulo 1 Biología Molecular Genética Molecular II 2009. Módulo 1. Amplificación de un fragmento de ADN genómico por PCR
 Módulo 1 Amplificación de un fragmento de ADN genómico por PCR En este primer módulo se amplificará por PCR, mediante el uso de oligonucleótidos específicos, un fragmento de ADN genómico de Aspergillus
Módulo 1 Amplificación de un fragmento de ADN genómico por PCR En este primer módulo se amplificará por PCR, mediante el uso de oligonucleótidos específicos, un fragmento de ADN genómico de Aspergillus
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 Unidad Curricular: Virología y Micología Veterinaria 1 TRABAJO PRÁCTICO No. 3 AMPLIFICACIÓN DE GENES VIRALES Reacción en Cadena de la Polimerasa, conocida como PCR (por sus siglas en inglés: Polimerase
Unidad Curricular: Virología y Micología Veterinaria 1 TRABAJO PRÁCTICO No. 3 AMPLIFICACIÓN DE GENES VIRALES Reacción en Cadena de la Polimerasa, conocida como PCR (por sus siglas en inglés: Polimerase
ELECTROFORESIS BASICA
 Ref.ELECBASICA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS BASICA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref.ELECBASICA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS BASICA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Código: IDX-016 Ver: 1 TOXO. Sistema para la detección de la presencia de ADN de Toxoplasma gondii. Reg. MSP 21205
 Sistema para la detección de la presencia de ADN de Toxoplasma gondii Reg. MSP 21205 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. info@atgen.com.uy www.atgen.com.uy
Sistema para la detección de la presencia de ADN de Toxoplasma gondii Reg. MSP 21205 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. info@atgen.com.uy www.atgen.com.uy
Materiales para la secuenciación de ADN
 Introduccion La Secuenciación Sanger es un método de secuenciación de ADN en el que el ADN diana se desnaturaliza y se hibrida con un cebador de oligonucleótidos, que se extiende entonces gracias a la
Introduccion La Secuenciación Sanger es un método de secuenciación de ADN en el que el ADN diana se desnaturaliza y se hibrida con un cebador de oligonucleótidos, que se extiende entonces gracias a la
Código: IDK-010 Ver: 1. Proteína G C825T. Sistema para la detección de la mutación C825T en el gene de la proteína G.
 C825T Sistema para la detección de la mutación C825T en el gene de la proteína G. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy www.atgen.com.uy
C825T Sistema para la detección de la mutación C825T en el gene de la proteína G. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy www.atgen.com.uy
AUTOR: JORGE CONTRERAS PINEDA 1. Titulo:
 Página 1 de 1 1. Titulo: Electroforesis de DNA 2. Objetivo Conocer los principios básicos de la electroforesis horizontal en geles de agarosa y aplicarlo para la separación de DNA humano, plasmídico, recombinante
Página 1 de 1 1. Titulo: Electroforesis de DNA 2. Objetivo Conocer los principios básicos de la electroforesis horizontal en geles de agarosa y aplicarlo para la separación de DNA humano, plasmídico, recombinante
CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA. Grado en Medicina
 DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III FACULTAD DE MEDICINA UNIVERSIDAD COMPLUTENSE DE MADRID CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA Grado en Medicina CURSO ACADÉMICO 2014/2015 INDICE
DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III FACULTAD DE MEDICINA UNIVERSIDAD COMPLUTENSE DE MADRID CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA Grado en Medicina CURSO ACADÉMICO 2014/2015 INDICE
Estudio de la dinámica integral de Babesia bigemina en un bovino infectado experimentalmente
 Jornadas de Parasitología Veterinaria, Facultad de Veterinaria, Uruguay (2002) Estudio de la dinámica integral de Babesia bigemina en un bovino infectado experimentalmente María A. Solari 1, Felipe Bermudez
Jornadas de Parasitología Veterinaria, Facultad de Veterinaria, Uruguay (2002) Estudio de la dinámica integral de Babesia bigemina en un bovino infectado experimentalmente María A. Solari 1, Felipe Bermudez
3/22/2010. Iván Ferrer Rodríguez, PhD Catedrático. En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR.
 Iván Ferrer Rodríguez, PhD Catedrático En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR. Síntesis "in vitro" de secuencias específicas de ADN son amplificadas.
Iván Ferrer Rodríguez, PhD Catedrático En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR. Síntesis "in vitro" de secuencias específicas de ADN son amplificadas.
METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR)
 METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR) Centro de de Microscopía Electrónica Facultad de de Ciencias Médicas Universidad Nacional de de Córdoba
METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR) Centro de de Microscopía Electrónica Facultad de de Ciencias Médicas Universidad Nacional de de Córdoba
5. MATERIALES Y MÉTODOS
 5. MATERIALES Y MÉTODOS 5.1 Equipos Los siguientes termocicladores se emplearon para la amplificación por PCR: - Perkin Elmer, GeneAmp PCR System 2400. - Perkin Elmer, GeneAmp PCR System 9600. - Applied
5. MATERIALES Y MÉTODOS 5.1 Equipos Los siguientes termocicladores se emplearon para la amplificación por PCR: - Perkin Elmer, GeneAmp PCR System 2400. - Perkin Elmer, GeneAmp PCR System 9600. - Applied
PROCEDIMIENTO PARA LA UTILIZACIÓN DEL POLIMORFISMO DEL GEN COMT (CATECOL-OXI-METILTRANSFERASA) EN EL DIAGNÓSTICO DEL SÍNDROME DE FIBROMIALGIA
 2 PROCEDIMIENTO PARA LA UTILIZACIÓN DEL POLIMORFISMO DEL GEN COMT (CATECOL-OXI-METILTRANSFERASA) EN EL DIAGNÓSTICO DEL SÍNDROME DE FIBROMIALGIA D E S C R I P C I Ó N OBJETO DE LA INVENCIÓN La presente
2 PROCEDIMIENTO PARA LA UTILIZACIÓN DEL POLIMORFISMO DEL GEN COMT (CATECOL-OXI-METILTRANSFERASA) EN EL DIAGNÓSTICO DEL SÍNDROME DE FIBROMIALGIA D E S C R I P C I Ó N OBJETO DE LA INVENCIÓN La presente
Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz
 IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
TÉCNICAS GENÓMICAS. 2) Cuantificación del número de virus presentes en muestras de sangre o suero: carga vírica
 TÉCNICAS GENÓMICAS Utilidad/Objetivos: 1) Detección de microorganismos directamente en muestras clínicas identificando un fragmento específico del genoma del microorganismo concreto 2) Cuantificación del
TÉCNICAS GENÓMICAS Utilidad/Objetivos: 1) Detección de microorganismos directamente en muestras clínicas identificando un fragmento específico del genoma del microorganismo concreto 2) Cuantificación del
Reacción en cadena de la polimerasa (PCR)
 Dr. Alejandro Leal Reacción en cadena de la polimerasa (PCR) La reacción en cadena de la polimerasa (PCR, por sus siglas en inglés de "polymerase chain reaction") es un método de amplificación in vitro
Dr. Alejandro Leal Reacción en cadena de la polimerasa (PCR) La reacción en cadena de la polimerasa (PCR, por sus siglas en inglés de "polymerase chain reaction") es un método de amplificación in vitro
DANAGENE RNA PURIFICATION KIT
 DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS
 GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS Leidy Diana Ardila Leal Docente. INTRODUCCIÓN En esta práctica se va a realizar la extracción
GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS Leidy Diana Ardila Leal Docente. INTRODUCCIÓN En esta práctica se va a realizar la extracción
PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR
 PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR Las causas pueden ser las siguientes: No hay ADN o se encuentra en muy baja concentración.
PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR Las causas pueden ser las siguientes: No hay ADN o se encuentra en muy baja concentración.
CUESTIONES. 1. Por qué la PCR convencional no es cuantitativa?
 2º BIOQUÍMICA CUESTIONES 1. Por qué la PCR convencional no es cuantitativa? En la PCR convencional, la cuantificación del ADN de la muestra es complicada debido a que la eficacia de amplificación va disminuyendo
2º BIOQUÍMICA CUESTIONES 1. Por qué la PCR convencional no es cuantitativa? En la PCR convencional, la cuantificación del ADN de la muestra es complicada debido a que la eficacia de amplificación va disminuyendo
Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa.
 Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa. Lic. Esp. Mariano Diego Massari 1er Congreso Bioquímico Córdoba 2011 8ª Jornada de Actualización
Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa. Lic. Esp. Mariano Diego Massari 1er Congreso Bioquímico Córdoba 2011 8ª Jornada de Actualización
Práctico: Genética bacteriana 2007.
 Práctico: Genética bacteriana 2007. Actividad integrada Departamento de Genética Departamento de Bacteriología y Virología. OBJETIVOS Objetivos generales El estudiante al terminar la actividad práctica
Práctico: Genética bacteriana 2007. Actividad integrada Departamento de Genética Departamento de Bacteriología y Virología. OBJETIVOS Objetivos generales El estudiante al terminar la actividad práctica
BIOTECNOLOGÍA. 1.- Ingeniería Genética, ADN recombinante
 BIOTECNOLOGÍA 1.- Ingeniería Genética, ADN recombinante Técnica del ADN recombinante: es la más usada en ingeniería genética, esta basada en el uso de las enzimas de restricción o endonucleasas de restricción
BIOTECNOLOGÍA 1.- Ingeniería Genética, ADN recombinante Técnica del ADN recombinante: es la más usada en ingeniería genética, esta basada en el uso de las enzimas de restricción o endonucleasas de restricción
GUIA TECNICAS MANUALES Y AUTOMATIZADAS DE VHS
 ESCUELA SALUD GUIA TECNICAS MANUALES Y AUTOMATIZADAS DE VHS DIRIGIDO A ALUMNOS DE: Técnico Superior de Laboratorio Clínico y Banco de Sangre PRE-REQUISITO: Laboratorio Clínico I, LCS 2100. INTRODUCCIÓN
ESCUELA SALUD GUIA TECNICAS MANUALES Y AUTOMATIZADAS DE VHS DIRIGIDO A ALUMNOS DE: Técnico Superior de Laboratorio Clínico y Banco de Sangre PRE-REQUISITO: Laboratorio Clínico I, LCS 2100. INTRODUCCIÓN
Practica la genética Ficha didáctica del profesorado Bachillerato
 Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
Artículo 3 Solución isotónica de Cloruro de Sodio
 Banco de levaduras Esta es una serie traducida del original en https://eurekabrewing.wordpress.com/ y publicada en nuestro sitio web con permiso expreso del autor. Artículo 3 Solución isotónica de Cloruro
Banco de levaduras Esta es una serie traducida del original en https://eurekabrewing.wordpress.com/ y publicada en nuestro sitio web con permiso expreso del autor. Artículo 3 Solución isotónica de Cloruro
P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA"
 P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA" Paso 1: Desnaturalización del DNA Paso 2: Hibridación de los "Primers" Paso 3: Extensión Paso 1: Desnaturalización del DNA
P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA" Paso 1: Desnaturalización del DNA Paso 2: Hibridación de los "Primers" Paso 3: Extensión Paso 1: Desnaturalización del DNA
PCR. Componentes del PCR. PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa)
 PCR PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa) Es una técnica de biología molecular descrita en 1986 por Kary Mullis. (Nobel de química en 1993) Necesidad de pruebas de diagnóstico
PCR PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa) Es una técnica de biología molecular descrita en 1986 por Kary Mullis. (Nobel de química en 1993) Necesidad de pruebas de diagnóstico
Técnicas moleculares.
 Técnicas moleculares. DMTV Carolina Acevedo Curso de Microbiología 2015 SÍNTESIS IN VITRO DE UNA GRAN CANTIDAD DE COPIAS DE UN SEGMENTO DE ADN EXISTENTE EN UNA MUESTRA. O sea. Amplificamos en forma exponencial
Técnicas moleculares. DMTV Carolina Acevedo Curso de Microbiología 2015 SÍNTESIS IN VITRO DE UNA GRAN CANTIDAD DE COPIAS DE UN SEGMENTO DE ADN EXISTENTE EN UNA MUESTRA. O sea. Amplificamos en forma exponencial
GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP)
 GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP) Existen diferentes modalidades de producción de PRP y es necesario establecer las garantías mínimas de calidad en la producción,
GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP) Existen diferentes modalidades de producción de PRP y es necesario establecer las garantías mínimas de calidad en la producción,
Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri
 Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri OBJETIVO Desarrollar un banco de datos a partir de plantas de origen indudable y del uso
Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri OBJETIVO Desarrollar un banco de datos a partir de plantas de origen indudable y del uso
1 MATERIALES Y MÉTODOS
 1 MATERIALES Y MÉTODOS El presente protocolo experimental contempla la amplificación del DNA de las bacterias y virus causantes de las ETS Neisseria gonorrhoeae, Chlamydia trachomatis y VPH mediante PCR
1 MATERIALES Y MÉTODOS El presente protocolo experimental contempla la amplificación del DNA de las bacterias y virus causantes de las ETS Neisseria gonorrhoeae, Chlamydia trachomatis y VPH mediante PCR
En los programas de estudio para sus estudiantes los Aprendizajes incluidos en la actividad son:
 INTRODUCCIÓN Recordemos que lo que define a un ser vivo entre otras funciones, es su función reproductiva, que permite que una especie se perpetúe en el tiempo, manteniendo las características de sus progenitores,
INTRODUCCIÓN Recordemos que lo que define a un ser vivo entre otras funciones, es su función reproductiva, que permite que una especie se perpetúe en el tiempo, manteniendo las características de sus progenitores,
CaniLeish : Metodología de aplicación
 CaniLeish : Metodología de aplicación Clínica de Petits Animals Albet www.albet.es clinicaveterinaria@albet.es El mercado informa de la disposición de una posible vacuna frente a la LEISHMANIOSIS. Enfermedad,
CaniLeish : Metodología de aplicación Clínica de Petits Animals Albet www.albet.es clinicaveterinaria@albet.es El mercado informa de la disposición de una posible vacuna frente a la LEISHMANIOSIS. Enfermedad,
Protocolos de secuenciación de ADN
 1 Protocolos de secuenciación de ADN Introducción El método de secuenciación utilizado aquí es el desarrollado por Sanger en 1975. Este consiste en la incorporación de didesixinucleótidos marcados fluorescentemente
1 Protocolos de secuenciación de ADN Introducción El método de secuenciación utilizado aquí es el desarrollado por Sanger en 1975. Este consiste en la incorporación de didesixinucleótidos marcados fluorescentemente
Actividad: Qué es la anomalía del agua?
 Nivel: 1º Medio Subsector: Ciencias químicas Unidad temática: El agua Actividad: Seguramente ya has escuchado sobre la anomalía del agua. Sabes en qué consiste y qué es algo anómalo? Se dice que algo es
Nivel: 1º Medio Subsector: Ciencias químicas Unidad temática: El agua Actividad: Seguramente ya has escuchado sobre la anomalía del agua. Sabes en qué consiste y qué es algo anómalo? Se dice que algo es
PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES
 PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES NO SE PRODUCE REACCIÓN O ÉSTA DECAE POCO DESPUÉS DE COMENZAR No hay ADN o hay menos del necesario No hay cebador o la concentración es inferior a la necesaria.
PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES NO SE PRODUCE REACCIÓN O ÉSTA DECAE POCO DESPUÉS DE COMENZAR No hay ADN o hay menos del necesario No hay cebador o la concentración es inferior a la necesaria.
LICITACIÓN PÚBLICA INTERNACIONAL PER/193/1630 ADQUISICIÓN DE ANALIZADORES AUTOMATICOS Y TERMOCICLADOR PARA EL HOSPITAL REGIONAL DE LAMBAYEQUE
 LICITACIÓN PÚBLICA INTERNACIONAL PER/193/1630 ADQUISICIÓN DE ANALIZADORES AUTOMATICOS Y TERMOCICLADOR PARA EL HOSPITAL REGIONAL DE LAMBAYEQUE Consultas y Pedido de Aclaraciones al Contenido de las Bases
LICITACIÓN PÚBLICA INTERNACIONAL PER/193/1630 ADQUISICIÓN DE ANALIZADORES AUTOMATICOS Y TERMOCICLADOR PARA EL HOSPITAL REGIONAL DE LAMBAYEQUE Consultas y Pedido de Aclaraciones al Contenido de las Bases
Tripanosomiasis bovina, Qué es? Y Por qué no representa un riesgo para el ganado Senepol?
 Asociación Senepol Colombia Departamento Técnico Santafé de Bogotá D.C. 2015 Tripanosomiasis bovina, Qué es? Y Por qué no representa un riesgo para el ganado Senepol? Qué es? La Tripanosomiasis es un término
Asociación Senepol Colombia Departamento Técnico Santafé de Bogotá D.C. 2015 Tripanosomiasis bovina, Qué es? Y Por qué no representa un riesgo para el ganado Senepol? Qué es? La Tripanosomiasis es un término
Procesado de muestras en el laboratorio de la clínica (I)
 12.prevención de la salud Procesado de muestras en el laboratorio de la clínica (I) A lo largo de esta primera parte veremos como realizar un manejo correcto de las muestras de sangre, orina y líquidos
12.prevención de la salud Procesado de muestras en el laboratorio de la clínica (I) A lo largo de esta primera parte veremos como realizar un manejo correcto de las muestras de sangre, orina y líquidos
Preguntas frecuentes sobre la enfermedad de Schmallenberg
 Preguntas frecuentes sobre la enfermedad de Schmallenberg 1.- DESCRIPCIÓN DE LA ENFERMEDAD: Qué es el virus Schmallenberg y cuál es su origen? El virus de Schmallenberg es un Orthobunyavirus vinculado
Preguntas frecuentes sobre la enfermedad de Schmallenberg 1.- DESCRIPCIÓN DE LA ENFERMEDAD: Qué es el virus Schmallenberg y cuál es su origen? El virus de Schmallenberg es un Orthobunyavirus vinculado
MMP. MÉTODOS DE MUESTREO Y PRUEBA DE MATERIALES
 LIBRO: PARTE: TÍTULO: CAPÍTULO: MMP. MÉTODOS DE MUESTREO Y PRUEBA DE MATERIALES 5. MATERIALES PARA SEÑALAMIENTO Y DISPOSITIVOS DE SEGURIDAD 01. Pinturas para Señalamiento 003. Contenido de Pigmento en
LIBRO: PARTE: TÍTULO: CAPÍTULO: MMP. MÉTODOS DE MUESTREO Y PRUEBA DE MATERIALES 5. MATERIALES PARA SEÑALAMIENTO Y DISPOSITIVOS DE SEGURIDAD 01. Pinturas para Señalamiento 003. Contenido de Pigmento en
Prueba ABtest. Para la cuantificación del pool beta-amiloide en sangre TOTAL
 Prueba Para la cuantificación del pool beta-amiloide en sangre TOTAL Introducción Es esencial un diagnóstico temprano. En la práctica clínica actual el diagnóstico de la enfermedad de Alzheimer se realiza
Prueba Para la cuantificación del pool beta-amiloide en sangre TOTAL Introducción Es esencial un diagnóstico temprano. En la práctica clínica actual el diagnóstico de la enfermedad de Alzheimer se realiza
CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS
 CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS Para el proceso de purificación del aceite, se pudo observar, en el momento del filtrado algunas partículas sólidas retenidas en los diferentes filtros
CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS Para el proceso de purificación del aceite, se pudo observar, en el momento del filtrado algunas partículas sólidas retenidas en los diferentes filtros
PROTOCOLO DE EXTRACCIÓN DE MUESTRAS FRESCAS DE TEJIDO DE AVES PARA ESTUDIOS GENÉTICOS
 PROTOCOLO DE EXTRACCIÓN DE MUESTRAS FRESCAS DE TEJIDO DE AVES PARA ESTUDIOS GENÉTICOS La mejor fuente de tejido fresco para la realización de estudios genéticos son los músculos. En el caso de aves la
PROTOCOLO DE EXTRACCIÓN DE MUESTRAS FRESCAS DE TEJIDO DE AVES PARA ESTUDIOS GENÉTICOS La mejor fuente de tejido fresco para la realización de estudios genéticos son los músculos. En el caso de aves la
17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico
 17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico Carmen Alicia Padilla Peña, Jesús Diez Dapena, Emilia Martínez Galisteo, José
17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico Carmen Alicia Padilla Peña, Jesús Diez Dapena, Emilia Martínez Galisteo, José
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503. GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN
 LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN I. EL PROBLEMA Dos líquidos completamente miscibles se pueden separar por métodos físicos llamados
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN I. EL PROBLEMA Dos líquidos completamente miscibles se pueden separar por métodos físicos llamados
4. Materiales y Métodos. Los equipos que a continuación se mencionan se encuentran en el laboratorio de
 39 4. Materiales y Métodos 4.1 Equipos Los equipos que a continuación se mencionan se encuentran en el laboratorio de Ingeniería Ambiental de la Universidad de las Américas Puebla y en el Laboratorio de
39 4. Materiales y Métodos 4.1 Equipos Los equipos que a continuación se mencionan se encuentran en el laboratorio de Ingeniería Ambiental de la Universidad de las Américas Puebla y en el Laboratorio de
FACULTAD DE CIENCIAS QUIMICAS
 UNIVERSIDAD AUTONOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUIMICAS OPERACIONES UNITARIAS II Dr. Iván Salmerón Ochoa REPORTE DE LABORATORIO: DESTILACIÓN FRACCIONADA AGUIRRE OLVERA OSCAR OSWALDO 232619 ARZATE
UNIVERSIDAD AUTONOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUIMICAS OPERACIONES UNITARIAS II Dr. Iván Salmerón Ochoa REPORTE DE LABORATORIO: DESTILACIÓN FRACCIONADA AGUIRRE OLVERA OSCAR OSWALDO 232619 ARZATE
Los estados financieros proporcionan a sus usuarios información útil para la toma de decisiones
 El ABC de los estados financieros Importancia de los estados financieros: Aunque no lo creas, existen muchas personas relacionadas con tu empresa que necesitan de esta información para tomar decisiones
El ABC de los estados financieros Importancia de los estados financieros: Aunque no lo creas, existen muchas personas relacionadas con tu empresa que necesitan de esta información para tomar decisiones
Estudio de la evaporación
 Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-476-1985. MÉTODO PARA LA DETERMINACIÓN DE DEXTRANA EN AZÚCAR CRUDO (MASCABADO). METHOD FOR THE DETERMINATION OF DEXTRAN IN RAW SUGAR (UNREFINED). NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS PREFACIO.
NMX-F-476-1985. MÉTODO PARA LA DETERMINACIÓN DE DEXTRANA EN AZÚCAR CRUDO (MASCABADO). METHOD FOR THE DETERMINATION OF DEXTRAN IN RAW SUGAR (UNREFINED). NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS PREFACIO.
DEPARTAMENTO DE CIENCIAS BASICAS LABORATORIO DE BIOQUÍMICA 502504. GUÍA No: 3.2. DETERMINACIÓN DE PROTEINA BRUTA POR EL MÉTODO DE KJELDAHL
 1 DEPARTAMENTO DE CIENCIAS BASICAS LABORATORIO DE BIOQUÍMICA 502504 GUÍA No: 3.2. DETERMINACIÓN DE PROTEINA BRUTA POR EL MÉTODO DE KJELDAHL I. EL PROBLEMA Determinar el contenido de proteína bruta presente
1 DEPARTAMENTO DE CIENCIAS BASICAS LABORATORIO DE BIOQUÍMICA 502504 GUÍA No: 3.2. DETERMINACIÓN DE PROTEINA BRUTA POR EL MÉTODO DE KJELDAHL I. EL PROBLEMA Determinar el contenido de proteína bruta presente
Tecnología para el Agua
 Logger registrador de sonido para la pre localización de fugas de agua SePem 01 Radio SePem 01 en posición horizontal Detalle del Master SePem 01 en posición vertical Aplicación El sistema SePem 01 constituye
Logger registrador de sonido para la pre localización de fugas de agua SePem 01 Radio SePem 01 en posición horizontal Detalle del Master SePem 01 en posición vertical Aplicación El sistema SePem 01 constituye
NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS.
 NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. ASUNTO Con fundamento en lo dispuesto en los Artículos
NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. ASUNTO Con fundamento en lo dispuesto en los Artículos
LA ESTRATEGIA NACIONAL DE BOSQUES Y CAMBIO CLIMÁTICO
 LA ESTRATEGIA NACIONAL DE BOSQUES Y CAMBIO CLIMÁTICO LA ESTRATEGIA NACIONAL DE BOSQUES Y CAMBIO CLIMÁTICO En palabras simples, el Cambio Climático es la modificación del clima que actualmente ocurre en
LA ESTRATEGIA NACIONAL DE BOSQUES Y CAMBIO CLIMÁTICO LA ESTRATEGIA NACIONAL DE BOSQUES Y CAMBIO CLIMÁTICO En palabras simples, el Cambio Climático es la modificación del clima que actualmente ocurre en
FACULTAD REGIONAL ROSARIO
 FACULTAD REGIONAL ROSARIO CATEDRA BIOTECNOLOGIA ROFESOR: Ing. Eduardo Santambrosio JTP: Ing. Marta Ortega AUX 1ª : Ing. Pablo Garibaldi PCR (Polymerase chain reaction) Reacción en cadena de la polimerasa
FACULTAD REGIONAL ROSARIO CATEDRA BIOTECNOLOGIA ROFESOR: Ing. Eduardo Santambrosio JTP: Ing. Marta Ortega AUX 1ª : Ing. Pablo Garibaldi PCR (Polymerase chain reaction) Reacción en cadena de la polimerasa
TEMA 1 INTRODUCCIÓN AL ANÁLISIS QUÍMICO
 TEMA 1 INTRODUCCIÓN AL ANÁLISIS QUÍMICO Este tema aporta una revisión panorámica del Análisis Químico, sus distintas vertientes y su terminología básica. La importancia de la Química Analítica queda plasmada
TEMA 1 INTRODUCCIÓN AL ANÁLISIS QUÍMICO Este tema aporta una revisión panorámica del Análisis Químico, sus distintas vertientes y su terminología básica. La importancia de la Química Analítica queda plasmada
PREGUNTAS Y RESPUESTAS FRECUENTES
 PREGUNTAS Y RESPUESTAS FRECUENTES 1 QUÉ RESULTADO PUEDO ESPERAR SI CONTRATO LOS SERVICIOS DE LA ORGANIZACIÓN SUPERA? Los servicios de la Organización SUPERA impactan positivamente en la Cultura de la Empresa,
PREGUNTAS Y RESPUESTAS FRECUENTES 1 QUÉ RESULTADO PUEDO ESPERAR SI CONTRATO LOS SERVICIOS DE LA ORGANIZACIÓN SUPERA? Los servicios de la Organización SUPERA impactan positivamente en la Cultura de la Empresa,
TEMA 4 INTRODUCCIÓN AL ANÁLISIS VOLUMÉTRICO
 TEMA 4 INTRODUCCIÓN AL ANÁLISIS VOLUMÉTRICO Las valoraciones se emplean extensivamente en Química Analítica para la cuantificación de diversas especies químicas. En este tema se describen los principios
TEMA 4 INTRODUCCIÓN AL ANÁLISIS VOLUMÉTRICO Las valoraciones se emplean extensivamente en Química Analítica para la cuantificación de diversas especies químicas. En este tema se describen los principios
EFECTO DE LA DIGESTIÓN SOBRE PROTEINAS, GRASAS Y GLÚCIDOS
 EFECTO DE LA DIGESTIÓN SOBRE PROTEINAS, GRASAS Y GLÚCIDOS Objetivos: Mª Jesús González García Mª Amparo Mora Alcácer COLEGIO AVE Mª DE PENYA-ROJA Aprender a trabajar en el laboratorio y apreciar el orden,
EFECTO DE LA DIGESTIÓN SOBRE PROTEINAS, GRASAS Y GLÚCIDOS Objetivos: Mª Jesús González García Mª Amparo Mora Alcácer COLEGIO AVE Mª DE PENYA-ROJA Aprender a trabajar en el laboratorio y apreciar el orden,
Protocolo para la toma, conservación y transporte de muestras de tejidos vegetales Muestras Compuestas (Hojas).
 Protocolo para la toma, conservación y transporte de muestras de tejidos vegetales Muestras Compuestas (Hojas). Ing. Agr. Lorena Luna & Lic. Natalia Nikichuk. Centro de Bioservicios Forestales (CEBIOF)
Protocolo para la toma, conservación y transporte de muestras de tejidos vegetales Muestras Compuestas (Hojas). Ing. Agr. Lorena Luna & Lic. Natalia Nikichuk. Centro de Bioservicios Forestales (CEBIOF)
38. Purificación de ADN plasmídico y electroforesis del mismo en gel de agarosa
 38. Purificación de ADN plasmídico y electroforesis del mismo en gel de agarosa José Luis Caballero Repullo, Enriqueta Moyano, Juan Muñoz Blanco Departamento de Bioquímica y Biología Molecular, Campus
38. Purificación de ADN plasmídico y electroforesis del mismo en gel de agarosa José Luis Caballero Repullo, Enriqueta Moyano, Juan Muñoz Blanco Departamento de Bioquímica y Biología Molecular, Campus
4 Teoría de diseño de Experimentos
 4 Teoría de diseño de Experimentos 4.1 Introducción En los capítulos anteriores se habló de PLC y de ruido, debido a la inquietud por saber si en una instalación eléctrica casera que cuente con el servicio
4 Teoría de diseño de Experimentos 4.1 Introducción En los capítulos anteriores se habló de PLC y de ruido, debido a la inquietud por saber si en una instalación eléctrica casera que cuente con el servicio
Detección de la secuencia Alu mediante la técnica Reacción en Cadena de la Polimerasa (PCR ) N. Rodríguez
 Detección de la secuencia Alu mediante la técnica Reacción en Cadena de la Polimerasa (PCR ) N. Rodríguez 1 Objetivos Entender la técnica: Reacción de Polimerasa en Cadena (PCR por sus siglas en inglés)
Detección de la secuencia Alu mediante la técnica Reacción en Cadena de la Polimerasa (PCR ) N. Rodríguez 1 Objetivos Entender la técnica: Reacción de Polimerasa en Cadena (PCR por sus siglas en inglés)
Exposición de trabajadores a sustancias químicas
 Exposición de trabajadores a sustancias químicas La exposición laboral a estas sustancias se define como aquella situación en la que un trabajador puede recibir la acción de un agente químico, así como
Exposición de trabajadores a sustancias químicas La exposición laboral a estas sustancias se define como aquella situación en la que un trabajador puede recibir la acción de un agente químico, así como
NORMA TÉCNICA DE AUDITORÍA SOBRE CONSIDERACIONES RELATIVAS A LA AUDITORÍA DE ENTIDADES QUE EXTERIORIZAN PROCESOS DE ADMINISTRACIÓN
 Resolución de 26 de marzo de 2004, del Instituto de Contabilidad y Auditoría de Cuentas, por la que se publica la Norma Técnica de Auditoría sobre consideraciones relativas a la auditoría de entidades
Resolución de 26 de marzo de 2004, del Instituto de Contabilidad y Auditoría de Cuentas, por la que se publica la Norma Técnica de Auditoría sobre consideraciones relativas a la auditoría de entidades
TRABAJO PRÁCTICO N 2: TÉCNICAS DE ESTERILIZACIÓN Y CULTIVO DE MICROORGANISMOS Objetivos:
 TRABAJO PRÁCTICO N 2: TÉCNICAS DE ESTERILIZACIÓN Y CULTIVO DE MICROORGANISMOS Objetivos: -Conocer las metodologías actuales de control y eliminación de microorganismos. -Obtener dominio de los métodos
TRABAJO PRÁCTICO N 2: TÉCNICAS DE ESTERILIZACIÓN Y CULTIVO DE MICROORGANISMOS Objetivos: -Conocer las metodologías actuales de control y eliminación de microorganismos. -Obtener dominio de los métodos
POR QUÉ YA NO SE RECOMIENDA ESPERAR 3 MESES PARA HACERSE LA PRUEBA DEL VIH?
 QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
Revista de Actualización Clínica Volumen 33 2013
 ESTUDIOS DESCRIPTIVOS Hoyos Serrano Maddelainne 1 Colaboración: Espinoza Mendoza Eduardo 2 RESUMEN Cuando el investigador se nutre con la literatura y elucubra el planteamiento del problema, comienza con
ESTUDIOS DESCRIPTIVOS Hoyos Serrano Maddelainne 1 Colaboración: Espinoza Mendoza Eduardo 2 RESUMEN Cuando el investigador se nutre con la literatura y elucubra el planteamiento del problema, comienza con
PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO
 PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO I. OBJETIVO Determinar la presencia de bacterias Mesófilas Aerobias en una muestra de agua potable por la técnica de
PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO I. OBJETIVO Determinar la presencia de bacterias Mesófilas Aerobias en una muestra de agua potable por la técnica de
MEDIDA DEL CALOR ESPECÍFICO
 Laboratorio de Física General Primer Curso (Termodinámica) MEDIDA DEL CALOR ESPECÍFICO Fecha: 07/02/05 1. Objetivo de la práctica Familiarizarse con las medidas calorimétricas mediante la medida del calor
Laboratorio de Física General Primer Curso (Termodinámica) MEDIDA DEL CALOR ESPECÍFICO Fecha: 07/02/05 1. Objetivo de la práctica Familiarizarse con las medidas calorimétricas mediante la medida del calor
Reacción en cadena de la polymerasa (PCR)
 Reacción en cadena de la polymerasa (PCR) 1 PCR Que es? Es una técnica in vitro diseñada para amplificar una región específica de DNA. Es extremadamente sensible, con la capacidad de amplificar millones
Reacción en cadena de la polymerasa (PCR) 1 PCR Que es? Es una técnica in vitro diseñada para amplificar una región específica de DNA. Es extremadamente sensible, con la capacidad de amplificar millones
Instructivo: Diagnóstico Interno y Externo por análisis FODA
 Página 1 de 8 1. INTRODUCCIÓN Ya definido y conocido el futuro al cual se quiere llegar (Visión), y establecido los compromisos para lograrlo (Misión) 1 es necesario generar una estrategia eficaz para
Página 1 de 8 1. INTRODUCCIÓN Ya definido y conocido el futuro al cual se quiere llegar (Visión), y establecido los compromisos para lograrlo (Misión) 1 es necesario generar una estrategia eficaz para
FICHA PÚBLICA DEL PROYECTO
 FICHA PÚBLICA DEL PROYECTO PROGRAMA DE ESTÍMULOS A LA INNOVACIÓN NUMERO DE PROYECTO: 214028 EMPRESA BENEFICIADA: PHARMACOS EXAKTA S.A. DE C.V. TÍTULO DEL PROYECTO: DESARROLLO DE UN MINI-ARREGLO DE ANTIGENOS
FICHA PÚBLICA DEL PROYECTO PROGRAMA DE ESTÍMULOS A LA INNOVACIÓN NUMERO DE PROYECTO: 214028 EMPRESA BENEFICIADA: PHARMACOS EXAKTA S.A. DE C.V. TÍTULO DEL PROYECTO: DESARROLLO DE UN MINI-ARREGLO DE ANTIGENOS
página 66 Diagrama de flujo. Elaboración de quesos frescos y quesos curados
 página 66 Diagrama de flujo. Elaboración de quesos frescos y quesos curados descripción de los procesos de la línea de elaboración de quesos frescos y quesos curados Recogida de la leche En la recogida
página 66 Diagrama de flujo. Elaboración de quesos frescos y quesos curados descripción de los procesos de la línea de elaboración de quesos frescos y quesos curados Recogida de la leche En la recogida
PROYECTO MEDICINA PERSONALIZADA PARA EL CÁNCER INFANTIL CÁNCER INFANTIL. Javier Alonso
 Página: 1 de 8 PROYECTO MEDICINA PERSONALIZADA PARA EL Javier Alonso Jefe de Área de Genética Humana. Jefe de la Unidad de Tumores Sólidos Infantiles del Instituto de Investigación de Enfermedades Raras,
Página: 1 de 8 PROYECTO MEDICINA PERSONALIZADA PARA EL Javier Alonso Jefe de Área de Genética Humana. Jefe de la Unidad de Tumores Sólidos Infantiles del Instituto de Investigación de Enfermedades Raras,
ORGANIZACIÓN DEL LABORATORIO DE CULTIVO DE TEJIDOS
 ORGANIZACIÓN DEL LABORATORIO DE CULTIVO DE TEJIDOS Las actividades relacionadas con cultivo in vitro de tejidos deben realizarse en ambientes asépticos, con iluminación y temperatura controladas, para
ORGANIZACIÓN DEL LABORATORIO DE CULTIVO DE TEJIDOS Las actividades relacionadas con cultivo in vitro de tejidos deben realizarse en ambientes asépticos, con iluminación y temperatura controladas, para
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O. Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua
 C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
Las razones financieras ayudan a determinar las relaciones existentes entre diferentes rubros de los estados financieros
 Razones financieras Uno de los métodos más útiles y más comunes dentro del análisis financiero es el conocido como método de razones financieras, también conocido como método de razones simples. Este método
Razones financieras Uno de los métodos más útiles y más comunes dentro del análisis financiero es el conocido como método de razones financieras, también conocido como método de razones simples. Este método
PROTOCOLO DE ACTUACIÓN PARA EXTRACCIONES PARA ESTUDIOS DE HEMOSTASIA Y TROMBOSIS
 PROTOCOLO DE ACTUACIÓN PARA EXTRACCIONES PARA ESTUDIOS DE HEMOSTASIA Y TROMBOSIS IDENTIFICACIÓN DEL PACIENTE Todas las muestras deben ir acompañadas de una solicitud debidamente formulada. La solicitud
PROTOCOLO DE ACTUACIÓN PARA EXTRACCIONES PARA ESTUDIOS DE HEMOSTASIA Y TROMBOSIS IDENTIFICACIÓN DEL PACIENTE Todas las muestras deben ir acompañadas de una solicitud debidamente formulada. La solicitud
ANÁLISIS DE AGUAS: Metodología
 FTTM06 Rev-2,21/11/2013 INSTITUTO DE TOXICOLOGÍA DE LA DEFENSA Hospital Central de la Defensa. Glorieta del Ejército s/n. 28047 MADRID. Tel.: 914222625. Fax: 914222624 E- mail : toxicologia@oc.mde.es Web
FTTM06 Rev-2,21/11/2013 INSTITUTO DE TOXICOLOGÍA DE LA DEFENSA Hospital Central de la Defensa. Glorieta del Ejército s/n. 28047 MADRID. Tel.: 914222625. Fax: 914222624 E- mail : toxicologia@oc.mde.es Web
DESTILACIÓN. DETERMINACIÓN DEL GRADO ALCOHÓLICO DEL VINO
 1. INTRODUCCION La destilación es un proceso que consiste en calentar un líquido hasta que sus componentes más volátiles pasan a la fase de vapor y, a continuación, enfriar el vapor para recuperar dichos
1. INTRODUCCION La destilación es un proceso que consiste en calentar un líquido hasta que sus componentes más volátiles pasan a la fase de vapor y, a continuación, enfriar el vapor para recuperar dichos
Operación de Microsoft Excel. Guía del Usuario Página 79. Centro de Capacitación en Informática
 Manejo básico de base de datos Unas de las capacidades de Excel es la de trabajar con listas o tablas de información: nombres, direcciones, teléfonos, etc. Excel puede trabajar con tablas de información
Manejo básico de base de datos Unas de las capacidades de Excel es la de trabajar con listas o tablas de información: nombres, direcciones, teléfonos, etc. Excel puede trabajar con tablas de información
CONFIRMACIÓN EPIDEMIOLÓGICA DE LA ENFERMEDAD DE AUJESZKY ANTE LA PRESENCIA DE ANIMALES POSITIVOS AISLADOS O FALSOS POSITIVOS
 MINISTERIO DE MEDIO AMBIENTE Y MEDIO RURAL Y MARINO DG DE RECURSOS AGRICOLAS Y GANADEROS SUBDIRECCIÓN GENERAL DE SANIDAD DE LA PRODUCCIÓIN PRIMARIA PROTOCOLO DE ACTUACIÓN PARA LA CONFIRMACIÓN EPIDEMIOLÓGICA
MINISTERIO DE MEDIO AMBIENTE Y MEDIO RURAL Y MARINO DG DE RECURSOS AGRICOLAS Y GANADEROS SUBDIRECCIÓN GENERAL DE SANIDAD DE LA PRODUCCIÓIN PRIMARIA PROTOCOLO DE ACTUACIÓN PARA LA CONFIRMACIÓN EPIDEMIOLÓGICA
CALENTAMIENTO DE AGUA CALIENTE SANITARIA
 CALENTAMIENTO DE AGUA CALIENTE SANITARIA De todas las formas de captación térmica de la energía solar, las que han adquirido un desarrollo comercial en España han sido los sistemas para su utilización
CALENTAMIENTO DE AGUA CALIENTE SANITARIA De todas las formas de captación térmica de la energía solar, las que han adquirido un desarrollo comercial en España han sido los sistemas para su utilización
GUIA REALIZACION DE FROTIS SANGUINEO Y TINCION DE LÁMINAS
 ESCUELA SALUD GUIA REALIZACION DE FROTIS SANGUINEO Y TINCION DE LÁMINAS DIRIGIDO A ALUMNOS DE: Técnico Superior de Laboratorio Clínico y Banco de Sangre PRE-REQUISITO: Laboratorio Clínico I (LCS 2100).
ESCUELA SALUD GUIA REALIZACION DE FROTIS SANGUINEO Y TINCION DE LÁMINAS DIRIGIDO A ALUMNOS DE: Técnico Superior de Laboratorio Clínico y Banco de Sangre PRE-REQUISITO: Laboratorio Clínico I (LCS 2100).
TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR
 TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DOCENTES: Andrés Ciocchini, Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR Purificación de ácido desoxiribonucleico (ADN) por partición diferencial
TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DOCENTES: Andrés Ciocchini, Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR Purificación de ácido desoxiribonucleico (ADN) por partición diferencial
APÉNDICE. Apéndice 1. Espectrofotómetro. (Users Manual 2100 Series Spectrophotometer) 68
 APÉNDICE Apéndice 1. Espectrofotómetro (Users Manual 2100 Series Spectrophotometer) 68 El espectrofotómetro de la marca UNICO serie 2100 UV posee un rango de longitud de onda de 200-1000 nm. La técnica
APÉNDICE Apéndice 1. Espectrofotómetro (Users Manual 2100 Series Spectrophotometer) 68 El espectrofotómetro de la marca UNICO serie 2100 UV posee un rango de longitud de onda de 200-1000 nm. La técnica
Análisis del Control Interno (Diseño & Implementación) correspondiente al Ciclo de Negocios de Inventarios para el caso de una Cooperativa Médica
 Análisis del Control Interno (Diseño & Implementación) correspondiente al Ciclo de Negocios de Inventarios para el caso de una Cooperativa Médica Tipo de empresa: IAMC (Cooperativa Medica) Área temática:
Análisis del Control Interno (Diseño & Implementación) correspondiente al Ciclo de Negocios de Inventarios para el caso de una Cooperativa Médica Tipo de empresa: IAMC (Cooperativa Medica) Área temática:
PCR. Técnica inventada por Kary Mullis :1987. Premio Nobel 1993. Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN
 PCR PCR Técnica inventada por Kary Mullis :1987 Premio Nobel 1993 Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN Aprovecha los requerimientos de la replicación Templete ADN Nucleótidos
PCR PCR Técnica inventada por Kary Mullis :1987 Premio Nobel 1993 Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN Aprovecha los requerimientos de la replicación Templete ADN Nucleótidos
