Información específica de seguridad
|
|
|
- María Luz Plaza Ruiz
- hace 8 años
- Vistas:
Transcripción
1 Información específica de seguridad Arava (leflunomida) es un fármaco antirreumático modificador de la enfermedad" (FARME) indicado para el tratamiento de pacientes adultos con artritis reumatoide activa o artritis psoriásica activa. Como parte del proceso de registro europeo de Arava, en el marco del plan de gestión de riesgos de este medicamento, el titular de la autorización de comercialización ha desarrollado un programa de formación, en el que se incluye este folleto dirigido a los médicos prescriptores de Arava. El objetivo de este material de formación es minimizar varios riesgos que han sido identificados en el contexto del plan europeo de gestión de riesgos establecido para Arava. Los riesgos más importantes que debe conocer cuando recete Arava son los siguientes: Riesgo de hepatotoxicidad, incluidos algunos casos muy poco frecuentes de daño hepático grave, que puede ser mortal. Riesgo de hematotoxicidad, incluidos algunos casos poco frecuentes de pancitopenia, leucopenia, eosinofilia y casos muy poco frecuentes de agranulocitosis. Riesgos de infecciones, incluidos algunos casos poco frecuentes de infecciones no controladas graves (sepsis), que pueden ser mortales. Riesgo de defectos congénitos graves cuando se administra durante el embarazo. Para minimizar estos riesgos, se recomienda: asesorar adecuadamente a los pacientes, llevar a cabo una cuidadosa monitorización y seguir las recomendaciones relativas al procedimiento de lavado del medicamento. La información completa sobre Arava aparece reflejada en la Ficha Técnica actualmente autorizada para este medicamento (ver anexo). 1
2 ASESORAMIENTO DE LOS PACIENTES Antes de iniciar el tratamiento con Arava, asegúrese de que los pacientes están convenientemente informados acerca de los riesgos importantes asociados al tratamiento y de las precauciones adecuadas que deben adoptar para minimizarlos. Con este objetivo, el Titular de la Autorización de Comercialización ha desarrollado, además de este folleto de información para el médico otro específico para el paciente. ANALÍTICAS DE RUTINA Debido al riesgo de hepatotoxicidad y hematotoxicidad, que en raras ocasiones puede llegar a ser grave o incluso mortal (véanse las tablas que se presentan a continuación), es fundamental llevar a cabo una cuidadosa monitorización de los parámetros hepáticos y del recuento hemático antes y durante el tratamiento con Arava. La Ficha Técnica del medicamento contiene información adicional sobre estas reacciones adversas. No se recomienda la administración concomitante de Arava y FARMEs (Fármacos Antirreumáticos Modificadores de la Enfermedad) hepatotóxicos o hematotóxicos (por ejemplo, metotrexato). Monitorización de las enzimas hepáticas Pruebas analíticas Como mínimo, debe determinarse la concentración de ALT (SGPT) Elevación confirmada de la concentración de ALT Entre 2 y 3 veces el LSN* Se mantiene entre 2 y 3 veces el LSN a pesar de la reducción de la dosis - O BIEN - > 3 veces el LSN Frecuencia Antes del inicio del tratamiento y cada 2 semanas durante los primeros seis meses de tratamiento A partir de entonces, si son estables, cada ocho semanas Ajuste de la dosis / Interrupción de la administración La reducción de la dosis de 20 mg/día a 10 mg/día puede permitir la administración continuada de Arava con monitorización semanal Interrumpir la administración de Arava Iniciar un procedimiento de lavado (véase el apartado "Procedimiento de lavado") y monitorizar las enzimas hepáticas hasta que se normalicen *LSN: límite superior de normalidad Monitorización hematológica Pruebas analíticas Hemograma completo que incluya fórmula leucocitaria y recuento de plaquetas Frecuencia Antes del inicio del tratamiento y cada 2 semanas durante los primeros seis meses de tratamiento A partir de entonces, cada ocho semanas. Interrupción de la administración Reacciones hematológicas graves, incluyendo pancitopenia Interrumpir la administración de Arava y de cualquier tratamiento mielosupresor concomitante Iniciar un procedimiento de lavado (véase el apartado Procedimiento de lavado ) 2
3 INFECCIONES Las propiedades inmunosupresoras de Arava pueden propiciar que los pacientes sean más susceptibles a sufrir infecciones, incluidas las de tipo oportunista. En raras ocasiones, pueden contraerse infecciones graves, como leucoencefalopatía multifocal progresiva (LMP) o padecerse infecciones no controladas graves (p. ej. sepsis). Los pacientes que presenten una reacción positiva a la tuberculina deben ser estrechamente controlados debido al riesgo de tuberculosis. En caso de aparición de reacciones graves, no controladas, puede ser necesario interrumpir el tratamiento con leflunomida e iniciar un procedimiento de lavado (véase el apartado Procedimiento de lavado ). Arava está contraindicado en: Pacientes con estados de inmunodeficiencia grave, como por ejemplo SIDA Pacientes con infecciones graves EMBARAZO Deberá informar a las mujeres en edad fértil, a las mujeres que deseen quedarse embarazadas y a los hombres que quieran ser padres, acerca del riesgo de defectos congénitos que conlleva tomar Arava y la necesidad de utilizar métodos anticonceptivos eficaces. Infórmeles también sobre las medidas que deben aplicarse en caso de que se produzca un embarazo durante el tratamiento o después de interrumpirlo. Esta información debe proporcionarse antes de comenzar con el tratamiento, regularmente durante el tiempo que dure el mismo, y una vez haya finalizado. Riesgo de defectos congénitos Basándose en los datos procedentes de estudios realizados con animales, se sospecha que el metabolito activo de Arava, A771726, provoca defectos congénitos graves cuando se administra durante el embarazo. Por tanto, Arava está contraindicado durante el embarazo. Mujeres Estado Recomendaciones Mujeres en edad fértil Es necesario un método anticonceptivo eficaz durante el tratamiento y hasta 2 años después de la interrupción del mismo Realizar una prueba de embarazo inmediatamente Cualquier retraso en el periodo menstrual O BIEN Cualquier otro motivo por el que se sospeche embarazo Si se confirma el embarazo: Interrumpir la administración de Arava Iniciar un procedimiento de lavado (véase a continuación) Llevar a cabo análisis de las concentraciones plasmáticas de A (véase a continuación) Informar a la paciente de los riesgos del embarazo Mujeres que deseen quedarse embarazadas Informar a la paciente de los riesgos del embarazo, así como del periodo de espera de 2 años requerido después de la interrupción del tratamiento antes de que se puedan quedar embarazadas. Si este periodo de espera con un método anticonceptivo eficaz se considera poco práctico, se aconseja la instauración de un procedimiento de lavado preventivo. Iniciar el procedimiento de lavado (véase a continuación) Llevar a cabo análisis de las concentraciones plasmáticas de A (véase a continuación) 3
4 Procedimiento de lavado Iniciar el procedimiento de lavado (véase el apartado Procedimiento de lavado ) permite evitar el periodo de espera de 2 años. Tanto la colestiramina como el carbón activado en polvo son capaces de modificar la absorción de estrógenos y progestágenos, por lo que se recomienda el uso de métodos anticonceptivos alternativos a los anticonceptivos orales durante todo el procedimiento de lavado. Si no puede realizarse el procedimiento de lavado, es necesario que antes de quedarse embarazada la mujer se someta a un periodo de espera de 2 años tras la interrupción del tratamiento. Durante esos dos años deberá utilizarse un método anticonceptivo eficaz. Analíticas que deben realizarse al final del periodo de lavado Deben realizarse 2 pruebas independientes, con una separación de al menos 14 días. Si los resultados de las 2 pruebas son < 0,02 mg/l (0,02 µg/ml), no es necesario realizar ninguna prueba más. Se requiere un periodo de espera de un mes y medio entre el primer resultado < 0,02 mg/l y la fertilización. Si los resultados de una de las pruebas son > 0,02 mg/l (0,02 µg/ml), debe repetirse el procedimiento de lavado con 2 pruebas independientes con 14 días de separación. Es necesario que transcurra un periodo de espera de tres meses entre la primera vez que se observa una concentración plasmática inferior a 0,02 mg/l y la fertilización. Hombres Debido a la posibilidad de toxicidad fetal mediada por los varones que toman leflunomida, debe garantizarse el uso de un método anticonceptivo eficaz durante el tratamiento con Arava. Para los hombres que quieran ser padres, debe considerarse el mismo procedimiento de lavado que se recomienda para las mujeres. Es necesario que transcurra un periodo de espera de tres meses entre la primera vez que se observa una concentración plasmática inferior a 0,02 mg/l y la fertilización. Servicio de asesoramiento específico Existe un servicio de asesoramiento específico para proporcionar información sobre las pruebas analíticas para determinar la concentración plasmática de leflunomida en pacientes tratados con Arava. Visite la página web de Sanofi para obtener información adicional en relación a este servicio. PROCEDIMIENTO DE LAVADO Cabe esperar que las concentraciones plasmáticas del metabolito activo de leflunomida A se mantengan por encima de los 0,02 mg/l durante un periodo de tiempo prolongado. Es de prever que su concentración disminuya por debajo de este nivel alrededor de 2 años después de interrumpir el tratamiento con Arava. Para acelerar la eliminación de A771726, cuando sea necesario eliminarlo rápidamente del organismo se recomienda realizar el procedimiento de lavado descrito en la tabla presentada a continuación. 4
5 Acontecimientos que motivan un procedimiento de lavado Protocolo del procedimiento de lavado Reacciones hematológicas y hepáticas graves Infecciones no controladas graves (p. ej. sepsis) Embarazo Previsto o no Otros acontecimientos que pudieran conducir a realizar el procedimiento de lavado: Reacciones en la piel y/o las mucosas (p. ej., estomatitis ulcerosa), con sospecha de reacciones graves, como síndrome de Stevens-Johnson o necrólisis epidérmica tóxica Después de la interrupción del tratamiento con Arava y el cambio a otros FARMEs (p. ej. metotrexato) que puedan aumentar la posibilidad de riesgo acumulativo Por cualquier otro motivo que requiera la eliminación rápida del metabolito activo de Arava del organismo. FARME: fármacos antireumáticos modificadores de la enfermedad Tras interrumpir el tratamiento con Arava : Colestiramina 8 g 3 veces al día (24 g al día) durante 11 días La administración oral de colestiramina a 3 voluntarios sanos, en una dosis de 8 g 3 veces al día durante 24 horas, redujo las concentraciones plasmáticas del metabolito activo A aproximadamente un 40% en 24 horas y entre un 49% y un 65% en 48 horas. O BIEN 50 g de carbón activado en polvo 4 veces al día (200 g al día) durante 11 días Se ha demostrado que la administración de carbón activado (polvo para suspensión) por vía oral o a través de sonda nasogástrica (50 g cada 6 horas durante 24 horas) reduce las concentraciones plasmáticas del metabolito activo A un 37% en 24 horas y un 48% en 48 horas. La duración del protocolo de lavado puede modificarse en función de variables clínicas o analíticas. ARAVA RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Arava 10 mg, Arava 20 mg, Arava 100 mg comprimidos recubiertos con película COMPOSICIÓN: Arava 10 mg. Cada comprimido contiene 10 mg de leflunomida. Excipiente(s) con efecto conocido: cada comprimido contiene 78 mg de lactosa monohidrato. Arava 20 mg. Cada comprimido contiene 20 mg de leflunomida. Excipiente(s) con efecto conocido: cada comprimido contiene 72 mg de lactosa monohidrato. Arava 100 mg. Cada comprimido contiene 100 mg de leflunomida. Excipiente(s) con efecto conocido: cada comprimido contiene 138,42 mg de lactosa monohidrato. FORMA FARMACÉUTICA: Comprimido recubierto con película. Arava 10 mg: comprimido recubierto con película blanco o blanquecino, redondo, con la inscripción ZBN en una cara. Arava 20 mg: comprimido recubierto con película amarillento a ocre, triangulares, con la inscripción ZBO en una cara. Arava 100 mg: comprimido recubierto con película blanco o blanquecino, redondo, con la inscripción ZBP en una cara. DATOS CLÍNICOS. Indicaciones terapéuticas: La leflunomida está indicada para el tratamiento de pacientes adultos con: artritis reumatoide activa como un fármaco antirreumático modificador de la enfermedad (FARME), artritis psoriásica activa. El tratamiento reciente o concomitante con FARMEs hepatotóxicos o hematotóxicos (por ejemplo, metotrexato) puede producir un aumento del riesgo de aparición de reacciones adversas graves; por tanto, en estos casos, el inicio del tratamiento con leflunomida debe considerarse en función del balance beneficio/riesgo. Más aún, el sustituir la leflunomida por otro FARME sin realizar el procedimiento de lavado, puede incrementar el riesgo de aparición de reacciones adversas graves incluso durante un largo período de tiempo después del cambio. Posología y forma de administración: El tratamiento se debe iniciar y supervisar por especialistas con experiencia en el tratamiento de artritis reumatoide y artritis psoriásica. Los niveles de alanina transaminasa (ALT) o transaminasa piruvato glutamato sérico (SGPT) y un recuento hemático completo, incluyendo un recuento diferencial de leucocitos y un recuento de plaquetas, deben determinarse simultáneamente, y con la misma frecuencia en las siguientes situaciones: antes de iniciar el tratamiento con leflunomida, cada dos semanas durante los primeros seis meses de tratamiento, y posteriormente, cada ocho semanas. Posología: En artritis reumatoide: el tratamiento con leflunomida se inicia normalmente con una dosis de carga de 100 mg una vez al día durante 3 días. La omisión de la dosis de carga puede disminuir el riesgo de reacciones adversas. La dosis de mantenimiento recomendada es de 10 mg a 20 mg de leflunomida una vez al día dependiendo de la gravedad (actividad) de la enfermedad. En artritis psoriásica: el tratamiento con leflunomida se inicia con una dosis de carga de 100 mg una vez al día durante 3 días. La dosis de mantenimiento recomendada es de 20 mg de leflunomida una vez al día. El efecto terapéutico normalmente empieza después de 4 ó 6 semanas y puede mejorar posteriormente hasta los 4 ó 6 meses. No hay un ajuste de dosis recomendable en pacientes con insuficiencia renal leve. No se requiere realizar un ajuste de la dosis en los pacientes con edad superior a 65 años. Población pediátrica: No se recomienda la utilización de Arava en pacientes menores de 18 años, ya que no se ha establecido la eficacia y la seguridad en la artritis reumatoide juvenil (ARJ). Forma de administración: Los comprimidos de Arava deben ingerirse enteros con suficiente líquido. La ingesta de alimentos no modifica la absorción de la leflunomida. Contraindicaciones: Hipersensibilidad al principio activo (especialmente con historial previo de síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, eritema multiforme) o a alguno de los excipientes (ver lista de excipientes). Pacientes con insuficiencia hepática. Pacientes con estados de inmunodeficiencia grave, por ejemplo, SIDA. Pacientes con afectación significativa de la función de la médula ósea o con anemia, leucopenia, neutropenia o trombocitopenia importante debida a causas distintas de la artritis reumatoide o psoriásica. Pacientes con infecciones graves. Pacientes con insuficiencia renal de moderada a grave, debido a que la experiencia clínica de la que se dispone en este grupo de pacientes es insuficiente. Pacientes con hipoproteinemia grave, por ejemplo en el síndrome nefrótico. Mujeres embarazadas o mujeres en edad fértil que no utilicen un método anticonceptivo eficaz durante el tratamiento con leflunomida y después de finalizar el mismo mientras los niveles plasmáticos del metabolito activo estén por encima de 0,02 mg/l. Antes de iniciar el tratamiento con leflunomida, debe descartarse el embarazo. Mujeres que se encuentren en periodo de lactancia. Advertencias y precauciones especiales de empleo: No se aconseja la administración conjunta con FARMEs hepatotóxicos o hematotóxicos (por ejemplo metotrexato). El metabolito activo de leflunomida, A771726, tiene una vida media larga, generalmente de 1 a 4 semanas. Pueden producirse efectos adversos graves (por ejemplo: hepatotoxicidad, hematotoxicidad o reacciones alérgicas, ver más abajo), aunque se haya interrumpido el tratamiento con leflunomida. Por tanto, cuando aparezcan estos efectos adversos o si por cualquier otro motivo se necesita eliminar rápidamente del organismo el metabolito A771726, se deberá realizar el procedimiento de lavado. Este proceso deberá repetirse las veces que sea clínicamente necesario. Para consultar el procedimiento para realizar el periodo de lavado en caso de embarazo tanto deseado como no planificado, ver sección de fertilidad, embarazo y lactancia. 5
6 Reacciones hepáticas: Durante el tratamiento con leflunomida, raramente se han notificado casos de lesiones hepáticas graves, incluyendo casos con desenlace fatal. La mayoría de los casos se produjeron durante los primeros seis meses de tratamiento. En estos casos, fue frecuente el tratamiento concomitante con otros fármacos hepatotóxicos. Se considera esencial que se cumplan estrictamente las recomendaciones de monitorización. Los niveles de ALT (SGPT) deben medirse antes de iniciar el tratamiento con leflunomida durante los primeros seis meses de tratamiento con la misma frecuencia que el recuento hemático completo (cada dos semanas) y posteriormente, cada ocho semanas. En el caso de elevaciones de ALT (SGPT) entre dos y tres veces el límite superior del rango normal, debe considerarse una reducción de la dosis de 20 mg a 10 mg y se debe realizar un control de la función hepática semanal. En el caso de que persista un aumento de los niveles de ALT (SGPT) de más de dos veces el límite superior del rango normal, o si se produjeran elevaciones de más de tres veces el límite superior del rango normal debe suspenderse el tratamiento con leflunomida e iniciar el periodo de lavado. Después de suspender el tratamiento, se recomienda mantener la monitorización de las enzimas hepáticas hasta su completa normalización. Debido al potencial de efectos hepatotóxicos aditivos, se recomienda evitar el consumo de alcohol durante el tratamiento con leflunomida. Dado que el metabolito activo de la leflunomida, A771726, se une en gran medida a las proteínas plasmáticas y se elimina vía metabolismo hepático y secreción biliar, es esperable que los niveles plasmáticos de A se incrementen en pacientes con hipoproteinemia. Arava está contraindicado en los pacientes con hipoproteinemia grave o afectación grave de la función hepática. Reacciones hematológicas: Junto con los niveles de ALT, debe realizarse un recuento hemático completo, incluyendo recuento diferencial de leucocitos y plaquetas, antes de iniciar el tratamiento con leflunomida, así como cada 2 semanas durante los 6 primeros meses de tratamiento y, posteriormente, cada 8 semanas. En pacientes con anemia, leucopenia y/o trombocitopenia preexistente, así como en pacientes con la función alterada de la médula ósea o aquéllos con riesgo de supresión de la médula ósea, es mayor el riesgo de aparición de alteraciones hematológicas. En estos casos, se debe considerar un periodo de lavado (ver más adelante) para reducir los niveles plasmáticos de A En el caso de que se produzcan reacciones hematológicas graves, incluyendo pancitopenia, se debe suspender el tratamiento con Arava y con cualquier tratamiento concomitante mielosupresor e iniciar el procedimiento para realizar un periodo de lavado de leflunomida. Combinaciones con otros tratamientos: Hasta el momento no se ha estudiado suficientemente en ensayos aleatorizados (a excepción del metotrexato), el empleo de la leflunomida con los antipalúdicos que se utilizan en el tratamiento de enfermedades reumáticas (por ejemplo, cloroquina e hidroxicloroquina), las sales de oro intramuscular u oral, la D-penicilamina, la azatioprina u otros agentes inmunosupresores incluyendo Inhibidores del Factor de Necrosis Tumoral Alfa. Se desconoce el riesgo asociado con una terapia de combinación, sobre todo a largo plazo. No se recomienda la combinación de leflunomida con otros FARMEs (por ejemplo metotrexato) debido a que este tipo de tratamiento puede causar toxicidad aditiva o incluso de tipo sinérgico (por ejemplo: hepato o hematotoxicidad). Se recomienda precaución en la administración de leflunomida junto con otros fármacos metabolizados por CYP2C9 distintos a los AINEs, como fenitoína, warfarina, femprocumon y tolbutamida. Cambio a otros tratamientos: Como leflunomida permanece en el organismo durante mucho tiempo, cualquier cambio a otro FARME (por ejemplo: metotrexato) sin realizar el procedimiento para realizar un periodo de lavado (ver más adelante) podría incrementar la posibilidad de riesgos adicionales, incluso después de un período de tiempo prolongado tras ese cambio (ej. interacciones cinéticas, toxicidad órgano-específica). De forma similar, el tratamiento reciente con medicamentos hepatotóxicos o hematotóxicos (por ejemplo: metotrexato) puede producir un aumento de los efectos adversos; por tanto, debe considerarse cuidadosamente si se inicia el tratamiento con leflunomida teniendo en cuenta el beneficio/riesgo que se espere alcanzar y se recomienda una monitorización más cuidadosa en la fase inicial tras el cambio. Reacciones cutáneas: En caso de estomatitis ulcerativa deberá suspenderse la administración de leflunomida. Se han notificado pocos casos de Síndrome de Stevens-Johnson o de necrolísis epidérmica tóxica en pacientes tratados con leflunomida. Tan pronto como se observen reacciones epidérmicas y/o de las mucosas, que susciten la sospecha de tales efectos adversos, debe suspenderse el tratamiento con Arava y con cualquier otro tratamiento con el que se pueda asociar e iniciar inmediatamente el procedimiento para realizar un periodo de lavado de leflunomida. En estos casos es esencial llevar a cabo un periodo de lavado completo. En estos casos está contraindicada la reexposición a leflunomida. Infecciones: Se sabe que los medicamentos con propiedades inmunosupresoras -como la leflunomidapueden producir que los pacientes sean más susceptibles a las infecciones, incluyendo infecciones oportunistas. Las infecciones pueden ser de naturaleza más grave, y por tanto, pueden requerir un tratamiento precoz y enérgico. En caso de que se presentara una infección grave no controlada, podría ser necesario interrumpir el tratamiento con leflunomida y realizar un procedimiento de lavado, tal como se describe más adelante. Raramente se han notificado casos de Leucoencefalopatía Progresiva Multifocal (LPM) en pacientes que reciben leflunomida entre otros inmunosupresores. Se debe considerar el riesgo de tuberculosis. Un test de reacción a la tuberculina se debe considerar en aquellos pacientes con otros factores de riesgo de tuberculosis. Reacciones respiratorias: Durante el tratamiento con leflunomida se notificaron casos de enfermedad pulmonar intersticial El riesgo de su incidencia está aumentado en pacientes con antecedentes de enfermedad pulmonar intersticial. La enfermedad pulmonar intersticial es una alteración potencialmente fatal, que puede aparecer de forma aguda durante la terapia. Síntomas pulmonares, como tos y disnea pueden ser una razón para interrumpir el tratamiento y para realizar un estudio, si se considera apropiado. Neuropatía periférica: Se han notificado casos de neuropatía periférica en pacientes que reciben ARAVA. La mayoría de los pacientes mejoraron después de discontinuar el tratamiento con ARAVA. Sin embargo existe una amplia variabilidad en el desenlace final, ej: en algunos pacientes la neuropatía se resolvió y en otros pacientes persistieron los síntomas. En pacientes de más de 60 años, con medicaciones neurotóxicas concomitantes, y diabetes puede aumentar el riesgo de neuropatía periférica. Si un paciente que está tomando ARAVA desarrolla una neuropatía periférica, considere discontinuar el tratamiento con ARAVA y realizar el procedimiento de eliminación del medicamento. Presión sanguínea La presión sanguínea debe comprobarse antes de comenzar el tratamiento con leflunomida y posteriormente de forma periódica. Procreación (recomendaciones para los hombres): Debe advertirse a los pacientes varones acerca de la posible toxicidad fetal mediada por el varón. Durante el tratamiento con leflunomida debe garantizarse una contracepción eficaz. No existen datos específicos sobre el riesgo de toxicidad fetal mediada a través del varón. A pesar de ello, no se han realizado estudios en animales para evaluar este posible riesgo. Para minimizar este posible riesgo, los hombres que deseen tener descendencia, deben considerar el suspender el uso de leflunomida y tomar 8 g de colestiramina, 3 veces al día, durante 11 días ó 50 g de carbón activo en polvo, 4 veces al día, durante 11 días. En cualquiera de estos casos, debe medirse por primera vez la concentración plasmática de A Posteriormente, debe determinarse de nuevo la concentración plasmática de A después de un intervalo mínimo de 14 días. Si ambas concentraciones plasmáticas son inferiores a 0,02 mg/l y se espera un periodo mínimo de 3 meses desde la suspensión del tratamiento, el riesgo de toxicidad fetal es muy bajo. Procedimiento para realizar un periodo de lavado: Administrar 8 g de colestiramina 3 veces al día o como alternativa, administrar 50 g de carbón activo en polvo, 4 veces al día. Por lo general, la duración de un periodo de lavado completo es de 11 días. La duración se puede modificar dependiendo de variables clínicas o de laboratorio. Lactosa: Arava contiene lactosa. Los pacientes con intolerancia hereditaria a la galactosa, deficiencia de lactasa de Lapp o malabsorción de glucosa-galactosa, no deben tomar este medicamento. Interacción con otros medicamentos y otras formas de interacción: Los estudios de interacciones se han realizado sólo en adultos. La administración reciente o el uso concomitante de fármacos hepatotóxicos o hematotóxicos, así como la administración de dichos fármacos tras el tratamiento con leflunomida sin un período de lavado, puede suponer un aumento de los efectos adversos (ver también las pautas relativas a la combinación con otros tratamientos). Por tanto, se recomienda una monitorización rigurosa de los parámetros de enzimas hepáticos y hematológicos en la fase inicial después del cambio. En un pequeño ensayo (n=30) en el que se estudió la administración concomitante de leflunomida (10 a 20 mg por día) con metotrexato (10 a 25 mg por semana) se observó una elevación de las enzimas hepáticas de entre 2 a 3 veces los valores normales, en 5 de 30 pacientes. Todas las elevaciones se solucionaron, en 2 pacientes se resolvieron manteniendo la administración de los dos fármacos y en 3 pacientes se resolvieron al interrumpir el tratamiento con leflunomida. En otros 5 pacientes se observó una elevación de las enzimas hepáticas superior a 3 veces los valores normales. Todas las elevaciones se resolvieron, en 2 pacientes con la continuación de ambos fármacos y en 3 pacientes tras la interrupción del tratamiento con leflunomida. En pacientes con artritis reumatoide, no se han demostrado interacciones farmacocinéticas entre leflunomida (10 20 mg/día) y metotrexato (10 25 mg/semana). Se recomienda que los pacientes en tratamiento con leflunomida no reciban colestiramina o carbón activo en polvo, ya que se produciría un descenso rápido y significativo de la concentración plasmática de A (el metabolito activo de la leflunomida). Es posible que esto se deba a la interrupción del ciclo enterohepático y/o diálisis gastrointestinal del A Si el paciente está en tratamiento con antiinflamatorios no esteroideos (AINEs) y/o corticosteroides, puede mantenerse la administración de los mismos después de iniciar el tratamiento con leflunomida. No se conocen con exactitud las enzimas involucradas en el metabolismo de leflunomida y sus metabolitos. En un estudio in vivo de interacción con cimetidina (inhibidor no específico del citocromo P450) se ha demostrado la falta de interacción significativa entre ambos. Tras la administración concomitante de una dosis única de leflunomida a sujetos en tratamiento con dosis múltiples de rifampicina (inductor no específico del citocromo P450) los niveles máximos de A se incrementaron en aproximadamente el 40%, mientras que el AUC no varió significativamente. El mecanismo de este efecto no está claro. Estudios in vitro indican que el A inhibe la actividad del citocromo P4502C9 (CYP2C9). En los ensayos clínicos, no se observaron problemas de seguridad cuando se administraron concomitantemente leflunomida y AINEs metabolizados por CYP2C9. Se recomienda precaución en la administración de leflunomida junto con otros fármacos metabolizados por CYP2C9 distintos a los AINEs, como fenitoína, warfarina, fenprocumon y tolbutamida. En un ensayo con voluntarias sanas en el que se administró leflunomida junto con un anticonceptivo oral trifásico que contenía 30 mg de etinilestradiol, no se produjo ninguna reducción en la eficacia anticonceptiva de la píldora y la farmacocinética del A se mantuvo dentro de los niveles previstos. Vacunaciones: No se dispone de datos clínicos sobre la eficacia y seguridad de las vacunaciones durante el tratamiento de leflunomida. Por tanto, no se recomienda la vacunación con vacunas vivas atenuadas. Cuando se considere la administración de vacunas vivas atenuadas tras la finalización del tratamiento con Arava, debe tenerse en cuenta que la leflunomida posee una semivida larga. Fertilidad, embarazo y lactancia: Embarazo: Se sospecha que el metabolito activo de la leflunomida, el A771726, provoca graves defectos natales si se administra durante el embarazo. El tratamiento con Arava está contraindicado durante el embarazo. Las mujeres en edad fértil deben utilizar medidas anticonceptivas eficaces durante el tratamiento y hasta 2 años después del mismo (ver Período de espera más adelante) o hasta 11 días después del tratamiento (ver Período de lavado más adelante). La paciente debe ser avisada de que si hubiera un retraso en la menstruación o cualquier otra razón por la que se sospeche un embarazo, debe avisar al médico inmediatamente para que le realice una prueba de embarazo y, en caso positivo, la paciente y el médico deben discutir el riesgo para el embarazo. Es posible que el riesgo para el feto producido por la leflunomida disminuya si en el primer retraso de la menstruación se reducen los niveles plasmáticos del metabolito activo mediante la instauración de los procesos de eliminación descritos posteriormente. En un estudio prospectivo reducido en mujeres (n=64) que se quedaron embarazadas involuntariamente mientras estaban tomando leflunomida durante un periodo de tiempo de no más de tres semanas después de la concepción y seguido de un procedimiento de lavado del 6
7 fármaco, no se observaron diferencias significativas (p=0.13) en la tasa total de defectos estructurales graves (5,4%) en comparación con cualquiera de los grupos comparativos (4,2% en el grupo en el que se presenta la enfermedad [n=108] y 4,2% en mujeres sanas embarazadas [n=78]). En las mujeres en tratamiento con leflunomida que deseen quedarse embarazadas se recomienda el seguimiento de uno de los siguientes procedimientos, para asegurar que el feto no sea expuesto a concentraciones tóxicas de A (concentración diana inferior a 0,02 mg/l). Período de espera: Es esperable que los niveles plasmáticos de A sean superiores a 0,02 mg/l durante un período de tiempo prolongado. La concentración de este metabolito podría descender por debajo de 0,02 mg/l después de aproximadamente 2 años tras la interrupción del tratamiento con leflunomida. Tras un período de espera de 2 años, se mide por primera vez la concentración plasmática de A Después, tras un intervalo mínimo de 14 días, debe determinarse nuevamente la concentración plasmática de A No es esperable que se produzca riesgo teratogénico si ambas concentraciones plasmáticas son inferiores a 0,02 mg/l. Para más información sobre las muestras para los análisis, contacte con el Titular de la Autorización de Comercialización o con sus representantes locales. Período de lavado (Procedimiento para realizar un periodo de lavado): Tras la suspensión del tratamiento con leflunomida: administrar 8 g de colestiramina, 3 veces al día, durante un período de 11 días. Como alternativa, administrar 50 g de carbón activo en polvo, 4 veces al día, durante un período de 11 días. Sin embargo, incluso siguiendo cualquiera de los dos procedimientos de lavado, es necesario que se verifique que los niveles plasmáticos del metabolito son inferiores a 0,02 mg/l mediante la realización de dos análisis separados por un intervalo mínimo de 14 días y también se requiere un período de espera de un mes y medio desde la primera medición en la que se obtenga un valor inferior a 0,02 mg/l y la fertilización. Se debe advertir a las mujeres en edad fértil que deseen quedarse embarazadas, que se requiere un período de espera de 2 años después de finalizar el tratamiento con leflunomida. Si no es posible que la paciente cumpla un periodo de espera de aproximadamente 2 años con una contracepción eficaz, se recomienda la realización de un procedimiento de lavado. Tanto la colestiramina como el carbón activo en polvo pueden modificar la absorción de estrógenos y progestágenos, por lo que la contracepción con anticonceptivos orales no está garantizada durante el período de lavado con colestiramina o carbón activo en polvo. Se recomienda el uso de medidas contraceptivas alternativas. Lactancia: Los estudios en animales indican que la leflunomida o sus metabolitos pasan a la leche materna. Por tanto, las mujeres en período de lactancia, no deben recibir tratamiento con leflunomida. Efectos sobre la capacidad para conducir y utilizar máquinas: En caso de que se produzcan efectos adversos como el mareo, puede verse afectada la capacidad de concentración y reacción del paciente. En estos casos, los pacientes deberán abstenerse de conducir coches y utilizar maquinaria. Reacciones adversas: Resumen del perfil de seguridad: Las reacciones adversas más frecuentemente notificadas durante el tratamiento con leflunomida son: aumento leve de la presión arterial, leucopenia, parestesia, cefalea, mareo, diarrea, náuseas, vómitos, trastornos de la mucosa oral (por ejemplo, estomatitis aftosa, úlceras bucales), dolor abdominal, aumento de la caída de cabello, eczema, erupción cutánea (incluyendo erupción maculopapular), prurito, sequedad de piel, tenosinovitis, incremento de creatinfosfoquinasa (CPK), anorexia, pérdida de peso (normalmente insignificante), astenia, reacciones alérgicas leves y elevación de los parámetros hepáticos (transaminasas (especialmente ALT), menos frecuente elevación de los niveles de gamma-gt, fosfatasa alcalina, bilirrubina)). Clasificación de las frecuencias esperadas: Muy frecuentes ( 1/10), frecuentes ( 1/100 a < 1/10), poco frecuentes ( 1/1.000 a < 1/100), raras ( 1/ a < 1/1.000) y muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Infecciones e infestaciones: Raras: infecciones graves, incluyendo sepsis que puede ser mortal. Como otros agentes con potencial inmunosupresor, leflunomida puede aumentar la susceptibilidad del paciente de padecer infecciones, incluyendo infecciones oportunistas. Por tanto la incidencia global de infecciones puede incrementarse (en particular, rinitis, bronquitis y pneumonía). Neoplasias benignas, malignas y no especificadas (incluyendo quistes y pólipos: El riesgo de malignidad, particularmente en trastornos linfoproliferativos, es mayor con el uso de algunos agentes inmunosupresores. Trastornos de la sangre y del sistema linfático: Frecuentes: leucopenia (leucocitos >2 G/l). Poco frecuentes: anemia, trombocitopenia leve (plaquetas <100 G/l). Raras: pancitopenia (probablemente mediada por un mecanismo antiproliferativo), leucopenia (leucocitos <2 G/l), eosinofilia. Muy raras: agranulocitosis. El uso reciente, concomitante o consecutivo de medicamentos potencialmente mielotóxicos puede asociarse con un mayor riesgo de reacciones hematológicas. Trastornos del sistema inmunológico: Frecuentes: reacciones alérgicas leves. Muy raras: reacciones anafilácticas/anafilactoides graves, vasculitis, incluyendo vasculitis necrotizante cutánea. Trastornos del metabolismo y de la nutrición: Frecuentes: incremento de CPK. Poco frecuentes: hipopotasemia, hiperlipidemia, hipofosfatemia. Raras: incremento de LDH. Frecuencia no conocida: hipouricemia. Trastornos psiquiátricos: Poco frecuentes: ansiedad. Trastornos del sistema nervioso: Frecuentes: parestesia, cefalea, mareo, neuropatía periférica. Trastornos cardiacos: Frecuentes: leve aumento de la presión arterial. Raras: aumento grave de la presión arterial. Trastornos respiratorios, torácicos y mediastínicos: Raras: enfermedad pulmonar intersticial (incluyendo pneumonitis intersticial) que puede llegar a ser mortal. Trastornos gastrointestinales: Frecuentes: diarrea, náuseas, vómitos, trastornos de la mucosa oral (por ejemplo, estomatitis aftosa, úlceras bucales), dolor abdominal. Poco frecuentes: alteraciones del gusto. Muy raras: pancreatitis. Trastornos hepatobiliares: Frecuentes: elevación de los parámetros hepáticos (transaminasas (especialmente ALT), menos frecuente elevación de los niveles de gamma-gt, fosfatasa alcalina, bilirrubina). Raras: hepatitis, ictericia/colestasis. Muy raras: daño hepático grave, tal como insuficiencia hepática y necrosis hepática aguda que pueden llegar a ser mortales. Trastornos de la piel y del tejido subcutáneo: Frecuentes: aumento de la caída de cabello, eczema, erupción cutánea (incluyendo erupción maculopapular), prurito, sequedad de piel. Poco frecuentes: urticaria. Muy raras: necrólisis epidérmica tóxica, síndrome de Stevens-Johnson, eritema multiforme. Trastornos musculoesqueléticos y del tejido conjuntivo: Frecuentes: tenosinovitis. Poco frecuentes: rotura de tendón. Trastornos renales y urinarios: Frecuencia no conocida: fallo renal. Trastornos del aparato reproductor y de la mama: Frecuencia no conocida: leve disminución (reversible) de la concentración de esperma, recuento total de esperma y de la motilidad progresiva rápida. Trastornos generales y alteraciones en el lugar de administración: Frecuentes: anorexia, pérdida de peso (normalmente insignificante), astenia. Sobredosis: Síntomas: Se han notificado casos de sobredosis crónica en pacientes en tratamiento con una dosis diaria de hasta 5 veces la dosis diaria recomendada de Arava, y casos de sobredosis aguda en adultos y niños. No se observaron reacciones adversas en la mayoría de los casos notificados de sobredosis. Las reacciones adversas fueron coherentes con el perfil de seguridad de leflunomida; las más frecuentes fueron dolor abdominal, náuseas, diarrea, elevación de las enzimas hepáticas, anemia, leucopenia, prurito y erupción. Tratamiento: En caso de sobredosis o toxicidad, se recomienda administrar colestiramina o carbón activo para acelerar la eliminación. La colestiramina administrada por vía oral a tres voluntarios sanos, a dosis de 8 g tres veces al día durante 24 horas, disminuyó los niveles plasmáticos de A aproximadamente en un 40%, en 24 horas, y en un 49 % a 65%, en 48 horas. La administración de carbón activo (polvo para suspensión), por vía oral o intubación nasogástrica (50 g cada 6 horas durante 24 horas), ha demostrado que reduce las concentraciones plasmáticas del metabolito activo A en un 37% en 24 horas y en un 48% en 48 horas. Estos procedimientos de lavado se podrían repetir si fuera clínicamente necesario. Estudios realizados tanto con hemodiálisis como con DPAC (diálisis peritoneal ambulatoria crónica) indican que A771726, el metabolito primario de leflunomida, no es dializable. DATOS FARMACÉUTICOS: Lista de excipientes. Arava 10 mg Núcleo del comprimido: Almidón de maíz Povidona (E1201) Crospovidona (E1202) Sílice coloidal anhidra Estearato de magnesio (E470b) Lactosa monohidrato Recubrimiento del comprimido: Talco (E553b) Hipromelosa (E464) Dióxido de titanio (E171) Macrogol 8000 Arava 20 mg Núcleo del comprimido: Almidón de maíz Povidona (E1201) Crospovidona (E1202) Sílice coloidal anhidra Estearato de magnesio (E470b) Lactosa monohidrato Recubrimiento del comprimido: Talco (E553b) Hipromelosa (E464) Dióxido de titanio (E171) Macrogol 8000 Óxido amarillo de hierro (E172) Arava 100 mg Núcleo del comprimido: Almidón de maíz Povidona (E1201) Crospovidona (E1202) Talco (E553b) Sílice coloidal anhidra Estearato de magnesio (E470b) Lactosa monohidrato Recubrimiento del comprimido: Talco (E553b) Hipromelosa (E464) Dióxido de titanio (E171) Macrogol
8 Incompatibilidades: No procede. Período de validez: 3 años. Precauciones especiales de conservación: Blister: Conservar en el embalaje original. Frasco: Mantener el envase perfectamente cerrado. Naturaleza y contenido del envase: Blister: Blister de aluminio/aluminio. Tamaño del envase: 3, 30 y 100 comprimidos recubiertos con película. Frasco: Frasco de polietileno de alta densidad de cuello ancho, de 100 ml, con tapón de rosca y un desecante integrado. Tamaño del envase: 30, 50 o 100 comprimidos recubiertos con película. Puede que sólo estén comercializados algunos tamaños de envases. Precauciones especiales de eliminación: Ninguna especial para su eliminación. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN: Sanofi-Aventis Deutschland GMBH D Frankfurt am Main, Alemania. Representante local: sanofi-aventis, S.A. C/ Josep Pla, Barcelona. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN Arava 10 mg: EU/1/99/118/ ; Arava 20 mg: EU/1/99/118/ ; Arava 100 mg EU/1/99/118/009. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN: Fecha de la primera autorización: 02 septiembre Fecha de la última revalidación: 02 septiembre CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN Con receta médica. Diagnóstico hospitalario. Aportación reducida. Presentaciones: Arava 10 mg, 30 comprimidos P.V.P: 25,92. P.V.P IVA: 26,96 Arava 20 mg, 30 comprimidos P.V.P: 51,86. P.V.P IVA: 53,94 Arava 100 mg, 3 comprimidos P.V.P: 25,92. P.V.P IVA: 26,96 CONSULTE LA FICHA TÉCNICA COMPLETA ANTES DE PRESCRIBIR ESTE MEDICAMENTO. FECHA DE LA REVISIÓN DEL TEXTO: Marzo 2012 PROES Julio 2012
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
NOMBRE DEL MEDICAMENTO: Arava 10 mg, Arava 20 mg, Arava 100 mg comprimidos recubiertos con película COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Arava 10
 NOMBRE DEL MEDICAMENTO: Arava 10 mg, Arava 20 mg, Arava 100 mg comprimidos recubiertos con película COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Arava 10 mg. Cada comprimido contiene 10 mg de leflunomida. Excipiente(s)
NOMBRE DEL MEDICAMENTO: Arava 10 mg, Arava 20 mg, Arava 100 mg comprimidos recubiertos con película COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Arava 10 mg. Cada comprimido contiene 10 mg de leflunomida. Excipiente(s)
FICHA TÉCNICA REDUCIDA. Arava 10 mg, Arava 20 mg, Arava 100 mg comprimidos recubiertos con película. Composición: Arava 10 mg: 10 mg de leflunomida,
 FICHA TÉCNICA REDUCIDA. Arava 10 mg, Arava 20 mg, Arava 100 mg comprimidos recubiertos con película. Composición: Arava 10 mg: 10 mg de leflunomida, Arava 20 mg: 20 mg de leflunomida, Arava 100 mg: 100
FICHA TÉCNICA REDUCIDA. Arava 10 mg, Arava 20 mg, Arava 100 mg comprimidos recubiertos con película. Composición: Arava 10 mg: 10 mg de leflunomida, Arava 20 mg: 20 mg de leflunomida, Arava 100 mg: 100
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
en tratamiento con Toctino ... Nombre de la paciente (alitretinoína) Para el médico Soluciones pensando en ti
 (alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
(alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA. 2. ANTES DE USAR Minoxidil Viñas 5% solución cutánea
 1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
EchinaMed Junior, comprimidos
 EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
FICHA TÉCNIA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNIA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1.NOMBRE DEL MEDICAMENTO. URSOBILANE 150 mg cápsulas. URSOBILANE 300 mg cápsulas. URSOBILANE 500 mg cápsulas. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNIA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1.NOMBRE DEL MEDICAMENTO. URSOBILANE 150 mg cápsulas. URSOBILANE 300 mg cápsulas. URSOBILANE 500 mg cápsulas. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
Plasimine está indicado para el tratamiento de las siguientes infecciones cutáneas causadas por microorganismos sensibles (ver sección 5.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento.
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos
 GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO
 ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
Cada comprimido de Pramipexol Actavis 0,18 mg contiene 0,18 mg de pramipexol base (como 0,25 mg de dihidrocloruro de pramipexol monohidrato).
 1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
FICHA TÉCNICA. Cada comprimido de TAMOXIFENO FUNK 10 mg Comprimidos contiene: Tamoxifeno citrato... 15,20 mg (equiv. a 10 mg base)
 1. DENOMINACIÓN DEL MEDICAMENTO TAMOXIFENO FUNK 10 mg Comprimidos TAMOXIFENO FUNK 20 mg Comprimidos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de TAMOXIFENO FUNK 10 mg Comprimidos
1. DENOMINACIÓN DEL MEDICAMENTO TAMOXIFENO FUNK 10 mg Comprimidos TAMOXIFENO FUNK 20 mg Comprimidos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de TAMOXIFENO FUNK 10 mg Comprimidos
MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro
 Prospecto: Información para el paciente MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
Prospecto: Información para el paciente MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
Ebastina ratiopharm 10 mg comprimidos bucodispersables EFG Ebastina
 Prospecto: información para el usuario Ebastina ratiopharm 10 mg comprimidos bucodispersables EFG Ebastina L ea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Ebastina ratiopharm 10 mg comprimidos bucodispersables EFG Ebastina L ea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
ROSIGLITAZONA (MALEATO) / METFORMINA CLORHIDRATO COMPRIMIDOS RECUBIERTOS 2/500mg,4/500mg-2/1000mg-4/1000mg
 ROSIGLITAZONA (MALEATO) / METFORMINA CLORHIDRATO COMPRIMIDOS RECUBIERTOS 2/500mg,4/500mg-2/1000mg-4/1000mg Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto.
ROSIGLITAZONA (MALEATO) / METFORMINA CLORHIDRATO COMPRIMIDOS RECUBIERTOS 2/500mg,4/500mg-2/1000mg-4/1000mg Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto.
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD
 PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
Prospecto: información para el usuario. Cebión 500 mg granulado para solución oral. Ácido ascórbico (Vitamina C)
 Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg
 SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG. Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
 1. NOMBRE DEL MEDICAMENTO Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
1. NOMBRE DEL MEDICAMENTO Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
FICHA TÉCNICA. Líquido oral. Líquido oleoso homogéneo, transparente, de color amarillo pálido
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
Menalgil B 6 Comprimidos
 agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
No hay evidencia de que un aumento de la dosis resulte en un aumento de la eficacia.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lambdaxel 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto contiene
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lambdaxel 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto contiene
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada cápsula dura contiene:
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
PROSPECTO: INFORMACIÓN PARA EL USUARIO DOLOCATIL 1 G COMPRIMIDOS EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO DOLOCATIL 1 G COMPRIMIDOS EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede tener que volver
PROSPECTO: INFORMACIÓN PARA EL USUARIO DOLOCATIL 1 G COMPRIMIDOS EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede tener que volver
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
Lea todo el prospecto detenidamente porque contiene información importante para usted.
 ENFRIESTOP Polvo para solución oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede obtenerse sin receta, para el tratamiento de afecciones
ENFRIESTOP Polvo para solución oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede obtenerse sin receta, para el tratamiento de afecciones
Prospecto: Información para el usuario. Ácidos omega 3 TARBIS 1.000 mg cápsulas blandas EFG Ésteres etílicos de ácidos grasos omega-3 al 90%
 Prospecto: Información para el usuario Ácidos omega 3 TARBIS 1.000 mg cápsulas blandas EFG Ésteres etílicos de ácidos grasos omega-3 al 90% Lea todo el prospecto detenidamente antes de empezar a tomar
Prospecto: Información para el usuario Ácidos omega 3 TARBIS 1.000 mg cápsulas blandas EFG Ésteres etílicos de ácidos grasos omega-3 al 90% Lea todo el prospecto detenidamente antes de empezar a tomar
AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE
 AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE 1.-ASPECTOS LEGALES El folleto de información al paciente debe cumplir con lo señalado en los
AGENCIA NACIONAL DE MEDICAMENTOS INSTRUCTIVO SOBRE CONTENIDOS Y FORMATO DE FOLLETO DE INFORMACIÓN AL PACIENTE 1.-ASPECTOS LEGALES El folleto de información al paciente debe cumplir con lo señalado en los
1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA
 POSTINOR 750 microgramos comprimidos. 1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Para los excipientes, véase en
POSTINOR 750 microgramos comprimidos. 1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Para los excipientes, véase en
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES
 DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
FICHA TÉCNICA. El comprimido es redondo, blanco y marcado con el código NL 1.5 en una cara.
 1. NOMBRE DEL MEDICAMENTO NorLevo 1,5mg comprimido. FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1,5mg de levonorgestrel. Excipientes: Lactosa monohidrato 90,9 mg. Para
1. NOMBRE DEL MEDICAMENTO NorLevo 1,5mg comprimido. FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1,5mg de levonorgestrel. Excipientes: Lactosa monohidrato 90,9 mg. Para
Eutirox 100 microgramos, comprimidos Levotiroxina (DCI) de sodio
 En este prospecto: 1. Qué es Eutirox 100 microgramos, comprimidos y para qué se utiliza? 2. Antes de tomar Eutirox 100 microgramos, comprimidos. 3. Cómo tomar Eutirox 100 microgramos, comprimidos. 4. Posibles
En este prospecto: 1. Qué es Eutirox 100 microgramos, comprimidos y para qué se utiliza? 2. Antes de tomar Eutirox 100 microgramos, comprimidos. 3. Cómo tomar Eutirox 100 microgramos, comprimidos. 4. Posibles
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario. Angileptol comprimidos para chupar sabor miel-limón Clorhexidina/Benzocaína/Enoxolona
 Prospecto: información para el usuario Angileptol comprimidos para chupar sabor miel-limón Clorhexidina/Benzocaína/Enoxolona Lea todo el prospecto detenidamente porque contiene información importante para
Prospecto: información para el usuario Angileptol comprimidos para chupar sabor miel-limón Clorhexidina/Benzocaína/Enoxolona Lea todo el prospecto detenidamente porque contiene información importante para
1. NOMBRE DEL MEDICAMENTO. FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de FAMOTIDINA MABO 20 mg COMPRIMIDOS contiene
1. NOMBRE DEL MEDICAMENTO FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de FAMOTIDINA MABO 20 mg COMPRIMIDOS contiene
FOLLETO DE INFORMACION AL PACIENTE
 FOLLETO DE INFORMACION AL PACIENTE DIANORMAX Comprimidos 80 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento.
FOLLETO DE INFORMACION AL PACIENTE DIANORMAX Comprimidos 80 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento.
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS
 INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
Prospecto: información para el usuario. Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro
 Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
QUÉ ES LA HEPATITIS C? CÓMO SE CONTAGIA?
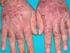 QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
Prospecto: Información para el usuario. Levelina 10 mg/g crema Bifonazol
 Prospecto: Información para el usuario Levelina 10 mg/g crema Bifonazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Prospecto: Información para el usuario Levelina 10 mg/g crema Bifonazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ciclopirox olamina ISDIN 15 mg/g champú 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de champú contiene 15
Hipersensibilidad al nedocromil sódico o a alguno de los excipientes.
 1. DENOMINACIÓN DEL MEDICAMENTO Tilad 2 mg suspensión para inhalación en envase a presión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Nedocromil sódico. Cada envase contiene 1,4085 % p/p de nedocromil sódico
1. DENOMINACIÓN DEL MEDICAMENTO Tilad 2 mg suspensión para inhalación en envase a presión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Nedocromil sódico. Cada envase contiene 1,4085 % p/p de nedocromil sódico
TRAMADOL LANALGET 100 mg comprimidos de liberación prolongada EFG
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo - Si tiene alguna duda, consulte a su médico o farmacéutico - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo - Si tiene alguna duda, consulte a su médico o farmacéutico - Este
Anexo II. Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos
 Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
VITRIFICACIÓN DE ÓVULOS (OVOCITOS)
 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 1 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 2 Es una técnica que se considera un procedimiento experimental, destinada a conservar gametos femeninos con fines reproductivos,
VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 1 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 2 Es una técnica que se considera un procedimiento experimental, destinada a conservar gametos femeninos con fines reproductivos,
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Prospecto: información para el usuario. Benzac 100 mg/g gel Peróxido de benzoilo
 Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica.
 DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg
 KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg Venta bajo receta Industria Argentina Comprimidos recubiertos FÓRMULA CUALICUANTITATIVA: Cada comprimido recubierto de 50 mg contiene: Losartán potásico 50 mg Excipientes:
KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg Venta bajo receta Industria Argentina Comprimidos recubiertos FÓRMULA CUALICUANTITATIVA: Cada comprimido recubierto de 50 mg contiene: Losartán potásico 50 mg Excipientes:
FICHA TÉCNICA. 3.- FORMA FARMACÉUTICA Solución inyectable. La solución es transparente y ligeramente amarillenta.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Miocrin 10 Miocrin 25 Miocrin 50 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Miocrin 10: Aurotiomalato sódico
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Miocrin 10 Miocrin 25 Miocrin 50 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Miocrin 10: Aurotiomalato sódico
Prospecto: información para el usuario Lacovin 20 mg/ml solución cutánea Minoxidil
 Prospecto: información para el usuario Lacovin 20 mg/ml solución cutánea Minoxidil Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Lacovin 20 mg/ml solución cutánea Minoxidil Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg
 INFORMACIÓN PARA PRESCRIBIR AMPLIA Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg 1. DENOMINACIÓN DISTINTIVA BONADOXINA 2. DENOMINACIÓN GENÉRICA Meclozina/Piridoxina 3. FORMA FARMACÉUTICA Y FORMULACIÓN
INFORMACIÓN PARA PRESCRIBIR AMPLIA Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg 1. DENOMINACIÓN DISTINTIVA BONADOXINA 2. DENOMINACIÓN GENÉRICA Meclozina/Piridoxina 3. FORMA FARMACÉUTICA Y FORMULACIÓN
Transfusión de sangre
 Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
ANEUROL 5 mg/10 mg comprimidos recubiertos Diazepam / Piridoxina Hidrocloruro
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ANEUROL 5 mg/10 mg comprimidos recubiertos Diazepam / Piridoxina Hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO ANEUROL 5 mg/10 mg comprimidos recubiertos Diazepam / Piridoxina Hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve
FICHA DE INFORMACIÓN AL PACIENTE: REPAGLINIDA
 FICHA DE INFORMACIÓN AL PACIENTE: REPAGLINIDA 1.1 Acción: Antidiabético oral. Hipoglucemiante. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: La repaglinida estimula la liberación de insulina
FICHA DE INFORMACIÓN AL PACIENTE: REPAGLINIDA 1.1 Acción: Antidiabético oral. Hipoglucemiante. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: La repaglinida estimula la liberación de insulina
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zulex 333 mg Comprimidos recubiertos Acamprosato
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
Prospecto: información para el usuario
 Prospecto: información para el usuario HIBITANE 5mg/5mg Comprimidos para chupar sabor mentol Clorhexidina dihidrocloruro/benzocaína Lea todo el prospecto detenidamente porque contiene información importante
Prospecto: información para el usuario HIBITANE 5mg/5mg Comprimidos para chupar sabor mentol Clorhexidina dihidrocloruro/benzocaína Lea todo el prospecto detenidamente porque contiene información importante
SIM EXPRESS Información dirigida a los profesionales de la salud Leflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos SIM EXPRESS Información dirigida a los profesionales
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos SIM EXPRESS Información dirigida a los profesionales
- Si es alérgico (hipersensible) a la clorhexidina, benzocaína o a cualquiera de los demás componentes de este medicamento.
 PROSPECTO: INFORMACIÓN PARA EL USUARIO APOGAR 5 mg /5 mg Comprimidos para chupar Clorhexidina dihidrocloruro/ Benzocaína Lea todo el prospecto detenidamente porque contiene información importante para
PROSPECTO: INFORMACIÓN PARA EL USUARIO APOGAR 5 mg /5 mg Comprimidos para chupar Clorhexidina dihidrocloruro/ Benzocaína Lea todo el prospecto detenidamente porque contiene información importante para
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A AMEFIN
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. NOMBRE COMERCIAL: 2. NOMBRE GENÉRICO: 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas Cada tableta contiene: Excipiente cbp 100 mg y 300 mg 1 tableta 4. INDICACIONES
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. NOMBRE COMERCIAL: 2. NOMBRE GENÉRICO: 3. FORMA FARMACÉUTICA Y FORMULACIÓN: Tabletas Cada tableta contiene: Excipiente cbp 100 mg y 300 mg 1 tableta 4. INDICACIONES
RELAXIBYS (Carisoprodol - Paracetamol)
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento porque contiene información importante para usted. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Citalopram Argenol 40 mg comprimidos recubiertos con película EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Citalopram Argenol 40 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Citalopram Argenol 40 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO NOMBRE DEL MEDICAMENTO Flerudin 5 mg comprimidos 1. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Flerudin contiene hidrocloruro
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO NOMBRE DEL MEDICAMENTO Flerudin 5 mg comprimidos 1. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Flerudin contiene hidrocloruro
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Ropinirol KERN PHARMA 0,25 mg comprimidos recubiertos con película EFG. Ropinirol KERN PHARMA 0,5 mg comprimidos recubiertos con película EFG. Ropinirol KERN PHARMA 1 mg comprimidos
1. NOMBRE DEL MEDICAMENTO Ropinirol KERN PHARMA 0,25 mg comprimidos recubiertos con película EFG. Ropinirol KERN PHARMA 0,5 mg comprimidos recubiertos con película EFG. Ropinirol KERN PHARMA 1 mg comprimidos
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Fluvastatina Alter 80 mg comprimidos de liberación prolongada EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Fluvastatina Alter 80 mg comprimidos de liberación prolongada EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento - Conserve este prospecto
PROSPECTO: INFORMACIÓN PARA EL USUARIO Fluvastatina Alter 80 mg comprimidos de liberación prolongada EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento - Conserve este prospecto
FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg
 FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg 1. DENOMINACIÓN Denominación Internacional MIRION Denominación del producto 17 B-Estradiol Valerato Micronizado 2. FÓRMULA QUÍMICA DEL PRINCIPIO
FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg 1. DENOMINACIÓN Denominación Internacional MIRION Denominación del producto 17 B-Estradiol Valerato Micronizado 2. FÓRMULA QUÍMICA DEL PRINCIPIO
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
www.printo.it/pediatric-rheumatology/ar/intro
 www.printo.it/pediatric-rheumatology/ar/intro Síndrome PAPA Versión de 2016 1. QUÉ ES EL SÍNDROME PAPA 1.1 En qué consiste? El acrónimo PAPA significa, en inglés, artritis piógena, pioderma gangrenoso
www.printo.it/pediatric-rheumatology/ar/intro Síndrome PAPA Versión de 2016 1. QUÉ ES EL SÍNDROME PAPA 1.1 En qué consiste? El acrónimo PAPA significa, en inglés, artritis piógena, pioderma gangrenoso
FICHA TÉCNICA. No hay ninguna advertencia o precaución en su empleo que merezca la pena destacar.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Foli-doce 400/2 microgramos comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: Acido fólico: 400 microgramos, Cianocobalamina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Foli-doce 400/2 microgramos comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: Acido fólico: 400 microgramos, Cianocobalamina
THIAFELINE 2,5 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA PARA GATOS
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO THIAFELINE 2,5 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA PARA GATOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO THIAFELINE 2,5 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA PARA GATOS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
COMPOSICIÓN ANGILEPTOL. Sabor Menta Comprimidos
 COMPOSICIÓN ANGILEPTOL Sabor Menta Comprimidos Cada comprimido contiene: Principios activos: Clorhexidina (D.C.I) HCl... 5 mg Benzocaína (D.C.I.)... 4 mg Enoxolona (D.C.I.)... 3 mg Excipientes: Sorbitol
COMPOSICIÓN ANGILEPTOL Sabor Menta Comprimidos Cada comprimido contiene: Principios activos: Clorhexidina (D.C.I) HCl... 5 mg Benzocaína (D.C.I.)... 4 mg Enoxolona (D.C.I.)... 3 mg Excipientes: Sorbitol
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Hirudoid 3 mg/g gel Condroitina sulfato de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Hirudoid 3 mg/g gel Condroitina sulfato de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO Hirudoid 3 mg/g gel Condroitina sulfato de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
LUPUS ERITEMATOSO Y EMBARAZO. Dra. Leticia Sánchez R2
 LUPUS ERITEMATOSO Y EMBARAZO Dra. Leticia Sánchez R2 El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria crónica, autoinmune y de causa desconocida. Curso clínico con periodos de actividad
LUPUS ERITEMATOSO Y EMBARAZO Dra. Leticia Sánchez R2 El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria crónica, autoinmune y de causa desconocida. Curso clínico con periodos de actividad
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 Nombre del producto: DCI Forma farmacéutica: Fortaleza: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Cetimer 5 mg (Levocetirizina) Comprimido recubierto 5 mg Presentación: Estuche por 10 blísteres de PVC/AL
Nombre del producto: DCI Forma farmacéutica: Fortaleza: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Cetimer 5 mg (Levocetirizina) Comprimido recubierto 5 mg Presentación: Estuche por 10 blísteres de PVC/AL
