If you wish to buy this book, please, write to the following address:
|
|
|
- Tomás Salas de la Cruz
- hace 8 años
- Vistas:
Transcripción
1
2 If you wish to buy this book, please, write to the following address: Si desea comprar este libro, por favor, escriba a la siguiente dirección: jaime.gonzalez@uam.es
3 Índice Analítico CONVERSIÓN Y ALMACENAMIENTO DE ENERGÍA POR VÍA ELECTROQUÍMICA Y FOTOELECTROQUÍMICA Capítulo I Dispositivos almacenadores de energía I.1.1. Pilas primarias y secundarias, acumuladores y células de combustión 3 I.1.2. Clasificación de las pilas electroquímicas 6 I.1.3. Parámetros importantes en el funcionamiento de las pilas 9 I.1.4. La pila Leclanché 12 I.1.5. Pilas de mercurio 17 I.1.6. La pila de plata 19 I.1.7. Pila de magnesio (Mg/MnO 2 ) 19 I.1.8. Pila cinc/aire 20 I.1.9. Pilas primarias con ánodos de litio 21 I.1.9.a. Pilas de litio con cátodo sólido 22 I.1.9.b. La pila Li/SOCl 2 25 I.1.9.c. La pila litio-iodo 28 I.1.9.d. Pilas de litio con cátodo sólido 30 I.1.9.e. Células de litio de cátodo soluble 31 I.2. Pilas secundarias o acumuladores 31 I.2.1. El acumulador de plomo-ácido 33 I.2.2. El acumulador de Ni-Cd 44 I.2.3. El acumulador de níquel-hierro 50 I.2.4. El acumulador de níquel-cinc 52 I.2.5. Acumuladores con cátodos de óxido de plata 53 I.2.6. Acumuladores hidrógeno-metal 54 I.2.7. Diagramas de Ragone 55 I.2.8. Acumuladores redox Tipos de pares redox que pueden utilizarse en un acumulador redox Ventajas e inconvenientes de los acumuladores redox 61 I El acumulador redox de Fe/Cr 65 I Acumuladores Zn-halógeno 68 I Acumuladores Zn/Cl 2 69 I Acumuladores Zn-Br 2 70 I Acumuladores metal-aire 71 I Acumuladores cinc-aire 71 I Acumuladores hierro-aire 72 I Acumuladores litio-aire 72 I Acumuladores aluminio-aire 73 I Acumuladores que hacen uso de electrolitos no acuosos 74 I Acumuladores que hacen uso de electrolitos no acuosos y funcionan a temperatura ambiente 74
4 I Acumuladores que hacen uso de electrolitos no acuosos y funcionan a elevada temperatura 75 I Acumuladores con electrolito de sales fundidas 76 I Acumuladores con electrolito sólido 77 I Acumuladores Na/S 77 I Acumuladores Na/Cl 3 Sb 79 I Acumuladores basados en polímeros conductores 79 I Estudio comparativo del funcionamiento de diversos tipos de acumuladores 84 I.3. Condensadores electroquímicos como acumuladores de energía 85 I.3.1. Materiales para electrodos, electrolitos y diseño de células en supercondensadores 90 I.4. Ultrabaterías 100 Capítulo II CÉLULAS DE COMBUSTIÓN II.1. Introducción a las células de combustible 105 II.2. Ventajas que presentan las células de combustión 106 II.3. Inconvenientes de las células de combustión 107 II.4. Cálculo del balance de energía en un sistema electroquímico 110 II.5. Consideraciones termodinámicas sobre la transformación electroquímica de energía. Eficiencia de las células de combustión 121 II.6. Cálculo del potencial de una célula de combustión durante su funcionamiento 122 II.7. Cambio de entropía en la reacción global y producción de calor en una célula de combustión 133 II.8. Variación del potencial de una célula de combustión con la temperatura 134 II.9. Variación del potencial reversible de célula con la presión 137 II.10. Datos termodinámicos de reacciones de combustión de diversos combustibles 139 II.11. Electrocatalizadores para células de combustión. Electrodos porosos 141 II.12. La célula de combustión de ácido fosfórico (PAFC) 145 II.13. Células de combustión alcalinas (Alkaline Fuel Cell, AFC) 151 II.14. Células de combustión de carbonato fundido. (MCFC) 153 II.15. Células de combustión de óxido sólido (SOFC) 155 II.16. Células de combustión para combustibles líquidos 160 II.17. Células de combustión de electrolito de membrana polimérica (PEMFC) o de membrana de intercambio de protones 163 II.18. Células de biocombustible 173 II.19. Sistemas que utilizan conjuntos de células de combustión. (Fuel Cell Stacks) 177 II.20. Comparación de las relaciones entre densidad de potencia y densidad de energía de sistemas de células de combustión para dispositivos portátiles y otros sistemas portátiles de generación de electricidad. Diagrama de Ragone 179
5 II.21. Comparación entre las células de combustión y otros sistemas de suministro de energía 181 II.22. Estudio del comportamiento de las células de combustión haciendo uso del método de espectroscopía de impedancia electroquímica (EIS) 183 II.23. Aplicación de las medidas de impedancia a la determinación de parámetros de importancia para el funcionamiento de células de cambustión 186 II.24. Circuito equivalente representativo de una célula de combustión 188 Capítulo III Fotoelectroquímica en interfases semiconductor-electrolito III.1. Ideas generales sobre Fotoelectroquímica 195 III.2. Descripción cualitativa del modelo de bandas en los sólidos 196 III.3. Semiconductores intrínsecos 205 III.4. Representación del potencial periódico en un cristal sólido 206 III.5. Semiconductores intrínsecos bajo iluminación 213 III.6. Semiconductores extrínsecos 214 III.7. Semiconductores extrínsecos de tipo p 217 III.8. Densidad de portadores de carga en semiconductores extrínsecos 221 III.9. Correlación entre la escala física de energía y la escala de potenciales electroquímicos 222 III.10. Métodos electroquímicos de caracterización de semiconductores 224 III.11. Eficiencia en la separación de carga. Espectro de acción 228 III.12. Generación de la interfase entre un semiconductor intrínseco y un electrolito 231 III.13. Estructura de la doble capa semiconductor/electrolito 237 III.14. Variación de la densidad de corriente con el potencial en interfases semiconductor electrolito. Velocidad de las reacciones de transferencia de carga 246 III.15. Fotoefectos en interfases semiconductor electrolito 252 III.16. Determinación de las características corriente potencial de una célula fotoelectroquímica regenerativa a partir de los registros i-e sobre los electrodos individuales en el mismo electrolito 258 III.17. Células fotoelectroquímicas 264 III.18. Células fotogalvánicas 266 III La célula fotogalvánica de tioinina 267 III.19. Células fotoelectroquímicas 271 III Eficiencia de conversión de energía solar en las células fotoelectroquímicas 274 III Características i/e de una célula fotoelectroquímica 282 III Condiciones que tiene que cumplir semiconductor y electrolito, para lograr un comportamiento óptimo en las células regenerativas 285 III.20. Condiciones que tiene que cumplir el material electródico necesario para construir una célula fotoelectroquímica regenerativa 289 III.21. Condiciones que tiene que cumplir el par redox necesario para construir una célula fotoelectroquímica regenerativa 289
6 III.22. Sensibilización de semiconductores 291 III.23. Sistemas fotovoltáicos moleculares. La célula regenerativa molecular de Grätzel 293 III Eficiencia de conversión de la célula fotovoltáica molecular 300 III.24. Conversión de energía solar en energía libre química 306 III Células fotoelectrosintéticas o fotoelectrolíticas 307 III.25. Células fotoelectroquímicas para la fotodescomposición del agua 311 III Condiciones que tiene que cumplir un fotoelectrodo para una célula fotoelectrolítica del agua 319 III.26. Selección de materiales semiconductores para la fotoelectrolisis del agua 325 III.27. Semiconductores de calcogenuros de metales de transición 328 III.28. Influencia de los estados superficiales sobre la fotoestabilidad de electrodos semiconductores 332 III.29. Fotodescomposición catódica 333 III.30. Formas de evitar la fotodescomposición de fotoelectrodos semiconductores 336 III.31. Células fotoelectrocatalíticas 336 III.32. Reacciones fotoelectrosintéticas y fotoelectrocatalíticas en sistemas microheterogéneos 338 III Eficiencia de conversión de fotones incidentes a fotocorriente [IPCE (Incident Photon to Current Conversion Efficiency)] 343 III Mecanismo de separación de los pares electrón/hueco en las partículas de semiconductor iluminadas 344 III Velocidades de las reacciones de oxidación/reducción sobre las partículas de semiconductores 348 III Reacciones fotosintéticas en suspensiones de partículas de semiconductor iluminadas 354 III.33. Nanopartículas o partículas cuánticas 359 III Procesos de adición de carga eléctrica. Energía de las bandas en partículas Q 363 III.34. Aplicaciones alternativas de los métodos fotoelectroquímicos 365 III Microlitografía, imágenes fotográficas por medios fotoelectroquímicos y pantallas electroquícas de semiconductores 366 III Imágenes fotográficas sobre semiconductores 368 III Sensores químicos basados en propiedades fotoelectroquímicas 370 III Aplicaciones de sistemas microheterogéneos a la eliminación de trazas de compuestos químicos tóxicos presentes en aguas residuales industriales. Fotocatálisis medioambiental 371 III Eliminación de microorganismos por recubrimientos de baldosas y azulejos con TiO III Cambios de humidificabilidad fotoinducidos. Superficies superhidrofílicas 373 III Superficie oleofílicas y anfifílicas 374 III Pigmentos, pinturas y recubrimientos 375 III Posibles aplicaciones de la Fotoelectroquímica a la Agricultura 375 Bibliografía 377 Índice alfabético 384
7 I.1.9. Pilas primarias con ánodos de litio Si se pretende que la pila fabricada presente el mayor valor posible para el voltaje a circuito abierto hay que tratar de elegir un ánodo y un cátodo que se caractericen por potenciales estándar muy alejados entre sí. Si se comparan los potenciales estándar de ánodos elaborados a partir de Zn, Mg y Cd (los cuales valen 0.76, 2.37 y 0.81 V NHE, respectivamente) con el del litio (E 0 Li + /Li = 3.04) puede observarse que, enfrentado al mismo cátodo este electrodo debería dar lugar a potenciales a circuito abierto mucho más elevados. Figura I.8. Curvas de descarga de una pila de Li/SOCl 2 y de una pila de Li/SO 2, en las que puede observarse la constancia del voltaje de celda a lo largo de la vida de las células. Por otra parte, la masa molecular del litio es menor que la de los otros metales mencionados, por lo que la densidad de energía del electrodo de Li es mucho mayor que la de los otros que se han mencionado (asi, el electrodo de litio presenta una densidad de energía de 3.86 Ah/gr, mientras que los de Zn, Mg y Cd muestran valores de 0.82, 2.2 y 0.47 Ah/gr, respectivamente, para la magnitud mencionada). Por estas razones, una sola pila de litio puede suministrar casi el mismo voltaje que tres pilas alcalinas en serie o mostrar una densidad de energía hasta quince veces mayor que la de un acumulador de plomo. En este caso, el voltaje de célula se mantiene prácticamente constante a lo largo de la mayor parte de la vida útil de este tipo de células, como muestran las Figuras I.8 y I.9. Sin embargo, como ocurre con todos los metales alcalinos, al poner al litio en contacto con agua se produce una reducción de la misma, en la que tiene lugar desprendimiento de hidrógeno y una liberación de grandes cantidades de calor, que pueden hacer explotar la mezcla hidrógeno aire. Por esa razón, los sistemas que utilizan al litio como ánodo hacen uso de electrolitos no acuosos, como pueden ser los que se generan a partir de un disolvente orgánico, o bien, sales fundidas o electrolitos sólidos. Al prescindir del agua como disolvente, las pilas que usan litio pueden trabajar a bajas temperaturas sin que se produzca congelación. Además, dado que el litio muestra muy baja actividad en los medios mencionados, la velocidad de autodescarga de las pilas es muy baja.
8 Figura I.9. Curvas de descarga de una batería de 2.65 Ah de tamaño AA de Li/SO 2, diseñada para aplicaciones de baja velocidad de descarga. Cada una de las curvas se registró a velocidades de descarga diferentes, las cuales vienen medidas por la corriente suministrada, que, en cada caso fue de 15, 5 y 1 ma, respectivamente. La imagen insertada muestra la variación de la capacidad de carga con la velocidad de descarga (medida por el valor de la corriente I en ma. Los cátodos que se suelen utilizar pueden ser clasificados en cuatro tipos diferentes. En las pilas de cátodo sólido se puede utilizar como cátodo monofluoruro de carbono, sales de Cu ó Ag, óxidos del tipo del MnO 2, BiO 2, PbO ó CuO, o bien sulfuros como el CuS ó el FeS x. En las pilas de cátodo soluble se hace uso de SO 2 y en las de cátodo líquido de SOCl 2, SO 2 Cl 2 ó POCl 3. Por último, en las pilas de electrolito sólido se utiliza una mezcla de polivinil piridina y yodo, Li 2 S, PbS. I.1.9.a. Pilas de litio con cátodo sólido Un caso interesante es el de la pila recargable de litio que se elabora a partir de un ánodo sólido de LiCoO 2, y de un cátodo de grafito. Las reacciones de semicélula en esta pila recargable son las siguientes: Reacción en el ánodo (en el proceso de descarga o cátodo en el de carga): Reacción en el cátodo (en el proceso de descarga o cátodo en el de carga): Donde las flechas de izquierda a derecha indican el sentido de la reacción de descarga y las de derecha a izquierda de la reacción de carga. La reacción global de la pila es la siguiente:
9 Donde E term representa la diferencia de potencial termodinámica entre ambos electrodos, que es la que se mide a circuito abierto, es decir, es la fuerza electromotriz de la pila. El circuito se completa por conducción iónica en el electrolito, en la que participan como portadores de carga los iones litio que se producen en la oxidación del retículo del LiCoO 2 representada por la Ecuación I.28. Estos iones litio difunden hacia el electrodo de carbono grafítico, entre cuyas láminas de grafeno se introducen en un proceso denominado intercalación. Los electrones generados en la reacción I.28 fluyen a través del circuito externo hasta el electrodo de carbono, donde contribuyen a la reducción de los iones litio intercalados entre las capas de grafeno, para dar lugar al compuesto CLi x. Este es el conjunto de reacciones que tienen lugar durante la descarga del acumulador. Durante el proceso de carga, el generador externo de electricidad extrae electrones del electrodo de carbono, lo que induce a que la reacción I.29 se produzca en sentido inverso, es decir, se produce una oxidación del CLi x a C más x iones Li +, los cuales difunden hacia el electrodo de LiCoO 2. A su vez, los electrones extraídos por el generador externo son bombeados por el mismo hasta alcanzar la energía libre suficiente para que pueda tener lugar la reacción I.28, pero en sentido inverso, es decir, en el de la reducción de los iones Li + que están llegando por difusión desde el electrodo de carbono a átomos de litio, los cuales se incorporan al retículo del Li (1 n) CoO 2 para regenerar el LiCoO 2 (s). Al final del proceso de carga se han regenerado los electrodos de LiCoO 2 y de carbono grafítico, el primero de los cuales se caracteriza por poseer un nivel de Fermi de mayor energía que el segundo, lo que constituye el estado de carga del sistema.
10 Figura I.10. Esquema de las estructuras de ánodo y cátodo (en proceso de descarga), es decir, del y del. (Li x se refiere a los átomos de litio que quedan intercalados entre las láminas del grafito y no indican un compuesto estequiométrico). La pila, como se indica, muestra un potencial a circuito abierto a plena carga de 3.7 voltios. El hecho de que todas las sustancias que participan en la reacción global sean sólidas indican que el cociente de reacción, Q, es igual a la unidad, lo que, de acuerdo con los argumentos que se mencionaron en el caso de la pila de mercurio, da lugar a que el potencial de pila se mantenga prácticamente constante a lo largo de los procesos de descarga y de carga. La Figura I.10 muestra un esquema de las estructuras de ánodo y cátodo (en proceso de descarga), es decir, del y del. Li x se refiere a los átomos de litio que quedan intercalados entre las láminas del grafito y no indican un compuesto estequiométrico. I.1.9.b. La pila Li/SOCl 2 Esta batería está formada por un ánodo de litio y un cátodo de pasta de carbón. El electrolito consiste en una disolución de tetracloroaluminato de litio (LiAlCl 4 ) en cloruro de tionilo. Las reacciones en cada uno de los electrodos son las siguientes: Reacción en el ánodo:
11 En el propio cátodo (pasta de carbón) no existe material reducible, por lo que es el propio disolvente el que actúa como material activo en el cátodo. Por esa razón, la reacción en el cátodo suele escribirse como sigue: Reacción en el cátodo: La reacción total es la siguiente: El voltaje de célula reversible, E, es de 3.65 voltios. Tomando como base la ecuación de reacción global, calculando las masas moleculares de los reactivos y el valor de G se puede calcular a partir de la ecuación de Nernst ( G = nfe; donde n = 4), dividiendo este valor, expresado en Wh, por la suma de las masas moleculares. Así pues, se puede escribir: En las células comerciales se llegan a alcanzar densidades de energía del orden de 700 Wh/kg. Las células de litio suelen fabricarse poniendo una cantidad limitante en el ánodo, es decir, se pone menor cantidad de litio qu la que es necesaria estequiométricamente para que se produzca la rescarga total de ánodo y cátodo, pero también se diseñan otras con cantidades estequiométricas en ánodo y cátodo, según cual sea el tipo de aplicación en la que pretenda emplearlas. Dada la gran actividad del litio, la cual se mide por la energía libre de interacción entre este metal alcalino y el disolvente, pudiera esperarse una reacción violenta e incluso explosiva entre ambos. Sin embargo, esto no ocurre por que, tan pronto como se produce el contacto entre el metal y el disolvente, se forma una capa protectora que impide que el ataque químico siga teniendo lugar. En el caso de la célula de Li/SOCl 2, la capa protectora está formada por LiCl, que es un producto insoluble en el disolvente. Cuando se utiliza como disolvente el carbonato
12 de propileno, entonces se forma una capa protectora de Li 2 CO 3. Ambas capas son permeables a los iones litio pero no lo son a los electrones. Se podría afirmar que las capas protectoras actúan como electrolitos sólidos, que conducen la electricidad debido al movimiento de iones litio a su través y no muestran conductividad electrónica. El número de transferencia de las capas con respecto al ión positivo es la unidad. Se habla de una interfaz de electrolito sólido (Solid Electrolyte Interface, SEI). Es preciso comentar que cuando un metal es atacado por una disolución se pueden formar tres tipos de recubrimientos. En el caso de que el recubrimiento consista en una capa densa, no conductora, el metal puede quedar protegido contra la corrosión, pero no puede ser utilzado para formar parte de una pila, debido a que se encuentra completamente aislado de la disolución, con la que no puede intercambiar ni iones ni electrones. Si la capa que se forma fuera tanto conductora iónica como electrónica, entonces podría tener lugar sin ningún impedimento la reducción del disolvente en la interfase que se forma entre la película de recubrimiento y el electrolito y la oxidación del metal en la interfaz entre el metal y la película de recubrimiento, lo que conduciría a una rápida autodescarga. Por último, cuando el resultado del ataque del metal por la disolución da lugar a la formación de una película como la que se forma en la pila Li- SOCl 2, que es conductora iónica pero no deja pasar electrones a su través, entonces no puede producirse la reducción espontánea del disolvente por el ánodo, mientras que si que pueden tener lugar la oxidación del metal en el ánodo y la reducción del disolvente en el cátodo a suficiente velocidad para que el sistema funcione como una pila. Las características más notables de las pilas de litio son su elevada densidad de energía y su alto valor del voltaje a circuito abierto. Como este valor es de 3.5 Voltios, es decir, más del doble que el de una pila Leclanché, basta con poner en serie la mitad de las células para obtener la misma diferencia de potencial. Esto da lugar a una mayor seguridad en el funcionamiento. Es preciso explicar que para alimentar aparatos para cuyo funcionamiento hay que aplicar diferencias de potencial elevadas, se recurre a baterías de varias pilas en serie. Un sistema de este tipo se comporta con una menor fiabilidad que una sola pila. Así, si la probabilidad de fallo de una pila aislada fuera del 1%, la probabilidad de que durante su funcionamiento no se produjera un fallo sería igual a Sin embargo, la probabilidad de que una batería de diez pilas de este tipo puestas en serie funcionara sin un solo fallo sería igual a (0.99) 10 = 0.9, es decir, se habría pasado de una fiabilidad del 99% en el caso de una sola célula a una del 90% cuando se hace uso de una batería de diez pilas del mismo tipo conectadas en serie. Muchas memorias de ordenador necesitan corriente suministrada a algo más de 3 Voltios para operar, por lo que puede bastar con hacer uso de una única pila de Li/SOCl 2. Otra ventaja de las pilas de litio es que su velocidad de autodescarga es muy lenta, alrededor de diez veces más baja que la que muestran las pilas Leclanché, lo que hace que sea posible almacenarlas sin refrigeración durante períodos de hasta diez años. Por otra parte, estas pilas muestran una elevada estabilidad del voltaje durante su descarga, como muestra la Figura I.8. Sin embargo, no se puede hacer uso de las curvas de potencial frente a descarga para obtener la carga que conserva una pila tras un cierto tipo de uso, como puede hacerse en el caso de una pila Leclanché. Las pilas y acumuladores de litio necesitan aparatos especiales para determinar su estado de carga. La Figura I.9 muestra representaciones gráficas del voltaje de célula de una pila de Li/SOCl 2 caracterizada por una muy elevada densidad de energía (749 Wh/kg) durante su descarga a diferentes velocidades. En la imagen insertada se muestra como decrece la densidad de energía con la velocidad de descarga. De acuerdo con las cantidades de reactivos determinadas por análisis químico, esta pila debería mostrar una carga de 2.65 Ah por unidad (se trataría pues, de una pila de pequeño tamaño). Sin embargo, cuando la pila se utiliza para suministrar una
13 corriente constante de 1 ma, lo que supone una baja velocidad de descarga, la carga que realmente suministra es 2.41 Ah, es decir, el 91% de su capacidad teórica, lo que indica que solo el 9% del total de la energía se ha degradado en calor después de ayudar a superar todas las resistencias a la corriente. Esto significa que la transformación química del material activo para dar lugar a la generación de energía eléctrica se ha producido de forma muy eficiente. Cuando se incrementa la velocidad de descarga a 5 ma, la carga suministrada es 1.8 Ah, lo que supone que se ha aprovechado el 75% de la capacidad teórica en generar electricidad. Por último si la descarga se produce a 15 ma entonces la capacidad de carga se reduce hasta 1.64 Ah, lo que significa que solo el 62% de la capacidad teórica se ha empleado en generar energía eléctrica. Todas las características que se acaban de discutir convierten a las pilas de litio en las más apropiadas para suministrar energía eléctrica a los ordenadores portátiles. No obstante, hay que añadir que este tipo de pilas resultan de tres a cinco veces más caras que las pilas Leclanché del mismo contenido energético. Por otra parte, aunque las pilas de litio de pequeño tamaño son bastante seguras, las que son capaces de suministrar elevados valores de energía eléctrica pueden, bajo ciertas condiciones de funcionamiento, llegar a hacer explosión. Por ejemplo, si se produce un calentamiento anómalo puede llegar a fundirse el litio (cuyo punto de fusión es de solo ºC), lo cual puede dar lugar a la ruptura de la capa que forma la interfaz de electrolito sólido (SEI), lo que conduce a una reacción violenta entre el metal y el disolvente, que puede llegar a ser explosiva. Estas pilas se utilizan para la iluminación de emergencia, las radiosondas meteorológicas o la instrumentación de submarinos. Además pueden trabajar en un amplio intervalo de temperaturas (que puede extenderse desde 40 hasta +70 ºC). También pueden utilizarse como cátodos líquidos y como electrolitos el cloruro de fosforilo (POCl 2 ) y el cloruro de sulforilo (SO 2 Cl 2 ). I.1.9.c. La pila litio/iodo La pila litio/iodo de estado sólido se utiliza para suministrar corriente a los marcapasos. Las reacciones que tienen lugar en cada uno de los electrodos en este caso son las siguientes: Reacción en el ánodo: Reacción en el cátodo: Reacción global: De una forma más compleja, la reacción global de descarga se puede escribir del siguiente modo:
14 En este caso el electrolito es LiI en estado sólido, el cual se forma durante el funcionamiento de la pila. La conducción en el electrolito es efectuada por transporte de los iones Li + a través de los defectos reticulares del sólido. A su vez, el electrolito sólido no presenta conductividad electrónica, con lo que cumple con las condiciones necesarias para poder ser empleado en la construcción de una pila. El cátodo está formado por una mezcla de poli-2-vinilpiridina y iodo molecular. Esta mezcla se elabora por fusión hasta que se forma un material homogéneo. El material resultante de este proceso es un complejo de transferencia de carga a través del cual se puede transferir iodo con facilidad. Al producirse la descarga de la pila crece el espesor de la capa de LiI sólida, lo que aumenta la resistencia que dicha capa opone al paso de la corriente. Sin embargo, dicha resistencia no es suficiente para que el término IE, llegue a ser elevado, ya que los valores de I necesarios para que el marcapasos funcione son muy bajos (la intensidad de corriente necesaria es I 10 A). Estas pilas muestran un voltaje a circuito abierto de 2.8 V, aunque, de acuerdo con los valores de los potenciales normales que muestran ambos electrodos, el potencial a circuito abierto de esta célula resultaría ser igual a 3.58 V. Sin embargo, no hay que olvidar que los potenciales normales se miden en disoluciones acuosas, mientras que el medio en que se encuentran los reactivos en la pila de Litio-iodo es sólido, donde las energías libres de los diferentes compuestos son muy diferentes. La densidad de energía de esta pila es de alrededor de 250 Wh/kg y su coste puede llegar a ser de alrededor de 8000 /kwh, que es mucho más elevado que los alrededor de 190 /kwh de las células de Li/SOCl 2 y que los aproximadamente 50 /kwh de las pilas Leclanché, para la misma cantidad de energía almacenada. Estas pilas presentan una velocidad de autodescarga muy baja, lo cual se atribuye a la baja velocidad de difusión de los iones ioduro a través de la película de LiI, Estas células son de una elevada fiabilidad. Su elevado coste es, en parte, debido a que hay que elaborarlas muy cuidadosamente con el fin de que sean fiables para su aplicación en los marcapasos. En otro tipo de pila de electrolito sólido de aplicación en marcapasos se utiliza como material catódico SPb y la reacción global de descarga se puede escribir del siguiente modo: I.1.9.d. Pilas de litio con cátodo sólido En este tipo de sistemas el electrolito consiste en sales que contienen el catión litio (LiClO 4, AlLiCl 4, BLiF 4, AgLiF 6 ) disueltas en disolventes orgánicos, como carbonato de propileno, carbonato de etileno, amidas. Al contacto con el ánodo de litio se forma sobre este una capa pasivante que impide su corrosión y que, si la corriente extraída no es excesivamente elevada, no da lugar a una caída de tensión excesiva. Se pueden utilizar como cátodos sólidos el monofluoruro de carbono [(CF) n ], sales de cobre o plata, óxidos y sulfuros. En el caso del cátodo de monofluoruro de carbono se utiliza como electrolito una disolución de LiBF 4 en carbonato de propileno y la reacción global de descarga es la siguiente:
15 Las pilas que utilizan este sistema son de tipo botón y se usan para alimentar relojes electrónicos y calculadoras de bolsillo. Presentan tensiones nominales que varían entre 2.8 y 3.3 voltios. Entre las pilas que utilizan como cátodo sólido sales de cobre o plata la más común es aquella que hace uso del cromato de plata (Ag 2 CrO 4 ) y carbono como material catódico. El electrolito es una disolución de cromato de litio (Li 2 CrO 4 ) en carbonato de propileno y la reacción global de descarga es la siguiente: Estas pilas presentan un potencial a circuito abierto de 3.5 voltios, una baja velocidad de autodescarga (< 1% al año) y un buen comportamiento a diferentes velocidades de descarga. Se suen aplicar en marcapasos, dispositivos de protección de memorias de ordenadores y en implantes. En los elementos que utilizan cátodos sólidos elaborados a partir de óxidos se pueden distinguir las pilas de alto voltaje, hechas de MnO 2, en las que la tensión a circuito abierto es de 3 voltios, y de bajo voltaje, fabricadas a partir de CuO, en las que el voltaje a circuito abierto es de 1.5 voltios. Una de las pilas que presentan una mayor densidad de energía entre las que utilizan al litio como ánodo es la que hace uso de un cátodo sólido de CuO, la cual puede llegar a valores de la densidad de energía de 300 Wh/kg ó de 750 Wh/dm 3. Estas pilas utilizan como electrolito una disolución de perclorato de litio (LiClO 4 ) en dioxano y la reacción global de descarga es la siguiente: Estas pilas encuentran aplicación en relojes electrónicos y calculadoras de bolsillo. Las pilas de cátodo sólido de sulfuros metálicos, como SCu ó SFe presentan la ventaja de que no es preciso agregar carbón para incrementar la conductividad del material activo, puesto que estos sulfuros sulfuros muestran una buena conductividad electrónica. En la pila de SCu se utiliza como electrolito una disolución de perclorato de litio (LiClO 4 ) en dioxano y la reacción global de descarga es la siguiente: Este tipo de elementos se caracteriza por una baja velocidad de autodescarga y una elevada capacidad volumétrica, que puede ser hasta 80% superior a la del sistema acuoso Zn/HgO. I.1.9.e. Células de litio de cátodo soluble
16 En estas pilas el material catódico es el SO 2, que es soluble en disolventes orgánicos, como el acetonitrilo y que funcionan bajo presión interna, por lo que necesitan un buen sellado. En estos elementos se utiliza como electrolito una disolución de LiBr en acetonitrilo y la reacción global de descarga es la siguiente: Este tipo de pilas se caracterizan por una elevada densidad de energía (300 Wh/kg y 525 Wh/dm 3 ), una baja velocidad de descarga (2% al año), potenciales a circuito abierto del orden de 3 voltios, una capacida para funcionar a temperaturas muy bajas. Encuentran aplicaciones en instalaciones militares: misiles, radiotransmisores, equipos de visión nocturna y en sistemas de alarma y de emergencia. I.2. PILAS SECUNDARIAS O ACUMULADORES Los acumuladores son dispositivos electroquímicos en los que la energía eléctrica puede convertirse en energía química, la cual puede permanecer almacenada durante intervalos de tiempo en los que la electricidad no es necesaria. Este almacenamiento no puede ser indefinido, pues en estado de carga aparecen compuestos y elementos químicos con un contenido elevado de energía libre, los cuales tienden espontáneamente a transformarse en productos más estables, es decir, en especies químicas con un menor contenido de energía libre. Cuando, por conexión a un circuito eléctrico externo, se facilita el paso de electrones a través del mismo, se produce la transformación de productos químicos, con gran contenido de energía libre, en otros con un contenido mínimo. La presencia de los electrodos y del electrolito da lugar a que esa diferencia de energía libre se convierta, en proporción elevada, en trabajo eléctrico útil. Históricamente, la primera batería o acumulador que se empleó fue la de plomo ácido, inventada por Planté en el siglo XIX. Este dispositivo, aunque muy perfeccionado, aún sigue utilizándose masivamente en automóviles y como almacenador de la energía eléctrica producida por células fotovoltáicas o por aerogeneradores, aparte de otras muchas aplicaciones. En el momento actual, en diversos laboratorios sigue investigándose con el fin de encontrar sistemas electroquímicos que funcionen más eficazmente que las baterías de plomo, las cuales se caracterizan por poseer bajas densidades de energía y períodos de vida relativamente cortos. Otro acumulador cada vez más utilizado es el de Ni/Cd, cuya invención se produjo hacia 1900, pero que empezó a comercializarse hacia 1970 y que se utiliza para suministrar electricidad a equipos electrónicos y a vehículos eléctricos. Las baterías de litio se introdujeron en 1991 y, aunque resultan caras, la elevada densidad de energía que presentan, con relación a la de otros sistemas acumuladores, las hacen adecuadas para suministrar energía a equipos electrónicos portables. Un acumulador electroquímico se caracteriza por el voltaje de celda y por las constantes de tiempo y de corriente. Como la potencia suministrada viene dada por el producto I V (corriente multiplicada por el potencial de célula), lo más conveniente sería recurrir a formar la célula electroquímica con dos electrodos sobre los que tuviesen lugar reacciones a potenciales lo más separados entre sí que fuera posible, lo que haría máxima la diferencia termodinámica de potenciales, V, entre ambos electrodos. Asimismo, hay que tratar de encontrar electrodos que se comporten como buenos electrocatalizadores con respecto a las reacciones que se producen
17 sobre ellos. De ese modo se conseguiría que las sobretensiones necesarias para llegar a corrientes de carga o descarga elevadas, fueran pequeñas, con lo que se harían mínimas las diferencias entre el potencial termodinámico y la diferencia de potencial real a la que opera el acumulador, para un valor determinado de la corriente. La mejora de la eficiencia electrocatalítica de los electrodos implicaría una mayor eficiencia en los procesos de conversión de energía eléctrica en energía química (proceso de carga), o de energía química en energía eléctrica (proceso de descarga), lo que equivale a decir que se harían mínimas las pérdidas asociadas a los procesos de carga y descarga del acumulador. I.2.1. El acumulador de plomo-ácido La celda base de un acumulador de plomo (que está formado por seis celdas en serie o en batería, lo que explica su otra denominación de batería de plomo) está formada por dos electrodos, uno de Pb y otro de PbO 2, sumergidos en una disolución concentrada de ácido sulfúrico (aproximadamente del 25% en peso). El número de oxidación del Pb en el PbO 2 es +4, es decir, es un átomo de Pb al que se habrían restado cuatro electrones, por lo que es fácil deducir que puestos en contacto ambos tipos de materiales, los electrones del plomo metálico tenderían espontáneamente a ser transferidos al PbO 2. En realidad, el PbO 2 es un óxido metálico con características de semimetal. Presenta una conductividad metálica y, por lo tanto, su descripción electrónica se hace mejor recurriendo a la teoría de bandas. La elevada conductividad eléctrica del PbO 2 es una consecuencia de que las bandas de valencia y de conducción se encuentran solapadas. Lo mismo ocurre en el Pb, pero el nivel de Fermi en el metal (la energía media de los electrones a la temperatura de trabajo), se encuentra por encima del nivel de Fermi en el PbO 2, por lo que, al poner en contacto entre sí ambos tipos de materiales, se produce una transferencia espontánea de electrones desde el Pb hacia el PbO 2. En Electroquímica, la energía media de los electrones en los diferentes sistemas se mide por medio de los potenciales, los cuales se encuentran clasificados en una escala que toma como referencia para la medida el denominado Electrodo Standard de Hidrógeno (Standard Hydrogen Electrode). Durante el proceso de descarga del acumulador el electrodo de Pb reacciona de forma espontánea con los iones sulfato para formar sulfato de plomo, liberando en el proceso dos electrones en una reacción que puede ser representada mediante la siguiente ecuación: Pb + SO 2 4 PbSO 4 + 2e 0 (E 0 = V ESH ) El electrodo de PbO 2 presenta un potencial estándar (el potencial estándar es el medido para condiciones en que las actividades de todos los iones participantes tienen un valor unidad, las fugacidades de todas las especies en fase gaseosa valen la unidad y al sistema se le considera a una temperatura de 298 K y p = 1 atmósfera) que viene dado a continuación: PbO 2 + SO H e 0 PbSO H 2 O (E 0 = V ESH ) Aunque los potenciales de los electrodos que forman parte de una batería de Pb práctica serían ligeramente diferentes a los potenciales estándar, ya que las actividades de los iones SO 4 2 y H + en el electrolito utilizado son mayores que la unidad, puede estimarse que la
18 diferencia de potencial termodinámica (es decir, la medida en condiciones de equilibrio, a corriente nula), también llamada fuerza electromotriz, valdría, cuando se produce la descarga de la pila secundaria: E celda = E cátodo E ánodo = V ( V) = 2.04 Voltios. Como los dispositivos que se utilizan en el automóvil funcionan con una tensión de 12 voltios, se recurre a conectar seis o más células o elementos en serie, dando lugar a la formación de una batería, la cual suministra, durante su descarga, una diferencia de potencial de alrededor de 12 voltios. Debido a las sobretensiones y resistencias que es preciso superar, durante el proceso de carga de un batería es preciso suministrar una diferencia de potencial de entre 12.5 a 15 voltios. Las reacciones descritas por las Ecuaciones I.44 y I.45 son las que se producen espontáneamente en el acumulador, es decir, son las reacciones de descarga, a través de las cuales tiene lugar la conversión de la energía química, que es la diferencia en energía libre entre el producto, PbSO 4, de la reacción, y los reactivos, Pb y PbO 2 en energía eléctrica. Los electrones fluyen desde el electrodo en que se encuentran a mayor energía, el de Pb, a aquel en que encuentran orbitales libres de menor energía. Dichos orbitales son los que forman parte de la banda de conducción del PbO 2. Por lo tanto, los electrones procedentes del electrodo de Pb, una vez cerrado el circuito, se dirigen espontáneamente, a través de este (en este circuito externo se pueden intercalar lámparas, resistencias, motores, o cualquier aparato que funcione con corriente continua) hacia el electrodo de PbO 2. El potencial real que suministra la batería en descarga, siempre es menor que la diferencia de potencial termodinámica entre ambos electrodos, es decir, es menor que el potencial medido a circuito abierto, ya que, durante la descarga es preciso superar las resistencias a que se produzcan las reacciones de transferencia de carga interfaciales en las dobles capas de ambos electrodos, la resistencia que opone el electrolito al paso de la corriente y la resistencia a la transferencia de materia a través del electrolito, tal como viene indicado en la Ecuación I.3. Puede observarse que durante la descarga del acumulador de Pb se genera agua, lo que da lugar a una dilución del ácido sulfúrico, cuya concentración puede ser estimada midiendo su densidad mediante un densímetro. De esta forma se puede determinar el estado de carga de una batería de Pb. En el proceso de carga, el electrodo donde se produce la reducción, el cátodo, es el de Pb, en el que el PbSO 4 producido en el proceso de descarga, se reduce a Pb y SO 4 =, de acuerdo con la reacción: PbSO e 0 Pb + SO 4 = El electrodo en el que se produce la oxidación, el ánodo, es el electrodo de PbO 2, donde el PbSO 4 producido en el proceso de descarga, se oxida a PbO 2 y el agua a protones, de acuerdo con la reacción siguiente: PbSO H 2 O PbO 2 + SO 4 = + 4 H e 0 Ambas semireacciones transcurren en contra de la espontaneidad, a costa de consumir la energía eléctrica producida en un generador eléctrico. El proceso de carga de la batería se produce suministrando corriente continua proveniente de una dinamo o de un alternador, o de un panel fotovoltáico, a una diferencia de potencial algo
19 mayor que los 12 V del voltaje que aporta el acumulador en el proceso de descarga. El hecho de que el potencial al que se produce el proceso de carga sea mayor que el termodinámico es debido a que el exceso de potencial es necesario para suministrar las sobretensiones que permiten superar las resistencias a la transferencia de carga, al transporte de las sustancias electroactivas y la que opone el electrolito al paso de la corriente. Por lo tanto, considerando simultáneamente las resistencias sobre cada uno de los electrodos durante el proceso de carga, cuando el mismo se produce a una velocidad medida por la intensidad de corriente I, se tendría que aplicar un potencial que vendría dado por la siguiente ecuación: Durante el proceso de descarga, si el mismo se verifica a una velocidad medida por la intensidad de corriente I, el potencial real al que funcionaría la célula vendría dado por la siguiente expresión: La Figura I.11 muestra la diferencia existente entre el potencial termodinámico, es decir, el potencial que se mide a circuito abierto y el que se mediría a circuito cerrado durante los procesos de carga y descarga, realizados ambos a un ritmo impuesto por la intensidad de corriente, I, a la que ambos se producen.
20 Figura I.11. Representación gráfica de la diferencia existente entre el potencial termodinámico, es decir, el potencial que se mide a circuito abierto y el que se mediría a circuito cerrado durante los procesos de carga y descarga, realizados ambos a un ritmo impuesto por la intensidad de corriente, I, a la que ambos se producen. Puede observarse que durante la carga, verificada a una velocidad medida por I, la diferencia de potencial que hay que aplicar entre ambos electrodos es mayor que el potencial a circuito abierto. Asimismo, durante la descarga a una velocidad medida por I, la diferencia de potencial real que se obtiene es menor que E term. No se han tenido en cuenta las pérdidas energéticas debidas al transporte de materia, las cuales corresponden a la parte derecha de las curvas, porque la velocidad a la que se tienen lugar los procesos interfaciales no es suficiente aún para que influya de forma apreciable el proceso de transporte de materia. Puede observarse que durante la carga, verificada a una velocidad medida por la intensidad de corriente I, la diferencia de potencial que hay que aplicar entre ambos electrodos es mayor que el potencial a circuito abierto. Asimismo, durante la descarga a una velocidad medida por I, la diferencia de potencial real que se obtiene es menor que E term. También puede observarse en la figura que cuanto mayor sea la intensidad de corriente a la que tienen lugar los procesos de carga y descarga, mayores son las diferencias entre los valores reales de la diferencia de potencial y el potencial a circuito abierto. Estas diferencias son una medida de la irreversibilidad de los procesos de transferencia de carga, migración iónica y transferencia deb materia. Dicha irreversibilidad aumenta al incrementar la velocidad a la que dichos procesos tienen lugar y viene a ser una medida del coste energético exigido por el segundo principio de la Termodinámica. Aplicando una diferencia de potencial mayor que la termodinámica las reacciones descritas por las Ecuaciones I.44 y I.45 son inducidas a producirse en contra de la espontaneidad, es decir, el PbSO 4 se reduce a Pb e iones sulfato y, por lo tanto, en la fase de carga el electrodo de Pb es el cátodo. En el otro electrodo, el Pb ++ que forma parte del PbSO 4 es oxidado a Pb 4+, regenerando el PbO 2. Consiguientemente, este electrodo es el ánodo en el proceso de carga. Obsérvese que el producto de la descarga en ambos electrodos es el PbSO 4. Este compuesto es un sólido no conductor, cuya transformación en Pb 4+ y en Pb tiene que ser facilitada, recurriendo a que este producto quede formando pequeñas partículas. Para ello, y para aumentar la superficie electródica, es decir, el área del electrocatalizador y, por lo tanto, la corriente que se puede extraer, se recurre a utilizar polvo de Pb y de PbO 2 aglomerados y presionados sobre una rejilla de Pb metálico que actúa como soporte. Precisamente, en la pérdida de material electródico y en la formación de aglomerados mayores del material aislante PbSO 4, que dejan de ser sensibles a oxidaciones o reducciones, se basa una de las causas limitantes de la vida de una batería de Pb. Para que las reacciones sobre los electrodos tengan lugar con mayor facilidad se agregan a dichos aglomerados diferentes aditivos, cuya presencia contribuye a incrementar la porosidad de lo mismos. Por otra parte, los aditivos también evitan que se formen grandes cristales de PbSO 4, proceso al que se denomina sulfatación de la batería, para cuya redisolución y conversión en Pb y PbO 2 habría que aplicar sobretensiones elevadas, ya que la sobretensión asociada a los procesos de cristalización y redisolución de los cristales son muy elevadas en este proceso. En la práctica, esta sulfatación de la batería se manifiesta en una mayor dificultad del proceso de carga, ya que, en este estado, se produce con facilidad la reacción de desarrollo de hidrógeno por reducción de los iones H + sobre los cristales, lo que conduce a la formación de hidrógeno molecular, en lugar de lograr la reducción de los iones Pb 2+ a Pb, que es lo que se pretende en el proceso de carga. Otro problema que hay que tratar de evitar es que se formen depósitos de plomo en forma de largas agujas, las cuales pueden llegar a perforar las pilas individuales que forman la batería, lo que puede dar lugar a cortocircuitos entre ánodo y cátodo. A este proceso
21 se le denomina perforación de los vasos. Esta dificultad se supera separando ambos electrodos mediante un separador poroso. Una cuestión interesante es considerar que Planté tuvo la fortuna de llegar, por vía puramente empírica, a dar con un sistema en que la reacción competitiva con la de descarga, que es la de desarrollo de hidrógeno sobre el electrodo de Pb, era muy lenta. El Pb se encuentra en contacto con protones en disolución. El nivel de Fermi del Pb se encuentran ev por encima de los niveles aceptores de los protones, por lo que, de modo espontáneo se pone en marcha la siguiente reacción: Pb + 2 H 3 O + Pb ++ + H H 2 O Afortunadamente para que el hecho de que el almacenamiento de energía sea duradero, el Pb es muy mal electrocatalizador con respecto a esta reacción. Esto quiere decir que las transferencias de carga interfaciales encuentran una resistencia elevada para producirse, probablemente debido a la dificultad que existe para que se pueda producir el proceso de adsorción de átomos de hidrógeno sobre la superficie del plomo, lo que da lugar a que la reacción global se produzca muy lentamente. Sin embargo, lenta pero inexorablemente, si la batería no se recarga durante un período prolongado de tiempo, la reacción anterior tendrá lugar y la batería perderá la energía libre cargada, como consecuencia de que dicha reacción, aunque lentamente, se producirá. La Figura I.12 muestra un esquema de las reacciones que tienen lugar durante los procesos de carga y descarga del acumulador de plomo junto a las curvas corrientepotencial, características de las diversas reacciones de transferencia de carga que se producen en las interfases de ambos electrodos. Puede observarse en la parte (b) de la figura que para que se produzca la reacción de electrolisis del agua, que compite con los procesos de carga y descarga del acumulador, a una velocidad suficientemente elevada, tendría que actuar una diferencia de potencial mucho mayor que la termodinámica (que se representa por V R en la figura). No obstante, la reacción de electrolisis del agua terminaría por descargar el acumulador si se deja mucho tiempo sin recargar. En ocasiones, debido a que el plomo es demasiado blando, se procede a alearlo con antimonio, con el fin de que el sistema tenga una estructura menos deformable y sea más adecuada para soportar las tensiones mecánicas a las que se producen durante transporte. Desafortunadamente, la aleación Pb/Sb es mejor catalizador de la reacción de desarrollo de hidrógeno, por lo que la reacción de autodescarga descrita por la Ecuación I.49 procede con mayor rapidez. Otra reacción de autodescarga que hay que tener en cuenta cuando se utiliza una aleación con antimonio es la que se produce de acuerdo con la siguiente ecuación: 5 PbO Sb + 6 H 2 SO 4 (SbO 2 ) 2 SO PbSO H 2 O Esta reacción, aunque procede de forma lenta, da lugar a la eliminación de parte del material electródico, lo que contribuye a hacer no deseable el uso de la aleación del plomo con el antimonio como electrodo.
22 En otras ocasiones se introduce Ca en el retículo del Pb, con el que forma una aleación sobre la que la descarga de hidrógeno se produce con gran lentitud, lo que prolonga el período durante el que la batería puede mantenerse cargada. También el PbO 2 es capaz de oxidar al agua a O 2 de acuerdo con la siguiente reacción: 6 H 2 O O H 3 O e 0 E 0 ESH = V ESH Puede observarse que el potencial estándar para la reacción I.52 es V ESH, lo que indica que el electrodo de PbO 2, con un potencial standard de V, es capaz de oxidar al agua, es decir, es capaz de inducir a que la reacción anterior tenga lugar en sentido inverso) y, además, es un electrocatalizador moderadamente bueno para la misma. Esto quiere decir que la reacción de desarrollo de oxígeno se produciría a mayor velocidad que la de desarrollo de hidrógeno, si ambos electrodos fueran independientes entre sí. Formando una célula global, lo que se produciría sería la electrolisis del agua y ello tendría lugar a la velocidad que impusiese la etapa más lenta, que es la de producción de hidrógeno (para el caso del electrodo de Pb). En realidad, la reacción de autodescarga del electrodo de PbO 2, se produce de acuerdo con la siguiente reacción: PbO 2 + H 2 SO 4 PbSO 4 + H 2 O + ½ O 2 También se produce una reacción entre el PbO 2 y el Pb de las rejillas donde va insertado el óxido, la cual da lugar a la corrosión de las rejillas, sobre todo cuando las baterías no se utilizan durante largo tiempo. Esta reacción es la siguiente: PbO 2 + Pb + 2 H 2 SO 4 2 PbSO H 2 O La reacción global de celda en un acumulador de Pb se obtiene sumando miembro a miembro las Ecuaciones I.44 y I.45, lo que lleva a la ecuación siguiente para la reacción global: ) Pb + PbO SO H + 2 PbSO H 2 O Esta reacción se produce de izquierda a derecha durante el proceso de descarga, es decir el proceso de transformación de energía química en energía eléctrica y a la inversa durante el proceso de carga, en que se produce la transformación de energía eléctrica en energía química.
TEMA 2. CIRCUITOS ELÉCTRICOS.
 TEMA 2. CIRCUITOS ELÉCTRICOS. 1. INTRODUCCIÓN. A lo largo del presente tema vamos a estudiar los circuitos eléctricos, para lo cual es necesario recordar una serie de conceptos previos tales como la estructura
TEMA 2. CIRCUITOS ELÉCTRICOS. 1. INTRODUCCIÓN. A lo largo del presente tema vamos a estudiar los circuitos eléctricos, para lo cual es necesario recordar una serie de conceptos previos tales como la estructura
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016
 REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016 1- Se lleva a cabo la electrolisis de una disolución acuosa de bromuro de sodio 1 M, haciendo pasar una corriente de 1,5 A durante 90 minutos. a) Ajuste
REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016 1- Se lleva a cabo la electrolisis de una disolución acuosa de bromuro de sodio 1 M, haciendo pasar una corriente de 1,5 A durante 90 minutos. a) Ajuste
Generador Solar de Energía Eléctrica a 200W CAPÍTULO V. Planteamiento del problema, parámetros y diseño fotovoltaico
 CAPÍTULO V Planteamiento del problema, parámetros y diseño fotovoltaico 5.1 Objetivo general El objetivo general de esta tesis es generar energía eléctrica por medio de la luz solar, con la finalidad de
CAPÍTULO V Planteamiento del problema, parámetros y diseño fotovoltaico 5.1 Objetivo general El objetivo general de esta tesis es generar energía eléctrica por medio de la luz solar, con la finalidad de
Curso de hidrógeno y pilas de combustible. 11ª edición TEST Modulo 3
 TEST MODULO 3 1. Qué componente de las pilas de polímeros es polimérico? a) La membrana que actúa como electrolito. b) Los catalizadores que favorecen la reacción. c) Todos los que forman la MEA de 5 capas.
TEST MODULO 3 1. Qué componente de las pilas de polímeros es polimérico? a) La membrana que actúa como electrolito. b) Los catalizadores que favorecen la reacción. c) Todos los que forman la MEA de 5 capas.
FISICA Y QUÍMICA 4º ESO 1.- TRABAJO MECÁNICO.
 1.- TRABAJO MECÁNICO. Si a alguien que sostiene un objeto sin moverse le preguntas si hace trabajo, probablemente te responderá que sí. Sin embargo, desde el punto de vista de la Física, no realiza trabajo;
1.- TRABAJO MECÁNICO. Si a alguien que sostiene un objeto sin moverse le preguntas si hace trabajo, probablemente te responderá que sí. Sin embargo, desde el punto de vista de la Física, no realiza trabajo;
ELECTRICIDAD Secundaria
 ELECTRICIDAD Secundaria Carga eléctrica. Los átomos que constituyen la materia están formados por otras partículas todavía más pequeñas, llamadas protones, neutrones y electrones. Los protones y los electrones
ELECTRICIDAD Secundaria Carga eléctrica. Los átomos que constituyen la materia están formados por otras partículas todavía más pequeñas, llamadas protones, neutrones y electrones. Los protones y los electrones
Temas de electricidad II
 Temas de electricidad II CAMBIANDO MATERIALES Ahora volvemos al circuito patrón ya usado. Tal como se indica en la figura, conecte un hilo de cobre y luego uno de níquel-cromo. Qué ocurre con el brillo
Temas de electricidad II CAMBIANDO MATERIALES Ahora volvemos al circuito patrón ya usado. Tal como se indica en la figura, conecte un hilo de cobre y luego uno de níquel-cromo. Qué ocurre con el brillo
1El fuego y el calor. S u m a r i o. 1.1. El tetraedro del fuego. 1.2. Reacciones químicas. 1.3. Transmisión del calor
 1El fuego y el calor S u m a r i o 1.1. El tetraedro del fuego 1.2. Reacciones químicas 1.3. Transmisión del calor INVESTIGACIÓN DE INCENDIOS EN VEHÍCULOS 5 Capítulo 1 Desde el punto de vista de la investigación
1El fuego y el calor S u m a r i o 1.1. El tetraedro del fuego 1.2. Reacciones químicas 1.3. Transmisión del calor INVESTIGACIÓN DE INCENDIOS EN VEHÍCULOS 5 Capítulo 1 Desde el punto de vista de la investigación
Polo positivo: mayor potencial. Polo negativo: menor potencial
 CORRIENTE ELÉCTRICA Es el flujo de carga a través de un conductor Aunque son los electrones los responsables de la corriente eléctrica, está establecido el tomar la dirección de la corriente eléctrica
CORRIENTE ELÉCTRICA Es el flujo de carga a través de un conductor Aunque son los electrones los responsables de la corriente eléctrica, está establecido el tomar la dirección de la corriente eléctrica
ELECTRICIDAD BÁSICA EN REPARACIÓN DE AUTOMÓVILES
 ELECTRICIDAD BÁSICA EN REPARACIÓN DE AUTOMÓVILES 1) CONCEPTOS BÁSICOS DE ELECTRICIDAD 1.1 TEORÍA ELECTRÓNICA Los físicos distinguen cuatro diferentes tipos de fuerzas que son comunes en todo el Universo.
ELECTRICIDAD BÁSICA EN REPARACIÓN DE AUTOMÓVILES 1) CONCEPTOS BÁSICOS DE ELECTRICIDAD 1.1 TEORÍA ELECTRÓNICA Los físicos distinguen cuatro diferentes tipos de fuerzas que son comunes en todo el Universo.
Actividad V.53 Transiciones de fases Calor latente de transformación
 Actividad V.53 Transiciones de fases Calor latente de transformación Objetivo Estudio de transiciones de fase líquido vapor y sólido líquido. Medición de los calores latentes de evaporación y de fusión
Actividad V.53 Transiciones de fases Calor latente de transformación Objetivo Estudio de transiciones de fase líquido vapor y sólido líquido. Medición de los calores latentes de evaporación y de fusión
PROBLEMAS QUÍMICA 2º BACHILLERATO
 PROBLEMAS QUÍMICA 2º BACHILLERATO ELECTRÓLISIS 1. A través de una cuba electrolítica que contiene una disolución de nitrato de cobalto (II) pasa una corriente eléctrica durante 30 minutos, depositándose
PROBLEMAS QUÍMICA 2º BACHILLERATO ELECTRÓLISIS 1. A través de una cuba electrolítica que contiene una disolución de nitrato de cobalto (II) pasa una corriente eléctrica durante 30 minutos, depositándose
ELECTROQUÍMICA CIENCIA Y TECNOLOGÍA
 ELECTROQUÍMICA CIENCIA Y TECNOLOGÍA ASIGNATURA CONVERSIÓN Y ALMACENAMIENTO ELECTROQUÍMICO DE ENERGIA Pilar Ocón Esteban 1 PROGRAMA Tema 1. Introducción general al problema de la energía 1.1 Introducción,
ELECTROQUÍMICA CIENCIA Y TECNOLOGÍA ASIGNATURA CONVERSIÓN Y ALMACENAMIENTO ELECTROQUÍMICO DE ENERGIA Pilar Ocón Esteban 1 PROGRAMA Tema 1. Introducción general al problema de la energía 1.1 Introducción,
CALENTAMIENTO DE AGUA CALIENTE SANITARIA
 CALENTAMIENTO DE AGUA CALIENTE SANITARIA De todas las formas de captación térmica de la energía solar, las que han adquirido un desarrollo comercial en España han sido los sistemas para su utilización
CALENTAMIENTO DE AGUA CALIENTE SANITARIA De todas las formas de captación térmica de la energía solar, las que han adquirido un desarrollo comercial en España han sido los sistemas para su utilización
REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis) 1 2 Electrólisis Aplicando una f.e.m. adecuada se puede conseguir que tenga lugar una reacción redox en el sentido que no es espontánea. En una
REACCIONES DE TRANSFERENCIA DE ELECTRONES (electrolisis) 1 2 Electrólisis Aplicando una f.e.m. adecuada se puede conseguir que tenga lugar una reacción redox en el sentido que no es espontánea. En una
PEMFC Pila de combustible de membrana polimérica. Protón Exchange Membrane Fuel Cell
 PEMFC Pila de combustible de membrana polimérica Protón Exchange Membrane Fuel Cell A finales de los años cincuenta Leonard Niedrach y Tom Grubb idearon un sistema de pila de combustible utilizando una
PEMFC Pila de combustible de membrana polimérica Protón Exchange Membrane Fuel Cell A finales de los años cincuenta Leonard Niedrach y Tom Grubb idearon un sistema de pila de combustible utilizando una
Solubilidad. y se representa por.
 Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
CAPÍTULO 4. DISEÑO CONCEPTUAL Y DE CONFIGURACIÓN. Figura 4.1.Caja Negra. Generar. Sistema de control. Acumular. Figura 4.2. Diagrama de funciones
 CAPÍTULO 4 37 CAPÍTULO 4. DISEÑO CONCEPTUAL Y DE CONFIGURACIÓN Para diseñar el SGE, lo primero que se necesita es plantear diferentes formas en las que se pueda resolver el problema para finalmente decidir
CAPÍTULO 4 37 CAPÍTULO 4. DISEÑO CONCEPTUAL Y DE CONFIGURACIÓN Para diseñar el SGE, lo primero que se necesita es plantear diferentes formas en las que se pueda resolver el problema para finalmente decidir
En la 3ª entrega de este trabajo nos centraremos en la relación entre magnitudes eléctricas, hecho que explica la famosa Ley de Ohm.
 3º parte En la 3ª entrega de este trabajo nos centraremos en la relación entre magnitudes eléctricas, hecho que explica la famosa Ley de Ohm. ELEMENTOS DEL CIRCUITO ELÉCTRICO Para poder relacionar las
3º parte En la 3ª entrega de este trabajo nos centraremos en la relación entre magnitudes eléctricas, hecho que explica la famosa Ley de Ohm. ELEMENTOS DEL CIRCUITO ELÉCTRICO Para poder relacionar las
35 Facultad de Ciencias Universidad de Los Andes Mérida-Venezuela. Potencial Eléctrico
 q 1 q 2 Prof. Félix Aguirre 35 Energía Electrostática Potencial Eléctrico La interacción electrostática es representada muy bien a través de la ley de Coulomb, esto es: mediante fuerzas. Existen, sin embargo,
q 1 q 2 Prof. Félix Aguirre 35 Energía Electrostática Potencial Eléctrico La interacción electrostática es representada muy bien a través de la ley de Coulomb, esto es: mediante fuerzas. Existen, sin embargo,
P9: ENSAYO DE VACÍO Y CORTOCIRCUITO DEL TRANSFORMADOR MONOFÁSICO FUNDAMENTOS DE TECNOLOGÍA ELÉCTRICA
 ESCUELA UNIVERSITARIA DE INGENIERÍA TÉCNICA INDUSTRIAL (BILBAO) Departamento de Ingeniería Eléctrica INDUSTRI INGENIARITZA TEKNIKORAKO UNIBERTSITATE-ESKOLA (BILBO) Ingeniaritza Elektriko Saila ALUMNO P9:
ESCUELA UNIVERSITARIA DE INGENIERÍA TÉCNICA INDUSTRIAL (BILBAO) Departamento de Ingeniería Eléctrica INDUSTRI INGENIARITZA TEKNIKORAKO UNIBERTSITATE-ESKOLA (BILBO) Ingeniaritza Elektriko Saila ALUMNO P9:
9.1 DIELÉCTRICOS 9.1.1 QUÉ SON LOS DIELÉCTRICOS? 9.1.2 RIGIDEZ DIELÉCTRICA
 9 DIELÉCTRICOS 9.1 DIELÉCTRICOS 9.1.1 QUÉ SON LOS DIELÉCTRICOS? Los dieléctricos son materiales, generalmente no metálicos, con una alta resistividad, por lo que la circulación de corriente a través de
9 DIELÉCTRICOS 9.1 DIELÉCTRICOS 9.1.1 QUÉ SON LOS DIELÉCTRICOS? Los dieléctricos son materiales, generalmente no metálicos, con una alta resistividad, por lo que la circulación de corriente a través de
ELECTRÓLISIS. Electrólisis de sales fundidas
 El proceso por el cual se produce una reacción química a partir de una energía eléctrica se denomina electrólisis. Y se lleva a cabo en un dispositivo que se conoce como cuba o celda electrolítica. Este
El proceso por el cual se produce una reacción química a partir de una energía eléctrica se denomina electrólisis. Y se lleva a cabo en un dispositivo que se conoce como cuba o celda electrolítica. Este
TEMA 4: ELECTRICIDAD
 TEMA 4: ELECTRICIDAD 1. Origen de los fenómenos eléctricos 2. La corriente eléctrica a. Corriente continua b. Corriente alterna 3. Elementos de un circuito a. Generadores b. Receptores c. Conductores d.
TEMA 4: ELECTRICIDAD 1. Origen de los fenómenos eléctricos 2. La corriente eléctrica a. Corriente continua b. Corriente alterna 3. Elementos de un circuito a. Generadores b. Receptores c. Conductores d.
Componentes: RESISTENCIAS FIJAS
 ELECTRÓNICA ELECTRÓNICA Componentes: RESISTENCIAS FIJAS Componentes: RESISTENCIAS VARIABLES Componentes: RESISTENCIAS DEPENDIENTES Componentes: RESISTENCIAS DEPENDIENTES Componentes: CONDENSADORES Componentes:
ELECTRÓNICA ELECTRÓNICA Componentes: RESISTENCIAS FIJAS Componentes: RESISTENCIAS VARIABLES Componentes: RESISTENCIAS DEPENDIENTES Componentes: RESISTENCIAS DEPENDIENTES Componentes: CONDENSADORES Componentes:
ELECTROQUIMICA CELDAS GALVANICAS, ELECTROLISIS Y ELECTROQUIMICA APLICADA
 ELECTROQUIMICA CELDAS GALVANICAS, ELECTROLISIS Y ELECTROQUIMICA APLICADA QUE ES LA ELECTROQUIMICA? Es la parte de la química que se encarga del estudio de las relaciones cualitativas y cuantitativas existentes
ELECTROQUIMICA CELDAS GALVANICAS, ELECTROLISIS Y ELECTROQUIMICA APLICADA QUE ES LA ELECTROQUIMICA? Es la parte de la química que se encarga del estudio de las relaciones cualitativas y cuantitativas existentes
Seminario de Electricidad Básica
 Seminario de Electricidad Básica Qué es la Electricidad? Es una forma de energía natural que puede ser producida artificialmente y que se caracteriza por su poder de transformación; ya que se puede convertir
Seminario de Electricidad Básica Qué es la Electricidad? Es una forma de energía natural que puede ser producida artificialmente y que se caracteriza por su poder de transformación; ya que se puede convertir
TEMA 4 CONDENSADORES
 TEMA 4 CONDENSADORES CONDENSADORES Un condensador es un componente que tiene la capacidad de almacenar cargas eléctricas y suministrarlas en un momento apropiado durante un espacio de tiempo muy corto.
TEMA 4 CONDENSADORES CONDENSADORES Un condensador es un componente que tiene la capacidad de almacenar cargas eléctricas y suministrarlas en un momento apropiado durante un espacio de tiempo muy corto.
LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO
 LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO 1. Trabajo mecánico y energía. El trabajo, tal y como se define físicamente, es una magnitud diferente de lo que se entiende sensorialmente por trabajo. Trabajo
LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO 1. Trabajo mecánico y energía. El trabajo, tal y como se define físicamente, es una magnitud diferente de lo que se entiende sensorialmente por trabajo. Trabajo
Introducción ELECTROTECNIA
 Introducción Podríamos definir la Electrotecnia como la técnica de la electricidad ; desde esta perspectiva la Electrotecnia abarca un extenso campo que puede comprender desde la producción, transporte,
Introducción Podríamos definir la Electrotecnia como la técnica de la electricidad ; desde esta perspectiva la Electrotecnia abarca un extenso campo que puede comprender desde la producción, transporte,
Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción. Ajuste de reacciones de oxidación-reducción.
 Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción Concepto de oxidación-reducción Número de oxidación Ajuste de reacciones de oxidación-reducción. Estequiometría Electroquímica
Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción Concepto de oxidación-reducción Número de oxidación Ajuste de reacciones de oxidación-reducción. Estequiometría Electroquímica
 Diapositiva 1 Para presentar los semiconductores, es útil empezar revisando los conductores. Hay dos perspectivas desde las que se puede explorar la conducción: 1) podemos centrarnos en los dispositivos
Diapositiva 1 Para presentar los semiconductores, es útil empezar revisando los conductores. Hay dos perspectivas desde las que se puede explorar la conducción: 1) podemos centrarnos en los dispositivos
Unidad Didáctica. Transformadores Trifásicos
 Unidad Didáctica Transformadores Trifásicos Programa de Formación Abierta y Flexible Obra colectiva de FONDO FORMACION Coordinación Diseño y maquetación Servicio de Producción Didáctica de FONDO FORMACION
Unidad Didáctica Transformadores Trifásicos Programa de Formación Abierta y Flexible Obra colectiva de FONDO FORMACION Coordinación Diseño y maquetación Servicio de Producción Didáctica de FONDO FORMACION
COMPENSACIÓN DE ENERGÍA REACTIVA CAPÍTULO XX
 COMPENSACIÓN DE ENERGÍA REACTIVA CAPÍTULO XX I N D I C E 1.- Disposiciones Reglamentarias con respecto a la Corrección de Energía Reactiva.Generalidades.... 1 2.- Sobrecompensación de Energía Reactiva....
COMPENSACIÓN DE ENERGÍA REACTIVA CAPÍTULO XX I N D I C E 1.- Disposiciones Reglamentarias con respecto a la Corrección de Energía Reactiva.Generalidades.... 1 2.- Sobrecompensación de Energía Reactiva....
Corriente continua y corriente alterna
 Electricidad ENTREGA 1 Corriente continua y corriente alterna Elaborado por Jonathan Caballero La corriente o intensidad eléctrica es el flujo de carga por unidad de tiempo que recorre un material. Se
Electricidad ENTREGA 1 Corriente continua y corriente alterna Elaborado por Jonathan Caballero La corriente o intensidad eléctrica es el flujo de carga por unidad de tiempo que recorre un material. Se
LA ENERGÍA. La energía es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza.
 Objetivos: Unidad II: La energía Conocer qué es la energía Distinguir las distintas formas de energía Comprender las transformaciones de la energía Distinguir entre conservación y degradación de la energía
Objetivos: Unidad II: La energía Conocer qué es la energía Distinguir las distintas formas de energía Comprender las transformaciones de la energía Distinguir entre conservación y degradación de la energía
TRANSFORMADORES EN PARALELO
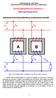 UNIVERIDD DE CNTRI TRNFORMDORE EN PRLELO Miguel ngel Rodríguez Pozueta Condiciones para que varios transformadores se puedan conectar en paralelo Fig. 0: Dos transformadores monofásicos ( y ) conectados
UNIVERIDD DE CNTRI TRNFORMDORE EN PRLELO Miguel ngel Rodríguez Pozueta Condiciones para que varios transformadores se puedan conectar en paralelo Fig. 0: Dos transformadores monofásicos ( y ) conectados
INTRODUCCION AL CONTROL AUTOMATICO DE PROCESOS
 INTRODUCCION AL CONTROL AUTOMATICO DE PROCESOS El control automático de procesos es parte del progreso industrial desarrollado durante lo que ahora se conoce como la segunda revolución industrial. El uso
INTRODUCCION AL CONTROL AUTOMATICO DE PROCESOS El control automático de procesos es parte del progreso industrial desarrollado durante lo que ahora se conoce como la segunda revolución industrial. El uso
Automatismos eléctricos
 Automatismos eléctricos Circuito de Mando: representa el circuito auxiliar de control. Compuesto de : Contactos auxiliares de mando y protección Circuitos y componentes de regulación y control Equipos
Automatismos eléctricos Circuito de Mando: representa el circuito auxiliar de control. Compuesto de : Contactos auxiliares de mando y protección Circuitos y componentes de regulación y control Equipos
INTERCAMBIADORES DE CALOR. Mg. Amancio R. Rojas Flores
 INTERCAMBIADORES DE CALOR Mg. Amancio R. Rojas Flores INTRODUCCIÓN Los intercambiadores de calor son aparatos que facilitan el intercambio de calor entre dos fluidos que se encuentran a temperaturas diferentes
INTERCAMBIADORES DE CALOR Mg. Amancio R. Rojas Flores INTRODUCCIÓN Los intercambiadores de calor son aparatos que facilitan el intercambio de calor entre dos fluidos que se encuentran a temperaturas diferentes
Contenidos Didácticos
 INDICE --------------------------------------------------------------------------------------------------------------------------------------------- 1 FUERZA...3 2 TRABAJO...5 3 POTENCIA...6 4 ENERGÍA...7
INDICE --------------------------------------------------------------------------------------------------------------------------------------------- 1 FUERZA...3 2 TRABAJO...5 3 POTENCIA...6 4 ENERGÍA...7
III. DIFUSION EN SOLIDOS
 Metalografía y Tratamientos Térmicos III - 1 - III. DIFUSION EN SOLIDOS III.1. Velocidad de procesos en sólidos Muchos procesos de producción y aplicaciones en materiales de ingeniería están relacionados
Metalografía y Tratamientos Térmicos III - 1 - III. DIFUSION EN SOLIDOS III.1. Velocidad de procesos en sólidos Muchos procesos de producción y aplicaciones en materiales de ingeniería están relacionados
Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: LA ENERGÍA Y SU TRANSFORMACIÓN. PRODUCCIÓN DE ENERGÍA ELÉCTRICA
 TEMA 1: LA ENERGÍA Y SU TRANSFORMACIÓN. PRODUCCIÓN DE ENERGÍA ELÉCTRICA 1.- Concepto de energía y sus unidades: La energía E es la capacidad de producir trabajo. Y trabajo W es cuando al aplicar una fuerza
TEMA 1: LA ENERGÍA Y SU TRANSFORMACIÓN. PRODUCCIÓN DE ENERGÍA ELÉCTRICA 1.- Concepto de energía y sus unidades: La energía E es la capacidad de producir trabajo. Y trabajo W es cuando al aplicar una fuerza
TEMA V TEORÍA DE CUADRIPOLOS LINEALES. 5.1.-Introducción. 5.2.-Parámetros de Impedancia a circuito abierto.
 TEMA V TEORÍA DE CUADRIPOLOS LINEALES 5.1.-Introducción. 5.2.-Parámetros de Impedancia a circuito abierto. 5.3.-Parámetros de Admitancia a cortocircuito. 5.4.-Parámetros Híbridos (h, g). 5.5.-Parámetros
TEMA V TEORÍA DE CUADRIPOLOS LINEALES 5.1.-Introducción. 5.2.-Parámetros de Impedancia a circuito abierto. 5.3.-Parámetros de Admitancia a cortocircuito. 5.4.-Parámetros Híbridos (h, g). 5.5.-Parámetros
UIT-T L.4 SECTOR DE NORMALIZACIÓN DE LAS TELECOMUNICACIONES DE LA UIT
 UNIÓN INTERNACIONAL DE TELECOMUNICACIONES UIT-T L.4 SECTOR DE NORMALIZACIÓN DE LAS TELECOMUNICACIONES DE LA UIT CONSTRUCCIÓN, INSTALACIÓN Y PROTECCIÓN DE LOS CABLES Y OTROS ELEMENTOS DE PLANTA EXTERIOR
UNIÓN INTERNACIONAL DE TELECOMUNICACIONES UIT-T L.4 SECTOR DE NORMALIZACIÓN DE LAS TELECOMUNICACIONES DE LA UIT CONSTRUCCIÓN, INSTALACIÓN Y PROTECCIÓN DE LOS CABLES Y OTROS ELEMENTOS DE PLANTA EXTERIOR
ELECTROQUÍMICA. químicas que se producen por acción de una corriente eléctrica.
 ELECTROQUÍMICA La electroquímica estudia los cambios químicos que producen una corriente eléctrica y la generación de electricidad mediante reacciones químicas. Es por ello, que el campo de la electroquímica
ELECTROQUÍMICA La electroquímica estudia los cambios químicos que producen una corriente eléctrica y la generación de electricidad mediante reacciones químicas. Es por ello, que el campo de la electroquímica
Instalaciones Aisladas de la Red
 Energía Solar Fotovoltaica El método más sencillo para la captación solar es el de la conversión fotovoltaica, que consiste en convertir la energía solar en energía eléctrica por medio de células solares.
Energía Solar Fotovoltaica El método más sencillo para la captación solar es el de la conversión fotovoltaica, que consiste en convertir la energía solar en energía eléctrica por medio de células solares.
1 cal = 4,18 J. 1 kwh = 1000 Wh = 1000 W 3600 s/h = 3600 1000 J = 3 6 10 6 J
 Energía Se define la energía, como la capacidad para realizar un cambio en forma de trabajo. Se mide en el sistema internacional en Julios (J), que se define como el trabajo que realiza una fuerza de 1N
Energía Se define la energía, como la capacidad para realizar un cambio en forma de trabajo. Se mide en el sistema internacional en Julios (J), que se define como el trabajo que realiza una fuerza de 1N
Las sustancias puras son los elementos y los compuestos.
 Las sustancias puras son los elementos y los compuestos. Un elemento es una sustancia pura porque todas las partículas que lo forman son iguales y tiene unas propiedades características. Ejemplo: el oxígeno,
Las sustancias puras son los elementos y los compuestos. Un elemento es una sustancia pura porque todas las partículas que lo forman son iguales y tiene unas propiedades características. Ejemplo: el oxígeno,
Conceptos y determinaciones aplicables a transformadores de intensidad
 Definiciones: Error de Calibración de un instrumento o Error de Clase: es el mayor error absoluto que acusa un instrumento en algún punto de la escala Cuando este error se expresa referido al máximo valor
Definiciones: Error de Calibración de un instrumento o Error de Clase: es el mayor error absoluto que acusa un instrumento en algún punto de la escala Cuando este error se expresa referido al máximo valor
Conceptos generales de una instalación fotovoltaica aislada
 CAPÍTULO 1 Conceptos generales de una instalación fotovoltaica aislada 1.1 Introducción Antes de proceder a los cálculos de una instalación solar aislada, se ha incluido este capítulo con la intención
CAPÍTULO 1 Conceptos generales de una instalación fotovoltaica aislada 1.1 Introducción Antes de proceder a los cálculos de una instalación solar aislada, se ha incluido este capítulo con la intención
LA IMPORTANCIA DE CONTROLAR LAS PÉRDIDAS DE ENERGÍA EN LAS EMPRESAS DISTRIBUIDORAS
 LA IMPORTANCIA DE CONTROLAR LAS PÉRDIDAS DE ENERGÍA EN LAS EMPRESAS DISTRIBUIDORAS Objetivo El presente informe se ha escrito con la finalidad de establecer un marco objetivo como punto de partida para
LA IMPORTANCIA DE CONTROLAR LAS PÉRDIDAS DE ENERGÍA EN LAS EMPRESAS DISTRIBUIDORAS Objetivo El presente informe se ha escrito con la finalidad de establecer un marco objetivo como punto de partida para
Física Nuclear y Reacciones Nucleares
 Slide 1 / 34 Física Nuclear y Reacciones Nucleares Slide 2 / 34 Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa de un neutrón
Slide 1 / 34 Física Nuclear y Reacciones Nucleares Slide 2 / 34 Protón: La carga de un protón es 1,6 x10-19 C. La masa de un protón es 1,6726x10-27 kg. Neutrones: El neutrón es neutro. La masa de un neutrón
INFORME. Dirección de Negocio Regulado 1. DESCRIPCIÓN DEL PROBLEMA
 INFORME ORGANISMO EMISOR: IBERDROLA DISTRIBUCIÓN, S.A.U. PROTECCIONES Y ASISTENCIA TÉCNICA REFERENCIA: SPFV HOJA 1 de 11 Dirección de Negocio Regulado 1. DESCRIPCIÓN DEL PROBLEMA En pruebas de desconexión
INFORME ORGANISMO EMISOR: IBERDROLA DISTRIBUCIÓN, S.A.U. PROTECCIONES Y ASISTENCIA TÉCNICA REFERENCIA: SPFV HOJA 1 de 11 Dirección de Negocio Regulado 1. DESCRIPCIÓN DEL PROBLEMA En pruebas de desconexión
Índice 1 NOCIONES BÁSICAS DE FUNCIONAMIENTO 2 COMPONENTES DE UNA INSTALACIÓN SOLAR FOTOVOLTAICA 3 TIPO DE INSTALACIONES
 Funcionamiento general de una instalación solar fotovoltaica. Índice 1 NOCIONES BÁSICAS DE FUNCIONAMIENTO 2 COMPONENTES DE UNA INSTALACIÓN SOLAR FOTOVOLTAICA 3 TIPO DE INSTALACIONES 1-.Nociones básicas
Funcionamiento general de una instalación solar fotovoltaica. Índice 1 NOCIONES BÁSICAS DE FUNCIONAMIENTO 2 COMPONENTES DE UNA INSTALACIÓN SOLAR FOTOVOLTAICA 3 TIPO DE INSTALACIONES 1-.Nociones básicas
2. Electrónica. 2.1. Conductores y Aislantes. Conductores.
 2. Electrónica. 2.1. Conductores y Aislantes. Conductores. Se produce una corriente eléctrica cuando los electrones libres se mueven a partir de un átomo al siguiente. Los materiales que permiten que muchos
2. Electrónica. 2.1. Conductores y Aislantes. Conductores. Se produce una corriente eléctrica cuando los electrones libres se mueven a partir de un átomo al siguiente. Los materiales que permiten que muchos
Cómo Reducir la Factura de Energía Eléctrica Corrigiendo el Factor de Potencia
 Cómo Reducir la Factura de Energía Eléctrica Corrigiendo el Factor de Potencia Por Ing. José Luís Ola García ( 1 ) RESUMEN El elevado consumo de la Potencia Reactiva (aumento de la necesidad de magnetizar
Cómo Reducir la Factura de Energía Eléctrica Corrigiendo el Factor de Potencia Por Ing. José Luís Ola García ( 1 ) RESUMEN El elevado consumo de la Potencia Reactiva (aumento de la necesidad de magnetizar
TEMA 9 Cicloconvertidores
 TEMA 9 Cicloconvertidores 9.1.- Introducción.... 1 9.2.- Principio de Funcionamiento... 1 9.3.- Montajes utilizados.... 4 9.4.- Estudio de la tensión de salida.... 6 9.5.- Modos de funcionamiento... 7
TEMA 9 Cicloconvertidores 9.1.- Introducción.... 1 9.2.- Principio de Funcionamiento... 1 9.3.- Montajes utilizados.... 4 9.4.- Estudio de la tensión de salida.... 6 9.5.- Modos de funcionamiento... 7
Electrón: partícula más pequeña de un átomo, que no se encuentra en el núcleo y que posee carga eléctrica negativa.
 Electricidad: flujo o corriente de electrones. Electrón: partícula más pequeña de un átomo, que no se encuentra en el núcleo y que posee carga eléctrica negativa. Elementos básicos de un circuito: generador,
Electricidad: flujo o corriente de electrones. Electrón: partícula más pequeña de un átomo, que no se encuentra en el núcleo y que posee carga eléctrica negativa. Elementos básicos de un circuito: generador,
Actividad: Qué es la anomalía del agua?
 Nivel: 1º Medio Subsector: Ciencias químicas Unidad temática: El agua Actividad: Seguramente ya has escuchado sobre la anomalía del agua. Sabes en qué consiste y qué es algo anómalo? Se dice que algo es
Nivel: 1º Medio Subsector: Ciencias químicas Unidad temática: El agua Actividad: Seguramente ya has escuchado sobre la anomalía del agua. Sabes en qué consiste y qué es algo anómalo? Se dice que algo es
Desulfatación para Baterías de Plomo-Ácido y NiCd
 Tecnología de Regeneración de Baterías *Según el BCI (Battery Council International) 80% de los fallos en las baterías ocurren por la sulfatación Desulfatación para Baterías de Plomo-Ácido y NiCd Tl:(34)
Tecnología de Regeneración de Baterías *Según el BCI (Battery Council International) 80% de los fallos en las baterías ocurren por la sulfatación Desulfatación para Baterías de Plomo-Ácido y NiCd Tl:(34)
Ing. Gerardo Sarmiento CALOR Y TEMPERATURA
 Ing. Gerardo Sarmiento CALOR Y TEMPERATURA Como se mide y transporta el calor La cantidad de calor (Q) se expresa en las mismas unidades que la energía y el trabajo, es decir, en Joule. Otra unidad es
Ing. Gerardo Sarmiento CALOR Y TEMPERATURA Como se mide y transporta el calor La cantidad de calor (Q) se expresa en las mismas unidades que la energía y el trabajo, es decir, en Joule. Otra unidad es
MÓDULO: GESTIÓN DE RESIDUOS TEMA: DESMINERALIZACIÓN
 MÓDULO: GESTIÓN DE RESIDUOS TEMA: DESMINERALIZACIÓN DOCUMENTACIÓN ELABORADA POR: NIEVES CIFUENTES MASTER EN INGENIERIÁ MEDIOAMBIENTAL Y GESTIÓN DEL AGUA ÍNDICE 1. INTRODUCCIÓN 2. INTERCAMBIO IÓNICO 3.
MÓDULO: GESTIÓN DE RESIDUOS TEMA: DESMINERALIZACIÓN DOCUMENTACIÓN ELABORADA POR: NIEVES CIFUENTES MASTER EN INGENIERIÁ MEDIOAMBIENTAL Y GESTIÓN DEL AGUA ÍNDICE 1. INTRODUCCIÓN 2. INTERCAMBIO IÓNICO 3.
INTRODUCCIÓN A LA ELECTRICIDAD
 Dpto. Escultura.Facultad de Bellas Artes de Valencia Prof: Moisés Mañas Moimacar@esc.upv.es Todas las cosas están formadas por átomos Todas las cosas están formadas por átomos Protones (carga +) Neutrones
Dpto. Escultura.Facultad de Bellas Artes de Valencia Prof: Moisés Mañas Moimacar@esc.upv.es Todas las cosas están formadas por átomos Todas las cosas están formadas por átomos Protones (carga +) Neutrones
De cualquier manera, solo estudiaremos en esta unidad los compuestos inorgánicos.
 Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
MEDIDA DEL CALOR ESPECÍFICO
 Laboratorio de Física General Primer Curso (Termodinámica) MEDIDA DEL CALOR ESPECÍFICO Fecha: 07/02/05 1. Objetivo de la práctica Familiarizarse con las medidas calorimétricas mediante la medida del calor
Laboratorio de Física General Primer Curso (Termodinámica) MEDIDA DEL CALOR ESPECÍFICO Fecha: 07/02/05 1. Objetivo de la práctica Familiarizarse con las medidas calorimétricas mediante la medida del calor
Medidas de Intensidad
 Unidad Didáctica Medidas de Intensidad Programa de Formación Abierta y Flexible Obra colectiva de FONDO FORMACION Coordinación Diseño y maquetación Servicio de Producción Didáctica de FONDO FORMACION (Dirección
Unidad Didáctica Medidas de Intensidad Programa de Formación Abierta y Flexible Obra colectiva de FONDO FORMACION Coordinación Diseño y maquetación Servicio de Producción Didáctica de FONDO FORMACION (Dirección
En el Cuadro N 1 se puede notar la influencia e la fuente solar en la mayoría de los vectores energéticos primarios, tanto directos como indirectos.
 Capítulo 5 Fuente Solar En el Cuadro N 1 se puede notar la influencia e la fuente solar en la mayoría de los vectores energéticos primarios, tanto directos como indirectos. Asimismo, en el gráfico N 1
Capítulo 5 Fuente Solar En el Cuadro N 1 se puede notar la influencia e la fuente solar en la mayoría de los vectores energéticos primarios, tanto directos como indirectos. Asimismo, en el gráfico N 1
U.T.N. F.R.Ro DEPTO. DE INGENIERÍA QUIMICA CATEDRA DE INTEGRACIÓN II PAG. 1
 U.T.N. F.R.Ro DEPTO. DE INGENIERÍA QUIMICA CATEDRA DE INTEGRACIÓN II PAG. 1 Introducción: En una planta química, para obtener el producto final deseado, el proceso se realiza en varias etapas, que podrían
U.T.N. F.R.Ro DEPTO. DE INGENIERÍA QUIMICA CATEDRA DE INTEGRACIÓN II PAG. 1 Introducción: En una planta química, para obtener el producto final deseado, el proceso se realiza en varias etapas, que podrían
El agua como disolvente
 hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
CAPITULO 3 LA TEMPERATURA
 CAPITULO 3 LA TEMPERATURA 1. CONCEPTO: La temperatura de un cuerpo indica en qué dirección se desplazará el calor al poner en contacto dos cuerpos que se encuentran a temperaturas distintas, ya que éste
CAPITULO 3 LA TEMPERATURA 1. CONCEPTO: La temperatura de un cuerpo indica en qué dirección se desplazará el calor al poner en contacto dos cuerpos que se encuentran a temperaturas distintas, ya que éste
Los negros de humo para cementos, hormigones y morteros.
 Los negros de humo para cementos, hormigones y morteros. Los pigmentos negros de óxido de hierro son los más utilizados para colorear cementos, morteros y hormigones. Estos, al igual que ocurre con los
Los negros de humo para cementos, hormigones y morteros. Los pigmentos negros de óxido de hierro son los más utilizados para colorear cementos, morteros y hormigones. Estos, al igual que ocurre con los
Agentes para la conservación de la energía mecánica
 Agentes para la conservación de la energía mecánica Para levantar un cuerpo verticalmente a velocidad constante, es necesario que algún agente externo realice trabajo y hemos demostrado que este trabajo
Agentes para la conservación de la energía mecánica Para levantar un cuerpo verticalmente a velocidad constante, es necesario que algún agente externo realice trabajo y hemos demostrado que este trabajo
ELECTROQUÍMICA. 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday.
 ELECTROQUÍMICA 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday. Química 2º bachillerato Electroquímica 1 0. CONOCIMIENTOS
ELECTROQUÍMICA 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday. Química 2º bachillerato Electroquímica 1 0. CONOCIMIENTOS
Comente: Los bancos siempre deberían dar crédito a los proyectos rentables. Falso, hay que evaluar la capacidad de pago.
 Explique Brevemente en que consiste el leasing y nombre los diferentes tipos existentes. Es un mecanismo de financiamiento de Activos el cual permite el uso del activo por un periodo determinado a cambio
Explique Brevemente en que consiste el leasing y nombre los diferentes tipos existentes. Es un mecanismo de financiamiento de Activos el cual permite el uso del activo por un periodo determinado a cambio
Mediciones Eléctricas
 Mediciones Eléctricas Grupos Electrógenos Mediciones Eléctricas Página 1 de 12 Tabla de Contenido Objetivo 1: Medidas de magnitudes eléctricas... 3 Objetivo 2: Generalidades sobre instrumentos de medición...
Mediciones Eléctricas Grupos Electrógenos Mediciones Eléctricas Página 1 de 12 Tabla de Contenido Objetivo 1: Medidas de magnitudes eléctricas... 3 Objetivo 2: Generalidades sobre instrumentos de medición...
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO. Modelo Curso 2010-2011
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Modelo Curso 010-011 MODELO INSTRUCCIONES Y CRITERIOS GENERALES DE
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Modelo Curso 010-011 MODELO INSTRUCCIONES Y CRITERIOS GENERALES DE
Estudio de la evaporación
 Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
Generador Solar Fotovoltaico Información técnica e ilustrativa
 Generador Solar Fotovoltaico Información técnica e ilustrativa Funcionamiento de un panel solar fotovoltaico Los paneles solares fotovoltaicos generan energía eléctrica a partir de la radiación solar.
Generador Solar Fotovoltaico Información técnica e ilustrativa Funcionamiento de un panel solar fotovoltaico Los paneles solares fotovoltaicos generan energía eléctrica a partir de la radiación solar.
CONDUCTIVIDAD Y ph PRACTICA Nº 7
 CONDUCTIVIDAD Y ph PRACTICA Nº 7 OBJETO DE LA PRÁCTICA: MEDIDA DE CONDUCTIVIDAD Y MANEJO DE SUS UNIDADES RELACIÓN CONDUCTIVIDAD-SALINIDAD- Nº DE PURGAS RELACIÓN CONDUCTIVIDAD-EROSIÓN/CORROSIÓN MANEJO DEL
CONDUCTIVIDAD Y ph PRACTICA Nº 7 OBJETO DE LA PRÁCTICA: MEDIDA DE CONDUCTIVIDAD Y MANEJO DE SUS UNIDADES RELACIÓN CONDUCTIVIDAD-SALINIDAD- Nº DE PURGAS RELACIÓN CONDUCTIVIDAD-EROSIÓN/CORROSIÓN MANEJO DEL
Tema 11 Endurecimiento por deformación plástica en frío. Recuperación, Recristalización y Crecimiento del grano.
 Tema 11 Endurecimiento por deformación plástica en frío. Recuperación, Recristalización y Crecimiento del grano. El endurecimiento por deformación plástica en frío es el fenómeno por medio del cual un
Tema 11 Endurecimiento por deformación plástica en frío. Recuperación, Recristalización y Crecimiento del grano. El endurecimiento por deformación plástica en frío es el fenómeno por medio del cual un
Información importante. 1. El potencial eléctrico. Preuniversitario Solidario. 1.1. Superficies equipotenciales.
 1.1 Superficies equipotenciales. Preuniversitario Solidario Información importante. Aprendizajes esperados: Es guía constituye una herramienta que usted debe manejar para poder comprender los conceptos
1.1 Superficies equipotenciales. Preuniversitario Solidario Información importante. Aprendizajes esperados: Es guía constituye una herramienta que usted debe manejar para poder comprender los conceptos
SEMICONDUCTORES PREGUNTAS
 SEMICONDUCTORES PREGUNTAS 1. Por qué los metales conducen mejor que los semiconductores 2. Por qué la conducción de la corriente eléctrica en los metales y los semiconductores tienen distinto comportamiento
SEMICONDUCTORES PREGUNTAS 1. Por qué los metales conducen mejor que los semiconductores 2. Por qué la conducción de la corriente eléctrica en los metales y los semiconductores tienen distinto comportamiento
Análisis y cuantificación del Riesgo
 Análisis y cuantificación del Riesgo 1 Qué es el análisis del Riesgo? 2. Métodos M de Análisis de riesgos 3. Método M de Montecarlo 4. Modelo de Análisis de Riesgos 5. Qué pasos de deben seguir para el
Análisis y cuantificación del Riesgo 1 Qué es el análisis del Riesgo? 2. Métodos M de Análisis de riesgos 3. Método M de Montecarlo 4. Modelo de Análisis de Riesgos 5. Qué pasos de deben seguir para el
CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION
 CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION Como hemos dicho anteriormente, los instrumentos de medición hacen posible la observación de los fenómenos eléctricos y su cuantificación. Ahora
CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION Como hemos dicho anteriormente, los instrumentos de medición hacen posible la observación de los fenómenos eléctricos y su cuantificación. Ahora
Capítulo 1 CONCLUSIO NES
 Conclusiones Conclusiones 143 Capítulo 1 CONCLUSIO NES La utilización de códigos de simulación tiene un papel relevante en el desarrollo de la investigación en el campo de la fusión nuclear por confinamiento
Conclusiones Conclusiones 143 Capítulo 1 CONCLUSIO NES La utilización de códigos de simulación tiene un papel relevante en el desarrollo de la investigación en el campo de la fusión nuclear por confinamiento
IES Menéndez Tolosa Física y Química - 4º ESO Trabajo y energía - Energías cinética y potencial con soluciones
 IES Menéndez Tolosa Física y Química - 4º ESO Trabajo y energía - Energías cinética y potencial con soluciones Define la unidad de energía en el sistema internacional (S.I.). Escribe otras unidades de
IES Menéndez Tolosa Física y Química - 4º ESO Trabajo y energía - Energías cinética y potencial con soluciones Define la unidad de energía en el sistema internacional (S.I.). Escribe otras unidades de
Actividad de Física: Conceptos Básicos de Celdas Solares Guía del Estudiante
 Actividad de Física: Conceptos Básicos de Celdas Solares Guía del Estudiante Objetivos: Los estudiantes serán capaces de Entender que la luz está compuesta de objetos discretos llamados fotones Calcular
Actividad de Física: Conceptos Básicos de Celdas Solares Guía del Estudiante Objetivos: Los estudiantes serán capaces de Entender que la luz está compuesta de objetos discretos llamados fotones Calcular
Tema 4 Tratamientos físico-químicos EUETI Escola Universitaria de Enxeñería Técnica Industrial
 Tratamiento de Residuos Tema 4 Tratamientos físico-químicos EUETI Escola Universitaria de Enxeñería Técnica Industrial Tecnología disponible para el tratamiento de residuos Técnicas mecánicas Son aquellas
Tratamiento de Residuos Tema 4 Tratamientos físico-químicos EUETI Escola Universitaria de Enxeñería Técnica Industrial Tecnología disponible para el tratamiento de residuos Técnicas mecánicas Son aquellas
EJERCICIOS DIAGRAMA DE FASES
 EJERCICIOS DIAGRAMA DE FASES 1. Con el diagrama de equilibrio Cu - Ni. Determinar para una aleación con el 40 % de Ni: a) Curva de enfriamiento, intervalo de solidificación, fases presentes en cada una
EJERCICIOS DIAGRAMA DE FASES 1. Con el diagrama de equilibrio Cu - Ni. Determinar para una aleación con el 40 % de Ni: a) Curva de enfriamiento, intervalo de solidificación, fases presentes en cada una
Reacciones de oxido reducción
 Reacciones de oxido reducción Oxidación pérdida de electrones Reducción ganancia de electrones Las reacciones de oxido reducción tienen lugar mediante intercambio de electrones Ej.: Zn(s) + 2 H + (ac)
Reacciones de oxido reducción Oxidación pérdida de electrones Reducción ganancia de electrones Las reacciones de oxido reducción tienen lugar mediante intercambio de electrones Ej.: Zn(s) + 2 H + (ac)
TRABAJO Y ENERGÍA; FUERZAS CONSERVATIVAS Y NO CONSERVATIVAS
 TRABAJO Y ENERGÍA; FUERZAS CONSERVATIVAS Y NO CONSERVATIVAS 1. CONCEPTO DE TRABAJO: A) Trabajo de una fuerza constante Todos sabemos que cuesta trabajo tirar de un sofá pesado, levantar una pila de libros
TRABAJO Y ENERGÍA; FUERZAS CONSERVATIVAS Y NO CONSERVATIVAS 1. CONCEPTO DE TRABAJO: A) Trabajo de una fuerza constante Todos sabemos que cuesta trabajo tirar de un sofá pesado, levantar una pila de libros
VECTORES. Módulo, dirección y sentido de un vector fijo En un vector fijo se llama módulo del mismo a la longitud del segmento que lo define.
 VECTORES El estudio de los vectores es uno de tantos conocimientos de las matemáticas que provienen de la física. En esta ciencia se distingue entre magnitudes escalares y magnitudes vectoriales. Se llaman
VECTORES El estudio de los vectores es uno de tantos conocimientos de las matemáticas que provienen de la física. En esta ciencia se distingue entre magnitudes escalares y magnitudes vectoriales. Se llaman
LOS GASES Y SUS LEYES DE
 EMA : LOS GASES Y SUS LEYES DE COMBINACIÓN -LAS LEYES DE LOS GASES En el siglo XII comenzó a investigarse el hecho de que los gases, independientemente de su naturaleza, presentan un comportamiento similar
EMA : LOS GASES Y SUS LEYES DE COMBINACIÓN -LAS LEYES DE LOS GASES En el siglo XII comenzó a investigarse el hecho de que los gases, independientemente de su naturaleza, presentan un comportamiento similar
ESTUDIO DE DIFERENTES FORMAS DE OBTENER ENERGÍA ELÉCTRICA
 ESTUDIO DE DIFERENTES FORMAS DE OBTENER ENERGÍA ELÉCTRICA Producción de energía eléctrica La energía eléctrica se produce a través de unos aparatos llamados generadores o alternadores. Un generador consta,
ESTUDIO DE DIFERENTES FORMAS DE OBTENER ENERGÍA ELÉCTRICA Producción de energía eléctrica La energía eléctrica se produce a través de unos aparatos llamados generadores o alternadores. Un generador consta,
Los estados financieros proporcionan a sus usuarios información útil para la toma de decisiones
 El ABC de los estados financieros Importancia de los estados financieros: Aunque no lo creas, existen muchas personas relacionadas con tu empresa que necesitan de esta información para tomar decisiones
El ABC de los estados financieros Importancia de los estados financieros: Aunque no lo creas, existen muchas personas relacionadas con tu empresa que necesitan de esta información para tomar decisiones
La electricidad. La electricidad se origina por la separación o movimiento de los electrones que forman los átomos.
 1 La electricidad Es el conjunto de fenómenos físicos relacionados con la presencia y flujo de cargas eléctricas. Se manifiesta en una gran variedad de fenómenos como los rayos, la electricidad estática,
1 La electricidad Es el conjunto de fenómenos físicos relacionados con la presencia y flujo de cargas eléctricas. Se manifiesta en una gran variedad de fenómenos como los rayos, la electricidad estática,
Gráfica 5.2 Acetato de cobalto 0.01M de 190 a 800nm con una absorbancia de 3.344 y λ 198.8 nm
 5- Resultados 5.1- Espectrofotometría UV/Vis de los reactivos Gráfica 5.1 Peroximonosulfato de potasio 0.01M de 190 a 800nm con una absorbancia de 365 y λ 193 nm Gráfica 5.2 Acetato de cobalto 0.01M de
5- Resultados 5.1- Espectrofotometría UV/Vis de los reactivos Gráfica 5.1 Peroximonosulfato de potasio 0.01M de 190 a 800nm con una absorbancia de 365 y λ 193 nm Gráfica 5.2 Acetato de cobalto 0.01M de
CAPÍTULO 7. CONCLUSIONES FINALES
 CAPÍTULO 7. CONCLUSIONES FINALES Conclusiones finales El grado de protección, UPF, que un tejido proporciona contra el paso de radiación ultravioleta viene influenciado por todos los parámetros de los
CAPÍTULO 7. CONCLUSIONES FINALES Conclusiones finales El grado de protección, UPF, que un tejido proporciona contra el paso de radiación ultravioleta viene influenciado por todos los parámetros de los
