Cada cápsula de Temodal contiene 5 mg, 20 mg, 100 mg ó 250 mg de temozolomida. Lista de excipientes, ver epígrafe 6.1.
|
|
|
- Natalia Flores Figueroa
- hace 8 años
- Vistas:
Transcripción
1 1. DENOMINACIÓN DEL MEDICAMENTO Temodal (temozolomida) 5 mg cápsulas duras. Temodal (temozolomida) 20 mg cápsulas duras. Temodal (temozolomida) 100 mg cápsulas duras. Temodal (temozolomida) 250 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula de Temodal contiene 5 mg, 20 mg, 100 mg ó 250 mg de temozolomida. Lista de excipientes, ver epígrafe FORMA FARMACÉUTICA Cápsula dura Las cápsulas duras son blancas, opacas y están impresas con un color específico de tinta para impresión que es único para cada concentración. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Temodal cápsulas está indicado en el tratamiento de pacientes con: - glioblastoma multiforme de nuevo diagnóstico concomitantemente con radioterapia y posteriormente en monoterapia - glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presenta recurrencia o progresión después de terapia estándar. 4.2 Posología y forma de administración Temodal sólo debe ser prescrito por médicos con experiencia en el tratamiento oncológico de tumores cerebrales. Posología Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico Temodal se administra en combinación con radioterapia focal (fase concomitante) seguido de hasta 6 ciclos de temozolomida en monoterapia. Fase concomitante Se administra Temodal a una dosis de 75 mg/m 2 al día por vía oral durante 42 días concomitantemente con radioterapia focal (60 Gy administrados en 30 fracciones). No se harán reducciones de dosis, pero se decidirá semanalmente el retraso o la discontinuación de la administración de temozolomida de acuerdo a los criterios de toxicidad hematológica y no hematológica. La dosis de Temodal se puede continuar todo el periodo concomitante de 42 días (de un total de 49 días) si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos 1,5 x 10 9 /l, recuento de trombocitos 100 x 10 9 /l, toxicidad no hematológica según los Criterios de Toxicidad Común (CTC) Grado 1 (excepto para alopecia, náuseas y vómitos). Durante el tratamiento se deberá realizar semanalmente un hemograma completo. La administración de Temodal se deberá interrumpir o discontinuar durante la fase concomitante de acuerdo a los criterios de toxicidad hematológica y no hematológica según la Tabla 1. 1
2 Tabla 1. Interrupción o discontinuación de la administración de temozolomida durante el tratamiento concomitante de temozolomida y radioterapia Toxicidad Interrupción de TMZ a Discontinuación de TMZ Recuento Absoluto de Neutrófilos 0,5 y < 1,5 x 10 9 /l < 0,5 x 10 9 /l Recuento de Trombocitos 10 y < 100 x 10 9 /l < 10 x 10 9 /l Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) Grado 2 según CTC Grado 3 ó 4 según CTC a: El tratamiento con TMZ concomitante se puede continuar si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos 1,5 x 10 9 /l, recuento de trombocitos 100 x 10 9 /l, toxicidad no hematológica según CTC Grado 1 (excepto para alopecia, náuseas y vómitos). TMZ = temozolomida; CTC = Criterios de Toxicidad Común. Fase de monoterapia Cuatro semanas después de completar la fase de Temodal + Radioterapia, se administran hasta 6 ciclos de Temodal en monoterapia. La dosis en el Ciclo 1 (monoterapia) es de 150 mg/m 2 una vez al día, durante 5 días, seguido de 23 días sin tratamiento. Al principio del Ciclo 2, la dosis se aumenta a 200 mg/m 2 si la toxicidad no hematológica según CTC en el Ciclo 1 es de Grado 2 (excepto para alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (RAN) es 1,5 x 10 9 /l y el recuento de trombocitos 100 x 10 9 /l. Si la dosis no se aumentó en el Ciclo 2, no se deberá aumentar la dosis en los ciclos posteriores. Si se aumentó la dosis, se mantiene a 200 mg/m 2 al día durante los primeros 5 días de cada ciclo posterior, excepto si se produce toxicidad. Las reducciones y discontinuaciones de dosis durante la fase de monoterapia se deberán realizar de acuerdo a las Tablas 2 y 3. Durante el tratamiento se deberá realizar un hemograma completo en el Día 22 (21 días después de la primera dosis de Temodal). La dosis de Temodal se reducirá o discontinuará de acuerdo a la Tabla 3. Tabla 2 Niveles de dosis de Temodal en monoterapia Nivel de Dosis Dosis (mg/m 2 /día) Observaciones Reducción por toxicidad previa Dosis durante el Ciclo Dosis durante los Ciclos 2-6 en ausencia de toxicidad Tabla 3. Reducción o discontinuación de la dosis de Temodal durante la monoterapia Toxicidad Reducir TMZ 1 nivel de Discontinuar TMZ dosis a Recuento Absoluto de Neutrófilos < 1,0 x 10 9 /l Véase nota b Recuento de Trombocitos < 50 x 10 9 /l Véase nota b Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) Grado 3 según CTC Grado 4 b según CTC a: Los niveles de dosis de TMZ aparecen en la Tabla 2. b: Se discontinua TMZ si: El nivel de dosis -1 (100 mg/m 2 ) todavía provoca toxicidad inaceptable La misma toxicidad no hematológica de Grado 3 (excepto para alopecia, náuseas, vómitos) vuelve a aparecer tras la reducción de dosis. TMZ = temozolomida; CTC = Criterios de Toxicidad Común. 2
3 Glioma maligno recurrente o progresivo: Pacientes adultos Un ciclo de tratamiento es de 28 días. En pacientes no tratados previamente con quimioterapia, Temodal se administra por vía oral a la dosis de 200 mg/m 2 una vez al día durante los primeros 5 días seguido por una interrupción del tratamiento de 23 días (un total de 28 días). En los pacientes tratados previamente con quimioterapia, la dosis inicial es de 150 mg/m 2 una vez al día, a incrementar en el segundo ciclo a 200 mg/m 2 una vez al día, durante 5 días si no apareciera toxicidad hematológica (ver epígrafe 4.4). Pacientes pediátricos En pacientes de edad igual o superior a 3 años, un ciclo de tratamiento es de 28 días. Temodal se administra por vía oral a la dosis de 200 mg/m 2 una vez al día durante los primeros 5 días seguido por una interrupción del tratamiento de 23 días (un total de 28 días). Los pacientes pediátricos previamente tratados con quimioterapia deben recibir una dosis inicial de 150 mg/m 2 una vez al día durante 5 días, con dosis escalada hasta 200 mg/m 2 una vez al día durante 5 días en el siguiente ciclo si no apareciera toxicidad hematológica (ver epígrafe 4.4). Pacientes con disfunción hepática o renal La farmacocinética de la temozolomida fue comparable en pacientes con función hepática normal y en aquellos con disfunción hepática leve o moderada. No hay datos disponibles sobre la administración de Temodal a pacientes con disfunción hepática grave (Clase III de Child) o con disfunción renal. En base a las propiedades farmacocinéticas de la temozolomida, es improbable que se requieran reducciones de dosis en pacientes con disfunción hepática o renal grave. Sin embargo, se debe tener precaución al administrar Temodal a estos pacientes. Pacientes de edad avanzada En base al análisis farmacocinético, el aclaramiento de la temozolomida no se ve afectado por la edad. Sin embargo, se debe tener precaución especial cuando se administre Temodal a pacientes de edad avanzada (ver epígrafe 4.4). Forma de administración Temodal debe administrarse en estado de ayuno. Las cápsulas de Temodal deben tragarse enteras con un vaso de agua y no deben abrirse o masticarse. La dosis prescrita debe administrarse utilizando el mínimo número de cápsulas posible. Puede administrarse terapia antiemética antes o después de la administración de Temodal (ver epígrafe 4.4). Si después de la administración de la dosis se produce vómito, no debe administrarse una segunda dosis ese día. 4.3 Contraindicaciones Temodal se encuentra contraindicado en pacientes con historia de hipersensibilidad a sus componentes o a la dacarbazina (DTIC). Temodal se encuentra contraindicado en pacientes con mielosupresión severa (ver epígrafe 4.4). Temodal se encuentra contraindicado en mujeres que estén embarazadas o amamantando (ver epígrafe 4.6). 4.4 Advertencias y precauciones especiales de empleo Los pacientes que recibieron concomitantemente Temodal y radioterapia en un ensayo piloto durante el régimen prolongado de 42 días parecieron presentar un especial riesgo a desarrollar neumonía por 3
4 Pneumocystis carinii (PCP). Por lo tanto, se requiere profilaxis frente a la neumonía por Pneumocystis carinii en todos los pacientes que reciban concomitantemente Temodal y radioterapia durante el régimen de 42 días (con un máximo de 49 días) con independencia del recuento de linfocitos. Si se produce linfopenia, deben continuar con la profilaxis hasta que la linfopenia sea de un grado 1. Puede haber una mayor incidencia de PCP cuando Temodal se administra durante un régimen de dosificación más largo. No obstante, todos los pacientes que reciban Temodal, en especial los pacientes que reciban esteroides, deberán ser observados cuidadosamente en cuanto al desarrollo de PCP con independencia del régimen. Terapia antiemética: Las náuseas y los vómitos se asocian muy frecuentemente con Temodal, y se facilitan las siguientes directrices: Pacientes con glioblastoma multiforme de nuevo diagnóstico: - Se recomienda profilaxis antiemética antes de la dosis inicial de temozolomida concomitante, - Se recomienda enérgicamente la profilaxis antiemética durante la fase de monoterapia. Pacientes con glioma maligno recurrente o progresivo: Los pacientes que hayan experimentado fuertes vómitos (Grado 3 ó 4) en ciclos de tratamiento previos pueden precisar tratamiento antiemético. Este medicamento contiene lactosa; por lo tanto, los pacientes con problemas hereditarios raros de intolerancia a galactosa, con insuficiencia de lactasa Lapp o con malabsorción de glucosa-galactosa no deberán tomar este medicamento. Parámetros de laboratorio Antes de la administración, deberán cumplirse los siguientes parámetros de laboratorio: RAN 1,5 x 10 9 /1 y recuento de plaquetas 100 x 10 9 /l. Deberá practicarse un hemograma completo el Día 22 (21 días después de la primera dosis) o dentro de las 48 horas de dicho día, y una vez a la semana hasta que el RAN se encuentre por encima de 1,5 x 10 9 /l y el recuento de plaquetas supere las 100 x 10 9 /l. Si el RAN disminuyera a < 1,0 x 10 9 /l o el recuento de trombocitos fuera < 50 x 10 9 /l durante cualquier ciclo, se disminuirá un nivel de dosis en el siguiente ciclo. Los niveles de dosis son de 100 mg/m 2, 150 mg/m 2 y 200 mg/m 2. La dosis más baja recomendada es de 100 mg/m 2. Uso pediátrico Se carece de experiencia clínica sobre el empleo de Temodal en niños menores de 3 años de edad. La experiencia en niños mayores es muy limitada. Uso en pacientes de edad avanzada Los pacientes de edad avanzada (> 70 años de edad) parecen presentar un mayor riesgo de neutropenia y trombocitopenia que los pacientes más jóvenes. Por lo tanto, se debe tener precaución especial cuando se administre Temodal a pacientes de edad avanzada. Pacientes de sexo masculino La temozolomida puede tener efectos genotóxicos. Por lo tanto, se advierte a los hombres que vayan a ser tratados con temozolomida que eviten dejar embarazada a su pareja durante los 6 meses posteriores al tratamiento y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento dada la posibilidad de infertilidad irreversible por terapia con temozolomida. 4.5 Interacción con otros medicamentos y otras formas de interacción La administración de Temodal con ranitidina no resultó en modificaciones del grado de absorción de la temozolomida o en la exposición a monometil triazenoimidazol carboxamida (MTIC). La administración de Temodal con los alimentos resultó en una disminución del 33 % de la C max y en una disminución del 9 % del área bajo la curva (AUC). Como no se puede excluir que el cambio en la C max sea clínicamente importante, Temodal debe administrarse sin alimentos. 4
5 En base a un análisis de farmacocinética poblacional observado en ensayos en Fase II, la administración concomitante de dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H 2 o fenobarbital no modificó la eliminación de la temozolomida. Se asoció la administración concomitante de ácido valproico con una pequeña pero estadísticamente importante disminución del aclaramiento de la temozolomida. No se han llevado a cabo estudios para determinar el efecto de la temozolomida sobre el metabolismo o eliminación de otros fármacos. No obstante, dado que la temozolomida no requiere metabolismo hepático y muestra una baja unión a proteínas, es improbable que afecte la farmacocinética de otros medicamentos. El empleo de Temodal en combinación con otros agentes mielosupresores puede aumentar la probabilidad de mielosupresión. 4.6 Embarazo y lactancia Embarazo No existen estudios en mujeres embarazadas. En los estudios preclínicos en la rata y el conejo tratados con 150 mg/m 2 se observó teratogenia y/o toxicidad fetal. Por tanto, Temodal no debe administrarse normalmente a la mujer embarazada. Si se debe considerar su uso durante el embarazo, el paciente debe ser informado del riesgo potencial para el feto. Se deberá advertir a las mujeres en edad de procrear que eviten el embarazo mientras se encuentren en tratamiento con Temodal. Lactancia Se desconoce si la temozolomida se elimina en la leche humana; por tanto, Temodal no deberá utilizarse por mujeres que estén amamantando. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas La capacidad para conducir y utilizar máquinas se puede deteriorar en pacientes tratados con Temodal debido a la fatiga y somnolencia. 4.8 Reacciones adversas Glioblastoma multiforme de nuevo diagnóstico La Tabla 4 incluye acontecimientos adversos derivados del tratamiento en pacientes con glioblastoma multiforme de nuevo diagnóstico durante las fases de tratamiento concomitante y monoterapia. Tabla 4: Temodal (TMZ) y radioterapia: Acontecimientos derivados del tratamiento durante el tratamiento concomitante y monoterapia Muy Frecuentes (> 1/10); Frecuentes (> 1/100, < 1/10); Poco Frecuentes (> 1/1.000, < 1/100) CIOMS III Clasificación por Aparatos Infecciones e infestaciones TMZ + radioterapia concomitante n=288* Candidiasis oral, herpes simple, infección, faringitis, infección de una herida TMZ en monoterapia n=224 Candidiasis oral, infección Herpes simple, Herpes zoster, síntomas pseudogripales 5
6 Trastornos de la sangre y del sistema linfático Leucopenia, linfopenia, neutropenia, trombocitopenia Anemia, neutropenia febril, leucopenia, trombocitopenia Anemia, neutropenia febril Linfopenia, petequia Trastornos endocrinos Cushingoide Cushingoide Trastornos del metabolismo y de la nutrición Anorexia Anorexia Trastornos psiquiátricos Trastornos del sistema nervioso Trastornos oculares Trastornos del oído y del laberinto Hiperglicemia, pérdida de peso Hipocalcemia, aumento de la fosfatasa alcalina, aumento de peso Ansiedad, labilidad emocional, insomnio Agitación, apatía, alteración del comportamiento, depresión, alucinaciones Cefalea Mareo, afasia, alteración del equilibrio, disminución de la concentración, confusión, pérdida de conocimiento, convulsiones, pérdida de memoria, neuropatía, parestesia, somnolencia, trastorno en el habla, temblor Ataxia, trastorno cognitivo, disfasia, trastorno extrapiramidal, trastorno de la marcha, hemiparesia, hiperestesia, hipoestesia, trastorno neurológico (NOS), neuropatía periférica, status epilepticus Visión borrosa Dolor ocular, hemianopsia, trastorno en la visión, disminución de la agudeza visual, defecto en el campo visual Trastorno en la audición Otalgia, hiperacusia, tinnitus, otitis media Pérdida de peso Hiperglicemia, ganancia de peso Ansiedad, depresión, labilidad emocional, insomnio Alucinaciones, amnesia Cefalea, convulsiones Mareo, afasia, alteración del equilibrio, disminución de la concentración, confusión, disfasia, hemiparesia, pérdida de memoria, trastorno neurológico (NOS), neuropatía, neuropatía periférica, parestesia, somnolencia, trastorno en el habla, temblor Ataxia, alteración en la coordinación, trastorno de la marcha, hemiplejía, hiperestesia, trastorno sensorial Visión borrosa, diplopía, defecto en el campo visual Dolor ocular, sequedad ocular, disminución de la agudeza visual Trastorno en la audición, tinnitus Sordera, otalgia, vértigo 6
7 Trastornos cardíacos Trastornos vasculares Trastornos respiratorios, torácicos y mediastínicos Trastornos gastrointestinales Trastornos de la piel y del tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Trastornos renales y urinarios Palpitaciones Edema, edema de la pierna, hemorragia Hipertensión, hemorragia cerebral Tos, disnea Neumonía, infección respiratoria superior, congestión nasal Estreñimiento, náuseas, vómitos Dolor abdominal, diarrea, dispepsia, disfagia, estomatitis Alopecia, rash Dermatitis, sequedad cutánea, eritema, prurito Reacción de fotosensibilidad, alteración en la pigmentación, exfoliación cutánea Artralgia, debilidad muscular Dolor de espalda, dolor musculoesquelético, mialgia, miopatía Polaquiuria, incontinencia urinaria Edema de la pierna, hemorragia, trombosis venosa intensa Edema, edema periférico, embolismo pulmonar Tos, disnea Neumonía, sinusitis, infección respiratoria superior, bronquitis Estreñimiento, náuseas, vómitos Diarrea, dispepsia, disfagia, sequedad de boca, estomatitis Distensión abdominal, incontinencia fecal, trastorno gastrointestinal (NOS), gastroenteritis, hemorroides Alopecia, rash Sequedad cutánea, prurito Eritema, alteración en la pigmentación, aumento de la sudoración Artralgia, dolor musculoesquelético, mialgia, debilidad muscular Dolor de espalda, miopatía Incontinencia urinaria Disuria 7
8 Trastornos del aparato reproductor y de la mama Impotencia Amenorrea, dolor de mama, menorragia, hemorragia vaginal, vaginitis Trastornos generales y alteraciones en el lugar de administración Fatiga Fatiga Exploraciones complementarias Fiebre, dolor, reacción alérgica, lesión por radiación, edema facial, alteración del gusto Enrojecimiento facial, sofocos, astenia, empeoramiento de una enfermedad, escalofríos, cambio de color de la lengua, parosmia, sed Aumento de ALT Fiebre, dolor, reacción alérgica, lesión por radiación, alteración del gusto Astenia, empeoramiento de una enfermedad, dolor, escalofríos, trastorno dental, edema facial, alteración del gusto Aumento de ALT Aumento de Gamma GT, aumento de enzimas hepáticas, aumento de AST *Un paciente que se aleatorizó al brazo de radioterapia únicamente, recibió Temodal + radioterapia. Resultados de laboratorio: Se observó mielosupresión (neutropenia y trombocitopenia), que es toxicidad limitante de dosis para la mayoría de los agentes citotóxicos, incluido Temodal. Cuando las alteraciones en las pruebas de laboratorio y los acontecimientos adversos se sumaron entre las fases de tratamiento concomitante y monoterapia, se observaron alteraciones en neutrófilos de Grado 3 o de Grado 4, incluyendo acontecimientos neutropénicos, en el 8 % de los pacientes. Se observaron alteraciones en los trombocitos de Grado 3 o Grado 4, incluyendo acontecimientos trombocitopénicos en el 14 % de los pacientes que recibieron Temodal. Glioma maligno recurrente o progresivo En ensayos clínicos, las reacciones adversas más frecuentes relacionadas con el tratamiento fueron de tipo gastrointestinal, en concreto náuseas (43 %) y vómitos (36 %). Estas reacciones fueron por lo general de Grado 1 ó 2 (0 5 episodios de vómito en 24 horas) y fueron de carácter auto-limitado o se controlaron rápidamente con tratamiento antiemético estándar. La incidencia de fuertes náuseas y vómitos fue del 4 %. La Tabla 5 incluye reacciones adversas notificadas durante ensayos clínicos en glioma maligno recurrente o progresivo y después de la comercialización de Temodal. 8
9 Tabla 5. Reacciones adversas relacionadas con el tratamiento: Glioma maligno recurrente o progresivo Muy frecuentes (> 1/10); Frecuentes (> 1/100, < 1/10); Poco frecuentes (> 1/1.000, < 1/100); Raras (> 1/10.000, < 1/1.000); Muy raras (< 1/10.000) (CIOMS III ) Infecciones e infestaciones Raras: Trastornos de la sangre y del sistema linfático Trastornos del metabolismo y de la nutrición Trastornos del sistema nervioso Trastornos respiratorios, torácicos y mediastínicos Trastornos gastrointestinales Trastornos de la piel y del tejido subcutáneo Muy raras : Trastornos generales y alteraciones en el lugar de administración Muy raras: Infecciones oportunistas, incluyendo neumonía por Pneumocystis carinii Trombocitopenia, neutropenia o linfopenia (grado 3-4), Pancitopenia, leucopenia, anemia (grado 3-4) Anorexia Pérdida de peso Cefalea Somnolencia, mareo, parestesia Disnea Náuseas, vómitos, estreñimiento Diarrea, dolor abdominal, dispepsia Rash, alopecia, prurito Urticaria, exantema, eritrodermia, eritema multiforme Fatiga Fiebre, astenia, dolor, escalofríos, malestar general, alteraciones en el gusto Reacciones alérgicas, incluyendo anafilaxia, angioedema Resultados de laboratorio: Se produjeron trombocitopenia y neutropenia de grados 3 ó 4 en el 19 % y 17 % respectivamente, de los pacientes tratados por glioma maligno. Esto provocó la hospitalización y/o interrupción del tratamiento con Temodal en el 8 % y 4 %, respectivamente. La mielosupresión fue previsible (normalmente dentro de los primeros ciclos, con el nadir entre el Día 21 y el Día 28), y la recuperación fue rápida, generalmente en 1-2 semanas. No se observó evidencia de una mielosupresión de tipo acumulativo. La presencia de trombocitopenia puede incrementar el riesgo de hemorragia, y la presencia de neutropenia o leucopenia puede incrementar el riesgo de infección. Los agentes antineoplásicos, y en particular los agentes alquilantes, se han asociado con un riesgo potencial de síndrome mielodisplásico (SMD) y con tumores malignos secundarios, incluyendo leucemia. Se han comunicado casos muy raros de SMD y tumores malignos secundarios, incluyendo leucemia mieloide, en pacientes con tratamientos que incluían Temodal. Se ha comunicado muy raramente pancitopenia prolongada, que podría ocasionar anemia aplásica. 4.9 Sobredosis Se han evaluado clínicamente en pacientes dosis de 500, 750, y mg/m 2 (dosis total por ciclo de 5 días). La toxicidad limitante de dosis fue hematológica y se comunicó con todas las dosis, pero se espera que sea más grave a dosis más altas. Un paciente recibió una sobredosis de mg 9
10 (dosis total por ciclo de 5 días) y los efectos adversos que se comunicaron fueron pancitopenia, pirexia, fracaso multiorgánico y muerte. Se han comunicado casos de pacientes que han tomado la dosis recomendada durante más de 5 días el tratamiento (hasta 64 días) comunicándose acontecimientos adversos que incluían supresión de médula ósea, con o sin infección, en algunos casos grave y prolongada, con resultado de muerte. En caso de sobredosis, es necesaria una evaluación hematológica. Se deben tomar medidas generales de soporte si fuera necesario. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes, código ATC L01A X03. La temozolomida es un triazeno, que a ph fisiológico sufre una rápida conversión química al compuesto activo MTIC. Se considera que la citotoxicidad del MTIC es consecuencia fundamentalmente de una alquilación en la posición O 6 de la guanina, con una alquilación adicional que se produce también en la posición N 7. Se considera que las lesiones citotóxicas que se desarrollan posteriormente conllevan una reparación aberrante del aducto metilo. Glioblastoma multiforme de nuevo diagnóstico Se aleatorizaron quinientos setenta y tres pacientes para recibir o temozolomida + Radioterapia (RT) (n=287) o RT sola (n=286). Los pacientes del brazo de temozolomida + RT recibieron temozolomida concomitante (75 mg/m 2 ) una vez al día, empezando el primer día de RT hasta el último día de RT, durante 42 días (con un máximo de 49 días). Este tratamiento iba seguido por temozolomida en monoterapia ( mg/m 2 ) en los Días 1-5 de cada ciclo de 28 días, hasta 6 ciclos, empezando 4 semanas después de la finalización de la RT. Los pacientes del brazo control sólo recibieron RT. Se necesitó profilaxis frente a neumonía por Pneumocystis carinii (PCP) durante la RT y la terapia combinada con temozolomida. En la fase de seguimiento se administró temozolomida como terapia de rescate en 161 pacientes de los 282 (57 %) del brazo de RT sola, y en 62 pacientes de los 277 (22 %) del brazo de temozolomida + RT. El hazard ratio (HR) para la supervivencia global fue de 1,59 (95 % IC para HR=1,33-1,91) con un rango logarítmico de p < 0,0001 a favor del brazo de temozolomida. La probabilidad estimada de sobrevivir 2 o más años (26 % frente a 10 %) es mayor para el brazo de RT + temozolomida. La adición de temozolomida concomitante a la radioterapia, seguida de temozolomida en monoterapia en el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico demostró una mejoría en la supervivencia global estadísticamente significativa en comparación con la radioterapia sola (Figura 1). 10
11 Figura 1 Curvas de Kaplan-Meier para la supervivencia global (pacientes por intención de tratar) Los resultados del ensayo no fueron coherentes en el subgrupo de pacientes con un estado funcional bajo (Performance Status=2, n=70), en el que la supervivencia global y el tiempo hasta la progresión fueron similares en ambos brazos. No obstante, este grupo de pacientes no parece presentar riesgos inaceptables. Glioma maligno recurrente o progresivo Los datos sobre eficacia clínica en pacientes con glioblastoma multiforme (índice de actividad de Karnofsky 70), progresivo o recurrente después de cirugía y radioterapia, se basaron en dos ensayos clínicos. Uno fue un ensayo no comparativo sobre 138 pacientes (el 29 % recibió quimioterapia previa), y el otro fue un ensayo randomizado con brazo control de temozolomida y procarbazina sobre un total de 225 pacientes (el 67 % recibió tratamiento previo con quimioterapia basada en nitrosourea). En ambos ensayos, la variable principal de valoración fue el periodo libre de enfermedad (PLE) definido por resonancia magnética o empeoramiento neurológico. En el ensayo no comparativo, el PLE a los 6 meses fue del 19 %, la mediana del periodo libre de enfermedad fue de 2,1 meses, y la mediana de la supervivencia global de 5,4 meses. La tasa de respuesta objetiva en base a la resonancia magnética fue del 8 %. En el ensayo randomizado, el PLE de 6 meses fue significativamente mayor para la temozolomida que para la procarbazina (21 % frente al 8 %, respectivamente - prueba de chi-cuadrado = 0,008) con una mediana del PLE de 2,89 y 1,88 meses respectivamente (rango logarítmico de p = 0,0063). La mediana de la supervivencia fue de 7,34 y 5,66 meses para la temozolomida y procarbazina, respectivamente (rango logarítmico de p = 0,33). A los 6 meses la fracción de pacientes que sobrevivieron fue significativamente superior con el tratamiento de temozolomida (60 %) en comparación con el de procarbazina (44 %) (prueba de chi-cuadrado = 0,019). En los pacientes que recibieron quimioterapia previa se observó un beneficio en aquellos con un índice de actividad de Karnofsky de 80 ó superior. Los datos sobre el tiempo para el empeoramiento del estado neurológico favorecieron a la temozolomida sobre la procarbazina al igual que los datos sobre el tiempo para el empeoramiento del índice de actividad (decrece a un Estado de Desarrollo de Karnofsky de < 70 o decrece al menos 30 puntos). En estas variables de valoración la mediana del tiempo a la progresión osciló entre los 0,7 y 2,1 meses más para la temozolomida que para la procarbazina (rango logarítmico de p = < 0,01 a 0,03). Astrocitoma anaplásico En un ensayo de fase II, multicéntrico, global y prospectivo, dirigido a evaluar la seguridad y la eficacia de la temozolomida oral en el tratamiento de pacientes con un astrocitoma anaplásico en su primera recaída, el periodo libre de enfermedad a los 6 meses fue del 46 %. La mediana del periodo libre de enfermedad fue de 5,4 meses. La mediana de la supervivencia global fue de 14,6 meses. La tasa de respuesta, basada en la evaluación practicada por un revisor central, fue del 35 % (13 RC y 43 RP) en la población analizada por intención de tratar. Se comunicó enfermedad estable en 43 pacientes. La supervivencia libre de eventos a los 6 meses en la población analizada por intención de tratar fue del 44 %, con una mediana de la supervivencia libre de eventos de 4,6 meses, cifra que fue similar a la hallada en el periodo libre de enfermedad. En la población elegible desde el punto de vista de la histología, los resultados de eficacia fueron similares. El alcance de una respuesta objetiva radiológica o el mantenimiento del estado de enfermedad libre de progresión se asoció poderosamente al mantenimiento o la mejoría de la calidad de vida. 5.2 Propiedades farmacocinéticas Los estudios de tomografía por emisión de positrones en el ser humano y los datos preclínicos sugieren que la temozolomida atraviesa rápidamente la barrera hemato-encefálica, encontrándose presente en LCR. Se confirmó la penetración en el LCR en un paciente; los niveles en LCR en base al 11
12 AUC de la temozolomida fueron aproximadamente el 30 % de los plasmáticos, lo que está de acuerdo con los datos en animales. Tras su administración oral a pacientes adultos, la temozolomida se absorbe rápidamente, alcanzándose las concentraciones pico ya a los 20 minutos de la administración (tiempos medios entre 0,5 y 1,5 horas). La semivida plasmática es aproximadamente de 1,8 horas. Las concentraciones plasmáticas se elevan de manera dependiente de la dosis. El aclaramiento plasmático, el volumen de distribución y la semivida son independientes de la dosis. La temozolomida muestra una baja unión a proteínas (10 % al 20 %), por lo que no es de esperar que presente interacciones con los agentes que se unen altamente a las proteínas plasmáticas. Tras la administración oral de temozolomida marcada con 14 C, la excreción fecal media de 14 C durante los 7 días siguientes a la administración fue del 0,8 %, lo que indica una absorción completa. La vía principal de eliminación de 14 C es renal. Tras la administración oral, en torno al 5 % - 10 % de la dosis se recupera sin alteración en la orina a lo largo de 24 horas, mientras que el resto se elimina como temozolomida ácido, 5- aminoimidazol-4-carboxamida (AIC) o como metabolitos polares no identificados. El análisis poblacional en base a la farmacocinética de la temozolomida reveló que el aclaramiento plasmático de la temozolomida era independiente de la edad, la función renal, o del consumo de tabaco. En un estudio farmacocinético distinto, los perfiles farmacocinéticos plasmáticos en los pacientes con disfunción hepática de leve a moderada fueron similares a los observados en pacientes con función hepática normal. Temozolomida se hidroliza espontáneamente a ph fisiológico principalmente a los metabolitos activos, 3-metil-(triazeno-1-il)imidazol-4-carboxamida (MTIC). MTIC se hidroliza espontáneamente a 5-amino-imidazol-4-carboxamida (AIC), un conocido intermedio en la biosíntesis de purina y ácido nucleico, y a metilhidrazina, que se cree que es el metabolito alquilante activo. Se cree que la citotoxicidad de MTIC se debe fundamentalmente a la alquilación del DNA principalmente en las posiciones O 6 y N 7 de la guanina. En relación al AUC de temozolomida, la exposición a MTIC y AIC es ~ 2,4 % y 23 %, respectivamente. In vivo, la t 1/2 de MTIC fue similar a la de temozolomida, 1,8 h. Los pacientes pediátricos mostraron unos valores del AUC mayores que los pacientes adultos; sin embargo, la dosis máxima tolerada (DMT) fue de mg/m 2 por ciclo tanto en el niño como en el adulto. 5.3 Datos preclínicos sobre seguridad Se llevaron a cabo estudios de toxicidad tras un solo ciclo (administración durante 5 días, 23 días sin tratamiento), tres ciclos y seis ciclos en la rata y el perro. Los órganos principales de la toxicidad fueron la médula ósea, el sistema linforreticular, el testículo, el tracto gastrointestinal, y, a dosis superiores, que fueron letales para el 60 % al 100 % de las ratas y perros tratados, se produjo degeneración de la retina. La mayoría de la toxicidad mostró evidencia de reversibilidad, excepto las reacciones adversas sobre el sistema reproductor masculino y la degeneración de la retina. No obstante, dado que las dosis implicadas en la degeneración de la retina se encontraban en el intervalo de dosis letal, y no se ha observado un efecto comparable en los estudios clínicos, no se consideró que este hallazgo tuviera relevancia clínica. La temozolomida es un agente alquilante embriotóxico, teratogénico y genotóxico. La temozolomida es más tóxica en la rata y el perro que en el ser humano, y la dosis clínica se acerca a la dosis letal mínima en la rata y el perro. Las reducciones, relacionadas con la dosis, en los leucocitos y las plaquetas muestran ser unos sensibles indicadores de toxicidad. En el estudio de administración a la rata durante seis ciclos, se observaron varias neoplasias, incluyendo carcinoma de mama, queratoacantoma y adenoma de células basales mientras que en los estudios en el perro no se observaron tumores o alteraciones preneoplásicas. La rata parece ser particularmente sensible a los efectos oncogénicos de la temozolomida, con la aparición de los primeros tumores dentro de los tres meses del inicio del tratamiento. Este periodo latente es muy corto incluso para un agente alquilante. Los resultados del test de Ames en salmonella y del test de aberración cromosómica en Linfocitos de Sangre Periférica Humana (HPBL) mostraron una respuesta positiva de mutagenia. 12
13 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes La cápsula contiene lactosa anhidra, sílice anhidra coloidal, glicolato sódico de almidón, ácido tartárico, ácido esteárico. Los cuerpos de las cápsulas contienen gelatina, dióxido de titanio, lauril sulfato sódico y se imprimen con tinta farmacéutica. Cápsula de 5 mg: impresión verde que contiene goma laca de grado farmacéutico, propilenglicol, hidróxido amónico, dióxido de titanio (E 171), óxido amarillo de hierro (E 172) e indigotina (E 132). Cápsula de 20 mg: impresión marrón que contiene goma laca de grado farmacéutico, propilenglicol, hidróxido amónico, hidróxido potásico, dióxido de titanio (E 171), óxido negro de hierro (E 172), óxido amarillo de hierro (E 172), óxido marrón de hierro (E 172) y óxido rojo de hierro (E 172). Cápsula de 100 mg: impresión azul que contiene barniz de grado farmacéutico (modificado) en una mezcla de etanol/goma laca, propilenglicol, dióxido de titanio (E 171) e indigotina (E 132). Cápsula de 250 mg: impresión negra que contiene goma laca de grado farmacéutico, propilenglicol, hidróxido amónico, hidróxido potásico y óxido negro de hierro (E 172). 6.2 Incompatibilidades No aplicable. 6.3 Periodo de validez 2 años 6.4 Precauciones especiales de conservación No conservar a temperatura superior a 30ºC. 6.5 Naturaleza y contenido del recipiente Frascos de vidrio ámbar de tipo I con cápsulas de cierre de polipropileno a prueba de niños, que contienen 5 y 20 cápsulas. 6.6 Instrucciones de uso y manipulación No abrir las cápsulas. Si una cápsula se rompiera, evitar el contacto del contenido en polvo con la piel o membranas mucosas. Si se produjera contacto, lavar el área afectada. Mantener las cápsulas fuera del alcance y de la vista de los niños, preferiblemente en un armario cerrado con llave. Su ingestión puede ser letal. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN SP Europe Rue de Stalle 73 B-1180 Bruxelles Bélgica 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN EU/1/98/096/
14 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 26 de enero, Fecha de última renovación: 26 de enero, FECHA DE LA REVISIÓN DEL TEXTO 15 de noviembre de 2005 PRECIOS AUTORIZADOS DESDE FEBRERO 2006: Temodal 5 mg, 5 cap, P.V.L.: 21,60 Temodal 20 mg, 5 cap, P.V.L.: 86,40 Temodal 20 mg, 20 cap, P.V.L.: 345,58 Temodal 100 mg, 5 cap, P.V.L.: 431,97 Temodal 100 mg, 20 cap, P.V.L.: 1.727,88 Temodal 250 mg, 5 cap, P.V.L.: 1.079,92 DIAGNÓSTICO HOSPITALARIO Temodal /FT/Noviembre 05/8 14
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Temodal 5 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 5 mg de temozolomida.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Temodal 5 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 5 mg de temozolomida.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
 1. NOMBRE DEL MEDICAMENTO Temodal 20 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 20 mg de temozolomida (temozolomide). Excipiente con efecto conocido: Cada cápsula
1. NOMBRE DEL MEDICAMENTO Temodal 20 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 20 mg de temozolomida (temozolomide). Excipiente con efecto conocido: Cada cápsula
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO NOMBRE DEL MEDICAMENTO Flerudin 5 mg comprimidos 1. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Flerudin contiene hidrocloruro
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO NOMBRE DEL MEDICAMENTO Flerudin 5 mg comprimidos 1. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Flerudin contiene hidrocloruro
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
Cada comprimido de Pramipexol Actavis 0,18 mg contiene 0,18 mg de pramipexol base (como 0,25 mg de dihidrocloruro de pramipexol monohidrato).
 1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
1. NOMBRE DEL MEDICAMENTO Pramipexol Actavis 0,18 mg comprimidos EFG Pramipexol Actavis 0,7 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Pramipexol Actavis 0,18 mg contiene
Cada capsulas contiene: Temozolomina. 20, 100 y 250 mg Excipiente, c.b.p.. 1 cápsula.
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre comercial: RUBRUM ASF 2. Nombre Genérico: ANTINEOPLASICO 3. Forma Farmacéutica y Formulación: Capsulas Cada capsulas contiene: Temozolomina. 20, 100 y 250 mg
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre comercial: RUBRUM ASF 2. Nombre Genérico: ANTINEOPLASICO 3. Forma Farmacéutica y Formulación: Capsulas Cada capsulas contiene: Temozolomina. 20, 100 y 250 mg
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG. Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
 1. NOMBRE DEL MEDICAMENTO Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
1. NOMBRE DEL MEDICAMENTO Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Temodal 5 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 5 mg de
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Temodal 5 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 5 mg de
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 Nombre del producto: DCI Forma farmacéutica: Fortaleza: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Cetimer 5 mg (Levocetirizina) Comprimido recubierto 5 mg Presentación: Estuche por 10 blísteres de PVC/AL
Nombre del producto: DCI Forma farmacéutica: Fortaleza: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Cetimer 5 mg (Levocetirizina) Comprimido recubierto 5 mg Presentación: Estuche por 10 blísteres de PVC/AL
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO FormulaExpec 13,33 mg/ml jarabe sabor miel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de jarabe contiene: Principio
ALCOHOLISMO. Daniel Vivas Juan Castaño
 ALCOHOLISMO Daniel Vivas Juan Castaño Índice 1. Que Es El Alcoholismo? 2.Características 3. Como Detectar El Alcoholismo? 4. Efectos Del Alcohol En El Cuerpo 5. Bibliografía 6. Preguntas 7. Mis Preguntas
ALCOHOLISMO Daniel Vivas Juan Castaño Índice 1. Que Es El Alcoholismo? 2.Características 3. Como Detectar El Alcoholismo? 4. Efectos Del Alcohol En El Cuerpo 5. Bibliografía 6. Preguntas 7. Mis Preguntas
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
Gel/Crema para uso cutáneo Gel homogéneo incoloro o de color amarillo pálido o ligeramente marrón. Crema blanca, brillante.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ROZEX 7,5 mg/g Gel tópico ROZEX 7,5 mg/g Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 gramo de gel/crema contiene 7,5 mg de metronidazol Para consultar la lista
MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro
 Prospecto: Información para el paciente MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
Prospecto: Información para el paciente MUNTEL 5 mg comprimidos recubiertos con película Levocetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA
 POSTINOR 750 microgramos comprimidos. 1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Para los excipientes, véase en
POSTINOR 750 microgramos comprimidos. 1. DENOMINACIÓN DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Para los excipientes, véase en
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. NOMBRE DEL MEDICAMENTO. FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de FAMOTIDINA MABO 20 mg COMPRIMIDOS contiene
1. NOMBRE DEL MEDICAMENTO FAMOTIDINA MABO 20 mg COMPRIMIDOS EFG FAMOTIDINA MABO 40 mg COMPRIMIDOS EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de FAMOTIDINA MABO 20 mg COMPRIMIDOS contiene
Plasimine está indicado para el tratamiento de las siguientes infecciones cutáneas causadas por microorganismos sensibles (ver sección 5.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Plasimine 20 mg/g pomada 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene; Mupirocina
Menalgil B 6 Comprimidos
 agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
agencia española de medicamentos y productos sanitarios Menalgil B 6 Comprimidos 1. NOMBRE DEL MEDICAMENTO MENALGIL B 6 Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA MENALGIL B 6 Comprimidos Cada
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada cápsula dura contiene:
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
FICHA TÉCNICA. DOVIDA 30 mg cápsulas blandas: Cada cápsula blanda contiene 30 mg de sulodexida, equivalente en actividad in vitro a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DOVIDA 30 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA DOVIDA 30 mg cápsulas blandas: Cada cápsula blanda contiene 30 mg de sulodexida, equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DOVIDA 30 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA DOVIDA 30 mg cápsulas blandas: Cada cápsula blanda contiene 30 mg de sulodexida, equivalente
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA ALOXIDIL 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
Prospecto: información para el usuario. Benzac 100 mg/g gel Peróxido de benzoilo
 Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Benzac 100 mg/g gel Peróxido de benzoilo Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA. 2. ANTES DE USAR Minoxidil Viñas 5% solución cutánea
 1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
FICHA TÉCNICA. Líquido oral. Líquido oleoso homogéneo, transparente, de color amarillo pálido
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO Ordelax 756,6 mg/ml líquido oral 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de líquido oral contiene: Parafina líquida...756,6 mg. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. PRODELION 25-50 microgramos comprimidos. PRODELION 150 microgramos comprimidos
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRODELION 25-50 microgramos comprimidos PRODELION 75 microgramos comprimidos PRODELION 150 microgramos comprimidos
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRODELION 25-50 microgramos comprimidos PRODELION 75 microgramos comprimidos PRODELION 150 microgramos comprimidos
FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg
 FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg 1. DENOMINACIÓN Denominación Internacional MIRION Denominación del producto 17 B-Estradiol Valerato Micronizado 2. FÓRMULA QUÍMICA DEL PRINCIPIO
FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg 1. DENOMINACIÓN Denominación Internacional MIRION Denominación del producto 17 B-Estradiol Valerato Micronizado 2. FÓRMULA QUÍMICA DEL PRINCIPIO
ROSIGLITAZONA (MALEATO) / METFORMINA CLORHIDRATO COMPRIMIDOS RECUBIERTOS 2/500mg,4/500mg-2/1000mg-4/1000mg
 ROSIGLITAZONA (MALEATO) / METFORMINA CLORHIDRATO COMPRIMIDOS RECUBIERTOS 2/500mg,4/500mg-2/1000mg-4/1000mg Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto.
ROSIGLITAZONA (MALEATO) / METFORMINA CLORHIDRATO COMPRIMIDOS RECUBIERTOS 2/500mg,4/500mg-2/1000mg-4/1000mg Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto.
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe
 SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CAPSICIN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada 100 g de crema contienen : Capsaicina...
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CAPSICIN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de crema contienen : Capsaicina... 0,075 g
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO CAPSICIN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de crema contienen : Capsaicina... 0,075 g
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Para consultar la lista completa de excipientes, ver sección 6.1.
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Desloratadina Kern Pharma 0,5 mg/ml solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Desloratadina Kern Pharma 0,5 mg/ml solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución
Prospecto: información para el usuario. Cebión 500 mg granulado para solución oral. Ácido ascórbico (Vitamina C)
 Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
PROYECTO DE PROSPECTO. SIBELIUM CLORHIDRATO DE FLUNARIZINA Comprimidos
 PROYECTO DE PROSPECTO SIBELIUM CLORHIDRATO DE FLUNARIZINA Comprimidos Industria Brasileña Venta bajo receta Fórmula: Cada comprimido contiene: clorhidrato de flunarizina equivalente a 10 mg de base de
PROYECTO DE PROSPECTO SIBELIUM CLORHIDRATO DE FLUNARIZINA Comprimidos Industria Brasileña Venta bajo receta Fórmula: Cada comprimido contiene: clorhidrato de flunarizina equivalente a 10 mg de base de
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO
 ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos
 GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
GLUCEMIX VILDAGLIPTINA / METFORMINA Comprimidos recubiertos Industria Alemana EXPENDIO BAJO RECETA Nota importante: Antes de recetar este medicamento, consulte toda la información relativa a su prescripción.
Lea todo el prospecto detenidamente porque contiene información importante para usted.
 ENFRIESTOP Polvo para solución oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede obtenerse sin receta, para el tratamiento de afecciones
ENFRIESTOP Polvo para solución oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede obtenerse sin receta, para el tratamiento de afecciones
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica.
 DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
DORMID 15mg/3ml MIDAZOLAM5mg/ml Solucióninyectable IndustriaHolandesa Ventabajorecetaarchivada Estemedicamentodebeserusadoexclusivamentebajoprescripciónyvigilanciamédicaynopuederepetirsesin nuevarecetamédica.
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC
 6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
FICHA TÉCNICA. Cada comprimido de TAMOXIFENO FUNK 10 mg Comprimidos contiene: Tamoxifeno citrato... 15,20 mg (equiv. a 10 mg base)
 1. DENOMINACIÓN DEL MEDICAMENTO TAMOXIFENO FUNK 10 mg Comprimidos TAMOXIFENO FUNK 20 mg Comprimidos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de TAMOXIFENO FUNK 10 mg Comprimidos
1. DENOMINACIÓN DEL MEDICAMENTO TAMOXIFENO FUNK 10 mg Comprimidos TAMOXIFENO FUNK 20 mg Comprimidos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de TAMOXIFENO FUNK 10 mg Comprimidos
FICHA TÉCNICA. 1. DENOMINACIÓN DEL MEDICAMENTO Actonel 30 mg comprimidos recubiertos con película
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Actonel 30 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 30 mg de risedronato
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Actonel 30 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 30 mg de risedronato
El abdomen péndulo se presenta con frecuencia (Figura 5-8).
 Sección 5. HIPERADRENOCORTICISMO Endocrinología para el clínico de pequeños animales Signos Clínicos La poliuria, la polidipsia y la polifagia son los signos clínicos más comunes y resultan, al menos en
Sección 5. HIPERADRENOCORTICISMO Endocrinología para el clínico de pequeños animales Signos Clínicos La poliuria, la polidipsia y la polifagia son los signos clínicos más comunes y resultan, al menos en
Prospecto: información para el usuario. Cedax 400 mg cápsulas duras Ceftibuteno
 Prospecto: información para el usuario Cedax 400 mg cápsulas duras Ceftibuteno Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Cedax 400 mg cápsulas duras Ceftibuteno Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Titular del Registro Sanitario, país: Centro de Inmunología Molecular, Cuba.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CIMAher (Nimotuzumab) Forma farmacéutica: Fortaleza: Presentación: Inyección IV. 5 mg/ml. Estuche con 4 bulbos por 10 ml. Titular del Registro
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CIMAher (Nimotuzumab) Forma farmacéutica: Fortaleza: Presentación: Inyección IV. 5 mg/ml. Estuche con 4 bulbos por 10 ml. Titular del Registro
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
LIDALTRIN 5 mg comprimidos recubiertos con película Quinapril
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico. Este medicamento
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto. Puede tener que volver a leerlo. Si tiene alguna duda, consulte a su médico o farmacéutico. Este medicamento
Grupo Nº 18: Otorrinolaringología Contenido
 Grupo Nº 18: Otorrinolaringología Contenido Grupo Nº 18: Otorrinolaringología... 2 BUDESONIDA... 2 CINARIZINA... 2 CLORFENAMINA COMPUESTA... 2 DIFENIDOL... 3 FENILEFRINA... 3 MOMETASONA... 4 NEOMICINA,
Grupo Nº 18: Otorrinolaringología Contenido Grupo Nº 18: Otorrinolaringología... 2 BUDESONIDA... 2 CINARIZINA... 2 CLORFENAMINA COMPUESTA... 2 DIFENIDOL... 3 FENILEFRINA... 3 MOMETASONA... 4 NEOMICINA,
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES
 DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
FICHA TÉCNICA. NORPROLAC 75 microgramos comprimidos
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NORPROLAC 25-50 microgramos comprimidos NORPROLAC 75 microgramos comprimidos 1. NOMBRE DEL MEDICAMENTO NORPROLAC 25-50 microgramos
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NORPROLAC 25-50 microgramos comprimidos NORPROLAC 75 microgramos comprimidos 1. NOMBRE DEL MEDICAMENTO NORPROLAC 25-50 microgramos
LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA
 LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA Se identifican diversos síntomas atípicos de la primo infección, algunos de ellos graves, aunque poco frecuentes Nota:
LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA Se identifican diversos síntomas atípicos de la primo infección, algunos de ellos graves, aunque poco frecuentes Nota:
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Caelyx 2 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml de
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Caelyx 2 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml de
VITRIFICACIÓN DE ÓVULOS (OVOCITOS)
 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 1 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 2 Es una técnica que se considera un procedimiento experimental, destinada a conservar gametos femeninos con fines reproductivos,
VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 1 VITRIFICACIÓN DE ÓVULOS (OVOCITOS) 2 Es una técnica que se considera un procedimiento experimental, destinada a conservar gametos femeninos con fines reproductivos,
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
1. NOMBRE DEL MEDICAMENTO. ALOPEXY 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO ALOPEXY 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 50 mg de minoxidil. Excipiente con efecto conocido: 500 mg/ml de propilenglicol.
1. NOMBRE DEL MEDICAMENTO ALOPEXY 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de solución contiene 50 mg de minoxidil. Excipiente con efecto conocido: 500 mg/ml de propilenglicol.
FICHA TÉCNICA. No hay ninguna advertencia o precaución en su empleo que merezca la pena destacar.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Foli-doce 400/2 microgramos comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: Acido fólico: 400 microgramos, Cianocobalamina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Foli-doce 400/2 microgramos comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: Acido fólico: 400 microgramos, Cianocobalamina
Cáncer de cuello uterino PREVENCIÓN. Dra Alicia Aleman Prof Ag. Departamento de Medicina Preventiva y Social Facultad de Medicina- UdelaR
 Cáncer de cuello uterino PREVENCIÓN Dra Alicia Aleman Prof Ag. Departamento de Medicina Preventiva y Social Facultad de Medicina- UdelaR Montevideo, julio 2012 De que hablaremos Algunos aspectos anatómicos
Cáncer de cuello uterino PREVENCIÓN Dra Alicia Aleman Prof Ag. Departamento de Medicina Preventiva y Social Facultad de Medicina- UdelaR Montevideo, julio 2012 De que hablaremos Algunos aspectos anatómicos
PROSPECTO: INFORMACIÓN PARA EL USUARIO VIRLIX 10 mg comprimidos recubiertos con película Cetirizina dihidrocloruro
 PROSPECTO: INFORMACIÓN PARA EL USUARIO VIRLIX 10 mg comprimidos recubiertos con película Cetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Este medicamento
PROSPECTO: INFORMACIÓN PARA EL USUARIO VIRLIX 10 mg comprimidos recubiertos con película Cetirizina dihidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Este medicamento
Prospecto: información para el usuario Lacovin 20 mg/ml solución cutánea Minoxidil
 Prospecto: información para el usuario Lacovin 20 mg/ml solución cutánea Minoxidil Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Lacovin 20 mg/ml solución cutánea Minoxidil Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes Código ATC: L01A X03.
 1. NOMBRE DEL PRINCIPIO ACTIVO TEMOZOLOMIDA 2. VIA DE ADMINISTRACION VIA ORAL 3. PROPIEDADES FARMACOLOGICAS Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes Código ATC: L01A
1. NOMBRE DEL PRINCIPIO ACTIVO TEMOZOLOMIDA 2. VIA DE ADMINISTRACION VIA ORAL 3. PROPIEDADES FARMACOLOGICAS Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes Código ATC: L01A
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Hirudoid 3 mg/g gel Condroitina sulfato de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Hirudoid 3 mg/g gel Condroitina sulfato de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO Hirudoid 3 mg/g gel Condroitina sulfato de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
Prospecto: información para el usuario diarfin 2 mg cápsulas duras loperamida hidrocloruro
 Prospecto: información para el usuario diarfin 2 mg cápsulas duras loperamida hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
Prospecto: información para el usuario diarfin 2 mg cápsulas duras loperamida hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante
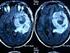
Presentado por Karla Franco Residente de Radioterapia Oncológica Fundación Marie Curie
 Presentado por Karla Franco Residente de Radioterapia Oncológica Fundación Marie Curie Glioblastoma Tumor primario SNC frecuencia Principalmente de 60 años Median survival 1 año RT-QT Temozolamida: standard
Presentado por Karla Franco Residente de Radioterapia Oncológica Fundación Marie Curie Glioblastoma Tumor primario SNC frecuencia Principalmente de 60 años Median survival 1 año RT-QT Temozolamida: standard
Prospecto: información para el usuario. Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro
 Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Utabon Niños 0,25 mg/ml gotas nasales en solución Oximetazolina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Transfusión de sangre
 Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
FICHA TÉCNICA. Neurontin está indicado en el tratamiento del dolor neuropático.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO NEURONTIN 300 mg cápsulas NEURONTIN 400 mg cápsulas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Neurontin 300: cada cápsula contiene 300 mg de gabapentina Neurontin
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO NEURONTIN 300 mg cápsulas NEURONTIN 400 mg cápsulas 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Neurontin 300: cada cápsula contiene 300 mg de gabapentina Neurontin
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
EchinaMed Junior, comprimidos
 EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
TRAMADOL LANALGET 100 mg comprimidos de liberación prolongada EFG
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo - Si tiene alguna duda, consulte a su médico o farmacéutico - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo - Si tiene alguna duda, consulte a su médico o farmacéutico - Este
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Protocolo para el uso de ácido fluorídrico (HF) en solución acuosa en la Plataforma Nanoquim
 Protocolo para el uso de ácido fluorídrico (HF) en solución acuosa en la Plataforma Nanoquim Redacción: Edgar León Revisión: Neus Romà y Enrique Irisarri Validación: Teresa Puig Septiembre 2013 PROTOCOLO
Protocolo para el uso de ácido fluorídrico (HF) en solución acuosa en la Plataforma Nanoquim Redacción: Edgar León Revisión: Neus Romà y Enrique Irisarri Validación: Teresa Puig Septiembre 2013 PROTOCOLO
SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg
 SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
Prospecto: información para el usuario. Gabapentina KERN PHARMA 300 mg cápsulas duras EFG
 Prospecto: información para el usuario Gabapentina KERN PHARMA 300 mg cápsulas duras EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Gabapentina KERN PHARMA 300 mg cápsulas duras EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
FICHA TÉCNICA. STREPSILS pastillas para chupar sabor miel y limón
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
Prospecto: Información para el usuario. Ácidos omega 3 TARBIS 1.000 mg cápsulas blandas EFG Ésteres etílicos de ácidos grasos omega-3 al 90%
 Prospecto: Información para el usuario Ácidos omega 3 TARBIS 1.000 mg cápsulas blandas EFG Ésteres etílicos de ácidos grasos omega-3 al 90% Lea todo el prospecto detenidamente antes de empezar a tomar
Prospecto: Información para el usuario Ácidos omega 3 TARBIS 1.000 mg cápsulas blandas EFG Ésteres etílicos de ácidos grasos omega-3 al 90% Lea todo el prospecto detenidamente antes de empezar a tomar
TEMA 12 LA VALORACIÓN Y TRATAMIENTO DEL ESTADO NUTRICIONAL EN LOS PACIENTES CON CÁNCER: ANOREXIA, PÉRDIDA DE PESO Y CAQUEXIA
 TEMA 12 LA VALORACIÓN Y TRATAMIENTO DEL ESTADO NUTRICIONAL EN LOS PACIENTES CON CÁNCER: ANOREXIA, PÉRDIDA DE PESO Y CAQUEXIA OBJETIVOS DE APRENDIZAJE DESPUES DE ESTUDIAR ESTE TEMA SE DEBEN: IDENTIFICAR
TEMA 12 LA VALORACIÓN Y TRATAMIENTO DEL ESTADO NUTRICIONAL EN LOS PACIENTES CON CÁNCER: ANOREXIA, PÉRDIDA DE PESO Y CAQUEXIA OBJETIVOS DE APRENDIZAJE DESPUES DE ESTUDIAR ESTE TEMA SE DEBEN: IDENTIFICAR
REACTINE Cetirizina 10 mg comprimidos recubiertos con película
 PROSPECTO: INFORMACIÓN PARA EL USUARIO REACTINE Cetirizina 10 mg comprimidos recubiertos con película Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento Este medicamento puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO REACTINE Cetirizina 10 mg comprimidos recubiertos con película Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento Este medicamento puede
FOLLETO DE INFORMACIÓN AL PROFESIONAL DEBRIDAT COMPRIMIDOS RECUBIERTOS 100 mg
 FOLLETO DE INFORMACIÓN AL PROFESIONAL DEBRIDAT COMPRIMIDOS RECUBIERTOS 100 mg 1. NOMBRE(S) DEL PRODUCTO MEDICINAL DEBRIDAT COMPRIMIDOS RECUBIERTOS 100 mg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FOLLETO DE INFORMACIÓN AL PROFESIONAL DEBRIDAT COMPRIMIDOS RECUBIERTOS 100 mg 1. NOMBRE(S) DEL PRODUCTO MEDICINAL DEBRIDAT COMPRIMIDOS RECUBIERTOS 100 mg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERITROMICINA 125 mg/5 ml POLVO PARA SUSPENSION ANTIHISTAMINICO Página 1 ERITROMICINA 125 mg/5 ml Polvo Para Suspensión
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERITROMICINA 125 mg/5 ml POLVO PARA SUSPENSION ANTIHISTAMINICO Página 1 ERITROMICINA 125 mg/5 ml Polvo Para Suspensión
Prospecto: información para el usuario. FUNGAREST 20 mg/g crema ketoconazol
 Prospecto: información para el usuario FUNGAREST 20 mg/g crema ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
Prospecto: información para el usuario FUNGAREST 20 mg/g crema ketoconazol Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
