11 Número de publicación: Int. Cl.: 74 Agente: Carpintero López, Francisco
|
|
|
- María Concepción Padilla Robles
- hace 8 años
- Vistas:
Transcripción
1 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: Int. Cl.: A61K 33/00 (06.01) A61K 33/ (06.01) A61K 4/06 (06.01) A61K 33/08 (06.01) A61K 31/42 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: Fecha de presentación : Número de publicación de la solicitud: Fecha de publicación de la solicitud: Título: Procedimientos y composiciones para prevenir y tratar ardor de estómago. Prioridad: US 2769 P GB Titular/es: Merck & Co., Inc. 126 East Lincoln Avenue Rahway, New Jersey 0706, US McNeil-PPC, Inc. 4 Fecha de publicación de la mención BOPI: Inventor/es: Korn, Scott, H.; McNally, Gerard, P.; Luber, Joseph, R. y Ells, Tom, S. 4 Fecha de la publicación del folleto de la patente: Agente: Carpintero López, Francisco ES T3 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. Pº de la Castellana, Madrid
2 ES T3 DESCRIPCIÓN Procedimientos y composiciones para prevenir y tratar ardor de estómago. 1 2 Antecedentes de la invención El ardor de estómago o pirosis, es una sensación de dolor o ardor localizada subesternalmente o más arriba en el epigastrio con radiación en el cuello y ocasionalmente en los brazos, asociada a la regularización de ácido péptido de jugo gástrico en el esófago. El ardor de estómago ocasional es común en las personas normales, pero el ardor de estómago frecuente y grave es generalmente una manifestación de la disfunción del esófago. El ardor de estómago se puede producir por actividad motora anormal o distensión del reflujo esofágico, o irritación de la mucosa esofágica (esofagitis). El ardor de estómago está muy a menudo asociado a reflujo gastroesofágico. En este escenario, el ardor de estómago típicamente se produce después de una comida, con paradas o flexiones, o cuando el paciente está en estado supino. Puede estar acompañado de la aparición espontánea en la boca de fluido que puede ser, salado, agrio, o amargo y verde o amarillo. El ardor de estómago puede surgir después de la ingestión de ciertos alimentos (por ejemplo zumos de frutas cítricos) o fármacos (por ejemplo alcohol o aspirina). La esofagitis de reflujo consta de daño mucosal esofágico que se produce por el reflujo de contenidos gástricos o intestinales en el esófago. la esofagitis, una inflamación del esófago a partir de la regurgitación de contenido gástrico ácido, que produce dolor subesternal, se desarrolla cuando las defensas de la mucosa que normalmente neutralizan el efecto de agentes dañinos en la mucosa esofágica sucumben al ataque de la pepsina ácida o bilis de reflujo. La esofagitis suave muestra cambios microscópicos de la infiltración mucosal con granulocitos o eosinófilos, hiperplasia y células basales, y elongación de piquetes dérmicos. La esofagitis erosiva muestra daño endoscópicamente visible a la mucosa en la forma de enrojecimiento notable, friabilidad, sangrado, úlceras lineales superficiales, y exudados. Los antagonistas conocidos del receptor H 2 de histamina incluyen, cimetidina, ranitidina, nizatidina, y famotidina. La famotidina (disponible de Mecrk y Co., Inc. Whitehouse Station, NJ, bajo el nombre PEPCID ), es 3-{{{2- [(aminoiminometil)amino]-4-tiazolil]metil]tio]-n-(aminosulfonil)propanimidamida, que tiene la fórmula estructural: La principal actividad farmacológica clínicamente importante de la famotidina es la inhibición de la secreción gástrica. Tanto la concentración de ácido como el volumen de la secreción gástrica se reducen por la famotidina. La famotidina se usa para tratar trastornos relacionados con ácido tales como úlcera gástrica y duodenal, enfermedad de reflujo gastroesofágico y síndrome de Zollinger Ellison. Su seguridad y eficacia se han establecido bien en estudios clínicos controlados. Es usado por más de 31 millones de pacientes en todo el mundo. Gitlin y col., Amer. Journal of Gastroenterology (198) vol. 80 p. 8 examina la eficacia de famotidina en el tratamiento de úlceras duodenales activas. mg dos veces al día y mg a la hora de acostarse se administraron durante un período de cuatro semanas. Se observaron tasas de curación de 67, 7, 70%, respectivamente. De manera similar, Miyoshi y col., Naike Ocán (1987) col. 34 p demuestra la eficacia de la famotidina como una terapia de gastritis. Miyoshi y col., evaluaron los regímenes de dosificación de,, o mg dos veces al día en el tratamiento del alivio del síntoma de gastritis. Los pacientes tratados con a mg de famotidina tienen pocas erosiones y hemorragias mucosales que los tratados con mg de famotidina. McCallum y col., Dig. Dis. Sci. (198) vol. p describe un estudio de pacientes sanos que demuestran que mg de famotidina producen un efecto en la secreción de ácido gástrico. Laskin y col., J. Clin. Pharamcol. (1993) vol. 33 p describe un estudio que demuestra que dosis individuales de y mg de famotidina produce disminuciones estadísticamente significativas en la acidez intragástrica, comenzando a 90-0 minutos y persistiendo durante aproximadamente 9 horas. La administración de antagonistas de H 2 antes de la ingestión de una comida que induce ardor de estómago puede reducir al cantidad de ácido gástrico producido y evitar los síntomas del ardor de estómago. Sin embargo, los antagonistas de H 2 no neutralizan el ácido gástrico, y la aparición del efecto antisecretor de de los antagonistas de H 2 no es instantánea. Por lo tanto, la administración de un antagonista de H 2 después de una comida no evitará sustancialmente el ardor de estómago y síntomas relacionados. Los antiácidos se sabe que neutralizan el ácido en el estómago y puede también actuar localmente en el esófago distal. Los antiácidos no se sabe que eviten el ardor de estómago cuando se toman antes de alimentos o bebidas que pueden provocar los síntomas. 2
3 ES T Wolfe, patente de Estados Unidos Nº , describe las composiciones y procedimientos que requieren la administración simultánea de un antagonista de H 2 con un antiácido que proporciona alivio de dolor, malestar y síntomas asociados a ardor de estómago episódicos el documento EP 138 describe las composiciones orales que contienen cimetidina y gel cosecado de carbonato - hidróxido de magnesio para tratar úlcera duodenal, gástrica, recurrente y de estómago, y esofagitis de reflujo. El documento EP describe las composiciones efervescentes que contienen cimetidina y bicarbonato de sodio para tratar úlceras duodenales y gástricas. El EP describe las composiciones que contienen cimetidina, gel de hidróxido de aluminio, e hidróxido de magnesio, para tratar ulceración duodenal, gástrica, recurrente y de estómago, y esofagitis de reflujo. El documento EP describen composiciones que contienen cimetidina, gel de hidróxido de aluminio e hidróxido de aluminio, para tratar ulceración duodenal, gástrica, recurrente y de estómago, y esofagitis de reflujo. El antiácido se describe por proporcionar alivio rápido de los síntomas de exceso de acidez de estómago neutralizándole ácido y la cimetidina se describe por llevar alivio más sostenido en la inhibición de la secreción de ácido. El documento WO 92/002 describe la coadminsitración de antagonistas de H 2 con antiácidos para tratar trastornos gástricos tales como hiperacidez. El documento WO 93/12779 describe las composiciones de antagonistas de H 2 con antiácidos para tratar trastornos gástricos tales como hiperacidez. El documento EP 0 72 describe las composiciones de famotidina con antiácidos para tratar aflicción gastrointestinal. Los solicitantes han encontrado ahora que la administración a un paciente de una composición que comprende un antagonista de H 2 y antiácido, después de un episodio que induce ardor de estómago tal como un consumo por ele paciente de un alimento o bebida que induce ardor de estómago, pero antes de desarrollar ardor de estómago, es un medio eficaz para prevenir ardor de estómago o reducir la frecuencia y gravedad de ardor de estómago postprnadial. Los solicitantes han encontrado que las composiciones que comprenden mg de famotidina y 21 meq de de capacidad neutralizante de ácido del antiácido son eficaces para prevenir y tratar los síntomas de ardor de estómago. Sumario de la invención La invención incluye un tratamiento para prevenir episodios de ardor de estómago en un paciente con riesgo de desarrollar ardor de estómago, que comprende la administración a un paciente, después del episodio que induce ardor de estómago pero antes de desarrollar ardor de estómago, de una composición que comprende una cantidad terapéuticamente eficaz de famotidina y una cantidad de antiácido que tiene 21 meq de capacidad neutralizadora de ácido (ANC). La invención es también una composición que comprende mg de famotidina y una cantidad de antiácido de 21 meq de AND. La invención también es un tratamiento para los síntomas de ardor de estómago en un paciente que comprende la administración al paciente de una cantidad eficaz de una composición que comprende mg de famotidina y una cantidad de antiácido de 21 meq de ANC. Descripción detallada de la invención 4 0 La invención incluye tratamientos para prevenir, reducir la frecuencia y gravedad de, evitar los síntomas asociados a, y reducir el riesgo de episodios de ardor de estómago en un paciente con riesgo de desarrollar ardor de estómago, que comprende la administración al paciente, después del episodio que induce ardor de estómago pero antes de desarrollar ardor de estómago, de una composición que comprende una cantidad farmacéuticamente eficaz de famotidina y una cantidad de antiácido que tiene 21 meq de ANC. Estos tratamientos son eficaces para prevenir los síntomas relacionados con el ardor de estómago como indigestión de ácidos y estómago agrio. En una clase de tratamientos, el episodio que induce ardor de estómago es ingestión de una comida que estimula la secreción de ácido gástrico. El antagonista de H 2 es famotidina. La cantidad de antiácido tiene 21 de ANC. La cantidad de famotidina es mg. La invención también incluye un tratamiento para los síntomas de ardor de estómago en un paciente que comprende la administración al paciente de una cantidad farmacéuticamente eficaz de una composición que comprende mg de famotidina y una cantidad de antiácido que tiene 21 meq de ANC. La invención también incluye composiciones que comprenden mg de famotidina y una cantidad de antiácido que tiene 21 meq de ANC. La composición está en la forma de un comprimido masticable, la cantidad de famotidina es mg, y la cantidad de antiácido es 21 meq de ANC. 6 Las composiciones están en la forma de un comprimido administrado después del episodio que induce ardor de estómago, muestran una aparición más rápida de alivio que los antagonistas de H 2 solos, y una mayor duración de alivio que el antiácido. La duración de la acción de antagonista de H 2 es al menos igual que una cantidad comparable de antagonista de H 2 administrada sin antiácido. El término prevención de los episodios de ardor de estómago significa síntomas de exclusión, o reducción de la gravedad de los síntomas, asociados al ardor de estómago en pacientes susceptibles de ardor de estómago después de la ingestión de un alimento o bebida que induce ardor de estómago. 3
4 ES T3 El término exclusión de síntomas significa que hace la experiencia de los síntomas imposible o ampliamente ineficaces eliminando las condiciones necesarias para ellos El término reducción de la frecuencia y gravedad de ardor de estómago postprandial significa que reduce sustancialmente el grado de dolor asociado a síntomas de ardor de estómago que se producirían de manera ordinaria en pacientes susceptibles de ardor de estómago después de la ingestión de un alimento o bebida que induce ardor de estómago. El término reducción del riesgo de episodios de ardor de estómago significa que reduce sustancialmente la tendencia de los pacientes susceptibles al ardor de estómago, después de la ingestión de un alimento o bebida que induce ardor de estómago, para experimentar los síntomas asociados a ardor de estómago después de la ingestión de un alimento o bebida que induce ardor de estómago. El término episodio de inducción de ardor de estómago incluye la experiencia por el paciente asociada a la estimulación de secreción de ácido gástrico y desarrollo de síntomas de ardor de estómago, tal como estrés o ingestión de de una comida que estimula la secreción de ácido gástrico. El término alimento o bebida que induce ardor de estómago incluye alimentos y bebidas asociadas comúnmente a ardor de estómago en pacientes susceptibles a episodios de ardor de estómago inducidos por alimento o bebida, por ejemplo tomates, vino tinto, zumo de cítricos, etc. Para los propósitos de descripción de la invención el término comida de aquí en adelante se ha de entender que significa alimento y/o bebida que induce ardor de estómago. El grado de dolor de ardor de estómago asociado a la ingestión de tales alimentos individuales y con tipos de alimentos. De este modo, algunos individuos pueden ser más sensibles a ciertos alimentos que inducen ardor de estómago que otros individuos. Sin embargo, a tendencia para un individuo dado a la experiencia de ardor de estómago en respuesta a la ingestión de un alimento o bebida particular es predecible y el individuo es capaz de determinar, antes de la ingestión, qué alimento o bebida inducirá síntomas de ardor de estómago. Un paciente susceptible a sufrir episodios de ardor de estómago después de la ingestión de alimento o bebida que induce ardor de estómago significa cualquier paciente que experimenta ordinariamente síntomas de ardor de estómago provocados por la ingestión de alimento o bebida que induce ardor de estómago. Los antiácidos adecuados para la presente invención son hidróxido de magnesio combinado con carbonato de calcio. El antagonista de H 2 adecuado para los tratamientos de la invención para prevenir ardor de estómago es la famotidina. Una cantidad adecuada de famotidina es mg. En las composiciones de la invención, una cantidad de aminoácido de 21 meq de ANC proporciona prevención y alivio terapéutico inmediato necesario para la prevención y tratamiento eficaz de síntomas de ardor de estómago. Los antiácidos tienen valores de ANC teóricos conocidos (por ejemplo, el ANC del carbonato de calcio es 0,0 meq/mg, y de hidróxido de magnesio es 0,343 meq/mg - véase la Farmacopea de Estados Unidos USP 23 NF 18, página 1732 que describe un ensayo para medir la capacidad de neutralización de ácido de las sustancias de ensayo), y la determinación de la cantidad de un antiácido especificado requerida para proporcionar un ANC especificado que se puede hacer fácilmente por una persona experta en la técnica. Las composiciones también pueden contener vehículos farmacéuticamente aceptables. Las composiciones se formulan para administración oral en forma sólida, como comprimidos masticables. De este modo las combinaciones se pueden formular mediante mezcla con vehículos farmacéuticamente aceptables que contienen adicionalmente, según se desee, adyuvantes farmacéuticamente aceptables que incluyen espesantes, conservantes, agentes colorantes, agentes aromatizantes y edulcorantes, por ejemplo, ciclamato y sacarina. Las formulaciones en polvo se pueden preparar mediante la mezcla en seco de ingredientes de temperatura y humedad controlada que usa equipo convencional. Las composiciones están en la forma de comprimidos masticables que se disgregan rápidamente en la boca cuando se mastican. Tales comprimidos se pueden preparar mediante tecnología conocida en la técnica, incluyendo, por ejemplo, los procedimientos para preparar comprimidos con capas de barrera, tales como los descritos en la publicación de patente europea Nº Tal tecnología es eficaz para enmascarar el sabor amargo asociado a antagonistas de H 2. En el ejemplo mostrado más adelante, se prepararon los comprimidos que comprenden famotidina y antiácido, y las cantidades de ingredientes inactivos tales como aglutinantes, por ejemplo, dextratos y almidón pergelatinizado., aromas, lubricantes, por ejemplo estearato de magnesio, colorantes, por ejemplo, óxido férrico rojo, adulcorante, por ejemplo, azúcar de pastelero, excipiente de granulación, por ejemplo, lactosa hídrica e hidroxi metil celulosa, revestimiento de partículas tal como celulosa acetato e hidroxi propil celulosa, y agentes humectantes, por ejemplo lauril sulfato sódico suficiente para preparar un comprimido farmacéuticamente aceptable para la distribución de famotidina y antiácido activos. 4
5 ES T3 Ejemplo 1 1 Un comprimido masticable que incluye mg de famotidina, 800 mg de carbonato de calcio y 16 mg de hidróxido de magnesio (dichas cantidades de carbonato cálcico e hidróxido de magnesio proporcionan 21 meq de ANC) se preparó de la manera siguiente. Se preparó una rotorgranulación de famotidina sin revestir mediante la mezcla en seco de famotidina con diversos excipientes de granulación de acuerdo con el procedimiento esquematizado en la publicación de patente europea Nº Se mezcló un intermedio de granulación de famotidina rotorgranulado y revestido con una calidad directamente compresible de carbonato de calcio (DESTAB 9S, disponible de Particle Dynamics) y polvo de hidróxido de magnesio directamente compresible de, dextratos, granulación de azúcar de pastelero, color, aromas, y después se mezcló. Después se añadió estearato de magnesio al mezclador para formar la mezcla final. La mezcla lubricada se comprimió en comprimidos de una sola capa, de color rosa pálido redondas en una herramienta apropiada. La siguiente tabla enumera los ingredientes y cantidades específicas que se usaron para preparar, de acuerdo con el procedimiento anterior, una composición farmacéutica que comprende famotidina y antiácido. mg/comprimido % seco mg/comprimido 2 3 Azúcar de pastelero 136,70 Dextratos 00,00 Famotidina revestida 86, Granulación Famotidina 11,7,00 Excipientes 76,4 Pipermín 11,00 Crema internacional N y A 2,0 Hidróxido de magnesio 168, Polvo DC Rosa Colorante 27,70 Carbonato de calcio (DESTAB 9S, Particle Dynamics) 842, Estearato de magnesio,1 Peso de comprimido total 1780,00 mg 4 Ejemplo comparativo 2 Se sigue el procedimiento del ejemplo 1, usando 3 mg de hidróxido de magnesio y 10 mg de carbonato de calcio, para proporcionar un comprimido masticable de famotidina/antiácido que tiene 42 de ANC. 0 Ejemplo comparativo 3 Se prepara un comprimido no masticable que tiene la siguiente composición: mg 6 Famotidina,0 Hidróxido de magnesio 16,0 Carbonato de calcio 800,0 Estearato de magnesio,0 Almidón pregelatinizado,0 Carboximetilcelulosa 0,0 Se mezclan y se granulan famotidina, hidróxido de magnesio, carbonato de calcio, carboximetil celulosa, y parte del almidón. Se tamiza la granulación resultante, se seca y se mezcla con el resto del almidón de maíz y el estearato de magnesio. La granulación resultante se comprime después en comprimidos.
6 ES T3 Ejemplo comparativo 4 Se prepara un comprimido no masticable que tiene la siguiente composición: mg 1 Granulación de famotidina revestida 86,4 Hidróxido de magnesio 16,0 Carbonato de calcio 800,0 Estearato de magnesio,0 Almidón pregelatinizado,0 Carboximetilcelulosa 0,0 Se mezclan y se granulan granulación de famotidina revestida (usada en el ejemplo 1), hidróxido de magnesio, carbonato de calcio, carboximetil celulosa, y parte del almidón. Se tamiza la granulación resultante, se seca y se mezcla con el resto del almidón de maíz y el estearato de magnesio. La granulación resultante se comprime después en comprimidos. Ejemplo comparativo 2 3 Se prepara un comprimido no masticable que tiene la siguiente composición: mg Famotidina,0 Hidróxido de magnesio 3,0 Carbonato de calcio 10,0 Estearato de magnesio,0 Almidón pregelatinizado,0 Carboximetilcelulosa 0,0 Se mezclan y se granulan famotidina, hidróxido de magnesio, carbonato de calcio, carboximetil celulosa, y parte del almidón. Se tamiza la granulación resultante, se seca y se mezcla con el resto del almidón de maíz y el estearato de magnesio. La granulación resultante se comprime después en comprimidos. Ejemplo 6 4 A pacientes adultos varones y mujeres que tienen un historial de ardor de estómago, indigestión de ácido, o estómago agrio/indispuesto se les proporciona una comida de chile y vino de Burdeos. Los comprimidos preparados de acuerdo con el ejemplo 1 se administran a los pacientes después del consumo de la comida pero antes de desarrollar los síntomas de ardor de estómago, disminuyendo la posibilidad de ardor de estómago. 0 Ejemplo 7 A pacientes adultos varones y mujeres que tienen un historial de ardor de estómago, indigestión de ácido, o estómago agrio/indispuesto se les proporciona una comida de chile y vino de Burdeos. Los comprimidos preparados de acuerdo con el ejemplo 1 se administran a los pacientes después de desarrollar síntomas de ardor de estómago inducido por la comida, aliviando el dolor asociado al ardor de estómago. 6 6
7 ES T3 REIVINDICACIONES 1. Una composición farmacéutica masticable de una sola capa que comprende mg de famotidina, 800 mg de carbonato de calcio y 16 mg de hidróxido de magnesio, donde la famotidina se ha granulado en un rotor y revestido
11 knúmero de publicación: 2 150 566. 51 kint. Cl. 7 : A61K 38/26. k 72 Inventor/es: Dupre, John. k 74 Agente: Manresa Val, Manuel
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 150 566 51 kint. Cl. 7 : A61K 38/26 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 95917874.0
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 150 566 51 kint. Cl. 7 : A61K 38/26 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 95917874.0
11 knúmero de publicación: 2 138 197. 51 kint. Cl. 6 : A61K 7/06. k 72 Inventor/es: Navarro, Roger y. k 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 138 197 1 Int. Cl. 6 : A61K 7/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9914382.7 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 138 197 1 Int. Cl. 6 : A61K 7/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9914382.7 86 Fecha de presentación
11 Número de publicación: 2 286 694. 51 Int. Cl.: 72 Inventor/es: Bombardelli, Ezio. 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 286 694 1 Int. Cl.: A61K 36/00 (06.01) A61Q 19/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 286 694 1 Int. Cl.: A61K 36/00 (06.01) A61Q 19/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
11 knúmero de publicación: 2 164 849. 51 kint. Cl. 7 : A61K 9/14
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 164 849 1 kint. Cl. 7 : A61K 9/14 A61K 9/16 A61K 47/ 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 164 849 1 kint. Cl. 7 : A61K 9/14 A61K 9/16 A61K 47/ 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
51 Int. CI.: A61K 31/519 (2006.01) A61P 15/18 (2006.01) A61K 31/567 (2006.01) A61K 31/57 (2006.01) TRADUCCIÓN DE PATENTE EUROPEA.
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 432 378 1 Int. CI.: A61K 31/19 (06.01) A61P 1/18 (06.01) A61K 31/67 (06.01) A61K 31/7 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 432 378 1 Int. CI.: A61K 31/19 (06.01) A61P 1/18 (06.01) A61K 31/67 (06.01) A61K 31/7 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA
11 knúmero de publicación: 2 158 146. 51 kint. Cl. 7 : A61K 31/59
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 18 146 1 kint. Cl. 7 : A61K 31/9 //(A61K 31/9 A61K 31:12) 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 18 146 1 kint. Cl. 7 : A61K 31/9 //(A61K 31/9 A61K 31:12) 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
Un comprimido masticable contiene: 680 mg de carbonato cálcico y 80 mg de carbonato de magnesio.
 agencia española de medicamentos y productos sanitarios Rennie comprimidos masticables con sacarina 1. NOMBRE DEL MEDICAMENTO Rennie comprimidos masticables con sacarina 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
agencia española de medicamentos y productos sanitarios Rennie comprimidos masticables con sacarina 1. NOMBRE DEL MEDICAMENTO Rennie comprimidos masticables con sacarina 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
X-Plain La pancreatitis Sumario
 X-Plain La pancreatitis Sumario La pancreatitis es una enfermedad poco común que provoca la inflamación del páncreas. A pesar de ser una enfermedad poco común, casi 80,000 norteamericanos padecen de pancreatitis
X-Plain La pancreatitis Sumario La pancreatitis es una enfermedad poco común que provoca la inflamación del páncreas. A pesar de ser una enfermedad poco común, casi 80,000 norteamericanos padecen de pancreatitis
11 knúmero de publicación: 2 123 095. 51 kint. Cl. 6 : A63F 3/06. k 72 Inventor/es: Behm, William Frederick y. k 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 123 09 1 Int. Cl. 6 : A63F 3/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 942827.4 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 123 09 1 Int. Cl. 6 : A63F 3/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 942827.4 86 Fecha de presentación
11 Número de publicación: 2 321 587. 51 Int. Cl.: 72 Inventor/es: Kunigita, Hisayuki. 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 321 587 51 Int. Cl.: G06T 11/60 (2006.01) G06T 15/00 (2006.01) G06Q 30/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Número
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 321 587 51 Int. Cl.: G06T 11/60 (2006.01) G06T 15/00 (2006.01) G06Q 30/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Número
k 11 N. de publicación: ES 2 056 975 k 51 Int. Cl. 5 : C02F 1/66
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 06 97 k 1 Int. Cl. : C02F 1/66 A23L 1/4 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 892771.6 86
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 06 97 k 1 Int. Cl. : C02F 1/66 A23L 1/4 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 892771.6 86
11 knúmero de publicación: 2 152 305. 51 kint. Cl. 7 : A61K 31/575. k 72 Inventor/es: Purser, Douglas Barrie y
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 152 305 51 kint. Cl. 7 : A61K 31/575 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 94908213.5
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 152 305 51 kint. Cl. 7 : A61K 31/575 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 94908213.5
11 Número de publicación: 2 207 542. 51 Int. Cl. 7 : B23K 9/10. 72 Inventor/es: Mela, Franco. 74 Agente: Ponti Sales, Adelaida
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 207 542 51 Int. Cl. 7 : B23K 9/10 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00954462.8 86 Fecha de
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 207 542 51 Int. Cl. 7 : B23K 9/10 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00954462.8 86 Fecha de
11 knúmero de publicación: 2 163 122. 51 kint. Cl. 7 : B23K 26/12. k 72 Inventor/es: Faerber, Mark. k 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 163 122 1 Int. Cl. 7 : B23K 26/12 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9790148.9 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 163 122 1 Int. Cl. 7 : B23K 26/12 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9790148.9 86 Fecha de presentación:
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Esófago de Barrett Definición. Causas. Factores de riesgo
 Esófago de Barrett Definición El esófago de Barrett es un trastorno en el cual el color y la composición de las células del esófago inferior (el tubo que lleva el alimento desde la garganta hasta el estómago)
Esófago de Barrett Definición El esófago de Barrett es un trastorno en el cual el color y la composición de las células del esófago inferior (el tubo que lleva el alimento desde la garganta hasta el estómago)
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
k 11 N. de publicación: ES 2 038 643 k 51 Int. Cl. 5 : A61K 31/58
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 038 643 k 1 Int. Cl. : A61K 31/8 A61K 47/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 87114368.1
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 038 643 k 1 Int. Cl. : A61K 31/8 A61K 47/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 87114368.1
Coordinadora de Internado: Lic. Nora Huarachi A. Fecha de Rotación: 01 31 de octubre de 2014. Cochabamba Bolivia
 Universidad mayor de san simón Carrera Lic. En enfermería Programa Descentralizado - Aiquile Nombre y Apellido: María Lerins Angulo Maturano Docente Asistencial: Lic. Nora Luz Torrico Coordinadora de Internado:
Universidad mayor de san simón Carrera Lic. En enfermería Programa Descentralizado - Aiquile Nombre y Apellido: María Lerins Angulo Maturano Docente Asistencial: Lic. Nora Luz Torrico Coordinadora de Internado:
DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett
 DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett Qué es el esófago de Barrett? El esófago de Barrett es un estado precanceroso que afecta al revestimiento del esófago, el tubo que, al tragar, transporta
DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett Qué es el esófago de Barrett? El esófago de Barrett es un estado precanceroso que afecta al revestimiento del esófago, el tubo que, al tragar, transporta
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
11 Número de publicación: 2 267 932. 51 Int. Cl.: 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 267 932 1 Int. Cl.: A61Q 19/00 (06.01) A61K 8/44 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 267 932 1 Int. Cl.: A61Q 19/00 (06.01) A61K 8/44 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
La función de los IBP de venta sin receta médica
 La función de los IBP de venta sin receta médica Prospecto informativo para el paciente ID: 7129152 Dreamstime Sensación de ardor? Gusto amargo en la boca? Si padece estos síntomas, no está solo, millones
La función de los IBP de venta sin receta médica Prospecto informativo para el paciente ID: 7129152 Dreamstime Sensación de ardor? Gusto amargo en la boca? Si padece estos síntomas, no está solo, millones
k 11 N. de publicación: ES 2 046 714 k 51 Int. Cl. 5 : B60C 5/08 k 72 Inventor/es: Sicard, Alain k 74 Agente: Esteban Pérez-Serrano, M ā Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 046 714 1 Int. Cl. : BC /08 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 900164.1 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 046 714 1 Int. Cl. : BC /08 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 900164.1 86 Fecha de presentación
Int. Cl. 6 : A23L 1/06
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 112 794 21 k Número de solicitud: 919 1 k Int. Cl. 6 : A23L 1/06 A23L 1/8 k 12 SOLICITUD DE PATENTE A1 22 kfecha de presentación:.0.96
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 112 794 21 k Número de solicitud: 919 1 k Int. Cl. 6 : A23L 1/06 A23L 1/8 k 12 SOLICITUD DE PATENTE A1 22 kfecha de presentación:.0.96
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Int. Cl.: 72 Inventor/es: Ortubai Balanzategui, Kristina. 74 Agente: Carvajal y Urquijo, Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 279 19 1 Int. Cl.: A63F 3/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 0378144.4 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 279 19 1 Int. Cl.: A63F 3/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 0378144.4 86 Fecha
Prospecto: Información para el usuario
 Prospecto: Información para el usuario Gaviscon suspensión oral sabor menta Alginato de sodio, bicarbonato (hidrógenocarbonato) de sodio y carbonato de calcio Lea todo el prospecto detenidamente antes
Prospecto: Información para el usuario Gaviscon suspensión oral sabor menta Alginato de sodio, bicarbonato (hidrógenocarbonato) de sodio y carbonato de calcio Lea todo el prospecto detenidamente antes
PANCREATITIS CRÓNICA
 PANCREATITIS CRÓNICA DEFINICION: Es una enfermedad que se caracteriza por la presencia de lesiones inflamatorias crónicas en el páncreas, las cuales conducen a la destrucción y fibrosis del parénquima
PANCREATITIS CRÓNICA DEFINICION: Es una enfermedad que se caracteriza por la presencia de lesiones inflamatorias crónicas en el páncreas, las cuales conducen a la destrucción y fibrosis del parénquima
11 knúmero de publicación: 2 141 353. 51 kint. Cl. 6 : F16H 37/04. Número de solicitud europea: 95919718.7 86 kfecha de presentación : 12.05.
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 141 33 1 kint. Cl. 6 : F16H 37/04 F16H 7/02 B2J 18/00 B2J 9/ H02K 7/116 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 141 33 1 kint. Cl. 6 : F16H 37/04 F16H 7/02 B2J 18/00 B2J 9/ H02K 7/116 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número
Tratamiento farmacológico de los trastornos mentales en la atención primaria de salud. Organización Mundial de la Salud
 Tratamiento farmacológico de los trastornos mentales en la atención primaria de salud Organización Mundial de la Salud Capítulo 1 Medicamentos esenciales para los trastornos mentales 1 1.1 El Informe sobre
Tratamiento farmacológico de los trastornos mentales en la atención primaria de salud Organización Mundial de la Salud Capítulo 1 Medicamentos esenciales para los trastornos mentales 1 1.1 El Informe sobre
VPH. (Virus del Papiloma Humano) Respuestas a sus preguntas sobre el VPH y cómo se trata
 VPH (Virus del Papiloma Humano) Respuestas a sus preguntas sobre el VPH y cómo se trata Qué es el VPH? VPH significa Virus del Papiloma Humano. Es un virus que está en la piel y en ocasiones produce verrugas.
VPH (Virus del Papiloma Humano) Respuestas a sus preguntas sobre el VPH y cómo se trata Qué es el VPH? VPH significa Virus del Papiloma Humano. Es un virus que está en la piel y en ocasiones produce verrugas.
Prospecto: información para el usuario
 Prospecto: información para el usuario HIBITANE 5mg/5mg Comprimidos para chupar sabor mentol Clorhexidina dihidrocloruro/benzocaína Lea todo el prospecto detenidamente porque contiene información importante
Prospecto: información para el usuario HIBITANE 5mg/5mg Comprimidos para chupar sabor mentol Clorhexidina dihidrocloruro/benzocaína Lea todo el prospecto detenidamente porque contiene información importante
Índice de contenidos DESCRIPCIÓN GENERAL. Bicarbonato de Sodio (Por vía oral)
 Bicarbonato de Sodio (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El bicarbonato de
Bicarbonato de Sodio (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El bicarbonato de
COMPOSICIÓN ANGILEPTOL. Sabor Menta Comprimidos
 COMPOSICIÓN ANGILEPTOL Sabor Menta Comprimidos Cada comprimido contiene: Principios activos: Clorhexidina (D.C.I) HCl... 5 mg Benzocaína (D.C.I.)... 4 mg Enoxolona (D.C.I.)... 3 mg Excipientes: Sorbitol
COMPOSICIÓN ANGILEPTOL Sabor Menta Comprimidos Cada comprimido contiene: Principios activos: Clorhexidina (D.C.I) HCl... 5 mg Benzocaína (D.C.I.)... 4 mg Enoxolona (D.C.I.)... 3 mg Excipientes: Sorbitol
11 kn. de publicación: ES 2 039 281. 51 kint. Cl. 5 : A61K 31/19
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 039 281 1 kint. Cl. : A61K 31/19 A61K 9/ 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 886211.9 86
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 039 281 1 kint. Cl. : A61K 31/19 A61K 9/ 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 886211.9 86
11 Número de publicación: 2 265 862. 51 Int. Cl.: 72 Inventor/es: Pastorino, Giorgio. 74 Agente: Espiell Volart, Eduardo María
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 265 862 51 Int. Cl.: B05D 7/14 (2006.01) B05D 7/22 (2006.01) B05D 5/08 (2006.01) F28F 19/04 (2006.01) 12 TRADUCCIÓN DE PATENTE
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 265 862 51 Int. Cl.: B05D 7/14 (2006.01) B05D 7/22 (2006.01) B05D 5/08 (2006.01) F28F 19/04 (2006.01) 12 TRADUCCIÓN DE PATENTE
ES 2 196 968 A1 A23L 1/318 A23L 1/315 A22C 11/00. Número de publicación: 2 196 968 PATENTES Y MARCAS. Número de solicitud: 200101862
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 196 968 21 k Número de solicitud: 200101862 1 k Int. Cl. 7 : A23L 1/314 A23L 1/318 A23L 1/31 A22C 11/00 k 12 SOLICITUD DE
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 196 968 21 k Número de solicitud: 200101862 1 k Int. Cl. 7 : A23L 1/314 A23L 1/318 A23L 1/31 A22C 11/00 k 12 SOLICITUD DE
11 Número de publicación: 2 239 799. 51 Int. Cl. 7 : A61K 38/00. 72 Inventor/es: Hauptman, Jonathan, Brian. 74 Agente: Isern Jara, Jorge
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 239 799 1 Int. Cl. 7 : A61K 38/00 A61K 31/36 A61P 3/ 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 98908008.0
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 239 799 1 Int. Cl. 7 : A61K 38/00 A61K 31/36 A61P 3/ 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 98908008.0
Recuerde que su médico ha prescrito SINEMET solamente para usted. Nunca se lo dé a nadie más.
 INFORMACIÓN PARA EL PACIENTE SOBRE SINEMET Por favor lea cuidadosamente este panfleto antes de que empiece a tomar su medicamento, inclusive si usted está iniciando una nueva prescripción. Alguna de la
INFORMACIÓN PARA EL PACIENTE SOBRE SINEMET Por favor lea cuidadosamente este panfleto antes de que empiece a tomar su medicamento, inclusive si usted está iniciando una nueva prescripción. Alguna de la
Cómo investigar y no morir en el intento
 Cómo investigar y no morir en el intento INTRODUCCIÓN Desde el comienzo de los tiempos, el ser humano se ha planteado preguntas a cerca de sus experiencias y de la naturaleza de las actividades entorno
Cómo investigar y no morir en el intento INTRODUCCIÓN Desde el comienzo de los tiempos, el ser humano se ha planteado preguntas a cerca de sus experiencias y de la naturaleza de las actividades entorno
PROTOCOLO DE USO DE INHIBIDORES DE LA BOMBA DE PROTONES (IBP)
 INDICACIONES Los inhibidores de la bomba de protones (IBP) tienen un efecto terapéutico similar a los anti-h 2 en úlcera gástrica y algo más eficaz en úlcera duodenal (aunque a partir de la cuarta semana
INDICACIONES Los inhibidores de la bomba de protones (IBP) tienen un efecto terapéutico similar a los anti-h 2 en úlcera gástrica y algo más eficaz en úlcera duodenal (aunque a partir de la cuarta semana
Int. Cl. 7 : B32B 7/04
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 170 710 21 k Número de solicitud: 200002878 1 k Int. Cl. 7 : B32B 7/04 B44C 1/10 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 170 710 21 k Número de solicitud: 200002878 1 k Int. Cl. 7 : B32B 7/04 B44C 1/10 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
11 knúmero de publicación: 2 187 100. 51 kint. Cl. 7 : A41D 31/00. k 72 Inventor/es: Schäfer, Werner; k 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 187 0 1 Int. Cl. 7 : A41D 31/00 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99111829.0 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 187 0 1 Int. Cl. 7 : A41D 31/00 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99111829.0 86 Fecha de presentación:
Identificación de problemas de mala nutrición y búsqueda de soluciones
 Consejos para los adultos de la tercera edad con enfermedades crónicas Herramientas para mantenerse saludable Obtenga noticias y consejos en su correo electrónico Suscríbase ahora! La mala nutrición es
Consejos para los adultos de la tercera edad con enfermedades crónicas Herramientas para mantenerse saludable Obtenga noticias y consejos en su correo electrónico Suscríbase ahora! La mala nutrición es
11 Número de publicación: 2 247 137. 51 Int. Cl. 7 : A61K 31/341. 74 Agente: Gil Vega, Víctor
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 247 137 1 Int. Cl. 7 : A61K 31/341 A61P 2/24 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01943711.0 86
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 247 137 1 Int. Cl. 7 : A61K 31/341 A61P 2/24 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01943711.0 86
k 11 N. de publicación: ES 2 001 671 k 21 Número de solicitud: 8601744 k 51 Int. Cl. 4 : A61K 9/10
 k 19 REGISTRO DE LA PROPIEDAD INDUSTRIAL ESPAÑA k 11 N. de publicación: ES 2 001 671 k 21 Número de solicitud: 81744 k 1 Int. Cl. 4 : A61K 9/ A61K 7/ k 12 PATENTEDEINVENCION A6 22 kfecha de presentación:.09.86
k 19 REGISTRO DE LA PROPIEDAD INDUSTRIAL ESPAÑA k 11 N. de publicación: ES 2 001 671 k 21 Número de solicitud: 81744 k 1 Int. Cl. 4 : A61K 9/ A61K 7/ k 12 PATENTEDEINVENCION A6 22 kfecha de presentación:.09.86
- Si es alérgico (hipersensible) a la clorhexidina, benzocaína o a cualquiera de los demás componentes de este medicamento.
 PROSPECTO: INFORMACIÓN PARA EL USUARIO APOGAR 5 mg /5 mg Comprimidos para chupar Clorhexidina dihidrocloruro/ Benzocaína Lea todo el prospecto detenidamente porque contiene información importante para
PROSPECTO: INFORMACIÓN PARA EL USUARIO APOGAR 5 mg /5 mg Comprimidos para chupar Clorhexidina dihidrocloruro/ Benzocaína Lea todo el prospecto detenidamente porque contiene información importante para
11 knúmero de publicación: 2 178 745. 51 kint. Cl. 7 : A23K 1/14
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 178 74 1 kint. Cl. 7 : A23K 1/14 A23K 1/18 A23P 1/14 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 178 74 1 kint. Cl. 7 : A23K 1/14 A23K 1/18 A23P 1/14 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
11 knúmero de publicación: 2 108 710. 51 kint. Cl. 6 : A61M 1/00. k 72 Inventor/es: Masaki, Nobuyuki. k 74 Agente: Carpintero López, Francisco
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 108 710 51 kint. Cl. 6 : A61M 1/00 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 91900941.5
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 108 710 51 kint. Cl. 6 : A61M 1/00 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 91900941.5
6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1)
 6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1) (1.1) Es importante valorar la intensidad, la frecuencia y la duración de los síntomas de reflujo,
6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1) (1.1) Es importante valorar la intensidad, la frecuencia y la duración de los síntomas de reflujo,
11 knúmero de publicación: 2 164 289. 51 kint. Cl. 7 : A62C 13/66. k 72 Inventor/es: Neumeir, Anton. k 74 Agente: Botella Reyna, Antonio
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 164 289 1 kint. Cl. 7 : A62C 13/66 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 97119016.0
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 164 289 1 kint. Cl. 7 : A62C 13/66 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 97119016.0
11 Número de publicación: 2 232 572. 51 Int. Cl. 7 : B23Q 17/00. 72 Inventor/es: Desmoulins, Marcel. 74 Agente: Urizar Anasagasti, José Antonio
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 232 72 1 Int. Cl. 7 : B23Q 17/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01400203.4 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 232 72 1 Int. Cl. 7 : B23Q 17/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01400203.4 86 Fecha de presentación:
ES 2 230 956 A1 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA. 11 Número de publicación: 2 230 956. 21 Número de solicitud: 200202096
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 230 956 21 Número de solicitud: 200202096 51 Int. Cl. 7 : B23Q 11/00 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación: 12.09.2002
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 230 956 21 Número de solicitud: 200202096 51 Int. Cl. 7 : B23Q 11/00 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación: 12.09.2002
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe
 SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
SINALERG Levocetirizina 2.5 mg / 5 ml Jarabe SINALERG (LEVOCETIRIZINA 2.5 mg/5 ml) Jarabe Antihistamínico COMPOSICIÓN Cada 100 ml contiene: Levocetirizina diclorhidrato... 0.05 g Excipientes c.s.p. INDICACIONES
11 Número de publicación: 2 221 796. 21 Número de solicitud: 200301089. 51 Int. Cl. 7 : A23B 4/10. 72 Inventor/es: Gómez Romero, Luis Antonio
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 221 796 21 Número de solicitud: 089 1 Int. Cl. 7 : A23B 4/ 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación: 12.0.03 71 Solicitante/s:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 221 796 21 Número de solicitud: 089 1 Int. Cl. 7 : A23B 4/ 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación: 12.0.03 71 Solicitante/s:
Mamoplastia de reducción y levantamiento del busto
 Cómo se debe escoger un cirujano plástico? Antes de tomar la decisión de realizarse una intervención quirúrgica, usted debe estar seguro de estar en el lugar adecuado y en buenas manos. Es importante tener
Cómo se debe escoger un cirujano plástico? Antes de tomar la decisión de realizarse una intervención quirúrgica, usted debe estar seguro de estar en el lugar adecuado y en buenas manos. Es importante tener
Normalización de soluciones de NaOH 0,1N y HCl 0,1N.
 Laboratorio N 1: Normalización de soluciones de NaOH 0,1N y HCl 0,1N. Objetivos: - Determinar la normalidad exacta de una solución de hidróxido de sodio aproximadamente 0,1 N, utilizando biftalato de potasio
Laboratorio N 1: Normalización de soluciones de NaOH 0,1N y HCl 0,1N. Objetivos: - Determinar la normalidad exacta de una solución de hidróxido de sodio aproximadamente 0,1 N, utilizando biftalato de potasio
11 Número de publicación: 2 290 597. 51 Int. Cl.: 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 290 97 1 Int. Cl.: H01Q 1/2 (06.01) H01Q /00 (06.01) H01Q 21/ (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 290 97 1 Int. Cl.: H01Q 1/2 (06.01) H01Q /00 (06.01) H01Q 21/ (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud
Prospecto: información para el usuario. Cebión 500 mg granulado para solución oral. Ácido ascórbico (Vitamina C)
 Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario Cebión 500 mg granulado para solución oral Ácido ascórbico (Vitamina C) Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
11 Número de publicación: 2 250 124. 51 Int. Cl. 7 : C22C 21/00. 74 Agente: Díez de Rivera y Elzaburu, Ignacio
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 124 1 Int. Cl. 7 : C22C 21/00 B22D 11/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00922378. 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 124 1 Int. Cl. 7 : C22C 21/00 B22D 11/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00922378. 86 Fecha
Peeling químico - Profundo
 Peeling químico - Profundo Los peelings químicos son uno de los tratamientos cosméticos no invasivos más populares que se realizan para rejuvenecer el aspecto de la piel. Con el tiempo, factores tales
Peeling químico - Profundo Los peelings químicos son uno de los tratamientos cosméticos no invasivos más populares que se realizan para rejuvenecer el aspecto de la piel. Con el tiempo, factores tales
LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus
 LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus Lea todo el prospecto detenidamente porque contiene información importante para Usted. Este medicamento puede obtenerse sin receta para el tratamiento
LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus Lea todo el prospecto detenidamente porque contiene información importante para Usted. Este medicamento puede obtenerse sin receta para el tratamiento
11 knúmero de publicación: 2 147 278. 51 kint. Cl. 7 : E04D 5/10
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 147 278 1 kint. Cl. 7 : E04D /10 E04D /14 E01D 19/08 B32B 7/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número de solicitud
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 147 278 1 kint. Cl. 7 : E04D /10 E04D /14 E01D 19/08 B32B 7/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número de solicitud
GASTO METABOLICO DE ENERGIA
 GASTO METABOLICO DE ENERGIA Indice Introducción Conceptos Básicos de Metabolismo Métodos Usados para Evaluar la Demanda Metabólica de una Tarea Desarrollo del Método Predictivo AAMA Cálculos del Modelo
GASTO METABOLICO DE ENERGIA Indice Introducción Conceptos Básicos de Metabolismo Métodos Usados para Evaluar la Demanda Metabólica de una Tarea Desarrollo del Método Predictivo AAMA Cálculos del Modelo
FICHA TÉCNICA. La especialidad farmacéutica debe administrarse con precaución en los siguientes poblaciones:
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PEPSAMAR comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 233 mg de Hidróxido
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PEPSAMAR comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 233 mg de Hidróxido
Informe Sectorial 2013 RESUMEN
 ENVASE DE VIDRIO El envase de vidrio es el más universal de los envases. Está presente en la práctica totalidad de los segmentos del mercado y no tiene ninguna contraindicación de uso. Cuenta con más de
ENVASE DE VIDRIO El envase de vidrio es el más universal de los envases. Está presente en la práctica totalidad de los segmentos del mercado y no tiene ninguna contraindicación de uso. Cuenta con más de
Sea un miembro activo de su equipo de atención médica. Council on Family Health
 Sea un miembro activo de su equipo de atención médica Council on Family Health en colaboración con el U.S. Department of Health and Human Services Food and Drug Administration Cuando se trata de usar medicamentos,
Sea un miembro activo de su equipo de atención médica Council on Family Health en colaboración con el U.S. Department of Health and Human Services Food and Drug Administration Cuando se trata de usar medicamentos,
Kinesiología del aparato respiratorio. Capítulo 5
 Kinesiología del aparato respiratorio Capítulo 5 Kinesiología del aparato respiratorio Capítulo 5 La kinesioterapia del aparato respiratorio es parte del tratamiento desde el diagnóstico. En este capítulo
Kinesiología del aparato respiratorio Capítulo 5 Kinesiología del aparato respiratorio Capítulo 5 La kinesioterapia del aparato respiratorio es parte del tratamiento desde el diagnóstico. En este capítulo
11. Joseph Wolpe Joseph Wolpe, (1915 1997), fue un psiquiatra sudafricano-estadounidense. Se inscribe en las corrientes de la psicología conductista,
 11. Joseph Wolpe Joseph Wolpe, (1915 1997), fue un psiquiatra sudafricano-estadounidense. Se inscribe en las corrientes de la psicología conductista, conocido sobre todo por sus teorías y experiencias
11. Joseph Wolpe Joseph Wolpe, (1915 1997), fue un psiquiatra sudafricano-estadounidense. Se inscribe en las corrientes de la psicología conductista, conocido sobre todo por sus teorías y experiencias
11 Número de publicación: 2 214 889. 51 Int. Cl. 7 : A45C 13/18. 72 Inventor/es: Haller, Hubert. 74 Agente: Lehmann Novo, María Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 214 889 51 Int. Cl. 7 : A45C 13/18 E05G 1/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99948973.5 86
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 214 889 51 Int. Cl. 7 : A45C 13/18 E05G 1/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99948973.5 86
Polímeros como estabilizadores de suelos. Cómo funciona SoilFix
 Polímeros como estabilizadores de suelos Es bien conocido desde hace muchos años que los aglomerados del suelo deben su estabilidad, en parte, a la presencia de materiales poliméricos naturales que se
Polímeros como estabilizadores de suelos Es bien conocido desde hace muchos años que los aglomerados del suelo deben su estabilidad, en parte, a la presencia de materiales poliméricos naturales que se
Guía del paciente. Braquiterapia: El mejor modo de tratar el cáncer. Porque la vida es para vivirla
 Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
Int. Cl.: 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 277 170 1 Int. Cl.: A61K 47/48 (06.01) A61P 2/00 (06.01) A61P 2/14 (06.01) A61P 2/18 (06.01) A61K 31/22 (06.01) A61P 2/28 (06.01)
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 277 170 1 Int. Cl.: A61K 47/48 (06.01) A61P 2/00 (06.01) A61P 2/14 (06.01) A61P 2/18 (06.01) A61K 31/22 (06.01) A61P 2/28 (06.01)
CÓMO MANTENER LOS ALIMENTOS LIMPIOS E INOCUOS
 55 CÓMO MANTENER LOS ALIMENTOS LIMPIOS E INOCUOS N O T A S S O B R E N U T R I C I Ó N Por qué los alimentos y bebidas deben ser limpios e inocuos Es importante que los alimentos que comemos y el agua
55 CÓMO MANTENER LOS ALIMENTOS LIMPIOS E INOCUOS N O T A S S O B R E N U T R I C I Ó N Por qué los alimentos y bebidas deben ser limpios e inocuos Es importante que los alimentos que comemos y el agua
En los países industrializados se consumen alrededor de 15 gramos de fibra al día, en promedio (17,8 g para los hombres y 13,6 g para las mujeres).
 Por qué es tan importante la fibra? En 1972, los científicos propusieron una "hipótesis de la fibra dietética", la que sugería que las enfermedades gastrointestinales comunes como el cáncer de colon, diverticulosis
Por qué es tan importante la fibra? En 1972, los científicos propusieron una "hipótesis de la fibra dietética", la que sugería que las enfermedades gastrointestinales comunes como el cáncer de colon, diverticulosis
Cómo Eliminar Piojos Sin Lágrimas Ni Pánico
 Cómo Eliminar Piojos Sin Lágrimas Ni Pánico Copyright 2010 PiojosyLiendres.com Todos los derechos reservados. Ninguna parte de este informe puede ser reproducida o transmitida en cualquier forma o por
Cómo Eliminar Piojos Sin Lágrimas Ni Pánico Copyright 2010 PiojosyLiendres.com Todos los derechos reservados. Ninguna parte de este informe puede ser reproducida o transmitida en cualquier forma o por
11 knúmero de publicación: 2 125 339. 51 kint. Cl. 6 : A61K 7/06
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 12 339 1 kint. Cl. 6 : A61K 7/06 A61K 7/1 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 9391148.6
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 12 339 1 kint. Cl. 6 : A61K 7/06 A61K 7/1 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 9391148.6
11 knúmero de publicación: 2 144 127. 51 kint. Cl. 7 : B07C 5/342. k 72 Inventor/es: Wahlquist, Anders. k 74 Agente: Esteban Pérez-Serrano, M ā Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 144 127 1 Int. Cl. 7 : B07C /342 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99331.6 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 144 127 1 Int. Cl. 7 : B07C /342 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99331.6 86 Fecha de presentación
11 Número de publicación: 2 242 073. 51 Int. Cl. 7 : A47G 29/14. 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 242 073 1 Int. Cl. 7 : A47G 29/14 G07C 9/00 G07F 17/12 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02779139.1
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 242 073 1 Int. Cl. 7 : A47G 29/14 G07C 9/00 G07F 17/12 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02779139.1
11 kn. de publicación: ES 2 075 192. 51 kint. Cl. 6 : B29C 55/06
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 07 192 1 kint. Cl. 6 : B29C /06 //B29K 27/18 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90890096.2
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 07 192 1 kint. Cl. 6 : B29C /06 //B29K 27/18 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90890096.2
Fibromas Uterinos. Guía para la paciente
 Fibromas Uterinos Guía para la paciente Fibromas Uterinos Guía para la paciente Los fibromas uterinos son muy comunes y, para muchas mujeres, causan síntomas que afectan su calidad de vida. Este folleto
Fibromas Uterinos Guía para la paciente Fibromas Uterinos Guía para la paciente Los fibromas uterinos son muy comunes y, para muchas mujeres, causan síntomas que afectan su calidad de vida. Este folleto
Tratamiento casero para la gastritis y las úlceras Autor: Dere Dioses Sernaque
 Tratamiento casero para la gastritis y las úlceras Autor: Dere Dioses Sernaque 1 Presentación del curso Si tienes problemas gastrointestinales, este curso de medicina es ideal para tí. Conoce la forma
Tratamiento casero para la gastritis y las úlceras Autor: Dere Dioses Sernaque 1 Presentación del curso Si tienes problemas gastrointestinales, este curso de medicina es ideal para tí. Conoce la forma
ES 2 150 868 A1. Número de publicación: 2 150 868 PATENTES Y MARCAS. Número de solicitud: 009802140. Int. Cl. 7 : A47K 7/03
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 10 868 21 k Número de solicitud: 009802140 1 k Int. Cl. 7 : A47K 7/03 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 10 868 21 k Número de solicitud: 009802140 1 k Int. Cl. 7 : A47K 7/03 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
Lactancia: algunas indicaciones que pueden ayudarla a comenzar por un buen camino
 Lactancia: algunas indicaciones que pueden ayudarla a comenzar por un buen camino Cuáles son los beneficios de la lactancia? Alimentar a su bebé con la leche de sus senos tiene muchos beneficios. La leche
Lactancia: algunas indicaciones que pueden ayudarla a comenzar por un buen camino Cuáles son los beneficios de la lactancia? Alimentar a su bebé con la leche de sus senos tiene muchos beneficios. La leche
11 Número de publicación: 2 205 235. 51 Int. Cl. 7 : A61K 7/16. 74 Agente: Tavira Montes-Jovellar, Antonio
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 23 1 Int. Cl. 7 : A61K 7/16 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 9792770.6 86 Fecha de presentación:.0.1997
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 23 1 Int. Cl. 7 : A61K 7/16 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 9792770.6 86 Fecha de presentación:.0.1997
BASADO EN LA NUEVA GUÍA DE BOLSILLO GINA 2009 PARA EL MANEJO Y PREVENCIÓN DEL ASMA EN NIÑOS DE 5 AÑOS Y MENORES
 BASADO EN LA NUEVA GUÍA DE BOLSILLO GINA 2009 PARA EL MANEJO Y PREVENCIÓN DEL ASMA EN NIÑOS DE 5 AÑOS Y MENORES Por favor, consulte este documento en www.ginasfhma.org 2009 Medical Communications Resources,
BASADO EN LA NUEVA GUÍA DE BOLSILLO GINA 2009 PARA EL MANEJO Y PREVENCIÓN DEL ASMA EN NIÑOS DE 5 AÑOS Y MENORES Por favor, consulte este documento en www.ginasfhma.org 2009 Medical Communications Resources,
CURSO. ELECTROTERAPIA FUNDAMENTAL EN MEDICINA DEL TRABAJO Metodología, eficacia y rentabilidad de su aplicación en la empresa
 CURSO ELECTROTERAPIA FUNDAMENTAL EN MEDICINA DEL TRABAJO Metodología, eficacia y rentabilidad de su aplicación en la empresa 2014 INDICE INDICE... 2 Título del curso:... 3 Fundamento del curso:... 3 Objetivos:...
CURSO ELECTROTERAPIA FUNDAMENTAL EN MEDICINA DEL TRABAJO Metodología, eficacia y rentabilidad de su aplicación en la empresa 2014 INDICE INDICE... 2 Título del curso:... 3 Fundamento del curso:... 3 Objetivos:...
Prospecto: información para el usuario. DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral)
 Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Diuréticos del Asa (Orales) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los diuréticos del asa ayudan
Diuréticos del Asa (Orales) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los diuréticos del asa ayudan
ENFERMEDAD POR REFLUJO GASTROESOFÁGICO (ERGE)
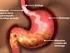 ENFERMEDAD POR REFLUJO GASTROESOFÁGICO (ERGE) QUÉ ES LA ERGE? CÓMO SE PRODUCE? La ERGE es una enfermedad que se produce cuando el reflujo gastroesofágico (RGE) ocasiona síntomas molestos, que deterioran
ENFERMEDAD POR REFLUJO GASTROESOFÁGICO (ERGE) QUÉ ES LA ERGE? CÓMO SE PRODUCE? La ERGE es una enfermedad que se produce cuando el reflujo gastroesofágico (RGE) ocasiona síntomas molestos, que deterioran
ALCOHOLISMO. Daniel Vivas Juan Castaño
 ALCOHOLISMO Daniel Vivas Juan Castaño Índice 1. Que Es El Alcoholismo? 2.Características 3. Como Detectar El Alcoholismo? 4. Efectos Del Alcohol En El Cuerpo 5. Bibliografía 6. Preguntas 7. Mis Preguntas
ALCOHOLISMO Daniel Vivas Juan Castaño Índice 1. Que Es El Alcoholismo? 2.Características 3. Como Detectar El Alcoholismo? 4. Efectos Del Alcohol En El Cuerpo 5. Bibliografía 6. Preguntas 7. Mis Preguntas
11 Número de publicación: 2 286 433. 51 Int. Cl.: 72 Inventor/es: Hedding-Eckerich, Monika. 74 Agente: Díaz de Bustamante Terminel, Isidro
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 286 433 1 Int. Cl.: A61K 31/70 (06.01) A61P 2/02 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 286 433 1 Int. Cl.: A61K 31/70 (06.01) A61P 2/02 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
Int. Cl.: 72 Inventor/es: Miller, Richard, A. 74 Agente: Carpintero López, Mario
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 31 429 1 Int. Cl.: A61K 31/33 (06.01) A61P 2/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Número de solicitud europea: 027992.3
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 31 429 1 Int. Cl.: A61K 31/33 (06.01) A61P 2/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Número de solicitud europea: 027992.3
X-Plain Glaucoma Sumario
 X-Plain Glaucoma Sumario El glaucoma es un grupo de enfermedades que afectan al ojo y que pueden llevar a la ceguera si no se recibe tratamiento adecuado. El glaucoma de ángulo abierto, la forma de glaucoma
X-Plain Glaucoma Sumario El glaucoma es un grupo de enfermedades que afectan al ojo y que pueden llevar a la ceguera si no se recibe tratamiento adecuado. El glaucoma de ángulo abierto, la forma de glaucoma
ES 2 137 877 A1. Número de publicación: 2 137 877 PATENTES Y MARCAS. Número de solicitud: 009702451. Int. Cl. 6 : A45D 44/22
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 137 877 21 k Número de solicitud: 00970241 1 k Int. Cl. 6 : A4D 44/22 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 137 877 21 k Número de solicitud: 00970241 1 k Int. Cl. 6 : A4D 44/22 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
Guión de programa de Radio N 8
 Guión de programa de Radio N 8 Programa Día Hora Duración Locutor 1 Locutor 1 La Salud y sus Medicamentos Jueves 8:00a.m. 40 min Fátima Pimentel Texto Saludos Buenas días estimados radioescuchas, en el
Guión de programa de Radio N 8 Programa Día Hora Duración Locutor 1 Locutor 1 La Salud y sus Medicamentos Jueves 8:00a.m. 40 min Fátima Pimentel Texto Saludos Buenas días estimados radioescuchas, en el
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH)
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Números del requerimiento affectandos: DE/H/1649/002/DC (potencia 12DH) 1 / 5 1. NOMBRE DEL MEDICAMENTO Lycopodium 12DH, glóbulos 2. COMPOSICIÓN
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento.
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
