Guía de usuario para los informes de web
|
|
|
- Ramona Henríquez Herrero
- hace 7 años
- Vistas:
Transcripción
1 Protección de la salud de los pacientes Esta guía de usuario para los informes de web facilita información sobre tipos de datos, presentacion, interpretación y funcionalidades del informe de web. 1. Tipos de datos Detalles adicionales sobre los tipos de datos Esquema Interpretación del informe de web Funcionalidades del informe de Web Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 (0) Facsimile +44 (0) info@ema.europa.eu Website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 1. Tipos de datos El informe de web ofrece detalles sobre los tipos de datos que forman parte de cada caso individual; la persona que informa sobre el caso cumplimenta todos estos elementos para proporcionar información sobre los presuntos efectos secundarios (también conocidos como reacciones adversas a un fármaco) observados tras el uso de un medicamento, pero no necesariamente relacionados con el medicamento o producidos por él. El Grupo de edad y Sexo facilitan información sobre la persona que ha experimentado el presunto efecto secundario. El Origen geográfico facilita información sobre la localización en la que se produjo el efecto secundario. El Grupo al que pertenece la persona que comunica la información facilita información sobre la cualificación de la persona que comunica el caso. El Desenlace proporciona información sobre el último estado notificado del presunto efecto secundario. La Presunta Reacción Notificada proporciona información sobre el o los efectos secundarios experimentados por el paciente según la persona que presenta el informe. La siguiente tabla presenta los tipos de datos incluidos en el informe de web y sus valores. Tipos de datos Grupo de edad Sexo Origen geográfico Grupo al que pertenece la persona que comunica la información Desenlace Presunta Reacción Notificada Valores No se especifica 0-1 mes 2 meses - 2 años 3-11 años años años años Más de 85 años Mujer Varón No se especifica Espacio Económico Europeo (EEE) No perteneciente al Espacio Económico Europeo (No EEE) No se especifica Profesional sanitario (Médico, farmacéutico u otro profesional sanitario) Profesional no sanitario (Abogado o consumidor u otro profesional no sanitario) No se especifica Recuperado/resuelto En recuperación/en proceso de resolución No recuperado/no resuelto Recuperado/resuelto con secuelas Mortal Desconocido No se especifica Cualquier efecto secundario (también conocido como reacción adversa al fármaco) notificado por la persona que informa sobre el caso Los términos de los efectos secundarios proceden del diccionario de términos médicos empleado para clasificar la información clínica Página2/11
3 Tipos de datos Grupos de reacciones Número de casos individuales Valores Cualquier Grupo de efectos secundarios basado en la clasificación de los efectos secundarios (también conocidos como reacciones adversas al fármaco) notificado por la persona que informa sobre el caso Los términos de los efectos secundarios proceden del diccionario de términos médicos empleados para clasificar la información clínica y se clasifican en Grupos en base a su significado clínico. Total acumulado del número de casos individuales La Presunta Reacción Notificada y los Grupos de reacciones proceden del diccionario médico de términos empleado para clasificar la información clínica. El diccionario empleado es el Diccionario Médico para Actividades Reguladoras (MedDRA por sus siglas en inglés Medical Dictionary for Regulatory Activities). La Presunta Reacción Notificada corresponde al "Término Preferido (TP)" de reacción del MedDRA y los Grupos de reacciones corresponden al "Sistema de Clasificación por Órganos y Sistemas (SOC)" del MedDRA. En la tabla se incluye ejemplos de la clasificación del MedDRA: Presunta Reacción Notificada (Término Preferido en el MedDRA) Cefaleas Trasplante de corazón Otitis Grupo de reacciones (Sistema de Clasificación por Órganos y Sistemas del MedDRA) Trastornos del sistema nervioso Intervenciones quirúrgicas y médicas Infecciones e infestaciones Si desea información adicional sobre el diccionario, consulte la página de Preguntas Frecuentes de la web Qué es el Diccionario Médico para Actividades Reguladoras (MedDRA )?. Página3/11
4 2. Detalles adicionales sobre los tipos de datos Un caso individual solo puede tener un valor para los datos Grupo de Edad, Sexo y Origen Geográfico; para los datos Grupo al que pertenece la persona que comunica la información y Desenlace, puede aparecer más de un valor. Por ejemplo, un caso individual se refiere solo a un paciente, por tanto el Grupo de Edad, Sexo y Origen Geográfico (donde se ha producido el presunto efecto secundario) solo puede caracterizarse por un valor. No obstante, un caso individual puede haber sido notificado por un abogado o un consumidor y un médico que pertenecen a diferentes Grupos; el Desenlace de un presunto efecto secundario podría haberse notificado como "en recuperación" en el momento del informe inicial y como "desconocido" tras una actualización. Para abordar estas eventualidades y un recuento excesivo del número de casos individuales en los informes de web, se aplican las normas siguientes: Cuando un caso individual ha sido notificado por más de una persona, si se indica que al menos uno de ellos es un "Médico", "Farmacéutico" u "Otro Profesional Sanitario" el Grupo al que pertenece la persona que comunica la información se define como "Profesional Sanitario". Por el contrario, si las personas que informan sobre una reacción son "Abogado" o "Consumidor" u otras que no sean "Profesional Sanitario", el Grupo se define como "Profesional no Sanitario". Persona(s) que comunican la informacion Grupo de personas que informa sobre la reacción Caso individual nº 1 Farmacéutico Profesional sanitario Caso individual nº 2 Médico; Abogado o Consumidor Profesional sanitario Caso individual nº 3 Otro Profesional no Sanitario Profesional no sanitario Cuando un caso individual ha sido notificado dos veces pero con diferentes Desenlaces, si al menos uno de los desenlaces es mortal, el desenlace para el caso individual de la reacción notificada se define como "Mortal"; si ninguno de los desenlaces es mortal, el desenlace para el caso individual de la reacción notificada se define como "Desconocido". Presuntas Reacciones Notificadas y Desenlace(s) Desenlace en el informe de web Caso individual nº 4 No se notifica la misma reacción dos veces: Reacción A -> Recuperado/Resuelto Reacción B -> No se especifica Reacción A -> Recuperado/Resuelto Reacción B -> No se especifica Caso individual nº 5 Se notifica la misma reacción dos veces: Reacción C -> En recuperación/en proceso de resolución Reacción C -> Mortal Reacción C -> Mortal Página4/11
5 Presuntas Reacciones Notificadas y Desenlace(s) Desenlace en el informe de web Caso individual nº 6 Se notifica la misma reacción dos veces: Reacción D -> Recuperado/Resuelto Reacción D -> Recuperado/Resuelto con secuelas Reacción D -> Desconocido Página5/11
6 3. Esquema Cada informe de web está compuesto por 4 pestañas. Pestaña 1 - Número de casos individuales Esta pestaña refleja el total acumulado de casos individuales identificados en EudraVigilance hasta el fin del mes anterior. La pestaña presenta la información del número de casos individuales por Grupo de Edad, Sexo y Origen Geográfico. Pestaña 2 - Número de casos individuales por Grupos de reacciones Esta pestaña muestra el número de casos individuales por Grupos de reacciones. Se dispone de cuatro vistas que presentan el número de casos individuales por Grupos de reacciones: por Grupo de edad, Sexo, Grupo al que pertenece la persona que comunica la información y Origen Geográfico. Página6/11
7 Pestaña 3 - Número de casos individuales por un Grupo de reacciones seleccionado Esta pestaña muestra el número de casos individuales para un Grupo de reacciones seleccionado, definido por el usuario. Existen tres informes para cada Grupo de reacciones seleccionado; el primero presenta los datos por Grupo de Edad y Sexo, el segundo por Grupo al que pertenece la persona que comunica la información y el tercero por Origen Geográfico. Pestaña 4 - Número de casos individuales para una Reacción seleccionada Esta pestaña muestra el número de casos individuales para una Reacción seleccionada, definida por el usuario. Existen tres informes para cada reacción seleccionada: el primer informe presenta los datos por Grupo de Edad y Sexo, el segundo por Grupo al que pertenece la persona que comunica la información y el tercero por Desenlace. Página7/11
8 4. Interpretación del informe de web El total acumulado de casos individuales que se presenta en la Pestaña 1- Número de casos individuales es el valor que deberá usarse para cuantificar el número total de casos individuales notificados a EudraVigilance para un medicamento o principio activo seleccionado. La información que se presenta en las Pestañas 2, 3 y 4 tiene en cuenta el/los presuntos efectos secundarios notificados en un caso individual; como un caso individual puede indicar más de un presunto efecto secundario, la información que se presenta en las Pestañas 2, 3 y 4 NO representa el número total de casos individuales notificados a EudraVigilance, sino el número de efectos secundarios relacionados. La tabla muestra un ejemplo del número de total acumulado de casos individuales (Pestaña 1) y cómo aparece esta información en las Pestañas 2, 3 y 4. Número de casos individuales (Pestaña 1) Presuntas Reacciones Notificadas y Grupo(s) de Reacciones correspondientes Número de casos individuales por Grupos de Reacciones (Pestaña 2 y Pestaña 3) Número de casos individuales por Presunta Reacción Notificada (Pestaña 4) 1 caso individual Reacción A -> Grupo de reacciones X Reacción B -> Grupo de reacciones X 1 caso para el Grupo de reacciones X 1 caso para la Reacción A 1 caso para la Reacción B 1 caso individual Reacción A -> Grupo de reacciones X Reacción C -> Grupo de reacciones Y 1 caso para el Grupo de reacciones X 1 caso para el Grupo de reacciones Y 1 caso para la Reacción A 1 caso para la Reacción C En este ejemplo, el informe de web muestra dos casos individuales para el medicamento o principio activo seleccionado en la Pestaña 1; empleando la clasificación del diccionario MedDRA, la Presunta Reacción Notificada se asocia a los correspondientes Grupos de reacciones. En las Pestañas 2 y 3, el número de casos individuales que aparece depende del número de Grupos de Reacciones de cada caso individual; el mismo caso aparece tantas veces como Grupos de Reacciones distintos haya. En la Pestaña 4, el número de casos individuales que aparece depende del número de Presunta Reacción Notificada en cada caso individual; el mismo caso aparece tantas veces como Presuntas Reacciones Notificadas distintas haya. Página8/11
9 5. Funcionalidades del informe de Web Navegación General Para navegar entre pestañas, pulse sobre la pestaña seleccionada. Navegación en la Pestaña 2 - "Número de casos individuales por Grupos de reacciones" Seleccione cómo desea ver la información pulsando sobre el panel seleccionado. Navegación en la Pestaña 3 - "Número de casos individuales por Grupos de reacciones" Escoja y pulse sobre un Grupo de reacciones Para ver la información correspondiente. Página9/11
10 Navegación en la Pestaña 4 - "Número de casos individuales para una Reacción seleccionada" Un selector interactivo permite seleccionar un Grupo de Reacciones y una Presunta Reacción Notificada. El Grupo de Reacciones y la Presunta Reacción Notificada proceden del diccionario de términos médicos y forman parte de la misma clasificación: 1) Escoja y pulse sobre un Grupo de Reacciones; 2) la lista de Presuntas Reacciones Notificadas perteneciente a dicho grupo se actualiza automáticamente; 2) Escoja y pulse sobre una Presunta Reacción Notificada para ver la información correspondiente. Si no se encuentra un Grupo de Reacciones o una Presunta Reacción Notificada, eso supone que todavía no se ha presentado a EudraVigilance ningún informe espontáneo grave con ese efecto secundario (también conocido como reacción adversa a un fármaco) para este medicamento o principio activo, es decir no existe ningún caso individual. Página10/11
11 Vista en gráficos/tabla El informe de web permite cambiar con rapidez de una vista en Gráfico a una vista en Tabla (y viceversa) pulsando sobre el icono. Leyenda La vista en Gráfico permite visualizar la información relevante pasando el ratón sobre el gráfico. Página11/11
Guía para la interpretación de informes espontáneos de presuntas reacciones adversas a medicamentos
 30 de enero de 2017 Inspecciones, Farmacovigilancia de Medicamentos de Uso Humano y Comités EMA/749446/2016 Revisión 1* Guía para la interpretación de informes espontáneos de presuntas reacciones adversas
30 de enero de 2017 Inspecciones, Farmacovigilancia de Medicamentos de Uso Humano y Comités EMA/749446/2016 Revisión 1* Guía para la interpretación de informes espontáneos de presuntas reacciones adversas
Preguntas más frecuentes
 4 de noviembre de 2011 EMA/527628/2011 Dirección Este documento contiene respuestas a las preguntas más frecuentes recibidas por la Agencia Europea de Medicamentos. Si no encuentra aquí la respuesta a
4 de noviembre de 2011 EMA/527628/2011 Dirección Este documento contiene respuestas a las preguntas más frecuentes recibidas por la Agencia Europea de Medicamentos. Si no encuentra aquí la respuesta a
Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto
 25 February 2016 EMA/PRAC/137780/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto Adoptado por el PRAC el
25 February 2016 EMA/PRAC/137780/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto Adoptado por el PRAC el
Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto
 25 January 2018 EMA/PRAC/35608/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC en su reunión
25 January 2018 EMA/PRAC/35608/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC en su reunión
Materiales educativos para los profesionales sanitarios y los pacientes que utilizan el medicamento antidiabético Suliqua
 19 de enero de 2017 EMA/747766/2016 Materiales educativos para los profesionales sanitarios y los pacientes que utilizan el medicamento antidiabético Suliqua Medidas para reducir el riesgo de confusión
19 de enero de 2017 EMA/747766/2016 Materiales educativos para los profesionales sanitarios y los pacientes que utilizan el medicamento antidiabético Suliqua Medidas para reducir el riesgo de confusión
Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
 23 April 2015 EMA/PRAC/273926/2015 Pharmacovigilance Risk Assessment Committee Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto Adoptado por el PRAC
23 April 2015 EMA/PRAC/273926/2015 Pharmacovigilance Risk Assessment Committee Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto Adoptado por el PRAC
Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto:
 17 December 2015 EMA/PRAC/835774/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto: Adoptado por el PRAC, 30
17 December 2015 EMA/PRAC/835774/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de la información sobre el producto: Adoptado por el PRAC, 30
Preguntas más frecuentes
 13 de febrero de 2017 EMA/527628/2011 Rev. 1 Dirección Este documento contiene respuestas a las preguntas más frecuentes recibidas por la Agencia Europea de Medicamentos (EMA). Si no encuentra aquí la
13 de febrero de 2017 EMA/527628/2011 Rev. 1 Dirección Este documento contiene respuestas a las preguntas más frecuentes recibidas por la Agencia Europea de Medicamentos (EMA). Si no encuentra aquí la
Aspectos más destacados del informe anual 2009
 4 octubre 2010 EMA/615505/2010 Oficina del Director Ejecutivo Aspectos más destacados del informe anual 2009 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 (0)20 741 8400 Facsimil
4 octubre 2010 EMA/615505/2010 Oficina del Director Ejecutivo Aspectos más destacados del informe anual 2009 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 (0)20 741 8400 Facsimil
Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto
 15 September 2016 EMA/PRAC/603550/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC el 30
15 September 2016 EMA/PRAC/603550/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC el 30
La Agencia Europea de Medicamentos recomienda cambios en el uso de la metoclopramida
 20 de diciembre de 2013 EMA/13239/2014 Corr. 1 La Agencia Europea de Medicamentos recomienda cambios en el uso de la El principal objetivo de los cambios es reducir el riesgo de efectos neurológicos secundarios
20 de diciembre de 2013 EMA/13239/2014 Corr. 1 La Agencia Europea de Medicamentos recomienda cambios en el uso de la El principal objetivo de los cambios es reducir el riesgo de efectos neurológicos secundarios
Información general sobre Eylea y sobre los motivos por los que se autoriza su uso en la UE
 EMA/481361/2018 EMEA/H/C/002392 Información general sobre Eylea y sobre los motivos por los que se autoriza su uso en la UE Qué es Eylea y para qué se utiliza? Eylea es un medicamento que se usa para tratar
EMA/481361/2018 EMEA/H/C/002392 Información general sobre Eylea y sobre los motivos por los que se autoriza su uso en la UE Qué es Eylea y para qué se utiliza? Eylea es un medicamento que se usa para tratar
CUESTIONARIO PARA NIÑOS Y ADOLESCENTES
 Punto de vista acerca del consumo de medicamentos Por qué preguntamos? El Comité Pediátrico (PDCO) trabaja con la Agencia Europea de Medicamentos, y es su trabajo asegurarse de que los medicamentos para
Punto de vista acerca del consumo de medicamentos Por qué preguntamos? El Comité Pediátrico (PDCO) trabaja con la Agencia Europea de Medicamentos, y es su trabajo asegurarse de que los medicamentos para
En el mieloma múltiple, un cáncer de un tipo de glóbulos blancos denominados células de descarga, Revlimid se utiliza:
 EMA/113870/2017 EMEA/H/C/000717 Resumen del EPAR para el público lenalidomida El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia ha evaluado
EMA/113870/2017 EMEA/H/C/000717 Resumen del EPAR para el público lenalidomida El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia ha evaluado
Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
 22 de enero de 2015 EMA/PRAC/63326/2015 Comité para la Determinación del Riesgo en farmacovigilancia Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
22 de enero de 2015 EMA/PRAC/63326/2015 Comité para la Determinación del Riesgo en farmacovigilancia Recomendaciones del PRAC sobre las señales para la actualización de la información sobre el producto
Para más información sobre el tratamiento con Simponi, el paciente deberá leer el prospecto o consultar a su médico o farmacéutico.
 EMA/412395/2016 EMEA/H/C/000992 Resumen del EPAR para el público general golimumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia ha evaluado
EMA/412395/2016 EMEA/H/C/000992 Resumen del EPAR para el público general golimumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia ha evaluado
Contratación de personal para La Agencia Europea de Medicamentos
 26 July 2011 EMA/592224/2011 Administration Contratación de personal para La Agencia Europea de Medicamentos La Agencia tiene la responsabilidad de coordinar la evaluación y supervisión de los medicamentos
26 July 2011 EMA/592224/2011 Administration Contratación de personal para La Agencia Europea de Medicamentos La Agencia tiene la responsabilidad de coordinar la evaluación y supervisión de los medicamentos
El sistema europeo de regulación de medicamentos
 El sistema europeo de regulación de medicamentos Un enfoque uniforme para la regulación de los medicamentos en toda la Unión Europea An agency of the European Union El sistema europeo de regulación de
El sistema europeo de regulación de medicamentos Un enfoque uniforme para la regulación de los medicamentos en toda la Unión Europea An agency of the European Union El sistema europeo de regulación de
Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto
 1 October 2018 1 EMA/PRAC/621122/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC el 3-6
1 October 2018 1 EMA/PRAC/621122/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Recomendaciones del PRAC sobre señales: nuevo texto de información sobre el producto Adoptado por el PRAC el 3-6
Introducción al programa de trabajo de la Agencia para 2016
 8 de febrero de 2016 EMA/171279/2016 Director ejecutivo Introducción al programa de trabajo de la Agencia para 2016 Por Guido Rasi, Director Ejecutivo Prioridades de la EMA e influencias clave La red europea
8 de febrero de 2016 EMA/171279/2016 Director ejecutivo Introducción al programa de trabajo de la Agencia para 2016 Por Guido Rasi, Director Ejecutivo Prioridades de la EMA e influencias clave La red europea
Introducción al programa de trabajo de la Agencia para 2015
 7 agosto 2015 EMA/372784/2015 Director Ejecutivo Adjunto Introducción al programa de trabajo de la Agencia para 2015 Por Andreas Pott, Director Ejecutivo Adjunto Prioridades de la EMA y circunstancias
7 agosto 2015 EMA/372784/2015 Director Ejecutivo Adjunto Introducción al programa de trabajo de la Agencia para 2015 Por Andreas Pott, Director Ejecutivo Adjunto Prioridades de la EMA y circunstancias
vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida)
 EMA/90006/2015 EMEA/H/C/001104 Resumen del EPAR para el público general vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida) El presente documento resume el Informe Público Europeo de
EMA/90006/2015 EMEA/H/C/001104 Resumen del EPAR para el público general vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida) El presente documento resume el Informe Público Europeo de
La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección cerebral, con Tysabri
 25/04/2016 EMA/266665/2016 La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección Se deberá considerar la realización de resonancias magnéticas más frecuentes en los pacientes
25/04/2016 EMA/266665/2016 La EMA confirma las recomendaciones para minimizar el riesgo de LMP, una infección Se deberá considerar la realización de resonancias magnéticas más frecuentes en los pacientes
Para más información sobre el tratamiento con Keytruda, el paciente deberá leer el prospecto o consultar a su médico o farmacéutico.
 EMA/524789/2017 EMEA/H/C/003820 Resumen del EPAR para el público general pembrolizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia
EMA/524789/2017 EMEA/H/C/003820 Resumen del EPAR para el público general pembrolizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia
GAC-Opendata Manual de Usuario
 GAC-Opendata Manual de Usuario Introducción GAC es la abreviatura de Global Aquifer Control. GAC-OpenData es: Una aplicación multinavegador que permite acceder a los datos de los acuíferos. Un conjunto
GAC-Opendata Manual de Usuario Introducción GAC es la abreviatura de Global Aquifer Control. GAC-OpenData es: Una aplicación multinavegador que permite acceder a los datos de los acuíferos. Un conjunto
Información general sobre Opdivo y sobre los motivos por los que se autoriza su uso en la UE
 EMA/489091/2018 EMEA/H/C/003985 Información general sobre Opdivo y sobre los motivos por los que se autoriza su uso en la UE Qué es Opdivo y para qué se utiliza? Opdivo es un medicamento contra el cáncer
EMA/489091/2018 EMEA/H/C/003985 Información general sobre Opdivo y sobre los motivos por los que se autoriza su uso en la UE Qué es Opdivo y para qué se utiliza? Opdivo es un medicamento contra el cáncer
Secretaría General Departamento de Sistemas y Tecnologías de la Información
 Registro de usuario físico Opciones de usuario físico Registro de Entidad y Responsable Opciones de usuario Responsable Registro de usuario físico asociado a Entidad Opciones usuario físico asociado a
Registro de usuario físico Opciones de usuario físico Registro de Entidad y Responsable Opciones de usuario Responsable Registro de usuario físico asociado a Entidad Opciones usuario físico asociado a
Manual de usuario para la Industria Farmacéutica:
 GOBIERNO DE ESPAÑA MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD agencia española de medicamentos y productos sanitarios Manual de usuario para la Industria Farmacéutica: CARGA ON-LINE DE SOSPECHAS
GOBIERNO DE ESPAÑA MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD agencia española de medicamentos y productos sanitarios Manual de usuario para la Industria Farmacéutica: CARGA ON-LINE DE SOSPECHAS
DICTAMEN DEL COMITÉ DE ESPECIALIDADES FARMACÉUTICAS DE CONFORMIDAD CON EL ARTÍCULO 12 DE LA DIRECTIVA 75/319/CEE DEL CONSEJO MODIFICADA, PARA
 The European Agency for the Evaluation of Medicinal Products DICTAMEN DEL COMITÉ DE ESPECIALIDADES FARMACÉUTICAS DE CONFORMIDAD CON EL ARTÍCULO 12 DE LA DIRECTIVA 75/319/CEE DEL CONSEJO MODIFICADA, PARA
The European Agency for the Evaluation of Medicinal Products DICTAMEN DEL COMITÉ DE ESPECIALIDADES FARMACÉUTICAS DE CONFORMIDAD CON EL ARTÍCULO 12 DE LA DIRECTIVA 75/319/CEE DEL CONSEJO MODIFICADA, PARA
Buenas Prácticas de Farmacovigilancia para las Américas. M.C. Miriam Sánchez Vicepresidenta AMFV Marzo 2013
 Buenas Prácticas de Farmacovigilancia para las Américas M.C. Miriam Sánchez Vicepresidenta AMFV Marzo 2013 Agenda Antecedentes Buenas Prácticas de Farmacovigilancia Buenas Prácticas de Análisis y Gestión
Buenas Prácticas de Farmacovigilancia para las Américas M.C. Miriam Sánchez Vicepresidenta AMFV Marzo 2013 Agenda Antecedentes Buenas Prácticas de Farmacovigilancia Buenas Prácticas de Análisis y Gestión
Información general sobre Metacam y sobre los motivos por los que se autoriza su uso en la UE
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Información general sobre Metacam y sobre los motivos por los que se autoriza su uso en la UE Qué es Metacam y para qué se utiliza? Metacam es un medicamento antiinflamatorio
EMA/CVMP/259397/2006 EMEA/V/C/000033 Información general sobre Metacam y sobre los motivos por los que se autoriza su uso en la UE Qué es Metacam y para qué se utiliza? Metacam es un medicamento antiinflamatorio
4. CIFs asociados... 5. 8. Enviar datos AEMPS... 10. Acceso a la aplicación ESVAC para los LABORATORIOS... 11. 1. Acceso a la aplicación...
 Manual de Usuario Aplicación para la recogida de datos del Sistema de Vigilancia Europeo de datos de consumo de antibióticos ESVAC (European Surveillance of Veterinary Antimicrobial Consumption) 2015 Acceso
Manual de Usuario Aplicación para la recogida de datos del Sistema de Vigilancia Europeo de datos de consumo de antibióticos ESVAC (European Surveillance of Veterinary Antimicrobial Consumption) 2015 Acceso
Para obtener información práctica sobre el tratamiento con Opdivo, el paciente deberá leer el prospecto o consultar a su médico o farmacéutico.
 EMA/691693/2017 EMEA/H/C/003985 Resumen del EPAR para el público general nivolumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia ha
EMA/691693/2017 EMEA/H/C/003985 Resumen del EPAR para el público general nivolumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia ha
En la audiencia pública, se tendrá debidamente en cuenta el efecto terapéutico del medicamento.
 13 de abril de 2016 EMA/389918/2016 Normas reguladoras del procedimiento para la organización y realización de audiencias públicas en el Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC)
13 de abril de 2016 EMA/389918/2016 Normas reguladoras del procedimiento para la organización y realización de audiencias públicas en el Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC)
deterioro de la visión causado por un edema macular provocado por la diabetes;
 EMA/677928/2015 EMA/H/C/002392 Resumen del EPAR para el público general aflibercept El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de Medicamentos
EMA/677928/2015 EMA/H/C/002392 Resumen del EPAR para el público general aflibercept El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de Medicamentos
Metacam. meloxicam. Qué es Metacam y para qué se utiliza? Resumen del EPAR para el público general
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Resumen del EPAR para el público general meloxicam El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia
EMA/CVMP/259397/2006 EMEA/V/C/000033 Resumen del EPAR para el público general meloxicam El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo la Agencia
IMI-PROTECT: Proyecto para la modernización de la farmacovigilancia europea
 Mesa de Iniciativas Internacionales IMI-PROTECT: Proyecto para la modernización de la farmacovigilancia europea Prof. Francisco J. de Abajo AEMPS Dpto. de Farmacología. Universidad de Alcalá III Conferencia
Mesa de Iniciativas Internacionales IMI-PROTECT: Proyecto para la modernización de la farmacovigilancia europea Prof. Francisco J. de Abajo AEMPS Dpto. de Farmacología. Universidad de Alcalá III Conferencia
Para acceder a la Biblioteca digital, lo primero es acceder al área privada de la web del Colegio www.icasal.com.
 Guía de Uso Acceso Para acceder a la Biblioteca digital, lo primero es acceder al área privada de la web del Colegio www.icasal.com. A continuación, pulse en el icono Nube de Lectura del CRACYL, que verá
Guía de Uso Acceso Para acceder a la Biblioteca digital, lo primero es acceder al área privada de la web del Colegio www.icasal.com. A continuación, pulse en el icono Nube de Lectura del CRACYL, que verá
Guía de usuario i. Guía de usuario
 Guía de usuario i Guía de usuario Sumario Introducción... 3 Datos empresa... 4 Configuración Datos Empresa... 5 Área de trabajo en la aplicación... 7 Entrada de datos... 15 Clientes... 15 Proveedores...
Guía de usuario i Guía de usuario Sumario Introducción... 3 Datos empresa... 4 Configuración Datos Empresa... 5 Área de trabajo en la aplicación... 7 Entrada de datos... 15 Clientes... 15 Proveedores...
SUPERINTENDENCIA DE BANCOS Y SEGUROS DEL ECUADOR
 SUPERINTENDENCIA DE BANCOS Y SEGUROS DEL ECUADOR SISTEMA DE PROVIDENCIAS JUDICIALES MANUAL DE USUARIO EXTERNO VERSIÓN 1.0 Septiembre de 2014 Contenido 1. Introducción... 3 2. Generalidades... 3 2.1. Ingreso
SUPERINTENDENCIA DE BANCOS Y SEGUROS DEL ECUADOR SISTEMA DE PROVIDENCIAS JUDICIALES MANUAL DE USUARIO EXTERNO VERSIÓN 1.0 Septiembre de 2014 Contenido 1. Introducción... 3 2. Generalidades... 3 2.1. Ingreso
COMUNICACIÓN DE SUPUESTA REACCIÓN ADVERSA EN ANIMALES O EN EL HOMBRE POSTERIOR AL USO DE MEDICAMENTOS VETERINARIOS
 PNT 066 Ed.2ª INFORMACIÓN CONFIDENCIAL Pág. 1 de 5 COMUNICACIÓN DE SUPUESTA REACCIÓN ADVERSA EN ANIMALES O EN EL HOMBRE POSTERIOR AL USO DE MEDICAMENTOS VETERINARIOS (leyenda en gris: parte a rellenar
PNT 066 Ed.2ª INFORMACIÓN CONFIDENCIAL Pág. 1 de 5 COMUNICACIÓN DE SUPUESTA REACCIÓN ADVERSA EN ANIMALES O EN EL HOMBRE POSTERIOR AL USO DE MEDICAMENTOS VETERINARIOS (leyenda en gris: parte a rellenar
Manual de integración Tarjeta Amarilla - RELE. e -
 Manual de integración Tarjeta Amarilla - RELE e - INDICE 1. INTEGRACIÓN DE RECETA ELECTRÓNICA CON TARJETA AMARILLA 2 2. PUNTOS DE ACCESO A TARJETA AMARILLA 2 2.1. ACCESO DESDE LA OFICINA DE FARMACIA 2
Manual de integración Tarjeta Amarilla - RELE e - INDICE 1. INTEGRACIÓN DE RECETA ELECTRÓNICA CON TARJETA AMARILLA 2 2. PUNTOS DE ACCESO A TARJETA AMARILLA 2 2.1. ACCESO DESDE LA OFICINA DE FARMACIA 2
CONVENIO COLECTIVO DE TRABAJO GENERAL (CCTG) PARA LA ADMINISTRACION PUBLICA NACIONAL (APN) HOMOLOGADO POR DECRETO N 214/06
 Año 2013 Decreto: 687/13 Gerente A 7.159,64 7.159,64 14.312,23 28.631,51 7.926,75 7.926,75 15.845,69 31.699,19 Gerente B 5.968,32 5.968,32 11.927,26 23.863,90 6.607,79 6.607,79 13.205,18 26.420,76 Coordinador
Año 2013 Decreto: 687/13 Gerente A 7.159,64 7.159,64 14.312,23 28.631,51 7.926,75 7.926,75 15.845,69 31.699,19 Gerente B 5.968,32 5.968,32 11.927,26 23.863,90 6.607,79 6.607,79 13.205,18 26.420,76 Coordinador
MANUAL DE USUARIO DE LABORATORIOS GESFARMA ADMINISTRACIÓN ELECTRÓNICA
 MANUAL DE USUARIO DE LABORATORIOS GESFARMA ADMINISTRACIÓN ELECTRÓNICA 1 ÍNDICE ÍNDICE 2 1. CONFIGURACIÓN DE LA MÁQUINA VIRTUAL DE JAVA 3 2. ACCESO A LA APLICACIÓN CON CERTIFICADO ELECTRÓNICO 6 3. RECONOCIMIENTO
MANUAL DE USUARIO DE LABORATORIOS GESFARMA ADMINISTRACIÓN ELECTRÓNICA 1 ÍNDICE ÍNDICE 2 1. CONFIGURACIÓN DE LA MÁQUINA VIRTUAL DE JAVA 3 2. ACCESO A LA APLICACIÓN CON CERTIFICADO ELECTRÓNICO 6 3. RECONOCIMIENTO
Aspectos más destacados del informe anual
 28 November 211 EMA/931664/211 Oficina del Director Ejecutivo Aspectos más destacados del informe anual 21 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 ()2 7418 84 Facsimile
28 November 211 EMA/931664/211 Oficina del Director Ejecutivo Aspectos más destacados del informe anual 21 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom Telephone +44 ()2 7418 84 Facsimile
Parametrización de instituciones
 PARAMETRIZACIÓN DE INSTITUCIONES... Visualizar parámetros de una institución... Incluir una institución... 2 Asignar un tipo de solicitud a una institución... 3 Eliminar un tipo de solicitud de una institución...
PARAMETRIZACIÓN DE INSTITUCIONES... Visualizar parámetros de una institución... Incluir una institución... 2 Asignar un tipo de solicitud a una institución... 3 Eliminar un tipo de solicitud de una institución...
NORMAS DE USO. El horario de uso para investigación del equipo de resonancia magnética (3 Teslas) es de 16:00-20:30.
 NORMAS DE USO SERVICIO DE RESONANCIA MAGNÉTICA PARA INVESTIGACIONES BIOMÉDICAS Responsable del Servicio: José Luis González Mora Técnico del Servicio: Cristián Modroño Pascual Dirección: Edificio Imetisa.
NORMAS DE USO SERVICIO DE RESONANCIA MAGNÉTICA PARA INVESTIGACIONES BIOMÉDICAS Responsable del Servicio: José Luis González Mora Técnico del Servicio: Cristián Modroño Pascual Dirección: Edificio Imetisa.
DICTAMEN DEFINITIVO DEL COMITÉ DE ESPECIALIDADES FARMACÉUTICAS DE CONFORMIDAD CON EL ARTÍCULO 12 DE LA DIRECTIVA 75/319/CEE MODIFICADA, PARA
 The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit CPMP/375/97-ES DICTAMEN DEFINITIVO DEL COMITÉ DE ESPECIALIDADES FARMACÉUTICAS DE CONFORMIDAD CON EL ARTÍCULO
The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit CPMP/375/97-ES DICTAMEN DEFINITIVO DEL COMITÉ DE ESPECIALIDADES FARMACÉUTICAS DE CONFORMIDAD CON EL ARTÍCULO
CONTROL DE VERSIONES. Manual de Usuario Crystal Box. Versión 1.1
 Manual de Usuario Crystal Box Versión 1.1 CONTROL DE VERSIONES Versión Fecha Modificaciones 1.0 11/07/2013 Creación del documento 1.1 26/11/2014 Añadida información de inspecciones y eventos de posicionados
Manual de Usuario Crystal Box Versión 1.1 CONTROL DE VERSIONES Versión Fecha Modificaciones 1.0 11/07/2013 Creación del documento 1.1 26/11/2014 Añadida información de inspecciones y eventos de posicionados
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Código seguro de verificación: VEFCMFH/-FZAgIi5U-ZlBNKKCL-7b/dur21 Página 1 de 12
 Código seguro de verificación: VEFCMFH/-FZAgIi5U-ZlBNKKCL-7b/dur21 Página 1 de 12 Código seguro de verificación: VEFCMFH/-FZAgIi5U-ZlBNKKCL-7b/dur21 Página 2 de 12 Código seguro de verificación: VEFCMFH/-FZAgIi5U-ZlBNKKCL-7b/dur21
Código seguro de verificación: VEFCMFH/-FZAgIi5U-ZlBNKKCL-7b/dur21 Página 1 de 12 Código seguro de verificación: VEFCMFH/-FZAgIi5U-ZlBNKKCL-7b/dur21 Página 2 de 12 Código seguro de verificación: VEFCMFH/-FZAgIi5U-ZlBNKKCL-7b/dur21
UNIVERSIDAD MIGUEL HERNANDEZ
 DETALLADO POR Página:1/ 12 1 00 4220 1 47.756.471,58 47.914.609,80 165.661,49 3.898,98 19.946.971,95 0,00 0,00 17.109.050,60 10.689.026,78 07 4220 1 17.000,00 25.320,00 8.320,00 0,00 680,00 0,00 0,00 11.280,00
DETALLADO POR Página:1/ 12 1 00 4220 1 47.756.471,58 47.914.609,80 165.661,49 3.898,98 19.946.971,95 0,00 0,00 17.109.050,60 10.689.026,78 07 4220 1 17.000,00 25.320,00 8.320,00 0,00 680,00 0,00 0,00 11.280,00
NO REQUIERE FIRMAS. Con_Pliegos de Prescripciones Técnicas: PLIEGO TECNICO GAS NATURAL
 Página 1 de 13 NO REQUIERE Página 2 de 13 NO REQUIERE Página 3 de 13 NO REQUIERE Página 4 de 13 NO REQUIERE Página 5 de 13 NO REQUIERE Página 6 de 13 NO REQUIERE Página 7 de 13 NO REQUIERE Página 8 de
Página 1 de 13 NO REQUIERE Página 2 de 13 NO REQUIERE Página 3 de 13 NO REQUIERE Página 4 de 13 NO REQUIERE Página 5 de 13 NO REQUIERE Página 6 de 13 NO REQUIERE Página 7 de 13 NO REQUIERE Página 8 de
Manual de Usuario DISTRIBUIDORES DE MEDICAMENTOS VETERINARIOS ENTIDADES GANADERAS
 Manual de Usuario DISTRIBUIDORES DE ENTIDADES GANADERAS Aplicación para la recogida de datos del Sistema de Vigilancia Europeo de datos de consumo de antibióticos ESVAC (European Surveillance of Veterinary
Manual de Usuario DISTRIBUIDORES DE ENTIDADES GANADERAS Aplicación para la recogida de datos del Sistema de Vigilancia Europeo de datos de consumo de antibióticos ESVAC (European Surveillance of Veterinary
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2016 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre del 2016
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2016 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre del 2016
EMBARGO DE B. MUEBLES. NOTIFICACIÓN. F.3 Rec. Ejecutiva/Embargo/Embargo de B. Muebles. Notificación F.3
 EMBARGO DE B. MUEBLES. NOTIFICACIÓN. F.3 Rec. Ejecutiva/Embargo/Embargo de B. Muebles. Notificación F.3 Desde esta opción se podrán generar y consultar todas las notificaciones referentes al embargo de
EMBARGO DE B. MUEBLES. NOTIFICACIÓN. F.3 Rec. Ejecutiva/Embargo/Embargo de B. Muebles. Notificación F.3 Desde esta opción se podrán generar y consultar todas las notificaciones referentes al embargo de
APLICACIÓN HCDSNS Manual de Acceso del Ciudadano
 APLICACIÓN HCDSNS Manual de Acceso del Ciudadano Versión 1.2 Mayo 2015 Página 1 de 13 1 Pasos previos y requisitos de acceso Los usuarios deberán realizar los siguientes pasos para acceder al sistema:
APLICACIÓN HCDSNS Manual de Acceso del Ciudadano Versión 1.2 Mayo 2015 Página 1 de 13 1 Pasos previos y requisitos de acceso Los usuarios deberán realizar los siguientes pasos para acceder al sistema:
GuíaSalud: Guías de Práctica Clínica en el Sistema Nacional de Salud
 GuíaSalud: Guías de Práctica Clínica en el Sistema Nacional de Salud Autores Eva López Madurga 1 Flavia Salcedo Fernández 2 Juan Ignacio Martín 2 1. Directora de Transferencia del Conocimiento. 2. Técnicos
GuíaSalud: Guías de Práctica Clínica en el Sistema Nacional de Salud Autores Eva López Madurga 1 Flavia Salcedo Fernández 2 Juan Ignacio Martín 2 1. Directora de Transferencia del Conocimiento. 2. Técnicos
Manual de usuario Portal Bolsa Nacional de Empleo
 Portal Bolsa Nacional de Empleo CONTROL DE VERSIONES ASEGÚRESE DE QUE ESTE DOCUMENTO ESTÁ ACTUALIZADO. LAS COPIAS IMPRESAS O LOCALES PUEDEN ESTAR OBSOLETAS. EDICIÓN 01 Primera versión validada del documento.
Portal Bolsa Nacional de Empleo CONTROL DE VERSIONES ASEGÚRESE DE QUE ESTE DOCUMENTO ESTÁ ACTUALIZADO. LAS COPIAS IMPRESAS O LOCALES PUEDEN ESTAR OBSOLETAS. EDICIÓN 01 Primera versión validada del documento.
APLICACIÓN HCDSNS Manual de Acceso del Ciudadano
 APLICACIÓN HCDSNS Manual de Acceso del Ciudadano Versión 1.2 Mayo 2015 Página 1 de 13 1 Pasos previos y requisitos de acceso Los usuarios deberán realizar los siguientes pasos para acceder al sistema:
APLICACIÓN HCDSNS Manual de Acceso del Ciudadano Versión 1.2 Mayo 2015 Página 1 de 13 1 Pasos previos y requisitos de acceso Los usuarios deberán realizar los siguientes pasos para acceder al sistema:
OPA Guía de usuario. Cita Previa por Internet GUÍA DE USUARIO. Consejo Sanitario 1
 OPA Guía de usuario Cita Previa por GUÍA DE USUARIO Consejo Sanitario 1 ÍNDICE 1. QUÉ ES?...3 2. CÓMO PUEDO ACCEDER?...4 3. CÓMO ME IDENTIFICO?...5 3.1. SECCIÓN DE IDENTIFICACIÓN...5 3.2. SECCIÓN DE AYUDA...7
OPA Guía de usuario Cita Previa por GUÍA DE USUARIO Consejo Sanitario 1 ÍNDICE 1. QUÉ ES?...3 2. CÓMO PUEDO ACCEDER?...4 3. CÓMO ME IDENTIFICO?...5 3.1. SECCIÓN DE IDENTIFICACIÓN...5 3.2. SECCIÓN DE AYUDA...7
Guía de uso básico de IMTLazarus
 Guía de uso básico de IMTLazarus En este documento se expone el uso básico de IMTLazarus. Dependiendo del perfil de supervisor se puede tener acceso a varias de las opciones que proporciona el sistema
Guía de uso básico de IMTLazarus En este documento se expone el uso básico de IMTLazarus. Dependiendo del perfil de supervisor se puede tener acceso a varias de las opciones que proporciona el sistema
Seguridad del paciente: estrategias y actuaciones. Alberto Pardo Subdirector de calidad Servicio Madrileño de Salud
 Seguridad del paciente: estrategias y actuaciones Alberto Pardo Subdirector de calidad Servicio Madrileño de Salud Calidad: Seguridad Propiedad o conjunto de propiedades inherentes a una cosa que permiten
Seguridad del paciente: estrategias y actuaciones Alberto Pardo Subdirector de calidad Servicio Madrileño de Salud Calidad: Seguridad Propiedad o conjunto de propiedades inherentes a una cosa que permiten
FORMULARIO DE RECOGIDA DE DATOS FARMACOVIGILANCIA VETERINARIA PNT066 Ed. 4ª INFORMACIÓN CONFIDENCIAL Página 1 de 5
 PNT066 Ed. 4ª INFORMACIÓN CONFIDENCIAL Página 1 de 5 Nota: importante rellenar todos los apartados marcados con un asterisco (*) Nº REFERENCIA: (A rellenar por el Dpto. de FV) Fecha de recepción de la
PNT066 Ed. 4ª INFORMACIÓN CONFIDENCIAL Página 1 de 5 Nota: importante rellenar todos los apartados marcados con un asterisco (*) Nº REFERENCIA: (A rellenar por el Dpto. de FV) Fecha de recepción de la
UNIVERSIDAD DE SEVILLA CENTRO INTERNACIONAL
 OFERTA DE SEGURO PARA ESTUDIANTES, PROFESORES Y PAS DE MOVILIDAD INTERNACIONAL PARA UNIVERSIDAD DE SEVILLA CENTRO INTERNACIONAL DATOS DEL OFERTANTE - Denominación Social: Montymarq Asociados, Consultores
OFERTA DE SEGURO PARA ESTUDIANTES, PROFESORES Y PAS DE MOVILIDAD INTERNACIONAL PARA UNIVERSIDAD DE SEVILLA CENTRO INTERNACIONAL DATOS DEL OFERTANTE - Denominación Social: Montymarq Asociados, Consultores
MANUAL DE USUARIOS DEL SITIO WEB REMAS
 MANUAL DE USUARIOS DEL SITIO WEB REMAS RED DE ESTACIONES METEOROLÓGICAS AUTOMATIZADAS DEL ESTADO DE SONORA Versión 1. Mayo de 2015 CESAVESON SIAFESON Contenido I. Introducción... 2 II. Sitio web... 2 III.
MANUAL DE USUARIOS DEL SITIO WEB REMAS RED DE ESTACIONES METEOROLÓGICAS AUTOMATIZADAS DEL ESTADO DE SONORA Versión 1. Mayo de 2015 CESAVESON SIAFESON Contenido I. Introducción... 2 II. Sitio web... 2 III.
REPORTE AL DÍA. Nuestro propósito es invertir la proporción que se refleja actualmente.
 BOLETÍN 7 2 AÑO 2 / FEBRERO 2005 REPORTE AL DÍA En la base de datos se encuentran sistematizados 1866 reportes de Eventos Adversos a Medicamentos (EAM). Se observa un importante incremento del reporte
BOLETÍN 7 2 AÑO 2 / FEBRERO 2005 REPORTE AL DÍA En la base de datos se encuentran sistematizados 1866 reportes de Eventos Adversos a Medicamentos (EAM). Se observa un importante incremento del reporte
Tutoriales y Guías de uso con Orientaciones Pedagógicas Entorno Virtual de Aprendizaje Plataforma Blackboard WIKIS
 Creación o Modificación de Wikis Wikis: Un wiki es una herramienta de colaboración que le permite a los alumnos ver, contribuir y modificar una o varias páginas de materiales relacionados con los cursos.
Creación o Modificación de Wikis Wikis: Un wiki es una herramienta de colaboración que le permite a los alumnos ver, contribuir y modificar una o varias páginas de materiales relacionados con los cursos.
Protocolo de Farmacovigilancia
 Protocolo de Farmacovigilancia Código tipo de Farmaindustria de Protección de Datos Personales en el ámbito de la Investigación Clínica y de la Farmacovigilancia Mercedes Francés Foz Departamento Técnico
Protocolo de Farmacovigilancia Código tipo de Farmaindustria de Protección de Datos Personales en el ámbito de la Investigación Clínica y de la Farmacovigilancia Mercedes Francés Foz Departamento Técnico
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME II SEMESTRE DEL 2016 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el segundo semestre del 2016
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME II SEMESTRE DEL 2016 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el segundo semestre del 2016
MANUAL FUNCIONAL GESTIÓN DE DEMANDAS SISTEMA SUBASTAS HOLANDESAS Y DEMANDAS EN FIRME
 Página: 1 de 18 TABLA DE CONTENIDO 1 ALCANCE... 3 2 REQUISITOS E INGRESO AL SISTEMA... 3 3 INGRESO A LA OPERACIÓN... 3 3.1 Ingreso a la operación después de autenticarse... 3 3.2 Cambiar de Operación...
Página: 1 de 18 TABLA DE CONTENIDO 1 ALCANCE... 3 2 REQUISITOS E INGRESO AL SISTEMA... 3 3 INGRESO A LA OPERACIÓN... 3 3.1 Ingreso a la operación después de autenticarse... 3 3.2 Cambiar de Operación...
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Manual de Usuario para LABORATORIOS
 Manual de Usuario para LABORATORIOS Aplicación para la recogida de datos del Sistema de Vigilancia Europeo de datos de consumo de antibióticos ESVAC (European Surveillance of Veterinary Antimicrobial Consumption)
Manual de Usuario para LABORATORIOS Aplicación para la recogida de datos del Sistema de Vigilancia Europeo de datos de consumo de antibióticos ESVAC (European Surveillance of Veterinary Antimicrobial Consumption)
Acceso a la aplicación ESVAC para DISTRIBUIDORES Acceso a la aplicación Alta de usuarios... 3
 Manual de Usuario Aplicación para la recogida de datos del Sistema de Vigilancia Europeo de datos de consumo de antibióticos ESVAC (European Surveillance of Veterinary Antimicrobial Consumption) 2016 Acceso
Manual de Usuario Aplicación para la recogida de datos del Sistema de Vigilancia Europeo de datos de consumo de antibióticos ESVAC (European Surveillance of Veterinary Antimicrobial Consumption) 2016 Acceso
Immediate action (acción inmediata) Update (actualización) Information request (solicitud de información)
 ALERTA DE DISPOSITIVO MÉDICO Expedido: 01 de julio de 2008 a las 11:00 Immediate action (acción inmediata) Action (acción) Update (actualización) Information request (solicitud de información) Dispositivo:
ALERTA DE DISPOSITIVO MÉDICO Expedido: 01 de julio de 2008 a las 11:00 Immediate action (acción inmediata) Action (acción) Update (actualización) Information request (solicitud de información) Dispositivo:
LA SEGURIDAD DE LOS MEDICAMENTOS: REACCIONES ADVERSAS
 LA SEGURIDAD DE LOS MEDICAMENTOS: REACCIONES ADVERSAS Contribución de la enfermería en el uso racional de los medicamentos DEFINICIÓN de RAM Una respuesta a un fármaco que es nociva e involuntaria, que
LA SEGURIDAD DE LOS MEDICAMENTOS: REACCIONES ADVERSAS Contribución de la enfermería en el uso racional de los medicamentos DEFINICIÓN de RAM Una respuesta a un fármaco que es nociva e involuntaria, que
PLANTILLAS. Facultativo
 PLANTILLAS. En muchas ocasiones los informes y hojas tendrán elementos comunes, existe la posibilidad de realizar plantilla, de forma que cuando un nuevo informe corresponda a alguna de esas plantillas
PLANTILLAS. En muchas ocasiones los informes y hojas tendrán elementos comunes, existe la posibilidad de realizar plantilla, de forma que cuando un nuevo informe corresponda a alguna de esas plantillas
MANUAL DE USUARIO DE LABORATORIOS GESFARMA ADMINISTRACIÓN ELECTRÓNICA
 MANUAL DE USUARIO DE LABORATORIOS GESFARMA ADMINISTRACIÓN ELECTRÓNICA 1 ÍNDICE ÍNDICE 2 1. CONFIGURACIÓN DE LA MÁQUINA VIRTUAL DE JAVA 3 2. VALIDAR FIRMA SIN REGISTRAR 6 3. ACCESO A LA APLICACIÓN CON CERTIFICADO
MANUAL DE USUARIO DE LABORATORIOS GESFARMA ADMINISTRACIÓN ELECTRÓNICA 1 ÍNDICE ÍNDICE 2 1. CONFIGURACIÓN DE LA MÁQUINA VIRTUAL DE JAVA 3 2. VALIDAR FIRMA SIN REGISTRAR 6 3. ACCESO A LA APLICACIÓN CON CERTIFICADO
PLATAFORMA - SAP Proyecto Comercio Electrónico
 PLATAFORMA - SAP Proyecto Comercio Electrónico MANUAL DE USUARIO Acceso y Navegación Suministrador Referencia: ECPR1_Acceso y Navegación Fecha creación: 22/12/2008 1. DESCRIPCIÓN Función: ACCESO y NAVEGACIÓN
PLATAFORMA - SAP Proyecto Comercio Electrónico MANUAL DE USUARIO Acceso y Navegación Suministrador Referencia: ECPR1_Acceso y Navegación Fecha creación: 22/12/2008 1. DESCRIPCIÓN Función: ACCESO y NAVEGACIÓN
4. Análisis de los procesos externos relacionados con el servicio de farmacia hospitalaria
 4. Análisis de los procesos externos relacionados con el servicio de farmacia hospitalaria Definición, objetivos y criterios Para evaluar los procesos externos en un SFH se han definido las tareas que
4. Análisis de los procesos externos relacionados con el servicio de farmacia hospitalaria Definición, objetivos y criterios Para evaluar los procesos externos en un SFH se han definido las tareas que
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2015 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre del 2015
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2015 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre del 2015
Número 11. Junio 1999 ANAMNESIS FARMACOLÓGICA NOTAS INFORMATIVAS SURVECTOR
 Número 11. Junio 1999 ANAMNESIS FARMACOLÓGICA Riesgos y beneficios de la información rápida sobre reacciones adversas NOTAS INFORMATIVAS SURVECTOR (amineptino), suspensión de su comercialización. QUE HAY
Número 11. Junio 1999 ANAMNESIS FARMACOLÓGICA Riesgos y beneficios de la información rápida sobre reacciones adversas NOTAS INFORMATIVAS SURVECTOR (amineptino), suspensión de su comercialización. QUE HAY
Sistema de Información de Compras y Contrataciones del Estado (SICE) Buscador de facturas
 Sistema de Información de Compras y Contrataciones del Estado (SICE) Buscador de facturas INFORMACIÓN DE INTERÉS Última actualización: 15/11/2011 Nombre actual del archivo: Buscador de facturas.odt Tabla
Sistema de Información de Compras y Contrataciones del Estado (SICE) Buscador de facturas INFORMACIÓN DE INTERÉS Última actualización: 15/11/2011 Nombre actual del archivo: Buscador de facturas.odt Tabla
Servicios de salud de Chihuahua
 2017 MÓDULO. KARDEX DE ENFERMERIA El kardex de enfermería presenta la información relacionada con las indicaciones médicas registradas al paciente como un plan de cuidados continuo. En este módulo, el
2017 MÓDULO. KARDEX DE ENFERMERIA El kardex de enfermería presenta la información relacionada con las indicaciones médicas registradas al paciente como un plan de cuidados continuo. En este módulo, el
MÓDULO 10 INVENTARIO
 MÓDULO 10 INVENTARIO 10.1.- FICHERO DE BIENES 10.2.- GRUPOS DE AMORTIZACIÓN 10.3.- GENERACIÓN DE AMORTIZACIÓN 10.4.- GENERACIÓN DE ASIENTOS DE DOTACIÓN 10.5.- GENERAR ASIENTO DE BAJA 10.6.- INVENTARIO
MÓDULO 10 INVENTARIO 10.1.- FICHERO DE BIENES 10.2.- GRUPOS DE AMORTIZACIÓN 10.3.- GENERACIÓN DE AMORTIZACIÓN 10.4.- GENERACIÓN DE ASIENTOS DE DOTACIÓN 10.5.- GENERAR ASIENTO DE BAJA 10.6.- INVENTARIO
Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN
 Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN 10.1. EFECTOS ADVERSOS ASOCIADOS A LAS VACUNAS Las vacunas son productos biológicos compuestos por antígeno/s (único o múltiples)
Capítulo 10 SEGURIDAD VACUNAL Y VIGILANCIA DE EFECTOS ADVERSOS DE LA VACUNACIÓN 10.1. EFECTOS ADVERSOS ASOCIADOS A LAS VACUNAS Las vacunas son productos biológicos compuestos por antígeno/s (único o múltiples)
Contenido. Dirección EDGAR SILVIO SANCHEZ VILLEGAS Gerente. Edición MARTHA HELENA MEDINA ANGEL Líder Gestión de Calidad
 Volumen 3. Nº 10 Abril -Junio de 2011 Contenido 1. EDITORIAL 2. REPORTE DE EVENTOS ADVERSOS 3. TIPOS DE EVENTOS ADVERSOS 4. EVENTOS ADVERSOS POR SERVICIOS 5. INFECCIONES DERIVADAS POR LA ATENCIÓN POR SERVICIO
Volumen 3. Nº 10 Abril -Junio de 2011 Contenido 1. EDITORIAL 2. REPORTE DE EVENTOS ADVERSOS 3. TIPOS DE EVENTOS ADVERSOS 4. EVENTOS ADVERSOS POR SERVICIOS 5. INFECCIONES DERIVADAS POR LA ATENCIÓN POR SERVICIO
Manual de Usuario DOCTOR Perfil
 Manual de Usuario PerfilDOCTOR Manual de Usuario PerfilDOCTOR Ventana Inicial Url de Ingreso Registro de Doctor Funcionalidades de la Ventana Inicial Recuperar la Contraseña Menú de Inicio Funcionalidades
Manual de Usuario PerfilDOCTOR Manual de Usuario PerfilDOCTOR Ventana Inicial Url de Ingreso Registro de Doctor Funcionalidades de la Ventana Inicial Recuperar la Contraseña Menú de Inicio Funcionalidades
MANUAL DE USO DE TIENDA ONLINE
 2016 MANUAL DE USO DE TIENDA ONLINE INDICE 1. Página de acceso (pag. 3) Dirección de acceso 2. Búsqueda de un neumático (pag. 4 y 5) Búsqueda sencilla Búsqueda avanzada 3.Resultados de búsqueda (pag. 5)
2016 MANUAL DE USO DE TIENDA ONLINE INDICE 1. Página de acceso (pag. 3) Dirección de acceso 2. Búsqueda de un neumático (pag. 4 y 5) Búsqueda sencilla Búsqueda avanzada 3.Resultados de búsqueda (pag. 5)
SUBVENCIONES GUADALINFO 2014 PREGUNTAS FRECUENTES
 SUBVENCIONES GUADALINFO 2014 PREGUNTAS FRECUENTES Cuál es el objeto de la Orden? Tiene como objeto incorporar y acercar las Nuevas Tecnologías a la ciudadanía de los municipios andaluces en situación de
SUBVENCIONES GUADALINFO 2014 PREGUNTAS FRECUENTES Cuál es el objeto de la Orden? Tiene como objeto incorporar y acercar las Nuevas Tecnologías a la ciudadanía de los municipios andaluces en situación de
DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2014 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre de 2014 (enero de 2014 hasta
DIRECCIÓN DE REGULACIÓN DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I SEMESTRE DEL 2014 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer semestre de 2014 (enero de 2014 hasta
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I CUATRIMESTRE DEL 2017 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer cuatrimestre
DIRECCIÓN DE REGULACIÓN DE PRODUCTOS DE INTERÉS SANITARIO CENTRO NACIONAL DE FARMACOVIGILANCIA INFORME I CUATRIMESTRE DEL 2017 SOSPECHAS DE REACCIÓN ADVERSA A MEDICAMENTO Durante el primer cuatrimestre
CARTILLA DE INSTRUCCIONES PARA EL USUARIO FORMULARIO DE INVENTARIO - SUPREMA - CORTES SUPERIORES DE JUSTICIA SISTEMA DE INVENTARIO DE EXPEDIENTES
 CARTILLA DE INSTRUCCIONES PARA EL USUARIO FORMULARIO DE INVENTARIO - SUPREMA - CORTES SUPERIORES DE JUSTICIA SISTEMA DE INVENTARIO DE EXPEDIENTES SISTEMA DE INVENTARIO DE EXPEDIENTES FECHA DE ENTREGA :
CARTILLA DE INSTRUCCIONES PARA EL USUARIO FORMULARIO DE INVENTARIO - SUPREMA - CORTES SUPERIORES DE JUSTICIA SISTEMA DE INVENTARIO DE EXPEDIENTES SISTEMA DE INVENTARIO DE EXPEDIENTES FECHA DE ENTREGA :
Portal de Proveedores Darse de alta
 Portal de Proveedores Darse de alta Índice 1 INTRODUCCIÓN...3 2 SOLICITUD DE ALTA...3 2.1 CONDICIONES DE USO... 4 2.2 DATOS GENERALES DE LA COMPAÑÍA... 5 2.3 ACTIVIDADES DE LA EMPRESA... 6 2.4 DATOS DEL
Portal de Proveedores Darse de alta Índice 1 INTRODUCCIÓN...3 2 SOLICITUD DE ALTA...3 2.1 CONDICIONES DE USO... 4 2.2 DATOS GENERALES DE LA COMPAÑÍA... 5 2.3 ACTIVIDADES DE LA EMPRESA... 6 2.4 DATOS DEL
Manual de Usuario. Figura 1.3
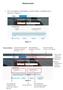 Manual de Usuario 1. Una vez que ingresó a la herramienta, se podrá visualizar la pantalla como se muestra en la Figura 1.3. Figura 1.3 Funcionalidades Central de información para búsqueda de posiciones
Manual de Usuario 1. Una vez que ingresó a la herramienta, se podrá visualizar la pantalla como se muestra en la Figura 1.3. Figura 1.3 Funcionalidades Central de información para búsqueda de posiciones


