RIÑÓN Y LÍQUIDOS CORPORALES. 29. Regulación del equilibrio ácido-base
|
|
|
- Cristián Velázquez Farías
- hace 7 años
- Vistas:
Transcripción
1 RIÑÓN Y LÍQUIDOS CORPORALES 29. Regulación del equilibrio ácido-base INTRODUCCIÓN La concentración de iones H + libres en sangre se mantiene normalmente entre 40 y 45 nmol/litro, lo cual da un valor de ph sanguíneo comprendido entre 7,35 y 7,45, valor medio de referencia 7,40 (los valores compatibles con la vida estarían entre 6,8 y 7,7). El organismo produce continuamente ácidos no volátiles y CO 2 como consecuencia del metabolismo, estas moléculas generadoras de H + modificarán la concentración de estos iones y el valor del ph. La regulación se realiza en dos etapas: 1) los iones H + son amortiguados o neutralizados por otras moléculas y, 2) posteriormente son eliminados del organismo. El equilibrio ácido-base estudia los mecanismos que mantienen los valores de los iones hidrógeno de los líquidos corporales dentro de los límites normales. Las células son muy sensibles al ph del medio extracelular. Éste tiene un ph de 7,4 y un descenso por debajo de 7 o un ascenso por encima de 7,8 puede resultar letal. Ello significa que la concentración de H + debe encontrarse entre nmol/litro. La sangre es ligeramente alcalina con un ph de 7,4 ± 0,04, es decir con un rango en la concentración de H + aún menor. ph INTRACELULAR Las células son menos alcalinas que el plasma, con un ph próximo a 7. Existen en el interior celular una gran cantidad de funciones que son dependientes estrechamente del ph (glucolisis, gluconeogénesis, síntesis de ADN, proliferación celular, funcionamiento de canales, etc.) El metabolismo celular produce H + que deben ser tamponados antes de proceder a su excreción. Las proteínas celulares y otras macromoléculas ejercen un importante papel tamponador y el sistema antitransporte de Na + / H + la vía más importante para su eliminación de las células. El ph extracelular es un reflejo del ph intracelular y a la viceversa. La concentración de H + en el cuerpo se regula de forma muy exacta, ya que las proteínas intracelulares como enzimas y canales de membrana son muy sensibles al ph. DISOCIACIÓN DEL AGUA El agua es un electrolito débil, que se disocia en pequeña escala H 2 O H + + OH - En esta reacción la constante de equilibrio K valdrá: + OH K [ H2O] Como esta constante es muy pequeña, la relación puede escribirse: K [ H ] 2O + OH, 1
2 siendo el primer término prácticamente constante, denominado "producto iónico del agua" (K w ), y su valor depende de la temperatura. 0ºC 10-14,9 8ºC 10-14,1 24ºC 10-14,0 Si se toma como valor de referencia los 24 ºC y el producto de iones es de 10-14,0 cada litro de agua pura contiene 10-7 equivalentes de hidrogeniones o de iones hidroxilo. Toda solución electrolítica con estos mismos valores se dice que es neutra. Si la concentración de hidrogeniones es mayor de 10-7 es ácida y con valores inferiores es básica. La neutralidad ácido-base viene dada por la igualdad de concentraciones de iones hidrógeno e iones hidroxilo; y la neutralidad electrolítica viene dada por la igualdad de aniones y cationes. CONCEPTO DE ph Se define ph como el logaritmo decimal del inverso de la [H + ] expresada en equivalentesgr/litro (N) ph log 1/ [H + ] o ph - log [H + ] De esta forma la neutralidad viene indicada por un valor de ph 7 siendo los valores inferiores de estado ácido y los valores superiores de estado básico. De la misma manera se puede definir poh log 1/[OH - ] Así ph + poh 14 Fisicoquímica del equilibrio ácido-base Un ácido es un compuesto capaz de liberar H + AH A - + H + Una base es un compuesto capaz de aceptar H + B + H + BH + Los pares ácido-básicos o papares conjugados están formados por un ácido y su base conjugada. Acido Base + H + Los ácidos y bases pueden caracterizarse en función de su disociación como ácidos y bases fuertes o débiles. En el caso de los fuertes la disociación es casi total y en el caso de los débiles la disociación es parcial. En el caso de un ácido débil la reacción que tendrá lugar estará desplazada hacia la izquierda cuanto más débil sea el ácido, y por lo tanto menos se disocie AH A - + H + 2
3 K a + A ; Despejando [H + ]; + [ AH] Ka A tomando logaritmos quedaría: log + + log K a log A ; cambiando de signo ambos lados de la ecuación, A log + log K a + log ; que puede escribirse como ph pka + log [ base] [ ácido] ; ecuación denominada de Henderson-Hasselbach Disoluciones reguladoras, amortiguadoras o tampón Los valores de ph en el organismo deben mantenerse en márgenes muy estrechos y próximos a la neutralidad, variando ligeramente según el órgano, célula o compartimento intracelular analizado. La sangre arterial presenta un ph alrededor de 7,4 y las oscilaciones, compatibles con la vida, no pueden ir más allá de cuatro décimas hacia arriba o hacia abajo. Para conseguirlo, el cuerpo humano dispone de varios sistemas, siendo el eje central de los mismos las disoluciones reguladoras o amortiguadoras. Se define una disolución de este tipo a la que es capaz de disminuir o "amortiguar" las variaciones de ph en el medio en el que se encuentra. H + + Tampón - Tampón Estas disoluciones pueden estar formadas de la siguiente manera: a) Un ácido débil y la sal de su base conjugada. Ejemplo: Acido acético/acetato sódico b) Una base débil y la sal de su ácido conjugado. Ejemplo: Amoniaco/Cloruro amónico Al añadir a estas disoluciones ácidos y/o bases se produce un cambio mínimo en el ph, su capacidad amortiguadora se mide como la cantidad de ácido o base añadida para lograr un cambio de una unidad en el ph. ph pka + log [sal] [acido] 3
4 La ley de masas aplicada a la situación en el equilibrio de una disolución amortiguadora permite la medida del ph mediante la ecuación de Henderson-Hasselbach La capacidad amortiguadora es máxima cuando el ph a regular está próximo a los valores de pka. Los tampones más importantes son los siguientes: Tampón Carbónico/Bicarbonato: H + + HCO - 3 H 2 CO 3 CO 2 + H 2 O Tampón Fosfato : H + + HPO H 2 PO 4 Tampón Proteinato: H + + Protein 2- HProtein (n-1)-- Los amortiguadores o tampones constituyen la primera línea de defensa en la regulación del ph. Estimación del ph plasmático La ecuación de Henderson-Hasselbach puede ser aplicada a los tampones, principalmente al Carbónico/Bicarbonato. El pk a de la siguiente reacción es de 6,1 y la solubilidad del CO 2 es de 0,03 mmol/mm Hg. CO 2 + H 2 O H 2 CO 3 H + + HCO - 3 ; abreviadamente: CO 2 + H 2 O H + + HCO - 3 ph 6,1 + log [HCO - 3] / 0,03 p CO 2 Si la concentración de ión bicarbonato vale 24 mmol/litro y la presión parcial de anhídrido carbónico en sangre arterial es de 40 mm Hg. Llevados estos valores a la ecuación anterior se obtiene un ph de 7,40. Esta ecuación resume la regulación fisiológica del ph, el numerador es controlado por el riñón, mientras que el denominador es controlado por el aparato respiratorio. Además esta ecuación también permite una clasificación racional de los desequilibrios ácidobásicos. El numerador se ve afectado bien por ingestión o producción de ácidos o bases produciendo acidosis o alcalosis metabólicas. El denominador se ve afectado por alteraciones en la ventilación pulmonar, o en la composición del aire inspirado dando lugar a acidosis o alcalosis metabólicas. 4
5 En algunas ocasiones las alteraciones pueden venir dadas por los dos mecanismos. De forma resumida se pueden clasificar las alteraciones ácido-básicas en: 1. Disminución de bicarbonato: acidosis metabólica 2. Aumento de bicarbonato: alcalosis metabólica 3. Disminución de anhídrido carbónico: alcalosis respiratoria 4. Aumento de anhídrido carbónico: acidosis respiratoria Regeneración de los tampones corporales a nivel renal La ventilación es la segunda línea de defensa en el control del ph. Es una respuesta rápida y de control reflejo que puede solucionar el 75% de los trastornos de ph. La línea final de defensa está en los riñones; son más lentos que los otros dos sistemas, amortiguadores y ventilación, pero muy eficaces para manejar cualquier trastorno remanente del ph en condiciones normales. Los riñones son los encargados de rectificar los cambios producidos por un exceso de ácido o álcali en el organismo. Debido a la compensación respiratoria, el ph puede encontrarse dentro de la normalidad, sin embargo, la concentración de tampones puede encontrarse disminuida (si ha habido un exceso de ácidos) o aumentada (si el exceso es de álcali) y se requiere su vuelta a los niveles normales. El riñón, en caso de acidosis por ejemplo, repone el bicarbonato que ha sido consumido y permite la excreción de hidrogeniones en la orina. Los mecanismos de los que dispone son los siguientes: 1. De forma directa, excretando o reabsorbiendo H + 2. De forma indirecta, aumentando o disminuyendo la reabsorción de bicarbonato Para llevar a cabo estas funciones se dispone de distintos mecanismos de transporte: a. Contratransportador bidireccional de Na + -H +, mueve Na + hacia el interior celular y H + hacia la luz del túbulo. b. Cotransportador basolateral de Na + -HCO - 3 mueve ambos hacia el líquido intersticial c. La H + -ATPasa mueve H + en contra de su gradiente hacia la luz tubular. d. La H + -K + -ATPasa, reabsorbe K + y secreta H + e. Contratransportador bidireccional de Na + -NH + 4, mueve NH + 4 a la luz tubular y Na + al interior. 5
Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H +
 Reacciones ácido-base 1 Brønsted-Lowry (1923) Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H + CH 3 COOH (aq) + H 2 O (l) H 3 O + (aq) + CH 3 COO (aq)
Reacciones ácido-base 1 Brønsted-Lowry (1923) Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H + CH 3 COOH (aq) + H 2 O (l) H 3 O + (aq) + CH 3 COO (aq)
REGULACIÓN DEL ph. Teoría Acido-Base - Anfolitos. Por lo común lo vemos representado como ph = - log [H + ]
![REGULACIÓN DEL ph. Teoría Acido-Base - Anfolitos. Por lo común lo vemos representado como ph = - log [H + ] REGULACIÓN DEL ph. Teoría Acido-Base - Anfolitos. Por lo común lo vemos representado como ph = - log [H + ]](/thumbs/40/20899659.jpg) REGULACIÓN DEL ph Teoría Acido-Base - Anfolitos Que es el ph??? Por lo común lo vemos representado como ph = - log [H ] Estrictamente, ph = - log a H En soluciones diluídas expresarlo en concentración
REGULACIÓN DEL ph Teoría Acido-Base - Anfolitos Que es el ph??? Por lo común lo vemos representado como ph = - log [H ] Estrictamente, ph = - log a H En soluciones diluídas expresarlo en concentración
Práctica 4: Fisiología renal y equilibrio ácido-base.
 Funciones del riñón: Práctica 4: Fisiología renal y equilibrio ácido-base. Técnicas Experimentales de Fisiología Animal Curso 2005-2006 1. Eliminar sustancias de desecho. 2. Regulación del equilibrio hidríco
Funciones del riñón: Práctica 4: Fisiología renal y equilibrio ácido-base. Técnicas Experimentales de Fisiología Animal Curso 2005-2006 1. Eliminar sustancias de desecho. 2. Regulación del equilibrio hidríco
ÁCIDO-BASE. ÁCIDO: Sustancia que en disolución acuosa disocia cationes H +. BASE: Sustancia que en disolución acuosa disocia aniones OH.
 ÁCIDO-BASE Ácidos: 1. CARACTERÍSTICAS DE ÁCIDOS Y BASES. Tienen sabor agrio, son corrosivos para la piel, enrojecen ciertos colorantes, vegetales. Disuelven sustancias, atacan a los metales desprendiendo
ÁCIDO-BASE Ácidos: 1. CARACTERÍSTICAS DE ÁCIDOS Y BASES. Tienen sabor agrio, son corrosivos para la piel, enrojecen ciertos colorantes, vegetales. Disuelven sustancias, atacan a los metales desprendiendo
[A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x
![[A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x [A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x](/thumbs/55/35730009.jpg) Una reacción enzimática transcurre en 10 ml de una disolución cuya concentración total de citrato es 120 mm y su ph inicial es de 7. Durante la reacción se producen 0.2 miliequivalentes de un ácido. Calcular
Una reacción enzimática transcurre en 10 ml de una disolución cuya concentración total de citrato es 120 mm y su ph inicial es de 7. Durante la reacción se producen 0.2 miliequivalentes de un ácido. Calcular
6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
SOLUCIONES AMORTIGUADORAS
 SOLUCIONES AMORTIGUADORAS Soluciones amortiguadoras son aquellas soluciones cuya concentración de hidrogeniones varía muy poco al añadirles ácidos o bases fuertes. El objeto de su empleo, tanto en técnicas
SOLUCIONES AMORTIGUADORAS Soluciones amortiguadoras son aquellas soluciones cuya concentración de hidrogeniones varía muy poco al añadirles ácidos o bases fuertes. El objeto de su empleo, tanto en técnicas
Tema 6 Reacciones de transferencia de protones. Ácidos y bases. Teoría de Brönsted-Lowry sobre ácidos y bases.
 Tema 6 Reacciones de transferencia de protones. Ácidos y bases. Teoría de Arrhenius sobre ácidos y bases. Teoría de Brönsted-Lowry sobre ácidos y bases. Fuerza relativa de ácidos y bases. Constante de
Tema 6 Reacciones de transferencia de protones. Ácidos y bases. Teoría de Arrhenius sobre ácidos y bases. Teoría de Brönsted-Lowry sobre ácidos y bases. Fuerza relativa de ácidos y bases. Constante de
Reacciones ácido-base
 Reacciones ácido-base 1 Brønsted-Lowry (1923) Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H + CH 3 COOH (aq) + H 2 O (l) H 3 O + (aq) + CH 3 COO (aq)
Reacciones ácido-base 1 Brønsted-Lowry (1923) Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H + CH 3 COOH (aq) + H 2 O (l) H 3 O + (aq) + CH 3 COO (aq)
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre. La hemoglobina aumenta la capacidad de la sangre para transportar oxígeno.
 Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
REACCIONES ÁCIDO-BASE O DE TRANSFERENCIA DE PROTONES
 REACCIONES ÁCIDOBASE O DE TRANSFERENCIA DE PROTONES Química de 2º Bachillerato Fernando Lozano Rosado INTRODUCCIÓN Desde hace mucho tiempo los químicos clasificaron todos los compuestos inorgánicos en
REACCIONES ÁCIDOBASE O DE TRANSFERENCIA DE PROTONES Química de 2º Bachillerato Fernando Lozano Rosado INTRODUCCIÓN Desde hace mucho tiempo los químicos clasificaron todos los compuestos inorgánicos en
Equilibrio Acido-Base. Dr Jorge Brenes Dittel. Nefrología.
 Equilibrio Acido-Base Dr Jorge Brenes Dittel. Nefrología. Equilibrio Acido-base. Fisiología ph es el logaritmo de la concentracíon del ión hidrogenion expresada en milimoles por litro. [H+] en sangre es
Equilibrio Acido-Base Dr Jorge Brenes Dittel. Nefrología. Equilibrio Acido-base. Fisiología ph es el logaritmo de la concentracíon del ión hidrogenion expresada en milimoles por litro. [H+] en sangre es
SOLUCIONES BUFFERS. pk = valor de ph en el cual las concentraciones del ácido y la sal son iguales
 SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
1.-EQUILIBRIOS IÓNICOS EN DISOLUCIONES ACUOSAS.
 TEMA 5 EQUILIBRIOS IÓNICOS y SISTEMAS TAMPÓN. GUIÓN. ( 2 sesiones). 1.- EQUILIBRIOS IÓNICOS EN DISOLUCIÓN ACUOSA 2.- CONCEPTO DE SISTEMA TAMPÓN. 3.- IMPORTANCIA DE LA REGULACIÓN DEL PH FISIOLÓGICO. 4.-
TEMA 5 EQUILIBRIOS IÓNICOS y SISTEMAS TAMPÓN. GUIÓN. ( 2 sesiones). 1.- EQUILIBRIOS IÓNICOS EN DISOLUCIÓN ACUOSA 2.- CONCEPTO DE SISTEMA TAMPÓN. 3.- IMPORTANCIA DE LA REGULACIÓN DEL PH FISIOLÓGICO. 4.-
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva, Ejercicio 4,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva, Ejercicio 4,
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM. ACIDOS Y BASES, ph, BUFFERS
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM ACIDOS Y BASES, ph, BUFFERS Ionización del agua y producto iónico del agua (K w ) H 2 O H + + OH - K eq = [H + ][OH - ] [H 2 O] K eq = [H + ][OH - ] [H 2 O] K eq
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM ACIDOS Y BASES, ph, BUFFERS Ionización del agua y producto iónico del agua (K w ) H 2 O H + + OH - K eq = [H + ][OH - ] [H 2 O] K eq = [H + ][OH - ] [H 2 O] K eq
ÁCIDOS Y BASES. Una sustancia se considera ácido o base según su comportamiento frente al agua.
 ÁCIDOS Y BASES 1. Concepto Ácido-Base 1.1. Teoría de Arrhenius Una sustancia se considera ácido o base según su comportamiento frente al agua. ÁCIDO: es toda sustancia que en disolución acuosa libera protones
ÁCIDOS Y BASES 1. Concepto Ácido-Base 1.1. Teoría de Arrhenius Una sustancia se considera ácido o base según su comportamiento frente al agua. ÁCIDO: es toda sustancia que en disolución acuosa libera protones
TALLER DE ANALISIS DE GASES ARTERIALES
 TALLER DE ANALISIS DE GASES ARTERIALES Dr. Menfil A Orellana-Barrios Medicina Interna Cursos Precongreso Congreso de Residentes 2012 HGSJDD www.drmenfilorellana.wordpress.com Para qué se utilizan los Gases
TALLER DE ANALISIS DE GASES ARTERIALES Dr. Menfil A Orellana-Barrios Medicina Interna Cursos Precongreso Congreso de Residentes 2012 HGSJDD www.drmenfilorellana.wordpress.com Para qué se utilizan los Gases
Actualización en Medio Interno Conceptos básicos
 Actualización en Medio Interno Conceptos básicos Bioquímica Lucrecia Drago Bioquímica M. Fernanda Pontoriero Ácidos Moléculas capaces de liberar H + HCl H + + Cl H 2 CO 3 H + + HCO 3 Bases Moléculas capaces
Actualización en Medio Interno Conceptos básicos Bioquímica Lucrecia Drago Bioquímica M. Fernanda Pontoriero Ácidos Moléculas capaces de liberar H + HCl H + + Cl H 2 CO 3 H + + HCO 3 Bases Moléculas capaces
ÍNDICE. Propiedades de ácidos y bases Teoría de Arrhenius Teoría de Brönsted y Lowry Pares conjugados ácido-base
 ÍNDICE Propiedades de ácidos y bases Teoría de Arrhenius Teoría de Brönsted y Lowry Pares conjugados ácido-base Fortaleza de las especies conjugadas Fuerza de ácidos Fuerza de bases Concepto de ph Indicadores
ÍNDICE Propiedades de ácidos y bases Teoría de Arrhenius Teoría de Brönsted y Lowry Pares conjugados ácido-base Fortaleza de las especies conjugadas Fuerza de ácidos Fuerza de bases Concepto de ph Indicadores
Aspectos fundamentales sobre ácidos y bases
 Aspectos fundamentales sobre ácidos y bases Apellidos, nombre Departamento Centro Atienza Boronat, Julia (matien@qim.upv.es) Herrero Villén, Mª Asunción (maherrero@qim.upv.es) Morais Ezquerro, Sergi B.
Aspectos fundamentales sobre ácidos y bases Apellidos, nombre Departamento Centro Atienza Boronat, Julia (matien@qim.upv.es) Herrero Villén, Mª Asunción (maherrero@qim.upv.es) Morais Ezquerro, Sergi B.
Equilibrio Ácido - Base
 Equilibrio Ácido - Base OBJETIVOS Comprender la importancia de mantener los valores de ph dentro del rango normal Analizar los diferentes mecanismos de regulación que permiten mantener el equilibrio ácido-base
Equilibrio Ácido - Base OBJETIVOS Comprender la importancia de mantener los valores de ph dentro del rango normal Analizar los diferentes mecanismos de regulación que permiten mantener el equilibrio ácido-base
VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS
 VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS Ejercicio 1 Cálculo del ph de una disolución de ácido fuerte a partir de su concentración. Se dispone de una disolución 0,02M de ácido nítrico. Calcular
VÍDEOS EJERCICIOS ÁCIDO-BASE RESUELTOS: ENUNCIADOS Ejercicio 1 Cálculo del ph de una disolución de ácido fuerte a partir de su concentración. Se dispone de una disolución 0,02M de ácido nítrico. Calcular
Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires
 ÁCIDOS Y BASES Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires OBJETIVOS: - Reconocer ácidos, bases y sales, determinar sus disociaciones en agua, según sean electrolitos fuertes
ÁCIDOS Y BASES Lic. Cintia Mendez Vedia Lic. en Nutrición Univesidad de Buenos Aires OBJETIVOS: - Reconocer ácidos, bases y sales, determinar sus disociaciones en agua, según sean electrolitos fuertes
EQUILIBRIO ÁCIDO-BASE.
 EQUILIBRIO ÁCIDOBASE. 1. PROPIEDADES DE ÁCIDOS Y BASES. 2. TEORÍA DE ARRHENIUS. 3. TEORÍA DE BRONSTED Y LOWRY. 4. TEORÍA DE LEWIS. 5. FUERZAS DE ÁCIDOS Y BASES. CONSTANTES DE DISOCIACIÓN. 6. EQUILIBRIO
EQUILIBRIO ÁCIDOBASE. 1. PROPIEDADES DE ÁCIDOS Y BASES. 2. TEORÍA DE ARRHENIUS. 3. TEORÍA DE BRONSTED Y LOWRY. 4. TEORÍA DE LEWIS. 5. FUERZAS DE ÁCIDOS Y BASES. CONSTANTES DE DISOCIACIÓN. 6. EQUILIBRIO
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
Tema 8: Equilibrio ácido-base.
 Tema 8: Equilibrio ácido-base. Teorías ácido-base de Arrhenius, Brønsted-Lowry y Lewis. Autoionización del agua. Conceptos de ph y poh. Ácidos y bases fuertes y débiles. Constantes de ionización de ácidos
Tema 8: Equilibrio ácido-base. Teorías ácido-base de Arrhenius, Brønsted-Lowry y Lewis. Autoionización del agua. Conceptos de ph y poh. Ácidos y bases fuertes y débiles. Constantes de ionización de ácidos
UNIDAD 8: EQUILIBRIO QUÍMICO EQUILIBRIO ÁCIDO-BASE
 UNIDAD 8: EQUILIBRIO QUÍMICO EQUILIBRIO ÁCIDO-BASE 1 Equilibrio Químico En la unidad 4 desarrollamos el tema de estequiometría de las reacciones químicas En esa unidad relacionábamos los reactivos con
UNIDAD 8: EQUILIBRIO QUÍMICO EQUILIBRIO ÁCIDO-BASE 1 Equilibrio Químico En la unidad 4 desarrollamos el tema de estequiometría de las reacciones químicas En esa unidad relacionábamos los reactivos con
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
Cátedra de Introducción a la Química para Ciencias Naturales - UNLP. ph I - EQUILIBRIO ÁCIDO-BASE
 ph I - EQUILIBRIO ÁCIDO-BASE En este y en el siguiente grupo de Trabajos Prácticos se estudiarán equilibrios que ocurren en solución acuosa. Debe tenerse en cuenta que, a pesar de tener diferentes denominaciones,
ph I - EQUILIBRIO ÁCIDO-BASE En este y en el siguiente grupo de Trabajos Prácticos se estudiarán equilibrios que ocurren en solución acuosa. Debe tenerse en cuenta que, a pesar de tener diferentes denominaciones,
PROBLEMAS EQUILIBRIO ÁCIDO BASE
 PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
ÁCIDO-BASE TEORÍA DE ARRHENIUS
 ÁCIDO-BASE TEORÍA DE ARRHENIUS Ácido es toda sustancia que en disolución acuosa se disocia con formación de iones de hidrógeno, H +, o protones. HA + H 2 O A -- + H + Base es toda sustancia que en disolución
ÁCIDO-BASE TEORÍA DE ARRHENIUS Ácido es toda sustancia que en disolución acuosa se disocia con formación de iones de hidrógeno, H +, o protones. HA + H 2 O A -- + H + Base es toda sustancia que en disolución
7. Medida del ph: Disoluciones reguladoras. Precipitación isoeléctrica de la caseína
 7. Medida del ph: Disoluciones reguladoras. Precipitación isoeléctrica de la caseína José Peinado Peinado, Fermín Toribio Meléndez-Valdés Departamento de Bioquímica y Biología Molecular, Campus Universitario
7. Medida del ph: Disoluciones reguladoras. Precipitación isoeléctrica de la caseína José Peinado Peinado, Fermín Toribio Meléndez-Valdés Departamento de Bioquímica y Biología Molecular, Campus Universitario
ÁCIDO BASE. SELECTIVIDAD UCLM 2ºBACH
 1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 3, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 2, Ejercicio 6,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 3, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 2, Ejercicio 6,
Objetivo principal de los seres vivos: cooperar y organizarse para poder realizar funciones más complejas y eficaces que garanticen su perpetuación
 Todos los seres vivos, desde una célula hasta el más complejo ser pluricelular, se desenvuelven en un medio con el que están en continua relación. Ni el ambiente externo, ni el sistema biológico son medios
Todos los seres vivos, desde una célula hasta el más complejo ser pluricelular, se desenvuelven en un medio con el que están en continua relación. Ni el ambiente externo, ni el sistema biológico son medios
Solución: Serie problemas para entregar ÁCIDO-BASE
 Solución: Serie problemas para entregar ÁCIDO-BASE 1.- El ácido metanoico, HCOOH, es un ácido débil porque en disolución acuosa no está totalmente disociado. Al disolver 4,6 g de ácido metanoico en 1 litro
Solución: Serie problemas para entregar ÁCIDO-BASE 1.- El ácido metanoico, HCOOH, es un ácido débil porque en disolución acuosa no está totalmente disociado. Al disolver 4,6 g de ácido metanoico en 1 litro
QUÍMICA 2º Bachillerato Ejercicios: Reacciones Ácido Base (II)
 1(13) Ejercicio nº 1 Completa las siguientes reacciones entre pares ácidos y bases de BrönstedLowry: a) NH 4 + + H 2 O _ b) H 2 O + CO 3 2 _ c) H 2 O + CH 3 COO _ Ejercicio nº 2 Complete los siguientes
1(13) Ejercicio nº 1 Completa las siguientes reacciones entre pares ácidos y bases de BrönstedLowry: a) NH 4 + + H 2 O _ b) H 2 O + CO 3 2 _ c) H 2 O + CH 3 COO _ Ejercicio nº 2 Complete los siguientes
b. Base es la sustancia que en disolución acuosa se disocia, liberando aniones de hidroxilo (OH ) según la ecuación general:
 ACIDOS y BASES Teorías ácido - base Los ácidos y las bases fueron definidos por primera vez por el científico sueco Svante Arrhenius en 1887 en su teoría disociación iónica, en la que establecía que hay
ACIDOS y BASES Teorías ácido - base Los ácidos y las bases fueron definidos por primera vez por el científico sueco Svante Arrhenius en 1887 en su teoría disociación iónica, en la que establecía que hay
FISIOLOGÍA LICENCIATURA EN ENFERMERÍA
 UNIDAD TEMÁTICA N 1: FISIOLOGÍA DE LOS LÍQUIDOS CORPORALES. MEDIO INTERNO. OBJETIVOS ESPECÍFICOS: Conocer y cuantifica la distribución del agua en el organismo y las concentraciones de los aniones, cationes,
UNIDAD TEMÁTICA N 1: FISIOLOGÍA DE LOS LÍQUIDOS CORPORALES. MEDIO INTERNO. OBJETIVOS ESPECÍFICOS: Conocer y cuantifica la distribución del agua en el organismo y las concentraciones de los aniones, cationes,
ÁCIDOS-BASES. 1.-Calcule la concentración molar de una disolución de ácido sulfúrico que tenga el mismo ph que otra de ácido acético 0,374 M.
 ÁCIDOS-BASES 1.-Calcule la concentración molar de una disolución de ácido sulfúrico que tenga el mismo ph que otra de ácido acético 0,374 M. DATOS: Masas atómicas: H = 1; C = 12; 0 = 16; S = 32. Ka ác.
ÁCIDOS-BASES 1.-Calcule la concentración molar de una disolución de ácido sulfúrico que tenga el mismo ph que otra de ácido acético 0,374 M. DATOS: Masas atómicas: H = 1; C = 12; 0 = 16; S = 32. Ka ác.
SOLUCIONES AMORTIGUADORAS ELABORADO POR: LIC. RAUL HERNANDEZ MAZARIEGOS. 3. Cuál es la función de un ácido débil en una solución reguladora:
 GUIA DE ESTUDIO SOLUCIONES AMORTIGUADORAS ELABORADO POR: LIC. RAUL HERNANDEZ MAZARIEGOS 1. Defina solución tampón o solución reguladora: 2. De qué componentes está formada una solución tampón:. Cuál es
GUIA DE ESTUDIO SOLUCIONES AMORTIGUADORAS ELABORADO POR: LIC. RAUL HERNANDEZ MAZARIEGOS 1. Defina solución tampón o solución reguladora: 2. De qué componentes está formada una solución tampón:. Cuál es
5. Reacciones de neutralización
 5. Reacciones de neutralización Una reacción de neutralización es una reacción entre un ácido y una base, generalmente en las reacciones acuosas ácido-base se forma agua y una sal, un ejemplo es el producto
5. Reacciones de neutralización Una reacción de neutralización es una reacción entre un ácido y una base, generalmente en las reacciones acuosas ácido-base se forma agua y una sal, un ejemplo es el producto
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción
CURSO Bases moleculares, celulares y genéticas de la organización de los sistemas vivos
 KINESIOLOGIA UNIVERSIDAD DE CHILE 2011 CURSO Bases moleculares, celulares y genéticas de la organización de los sistemas vivos UNIDAD DE QUIMICA REMEDIAL Prof. Asoc. LUIS QUIÑONES SEPULVEDA, BQ., PhD Capítulo
KINESIOLOGIA UNIVERSIDAD DE CHILE 2011 CURSO Bases moleculares, celulares y genéticas de la organización de los sistemas vivos UNIDAD DE QUIMICA REMEDIAL Prof. Asoc. LUIS QUIÑONES SEPULVEDA, BQ., PhD Capítulo
TEMA 6.- Reacciones de trans- ferencia de protones
 TEMA 6.- Reacciones de trans- ferencia de protones CUESTIONES 51.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más débil es un ácido menor es el ph de sus
TEMA 6.- Reacciones de trans- ferencia de protones CUESTIONES 51.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más débil es un ácido menor es el ph de sus
PH y SISTEMAS TAMPÓN
 PH y SISTEMAS TAMPÓN DISOCIACIÓN DEL AGUA.- El agua se disocia de la manera siguiente: HOH H+ OH- El valor de Kéq. a 25ºC es muy pequeña, siendo del orden de 1 8 x 10(-16). Esto significa
PH y SISTEMAS TAMPÓN DISOCIACIÓN DEL AGUA.- El agua se disocia de la manera siguiente: HOH H+ OH- El valor de Kéq. a 25ºC es muy pequeña, siendo del orden de 1 8 x 10(-16). Esto significa
Cátedra de Fisiología Humana CAPÍTULO I CAPITULO III. Equilibrio Acido Base PH. Carrera de Enfermería. Universidad Nacional del Nordeste
 CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
4. Cuál de las siguientes es una base de Brönsted? A) SO 4
 CUESTIONES ACIDO-BASE ---------------------------------------------------------------------------------------------------------- 1. El ácido conjugado del HSO - 4 es: A) HSO - 4 B) H 2 SO 4 C) H 3 O +
CUESTIONES ACIDO-BASE ---------------------------------------------------------------------------------------------------------- 1. El ácido conjugado del HSO - 4 es: A) HSO - 4 B) H 2 SO 4 C) H 3 O +
( kj / mol) -1268 0-393,5-285,8
 Apellidos y Nombre Grupo 1. (1 punto) En un experimento se disuelve una barra de aluminio (sólido) en 100,00 ml de una disolución de HCl 1,50 M. 2 Al(s) + 6 HCl(ac) 2 AlCl 3 (ac) + 3 H 2 (g) Cuando termina
Apellidos y Nombre Grupo 1. (1 punto) En un experimento se disuelve una barra de aluminio (sólido) en 100,00 ml de una disolución de HCl 1,50 M. 2 Al(s) + 6 HCl(ac) 2 AlCl 3 (ac) + 3 H 2 (g) Cuando termina
ÁCIDO BASE QCA 07 ANDALUCÍA
 por ÁCIDO BASE QCA 07 ANDALUCÍA 1.- a) Calcule el ph de una disolución de HClO 4 0 0 M y de una disolución 0 05 M de NaOH. b) Calcule el ph de la disolución obtenida al mezclar 50 ml de cada una de las
por ÁCIDO BASE QCA 07 ANDALUCÍA 1.- a) Calcule el ph de una disolución de HClO 4 0 0 M y de una disolución 0 05 M de NaOH. b) Calcule el ph de la disolución obtenida al mezclar 50 ml de cada una de las
BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph
 BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph INTRODUCCION Importancia del mantenimiento del ph [H + ] afecta: Conformación de proteínas Reacciones donde el H + es producto o reactivo Liberación de O 2 de la
BALANCE ÁCIDO-BASE Y REGULACIÓN DEL ph INTRODUCCION Importancia del mantenimiento del ph [H + ] afecta: Conformación de proteínas Reacciones donde el H + es producto o reactivo Liberación de O 2 de la
Definición Bronsted-Lowry
 TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
Los bioelementos se encuentran en los seres vivos formando parte de las moléculas, que pueden ser inorgánicas u orgánicas.
 BIOELEMENTOS: BIOMOLÉCULAS INORGÁNICAS: AGUA Y SALES MINERALES Los bioelementos se encuentran en los seres vivos formando parte de las moléculas, que pueden ser inorgánicas u orgánicas. Biomoléculas orgánicas:
BIOELEMENTOS: BIOMOLÉCULAS INORGÁNICAS: AGUA Y SALES MINERALES Los bioelementos se encuentran en los seres vivos formando parte de las moléculas, que pueden ser inorgánicas u orgánicas. Biomoléculas orgánicas:
1010 DEPARTAMENTO DE FÍSICA Y QUÍMICA 2º Bachillerato QUÍMICA
 1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
REACCIONES ÁCIDO-BASE
 REACCIONES ÁCIDO-BASE 1. Conceptos de ácido y base.. Fuerzas de ácidos y bases. 3. Concepto de ph. 4. Hidrólisis. 5. Disoluciones reguladoras. 6. Volumetrías ácido-base. 7. Indicadores. Química º bachillerato
REACCIONES ÁCIDO-BASE 1. Conceptos de ácido y base.. Fuerzas de ácidos y bases. 3. Concepto de ph. 4. Hidrólisis. 5. Disoluciones reguladoras. 6. Volumetrías ácido-base. 7. Indicadores. Química º bachillerato
6. ph y amortiguadores: Tampones fisiológicos
 6. ph y amortiguadores: Tampones fisiológicos Isaac Túnez Fiñana 1, Aurora Galván Cejudo 2, Emilio Fernández Reyes 2 Departamento de Bioquímica y Biología Molecular, 1 Facultad de Medicina, Avda. Menéndez
6. ph y amortiguadores: Tampones fisiológicos Isaac Túnez Fiñana 1, Aurora Galván Cejudo 2, Emilio Fernández Reyes 2 Departamento de Bioquímica y Biología Molecular, 1 Facultad de Medicina, Avda. Menéndez
6. Equilibrio ácido-base I
 6. Equilibrios ácido-base I Equilibrios ácido-base I Contenidos Ácidos y bases Producto iónico i del agua. Disoluciones neutras, ácidas y básicas. b Concepto de ph. Ácidos y bases fuertes y débiles: d
6. Equilibrios ácido-base I Equilibrios ácido-base I Contenidos Ácidos y bases Producto iónico i del agua. Disoluciones neutras, ácidas y básicas. b Concepto de ph. Ácidos y bases fuertes y débiles: d
GUIA DE ESTUDIO SEMANA 13 DISOLUCIONES TAMPON, AMORTIGUADORES O BUFFER Elaborado por: Licda. Edda García
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO GUIA DE ESTUDIO 2015 SEMANA 13 DISOLUCIONES TAMPON, AMORTIGUADORES O BUFFER Elaborado por:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO GUIA DE ESTUDIO 2015 SEMANA 13 DISOLUCIONES TAMPON, AMORTIGUADORES O BUFFER Elaborado por:
REACCIONES ÁCIDO-BASE
 9 REACCINES ÁCID-BASE SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Escribe las reacciones de disociación de las siguientes sustancias, indicando cuál o cuáles de ellas son ácidos o
9 REACCINES ÁCID-BASE SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Escribe las reacciones de disociación de las siguientes sustancias, indicando cuál o cuáles de ellas son ácidos o
Para resolver ésta guía deberá leer el tema en el Capítulo 10 del libro de texto.
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 13 DISOLUCIONES TAMPON, AMORTIGUADORES O BUFFER Elaborado por:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 13 DISOLUCIONES TAMPON, AMORTIGUADORES O BUFFER Elaborado por:
Amortiguadores o Buffer. SEMANA 13 Licda. Lilian Judith Guzman melgar
 Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
Capítulo 15: Ácidos y bases
 Capítulo 15: Ácidos y bases Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM-3002 Quimica general II, Ácidos y bases p.1 Ácidos y bases de Brønsted
Capítulo 15: Ácidos y bases Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM-3002 Quimica general II, Ácidos y bases p.1 Ácidos y bases de Brønsted
Fundación H.A. Barceló Facultad de Medicina
 Fundación H.A. Barceló Facultad de Medicina LICENCIATURA EN NUTRICION PRIMER AÑO FISIOLOGIA MODULO 16 LECCIONES 1 Y 2 1 MODULO 16: Equilibrio Electrolítico y Control de ph OBJETIVOS - Conocer las vías
Fundación H.A. Barceló Facultad de Medicina LICENCIATURA EN NUTRICION PRIMER AÑO FISIOLOGIA MODULO 16 LECCIONES 1 Y 2 1 MODULO 16: Equilibrio Electrolítico y Control de ph OBJETIVOS - Conocer las vías
Amortiguadores o Buffer. SEMANA 13 Licda. Lilian Judith Guzman Melgar
 Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman Melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman Melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
Amortiguadores o Buffer. SEMANA 13 Licda. Lilian Judith Guzman Melgar
 Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman Melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
Amortiguadores o Buffer SEMANA 13 Licda. Lilian Judith Guzman Melgar Soluciones amortiguadoras También llamadas soluciones: Buffer Reguladoras Tampón Solución Buffer Es una solución de un ácido débil y
EQUILIBRIO ACIDO BASE
 EQUILIBRIO ACIDO BASE 1. Cuáles de las siguientes soluciones tiene el ph mas alto: a) una solución 0.1M de un ácido fuerte o una solución 0.1 M de un ácido débil. b) Una solución 0.1 M de un ácido con
EQUILIBRIO ACIDO BASE 1. Cuáles de las siguientes soluciones tiene el ph mas alto: a) una solución 0.1M de un ácido fuerte o una solución 0.1 M de un ácido débil. b) Una solución 0.1 M de un ácido con
Agua, electrolitos, balance acido-base. Dra. Luz E. Cuevas-Molina NURS 1231
 Agua, electrolitos, balance acido-base Dra. Luz E. Cuevas-Molina NURS 1231 1 Introducción Para mantener la homoestasis debe haber un balance entre las cantidades de fluido y electrolitos Los electrolitos
Agua, electrolitos, balance acido-base Dra. Luz E. Cuevas-Molina NURS 1231 1 Introducción Para mantener la homoestasis debe haber un balance entre las cantidades de fluido y electrolitos Los electrolitos
Tema 3: Ecuaciones químicas y concentraciones
 Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
Reacciones en disolución acuosa
 Reacciones en disolución acuosa (no redox) Ramón L. Hernández-Castillo, Ph.D. Química 106 (laboratorio) Objetivos Reglas de Solubilidad en medio acuoso Reacciones típicas en medio acuoso (precipitación,
Reacciones en disolución acuosa (no redox) Ramón L. Hernández-Castillo, Ph.D. Química 106 (laboratorio) Objetivos Reglas de Solubilidad en medio acuoso Reacciones típicas en medio acuoso (precipitación,
Trastornos respiratorios. Acidosis y alcalosis
 Trastornos respiratorios Acidosis y alcalosis Acidosis Respiratoria Trastorno que se caracteriza por aumento primario de la paco2 con elevación de la concentración de H+ en sangre, disminución del ph y
Trastornos respiratorios Acidosis y alcalosis Acidosis Respiratoria Trastorno que se caracteriza por aumento primario de la paco2 con elevación de la concentración de H+ en sangre, disminución del ph y
Alteración del equilibrio ácido-base
 Clase N 1 de ph Lunes 15-sept-2008 1 Alteración del equilibrio ácido-base Cuando generalmente uno habla de ph, se torna un problema complejo pero si uno entiende bien lo básico desde un principio, el resto
Clase N 1 de ph Lunes 15-sept-2008 1 Alteración del equilibrio ácido-base Cuando generalmente uno habla de ph, se torna un problema complejo pero si uno entiende bien lo básico desde un principio, el resto
AH H + + A - HCl H + + Cl -
 A. ÁCIDOS FUERTES Y DÉBILES Brönsted define ácido como cualquier sustancia que en solución es capaz de donar un hidrogenión o protón (H + ) y base como cualquier sustancia que en solución es capaz de aceptar
A. ÁCIDOS FUERTES Y DÉBILES Brönsted define ácido como cualquier sustancia que en solución es capaz de donar un hidrogenión o protón (H + ) y base como cualquier sustancia que en solución es capaz de aceptar
COMUNIDAD VALENCIANA (VALENCIA) / JUNIO 99. COU / BIOLOGÍA / BIOMOLÉCULAS / OPCIÓN A / EJERCICIO 1
 COMUNIDAD VALENCIANA (VALENCIA) / JUNIO 99. COU / BIOLOGÍA / BIOMOLÉCULAS / OPCIÓN A / EJERCICIO 1 1.- Propiedades del agua e importancia biológica. El agua es un componente esencial de todo ser vivo,
COMUNIDAD VALENCIANA (VALENCIA) / JUNIO 99. COU / BIOLOGÍA / BIOMOLÉCULAS / OPCIÓN A / EJERCICIO 1 1.- Propiedades del agua e importancia biológica. El agua es un componente esencial de todo ser vivo,
http://kardia.cjb.net
 Dr. David Martínez Duncker R. Catedrático Titular Equilibrio Ácido Base http://kardia.cjb.net Cátedra de Fisiología I Facultad de Medicina, U.A.E.M. Líquidos y Electrólitos CONSIDERACIONES GENERALES.-
Dr. David Martínez Duncker R. Catedrático Titular Equilibrio Ácido Base http://kardia.cjb.net Cátedra de Fisiología I Facultad de Medicina, U.A.E.M. Líquidos y Electrólitos CONSIDERACIONES GENERALES.-
HCl H + + Cl Ácido Hidrogenión Base Conjugada. Revista de Actualización Clínica Volumen POTENCIAL DE HIDROGENIONES- ph
 POTENCIAL DE HIDROGENIONES- ph Dr. Mansilla Canela Gonzalo 1 RESUMEN En todo organismo vivo, se producen sustancias ácidas y álcalis a partir del metabolismo de hidratos de carbono, lípidos y proteínas.
POTENCIAL DE HIDROGENIONES- ph Dr. Mansilla Canela Gonzalo 1 RESUMEN En todo organismo vivo, se producen sustancias ácidas y álcalis a partir del metabolismo de hidratos de carbono, lípidos y proteínas.
7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE ESQUEMA - Estudio del equilibrio ácido-base de un paciente - Trastornos del
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE ESQUEMA - Estudio del equilibrio ácido-base de un paciente - Trastornos del
Ácidos y bases (I) Teorías. Escala ph
 Ácidos y bases (I) Teorías. Escala ph Desde muy antiguo se sabía de la existencia de dos grupos de compuestos químicos, los ácidos y las bases (o álcalis), que presentaban propiedades aparentemente antagónicas:
Ácidos y bases (I) Teorías. Escala ph Desde muy antiguo se sabía de la existencia de dos grupos de compuestos químicos, los ácidos y las bases (o álcalis), que presentaban propiedades aparentemente antagónicas:
2. CURVAS DE TITULACION DE ACIDOS & BASES
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 2. CURVAS DE TITULACION DE ACIDOS & BASES ESQUEMA - Curvas de titulación. Concepto - Fases de una curva de titulación - Ejemplo
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 2. CURVAS DE TITULACION DE ACIDOS & BASES ESQUEMA - Curvas de titulación. Concepto - Fases de una curva de titulación - Ejemplo
FÍSICA DE LOS GASES INTRODUCCIÓN
 FÍSICA DE LOS GASES 19 INTRODUCCIÓN U n campo en que la medicina ha logrado mayor y más rápido avance en los últimos años es el de la aplicación de la fisiología respiratoria al manejo del paciente en
FÍSICA DE LOS GASES 19 INTRODUCCIÓN U n campo en que la medicina ha logrado mayor y más rápido avance en los últimos años es el de la aplicación de la fisiología respiratoria al manejo del paciente en
EQUILIBRIO ÁCIDO-BASE
 EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología - Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H + ). HCl H + + Cl - Base:
EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología - Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H + ). HCl H + + Cl - Base:
METABOLISMO ACIDO / BASE
 METABOLISMO ACIDO / BASE Dr Sergio Octavio GRANADOS TINAJERO Hospital Angeles de Villahermosa, Villahermosa, Tabasco, México. Course : 3 Year : 2003 Language : Spanish Country : Mexico City : Baja California
METABOLISMO ACIDO / BASE Dr Sergio Octavio GRANADOS TINAJERO Hospital Angeles de Villahermosa, Villahermosa, Tabasco, México. Course : 3 Year : 2003 Language : Spanish Country : Mexico City : Baja California
V solución Ba(II) + V solución ion sulfato = V total 15 ml + 20 ml = 35 ml. Esta sal se disocia completamente y por lo tanto la [ Ba 2+ ] = 4,3 10-4 M
![V solución Ba(II) + V solución ion sulfato = V total 15 ml + 20 ml = 35 ml. Esta sal se disocia completamente y por lo tanto la [ Ba 2+ ] = 4,3 10-4 M V solución Ba(II) + V solución ion sulfato = V total 15 ml + 20 ml = 35 ml. Esta sal se disocia completamente y por lo tanto la [ Ba 2+ ] = 4,3 10-4 M](/thumbs/40/21002473.jpg) Compuestos Poco Solubles 227 17. Determinar cuanto precipitado se formará al mezclar 15 ml de BaCl 2 0,001 M con 20 ml de Na 2 SO 4 0,009 M. Calcule, además las concentraciones de los iones en solución.
Compuestos Poco Solubles 227 17. Determinar cuanto precipitado se formará al mezclar 15 ml de BaCl 2 0,001 M con 20 ml de Na 2 SO 4 0,009 M. Calcule, además las concentraciones de los iones en solución.
ÁCIDOS Y BASES MPSS GÓMEZ CHANG ERIKA. Todos los derechos reservados. Julio 2007 M. en C. Alicia Cea Bonilla -
 ÁCIDOS Y BASES MPSS GÓMEZ CHANG ERIKA 1 Probablemente no haya otro tipo de equilibrio tan importante como el de ácidos y bases B. M. Mahan y R. J. Myers 2 CASO AMC de 52 años de edad, acostumbraba consumir
ÁCIDOS Y BASES MPSS GÓMEZ CHANG ERIKA 1 Probablemente no haya otro tipo de equilibrio tan importante como el de ácidos y bases B. M. Mahan y R. J. Myers 2 CASO AMC de 52 años de edad, acostumbraba consumir
REACCIONES DE TRANSFERENCIA DE PROTONES ELECTROLITOS
 REACCIONES DE TRANSFERENCIA DE PROTONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA ELECTROLITOS Un electrolito es una sustancia que al disolverse en agua experimenta una disociación (o ionización) total
REACCIONES DE TRANSFERENCIA DE PROTONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA ELECTROLITOS Un electrolito es una sustancia que al disolverse en agua experimenta una disociación (o ionización) total
DISOLUCIÓN DE GASES EN AGUA. PROCESOS ÁCIDO BASE Y SOLUBILIDAD
 SEMINARIO 1 DISOLUCIÓN DE GASES EN AGUA. PROCESOS ÁCIDO BASE Y SOLUBILIDAD Solubilidad de gases en agua El oxígeno es, sin duda, el mas importante agente oxidante del agua natural, en ausencia de otros
SEMINARIO 1 DISOLUCIÓN DE GASES EN AGUA. PROCESOS ÁCIDO BASE Y SOLUBILIDAD Solubilidad de gases en agua El oxígeno es, sin duda, el mas importante agente oxidante del agua natural, en ausencia de otros
4. Ácidos y bases. Volumetrías ácido-base. Punto de equivalencia. Aplicaciones y tratamiento experimental.
 4. Ácidos y bases Contenidos Revisión de la interpretación del carácter ácido-base de una sustancia. Teoría de Brönsted y Lowry. Las reacciones de transferencia de protones. Ácidos y bases fuertes y débiles.
4. Ácidos y bases Contenidos Revisión de la interpretación del carácter ácido-base de una sustancia. Teoría de Brönsted y Lowry. Las reacciones de transferencia de protones. Ácidos y bases fuertes y débiles.
Química Analítica para Ingenieros Químicos
 CAPÍTULO 2 EQUILIBRIO IÓNICO CONTENIDO: - Ácidos y Bases Definición de ácido y base - Propiedades ácido base del agua. - La medida de la acidez de una solución: el ph. Clasificación de soluciones y ph
CAPÍTULO 2 EQUILIBRIO IÓNICO CONTENIDO: - Ácidos y Bases Definición de ácido y base - Propiedades ácido base del agua. - La medida de la acidez de una solución: el ph. Clasificación de soluciones y ph
2.3.4 Reacciones con ácidos y bases 11
 100 Parte (b). Hay que determinar la cantidad teórica requerida de HCl puro. Luego, se calcula el volumen de ácido comercial (disolución acuosa) que provee esa cantidad de moles de HCL puro: 2 kgmol HCl
100 Parte (b). Hay que determinar la cantidad teórica requerida de HCl puro. Luego, se calcula el volumen de ácido comercial (disolución acuosa) que provee esa cantidad de moles de HCL puro: 2 kgmol HCl
CARACTERÍSTICAS ÁCIDOS: BASES:
 EQUILIBRIO IÓNICO CARACTERÍSTICAS ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
EQUILIBRIO IÓNICO CARACTERÍSTICAS ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
Teorías : Arrhenius Bronsted-Lowry Lewis Equilibrio iónico del agua. ph. Soluciones Amortiguadoras. 2006-I 1
 Teorías : Arrhenius Bronsted-Lowry Lewis Equilibrio iónico del agua. ph. Soluciones Amortiguadoras. 2006-I 1 ACIDOS Y BASES LA TEORÍA DE ARRHENIUS Qué es un ácido? Se reconocía a los ácidos en forma general
Teorías : Arrhenius Bronsted-Lowry Lewis Equilibrio iónico del agua. ph. Soluciones Amortiguadoras. 2006-I 1 ACIDOS Y BASES LA TEORÍA DE ARRHENIUS Qué es un ácido? Se reconocía a los ácidos en forma general
Bases Científicas 1 Autor: Marta Adonis
 ACIDO-BASE En los organismos vivos la concentración de protones debe mantenerse dentro de límites muy estrechos, como requisito indispensable para el desarrollo normal de los procesos metabólicos intracelulares.
ACIDO-BASE En los organismos vivos la concentración de protones debe mantenerse dentro de límites muy estrechos, como requisito indispensable para el desarrollo normal de los procesos metabólicos intracelulares.
No hay más que una diferencia entre el Aparato Urinario femenino y masculino: la uretra masculina es algo más larga y es, al mismo tiempo, una vía
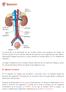 La excreción es la eliminación de los residuos tóxicos que producen las células de nuestro cuerpo. En este sentido, también los pulmones son, al igual que los dos riñones, importantes órganos excretores,
La excreción es la eliminación de los residuos tóxicos que producen las células de nuestro cuerpo. En este sentido, también los pulmones son, al igual que los dos riñones, importantes órganos excretores,
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO PUEDAS, CON UNA ONG.
 SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
Tema 2-Equilibrios ácido-base
 Tema 2-Equilibrios ácido-base CONTENIDO Especies ácido-base. Acidez de la disolución Calculo numérico y gráfico de ph Disoluciones amortiguadoras. Capacidad reguladora. DEFINICIONES DE ÁCIDOS Y BASES.
Tema 2-Equilibrios ácido-base CONTENIDO Especies ácido-base. Acidez de la disolución Calculo numérico y gráfico de ph Disoluciones amortiguadoras. Capacidad reguladora. DEFINICIONES DE ÁCIDOS Y BASES.
ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 4: DETERMINACION DE ph
 I. Presentación de la guía: ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 4: DETERMINACION DE ph Competencia: El alumno será capaz de aplicar diferentes métodos instrumentales para la determinación
I. Presentación de la guía: ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N 4: DETERMINACION DE ph Competencia: El alumno será capaz de aplicar diferentes métodos instrumentales para la determinación
EXPERIMENTO 3. CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk
 EXPERIMENTO 3 CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk REQUISITOS Repasar los conceptos sobre las propiedades de los aminoácidos (AA), reacciones ácido base, ph, pk, soluciones
EXPERIMENTO 3 CURVAS DE TITULACION DE AMINOACIDOS. DETERMINACION DE VALORES DE pk REQUISITOS Repasar los conceptos sobre las propiedades de los aminoácidos (AA), reacciones ácido base, ph, pk, soluciones
Consecuencias de la disminución de la presión de vapor de una solución Disminuye la presión de vapor 2. Aumento del punto de ebullición de la solución
 Algunas propiedades físicas de las soluciones dependen de la cantidad de soluto no volátil disuelto, aunque no de su naturaleza A atm de presión, el agua pura congela a C y ebulle a C pero una disolución
Algunas propiedades físicas de las soluciones dependen de la cantidad de soluto no volátil disuelto, aunque no de su naturaleza A atm de presión, el agua pura congela a C y ebulle a C pero una disolución
