Física y Química - 3º ESO
|
|
|
- Ángela Vega Campos
- hace 7 años
- Vistas:
Transcripción
1 C O L L E G I S A N A N T O N I O D E P A D U A F R A N C I S C A N S L C A R C A I X E N T C U R S / Física y Química - 3º ESO Tema 1 La ciencia y su método. Medida de magnitudes. Anexo 1 Etapas del método científico. Magnitudes físicas y unidades del Sistema Internacional. Múltiplos y submúltiplos en base 10. Definiciones de medir, incertidumbre, Precisión, sensibilidad, errores sistemáticos y accidentales. Factores de conversión. Notación científica. Cifras significativas. Redondeo. Cálculo de valores medios. Cálculo de errores (E. absoluto, E. relativo). Ejercicios: 5, 6, 7, 8, 9, 11, 18, 19, 20, 21, 22, 28. Tema 2 Los sistemas materiales. Anexo 2 Materia, Sistema material, sustancia Masa, volumen, densidad. Estados de agregación de la materia. Teoría cinético-ecular. Cambios de estado. Temperaturas de fusión y ebullición. Temperatura, presión. Identificar cambios de fase en una gráfica y la sustancia a la que pertenece. Ejercicios: 4, 5, 6, 7, 8, 11, 12, 14, 22, 23-a, 25, 28, 30, 31, 38. Tema 3 Mezclas, disoluciones y sustancias puras. Anexo 3 Sistemas materiales heterogéneos y homogéneos. Mezcla heterogénea (concepto). Mezcla homogénea: disoluciones, disolvente, soluto. Sustancias puras. Elementos y compuestos. Solubilidad. Concentración de una disolución en gramos por litro, tanto por ciento en peso y tanto por ciento en volumen. Identificación mediante gráfico de sustancia pura y mezcla homogénea. Cálculo de solubilidades, masas disueltas y masas precipitadas. Ejercicios: 8, 9, 10, 12, 15, 17, 22, 23, 26, 27, 29, 32, 33, 36, 38. Tema 4 Los átomos y su complejidad. Anexo 4 Constitución de la materia. Modelos atómicos (Dalton, Thomson, Ruterford, atómico nuclear. Número atómico, número másico, masa atómica, isótopos. Ley ponderal de la masa. Iones. Distribución de las partículas subatómicas del átomo (Tabla de distribución). Ley ponderal de la masa. Ejercicios: 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 22, 23, 24, 25, 27, 32, 33, 34, 35, 37, 42, 46. Tema 5 Uniones entre átomos.
2 Estabilidad energética. Regla del octeto. Moléculas y cristales. Enlace iónico, covalente y metálico. El, número de Avogadro. Definición de uma y su relación con el SI. Cálculo de la masa ecular. Composición centesimal. Ejercicios: 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 21, 22, 24, 25, 26, 27. Tema 6 Las reacciones químicas. Anexo 6 Cambios físicos y químicos. Qué ocurre en una reacción química? Ley de conservación de la masa. Concepto de reacción química. Información que proporciona una ecuación química ajustada. Ley de Avogadro (número). Tema 7 Distintos tipos de reacciones químicas. Identificar el tipo de reacciones a partir de los tipos: Descomposición, Síntesis, Sustitución, Doble sustitución, Combustión, Neutralización. Ley de conservación de la masa. Ajuste de las ecuaciones químicas. Cálculos químicos elementales (es, volumen en condiciones normales y en condiciones estándar, masas). Ejercicios: 1, 5, 7, 8, 9, 10, 11, 12, 14, 17, 18, 26, 27, 28, 29, 30, 34, 35, 36, 37, 39, 40, 41, 42, 45. Saber identificar las reacciones. Ejercicios: 3, 6, 7, 27, 28, 33. Formulación inorgánica. Aplicación de la teoría de la IUPAC para realizar los ejercicios de formulación. Anexo Formulación Documento de ejercicios de formulación inorgánica. Material interactivo: nº libro:
3 Anexo al Tema 1 Sistema internacional de unidades Múltiplos y submúltiplos en base 10 Magnitud Unidad (S.I.) Símbolo tera (T) Longitud Metro m giga (G) 10 9 Masa Kilogramo Kg mega (M) 10 6 Tiempo Segundo s kilo (k) 10 3 Temperatura Kelvin K Unidad 10 0 Cant. De sustancia Mol mili (m) 10-3 Int. Corriente eléctrica Amperio A micro (μ) 10-6 Int. Luminosa Candela Cd nano (n) 10-9 pico (p) Tabla para el cálculo de errores, medias etc. Número de Medida (unidad) Error absoluto de la medida medida (unidad) Error relativo de la medida Porcentaje de error relativo Ejemplo para 5 medidas: n t (s) Є a (s) Є r %(Є r ) 1 2,1 2,1-2,3 = -0,2-0,2 / 2,3 = 0,09 0, = 9 2 2,3 2,3-2,3= 0 0 / 2,3 = = 0 3 2, ,5 0,2 0, ,4 0,1 0,04 4 t = 2,3 t = x 1 x 2 x 3 x 4 x 5 n a =t i t r = a t = t i t t % r = r 100
4 Anexo al Tema 2 d = m V Anexo al Tema 3 Concentración Gramos por litro de disolución Tanto por ciento en peso Tanto por ciento en volúmen C= m soluto m disolución C= m soluto g V disolución L % peso= m soluto m disolución 100 % volumen= V soluto V disolución 100
5 Anexo al Tema 4 Identificación de los símbolos utilizados para la distribución de las partículas subatómicas. Número másico (Z+N) A Número atómico, núm. de prot. Z X Q Carga eléctrica N Número de neutrones Tabla para la distribución de las partículas subatómicas de los átomos. Balance de masa Balance de carga Configuración electrónica Símbolo Z N A p + e - K (2) L (8) M (18) N (32) A Q Z N N Ejemplo: Valor de Z Valor de N La suma de Z + A El mismo valor que Z Este se debe modificar para que la suma con los protones de la carga (Q). Aquí se reparten los electrones (e - ), poniendo como máximo en cada capa la cantidad que hay entre paréntesis. Balance de masa Balance de carga Configuración electrónica Símbolo Z N A p + e - K (2) L (8) M (18) N (32) 7 N K 16 8O Na Ejemplo de la Ley ponderal de las masas %( 1 H)=99,985% m( 1 H)=1uma %( 2 H)=0,012% m( 2 H)=2uma %( 3 H)=0,003% m( 3 H)=3uma m atomo = m atomo % atomo m H =m 1 H 1 H m 2 H 2 H m 3 H 3 H = =1 99, ,012 0, =1,00018uma
6 Anexo al Tema 6 n Mr (g) Reactivos Productos Ajustar la reacción química. m (g) = Coeficientes del ajuste. Suma de las masas atómicas de cada écula sin coeficientes. Ley de Conservación de las masas: Suma de las masas de los productos = Suma de las masas de los reactivos. 23 atomos Nº atomos n N A n N A N A =6, V CN (L) n V CN n V CN V CN =22,4 L V CS (L) n V CS n V CS V CS =24 L Número de es Masa de la écula Número de Avogadro n= m 23 atomos m=n M M r N A =6, r V CN (Volumen en condiciones normales) T=0ºC y P=1atm Sólo para gases. V CS (Volumen en condiciones estándar) T=25ºC y P=1atm Sólo para gases. Ejemplo: 2 H 2 g + O 2 g 2 H 2 O g Ajustar la reacción química. n Coeficientes del ajuste. Mr (g) 2 A r H = = 2 1=2 2 A r O = = 2 16=32 2 A r H A r O = = =18 m (g) 2 2= =32 = 2 18=36 Nº atomos V CN (L) V CS (L) Suma de las masas atómicas de cada écula sin coeficientes. Ley de Conservación de las masas: Suma de las masas de los productos = Suma de las masas de los reactivos. 23 atomos 2 N A 1 N A 2 N A N A =6, ,4 = = 44, = = ,4 = = 22, = = ,4 = = 44, = = 48 V CN =22,4 V CS =24 L L A r H =1u A r O =16u
Contenido de Física y Química Conceptos y ejercicios - 13-14
 Contenido de Física y Química Conceptos y ejercicios - 13-14 Concepto Teoría (Conceptos) Práctica (Ejercicios) Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura.
Contenido de Física y Química Conceptos y ejercicios - 13-14 Concepto Teoría (Conceptos) Práctica (Ejercicios) Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura.
UNIDAD 4. La materia: propiedades eléctricas y el átomo
 PRUEBAS EXTRAORDINARIA DE FÍSICA Y QUÍMICA DE 3º y 4º ESO 1.- CONTENIDOS MÍNIMOS 3º DE LA ESO UNIDAD 1. La ciencia, la materia y su medida 1. Diferenciar ciencia y pseudociencia. 2. Distinguir entre propiedades
PRUEBAS EXTRAORDINARIA DE FÍSICA Y QUÍMICA DE 3º y 4º ESO 1.- CONTENIDOS MÍNIMOS 3º DE LA ESO UNIDAD 1. La ciencia, la materia y su medida 1. Diferenciar ciencia y pseudociencia. 2. Distinguir entre propiedades
Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la
 Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
Tema 0. Conceptos Básicos en Química. Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones
 Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
Orientaciones sobre la prueba de QUIMICA (Parte Específica ) CONTENIDOS. Estados de agregación y composición de la materia.
 Orientaciones sobre la prueba de QUIMICA (Parte Específica ) CONTENIDOS Estados de agregación y composición de la materia. Lenguaje químico Teoría cinético-molecular. Aplicación para la explicación de
Orientaciones sobre la prueba de QUIMICA (Parte Específica ) CONTENIDOS Estados de agregación y composición de la materia. Lenguaje químico Teoría cinético-molecular. Aplicación para la explicación de
TRANSFORMACIONES QUÍMICAS 1.- SUSTANCIAS PURAS, ELEMENTOS Y COMPUESTOS
 TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
Tema 13: La materia Ciencias Naturales 1º ESO página 1. Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
 Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Tema 13: La materia Ciencias Naturales 1º ESO página 1 TEMA 13: LA MATERIA, BASE DEL UNIVERSO 1. Qué es materia? Materia es todo aquello que posee masa y ocupa un volumen. Está formada de partículas muy
Tema 2. Estequiometría
 Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
TEMA 1: LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES
 Nombre Grupo TEMA 1: LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES 5. Realiza cálculos y expresa las siguientes cantidades en unidades del Sistema Internacional. a) 237 mm b) 50 horas 1. Cuándo una hipótesis
Nombre Grupo TEMA 1: LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES 5. Realiza cálculos y expresa las siguientes cantidades en unidades del Sistema Internacional. a) 237 mm b) 50 horas 1. Cuándo una hipótesis
El mol. Chema Martín, 3º ESO. 2016
 El mol Chema Martín, 3º ESO. 2016 El mol Es el concepto fundamental de la química. Todos los cálculos que haremos a partir de ahora se basarán en él, por eso es muy importante entenderlo correctamente
El mol Chema Martín, 3º ESO. 2016 El mol Es el concepto fundamental de la química. Todos los cálculos que haremos a partir de ahora se basarán en él, por eso es muy importante entenderlo correctamente
TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones.
 TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones. 1. Introducción: sustancias puras (elementos y compuestos); transformaciones de la materia
TEMA 1: Introducción a la Química. Reacción química: leyes. Mol y Número de Avogadro. Estequiometría y disoluciones. 1. Introducción: sustancias puras (elementos y compuestos); transformaciones de la materia
GUIA Nº 2 DE CIENCIAS PARA 7º B. Realizar los tipos de energía con 3 ejemplos ilustrarlo cada uno y explicarlo.
 GUIA Nº 2 DE CIENCIAS PARA 7º B Realizar los tipos de energía con 3 ejemplos ilustrarlo cada uno y explicarlo. Investigar la energía mecánica con sus formulas. La teoría atómica con sus enlaces, átomos,
GUIA Nº 2 DE CIENCIAS PARA 7º B Realizar los tipos de energía con 3 ejemplos ilustrarlo cada uno y explicarlo. Investigar la energía mecánica con sus formulas. La teoría atómica con sus enlaces, átomos,
MINISTERIO DE EDUCACIÓN PÚBLICA DIRECCIÓN DE GESTIÓN Y EVALUACIÓN DE LA CALIDAD Departamento de Evaluación Académica y Certificación
 MINISTERIO DE EDUCACIÓN PÚBLICA DIRECCIÓN DE GESTIÓN Y EVALUACIÓN DE LA CALIDAD Departamento de Evaluación Académica y Certificación por objetivos generales del Programa de estudio Pruebas Nacionales de
MINISTERIO DE EDUCACIÓN PÚBLICA DIRECCIÓN DE GESTIÓN Y EVALUACIÓN DE LA CALIDAD Departamento de Evaluación Académica y Certificación por objetivos generales del Programa de estudio Pruebas Nacionales de
GUÍA N 1: Unidades de medida y Leyes Ponderales. 1.- Convierta las siguientes unidades de temperatura en C, F y K según corresponda:
 1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
Estructura de los átomos.
 Estructura de los átomos. Teoría atomística de Demócrito: Átomo, del griego: que no se puede cortar. Demócrito, filósofo griego (s. IV a.c.): Si dividimos la materia de forma sucesiva llegará un momento
Estructura de los átomos. Teoría atomística de Demócrito: Átomo, del griego: que no se puede cortar. Demócrito, filósofo griego (s. IV a.c.): Si dividimos la materia de forma sucesiva llegará un momento
CONCRECIÓN CURRICULAR FÍSICA Y QUÍMICA CURSO: 3º DE LA ESO
 CONCRECIÓN CURRICULAR FÍSICA Y QUÍMICA CURSO: 3º DE LA ESO CRITERIOS DE EVALUACIÓN COMPETENCIAS BÁSICAS CONTENIDOS OBJETIVOS DE ÁREA /MATERIA OBJETIVOS DE ETAPA Trabajar con orden, limpieza, exactitud
CONCRECIÓN CURRICULAR FÍSICA Y QUÍMICA CURSO: 3º DE LA ESO CRITERIOS DE EVALUACIÓN COMPETENCIAS BÁSICAS CONTENIDOS OBJETIVOS DE ÁREA /MATERIA OBJETIVOS DE ETAPA Trabajar con orden, limpieza, exactitud
Cuaderno de Repaso para Alumnos Pendientes con la asignatura de 3º ESO Física-Química
 Departamento de Física y Química Cuaderno de Repaso para Alumnos Pendientes con la asignatura de 3º ESO Física-Química CAMBIO DE UNIDADES Repaso Global 3ºESO FyQ 1. Cuáles son las magnitudes fundamentales
Departamento de Física y Química Cuaderno de Repaso para Alumnos Pendientes con la asignatura de 3º ESO Física-Química CAMBIO DE UNIDADES Repaso Global 3ºESO FyQ 1. Cuáles son las magnitudes fundamentales
Todo lo que puedas imaginar está compuesto por átomos.
 Todo lo que puedas imaginar está compuesto por átomos. El átomo es la partícula más pequeña de un elemento químico (materia formada por átomos iguales) y posee las características del mismo. Cuando se
Todo lo que puedas imaginar está compuesto por átomos. El átomo es la partícula más pequeña de un elemento químico (materia formada por átomos iguales) y posee las características del mismo. Cuando se
CUADERNILLO RECUPERACIÓN SEPTIEMBRE FÍSICA Y QUÍMICA 3º E.S.O.
 CUADERNILLO RECUPERACIÓN SEPTIEMBRE FÍSICA Y QUÍMICA 3º E.S.O. NOMBRE: CURSO: TEMA 1: LA CIENCIA: LA MATERIA Y SU MEDIDA 1.- Completa la siguiente tabla: Medida Magnitud que se mide Unidad usada Unidad
CUADERNILLO RECUPERACIÓN SEPTIEMBRE FÍSICA Y QUÍMICA 3º E.S.O. NOMBRE: CURSO: TEMA 1: LA CIENCIA: LA MATERIA Y SU MEDIDA 1.- Completa la siguiente tabla: Medida Magnitud que se mide Unidad usada Unidad
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq Actividades de recuperación de 2º trimestre 3º ESO wertyuiopasdfghjklzxcvbnmqwertyui
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq Actividades de recuperación de 2º trimestre 3º ESO wertyuiopasdfghjklzxcvbnmqwertyui
1.2 LA MATERIA Y LOS CAMBIOS
 1.2 LA MATERIA Y LOS CAMBIOS Por equipo definir que es átomo, molécula y de que están formados Equipo Átomo Molécula 1 2 3 4 5 6 7 8 ÁTOMO 1. Un átomo es eléctricamente neutro. tiene el mismo número
1.2 LA MATERIA Y LOS CAMBIOS Por equipo definir que es átomo, molécula y de que están formados Equipo Átomo Molécula 1 2 3 4 5 6 7 8 ÁTOMO 1. Un átomo es eléctricamente neutro. tiene el mismo número
PROGRAMA QUÍMICA 2015-2016
 PROGRAMA QUÍMICA 2015-2016 1. Conceptos comunes. Transformaciones físicas y químicas. Leyes ponderales de la química. Masas atómicas y masas moleculares. Número de Avogadro. Mol. Fórmula empírica y fórmula
PROGRAMA QUÍMICA 2015-2016 1. Conceptos comunes. Transformaciones físicas y químicas. Leyes ponderales de la química. Masas atómicas y masas moleculares. Número de Avogadro. Mol. Fórmula empírica y fórmula
UNIDAD 4. ESTRUCTURA DE LA MATERIA.
 UNIDAD 4. ESTRUCTURA DE LA MATERIA. 1.- Resume las características principales de los distintos modelos atómicos que has estudiado y ordénalos cronológicamente. (Pág. 74 a 78) 2.- Indica si las siguientes
UNIDAD 4. ESTRUCTURA DE LA MATERIA. 1.- Resume las características principales de los distintos modelos atómicos que has estudiado y ordénalos cronológicamente. (Pág. 74 a 78) 2.- Indica si las siguientes
PROGRAMA DE QUÍMICA ESTRUCTURA ATÓMICA Y CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS
 PROGRAMA DE QUÍMICA La asignatura se ajustará al programa oficial (Decreto 115/2008, de 6 de junio, por el que se establece el currículo de Bachillerato en Extremadura- DOE, nº 117, de 18 de junio de 2008-).
PROGRAMA DE QUÍMICA La asignatura se ajustará al programa oficial (Decreto 115/2008, de 6 de junio, por el que se establece el currículo de Bachillerato en Extremadura- DOE, nº 117, de 18 de junio de 2008-).
GUIA DE ESTUDIO DE CIENCIAS III
 GUIA DE ESTUDIO DE CIENCIAS III INSTRUCCIÓN: Investiga en tu libro de química o tu cuaderno para poder colocar la respuesta correcta, en cada planteamiento. 1. Por qué la química se considera una ciencia?
GUIA DE ESTUDIO DE CIENCIAS III INSTRUCCIÓN: Investiga en tu libro de química o tu cuaderno para poder colocar la respuesta correcta, en cada planteamiento. 1. Por qué la química se considera una ciencia?
Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica. Clasificación de los elementos y propiedades periódicas
 Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica Clasificación de los elementos y propiedades periódicas Modelos atómicos: Átomo de Dalton NOMBRE EN QUÉ CONSISTE QUÉ EXPLICA QUÉ
Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica Clasificación de los elementos y propiedades periódicas Modelos atómicos: Átomo de Dalton NOMBRE EN QUÉ CONSISTE QUÉ EXPLICA QUÉ
Ejercicios y respuestas del apartado: Teoría atómica. Z, A, isótopos, n, p, e-. Iones
 Ejercicios y respuestas del apartado: Teoría atómica. Z, A, isótopos, n, p, e-. Iones Teorías atómicas 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos
Ejercicios y respuestas del apartado: Teoría atómica. Z, A, isótopos, n, p, e-. Iones Teorías atómicas 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos
NÚCLEO ATÓMICO Profesor: Juan T. Valverde
 6 1.- Deduce la masa atómica del litio a partir de sus isótopos Li con una abundancia del 7 7,5% y Li con una abundancia del 92,5%. http://www.youtube.com/watch?v=8vvo-xqynea&feature=youtu.be 2.- Calcula
6 1.- Deduce la masa atómica del litio a partir de sus isótopos Li con una abundancia del 7 7,5% y Li con una abundancia del 92,5%. http://www.youtube.com/watch?v=8vvo-xqynea&feature=youtu.be 2.- Calcula
, que no está formado por moléculas, sino por una red cristalina en la que hay una proporción de dos átomos de flúor por cada átomo de calcio.
 7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
Sistema Internacional de unidades
 Sistema Internacional de Medidas pág 1 de 8 Sistema Internacional de unidades 1. Introducción La observación de un fenómeno es en general incompleta a menos a menos que dé lugar a una información cuantitativa.
Sistema Internacional de Medidas pág 1 de 8 Sistema Internacional de unidades 1. Introducción La observación de un fenómeno es en general incompleta a menos a menos que dé lugar a una información cuantitativa.
PCPI Ámbito Científico-Tecnológico LA MATERIA
 LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
LA MATERIA La materia es todo aquello que ocupa lugar en el espacio y tiene masa. Un sistema material es una porción de materia que, para su estudio, aislamos del resto. La materia está formada por partículas
Contenido de Física y Química de la Primera Evaluación
 Contenido de Física y Química de la Primera Evaluación Concepto Teoría Práctica Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura. En tradicional se denominan
Contenido de Física y Química de la Primera Evaluación Concepto Teoría Práctica Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura. En tradicional se denominan
ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA
 ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA Teoría Atómica de DALTON 1- Los elementos químicos están constituidos por partículas denominadas átomos 2- Átomos de un mismo elemento, tienen las mismas
ESTRUCTURA ATÓMICA TABLA PERIÓDICA UNIÓN QUÍMICA Teoría Atómica de DALTON 1- Los elementos químicos están constituidos por partículas denominadas átomos 2- Átomos de un mismo elemento, tienen las mismas
UNIDAD 1: ATOMOS Y MOLÉCULAS
 UNIDAD 1: ATOMOS Y MOLÉCULAS 1 Se define átomo como la menor porción de un elemento que se puede intercambiar por medio de una reacción química. Se define molécula como la menor porción de materia que
UNIDAD 1: ATOMOS Y MOLÉCULAS 1 Se define átomo como la menor porción de un elemento que se puede intercambiar por medio de una reacción química. Se define molécula como la menor porción de materia que
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS
 PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
PROGRAMACIÓN DE FÍSICA Y QUÍMICA 1º BACHILLERATO. Curso 2013/14
 PROGRAMACIÓN DE FÍSICA Y QUÍMICA 1º BACHILLERATO. Curso 2013/14 OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN OBJETIVOS CONTENIDOS CRITERIOS DE EVALUACIÓN Distinguir valencia de número de oxidación e
PROGRAMACIÓN DE FÍSICA Y QUÍMICA 1º BACHILLERATO. Curso 2013/14 OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN OBJETIVOS CONTENIDOS CRITERIOS DE EVALUACIÓN Distinguir valencia de número de oxidación e
ejercicios propuestos
 INGRESO ESCUELA NAVAL MILITAR QUÍMICA ejercicios propuestos 1. El átomo está constituido principalmente por: a) Fotones, neutrones y protones. b) Protones, neutrones y electrones. c) Electrones, aniones
INGRESO ESCUELA NAVAL MILITAR QUÍMICA ejercicios propuestos 1. El átomo está constituido principalmente por: a) Fotones, neutrones y protones. b) Protones, neutrones y electrones. c) Electrones, aniones
Criterios de evaluación mínimos para Física y Química en 4º ESO: UNIDAD DIDÁCTICA 0Q.- MEDIDA Y MÉTODO CIENTÍFICO
 FÍSICA Y QUÍMICA 4º E.S.O. Criterios de evaluación mínimos para Física y Química en 4º ESO: Los Contenidos mínimos imprescindibles que deben asimilar los alumnos de 4º de E.S.O. son los siguientes: UNIDAD
FÍSICA Y QUÍMICA 4º E.S.O. Criterios de evaluación mínimos para Física y Química en 4º ESO: Los Contenidos mínimos imprescindibles que deben asimilar los alumnos de 4º de E.S.O. son los siguientes: UNIDAD
La materia. Clasificación de la materia
 27 de marzo de 2005 Contenidos 1 Introducción La materia 2 La materia Qué es la materia? Materia es todo aquello que tiene masa y posee volumen. La materia Qué es la materia? Materia es todo aquello que
27 de marzo de 2005 Contenidos 1 Introducción La materia 2 La materia Qué es la materia? Materia es todo aquello que tiene masa y posee volumen. La materia Qué es la materia? Materia es todo aquello que
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq ACTIVIDADES DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º ESO 2º TRIMESTRE
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq ACTIVIDADES DE RECUPERACIÓN DE FÍSICA Y QUÍMICA 3º ESO 2º TRIMESTRE
B. Cuál es su número atómico y másico? Di cuántos protones y neutrones hay en el núcleo y electrones en la corteza.
 Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
CIENCIAS DE LA NATURALEZA 1º ESO BLOQUE FÍSICA / QUÍMICA
 CIENCIAS DE LA NATURALEZA 1º ESO BLOQUE FÍSICA / QUÍMICA El último bloque de la asignatura de ciencias de la naturaleza corresponde al estudio de los conceptos más básicos de física y química. La FÍSICA
CIENCIAS DE LA NATURALEZA 1º ESO BLOQUE FÍSICA / QUÍMICA El último bloque de la asignatura de ciencias de la naturaleza corresponde al estudio de los conceptos más básicos de física y química. La FÍSICA
Concepto Teoría Práctica Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Nomenclatura. En tradicional se denominan anhídridos.
 Concepto Teoría Práctica Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura. En tradicional se denominan anhídridos. Tablas de formulación. Hidruros metálicos (M+H)
Concepto Teoría Práctica Óxidos básicos (M+O) Nomenclatura. Tablas de formulación. Óxidos ácidos (NM+O) Nomenclatura. En tradicional se denominan anhídridos. Tablas de formulación. Hidruros metálicos (M+H)
I N TRODUCCIÓN A LA QUÍMICA
 I N TRODUCCIÓN A LA QUÍMICA FUNDAMENTACIÓN La Química es una ciencia que se ocupa del estudio de los materiales que constituyen el universo y de los cambios que los mismos experimentan. Su campo es innumerablemente
I N TRODUCCIÓN A LA QUÍMICA FUNDAMENTACIÓN La Química es una ciencia que se ocupa del estudio de los materiales que constituyen el universo y de los cambios que los mismos experimentan. Su campo es innumerablemente
Refuerzo Modelos atómicos
 Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Unidades de masa atómica
 Unidades de masa atómica La estructura química y las fórmulas químicas sirven para estudiar las relaciones de masa de átomos y moléculas. Estas relaciones ayudan a explicar la composición de los compuestos
Unidades de masa atómica La estructura química y las fórmulas químicas sirven para estudiar las relaciones de masa de átomos y moléculas. Estas relaciones ayudan a explicar la composición de los compuestos
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA
 UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda
UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda
----------SOLUCIÓN ---------- 1. (b) 8. (a) 2. (a) 29. (b) 30. (c) 22. (d) 23. (b) 24. (a) 25. (b) 26. (d) 27. (c) 28. (a)
 29. Si la presión externa del ambiente que rodea a un líquido aumenta, qué le pasa a la temperatura a la que hierve? a) disminuye b) aumenta c) no cambia d) no se puede saber 30. Las gotas de agua que
29. Si la presión externa del ambiente que rodea a un líquido aumenta, qué le pasa a la temperatura a la que hierve? a) disminuye b) aumenta c) no cambia d) no se puede saber 30. Las gotas de agua que
EJERCICIOS DE SELECTIVIDAD 99/00
 EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
Tema 3: Ecuaciones químicas y concentraciones
 Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
Tema 3: Ecuaciones químicas y concentraciones Definición de disolución. Clases de disoluciones. Formas de expresar la concentración de una disolución. Proceso de dilución. Solubilidad. Diagramas de fases
Experiencia Consecuencia Modelo. Partículas elementales. Radiactividad Existencia del núcleo Modelo atómico Rutherford (modelo planetario) - 1911
 ESTRUCTURA ATÓMICA Experiencia Consecuencia Modelo Rayos catódicos Divisibilidad del átomo. Partículas elementales. Modelo atómico de Thomson (modelo sandía) - 1904 Radiactividad Existencia del núcleo
ESTRUCTURA ATÓMICA Experiencia Consecuencia Modelo Rayos catódicos Divisibilidad del átomo. Partículas elementales. Modelo atómico de Thomson (modelo sandía) - 1904 Radiactividad Existencia del núcleo
LA MATERIA Y SU MEDIDA. 2º ESO Ciencias de la naturaleza
 LA MATERIA Y SU MEDIDA 2º ESO Ciencias de la naturaleza LA MATERIA Materia es todo aquello que tiene volumen (ocupa un espacio) y masa. PROPIEDADES DE LA MATERIA Las propiedades son las características
LA MATERIA Y SU MEDIDA 2º ESO Ciencias de la naturaleza LA MATERIA Materia es todo aquello que tiene volumen (ocupa un espacio) y masa. PROPIEDADES DE LA MATERIA Las propiedades son las características
quimica2univia.wordpress.com www.youtube.com/watch?v=6-jfwqiv-q0
 quimica2univia.wordpress.com www.youtube.com/watch?v=6-jfwqiv-q0 Átomo definición 1 En física y química, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento
quimica2univia.wordpress.com www.youtube.com/watch?v=6-jfwqiv-q0 Átomo definición 1 En física y química, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento
La ciencia y su método. Medida de magnitudes
 Unidad 1 La ciencia y su método. Medida de magnitudes 1. Completa las siguientes frases referentes al trabajo científico. a) La ciencia estudia el mundo ; por ello, se habla de de la naturaleza. b) Los
Unidad 1 La ciencia y su método. Medida de magnitudes 1. Completa las siguientes frases referentes al trabajo científico. a) La ciencia estudia el mundo ; por ello, se habla de de la naturaleza. b) Los
CRITERIOS DE EVALUACIÓN. QUÍMICA 2º BACHILLERATO. IES REYES CATÓLICOS ESTRUCTURA ATÓMICA Y SISTEMA PERIÓDICO. ENLACE QUÍMICO
 CRITERIOS DE EVALUACIÓN. QUÍMICA 2º BACHILLERATO. IES REYES CATÓLICOS CAPÍTULO 1 Aplicar el modelo mecánico- cuántico del átomo para explicar las variaciones periódicas de algunas de sus propiedades. -
CRITERIOS DE EVALUACIÓN. QUÍMICA 2º BACHILLERATO. IES REYES CATÓLICOS CAPÍTULO 1 Aplicar el modelo mecánico- cuántico del átomo para explicar las variaciones periódicas de algunas de sus propiedades. -
Curso 2014/15 Física y Química 3º ESO ACTIVIDADES DE REFUERZO PRIMER TRIMESTRE Nombre: Apellidos:
 Curso 2014/15 Física y Química 3º ESO ACTIVIDADES DE REFUERZO PRIMER TRIMESTRE Nombre: Apellidos: Fecha de entrega: día del examen de recuperación. 1. Contesta brevemente las siguientes preguntas relacionadas
Curso 2014/15 Física y Química 3º ESO ACTIVIDADES DE REFUERZO PRIMER TRIMESTRE Nombre: Apellidos: Fecha de entrega: día del examen de recuperación. 1. Contesta brevemente las siguientes preguntas relacionadas
Pegatina del Estudiante
 Examen 2015-16 Plan: [G25] ACCESO A GRADO PARA MAYORES DE 25 Asignatura: [558] Química Profesor: Lucas Castro Martínez Fecha: 28/04/2016 Horario peninsular 9:00-10:30 Pegatina del Estudiante Espacio para
Examen 2015-16 Plan: [G25] ACCESO A GRADO PARA MAYORES DE 25 Asignatura: [558] Química Profesor: Lucas Castro Martínez Fecha: 28/04/2016 Horario peninsular 9:00-10:30 Pegatina del Estudiante Espacio para
ESTEQUIOMETRÍA I. ÁTOMO Mínima porción de materia que posee aún las propiedades del elemento.
 ESTEQUIOMETRÍA I Preparado por: José del c. Mondragón C. El término estequiometría deriva del griego steicheion, que significa primer principio o elemento y de metron, que significa medida. La estequiometría
ESTEQUIOMETRÍA I Preparado por: José del c. Mondragón C. El término estequiometría deriva del griego steicheion, que significa primer principio o elemento y de metron, que significa medida. La estequiometría
Definición de unidad de masa atómica (u): La unidad de masa atómica es la doceava 1/12 parte de la masa de un átomo de Carbono-12
 EL CONCEPTO DE MOL. Antes de nada vamos a recordar la definición de la unidad de masa atómica, conocida como u.m.a. o simplemente u. y la historia de su medición: En 1801 Dalton eligió como patrón de referencia
EL CONCEPTO DE MOL. Antes de nada vamos a recordar la definición de la unidad de masa atómica, conocida como u.m.a. o simplemente u. y la historia de su medición: En 1801 Dalton eligió como patrón de referencia
1. Cuál de los siguientes enunciados es uno de los postulados correspondientes al modelo atómico de Bohr?
 Programa Estándar Anual Nº Guía práctica: Teoría atómica I: modelos atómicos, estructura atómica y tipos de átomos Ejercicios PSU 1. Cuál de los siguientes enunciados es uno de los postulados correspondientes
Programa Estándar Anual Nº Guía práctica: Teoría atómica I: modelos atómicos, estructura atómica y tipos de átomos Ejercicios PSU 1. Cuál de los siguientes enunciados es uno de los postulados correspondientes
Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p
 1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN
 PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN 1) Razona si los procesos siguientes son físicos o químicos: a. La fermentación del azúcar. b. Formación de hielo. c. Destrucción de la
PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN 1) Razona si los procesos siguientes son físicos o químicos: a. La fermentación del azúcar. b. Formación de hielo. c. Destrucción de la
Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia.
 TEMA 02 Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia. -.-.-.-.-.-.-.-.-..-..-..-..-..-..-.-..-..-..-..-..-.-..-.-..-.-.-.-..-.-...-..-.-..-.-..-.-..-.-..-.-..-.-..-.-..-.-
TEMA 02 Materia. Definición, propiedades, cambios de la materia y energía, clasificación de la materia. -.-.-.-.-.-.-.-.-..-..-..-..-..-..-.-..-..-..-..-..-.-..-.-..-.-.-.-..-.-...-..-.-..-.-..-.-..-.-..-.-..-.-..-.-..-.-
JMLC - Chena IES Aguilar y Cano - Estepa
 Termodinámica es la parte de la física que estudia los intercambios de calor y trabajo que acompañan a los procesos fisicoquímicos. Si estos son reacciones químicas, la parte de ciencia que los estudia
Termodinámica es la parte de la física que estudia los intercambios de calor y trabajo que acompañan a los procesos fisicoquímicos. Si estos son reacciones químicas, la parte de ciencia que los estudia
Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros 1
 Departamento de Ingeniería Química y Química Inorgánica Universidad de Cantabria (SPAIN) Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros
Departamento de Ingeniería Química y Química Inorgánica Universidad de Cantabria (SPAIN) Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros
TIPOS DE REACCIONES QUIMICAS
 Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
Segundo ensayo parcial de química electivo. Química Común
 Segundo ensayo parcial de química electivo. Para la resolución de algunos ejercicios propuestos en este módulo, se adjunta una parte de la tabla periódica de los elementos. Química Común 1. En el ión Cu
Segundo ensayo parcial de química electivo. Para la resolución de algunos ejercicios propuestos en este módulo, se adjunta una parte de la tabla periódica de los elementos. Química Común 1. En el ión Cu
Tema 3. Enlace químico
 Tema 3. Enlace químico Teoría de Lewis Enlace iónico Enlace covalente Parámetros de enlace Forma de las moléculas Polaridad de las moléculas Teoría del enlace de valencia Enlace químico Modo de combinarse
Tema 3. Enlace químico Teoría de Lewis Enlace iónico Enlace covalente Parámetros de enlace Forma de las moléculas Polaridad de las moléculas Teoría del enlace de valencia Enlace químico Modo de combinarse
Estándar Anual. Ejercicios PSU. Ciencias Básicas Química. Guía práctica: El enlace químico GUICES004CB33-A16V1. Programa
 Programa Estándar Anual Nº Guía práctica: El enlace químico Ejercicios PSU 1. Con respecto al enlace químico, se afirma que A) el enlace iónico se establece entre elementos de electronegatividad similar.
Programa Estándar Anual Nº Guía práctica: El enlace químico Ejercicios PSU 1. Con respecto al enlace químico, se afirma que A) el enlace iónico se establece entre elementos de electronegatividad similar.
Colegio Superior de Señoritas Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 -
 Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Complete el siguiente cuadro calculando en cada caso los valores faltantes. Características de algunas especies químicas Especie química
Profesora: Noylen Vega Martínez Practica 8 avo año Química: - 1 - Complete el siguiente cuadro calculando en cada caso los valores faltantes. Características de algunas especies químicas Especie química
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
ACTIVIDADES 3º E.S.O. Tema 4.- La estructura de la materia. Agrupaciones de átomos
 ACTIVIDADES 3º E.S.O. Tema 4.- La estructura de la materia. Agrupaciones de átomos Pág. 74 3. Responde a las siguientes cuestiones basándote en la teoría atómica de Dalton: a) Pueden dos elementos distintos
ACTIVIDADES 3º E.S.O. Tema 4.- La estructura de la materia. Agrupaciones de átomos Pág. 74 3. Responde a las siguientes cuestiones basándote en la teoría atómica de Dalton: a) Pueden dos elementos distintos
CONTENIDOS, CRITERIOS DE EVALUACIÓN Y CALIFICACIÓN DE LAS MATERIAS DEL DEPARTAMENTO DE FÍSICA Y QUÍMICA
 CONTENIDOS, CRITERIOS DE EVALUACIÓN Y CALIFICACIÓN DE LAS MATERIAS DEL DEPARTAMENTO DE FÍSICA Y QUÍMICA 3º ESO- FÍSICA Y QUÍMICA SECUENCIACIÓN DE LAS UNIDADES DIDÁCTICAS. Se han distribuido las horas dedicadas
CONTENIDOS, CRITERIOS DE EVALUACIÓN Y CALIFICACIÓN DE LAS MATERIAS DEL DEPARTAMENTO DE FÍSICA Y QUÍMICA 3º ESO- FÍSICA Y QUÍMICA SECUENCIACIÓN DE LAS UNIDADES DIDÁCTICAS. Se han distribuido las horas dedicadas
TEMA 3. CLASIFICACIÓN DE LA MATERIA.
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3º ESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. - Elemento. Es una sustancia
Disoluciones químicas
 Disoluciones químicas Recordemos. Qué son las disoluciones químicas? Mezcla homogénea, constituida por dos o más componentes Soluciones = disoluciones COMPONENTES DE UNA DISOLUCION SOLUTO: Es la sustancia
Disoluciones químicas Recordemos. Qué son las disoluciones químicas? Mezcla homogénea, constituida por dos o más componentes Soluciones = disoluciones COMPONENTES DE UNA DISOLUCION SOLUTO: Es la sustancia
EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS.
 Mapa conceptual. EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS. AUTOR DALTON (1808) THOMSON (1900) RUTHERFORD (1911) HECHOS EN LOS QUE SE BASÓ. Ley de conservación de la masa en las reacciones químicas (Lavoisier,
Mapa conceptual. EVOLUCIÓN HISTÓRICA DE LOS MODELOS ATÓMICOS. AUTOR DALTON (1808) THOMSON (1900) RUTHERFORD (1911) HECHOS EN LOS QUE SE BASÓ. Ley de conservación de la masa en las reacciones químicas (Lavoisier,
Rige a partir de la convocatoria 01-2016
 Q u í m i c a LISTADO DE OBJETIVOS Y CONTENIDOS QUE SE MEDIRÁN EN LAS PRUEBAS DE CERTIFICACIÓN DE LOS PROGRAMAS: Bachillerato por Madurez Suficiente Bachillerato de Educación Diversificada a Distancia
Q u í m i c a LISTADO DE OBJETIVOS Y CONTENIDOS QUE SE MEDIRÁN EN LAS PRUEBAS DE CERTIFICACIÓN DE LOS PROGRAMAS: Bachillerato por Madurez Suficiente Bachillerato de Educación Diversificada a Distancia
OBJETIVOS Y METODOS DE LA QUIMICA. CLASIFICACIÓN DE LA MATERIA. OBJETIVOS Y METODOS DE LA QUIMICA.
 OBJETIVOS Y METODOS DE LA QUIMICA. CLASIFICACIÓN DE LA MATERIA. OBJETIVOS Y METODOS DE LA QUIMICA. Para reflexionar: la Química forma parte de las Ciencias Naturales, cuyo objetivo último es mejorar las
OBJETIVOS Y METODOS DE LA QUIMICA. CLASIFICACIÓN DE LA MATERIA. OBJETIVOS Y METODOS DE LA QUIMICA. Para reflexionar: la Química forma parte de las Ciencias Naturales, cuyo objetivo último es mejorar las
CONTENIDOS, CRITERIOS DE EVALUACIÓN Y CALIFICACIÓN DE LAS MATERIAS DEL DEPARTAMENTO DE FÍSICA Y QUÍMICA
 CONTENIDOS, CRITERIOS DE EVALUACIÓN Y CALIFICACIÓN DE LAS MATERIAS DEL DEPARTAMENTO DE FÍSICA Y QUÍMICA 3º ESO- FÍSICA Y QUÍMICA SECUENCIACIÓN DE LAS UNIDADES DIDÁCTICAS. Se han distribuido las horas dedicadas
CONTENIDOS, CRITERIOS DE EVALUACIÓN Y CALIFICACIÓN DE LAS MATERIAS DEL DEPARTAMENTO DE FÍSICA Y QUÍMICA 3º ESO- FÍSICA Y QUÍMICA SECUENCIACIÓN DE LAS UNIDADES DIDÁCTICAS. Se han distribuido las horas dedicadas
UNIDAD: 7 ESTEQUIOMETRÍA
 UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
1. La medida y el método científico
 COPIA Y RESUELVE 1. La medida y el método científico 1. A qué llamamos unidad de medida? Qué es un sistema de unidades? 2. Cuáles son las unidades de medida del sistema internacional para las siguientes
COPIA Y RESUELVE 1. La medida y el método científico 1. A qué llamamos unidad de medida? Qué es un sistema de unidades? 2. Cuáles son las unidades de medida del sistema internacional para las siguientes
MASA ATÓMICA MASA MOLECULAR. Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1
 Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1 MASA ATÓMICA Al igual que ocurre en la materia ordinaria (piensa en las distintas variedades de panes en tamaño, composición y peso,
Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1 MASA ATÓMICA Al igual que ocurre en la materia ordinaria (piensa en las distintas variedades de panes en tamaño, composición y peso,
EJERCICIOS RELACIONADOS CON LOS ELEMENTOS QUÍMICOS Y EL ÁTOMO
 EJERCICIOS RELACIONADOS CON LOS ELEMENTOS QUÍMICOS Y EL ÁTOMO En muchos de los ejercicios se utilizan isótopos de los elementos, por esta razón, se escriben números enteros que corresponden al número de
EJERCICIOS RELACIONADOS CON LOS ELEMENTOS QUÍMICOS Y EL ÁTOMO En muchos de los ejercicios se utilizan isótopos de los elementos, por esta razón, se escriben números enteros que corresponden al número de
La ciencia y su método. Medida de magnitudes
 Unidad 1 La ciencia y su método. Medida de magnitudes 1. Completa las siguientes frases referentes al trabajo científico. a) La ciencia estudia el mundo ; por ello, se habla de de la naturaleza. b) Los
Unidad 1 La ciencia y su método. Medida de magnitudes 1. Completa las siguientes frases referentes al trabajo científico. a) La ciencia estudia el mundo ; por ello, se habla de de la naturaleza. b) Los
1. Analizar situaciones y obtener información sobre fenómenos químicos utilizando las estrategias básicas del trabajo científico.
 ASIGNATURA: QUIMICA Actualización: Mayo 2009 Validez desde el curso: 2009/2010 Autorización: COPAEU Castilla y León PROGRAMA Análisis del currículo y acuerdos para las Pruebas de Acceso a Estudios Universitarios
ASIGNATURA: QUIMICA Actualización: Mayo 2009 Validez desde el curso: 2009/2010 Autorización: COPAEU Castilla y León PROGRAMA Análisis del currículo y acuerdos para las Pruebas de Acceso a Estudios Universitarios
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
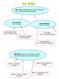 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO.
 BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos. 1. Ordena cronológicamente los siguientes hechos. a) Descubrimiento del protón. b) Experimento de Millikan. c) Experimento
BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos. 1. Ordena cronológicamente los siguientes hechos. a) Descubrimiento del protón. b) Experimento de Millikan. c) Experimento
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
GUÍA DE APRENDIZAJE Nº 6 para 1º MEDIO TEMA: ESTEQUIOMETRIA 2ª parte. Subsector: QUÍMICA Docente: Liduvina Campos A. Nombre alumno: Curso: Fecha:
 Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Estequiometría. GUÍA DE APRENDIZAJE Nº 6 para 1º MEDIO TEMA: ESTEQUIOMETRIA 2ª parte Objetivo General: Aplicación de cálculos estequiométricos
Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Estequiometría. GUÍA DE APRENDIZAJE Nº 6 para 1º MEDIO TEMA: ESTEQUIOMETRIA 2ª parte Objetivo General: Aplicación de cálculos estequiométricos
Autor: Sabino Menolasina Mérida, 2010. 1ª Ed. 562 p. ISBN 978-980-11-1276-1 PRÓLOGO... 17
 QUÍMICA GENERAL APLICADA A LAS CIENCIAS DE LA SALUD Autor: Sabino Menolasina Mérida, 2010. 1ª Ed. 562 p. ISBN 978-980-11-1276-1 En esta obra, el autor expone una serie de conceptos fundamentales y ejercicios
QUÍMICA GENERAL APLICADA A LAS CIENCIAS DE LA SALUD Autor: Sabino Menolasina Mérida, 2010. 1ª Ed. 562 p. ISBN 978-980-11-1276-1 En esta obra, el autor expone una serie de conceptos fundamentales y ejercicios
1. Temas a desarrollar en la Unidad I.
 Secretaria de educación Pública Subsecretaría de Educación Media Superior Dirección General de Educación Tecnológica Industrial Centro de Estudios Tecnológicos Industrial y de Servicios No. 5 Gertrudis
Secretaria de educación Pública Subsecretaría de Educación Media Superior Dirección General de Educación Tecnológica Industrial Centro de Estudios Tecnológicos Industrial y de Servicios No. 5 Gertrudis
Cinética química. Cinética Química Química 2º. Velocidad de reacción
 Cinética química Velocidad de reacción La velocidad de una reacción es la derivada de la concentración de un reactivo o producto con respecto al tiempo tomada siempre como valor positivo. Expresión de
Cinética química Velocidad de reacción La velocidad de una reacción es la derivada de la concentración de un reactivo o producto con respecto al tiempo tomada siempre como valor positivo. Expresión de
MODELO DE RESPUESTAS
 1/6 UNIVERSIDAD NACIONAL ABIERTA VICERRECTORADO ACADEMICO AREA: INGENIERÍA CARRERA: INGENIERIA INDUSTRIAL S ASIGNATURA: QUIMICA CÓDIGO: 209 MOMENTO: VERSION: 1 FECHA DE APLICACIÓN: 09/07/2011 LAPSO: Prof.
1/6 UNIVERSIDAD NACIONAL ABIERTA VICERRECTORADO ACADEMICO AREA: INGENIERÍA CARRERA: INGENIERIA INDUSTRIAL S ASIGNATURA: QUIMICA CÓDIGO: 209 MOMENTO: VERSION: 1 FECHA DE APLICACIÓN: 09/07/2011 LAPSO: Prof.
Qué información podemos obtener de ella?
 Qué información podemos obtener de ella? Dmitri Mendeleiev (1834-1907) Elementos enlistados según su masa atómica Propiedades periódicas de los elementos Predice existencia de elementos con determinadas
Qué información podemos obtener de ella? Dmitri Mendeleiev (1834-1907) Elementos enlistados según su masa atómica Propiedades periódicas de los elementos Predice existencia de elementos con determinadas
PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14
 PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14 INFORMACIÓN Y CONTENIDOS MÍNIMOS PARA LA EVALUACIÓN Información Para que los alumnos puedan recuperar esta asignatura lo más pronto posible,
PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14 INFORMACIÓN Y CONTENIDOS MÍNIMOS PARA LA EVALUACIÓN Información Para que los alumnos puedan recuperar esta asignatura lo más pronto posible,
4. TEORÍA ATÓMICO-MOLECULAR
 4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza
4. TEORÍA ATÓMICO-MOLECULAR Sustancias que reaccionan 1. Explica qué son los procesos o cambios físicos y pon ejemplos de ellos. Los procesos o cambios físicos no producen modificaciones en la naturaleza
FÍSICA Y QUÍMICA 3ºESO
 TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3ºESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. Por ejemplo siempre tienen
TEMA 3. CLASIFICACIÓN DE LA MATERIA. FÍSICA Y QUÍMICA 3ºESO 1. CLASIFICACIÓN DE LA MATERIA SUSTANCIAS PURAS. Son las que tienen siempre las mismas propiedades físicas y químicas. Por ejemplo siempre tienen
TRANSFORMACIONES Y REACCIONES QUÍMICAS
 TRANSFORMACIONES Y REACCIONES QUÍMICAS 1. TRANSFORMACIONES FÍSICAS Y QUÍMICAS a. Transformaciones físicas: Cambios que sufre la materia y que no alteran su naturaleza. (Ej.: el agua al congelarse) b. Transformaciones
TRANSFORMACIONES Y REACCIONES QUÍMICAS 1. TRANSFORMACIONES FÍSICAS Y QUÍMICAS a. Transformaciones físicas: Cambios que sufre la materia y que no alteran su naturaleza. (Ej.: el agua al congelarse) b. Transformaciones
Propiedades de las disoluciones
 Tema 1: Disoluciones Propiedades de las disoluciones Factor de van t Hoff (i) El factor de van t Hoff (i) indica la medida del grado de disociación o de ionización de un soluto en agua. El factor de van
Tema 1: Disoluciones Propiedades de las disoluciones Factor de van t Hoff (i) El factor de van t Hoff (i) indica la medida del grado de disociación o de ionización de un soluto en agua. El factor de van
