TRABAJO PRÁCTICO N 2 DETERMINACIÓN DE DENSIDADES
|
|
|
- Elvira Toro Plaza
- hace 7 años
- Vistas:
Transcripción
1 0 TRABAJO PRÁCTICO N 2 DETERMINACIÓN DE DENSIDADES a) Determinación de la densidad de hidrógeno Objetivos Determinar la densidad de un gas Conceptos Gases ideales, presión de vapor, rendimiento, pureza, estequiometría, reactivo limitante. Parte experimental 1. Introducción: En este experimento se medirá el volumen de un gas (hidrógeno), desprendido en una reacción química representada por la siguiente ecuación: Mg (s) + 2 HCl Mg 2+ (ac.) + 2 Cl - (ac.) + H 2 El gas generado desplazará un volumen de agua contenida en la probeta. De esta manera se pretende evaluar el volumen total del gas producido como resultado de la reacción. 2. Procedimiento: Para la realización de la práctica se armará el siguiente equipo: Mangera Probeta Agarradera Tapón de goma Soporte Vaso de precipitado Kitasato Tubo U
2 Verificar la ausencia de burbujas de aire en la probeta (consultar al docente para lograrlo). Colocar en el kitasato 20 cm 3 de HCl 2M, luego colocar cuidadosamente sobre la boca del kitasato inclinado, cuidando que no tome contacto con el HCl, 60 mg de Mg pesados. Tapar rápidamente empujando el Mg con el tapón (la reacción comienza instantáneamente. Ante cualquier duda consulte al docente). Cuando la reacción haya concluido (cuando se haya consumido todo el Mg y haya cesado el desprendimiento de gas), equilibrar la presión interna y externa igualando los niveles de agua dentro y fuera de la probeta, modificando para ello la altura de la misma, sin sacarla del agua. Si esto no es posible y quedara una columna de agua en la probeta, ésta será la altura en milímetros de la columna de agua. Medir el volumen de gas contenido en la probeta. DURANTE LA REACCIÓN, LOS MECHEROS DEBEN ESTAR APAGADOS PARA EVITAR ACCIDENTES, PORQUE EL HIDRÓGENO DESPRENDIDO FORMA UNA MEZCLA DETONANTE CON EL OXÍGENO DEL AIRE 3. Registrar los siguientes datos: a. El volumen de gas obtenido. b. La temperatura del agua del vaso. c. La altura de la columna de agua. d. El valor de la presión atmosférica. 4. Buscar en tablas: a. La presión de vapor de agua a la temperatura del experimento. b. La densidad del hidrógeno en CNPT. 5. Indicaciones para el informe: a. Ecuación balanceada que interpreta la reacción. b. Tabla de datos: Masa de Mg utilizada. Volumen de gas liberado. Altura de la columna de agua en "milímetros de agua". Temperaturas del agua y del gas. Presión de vapor del agua a la temperatura del experimento. Presión atmosférica. c. Cálculos: 1) Calcular el número de moles de Mg consumidos durante el experimento: n = m Mg / M Mg Mr Mg = 24 g/mol 2) Suponiendo que la pureza del Mg es del 100% y que la reacción ocurre con un 100% de rendimiento, calcular la masa de hidrógeno producida: m = n hidógeno. M hidrógeno 3) Hallar la presión del gas en el recipiente corrigiendo por la altura de la columna de agua y por la presión de vapor del agua: Logrado el equilibrio dentro y fuera de la probeta, se cumple:
3 P atm. = P hidrógeno + P vapor de agua + P columna de agua La presión de la columna de agua en milímetros de mercurio es igual a: P (mm Hg) = h (mm H 2 O) [δ agua / δ Hg ] δ = 13,6 g/cm 3 Hg 4) Calcular la densidad experimental del hidrógeno en las condiciones de trabajo: δ Hidrógeno = masa / volumen 5) Calcular la densidad del hidrógeno con la ecuación de los gases ideales, en las condiciones de trabajo. 6) Buscar el valor de literatura de la densidad del hidrógeno en las condiciones de trabajo. 7) Comparar los tres valores. d. Resultados: Presión del hidrógeno. Volumen del hidrógeno en CNPT. Número de moles de Mg. Número de moles de H. 2 Masa de H. 2 Densidad del H en CNPT (experimental). 2 Densidad ideal del H. 2 Densidad del H en CNPT (tablas). 2 b) Determinación de la densidad de sólidos. Se usará para estas determinaciones un picnómetro para sólidos. Se pesa el picnómetro completamente lleno con un solvente en el cual el sólido (cuya densidad se quiere determinar) no sea soluble (ej. tolueno). Se pesa alrededor de 0,5 g exactamente pesados de cloruro de sodio y se agrega al picnómetro que contiene el solvente. Durante este agregado, se desplazará una cierta cantidad de solvente. El picnómetro se seca bien y se vuelve a pesar. En todos los casos el picnómetro debe termostatizarse antes de proceder a las pesadas. La densidad del sólido se calcula según la siguiente ecuación: δ = + δ Donde, C = masa de muestra sólida A = masa del picnómetro lleno de solvente B = masa del picnómetro con muestra sólida y solvente δ sólido (t) y δ sv (t): densidades del sólido y del solvente respectivamente a la temperatura de termostatización t. Discutir los resultados obtenidos y obtener el valor de la arista de la celda unidad cristalográfica.
4 Cuestionario: 1. Cuántos moles de HCl hay en los 20 cm 3 de solución? 2. Cuántos moles de HCl reaccionan si se consumen 60 mg de Mg? 3. Por qué los cálculos se hacen con la masa de Mg utilizada? 4. Qué se entiende por reactivo limitante? 5. Cuál es el reactivo limitante en el experimento? Por qué? 6. Mencione posibles causas de error en las determinaciones realizadas en el experimento. 7. Se obtiene oxígeno según: 2 KClO 3 2 KCl + 3 O 2 Se emplean 0,2 g de KClO 3 y se recogen, por desalojo de agua, 57 cm 3 de O 2 a 25ºC. Calcular la densidad del oxígeno. Datos: P vapor de agua a 25ªC =23,756 mmhg. P atmosférica = 784 mm Hg 8. Deducir la ecuación usada para determinar la densidad de los sólidos. 9. Discutir la importancia de la termostatización en la determinación de la densidad. 10. Cómo se relaciona la densidad de un sólido cristalino con la arista de la celda unidad? Comisión Nº: Integrantes: Fecha: a) Determinación de la densidad de hidrógeno INFORME TRABAJO PRÁCTICO N o 2 DETERMINACION DE DENSIDADES Rta: 1,4 g/dm 3. Objetivos:... Reacción en estudio: Esquema simple del equipo utilizado:
5 Observaciones:... Tabla de datos experimentales: Masa Mg + Masa Vidrio Reloj (m 1 ± Δm 1 ) / g Masa Vidrio Reloj (m 2 ± Δm 2 ) / g Altura de la columna de agua (h ± Δh) / mm Volumen de H 2 O desplazada (V ± ΔV) / l Temperatura ambiente (T ± ΔT) / C Presión barométrica / hpa Presión de vapor de H 2 O a la temperatura de trabajo* / Pa... Adjuntar un apéndice con los cálculos realizados incluyendo el cálculo de las incertezas. b) Densidad de hidrógeno en CNPT. Resultados Número de moles de Mg Volumen de H 2 en CNPT (V 0 ), experimental /L Densidad de H 2 en CNPT (δ 0 ), valor experimental /g.cm -3 Densidad de H 2 en CNPT, valor tabulado* / g.cm -3 Densidad de H 2 en CNPT, valor ideal / g.cm -3 Adjuntar un apéndice con los cálculos realizados incluyendo el cálculo de las incertezas. c) Determinación de la densidad de sólidos. Tabla de datos experimentales: Masa Muestra Sólida (C± ΔC) / g Masa Picnómetro + Solvente (A ± ΔA) / g Masa Picnómetro + Sólido + Solvente (B ± ΔB) / g Temperatura ambiente (T ± ΔT) / C δ solvente a T*/ g.cm -3 d) Densidad del sólido a T. Resultados δ NaCl a T, valor experimental/ g.cm -3 δ NaCl a T, valor taulado*/ g.cm -3 Adjuntar un apéndice con los cálculos realizados incluyendo el cálculo de las incertezas.
6 e) Cálculo de la constante de celda del NaCl. Esquema simple de la celda unidad del NaCl: f) Derivación de la ecuación que relaciona la densidad del NaCl con la constante de celda: Constante de celda del NaCl, valor experimental/ Å Constante de celda del NaCl, valor, valor taulado*/ Å Conclusiones:...
QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
H2SO4 (aq)+ NaOH (aq) Na2SO4 (aq)+ H2O (líq)
 1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar:
 1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
ESTEQUIOMETRIA Y GASES
 QUÍMICA GENERAL -1º año de Ingeniería Química UTN FRRo Pág 1 de 5 Unidades de presión atmosférica ESTEQUIOMETRIA Y GASES Patm = densidad Hg x altura de columna de mercurio = dhg x hhg = = 13,6 g / cm 3
QUÍMICA GENERAL -1º año de Ingeniería Química UTN FRRo Pág 1 de 5 Unidades de presión atmosférica ESTEQUIOMETRIA Y GASES Patm = densidad Hg x altura de columna de mercurio = dhg x hhg = = 13,6 g / cm 3
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría
 1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
Determinación de la Masa Molar del Magnesio
 Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando
Determinación de la Masa Molar del Magnesio Introducción teórica Como en muchas reacciones químicas, los reactivos o sus productos o ambos son gases, es más común medir éstos en función del volumen usando
GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA. 1. Igualar las siguientes ecuaciones mediante el método algebraico.
 1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas. Química General para Ingenieros: QUIM 2115
 UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Química General para Ingenieros: QUIM 115 Experimento No. : ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Química General para Ingenieros: QUIM 115 Experimento No. : ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO
Estequiometría. En química, la estequiometría (del griego "στοιχειον"
 Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
PRÁCTICA 16 ESTEQUIOMETRÍA DE LAS REACCIONES QUÍMICAS 1.- FUNDAMENTO TEÓRICO.
 PRÁCTICA 16 ESTEQUIOMETRÍA DE LAS REACCIONES QUÍMICAS 1.- FUNDAMENTO TEÓRICO. En esta práctica se dirigirá la atención hacia el concepto de reacción química. Toda reacción es una transformación de la materia
PRÁCTICA 16 ESTEQUIOMETRÍA DE LAS REACCIONES QUÍMICAS 1.- FUNDAMENTO TEÓRICO. En esta práctica se dirigirá la atención hacia el concepto de reacción química. Toda reacción es una transformación de la materia
DEPARTAMENTO DE ELECTRÓNICA Y AUTOMÁTICA
 DEPARTAMENTO DE ELECTRÓNICA Y AUTOMÁTICA FACULTAD DE INGENIERÍA UNIVERSIDAD NACIONAL DE SAN JUAN Informe de Practica Laboratorio Nº 03 OBTENCIÓN DE HIDRÓGENO Asignatura: Química 1 Bioingeniería Autores
DEPARTAMENTO DE ELECTRÓNICA Y AUTOMÁTICA FACULTAD DE INGENIERÍA UNIVERSIDAD NACIONAL DE SAN JUAN Informe de Practica Laboratorio Nº 03 OBTENCIÓN DE HIDRÓGENO Asignatura: Química 1 Bioingeniería Autores
Calor de Reacción. Departamento de Química. Facultad de Ciencias. Universidad de Los Andes. Mérida. Venezuela
 Calor de Reacción Objetivos 1. Estudiar el calor de reacción de tres tipos de reacciones: Hidratación de un ácido. Disolución de una sal. Neutralización de un ácido 2. Determinar el calor involucrado en
Calor de Reacción Objetivos 1. Estudiar el calor de reacción de tres tipos de reacciones: Hidratación de un ácido. Disolución de una sal. Neutralización de un ácido 2. Determinar el calor involucrado en
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos
 1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
Resolución de Cuestiones
 La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
Descripción de los 3 estados de la materia. Química General II Estado Gaseoso
 Descripción de los 3 estados de la materia Química General II Estado Gaseoso Clasificación de los Estados de la Materia. Gases Líquidos Sólidos 1. Carecen de forma definida, llenan completamente el recipiente.
Descripción de los 3 estados de la materia Química General II Estado Gaseoso Clasificación de los Estados de la Materia. Gases Líquidos Sólidos 1. Carecen de forma definida, llenan completamente el recipiente.
8/6/2014. Objetivos. Propiedad física. Marco teórico. Densidad de sólidos y tratamiento estadístico de los datos experimentales
 8/6/0 Densidad de sólidos y tratamiento estadístico de los datos experimentales Ileana Nieves Martínez QUIM 00 Obetivos Determinar la densidad de algunos sólidos usando diferentes métodos para: discernir
8/6/0 Densidad de sólidos y tratamiento estadístico de los datos experimentales Ileana Nieves Martínez QUIM 00 Obetivos Determinar la densidad de algunos sólidos usando diferentes métodos para: discernir
Termoquímica Calor de Neutralización
 LABORATORIO DE FISICOQUÍMICA QMC-313 Termoquímica Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 23/05/2014 Página 2 de 6 Termoquímica Tabla de contenido 1. FUNDAMENTO... 3 2. INSTRUMENTOS
LABORATORIO DE FISICOQUÍMICA QMC-313 Termoquímica Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 23/05/2014 Página 2 de 6 Termoquímica Tabla de contenido 1. FUNDAMENTO... 3 2. INSTRUMENTOS
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
FUNDAMENTOS FÍSICOS DE LA INGENIERÍA CUARTA SESIÓN DE PRÁCTICAS
 DEPARTAMENTO DE FÍSICA APLICADA ESCUELA TÉCNICA SUPERIOR DE INGENIEROS AGRÓNOMOS Y DE MONTES UNIVERSIDAD DE CÓRDOBA FUNDAMENTOS FÍSICOS DE LA INGENIERÍA CUARTA SESIÓN DE PRÁCTICAS 6.- Principio de Arquímedes.
DEPARTAMENTO DE FÍSICA APLICADA ESCUELA TÉCNICA SUPERIOR DE INGENIEROS AGRÓNOMOS Y DE MONTES UNIVERSIDAD DE CÓRDOBA FUNDAMENTOS FÍSICOS DE LA INGENIERÍA CUARTA SESIÓN DE PRÁCTICAS 6.- Principio de Arquímedes.
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN
 UNIVERSIDAD DEL CAUCA FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química Básica Práctica: DETERMINACIÓN DEL VOLUMEN
UNIVERSIDAD DEL CAUCA FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química Básica Práctica: DETERMINACIÓN DEL VOLUMEN
ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD
 Práctico 2 Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten;
Práctico 2 Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten;
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA
 TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
1010 DEPARTAMENTO DE FÍSICA Y QUÍMICA 2º Bachillerato QUÍMICA
 1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
PRÁCTICA 4: DETERMINACIÓN DE LA CONSTANTE UNIVERSAL DE LOS GASES
 PRÁCTICA 4: DETERMINACIÓN DE LA CONSTANTE UNIVERSAL DE LOS GASES Prof. Elizabeth K. Galván Miranda Prof. Ximena Villegas Pañeda Facultad de Química, UNAM Departamento de Fisicoquímica Laboratorio de Termodinámica
PRÁCTICA 4: DETERMINACIÓN DE LA CONSTANTE UNIVERSAL DE LOS GASES Prof. Elizabeth K. Galván Miranda Prof. Ximena Villegas Pañeda Facultad de Química, UNAM Departamento de Fisicoquímica Laboratorio de Termodinámica
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
Química 2º Bacharelato
 Química 2º Bacharelato DEPARTAMENTO DE FÍSICA E QUÍMICA Termodinámica química 13/12/07 Nombre: Problemas 1. a) Calcula qué calor se desprende en la combustión de 20,0 cm 3 de etanol líquido a presión atmosférica
Química 2º Bacharelato DEPARTAMENTO DE FÍSICA E QUÍMICA Termodinámica química 13/12/07 Nombre: Problemas 1. a) Calcula qué calor se desprende en la combustión de 20,0 cm 3 de etanol líquido a presión atmosférica
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez DEYMER GÓMEZ CORREA: 1 042 091 432
 UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: ESTEQUIOMETRÍA 2: RELACIÓN MASA- Fecha: 16/Febrero/2010 MASA. DEYMER GÓMEZ CORREA:
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: ESTEQUIOMETRÍA 2: RELACIÓN MASA- Fecha: 16/Febrero/2010 MASA. DEYMER GÓMEZ CORREA:
8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO
 8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO OBJETIVO El objetivo de la práctica es determinar la densidad de un sólido. Para ello vamos a utilizar dos métodos: Método 1 : Cálculo de la densidad de un
8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO OBJETIVO El objetivo de la práctica es determinar la densidad de un sólido. Para ello vamos a utilizar dos métodos: Método 1 : Cálculo de la densidad de un
Soportará el tanque la presión ejercida por el gas? =
 27ª OLIMPÍADA ARGENTINA DE QUÍMICA 18 DE SEPTIEMBRE DE 2017 CERTAMEN ZONAL NIVEL INICIAL (Utiliza solamente la tabla periódica suministrada por los docentes para resolver el examen) Datos útiles: Número
27ª OLIMPÍADA ARGENTINA DE QUÍMICA 18 DE SEPTIEMBRE DE 2017 CERTAMEN ZONAL NIVEL INICIAL (Utiliza solamente la tabla periódica suministrada por los docentes para resolver el examen) Datos útiles: Número
HOJA Nº 6. REACCIONES QUÍMICAS (II)
 HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
Ley de Boyle P 1/V (T y n constante) Ley de Charles Gay-Lussac V T (P y n constante) Ley de Amonton P T (V y n constante)
 Práctica 6 Ecuación de los Gases Ideales 6.1 Objetivo El estado de un gas puede describirse en términos de cuatro variables (denominadas variables de estado): presión (P), volumen (V), temperatura (T)
Práctica 6 Ecuación de los Gases Ideales 6.1 Objetivo El estado de un gas puede describirse en términos de cuatro variables (denominadas variables de estado): presión (P), volumen (V), temperatura (T)
Formas de expresar la concentración de disoluciones. Química General II 2011
 Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
UNIDADES DE CONCENTRACIÓN
 Colegio San Esteban Diácono Departamento de Ciencias Química IIº Medio Prof. Juan Pastrián / Sofía Ponce de León UNIDADES DE CONCENTRACIÓN 1. Porcentaje masa/masa (%m/m) Cantidad en masa (g) de un componente
Colegio San Esteban Diácono Departamento de Ciencias Química IIº Medio Prof. Juan Pastrián / Sofía Ponce de León UNIDADES DE CONCENTRACIÓN 1. Porcentaje masa/masa (%m/m) Cantidad en masa (g) de un componente
Reactivos limitantes UNIDAD 3: ESTEQUIOMETRÍA
 Reactivos limitantes En muchos procesos industriales la cantidad de productos que se obtenga dependerá de la cantidad de materias iniciales con las que se cuente. Por ejemplo, si deseas fabricar bicicletas,
Reactivos limitantes En muchos procesos industriales la cantidad de productos que se obtenga dependerá de la cantidad de materias iniciales con las que se cuente. Por ejemplo, si deseas fabricar bicicletas,
ρ 20º/20º = ρ a /ρ ref (I)
 Práctica N 1 Determinación de Densidad en los Alimentos Objetivos Determinar la densidad de diferentes muestras de alimentos utilizando el picnómetro. Determinar la densidad de diferentes muestras de alimentos
Práctica N 1 Determinación de Densidad en los Alimentos Objetivos Determinar la densidad de diferentes muestras de alimentos utilizando el picnómetro. Determinar la densidad de diferentes muestras de alimentos
EJERCICIOS DE EQUILIBRIO QUÍMICO.
 EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
PAAU (LOXSE) Setembro 2007
 PAAU (LOXSE) Setembro 27 Código: 3 QUÍMICA CALIICACIÓN: CUESTIONES =2 PUNTOS CADA UNA; PROBLEMAS: 2 PUNTOS CADA UNO; PRÁCTICA: 2 PUNTOS CUESTIONES (Responda SOLAMENTE a DOS de las siguientes cuestiones).
PAAU (LOXSE) Setembro 27 Código: 3 QUÍMICA CALIICACIÓN: CUESTIONES =2 PUNTOS CADA UNA; PROBLEMAS: 2 PUNTOS CADA UNO; PRÁCTICA: 2 PUNTOS CUESTIONES (Responda SOLAMENTE a DOS de las siguientes cuestiones).
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
PROPIEDADES DE LOS FLUIDOS
 PROPIEDADES DE LOS FLUIDOS CRUDO Objetivo: Determinar las propiedades importantes del Crudo, tales como la Densidad, Gravedad API, Viscosidad Cinemática y Viscosidad Dinámica; utilizando diferentes métodos.
PROPIEDADES DE LOS FLUIDOS CRUDO Objetivo: Determinar las propiedades importantes del Crudo, tales como la Densidad, Gravedad API, Viscosidad Cinemática y Viscosidad Dinámica; utilizando diferentes métodos.
UNIDAD: 7 ESTEQUIOMETRÍA
 UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES
 TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
Tema 0. Conceptos Básicos en Química. Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones
 Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
Interacción aire - agua. Termómetro húmedo
 Interacción aire - agua. Termómetro húmedo Objetivos de la práctica! Obtener experimentalmente la denominada temperatura húmeda.! Estudiar las magnitudes psicrométricas de dos corrientes de aire húmedo,
Interacción aire - agua. Termómetro húmedo Objetivos de la práctica! Obtener experimentalmente la denominada temperatura húmeda.! Estudiar las magnitudes psicrométricas de dos corrientes de aire húmedo,
ESTEQUIOMETRÍA (1) Yr 13
 1. Tenemos 50 g de tricloruro de aluminio, AlCl 3. Calcule en esta cantidad de compuesto: a) El número de moles de aluminio. b) El número de moléculas de tricloruro de aluminio. c) El número de átomos
1. Tenemos 50 g de tricloruro de aluminio, AlCl 3. Calcule en esta cantidad de compuesto: a) El número de moles de aluminio. b) El número de moléculas de tricloruro de aluminio. c) El número de átomos
FUERZAS EN LOS FLUIDOS
 FUERZAS EN LOS FLUIDOS 1.- Calcula la presión ejercida sobre la mesa por un bloque de 10 kg que apoya sobre una superficie de 60cm 2. 2.- Una botella cilíndrica de 18 cm de altura y 4 cm de radio está
FUERZAS EN LOS FLUIDOS 1.- Calcula la presión ejercida sobre la mesa por un bloque de 10 kg que apoya sobre una superficie de 60cm 2. 2.- Una botella cilíndrica de 18 cm de altura y 4 cm de radio está
SOLUCIONES. Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva Santiago (Concepción)
 SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas
 UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Experimento No. 5: ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO Laboratorio QUIM 1111 Objetivos experimentales
UNIVERSIDAD INTERAMERICANA Recinto de Bayamón Departamento de Ciencias Naturales y Matemáticas Experimento No. 5: ESTEQUIOMETRIA DE UNA REACCION EN MEDIO ACUOSO Laboratorio QUIM 1111 Objetivos experimentales
Leyes de los gases ideales
 QUIMICA GENERAL 1 Leyes de los gases ideales La mayoría de las sustancias pueden existir en los tres estados de la materia, dependiendo el estado del sistema de la presión y de la temperatura. En muchos
QUIMICA GENERAL 1 Leyes de los gases ideales La mayoría de las sustancias pueden existir en los tres estados de la materia, dependiendo el estado del sistema de la presión y de la temperatura. En muchos
Fundamentos Físicos de la Ingeniería (Ingeniería Industrial) Prácticas de Laboratorio Curso 2008-09
 Fundamentos Físicos de la Ingeniería Práctica 2: Estudio experimental de los gases ideales Objeto de la práctica El objetivo específico es estudiar el comportamiento experimental de los gases. Se supondrá
Fundamentos Físicos de la Ingeniería Práctica 2: Estudio experimental de los gases ideales Objeto de la práctica El objetivo específico es estudiar el comportamiento experimental de los gases. Se supondrá
Relaciones Ponderales en las Reacciones I
 Facultad de Química Cátedra de Química Inorgánica DEPARTAMENTO ESTRELLA CAMPOS QUÍMICA GENERAL II 2006 Semana 2 Relaciones Ponderales en las Reacciones I Bibliografía: - Química, La Ciencia Central, T.L.Brown,
Facultad de Química Cátedra de Química Inorgánica DEPARTAMENTO ESTRELLA CAMPOS QUÍMICA GENERAL II 2006 Semana 2 Relaciones Ponderales en las Reacciones I Bibliografía: - Química, La Ciencia Central, T.L.Brown,
2 o Bach. QUÍMICA - Seminario ESTEQUIOMETRÍA. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 % de F.
 ESTEQUIOMETRÍA 1. Calcula la densidad del butano (C 4 H 10 ) a una temperatura de 10 o C y una presión de 700 mmhg. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 %
ESTEQUIOMETRÍA 1. Calcula la densidad del butano (C 4 H 10 ) a una temperatura de 10 o C y una presión de 700 mmhg. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 %
RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I)
 RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I) 1. Es un problema de estequiometría básico. Sustancia dato: CO 2. Sustancia problema: C 2 H 2 Reacción ajustada: C 2 H 2 + 1/2O 2 2CO 2 + H 2 O a) Calculo
RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I) 1. Es un problema de estequiometría básico. Sustancia dato: CO 2. Sustancia problema: C 2 H 2 Reacción ajustada: C 2 H 2 + 1/2O 2 2CO 2 + H 2 O a) Calculo
Práctica No 2. Determinación experimental del factor de compresibilidad
 Práctica No 2 Determinación experimental del factor de compresibilidad 1. Objetivo general: Determinación del comportamiento de un gas a diferentes presiones, mediante el cálculo experimental del factor
Práctica No 2 Determinación experimental del factor de compresibilidad 1. Objetivo general: Determinación del comportamiento de un gas a diferentes presiones, mediante el cálculo experimental del factor
LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES
 LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES I.- INTRODUCCIÓN A) Soluciones La materia puede presentarse en forma de mezclas o sustancias puras. Cuando una mezcla tiene una composición uniforme, en cualquier
LABORATORIO N 2 PREPARACIÓN DE SOLUCIONES I.- INTRODUCCIÓN A) Soluciones La materia puede presentarse en forma de mezclas o sustancias puras. Cuando una mezcla tiene una composición uniforme, en cualquier
CaCl 2(ac) + K 2 CO 3(ac) CaCO KCl (ac)
 Equipo: Nombre: Nombre: Nombre: Práctica 5. Reactivo Limitante Problema Qué especie actúa como reactivo limitante en la siguiente reacción química? CaCl 2(ac) + K 2 CO 3(ac) CaCO 3 + 2 KCl (ac) Tarea previa.
Equipo: Nombre: Nombre: Nombre: Práctica 5. Reactivo Limitante Problema Qué especie actúa como reactivo limitante en la siguiente reacción química? CaCl 2(ac) + K 2 CO 3(ac) CaCO 3 + 2 KCl (ac) Tarea previa.
TEMA 2: La Estructura de los sólidos cristalinos
 TEMA 2: La Estructura de los sólidos cristalinos 1. La plata solidifica en una estructura cúbica centrada en las caras (fcc). La masa atómica de la plata es 107.8682 y la longitud de la celda unidad, esto
TEMA 2: La Estructura de los sólidos cristalinos 1. La plata solidifica en una estructura cúbica centrada en las caras (fcc). La masa atómica de la plata es 107.8682 y la longitud de la celda unidad, esto
QUÍMICA 2º BACHILLERATO
 1.-/ El oxígeno se prepara por calentamiento del clorato de potasio según la reacción (sin ajustar): calor KClO 3 KCl + O 2 a) Qué masa de oxígeno se obtiene a partir de 3 g de clorato de potasio?. b)
1.-/ El oxígeno se prepara por calentamiento del clorato de potasio según la reacción (sin ajustar): calor KClO 3 KCl + O 2 a) Qué masa de oxígeno se obtiene a partir de 3 g de clorato de potasio?. b)
TRABAJO PRÁCTICO Nº 4
 TRABAJO PRÁCTICO Nº 4 CINÉTICA QUÍMICA OBJETIVOS: Observar el efecto de la temperatura y la concentración de reactivo en la velocidad de las reacciones químicas. Interpretar estos cambios a partir de la
TRABAJO PRÁCTICO Nº 4 CINÉTICA QUÍMICA OBJETIVOS: Observar el efecto de la temperatura y la concentración de reactivo en la velocidad de las reacciones químicas. Interpretar estos cambios a partir de la
Práctica 6. Reactivo Limitante. NOTA: Para esta práctica deberás llevar al laboratorio una regla con graduación en milímetros
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II 1 Nombre: Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Problema Práctica 6. Reactivo Limitante Qué especie
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II 1 Nombre: Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Problema Práctica 6. Reactivo Limitante Qué especie
Problemas de Química (1ero Grado de Química). Tema 1.
 Problemas de Química (1ero Grado de Química). Tema 1. CÁLCULOS BÁSICOS 1. Expresa en notación científica, indicando en cada caso el número de cifras significativas: a) 258292 b) 1804, 5289 c) 0, 48 d)
Problemas de Química (1ero Grado de Química). Tema 1. CÁLCULOS BÁSICOS 1. Expresa en notación científica, indicando en cada caso el número de cifras significativas: a) 258292 b) 1804, 5289 c) 0, 48 d)
ESPOL / ICQA / 3era EVALUACIÓN QUÍMICA GENERAL I
 ESPOL / ICQA / 3era EVALUACIÓN QUÍMICA GENERAL I NOMBRES APELLIDOS No. en LISTA PARALELO NOTA: PARA ESTA EVALUACIÓN EL SIGNO COMA (,) SE TOMARÁ PARA REPRESENTAR MILES, EJEMPLO: 10 +3 = 1,000. EL PUNTO
ESPOL / ICQA / 3era EVALUACIÓN QUÍMICA GENERAL I NOMBRES APELLIDOS No. en LISTA PARALELO NOTA: PARA ESTA EVALUACIÓN EL SIGNO COMA (,) SE TOMARÁ PARA REPRESENTAR MILES, EJEMPLO: 10 +3 = 1,000. EL PUNTO
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación.
 PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
PRÁCTICA Nº 2 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de una muestra problema. Realizar la destilación
Ejercicios Estequiometria
 Ejercicios Estequiometria 1. Se hacen reaccionar 22,75 g de Zn que contiene un 7,25 % de impurezas con exceso de HCl. Calcula la masa de H 2 desprendida. HCl + Zn ZnCl 2 + H 2 2. Se calcinan en un horno
Ejercicios Estequiometria 1. Se hacen reaccionar 22,75 g de Zn que contiene un 7,25 % de impurezas con exceso de HCl. Calcula la masa de H 2 desprendida. HCl + Zn ZnCl 2 + H 2 2. Se calcinan en un horno
FACULTAD DE INGENIERIA LABORATORIO DE QUIMICA TEMA: VOLUMENES. Belkis saumeth lopez cod: 2010217066. Faviel Miranda Lobo cod: 2011111006
 FACULTAD DE INGENIERIA LABORATORIO DE QUIMICA TEMA: VOLUMENES Belkis saumeth lopez cod: 2010217066 Faviel Miranda Lobo cod: 2011111006 Roberto Carlos Correa 2010213015 Victor andres castrillon martinez
FACULTAD DE INGENIERIA LABORATORIO DE QUIMICA TEMA: VOLUMENES Belkis saumeth lopez cod: 2010217066 Faviel Miranda Lobo cod: 2011111006 Roberto Carlos Correa 2010213015 Victor andres castrillon martinez
Determinación de la constante de los gases ideales
 Prácticas de Química. Determinación de la constante de los gases ideales I. Introducción teórica y objetivos........................................ 2 II. Material................................................................
Prácticas de Química. Determinación de la constante de los gases ideales I. Introducción teórica y objetivos........................................ 2 II. Material................................................................
B. Cuál es su número atómico y másico? Di cuántos protones y neutrones hay en el núcleo y electrones en la corteza.
 Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
Tema 2. Estequiometría
 Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
UNIVERSIDAD NACIONAL SANTIAGO ANTÚNEZ DE MAYOLO
 UNIVERSIDAD NACIONAL SANTIAGO ANTÚNEZ DE MAYOLO DEPARTAMENTO ACADÉMICO CIENCIAS M. RAMÍREZ G. 1 Dr. Miguel RAMÍREZ GUZMÁN Teoría Cinética Molecular Ofrece un modelo para explicar las propiedades de los
UNIVERSIDAD NACIONAL SANTIAGO ANTÚNEZ DE MAYOLO DEPARTAMENTO ACADÉMICO CIENCIAS M. RAMÍREZ G. 1 Dr. Miguel RAMÍREZ GUZMÁN Teoría Cinética Molecular Ofrece un modelo para explicar las propiedades de los
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
EJERCICIOS BÁSICOS DE EMPUJE
 EJERCICIOS BÁSICOS DE EMPUJE 1.- Un trozo de corcho de 40 cm ³ se coloca en éter (δ = 0,72 g/cm ³), si la densidad del corcho es de 0,24 g/cm ³, qué volumen queda sumergido?. Respuesta: 13,3 cm ³ 2) Se
EJERCICIOS BÁSICOS DE EMPUJE 1.- Un trozo de corcho de 40 cm ³ se coloca en éter (δ = 0,72 g/cm ³), si la densidad del corcho es de 0,24 g/cm ³, qué volumen queda sumergido?. Respuesta: 13,3 cm ³ 2) Se
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA
 ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
GUÍA N 1: Unidades de medida y Leyes Ponderales. 1.- Convierta las siguientes unidades de temperatura en C, F y K según corresponda:
 1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
PRUEBA ESPECÍFICA PRUEBA 2015
 PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 2015 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada
PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 2015 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]
![Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]](/thumbs/40/20756584.jpg) Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
PRÁCTICA N 7. Determinar el peso equivalente experimental en los procesos en que intervienen reacciones químicas redox.
 PRÁCTICA N 7 DETERMINACION EXPERIMENTAL DEL PESO EQUIVALENTE DEL MAGNESIO I. OBJETIVO GENERAL Determinar el peso equivalente experimental en los procesos en que intervienen reacciones químicas redox. II.
PRÁCTICA N 7 DETERMINACION EXPERIMENTAL DEL PESO EQUIVALENTE DEL MAGNESIO I. OBJETIVO GENERAL Determinar el peso equivalente experimental en los procesos en que intervienen reacciones químicas redox. II.
GASES Y ESTEQUIOMETRIA
 Universidad Católica del Norte Departamento de Química ractica Nº 4 GASES Y ESTEQUIOMETRIA Recolección de gas en agua Objetivos 1. Aprender a realizar un montaje para el análisis de un sistema en equilibrio.
Universidad Católica del Norte Departamento de Química ractica Nº 4 GASES Y ESTEQUIOMETRIA Recolección de gas en agua Objetivos 1. Aprender a realizar un montaje para el análisis de un sistema en equilibrio.
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez
 UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: Determinación de Densidades. Fecha: 24 de noviembre de 2009 DEYMER GÓMEZ CORREA:
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA LABORATORIO DE QUÍMICA GENERAL Profesor: Jaime O. Pérez Práctica: Determinación de Densidades. Fecha: 24 de noviembre de 2009 DEYMER GÓMEZ CORREA:
GUÍA DE TRABAJOS PRÁCTICOS DE AULA Nº6
 Departamento de Electrónica y Automática Facultad de Ingeniería Universidad Nacional de San Juan QUÍMICA GUÍA DE TRABAJOS PRÁCTICOS DE AULA Nº6 ESTEQUIMETRÍA Año 2017 La estequiometría (del griego stoicheion,
Departamento de Electrónica y Automática Facultad de Ingeniería Universidad Nacional de San Juan QUÍMICA GUÍA DE TRABAJOS PRÁCTICOS DE AULA Nº6 ESTEQUIMETRÍA Año 2017 La estequiometría (del griego stoicheion,
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
, que no está formado por moléculas, sino por una red cristalina en la que hay una proporción de dos átomos de flúor por cada átomo de calcio.
 7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
DETERMINACIÓN DE LA LEY EXPERIMENTAL DE RAPIDEZ. ESTUDIO DE LA CINÉTICA DE YODACIÓN DE LA ACETONA. Grupo: Equipo: Fecha: Nombre(s):
 DETERMINACIÓN DE LA LEY EXPERIMENTAL DE RAPIDEZ. ESTUDIO DE LA CINÉTICA DE YODACIÓN DE LA ACETONA. Grupo: Equipo: Fecha: Nombre(s): I. OBJETIVO GENERAL Comprender que la composición de un sistema reaccionante
DETERMINACIÓN DE LA LEY EXPERIMENTAL DE RAPIDEZ. ESTUDIO DE LA CINÉTICA DE YODACIÓN DE LA ACETONA. Grupo: Equipo: Fecha: Nombre(s): I. OBJETIVO GENERAL Comprender que la composición de un sistema reaccionante
(g) CO 2. (g) + 2 H 2. Procediendo en la misma forma con la segunda ecuación, obtenemos: (g) 3 CO 2. (g) + 4 H 2
 Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
QG II Reactivo limitante Página 1
 6. Problema Reactivo limitante Modificaciones realizadas por: QFB Rosario Velázquez Miranda Q. Brenda Lizette Ruiz Herrera Dr. Víctor Manuel Ugalde Saldívar Qué especie actúa como reactivo limitante en
6. Problema Reactivo limitante Modificaciones realizadas por: QFB Rosario Velázquez Miranda Q. Brenda Lizette Ruiz Herrera Dr. Víctor Manuel Ugalde Saldívar Qué especie actúa como reactivo limitante en
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
ECUACIÓN DE ESTADO DE LOS GASES IDEALES
 ECUACIÓN DE ESTADO DE LOS GASES IDEALES Laboratorio de Física 1. OBJETIVO Se estudiará, tomando como ejemplo el aire, el comportamiento de un gas ideal cuando varían sus variables de estado, y se comprobarán
ECUACIÓN DE ESTADO DE LOS GASES IDEALES Laboratorio de Física 1. OBJETIVO Se estudiará, tomando como ejemplo el aire, el comportamiento de un gas ideal cuando varían sus variables de estado, y se comprobarán
CONCENTRACIÓN DE LAS DISOLUCIONES
 CONCENTRACIÓN DE LAS DISOLUCIONES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza
CONCENTRACIÓN DE LAS DISOLUCIONES NOMBRE DEL ALUMNO: PROFESOR: GRUPO: 2. Espacio sugerido: Laboratorio de usos múltiples. 3. Desempeño y habilidades: 4. Marco Teórico: 1. Obtiene, registra y sistematiza
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
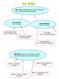 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
ESTEQUIOMETRIA. 11. Se descomponen por el calor 13 gramos de clorato de potasio, según el proceso:
 ESTEQUIOMETRIA 1. Un hidrocarburo gaseoso cuya densidad en condiciones estándar es de 2 21gr/l, produce por combustión de 4 32 gr., la misma cantidad de agua y 14 08 gr. de dióxido de carbono. Calcular
ESTEQUIOMETRIA 1. Un hidrocarburo gaseoso cuya densidad en condiciones estándar es de 2 21gr/l, produce por combustión de 4 32 gr., la misma cantidad de agua y 14 08 gr. de dióxido de carbono. Calcular
NO DESABROCHES EL CUADERNILLO. NO RESUELVAS CON LÁPIZ.
 Datos útiles Número de Avogadro = 6,02 x 10 23 1 atm = 760 mmhg = 1,0131 bar = 1,01 x 10 5 Pa R = 0,082 atm L / K mol T (en C) = T (en K) 273 P V = n R T 1. Una esfera metálica (V = 4/3 π r 3 ) tiene un
Datos útiles Número de Avogadro = 6,02 x 10 23 1 atm = 760 mmhg = 1,0131 bar = 1,01 x 10 5 Pa R = 0,082 atm L / K mol T (en C) = T (en K) 273 P V = n R T 1. Una esfera metálica (V = 4/3 π r 3 ) tiene un
OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución.
 OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución. FUNDAMENTO TEÓRICO Una disolución es una mezcla homogénea
OBJETIVO Aprender a preparar disoluciones de concentración dada, ya que la mayor parte de las reacciones químicas tienen lugar en forma de disolución. FUNDAMENTO TEÓRICO Una disolución es una mezcla homogénea
Guía de repaso 5: Gases-Transformación isotérmica
 Guía de repaso 5: Gases-Transformación isotérmica 1- a) Cuáles son las cantidades que determinan el estado de un gas? b) Qué significa decir que un gas sufrió una transformación? 2- a) Qué son los gases
Guía de repaso 5: Gases-Transformación isotérmica 1- a) Cuáles son las cantidades que determinan el estado de un gas? b) Qué significa decir que un gas sufrió una transformación? 2- a) Qué son los gases
GUÍA DE TRABAJO: MASA Y VOLUMEN
 GUÍA DE TRABAJO: MASA Y VOLUMEN 1 1_ Qué harías para determinar la masa de agua que absorbe un trozo de papel secante? Con una balanza se mide la masa del trozo de papel secante. Se humedece el papel secante
GUÍA DE TRABAJO: MASA Y VOLUMEN 1 1_ Qué harías para determinar la masa de agua que absorbe un trozo de papel secante? Con una balanza se mide la masa del trozo de papel secante. Se humedece el papel secante
Determinación de Calor de Neutralización
 LABORATORIO DE FISICOQUÍMICA QMC-313 Determinación de Calor de Neutralización Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 03/10/2014 Determinación de ácido-base Página 2 de 5 Determinación
LABORATORIO DE FISICOQUÍMICA QMC-313 Determinación de Calor de Neutralización Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 03/10/2014 Determinación de ácido-base Página 2 de 5 Determinación
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II HOJAS DE TRABAJO UNIDAD IV DISOLUCIONES Libros a utilizar:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II HOJAS DE TRABAJO UNIDAD IV DISOLUCIONES Libros a utilizar:
