QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
|
|
|
- Alejandro Blázquez Rojas
- hace 7 años
- Vistas:
Transcripción
1 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura. Indica razonadamente: a) Cuál contiene mayor número de moléculas? b) Cuál contiene mayor número de átomos? Ejercicio nº 2 Tenemos la siguiente reacción: 2 HCl + Zn ZnCl 2 + H 2 Si partimos de 100 g de cada uno de los reactivos: a) Qué masa de hidrógeno podemos obtener? b) Cuántos átomos de hidrógeno corresponden a dicha masa? y N A Ejercicio nº 3 Ordenar razonadamente de mayor a menor número de átomos, las cantidades siguientes: a) 10 g de cloruro de plata. b) moléculas de dióxido de azufre. c) 4 moles de monóxido de carbono. y N A Ejercicio nº 4 Ordenar razonadamente de mayor a menor número de átomos, las cantidades siguientes: a) 5 g de cloruro de bario. b) moléculas de dióxido de nitrógeno. c) 2 moles de ácido clorhídrico. y N A Ejercicio nº 5 Se dispone de dos recipientes que contienen 1 litro de propano gaseoso, y dos litros de hexano gaseoso respectivamente, en las mismas condiciones de presión y temperatura. Indica razonadamente: a) Cuál contiene mayor número de moléculas? b) Cuál contiene mayor número de átomos? Ejercicio nº 6 Ordenar razonadamente de mayor a menor número de átomos, las cantidades siguientes: a) 7 g de fluoruro de sodio. b) moléculas de dióxido de carbono c) 2 moles de cloruro de plata. y N A
2 2(8) Ejercicio nº 7 La soldadura aluminotérmica se basa en el calor generado en la reacción: 2 Al + Fe 2 O 3 Al 2 O Fe Si partimos de 100 g de cada uno de los reactivos: a) Qué masa de hierro podemos obtener? b) Cuántos átomos de hierro corresponden a dicha masa? y N A Ejercicio nº 8 El clorato de potasio (KClO 3 ) se descompone a alta temperatura para dar cloruro de potasio y oxígeno molecular. a) Escribe y ajusta la reacción. b) Qué cantidad de clorato de potasio puro debe descomponerse para obtener 5 L de oxígeno medidos a 20 ºC y 2 atm de presión? c) Qué cantidad de cloruro de potasio se obtendrá al descomponer 60 g de clorato de potasio del 83 % de pureza? Ejercicio nº 9 El yodato de potasio (KIO 3 ) se descompone a alta temperatura para dar yoduro de potasio y oxígeno molecular. a) Escribe y ajusta la reacción. b) Qué cantidad de yodato de potasio puro debe descomponerse para obtener 3 L de oxígeno medidos a 22 ºC y 1 atm de presión? c) Qué cantidad de yoduro de potasio se obtendrá al descomponer 35 g de yodato de potasio del 85 % de pureza? Ejercicio nº 10 Un comerciante vende botes con 250 g de carbonato de calcio, cuya pureza es del 80%. Se desea conocer: a) Cuántos botes habrían de adquirirse para obtener 650 L de dióxido de carbono medidos a presión normal y a temperatura de 33ºC, sabiendo que del carbonato de calcio por reacción se obtiene dióxido de carbono y cal viva (óxido de calcio)? b) La masa de cal viva que se forma. Ejercicio nº 11 Se dispone de 9,6 litros de propano, medidos en condiciones normales. Si se realiza su combustión completa, calcule: a) Qué volumen de oxígeno será necesario, medido en condiciones normales? b) Qué volumen de aire (cuya composición es 80% de nitrógeno y 20% de oxígeno, en volumen) se necesitará, medido a 20 ºC y 740 mm de Hg?, R y 1 atm = 760 mm de Hg Ejercicio nº 12 Se dispone de 10,4 litros de acetileno (etino), medidos en condiciones normales. Si se
3 3(8) realiza su combustión completa, calcule: a) Qué volumen de oxígeno será necesario, medido en condiciones normales? b) Qué volumen de aire (cuya composición es 80% de nitrógeno y 20% de oxígeno, en volumen) se necesitará, medido a 17 ºC y 700 mm de Hg?, R y 1 atm = 760 mm de Hg Ejercicio nº 13 Se queman 10 g de acetileno (C 2 H 2 ) con 2 litros de oxígeno a la temperatura de 20 ºC y 0,98 atm de presión. Calcula: a) El reactivo limitante. b) Los gramos de dióxido de carbono obtenidos, sabiendo que el rendimiento del proceso ha sido del 90 %. Ejercicio nº 14 A un vaso de precipitados que contiene 7,6 g de aluminio se le añaden 100 ml de un ácido clorhídrico comercial del 36 % y de densidad g/cm 3, obteniéndose tricloruro de aluminio e hidrógeno. Indique después de realizar los cálculos necesarios cuál es el reactivo limitante y calcule qué volumen de hidrógeno se obtiene si las condiciones en las que se realiza el proceso son 25 ºC y 750 mm de Hg., R y 1 atm = 760 mm de Hg Ejercicio nº 15 En la reacción de galio con ácido clorhídrico se obtiene tricloruro de galio y se desprende hidrógeno. Se ponen en un matraz 50 g de galio del 83 % de pureza y se añaden 150 ml de un ácido clorhídrico comercial de densidad 1,1 g/ml y del 52 % de pureza en peso. Con estos datos calcula: a) Cuál es el reactivo limitante. b) El volumen de hidrógeno que se obtendrá a 20 ºC y 700 mm de Hg., R y 1 atm = 760 mm de Hg Ejercicio nº 16 En el proceso de formación del dióxido de carbono a partir de sus elementos: a) Calcula la masa de dióxido de carbono, en gramos, que se forma a partir de 20 g de carbono y 60 de oxígeno. b) Si el dióxido de carbono formado se encuentra a 25 ºC y 1 atm de presión, calcula el volumen que ocupa. Ejercicio nº 17 En el proceso de formación del agua a partir de sus elementos: a) Calcula la masa de agua, en gramos, que se forma a partir de 30 g de hidrógeno y 70 de oxígeno. b) Si el agua formada se encuentra a 20 ºC y 1 atm de presión, calcula el volumen que ocupa.
4 4(8) Ejercicio nº 18 En la reacción de aluminio con ácido clorhídrico se obtiene cloruro de aluminio y se desprende hidrógeno. Se ponen en un matraz 30 g de aluminio del 95 % de pureza y se añaden 100 ml de un ácido clorhídrico comercial de densidad 1,170 g/ml y del 35 % de pureza en peso. Con estos datos calcula: a) Cuál es el reactivo limitante. b) El volumen de hidrógeno que se obtendrá a 25 ºC y 740 mm de Hg., R y 1 atm = 760 mm de Hg Ejercicio nº 19 En una disolución acuosa de hidróxido sódico, cuya densidad es 1,170 g/ml, la fracción molar de soluto es 0,2, calcular su molaridad y porcentaje en peso de soluto. Ejercicio nº 20 El ácido fluorhídrico concentrado, HF, tiene habitualmente una concentración del 49 % en masa y su densidad relativa es de 1,17 g/ml. a) Cuál es la molaridad de la disolución? b) Cuál es la molaridad de la disolución que resulta de mezclar 500 ml de este ácido con 1 litro de ácido fluorhídrico 2 M? Ejercicio nº 21 El ácido clorhídrico concentrado, HCl, tiene habitualmente una concentración del 56 % en masa y su densidad es de 1,07 g/ml. a) Cuál es la molaridad de la disolución? b) Cuál es la molaridad de la disolución que resulta de mezclar 250 ml de este ácido con 1000 ml de ácido clorhídrico 1M? Ejercicio nº 22 Se tiene un litro de una disolución de ácido sulfúrico del 98 % de riqueza y de densidad 1,84 g/ml. Calcular: a) La molaridad b) El volumen de esa disolución de ácido sulfúrico necesario para preparar 100 ml de otra disolución del 20 % y densidad 1,14g/mL. Ejercicio nº 23 Se mezcla 1,5 L de ácido sulfúrico de densidad 1,2 g/ml y 46 % de riqueza en peso con 1 L de ácido sulfúrico de densidad 1,350 g/ml y 57,8 % en peso. Calcule la molaridad de la disolución resultante, admitiendo que los volúmenes son aditivos. Ejercicio nº 24 Se tiene un litro de una disolución de ácido clorhídrico del 86 % de riqueza y de densidad 1,24 g/ml. Calcular:
5 5(8) a) La molaridad b) El volumen de esa disolución de ácido clorhídrico necesario para preparar 150mL de otra disolución del 30 % y densidad 1g/mL. Ejercicio nº 25 Al quemar 24 g de acetileno (C 2 H 2 ), se han obtenido 4,8 L de dióxido de carbono medidos a 1 atm y 23 ºC, cuál ha sido el rendimiento de la reacción? Datos: Masas atómicas y R Ejercicio nº 26 Se quema butano (C 4 H 10 ) a) Cuántos gramos de dióxido de carbono por gramo de butano quemado se obtienen? b) Cuántos moles de oxígeno reaccionan con 1 mol de butano? c) Cuántos litros de dióxido de carbono a la presión de 1 atm y a la temperatura de 25 ºC se obtienen a partir de 1 mol de butano si el rendimiento es del 98 %? Ejercicio nº 27 El carbonato de calcio reacciona con ácido clorhídrico para dar cloruro de calcio, dióxido de carbono y agua. Partimos de 35 g de carbonato de calcio si se han obtenido 6,95 L de dióxido de carbono medidos a 1 atm y 20ºC, cuál ha sido el rendimiento de la reacción? Ejercicio nº 28 Se trata una caliza del 80% en carbonato cálcico con 1 litro de disolución 4 M de ácido clorhídrico: CaCO 3 + 2HCl CaCl 2 + CO 2 + H 2 O Calcula: a) Los gramos de muestra empleados. b) El volumen de dióxido de carbono obtenido a 20 ºC y 0,92 atm. Datos: Masas atómicas y R Ejercicio nº 29 El nitrato de calcio se puede obtener por reacción entre el carbonato de calcio y el ácido nítrico. Si se han añadido 60 gramos de carbonato de calcio a 300 ml de disolución de ácido nítrico 2 M, calcula: a) Los gramos de sal obtenidos. b) El volumen recogido de CO 2 medido en c.n. El rendimiento del proceso es del 95 %. CaCO 3 + 2HNO 3 Ca(NO 3 ) 2 + CO 2 + H 2 O Datos: Masas atómicas y R
6 6(8) Ejercicio nº 30 Se desea preparar un litro de disolución 1 M de ácido sulfúrico a partir de un ácido comercial cuya etiqueta indica 97 6 % de concentración centesimal y 1 85 g/cm 3 de densidad. Determina: a) La molaridad del ácido comercial. b) El volumen de ácido comercial necesario para preparar la disolución pedida. Datos: Masas atómicas Ejercicio nº 31 Determina el grado de pureza de un mármol si al descomponerse 125 g del mismo se desprenden 20 litros de dióxido de carbono medidos a 15 ºC y 1 atm. CaCO 3 CaO + CO 2 Ejercicio nº 32 Al descomponer 3 gramos de carburo de aluminio con agua caliente se recogen 1 25 litros de metano a 25 ºC y 800 mm de Hg. Determina el grado de pureza del carburo de aluminio sabiendo que la reacción producida es: Al 4 C H 2 O 4 Al(OH) CH 4 Ejercicio nº 33 Un trozo de una muestra de 100 gramos que contiene cinc reacciona exactamente con 150 cm 3 de un ácido clorhídrico de densidad 1 19 g/cm 3 y que contiene un % en peso de HCl. Cuál es el porcentaje de cinc en la muestra? Zn + 2HCl ZnCl 2 + H 2 Ejercicio nº 34 Se hacen reaccionar en condiciones normales 100 litros de cloro con hidrógeno suficiente para que reaccione todo el cloro. Qué volumen de ácido clorhídrico al 30 % de 1 18 g/ml de densidad se obtendrá? RESPUESTAS Solución nº 1 a) El segundo recipiente; b) El primer recipiente Solución nº 2 a) 2 7 gramos de hidrógeno; b) átomos Solución nº 3 c, a y b Solución nº 4 c, a y b
7 7(8) Solución nº 5 a) El segundo recipiente; b) El segundo recipiente Solución nº 6 c, a y b Solución nº 7 a) 70 gramos de hierro; b) átomos Solución nº 8 a) 2 KClO 3 2 KCl + 3 O 2 ; b) 34 3 gramos; c) 30 3 gramos Solución nº 9 a) 2 KIO 3 2 KI + 3 O 2 ; b) gramos; c) gramos Solución nº 10 a) 13 botes; b) gramos Solución nº 11 a) 48 litros; b) 265 litros Solución n º12 a) 26 litros; b) 150 litros Solución nº 13 a) O 2 ; b) 2,6 gramos Solución nº 14 El reactivo limitante es el aluminio; 10 4 litros de hidrógeno Solución nº 15 a) El reactivo limitante es el galio; b) litros Solución nº 16 a) 74 8 gramos; b) litros Solución nº 17 a) 79 2 gramos; b) litros Solución nº 18 a) El ácido clorhídrico; b) 14 litros Solución nº M y 35 7 % Solución nº 20 a) 28 7 M; b) 10 9 M
8 8(8) Solución nº 21 a) 16 4 M; b) 4 1 M Solución nº 22 a) 18 4 M; b) 12 5 ml Solución nº M Solución nº 24 a) 29 2 M; b) 42 2 ml Solución nº % Solución nº 26 a) 3 gramos; b) 6 5 moles; c) 95 8 litros Solución nº % Solución nº 28 a) 250 gramos de caliza; b) 52 litros de CO 2 Solución nº 29 a) 93 5 gramos; b) 12 7 litros Solución nº 30 a) 18 4 M; b) 54 3 cm 3 de ácido comercial Solución nº % Solución nº % Solución nº % Solución nº litros
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría
 1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
H2SO4 (aq)+ NaOH (aq) Na2SO4 (aq)+ H2O (líq)
 1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos
 1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
Resolución de Cuestiones
 La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar:
 1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA. 1. Igualar las siguientes ecuaciones mediante el método algebraico.
 1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
2 o Bach. QUÍMICA - Seminario ESTEQUIOMETRÍA. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 % de F.
 ESTEQUIOMETRÍA 1. Calcula la densidad del butano (C 4 H 10 ) a una temperatura de 10 o C y una presión de 700 mmhg. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 %
ESTEQUIOMETRÍA 1. Calcula la densidad del butano (C 4 H 10 ) a una temperatura de 10 o C y una presión de 700 mmhg. 2. La composición centesimal de un compuesto de Criptón es de 68,80 % de Kr y 31,20 %
Física 4º E.S.O. 2014/15
 Física 4º E.S.O. 2014/15 Problemas de Química Ficha número 13 1.- Ajusta las siguientes reacciones químicas: a) Na 2 CO 3 + HCl NaCl + CO 2 + H 2 O (Sol: Na 2 CO 3 + 2 HCl 2 NaCl + CO 2 + H 2 O) b) PBr
Física 4º E.S.O. 2014/15 Problemas de Química Ficha número 13 1.- Ajusta las siguientes reacciones químicas: a) Na 2 CO 3 + HCl NaCl + CO 2 + H 2 O (Sol: Na 2 CO 3 + 2 HCl 2 NaCl + CO 2 + H 2 O) b) PBr
(g) CO 2. (g) + 2 H 2. Procediendo en la misma forma con la segunda ecuación, obtenemos: (g) 3 CO 2. (g) + 4 H 2
 Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
Formas de expresar la concentración de disoluciones. Química General II 2011
 Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Academia Las Rozas
 Ejercicios de estequiometría: 1º El ácido sulfúrico reacciona con el cloruro de sodio produciendo sulfato de sodio y cloruro de hidrógeno gas. Calcula cuántos gramos de cloruro de hidrógeno se pueden obtener
Ejercicios de estequiometría: 1º El ácido sulfúrico reacciona con el cloruro de sodio produciendo sulfato de sodio y cloruro de hidrógeno gas. Calcula cuántos gramos de cloruro de hidrógeno se pueden obtener
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
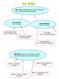 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
REPASO SOBRE CÁLCULOS EN QUÍMICA
 REPASO SOBRE CÁLCULOS EN QUÍMICA 1. LA MEDIDA DE LA MASA EN QUÍMICA. 1.1 La masa de un átomo y de una molécula. Tanto si se trata de elementos químicos como de compuestos, la materia está formada por átomos;
REPASO SOBRE CÁLCULOS EN QUÍMICA 1. LA MEDIDA DE LA MASA EN QUÍMICA. 1.1 La masa de un átomo y de una molécula. Tanto si se trata de elementos químicos como de compuestos, la materia está formada por átomos;
FÍSICA Y QUÍMICA 1º BACHILLERATO
 1º BACHILLERATO CUADERNO PROBLEMAS DE ESTEQUIOMETRÍA DTO. FÍSICA Y QUÍMICA I.E.S. MAESTRO DOMINGO CÁCERES BADAJOZ REACCIONES QUÍMICAS 1. Qué cantidad de oxígeno se precisa para quemar 0,464 kg de butano
1º BACHILLERATO CUADERNO PROBLEMAS DE ESTEQUIOMETRÍA DTO. FÍSICA Y QUÍMICA I.E.S. MAESTRO DOMINGO CÁCERES BADAJOZ REACCIONES QUÍMICAS 1. Qué cantidad de oxígeno se precisa para quemar 0,464 kg de butano
PROBLEMAS DE DISOLUCIONES 1º Bachillerato.-
 1 - Cuántos gramos de ácido nítrico son necesarios para preparar 1,5 litros de disolución acuosa de dicho ácido 0,6 M?. (Solución: 56,7 g) 2 - Una disolución 0,25 m de cloruro de sodio contiene 58,5 g
1 - Cuántos gramos de ácido nítrico son necesarios para preparar 1,5 litros de disolución acuosa de dicho ácido 0,6 M?. (Solución: 56,7 g) 2 - Una disolución 0,25 m de cloruro de sodio contiene 58,5 g
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
QUÍMICA 2º BACHILLERATO
 1.-/ El oxígeno se prepara por calentamiento del clorato de potasio según la reacción (sin ajustar): calor KClO 3 KCl + O 2 a) Qué masa de oxígeno se obtiene a partir de 3 g de clorato de potasio?. b)
1.-/ El oxígeno se prepara por calentamiento del clorato de potasio según la reacción (sin ajustar): calor KClO 3 KCl + O 2 a) Qué masa de oxígeno se obtiene a partir de 3 g de clorato de potasio?. b)
TEMA 3.- Reacciones químicas. Estequiometría
 TEMA 3.- Reacciones químicas. Estequiometría 123.- Se hace reaccionar ácido sulfúrico con magnesio. Se pide: a) Masa de magnesio que se necesita para reaccionar con 150 ml de una disolución acuosa de ácido
TEMA 3.- Reacciones químicas. Estequiometría 123.- Se hace reaccionar ácido sulfúrico con magnesio. Se pide: a) Masa de magnesio que se necesita para reaccionar con 150 ml de una disolución acuosa de ácido
PROBLEMAS DE ESTEQUIOMETRIA
 PROBLEMAS DE ESTEQUIOMETRIA 1. Dada la ecuación de síntesis del agua, si partimos de 15 moles de oxígeno calcular: los moles de hidrógeno que necesitaremos y los moles de agua que se formarán. 2. Se evapora
PROBLEMAS DE ESTEQUIOMETRIA 1. Dada la ecuación de síntesis del agua, si partimos de 15 moles de oxígeno calcular: los moles de hidrógeno que necesitaremos y los moles de agua que se formarán. 2. Se evapora
PROBLEMAS TIPO DE CÁLCULOS QUÍMICOS
 PROBLEMAS TIPO DE CÁLCULOS QUÍMICOS Átomos, moléculas y moles 1) Un tubo de ensayo contiene 25 ml de agua. Calcula: a) El número de moles de agua. b) El número total de átomos de hidrógeno. c) La masa
PROBLEMAS TIPO DE CÁLCULOS QUÍMICOS Átomos, moléculas y moles 1) Un tubo de ensayo contiene 25 ml de agua. Calcula: a) El número de moles de agua. b) El número total de átomos de hidrógeno. c) La masa
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría (II)
 1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
REPASO DE QUÍMICA- TEMA
 REPASO DE QUÍMICA- TEMA 0 1. Se tienen 8 5 g de amoniaco y se eliminan 1 5 10 23 moléculas. a) Cuántas moléculas de amoniaco quedan? b) Cuántos gramos de amoniaco quedan? c) Cuántos moles de átomos de
REPASO DE QUÍMICA- TEMA 0 1. Se tienen 8 5 g de amoniaco y se eliminan 1 5 10 23 moléculas. a) Cuántas moléculas de amoniaco quedan? b) Cuántos gramos de amoniaco quedan? c) Cuántos moles de átomos de
1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml.
 ESTEQUIOMETRÍA,DISOLUCIONES: ACTIVIDADES DE SELECTIVIDAD. 1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml. a) Qué volumen de esta disolución se
ESTEQUIOMETRÍA,DISOLUCIONES: ACTIVIDADES DE SELECTIVIDAD. 1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml. a) Qué volumen de esta disolución se
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO
 PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
ESTEQUIOMETRIA. 11. Se descomponen por el calor 13 gramos de clorato de potasio, según el proceso:
 ESTEQUIOMETRIA 1. Un hidrocarburo gaseoso cuya densidad en condiciones estándar es de 2 21gr/l, produce por combustión de 4 32 gr., la misma cantidad de agua y 14 08 gr. de dióxido de carbono. Calcular
ESTEQUIOMETRIA 1. Un hidrocarburo gaseoso cuya densidad en condiciones estándar es de 2 21gr/l, produce por combustión de 4 32 gr., la misma cantidad de agua y 14 08 gr. de dióxido de carbono. Calcular
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio 5,
CuO (s) + H 2 SO 4(aq) CuSO 4(aq) +H 2 O (aq)
 Relación de problemas Química 4º ESO CDP. NTRA. SRA. DE LORETO 1. El trióxido de azufre se sintetiza a partir de dióxido de azufre y oxígeno molecular. Calcula la masa y el volumen de los reactivos que
Relación de problemas Química 4º ESO CDP. NTRA. SRA. DE LORETO 1. El trióxido de azufre se sintetiza a partir de dióxido de azufre y oxígeno molecular. Calcula la masa y el volumen de los reactivos que
TEMA 1: QUÍMICA DESCRIPTIVA
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 1023 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 1023 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
= M m = 0,1 M. moles 0,2 L = 0,02 moles de HNO3. moles = disolución
 CÁCUOS QUÍMICOS. PENDIENTES 1º BACIERATO (RESUETOS) 1) Se disuelven 6, de ácido nítrico hasta completar 1 litro de. a) Calcula su aridad b) Si de dicha se toman 00 cm y se les añade más aua hasta completar
CÁCUOS QUÍMICOS. PENDIENTES 1º BACIERATO (RESUETOS) 1) Se disuelven 6, de ácido nítrico hasta completar 1 litro de. a) Calcula su aridad b) Si de dicha se toman 00 cm y se les añade más aua hasta completar
DISOLUCIONES Y ESTEQUIOMETRÍA
 DISOLUCIONES Y ESTEQUIOMETRÍA DISOLUCIONES 1.-/ Se disuelven 7 gramos de NaCl en 50 gramos de agua. Cuál es la concentración centesimal de la disolución? Sol: 12,28 % de NaCl 2.-/ En 20 ml de una disolución
DISOLUCIONES Y ESTEQUIOMETRÍA DISOLUCIONES 1.-/ Se disuelven 7 gramos de NaCl en 50 gramos de agua. Cuál es la concentración centesimal de la disolución? Sol: 12,28 % de NaCl 2.-/ En 20 ml de una disolución
LEYES PONDERALES Y LEYES DE LOS GASES
 LEYES PONDERALES Y LEYES DE LOS GASES En una cápsula de porcelana se colocan 2,15 gr de limaduras de hierro y se le agrega una cucharada de azufre suficiente como para que una vez que reaccionen quede
LEYES PONDERALES Y LEYES DE LOS GASES En una cápsula de porcelana se colocan 2,15 gr de limaduras de hierro y se le agrega una cucharada de azufre suficiente como para que una vez que reaccionen quede
EJERCICIOS DE LA PAU CYL TEMA
 EJERCICIOS DE LA PAU CYL TEMA 0 2007-13 CONCEPTO DE MOL: 1. (16-S07) Calcule la masa de cada uno de los elementos presentes en: a) 2,5 moles de Ca. (0,6 puntos) b) 2,0 10 23 átomos de Al. (0,7 puntos)
EJERCICIOS DE LA PAU CYL TEMA 0 2007-13 CONCEPTO DE MOL: 1. (16-S07) Calcule la masa de cada uno de los elementos presentes en: a) 2,5 moles de Ca. (0,6 puntos) b) 2,0 10 23 átomos de Al. (0,7 puntos)
DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I)
 COLEGIO HISPANO-INGLÉS DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I) NOMBRE: DPTO.FÍSICA-QUÍMICA CURSO:1º DE BACH A y B 1.- Un hidrocarburo gaseoso contenido en un matraz de 500 ml en condiciones normales
COLEGIO HISPANO-INGLÉS DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I) NOMBRE: DPTO.FÍSICA-QUÍMICA CURSO:1º DE BACH A y B 1.- Un hidrocarburo gaseoso contenido en un matraz de 500 ml en condiciones normales
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD
 CUESTIONES Y PROBLEMAS DE SELECTIVIDAD CUESTIONES 1. Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más volumen,
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD CUESTIONES 1. Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más volumen,
RESOLUCIÓN DE 51 PROBLEMAS DE REAPASO DE 4º DE E.S.O. Y 1º DE BACHLLERATO PARA LA RUEBA DE SELECTIVIDAD.
 RESOLUCIÓN DE 51 PROBLEMAS DE REAPASO DE 4º DE E.S.O. Y 1º DE BACHLLERATO PARA LA RUEBA DE SELECTIVIDAD. NOTA DEL PROFESOR: Posiblemente sea la primera vez que os encontráis con una colección de problemas
RESOLUCIÓN DE 51 PROBLEMAS DE REAPASO DE 4º DE E.S.O. Y 1º DE BACHLLERATO PARA LA RUEBA DE SELECTIVIDAD. NOTA DEL PROFESOR: Posiblemente sea la primera vez que os encontráis con una colección de problemas
La riqueza en peso nos dice que en 100 gramos de disolución hay 37 gramos de soluto, de modo que en 1180 gramos de disolución habrá:
 40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
40.- Calcula la concentración en g/l de un ácido clorhídrico comercial de 37 % de riqueza en peso y densidad 1,18 g/ml. En primer lugar expresamos la densidad en g/l : 1180 g/l La riqueza en peso nos dice
EJERCICIOS DE EQUILIBRIO QUÍMICO.
 EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
ESTEQUIOMETRÍA. 1 Estequiometría
 1 ESTEQUIOMETRÍA 1. El titanio es un metal con numerosas aplicaciones debido a su baja densidad y resistencia a la corrosión. La primera etapa en la obtención del titanio es la conversión de la mena rutilo,
1 ESTEQUIOMETRÍA 1. El titanio es un metal con numerosas aplicaciones debido a su baja densidad y resistencia a la corrosión. La primera etapa en la obtención del titanio es la conversión de la mena rutilo,
CANTIDAD DE SUSTANCIA
 CANTIDAD DE SUSTANCIA 1. Una gota de ácido sulfúrico ocupa 0,025 ml. Si la densidad del mismo es 1,981 g/cm 3 a) calcula el número de moléculas de dicho ácido que hay en la gota y b) el número de átomos
CANTIDAD DE SUSTANCIA 1. Una gota de ácido sulfúrico ocupa 0,025 ml. Si la densidad del mismo es 1,981 g/cm 3 a) calcula el número de moléculas de dicho ácido que hay en la gota y b) el número de átomos
Ejercicios 3 (Soluciones) 2) Determinar el peso de 400 ml de ácido clorhídrico cuya densidad es de 1,16 g/ml R: 464 g
 Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
3. Calcula la cantidad estequiométrica de hidrógeno molecular, en moles, necesaria para reaccionar con 5 moles de oxígeno en la síntesis del agua.
 CÁLCULOS ESTEQUIOMÉTRICOS BÁSICOS 1. Ajusta las siguientes reacciones químicas: C 3 H 6 (g) + O 2 (g) CO 2 (g) + H 2 O (g) N 2 (g) + H 2 (g) NH 3 (g) KClO 3 (aq) KCl (aq) + O 2 (g) H 2 O 2 (l) O 2 (g)
CÁLCULOS ESTEQUIOMÉTRICOS BÁSICOS 1. Ajusta las siguientes reacciones químicas: C 3 H 6 (g) + O 2 (g) CO 2 (g) + H 2 O (g) N 2 (g) + H 2 (g) NH 3 (g) KClO 3 (aq) KCl (aq) + O 2 (g) H 2 O 2 (l) O 2 (g)
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
ESTEQUIOMETRÍA Y CONCEPTOS BÁSICOS 2002
 ESTEQUIOMETRÍA Y CONCEPTOS BÁSICOS 2002 1- a) Cuál es la masa, expresada en gramos, de un átomo de sodio? b) Cuántos átomos de aluminio hay en 0 5 g de este elemento? c) Cuántas moléculas hay en una muestra
ESTEQUIOMETRÍA Y CONCEPTOS BÁSICOS 2002 1- a) Cuál es la masa, expresada en gramos, de un átomo de sodio? b) Cuántos átomos de aluminio hay en 0 5 g de este elemento? c) Cuántas moléculas hay en una muestra
EJERCICIOS DE REPASO DE QUÍMICA DE 1º DE BACHILLER CURSO 2012/13
 CENTRO DE EDUCACIÓN SECUNDARIA JUAN XXIII Cartuja Tlf: 958 151560 C/ Periodista Luis de Vicente, 1 Fax: 958185180 18011 GRANADA Correo e: juan23cartuja@hotmail.com Web: juanxxiiicartuja.org EJERCICIOS
CENTRO DE EDUCACIÓN SECUNDARIA JUAN XXIII Cartuja Tlf: 958 151560 C/ Periodista Luis de Vicente, 1 Fax: 958185180 18011 GRANADA Correo e: juan23cartuja@hotmail.com Web: juanxxiiicartuja.org EJERCICIOS
EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA
 EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA REACCIONES: 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono, medido
EJERCICIOS DE DISOLUCIONES Y ESTEQUIOMETRÍA REACCIONES: 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono, medido
ESTEQUIOMETRÍA Y DISOLUCIONES
 ESTEQUIOMETRÍA Y DISOLUCIONES 1. Se dispone de 100 ml de una disolución de ácido clorhídrico 0,5 M y se desea preparar 100 ml de otra disolución del mismo ácido pero de concentración 0,05 M. a) Cómo se
ESTEQUIOMETRÍA Y DISOLUCIONES 1. Se dispone de 100 ml de una disolución de ácido clorhídrico 0,5 M y se desea preparar 100 ml de otra disolución del mismo ácido pero de concentración 0,05 M. a) Cómo se
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
Página 1
 TEMA O. ASPECTOS BÁSICOS. DISOLUCIONES Y ESTEQUIOMETRÍA 1.1) Una bombona de butano C4H10, contiene 12 Kg de este gas. Para esta cantidad calcule: a) El número de moles de butano. b) El número de átomos
TEMA O. ASPECTOS BÁSICOS. DISOLUCIONES Y ESTEQUIOMETRÍA 1.1) Una bombona de butano C4H10, contiene 12 Kg de este gas. Para esta cantidad calcule: a) El número de moles de butano. b) El número de átomos
Ejercicios Estequiometria
 Ejercicios Estequiometria 1. Se hacen reaccionar 22,75 g de Zn que contiene un 7,25 % de impurezas con exceso de HCl. Calcula la masa de H 2 desprendida. HCl + Zn ZnCl 2 + H 2 2. Se calcinan en un horno
Ejercicios Estequiometria 1. Se hacen reaccionar 22,75 g de Zn que contiene un 7,25 % de impurezas con exceso de HCl. Calcula la masa de H 2 desprendida. HCl + Zn ZnCl 2 + H 2 2. Se calcinan en un horno
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]
![Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]](/thumbs/40/20756584.jpg) Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
Contenidos. Concepto de reacción química: interpretación microscópica de las reacciones
 3. ESTUDIO DE LAS TRANSFORMACIONES QUÍMICAS. Contenidos Concepto de reacción química: interpretación microscópica de las reacciones químicas. Velocidad de reacción. Factores de los que depende. Ecuación
3. ESTUDIO DE LAS TRANSFORMACIONES QUÍMICAS. Contenidos Concepto de reacción química: interpretación microscópica de las reacciones químicas. Velocidad de reacción. Factores de los que depende. Ecuación
1010 DEPARTAMENTO DE FÍSICA Y QUÍMICA 2º Bachillerato QUÍMICA
 1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
EJERCICIOS Y PROBLEMAS DE REPASO PARA EL ALUMNADO QUE PROMOCIONA A PRIMERO DE BACHILLER Y QUIERE ESTUDIAR FÍSICA Y QUÍMICA
 EJERCICIOS Y PROBLEMAS DE REPASO PARA EL ALUMNADO QUE PROMOCIONA A PRIMERO DE BACHILLER Y QUIERE ESTUDIAR FÍSICA Y QUÍMICA 1.- El gas propano reacciona con el oxígeno según la siguiente reacción: C 3 H
EJERCICIOS Y PROBLEMAS DE REPASO PARA EL ALUMNADO QUE PROMOCIONA A PRIMERO DE BACHILLER Y QUIERE ESTUDIAR FÍSICA Y QUÍMICA 1.- El gas propano reacciona con el oxígeno según la siguiente reacción: C 3 H
CALCULOS MOLES MOLES 1. En un alto horno, el mineral de hierro, Fe 2 O 3, se convierte en hierro mediante la reacción: Fe 2 O 3 (s) + 3 CO (g) 2 Fe
 CALCULOS MOLES MOLES 1. En un alto horno, el mineral de hierro, Fe 2 O 3, se convierte en hierro mediante la reacción: Fe 2 O 3 (s) + 3 CO (g) 2 Fe (I) + 3 CO 2 (g) a) Cuántos moles de monóxido de carbono
CALCULOS MOLES MOLES 1. En un alto horno, el mineral de hierro, Fe 2 O 3, se convierte en hierro mediante la reacción: Fe 2 O 3 (s) + 3 CO (g) 2 Fe (I) + 3 CO 2 (g) a) Cuántos moles de monóxido de carbono
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
HOJA Nº 6. REACCIONES QUÍMICAS (II)
 HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
PROBLEMAS QUÍMICA. (Proyecto integrado)
 PROBLEMAS QUÍMICA. (Proyecto integrado) CONCEPTOS FUNDAMENTALES 1. Razone qué cantidad de las siguientes sustancias tiene mayor nº de átomos: a) 0 5 moles de SO 2 b) 14 gramos de nitrógeno molecular. c)
PROBLEMAS QUÍMICA. (Proyecto integrado) CONCEPTOS FUNDAMENTALES 1. Razone qué cantidad de las siguientes sustancias tiene mayor nº de átomos: a) 0 5 moles de SO 2 b) 14 gramos de nitrógeno molecular. c)
SOLUCIONES A LOS EJERCICIOS DE ESTEQUIOMETRÍA
 SOLUCIONES A LOS EJERCICIOS DE ESTEQUIOMETRÍA 1. La reacción del aluminio con el cloro produce cloruro de aluminio. a. Qué masa de tricloruro de aluminio se obtiene al hacer reaccionar 23 g de aluminio
SOLUCIONES A LOS EJERCICIOS DE ESTEQUIOMETRÍA 1. La reacción del aluminio con el cloro produce cloruro de aluminio. a. Qué masa de tricloruro de aluminio se obtiene al hacer reaccionar 23 g de aluminio
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
PROBLEMAS EQUILIBRIO ÁCIDO BASE
 PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
Problemas de Química (1ero Grado de Química). Tema 1.
 Problemas de Química (1ero Grado de Química). Tema 1. CÁLCULOS BÁSICOS 1. Expresa en notación científica, indicando en cada caso el número de cifras significativas: a) 258292 b) 1804, 5289 c) 0, 48 d)
Problemas de Química (1ero Grado de Química). Tema 1. CÁLCULOS BÁSICOS 1. Expresa en notación científica, indicando en cada caso el número de cifras significativas: a) 258292 b) 1804, 5289 c) 0, 48 d)
IES Real Instituto Jovellanos 1º BACHILLERATO. SERIE 17
 1.- Ajustar las siguientes reacciones: a) Propano + oxígeno === dióxido de carbono + agua b) Carbonato de sodio + ácido clorhídrico === cloruro de sodio + agua c) Tribromuro de fósforo + agua === ácido
1.- Ajustar las siguientes reacciones: a) Propano + oxígeno === dióxido de carbono + agua b) Carbonato de sodio + ácido clorhídrico === cloruro de sodio + agua c) Tribromuro de fósforo + agua === ácido
Problemas de Estequiometría (ampliación) Pág. Nº 1
 Problemas de Estequiometría (ampliación) Pág. Nº 1 MOLES, MOLÉCULAS Y ÁTOMOS: 1.- Calcular la masa de agua que contienen 0,23 moles de agua. Sol: 4,14 g 2.- Calcular la masa de una molécula de agua. Sol:
Problemas de Estequiometría (ampliación) Pág. Nº 1 MOLES, MOLÉCULAS Y ÁTOMOS: 1.- Calcular la masa de agua que contienen 0,23 moles de agua. Sol: 4,14 g 2.- Calcular la masa de una molécula de agua. Sol:
M; ph =2,88; b. α = 1,33.10
 EJERCICIOS DE ÁCIDO BASE. 1º. Tenemos 100cc de agua destlada. Calcular: a. su ph b. si le añadimos una gota (0,05 cc) de HCl 0,1M, calcular el ph de la disolución resultante b. calcular el ph de la disolución
EJERCICIOS DE ÁCIDO BASE. 1º. Tenemos 100cc de agua destlada. Calcular: a. su ph b. si le añadimos una gota (0,05 cc) de HCl 0,1M, calcular el ph de la disolución resultante b. calcular el ph de la disolución
 70. Disponemos de ácido clorhídrico comercial (densidad = 1,2 g/cm 3 y riqueza 36 % en peso) y deseamos preparar 500 cm 3 de una disolución de ácido clorhídrico 0,1 M. Explica detalladamente cómo lo harías,
70. Disponemos de ácido clorhídrico comercial (densidad = 1,2 g/cm 3 y riqueza 36 % en peso) y deseamos preparar 500 cm 3 de una disolución de ácido clorhídrico 0,1 M. Explica detalladamente cómo lo harías,
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA.
 PROBLEMAS ESTEQUIOMETRÍA 1º BACH. REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA. 1. El cloruro amónico con hidróxido de calcio produce al reaccionar cloruro de calcio, amoníaco y agua. Si el
PROBLEMAS ESTEQUIOMETRÍA 1º BACH. REACCIONES DE QUÍMICA INORGÁNICA. RENDIMIENTO Y RIQUEZA. 1. El cloruro amónico con hidróxido de calcio produce al reaccionar cloruro de calcio, amoníaco y agua. Si el
Química 2º Bachillerato Termoquímica
 I. E. S. Atenea. Departamento de Física y Química 1 Química 2º Bachillerato Termoquímica 1. Calcular la variación de energía interna para la reacción de combustión del benceno (C 6 H 6 ) si el proceso
I. E. S. Atenea. Departamento de Física y Química 1 Química 2º Bachillerato Termoquímica 1. Calcular la variación de energía interna para la reacción de combustión del benceno (C 6 H 6 ) si el proceso
Problemas del Tema 1: Aspectos cuantitativos en Química
 Problemas del Tema 1: Aspectos cuantitativos en Química 1.- Se dispone de una botella de ácido sulfúrico cuya etiqueta aporta los siguientes datos: densidad 1 84 g/ml y riqueza en masa 96 %. Calcule: La
Problemas del Tema 1: Aspectos cuantitativos en Química 1.- Se dispone de una botella de ácido sulfúrico cuya etiqueta aporta los siguientes datos: densidad 1 84 g/ml y riqueza en masa 96 %. Calcule: La
PROBLEMAS REPASO QUÍMICA.
 PROBLEMAS REPASO QUÍMICA. CÁLCULOS QUÍMICOS A) Concepto de mol, moléculas, leyes de los gases, leyes ponderales. 1.- Cuántos moles, átomos y moléculas hay en 4,6g de etanol (C 2 H 6 O)? Sol: 0,1 moles;
PROBLEMAS REPASO QUÍMICA. CÁLCULOS QUÍMICOS A) Concepto de mol, moléculas, leyes de los gases, leyes ponderales. 1.- Cuántos moles, átomos y moléculas hay en 4,6g de etanol (C 2 H 6 O)? Sol: 0,1 moles;
TRANSFORMACIONES QUÍMICAS. ESTEQUIOMETRÍA.
 Tema 3 Estequiometría 1 TEMA 3. TRANSFORMACIONES QUÍMICAS. ESTEQUIOMETRÍA. 2. LAS REACCIONES QUÍMICAS. 1.- Señala justificándolas, las respuestas correctas: Se produce un cambio químico: a) Cuando las
Tema 3 Estequiometría 1 TEMA 3. TRANSFORMACIONES QUÍMICAS. ESTEQUIOMETRÍA. 2. LAS REACCIONES QUÍMICAS. 1.- Señala justificándolas, las respuestas correctas: Se produce un cambio químico: a) Cuando las
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA
 ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
Refuerzo Modelos atómicos
 Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
1º Control 2ª Evaluación. Física y Química 1º Bachillerato D. 1.- (2 puntos) Formula o nombra los siguientes compuestos químicos:
 1º Control 2ª Evaluación Física y Química 1º Bachillerato D a) Seleniuro de hidrógeno; b) Yodato de cobre (II); c) Li 2 O 2; d) K 2 S; e) Na 3 PO 4 2. (2 puntos) a) Calcula los gramos de hidróxido potásico
1º Control 2ª Evaluación Física y Química 1º Bachillerato D a) Seleniuro de hidrógeno; b) Yodato de cobre (II); c) Li 2 O 2; d) K 2 S; e) Na 3 PO 4 2. (2 puntos) a) Calcula los gramos de hidróxido potásico
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol
 COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
5. Cuánto pesan 1,025 moles de amoníaco más 6, átomos de plata? Expresa el resultado en gramos. Dato: 1 u = 1, g Sol: 125,295 g
 EJERCICIOS DE REPASO 2º BACH CANTIDADES EN QUÍMICA 1. La masa atómica de la plata que encontramos en las tablas es de 107,87 u. Determina la abundancia relativa de los dos isótopos que tiene, sabiendo
EJERCICIOS DE REPASO 2º BACH CANTIDADES EN QUÍMICA 1. La masa atómica de la plata que encontramos en las tablas es de 107,87 u. Determina la abundancia relativa de los dos isótopos que tiene, sabiendo
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II HOJAS DE TRABAJO UNIDAD IV DISOLUCIONES Libros a utilizar:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II HOJAS DE TRABAJO UNIDAD IV DISOLUCIONES Libros a utilizar:
ESTEQUIOMETRÍA Y DISOLUCIONES.
 ESTEQUIOMETRÍA Y DISOLUCIONES. Julio 2017; Opción B; Problema 2.- La dureza de la cáscara de los huevos se puede determinar por la cantidad de carbonato de calcio, CaCO 3, que contiene. El carbonato de
ESTEQUIOMETRÍA Y DISOLUCIONES. Julio 2017; Opción B; Problema 2.- La dureza de la cáscara de los huevos se puede determinar por la cantidad de carbonato de calcio, CaCO 3, que contiene. El carbonato de
LAS REACCIONES QUÍMICAS.
 1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
ACTIVIDADES VOLUNTARIAS DE REPASO (QUÍMICA) 1º BACH. ( verano) Curso 10-11. 1) Yodato de estaño (II) 2) Hidruro de berilio 3) Ácido acético
 ACTIVIDADES VOLUNTARIAS DE REPASO (QUÍMICA) 1º BACH. ( verano) Curso 10-11 1. Formular los siguientes compuestos: 1) Yodato de estaño (II) 2) Hidruro de berilio 3) Ácido acético 4) óxido de cromo (III)
ACTIVIDADES VOLUNTARIAS DE REPASO (QUÍMICA) 1º BACH. ( verano) Curso 10-11 1. Formular los siguientes compuestos: 1) Yodato de estaño (II) 2) Hidruro de berilio 3) Ácido acético 4) óxido de cromo (III)
EJERCICIOS: Moles, moléculas, átomos. Fórmula empírica y molecular. Gases. Disoluciones. Estequiometria.
 EJERCICIOS: Moles, moléculas, átomos. Fórmula empírica y molecular. Gases. Disoluciones. Estequiometria. Moles, moléculas, átomos 1. En 200 g de dicromato de potasio: a) cuántos moles de dicromato de potasio
EJERCICIOS: Moles, moléculas, átomos. Fórmula empírica y molecular. Gases. Disoluciones. Estequiometria. Moles, moléculas, átomos 1. En 200 g de dicromato de potasio: a) cuántos moles de dicromato de potasio
Problemas de Química.
 Nombre y apellidos : Materia: Física y Química Curso: 1º Bach. 1ª entrega Fecha: INSTRUCCIONES: Los siguientes ejercicios deben ser entregados el mismo día del examen. Procura estudiar primero la teoría
Nombre y apellidos : Materia: Física y Química Curso: 1º Bach. 1ª entrega Fecha: INSTRUCCIONES: Los siguientes ejercicios deben ser entregados el mismo día del examen. Procura estudiar primero la teoría
QUIMICA GENERAL GUIA DE EJERCICIOS Nº2
 1 QUIMICA GENERAL GUIA DE EJERCICIOS Nº2 TIPO 1: PORCENTAJE PESO-PESO (% p/p) 1) Si se disuelven 23 g. de KOH en 400 g de agua, determina el %p/p de la solución. 2) Si se disuelven 456 g. de NaCl en agua
1 QUIMICA GENERAL GUIA DE EJERCICIOS Nº2 TIPO 1: PORCENTAJE PESO-PESO (% p/p) 1) Si se disuelven 23 g. de KOH en 400 g de agua, determina el %p/p de la solución. 2) Si se disuelven 456 g. de NaCl en agua
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2010. Fase general OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
REACCIONES QUÍMICAS MASA MOLES MOLÉCULAS ÁTOMOS ÁTOMOS. Factor de conversión N A = 6, partículas/mol
 REACCIONES QUÍMICAS CANTIDAD DE MATERIA La cantidad de sustancia se puede expresar en gramos (masa), en moles, moléculas o átomos. Podemos pasar de unas unidades a otras utilizando el siguiente esquema:
REACCIONES QUÍMICAS CANTIDAD DE MATERIA La cantidad de sustancia se puede expresar en gramos (masa), en moles, moléculas o átomos. Podemos pasar de unas unidades a otras utilizando el siguiente esquema:
TEMA 6 La reacción química
 TEMA 6 La reacción química 37. Cuando se calienta el carbonato de bario se desprende dióxido de carbono y queda un residuo de óxido de bario. Calcula: a) La cantidad de carbonato que se calentó si el dióxido
TEMA 6 La reacción química 37. Cuando se calienta el carbonato de bario se desprende dióxido de carbono y queda un residuo de óxido de bario. Calcula: a) La cantidad de carbonato que se calentó si el dióxido
C: Cálculos estequiométricos que incluyen otros cálculos previos o posteriores
 C: Cálculos estequiométricos que incluyen otros cálculos previos o posteriores C-01 - Dada la reacción: 4 HCl + MnO ---------> Cl + MnCl + H O, calcule la masa de dióxido de manganeso que se necesita para
C: Cálculos estequiométricos que incluyen otros cálculos previos o posteriores C-01 - Dada la reacción: 4 HCl + MnO ---------> Cl + MnCl + H O, calcule la masa de dióxido de manganeso que se necesita para
EJERCICIOS DE TERMODINÁMICA
 EJERCICIOS DE TERMODINÁMICA. La descomposición del tetraóxido de nitrógeno ( N O 4 NO4( NO( ocurre espontáneamente a temperaturas altas. Los datos termodinámicos a 98ºK se incluyen en la tabla adjunta.
EJERCICIOS DE TERMODINÁMICA. La descomposición del tetraóxido de nitrógeno ( N O 4 NO4( NO( ocurre espontáneamente a temperaturas altas. Los datos termodinámicos a 98ºK se incluyen en la tabla adjunta.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 5, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 5, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 5,
TEMA 7: (productos de la reacción) por la reorganización de los átomos formando moléculas nuevas. Para ello es
 TEMA 7: REACCIONES QUÍMICAS Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando
TEMA 7: REACCIONES QUÍMICAS Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando
PROBLEMAS DE SELECTIVIDAD. TEMA 1: CÁLCULOS QUÍMICOS
 PROBLEMAS DE SELECTIVIDAD. TEMA 1: CÁLCULOS QUÍMICOS 2015 1) Una cantidad de dioxígeno ocupa un volumen de 825 ml a 27 ºC y una presión de 0,8 atm. Calcula: a) Cuántos gramos hay en la muestra? b) Qué
PROBLEMAS DE SELECTIVIDAD. TEMA 1: CÁLCULOS QUÍMICOS 2015 1) Una cantidad de dioxígeno ocupa un volumen de 825 ml a 27 ºC y una presión de 0,8 atm. Calcula: a) Cuántos gramos hay en la muestra? b) Qué
