LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (II)
|
|
|
- Dolores Mendoza Santos
- hace 7 años
- Vistas:
Transcripción
1 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (II) Se van a presentar tres electrólisis en diferentes condiciones y con distintos electrodos, a fin de observar la influencia de estas condiciones en sus resultados a través de la fotografía digital. Las sales sometidas a electrólisis son: sulfato de cobre(ii), cloruro de cobre(ii) y cloruro de cobre(i). En principio se van a emplear dos montajes, uno con electrodos metálicos tal como el expuesto en la fig. 1 del tema Electrólisis de disoluciones salinas (I), y otro con dos minas de lápiz como electrodos, enganchados por pinzas de cocodrilo (fig. 1) Fig.1 ELECTRÓLISIS DEL SULFATO DE COBRE(II) La electrólisis del sulfato de cobre (II), sal bastante soluble en agua, se produce a través de los fenómenos descritos en el dibujo, de acuerdo con la facilidad de descarga de los iones en los electrodos respectivos dada en la figura 2 de primera parte de este trabajo. Se emplean primeramente electrodos metálicos. En el ánodo se descargará el OH -, y en el cátodo el Cu 2+ Ánodo : OH - -2e = ½ O 2 (gas) + H + Cátodo: Cu e = Cu(s). quedando en disolución ácido sulfúrico, que producirá un ph ácido que se puede caracterizar por el indicador apropiado. La sucesión de fotografías que describen este proceso, Son las figuras 3, 4 y 5 Fig.2 Fig.3 Fig.4
2 En la figura 5, se agregó a la cubeta violeta de metilo, que en la zona del ánodo va a presentar un color azul, o sea ph ácido (aunque no en exceso). Se observa perfectamente el desprendimiento de oxígeno en forma de burbujas, en el ánodo, mientras que se deposita cobre metálico en el cátodo. Fig.5 Sin embargo si los electrodos son de grafito, observamos, una vez transcurrido cierto tiempo, el ataque del ánodo de grafito y el depósito de cobre en el cátodo (figuras 6 y 7) y el color azulado que toma el violeta de metilo, en las proximidades del ánodo. Las fotografías 6 y 7 se han tomado con un intervalo de tiempo de 10 minutos. Fig.6 Fig.7 ELECTRÓLISIS DEL CLORURO DE COBRE (II) La electrólisis de cloruro de cobre (II), se realiza primero con electrodos metálicos, partiendo de una disolución 0,1M. En la figura 8, se presenta un esquema de lo que sucede en las proximidades de los electrodos, de acuerdo con lo explicado en desarrollos anteriores. Ánodo : 2Cl - -2e- = Cl 2 (gas) Cátodo: Cu e = Cu(s). La disolución tendrá un ph neutro. Las fotos digitales sucesivas, se dan en las figuras 9, 10,11 y 11. En estas dos últimas se ha agregado violeta de metilo. Fig.8
3 Se observa el crecimiento del depósito metálico, en forma de árbol, así como el escaso desprendimiento de burbujas de cloro como se preveía según el modelo propuesto en la figura 8. Esto puede justificarse por reacción del cloro con el metal del electrodo. Fig.9 Fig.10 Fig.12 Fig.11 En cambio si se emplean electrodos de grafito, se observa perfectamente el desprendimiento de cloro en el ánodo (sucesión de fotos 13, 14, 15 y 16). A partir de la 14 se agrega violeta de metilo a la disolución. Fig.13 Fig.14
4 Fig.16 Fig.15 ELECTRÓLISIS DEL CLORURO DE COBRE(I) El cloruro de cobre(i), difiere totalmente del cloruro de cobre(ii), no solamente en el color (gris verdoso) sino especialmente en su solubilidad en el agua, ello hace que la concentración de iones en disolución sea muy pequeña, lo que modifica su descarga en los electrodos. Cabría suponer las reacciones indicadas en el esquema de la figura 17, según el criterio de descarga, sin embargo lo que realmente ocurre es lo que se especifica en la figura 18. Fig.17 Fig.18 Las cinco primeras fotografías hacen referencia a la electrólisis con electrodos metálicos (fig. 19, 20, y 23). A partir de la 21, se le agrega a la disolución una gota de fenolftaleína, que enrojece el cátodo, lo que prueba que el desprendimiento de burbujas que se observa en él, se debe a la descarga del H +, aumentando por lo tanto la concentración de OH -. Obsérvese el detalle de la figura 22.
5 Fig.19 Fig.20 Fig.22 Fig.21 Aparentemente casi no se observa desprendimiento de burbujas en el ánodo metálico, como cabría esperar del proceso indicado en la figura 18. Se debe a que el cloro posiblemente reaccione con el metal del electrodo, como se comprueba en la figura 23, que ofrece una ampliación del ánodo en su parte sumergida, después de la electrólisis. Fig.23
6 Si la electrólisis se realiza con electrodos de grafito, se observa el desprendimiento de considerables burbujas en el ánodo, como se puede apreciar en la sucesión de fotos que se presenta en las figuras 24, 25, 26 y 27. Fig.24 Fig.25 Fig.27 Fig.26 Se debe comparar la fotografía de la fig.26, con la de la fig.21, para apreciar la diferencia que presenta la utilización de diferentes electrodos en la electrólisis de una misma sustancia tal como el cloruro de cobre(i) en similar concentración, empleando la misma diferencia de potencial, y al cabo del mismo tiempo.
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III)
 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III) Se va a presentar la electrólisis de sales de elementos del mismo grupo (el 12), con diferentes aniones a fin de observar la electrodeposición de estos metales.
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (III) Se va a presentar la electrólisis de sales de elementos del mismo grupo (el 12), con diferentes aniones a fin de observar la electrodeposición de estos metales.
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (V)
 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (V) Se va a presentar la electrólisis de sales de elementos pesados con diferentes aniones a fin de observar la electrodeposición de estos metales, si la hubiere.
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (V) Se va a presentar la electrólisis de sales de elementos pesados con diferentes aniones a fin de observar la electrodeposición de estos metales, si la hubiere.
ELECTRÓLISIS DEL SULFATO DE CINC: EFECTO DE LA CONCENTRACIÓN
 ELECTRÓLISIS DEL SULFATO DE CINC: EFECTO DE LA CONCENTRACIÓN ELECTRÓLISIS DEL SULFATO DE CINC(II) La electrólisis del sulfato de cinc se ha estudiado desde el punto de vista cualitativo, ahora se va a
ELECTRÓLISIS DEL SULFATO DE CINC: EFECTO DE LA CONCENTRACIÓN ELECTRÓLISIS DEL SULFATO DE CINC(II) La electrólisis del sulfato de cinc se ha estudiado desde el punto de vista cualitativo, ahora se va a
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (I)
 LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (I) Se va a emplear la fotografía digital, para estudiar la electrólisis de disoluciones salinas y la migración de iones a los electrodos. Se necesita una fuente
LA ELECTRÓLISIS DE DISOLUCIONES SALINAS (I) Se va a emplear la fotografía digital, para estudiar la electrólisis de disoluciones salinas y la migración de iones a los electrodos. Se necesita una fuente
ELECTROLISIS DEL CLORURO DE ESTAÑO(II) Fotografía 1
 ELECTROLISIS DEL CLORURO DE ESTAÑO(II) Introducción En esta web, en la sección de Química a la gota y en el apartado electrolisis salinas V (ubicada en el almacén) se ha expuesto, mediante fotografía digital,
ELECTROLISIS DEL CLORURO DE ESTAÑO(II) Introducción En esta web, en la sección de Química a la gota y en el apartado electrolisis salinas V (ubicada en el almacén) se ha expuesto, mediante fotografía digital,
QUÍMICA 2º Bachillerato Ejercicios: Electroquímica
 1(8) Ejercicio nº 1 Considera la reacción: Cu(s) + 2Ag + (aq) Cu +2 (aq) + 2Ag(s) a) Escribe las semirreacciones de oxidación y de reducción c) Escribe el esquema de la pila que se puede formar con dicha
1(8) Ejercicio nº 1 Considera la reacción: Cu(s) + 2Ag + (aq) Cu +2 (aq) + 2Ag(s) a) Escribe las semirreacciones de oxidación y de reducción c) Escribe el esquema de la pila que se puede formar con dicha
Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno.
 PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 001 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 001 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A
Redox 10. Fig.1. Fig.2
 Redox 10 Foto 1 Foto 2 181. Si se dispone una moneda de cobre, sobre una disolución de nitrato de plata (foto 1), los resultados se aprecian en la foto 2. Se ha obtenido lo que fue llamado un árbol de
Redox 10 Foto 1 Foto 2 181. Si se dispone una moneda de cobre, sobre una disolución de nitrato de plata (foto 1), los resultados se aprecian en la foto 2. Se ha obtenido lo que fue llamado un árbol de
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
Electrólisis. Laboratorio de físico-química Universidad de La Serena. Rodrigo Araya Cortes. Pedagogía en Química y Ciencias naturales
 Electrólisis Laboratorio de físico-química Universidad de La Serena Rodrigo Araya Cortes Pedagogía en Química y Ciencias naturales Jueves 01 de octubre del 2009 Electrolisis Objetivos: o o o o Aprender
Electrólisis Laboratorio de físico-química Universidad de La Serena Rodrigo Araya Cortes Pedagogía en Química y Ciencias naturales Jueves 01 de octubre del 2009 Electrolisis Objetivos: o o o o Aprender
Zn 2e Zn +2 proceso de oxidación Ánodo Polo negativo. Cu e Cu proceso de reducción Cátodo Polo positivo. Zn + Cu +2 Zn+2 + Cu
 Tema 4(II).PILAS Y CELDAS ELECTROLÍTICAS PILAS GALVÁNICAS Los procesos redox son procesos de transferencia de electrones. Podemos aprovechar tales procesos para producir corriente eléctrica si conseguimos
Tema 4(II).PILAS Y CELDAS ELECTROLÍTICAS PILAS GALVÁNICAS Los procesos redox son procesos de transferencia de electrones. Podemos aprovechar tales procesos para producir corriente eléctrica si conseguimos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2016 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 016 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 016 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
de todos los dados el correcto será el: a) A b) B c) C d) D
 Redox 3 41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de
Redox 3 41*. Uno de los experimentos que puedes hacer perfectamente en el laboratorio y que te permitiría recordar el proceso de la pila Daniell, sería sumergir una lámina o chapa de cinc en un vaso de
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
ELECTRÓLISIS. Electrólisis de sales fundidas
 El proceso por el cual se produce una reacción química a partir de una energía eléctrica se denomina electrólisis. Y se lleva a cabo en un dispositivo que se conoce como cuba o celda electrolítica. Este
El proceso por el cual se produce una reacción química a partir de una energía eléctrica se denomina electrólisis. Y se lleva a cabo en un dispositivo que se conoce como cuba o celda electrolítica. Este
EQUILIBRIO QUÍMICO 2
 EQUILIBRIO QUÍMICO 2 Los desplazamientos de equilibrio con la transferencia de energía. Termómetros químicos. Muchos de los intercambios de ligandos en la formación de complejos ocurren con absorción o
EQUILIBRIO QUÍMICO 2 Los desplazamientos de equilibrio con la transferencia de energía. Termómetros químicos. Muchos de los intercambios de ligandos en la formación de complejos ocurren con absorción o
Tecnólogo en Minería Química I. PRÁCTICO DE LABORATORIO Reacciones Redox
 Tecnólogo en Minería Química I PRÁCTICO DE LABORATORIO Reacciones Redox I. INTRODUCCIÓN Las reacciones redox se encuentran entre las reacciones más comunes. Son aquellas que involucran la transferencia
Tecnólogo en Minería Química I PRÁCTICO DE LABORATORIO Reacciones Redox I. INTRODUCCIÓN Las reacciones redox se encuentran entre las reacciones más comunes. Son aquellas que involucran la transferencia
ELECTROLISIS. QUÍMICA 2º bachillerato. 29/05/201
 ELECTROLISIS QUÍMICA 2º bachillerato 29/05/201 www.profesorjano.org www.profesorjano.com www.profesorjano.info 1 ESQUEMA GENERAL Definición - Diferencias con una pila (1) Descripción cualitativa: Electrolisis
ELECTROLISIS QUÍMICA 2º bachillerato 29/05/201 www.profesorjano.org www.profesorjano.com www.profesorjano.info 1 ESQUEMA GENERAL Definición - Diferencias con una pila (1) Descripción cualitativa: Electrolisis
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
Complejos del Co (continuación)
 Complejos del Co (continuación) Los compuestos de coordinación del cobalto(iii), que fueron los primeros estudiados, son difíciles de obtener, puesto que son menos estables que los de Co(II) vistos con
Complejos del Co (continuación) Los compuestos de coordinación del cobalto(iii), que fueron los primeros estudiados, son difíciles de obtener, puesto que son menos estables que los de Co(II) vistos con
PROBLEMA VISUALES DE QUÍMICA. PVQ14-1*** Aproximación al Número de Avogadro. Fotografía 2. Fotografía 1
 PROBLEMA VISUALES DE QUÍMICA PVQ1-1*** Aproximación al Número de Avogadro Fotografía Fotografía 1 Las fotografías dadas visualizan un experimento que popularizó Langmuir en 1919, para calcular aproximadamente
PROBLEMA VISUALES DE QUÍMICA PVQ1-1*** Aproximación al Número de Avogadro Fotografía Fotografía 1 Las fotografías dadas visualizan un experimento que popularizó Langmuir en 1919, para calcular aproximadamente
REACCIONES DE OXIDACIÓN-REDUCCIÓN
 10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
Problemas de electrolisis. Resueltos
 Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
Problemas de electrolisis Resueltos Problemas 5,6 y 7 de la hoja de refuerzo Tambien estan al final de la hoja con enunciados de ejecicios PAU Serie refuerzo electroquímica 5 Se realiza la electrólisis
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
Unidad 8 Reacciones de oxidaciónreducción
 Unidad 8 Reacciones de oxidaciónreducción 1. Reacciones de Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. 2 2. Número de oxidación
Unidad 8 Reacciones de oxidaciónreducción 1. Reacciones de Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. 2 2. Número de oxidación
PROBLEMAS QUÍMICA 2º BACHILLERATO ELECTRÓLISIS
 PROBLEMAS QUÍMICA 2º BACHILLERATO ELECTRÓLISIS 1. A través de una cuba electrolítica que contiene una disolución de nitrato de cobalto (II) pasa una corriente eléctrica durante 30 minutos, depositándose
PROBLEMAS QUÍMICA 2º BACHILLERATO ELECTRÓLISIS 1. A través de una cuba electrolítica que contiene una disolución de nitrato de cobalto (II) pasa una corriente eléctrica durante 30 minutos, depositándose
OXIDACIÓN REDUCCIÓN QCA 09 ANDALUCÍA
 OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA - (TIPO I)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA - (TIPO I) Las preguntas de este tipo constan de un enunciado y de cuatro posibilidades de respuesta, entre las cuales debe escoger la que considere
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA - (TIPO I) Las preguntas de este tipo constan de un enunciado y de cuatro posibilidades de respuesta, entre las cuales debe escoger la que considere
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS REACCIONES DE TRANSFERENCIA DE ELECTRONES
 CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS 2001-2012 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. El KMnO 4, en medio ácido sulfúrico, reacciona con el H 2 O 2 para dar MnSO
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS 2001-2012 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. El KMnO 4, en medio ácido sulfúrico, reacciona con el H 2 O 2 para dar MnSO
DETERMINACION DE CLORUROS Y ALCALINIDAD PARTE N INSTRUCCIONES
 DETERMINACION DE CLORUROS Y ALCALINIDAD PARTE N 144-50 INSTRUCCIONES EQUIPAMIENTO: Cantidad Descripción Parte N 1 Plato de Titulación, polietileno 153-26 2 Varillas de Agitación, polietileno 153-28 2 Pipeta,
DETERMINACION DE CLORUROS Y ALCALINIDAD PARTE N 144-50 INSTRUCCIONES EQUIPAMIENTO: Cantidad Descripción Parte N 1 Plato de Titulación, polietileno 153-26 2 Varillas de Agitación, polietileno 153-28 2 Pipeta,
ELECTROQUÍMICA. Se discutirán en la clase práctica algunos de los siguientes ejercicios de Brown: Capítulo 20: 5, 7, 13, 21, 23, 33, 39, 47, 51
 REPARTIDO 8 ELECTROQUÍMICA 2007 Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Capítulo 20, 723-761 APENDICE E Ejercicios
REPARTIDO 8 ELECTROQUÍMICA 2007 Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Capítulo 20, 723-761 APENDICE E Ejercicios
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
REACCIONES RED-OX QCA 01
 1.- Una muestra de un metal se disuelve en ácido clorhídrico y se realiza la electrólisis de la disolución. Cuando han pasado por la célula electrolítica 315 C, se encuentra que en el cátodo se han depositado
1.- Una muestra de un metal se disuelve en ácido clorhídrico y se realiza la electrólisis de la disolución. Cuando han pasado por la célula electrolítica 315 C, se encuentra que en el cátodo se han depositado
COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA II TERCER SEMESTRE
 COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA II TERCER SEMESTRE PRACTICA # 1 CAMBIOS QUÍMICOS OBJETIVO DE LA PRÁCTICA: Identificar que los cambios químicos están acompañados
COLEGIO DE BACHILLERES PLANTEL 5 SATÉLITE PRÁCTICAS DE LABORATORIO QUÍMICA II TERCER SEMESTRE PRACTICA # 1 CAMBIOS QUÍMICOS OBJETIVO DE LA PRÁCTICA: Identificar que los cambios químicos están acompañados
Reacciones redox espontáneas
 Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
RESUMEN DE ELECTROQUÍMICA 2ºBACH
 Toda reacción redox consiste en una transferencia de electrones desde la sustancia que se oxida (reductor)a la que se reduce (oxidante.) Una reacción redox espontánea permite obtener una corriente eléctrica.
Toda reacción redox consiste en una transferencia de electrones desde la sustancia que se oxida (reductor)a la que se reduce (oxidante.) Una reacción redox espontánea permite obtener una corriente eléctrica.
REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016
 REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016 1- Se lleva a cabo la electrolisis de una disolución acuosa de bromuro de sodio 1 M, haciendo pasar una corriente de 1,5 A durante 90 minutos. a) Ajuste
REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016 1- Se lleva a cabo la electrolisis de una disolución acuosa de bromuro de sodio 1 M, haciendo pasar una corriente de 1,5 A durante 90 minutos. a) Ajuste
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX
 TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS
 1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
ELECTROQUÍMICA. 1. Conceptos de oxidación-reducción
 ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
OXIDACIÓN REDUCCIÓN QCA 07 ANDALUCÍA
 .- Se realiza la electrolisis de litros de una disolución de nitrato de plata 0 M haciendo pasar una corriente eléctrica de 0 5 amperios durante 4 horas. Calcule: a) La masa de plata que se deposita en
.- Se realiza la electrolisis de litros de una disolución de nitrato de plata 0 M haciendo pasar una corriente eléctrica de 0 5 amperios durante 4 horas. Calcule: a) La masa de plata que se deposita en
-0,36-0,44 Zn 2+ +2e Zn -0,76 Mn 2+ +2e Mn -1,19 Al 3+ +3e Al -1,66 Mg 2+ +2e Mg -2,37 Na + +e Na -2,71 K + +e K -2,92 Li + +e Li -3,05
 Redox 2 21*. El número de oxidación, índice de oxidación o estado de oxidación fue definido por primera vez en 1880, por el inglés Otis Coe Johnson, como el número de cargas que un elemento aporta a la
Redox 2 21*. El número de oxidación, índice de oxidación o estado de oxidación fue definido por primera vez en 1880, por el inglés Otis Coe Johnson, como el número de cargas que un elemento aporta a la
Física y Química 4º ESO: guía interactiva para la resolución de ejercicios
 REACCIONES QUÍMICAS Oxidación reducción. Pilas Física y Química º ESO: guía interactiva para la resolución de ejercicios I.E.S. Élaios Departamento de Física y Química EJERCICIO 1 Indica cuáles de las
REACCIONES QUÍMICAS Oxidación reducción. Pilas Física y Química º ESO: guía interactiva para la resolución de ejercicios I.E.S. Élaios Departamento de Física y Química EJERCICIO 1 Indica cuáles de las
REACCIONES REDOX CON DICROMATO POTÁSICO
 REACCIONES REDOX CON DICROMATO POTÁSICO Se han comenzado los trabajos de Química a la gota con las reacciones redox del permanganato potásico, un oxidante característico y visualmente muy interesante por
REACCIONES REDOX CON DICROMATO POTÁSICO Se han comenzado los trabajos de Química a la gota con las reacciones redox del permanganato potásico, un oxidante característico y visualmente muy interesante por
Estado de oxidación (E.O.)
 Reacciones Redox Estado de oxidación (E.O.) Es la carga que tendría un átomo si todos sus enlaces fueran iónicos. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones
Reacciones Redox Estado de oxidación (E.O.) Es la carga que tendría un átomo si todos sus enlaces fueran iónicos. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones
Reacciones Redox. Química General e Inorgánica Ingeniería Ambiental
 Reacciones Redox Hasta esta guía hemos aprendido a balancear ecuaciones químicas sencillas por tanteo, pero muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo
Reacciones Redox Hasta esta guía hemos aprendido a balancear ecuaciones químicas sencillas por tanteo, pero muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo
Redox 7. la única correcta, sería la: a) A b)b c)c d)d
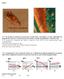 Redox 7 121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará
Redox 7 121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará
Ordenar, de menor a mayor solubilidad, los siguientes compuestos de cobre: Cu(OH) 2, CuCO 3, CuSO 4, CuS y Cu 2 [Fe(CN) 6 ].
![Ordenar, de menor a mayor solubilidad, los siguientes compuestos de cobre: Cu(OH) 2, CuCO 3, CuSO 4, CuS y Cu 2 [Fe(CN) 6 ]. Ordenar, de menor a mayor solubilidad, los siguientes compuestos de cobre: Cu(OH) 2, CuCO 3, CuSO 4, CuS y Cu 2 [Fe(CN) 6 ].](/thumbs/87/95356961.jpg) 13. Equilibrios de Solubilidad Elaborada por: Dr. Ruy Cervantes Díaz de Guzmán Pregunta a responder al final de la sesión Ordenar, de menor a mayor solubilidad, los siguientes compuestos de cobre: Cu(OH)
13. Equilibrios de Solubilidad Elaborada por: Dr. Ruy Cervantes Díaz de Guzmán Pregunta a responder al final de la sesión Ordenar, de menor a mayor solubilidad, los siguientes compuestos de cobre: Cu(OH)
7º) En la tabla siguiente se indican los potenciales estándar de distintos pares en disolución acuosa: Fe2+/Fe = - 0,44 V Cu2+/Cu = 0,34 V
 EJERCICIOS DE OXIDACIÓN Y REDUCCIÓN 1º) Ajuste las siguientes ecuaciones iónicas, en medio ácido, por el método del ión-electrón: a) MnO4 + I Mn2+ + I2 b) VO43 + Fe2+ VO2+ + Fe3+ c) Cl2 + I Cl + I2 2º)
EJERCICIOS DE OXIDACIÓN Y REDUCCIÓN 1º) Ajuste las siguientes ecuaciones iónicas, en medio ácido, por el método del ión-electrón: a) MnO4 + I Mn2+ + I2 b) VO43 + Fe2+ VO2+ + Fe3+ c) Cl2 + I Cl + I2 2º)
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio 6, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio 6, Opción B
PILAS Y ELECTRÓLISIS. Foto: Gabriel Acquistapace
 PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA
 QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
-0,36-0,44 Zn 2+ +2e Zn -0,76 Mn 2+ +2e Mn -1,19 Al 3+ +3e Al -1,66 Mg 2+ +2e Mg -2,37 Na + +e Na -2,71 K + +e K -2,92 Li + +e Li -3,05
 Redox 8 141*. Las primeras electrólisis fueran realizadas por el inglés Humphrey Davy, a principios del siglo XIX, tan pronto se desarrollaron las pilas de Volta, y se realizaron en sólidos fundidos. Para
Redox 8 141*. Las primeras electrólisis fueran realizadas por el inglés Humphrey Davy, a principios del siglo XIX, tan pronto se desarrollaron las pilas de Volta, y se realizaron en sólidos fundidos. Para
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
ELECTROQUÍMICA. 1- Concepto de potencial normal. Electrodo de referencia
 ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
(masa atómica y carga), de la intensidad de la corriente y del tiempo. Son correctas las propuestas a,c y d.
 Redo 9 6. En 8, Faraday propone que a acción química de una corriente eléctrica es directamente proporcional a la cantidad de electricidad que pasa.eso quiere decir que, cuando en un cátodo se deposan
Redo 9 6. En 8, Faraday propone que a acción química de una corriente eléctrica es directamente proporcional a la cantidad de electricidad que pasa.eso quiere decir que, cuando en un cátodo se deposan
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 6, Opción B Reserva 3, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 6, Opción B Reserva 3, Ejercicio 3, Opción
Procesos de Oxidación-Reducción
 2012 Procesos de Oxidación-Reducción TERMINOLOGIA La Electroquímicaes la rama de la química que estudia la transformación entre la energía eléctrica y la energía química. Material preparado por: Licda.Victoria
2012 Procesos de Oxidación-Reducción TERMINOLOGIA La Electroquímicaes la rama de la química que estudia la transformación entre la energía eléctrica y la energía química. Material preparado por: Licda.Victoria
NOTA CALI/ORDEN/PRES ORTOGRAFÍA PUNTUACIÓN EXPRESIÓN NOTA FINAL
 1.- Formule o nombre los compuestos siguientes: a) Nitrito de escandio b) Peróxido de plata c) Ácido 2-hidroxiprop-2-enoico d) NH 4 H 2 PO 4 e) Y(CN) 3 f) C H 2 =CHCON(CH 3 ) 2 Res. a) Sc(NO 2 ) 3 ; b)
1.- Formule o nombre los compuestos siguientes: a) Nitrito de escandio b) Peróxido de plata c) Ácido 2-hidroxiprop-2-enoico d) NH 4 H 2 PO 4 e) Y(CN) 3 f) C H 2 =CHCON(CH 3 ) 2 Res. a) Sc(NO 2 ) 3 ; b)
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca
 1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química
 1 Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química 1. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado
1 Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química 1. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado
REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015
 REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015 1- El permanganato de potasio actúa como oxidante en medio ácido, dando como producto Mn 2+. Por el contrario, como oxidante en medio básico el
REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015 1- El permanganato de potasio actúa como oxidante en medio ácido, dando como producto Mn 2+. Por el contrario, como oxidante en medio básico el
TRABAJO PRÁCTICO N 9 ÓXIDO-REDUCCIÓN
 TRABAJO PRÁCTICO N 9 ÓXIDO-REDUCCIÓN Las reacciones químicas de óxido - reducción (reacciones redox) son aquellas en las cuales se produce una transferencia de electrones. Son las reacciones donde se producen
TRABAJO PRÁCTICO N 9 ÓXIDO-REDUCCIÓN Las reacciones químicas de óxido - reducción (reacciones redox) son aquellas en las cuales se produce una transferencia de electrones. Son las reacciones donde se producen
Práctica 13. Equilibrios de solubilidad
 Práctica 13. Equilibrios de solubilidad ELABORADO POR: LAURA GASQUE SILVA ENUNCIADO A RESPONDER AL FINAL DE LA PRÁCTICA En sales poco solubles cuando el valor de (K ps /pk ps ), se (incrementa/disminuye),
Práctica 13. Equilibrios de solubilidad ELABORADO POR: LAURA GASQUE SILVA ENUNCIADO A RESPONDER AL FINAL DE LA PRÁCTICA En sales poco solubles cuando el valor de (K ps /pk ps ), se (incrementa/disminuye),
EJERCICIOS RESUELTOS DE REDOX
 EJERCICIOS RESUELTOS DE REDOX 1. Al hacer reaccionar cobre metálico con ácido nítrico diluido se obtiene monóxido de nitrógeno y nitrato de cobre (II). Plantee, iguale y complete la ecuación redox correspondiente,
EJERCICIOS RESUELTOS DE REDOX 1. Al hacer reaccionar cobre metálico con ácido nítrico diluido se obtiene monóxido de nitrógeno y nitrato de cobre (II). Plantee, iguale y complete la ecuación redox correspondiente,
Tema 9: Electroquímica
 1.Dado el siguiente diagrama de una celda electroquímica: Pt(s) H 2 (g) H + (ac) Ag + (ac) Ag(s) Cual es la reacción global balanceada de la celda? A) 2H + (ac) + 2Ag + (ac) H 2 (g) + 2Ag(s) B) H 2 (g)
1.Dado el siguiente diagrama de una celda electroquímica: Pt(s) H 2 (g) H + (ac) Ag + (ac) Ag(s) Cual es la reacción global balanceada de la celda? A) 2H + (ac) + 2Ag + (ac) H 2 (g) + 2Ag(s) B) H 2 (g)
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 15 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 15 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
Práctica 13. Equilibrios de solubilidad
 Práctica 13. Equilibrios de solubilidad ELABORADO POR: LAURA GASQUE SILVA ENUNCIADO A RESPONDER AL FINAL DE LA PRÁCTICA En sales poco solubles cuando el valor de (K ps /pk ps ), se (incrementa/disminuye),
Práctica 13. Equilibrios de solubilidad ELABORADO POR: LAURA GASQUE SILVA ENUNCIADO A RESPONDER AL FINAL DE LA PRÁCTICA En sales poco solubles cuando el valor de (K ps /pk ps ), se (incrementa/disminuye),
Práctica 11 Equilibrios de Solubilidad
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Nombre: 1 PROBLEMAS: Práctica 11 Equilibrios de Solubilidad
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA LABORATORIO DE QUÍMICA GENERAL II Grupo: Equipo: Nombre: Nombre: Nombre: Nombre: Nombre: 1 PROBLEMAS: Práctica 11 Equilibrios de Solubilidad
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA QUÍMICA TEMA 7: REACCIONES REDOX.
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 7: REACCIONES REDOX http://emestrada.wordpress.com Dada la siguiente reacción redox en disolución acuosa: KMnO + KI + HSO I + MnSO + K SO + HO
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 7: REACCIONES REDOX http://emestrada.wordpress.com Dada la siguiente reacción redox en disolución acuosa: KMnO + KI + HSO I + MnSO + K SO + HO
Reacciones de transferencia de electrones
 DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO Actividades tema 8 Reacciones de transferencia de electrones Reacciones de oxidación-reducción 1.-Asigna el número
DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO Actividades tema 8 Reacciones de transferencia de electrones Reacciones de oxidación-reducción 1.-Asigna el número
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2009 PRIMERA PARTE
 1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
1 PAU Química. Junio 2009 PRIMERA PARTE Cuestión 1. La primera y segunda energía de ionización para el átomo A, cuya configuración electrónica es 1s 2 2s 1, son 520 y 7300 kj mol 1, respectivamente: a)
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
Reacciones de transferencias de electrones
 Reacciones de transferencias de electrones 5. Ajustar reacciones de oxidación-reducción y aplicarlas a problemas estequiométricos. Saber el significado de potencial estándar de reducción de un par redox,
Reacciones de transferencias de electrones 5. Ajustar reacciones de oxidación-reducción y aplicarlas a problemas estequiométricos. Saber el significado de potencial estándar de reducción de un par redox,
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA 1 REACIONES DE OXIDACIÓNREDUCCIÓN Son aquellas en las que se produce una transferencia de electrones entre dos sustancias.
REACCIONES DE TRANSFERENCIA DE ELECTRONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA 1 REACIONES DE OXIDACIÓNREDUCCIÓN Son aquellas en las que se produce una transferencia de electrones entre dos sustancias.
Unidad 6: ELECTROQUIMICA
 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
1atm OPCIÓN A. Solución:
 OPCIÓN A CUESTIÓN.- Si se preparan disoluciones 0,5 M de NH 3, NaCl, NaOH y NH Cl: a) Justifica de forma cualitativa cuál de ellas tendrá el ph más bajo. b) Elige de forma razonada una pareja que forme
OPCIÓN A CUESTIÓN.- Si se preparan disoluciones 0,5 M de NH 3, NaCl, NaOH y NH Cl: a) Justifica de forma cualitativa cuál de ellas tendrá el ph más bajo. b) Elige de forma razonada una pareja que forme
PRÁCTICA 18 ELECTROQUÍMICA 1.- FUNDAMENTO TEÓRICO.
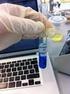 PRÁCTICA 18 ELECTROQUÍMICA 1.- FUNDAMENTO TEÓRICO. El concepto de Electroquímica implica transformaciones que requieren la presencia de electrodos. Dos electrodos sumergidos en un electrólito y unidos
PRÁCTICA 18 ELECTROQUÍMICA 1.- FUNDAMENTO TEÓRICO. El concepto de Electroquímica implica transformaciones que requieren la presencia de electrodos. Dos electrodos sumergidos en un electrólito y unidos
4. Un agente oxidante (2 correctas) A) Toma electrones de otra sustancia B) Da electrones a otra sustancia C) Se oxida D) Se reduce
 CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
QUÍMICA. Br (g) [ΔH afinidad Br(g)] = - 324,6 kj mol - (0,25 puntos) ½ [ΔH D Br 2 (g)] = 1 96,5 kj mol -1 Na + (g) + Br - (g)
![QUÍMICA. Br (g) [ΔH afinidad Br(g)] = - 324,6 kj mol - (0,25 puntos) ½ [ΔH D Br 2 (g)] = 1 96,5 kj mol -1 Na + (g) + Br - (g) QUÍMICA. Br (g) [ΔH afinidad Br(g)] = - 324,6 kj mol - (0,25 puntos) ½ [ΔH D Br 2 (g)] = 1 96,5 kj mol -1 Na + (g) + Br - (g)](/thumbs/76/73887985.jpg) OPCIÓN A QUÍMICA 1. (2,5 puntos) Construya el ciclo de Born-Haber para la formación del NaBr(s), a partir de bromo líquido y sodio metálico, y calcule la energía de red (ΔH red ) del compuesto, a partir
OPCIÓN A QUÍMICA 1. (2,5 puntos) Construya el ciclo de Born-Haber para la formación del NaBr(s), a partir de bromo líquido y sodio metálico, y calcule la energía de red (ΔH red ) del compuesto, a partir
DEMOSTRAR LAS DIFERENTES CONDUCTIVIDADES DE LOS LIQUIDOS. Está diseñada para demostrar que el flujo de corriente eléctrica sólo es
 INFORME: CORROSIÓN ELECTROQUÍMICA NOMBRE: GRUPO: CORROSION 1 DEMOSTRAR LAS DIFERENTES CONDUCTIVIDADES DE LOS LIQUIDOS Está diseñada para demostrar que el flujo de corriente eléctrica sólo es posible a
INFORME: CORROSIÓN ELECTROQUÍMICA NOMBRE: GRUPO: CORROSION 1 DEMOSTRAR LAS DIFERENTES CONDUCTIVIDADES DE LOS LIQUIDOS Está diseñada para demostrar que el flujo de corriente eléctrica sólo es posible a
PAAU (LOXSE) Xuño 2008
 PAAU (LOXSE) Xuño 2008 Código: 31 QUÍMICA CALIFICACIÓN: CUESTIONES =2 PUNTOS CADA UNA; PROBLEMAS: 2 PUNTOS CADA UNO; PRÁCTICA: 2 PUNTOS CUESTIONES (Responda SOLAMENTE a DOS de las siguientes cuestiones)
PAAU (LOXSE) Xuño 2008 Código: 31 QUÍMICA CALIFICACIÓN: CUESTIONES =2 PUNTOS CADA UNA; PROBLEMAS: 2 PUNTOS CADA UNO; PRÁCTICA: 2 PUNTOS CUESTIONES (Responda SOLAMENTE a DOS de las siguientes cuestiones)
Examen de recuperación de la 3ª evaluación de Química de 2º de Bachillerato
 Examen de recuperación de la 3ª evaluación de Química de 2º de Bachillerato Nombre: Fecha: 1. En medio ácido, el ion permanganato (MnO - 4 ) se utiliza como agente oxidante fuerte. Conteste razonadamente
Examen de recuperación de la 3ª evaluación de Química de 2º de Bachillerato Nombre: Fecha: 1. En medio ácido, el ion permanganato (MnO - 4 ) se utiliza como agente oxidante fuerte. Conteste razonadamente
Ejercicios de acceso a la Universidad Problemas de Electroquímica
 Ejercicios de acceso a la Universidad Problemas de Electroquímica 57 Dada la reacción en la que el ión permanganato [tetraoxomanganato(vii)] oxida, en medio ácido, al dióxido de azufre, obteniéndose ión
Ejercicios de acceso a la Universidad Problemas de Electroquímica 57 Dada la reacción en la que el ión permanganato [tetraoxomanganato(vii)] oxida, en medio ácido, al dióxido de azufre, obteniéndose ión
PIP 4º ESO IES SÉNECA TRABAJO EXPERIMENTAL EN FÍSICA Y QUÍMICA
 1. REACCIÓN REDOX Una reacción redox muy conocida es la reducción del permanganato. Si dicho proceso se lleva a cabo en medio ácido, el ion permanganato (MnO4 - ), de color violeta intenso en disolución,
1. REACCIÓN REDOX Una reacción redox muy conocida es la reducción del permanganato. Si dicho proceso se lleva a cabo en medio ácido, el ion permanganato (MnO4 - ), de color violeta intenso en disolución,
PILAS ELECTROQUÍMICAS
 PILAS ELECTROQUÍMICAS Las pilas electroquímicas se llaman también células galvánicas, células electroquímicas, pilas galvánicas, pilas voltaicas, pilas eléctricas o, simplemente, pilas. Como ya hemos visto,
PILAS ELECTROQUÍMICAS Las pilas electroquímicas se llaman también células galvánicas, células electroquímicas, pilas galvánicas, pilas voltaicas, pilas eléctricas o, simplemente, pilas. Como ya hemos visto,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción A Reserva 3, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 5, Opción A Reserva 3, Ejercicio 3, Opción
Métodos analíticos cuantitativos basados en las propiedades eléctricas de una solución de analito cuando forma parte de una celda electroquímica
 POTENCIOMETRÍA Química electroanalítica Métodos analíticos cuantitativos basados en las propiedades eléctricas de una solución de analito cuando forma parte de una celda electroquímica Electroquímica Conversión
POTENCIOMETRÍA Química electroanalítica Métodos analíticos cuantitativos basados en las propiedades eléctricas de una solución de analito cuando forma parte de una celda electroquímica Electroquímica Conversión
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
PVQ28-1.**. Mezcla de Fe/S con ácido sulfúrico reaccionando sobre sulfato de cobre(ii)
 PROBLEMAS VISUALES DE QUÍMICA PVQ8-1.**. Mezcla de Fe/S con ácido sulfúrico reaccionando sobre sulfato de cobre(ii) En A se disponen 5,6 de Fe y 3,g de azufre,y 10mL de ácido sulfúrico 6N,y en B, 30mL
PROBLEMAS VISUALES DE QUÍMICA PVQ8-1.**. Mezcla de Fe/S con ácido sulfúrico reaccionando sobre sulfato de cobre(ii) En A se disponen 5,6 de Fe y 3,g de azufre,y 10mL de ácido sulfúrico 6N,y en B, 30mL
Unidad 7 Redox. La ecuación iónica sin ajustar con los números de oxidación:
 OPCIÓN A Unidad 7 Redox 1. Indique cual es el oxidante y cual es el reductor en los siguientes procesos de oxidación-reducción, sin ajustar: (2 p) El oxidante será aquel elemento que gane electrones (se
OPCIÓN A Unidad 7 Redox 1. Indique cual es el oxidante y cual es el reductor en los siguientes procesos de oxidación-reducción, sin ajustar: (2 p) El oxidante será aquel elemento que gane electrones (se
TEMA - 9. DATOS: R = 0,082 atm L K. (Sol: b) 0.05 M;; c) V = 28 ml)
 TEMA - 9 1.- El análisis químico del agua oxigenada (peróxido de hidrógeno), se realiza disolviendo la muestra en ácido sulfúrico diluido y valorando con una disolución de permanganato potásico, según
TEMA - 9 1.- El análisis químico del agua oxigenada (peróxido de hidrógeno), se realiza disolviendo la muestra en ácido sulfúrico diluido y valorando con una disolución de permanganato potásico, según
DETERMINACION DE CLORUROS, ALCALINIDAD Y DUREZA PARTE N INSTRUCCIONES
 DETERMINACION DE CLORUROS, ALCALINIDAD Y DUREZA PARTE N 144-80 INSTRUCCIONES EQUIPAMIENTO PARA DETERMINACION DE CLORURO Y ALCALINIDAD Cantidad Descripción Parte N 1 Tasa de Titilación, Polietileno 153-26
DETERMINACION DE CLORUROS, ALCALINIDAD Y DUREZA PARTE N 144-80 INSTRUCCIONES EQUIPAMIENTO PARA DETERMINACION DE CLORURO Y ALCALINIDAD Cantidad Descripción Parte N 1 Tasa de Titilación, Polietileno 153-26
Práctica 11: Equilibrios de Solubilidad
 Equipo: Nombre: Nombre: Nombre: Práctica 11: Equilibrios de Solubilidad PROBLEMAS: Ordenar, de menor a mayor solubilidad, los siguientes compuestos de cobre: Cu(OH) 2, CuCO 3, CuSO 4, Cu (S) y Cu 2 [Fe(CN)
Equipo: Nombre: Nombre: Nombre: Práctica 11: Equilibrios de Solubilidad PROBLEMAS: Ordenar, de menor a mayor solubilidad, los siguientes compuestos de cobre: Cu(OH) 2, CuCO 3, CuSO 4, Cu (S) y Cu 2 [Fe(CN)
