Unidad 6: ELECTROQUIMICA
|
|
|
- Vicenta Zúñiga Hernández
- hace 7 años
- Vistas:
Transcripción
1 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación: Pérdida de electrones por un átomo, ion o molécula (aumenta el número de oxidación). Reducción: Ganancia de electrones por un átomo, ion o molécula (disminuye el número de oxidación). Una reacción de oxidación reducción es una reacción en la cual ocurren simultáneamente la oxidación y la reducción porque el número de electrones perdidos en la oxidación debe ser igual al número de electrones ganados en la reducción. Agente reductor: Sustancia que se oxida (pierde electrones, aumenta el número de oxidación). Agente oxidante: Sustancia que se reduce (gana electrones, disminuye el número de oxidación). Ejemplo de reacción de oxidación reducción: 2 Na + Cl 2 2NaCl Semi reacción de oxidación: 2 Na 2 Na e - Semi reacción de reducción: Cl e - 2 Cl - Agente reductor: Na ; Agente oxidante: Cl 2. EJERCICIO: determinar en cada caso si se trata de una oxidación o una reducción a. Fe Fe 2+ b. Cu 2+ Cu c. Fe 3+ Fe 2+ d. Sn 4+ Sn 2+ ELECTROQUIMICA La electroquímica es la parte de la química que estudia las relaciones entre las reacciones de oxidación reducción y la energía eléctrica. Si una reacción química se produce espontáneamente puede, bajo condiciones apropiadas, producir energía eléctrica: obtención de celdas electroquímicas o pilas galvánicas. Si un proceso no es espontáneo puede ocurrir, bajo condiciones apropiadas, si se le suministra energía eléctrica: electrólisis o celdas electrolíticas. Cuando se introduce una lámina de cinc en una solución acuosa de CuSO 4 se produce una reacción de oxidación reducción espontánea: se forma un depósito rojizo de cobre sobre la superficie del cinc; la solución inicialmente azul va perdiendo su color; la lámina de cinc se empieza a disolver y la temperatura de la solución aumenta. La reacción es: Zn Zn e -. (Semi reacción de oxidación). Cu e - Cu. (Semi reacción de reducción). Para utilizar una reacción espontánea de oxidación reducción en producción de corriente eléctrica, es necesario que las semi - reacciones de oxidación y de reducción no estén en contacto sino en recipientes separados, llamadas semiceldas, para que los electrones involucrados en el proceso circulen primero por un conductor metálico externo.
2 2 CELDAS ELECTROQUIMICAS O GALVANICAS Una semicelda electroquímica está constituída por una lámina metálica llamada electrodo, sumergida en una solución acuosa de sus iones, llamada electrólito. Un metal en contacto con una solución 1 M de sus iones a 25 º C y 1 atm, constituye una semicelda normal o patrón. Equilibrio dinámico entre el Zn Equilibrio dinámico entre el Cu sólido (electrodo) y los iones sólido (electrodo) y los iones Zn 2+ de la solución: Cu 2+ de la solución: Zn Zn e - Cu Cu e - Semicelda normal Semicelda normal El puente salino que une las dos semiceldas es un tubo de vidrio con una solución de una sal apropiada (KNO 3 en este caso), taponado en los extremos con un material poroso. Este puente comunica eléctricamente las dos semiceldas ya que los iones K + y NO 3 - pueden migrar de un lado a otro, pero al mismo tiempo evita que se mezclen los iones Cu 2+ y Zn 2+. El circuito externo consta de un conductor metálico (alambre de cobre) y un voltímetro par medir la diferencia de potencial. El flujo de corriente lo ocasiona la reacción que sucede en la semicelda de Zn donde éste se disuelve (se oxida) por pérdida de electrones: Zn Zn e -. (Semirreación de oxidación). Los electrones cedidos por el electrodo de Zn fluyen por el alambre metálico externo hacia el electrodo de Cu donde se deposita cobre metálico pues los iones Cu 2+ de la solución de la semicelda de Cu ganan electrones: Cu e - Cu (Semirreacción de reducción) La reacción neta es: Zn Zn e -. Cu e - Cu Zn + Cu 2+ Zn 2+ + Cu Reacción neta
3 A medida que la reacción avanza la concentración de iones Zn 2+ aumenta en las cercanías del electrodo de cinc y disminuye la concentración de iones Cu 2+ en las cercanías del electrodo de cobre (aumentando en este sitio la concentración de iones SO ). Entonces, para evitar el desbalance de carga eléctrica los iones NO 3 del puente salino fluyen hacia la semicelda de cinc neutralizando el exceso de iones Zn 2+ y los iones K + del puente salino migran hacia la semicelda de cobre neutralizando el exceso de iones SO 2-4. Por tanto, el puente salino sirve para que las soluciones no se mezclen y para mantener la neutralidad eléctrica. La reacción neta es espontánea porque produce energía eléctrica para encender la bombilla; produce algo de calor porque se eleva la temperatura de la solución y del alambre del circuito externo. Si la misma reacción ocurre por la simple mezcla de los reactivos solamente se libera calor. Esta pila o celda combinada se representa así: Zn / Zn 2+ (1 M) // Cu 2+ (1 M) / Cu /: Unión entre el electrodo y la solución. //: Puente salino o tabique poroso. Se escribe primero la notación de la semicelda de oxidación. La diferencia de potencial medida en el voltímetro se llama fuerza electromotriz (fem) de la celda normal o voltaje normal. Se representa por E. Para esta reacción E = 1,10 V pero sólo cuando las soluciones tienen una concentración 1 M (o sea, cuando la celda empieza a funcionar) pues cuando la corriente fluye la concentración de Zn 2+ aumenta, la de Cu 2+ disminuye y, por tanto, E disminuye. E es máximo al principio pero gradualmente desciende hasta E = 0. Cuando esto sucede la celda deja de funcionar. El voltaje de una celda puede tomarse como una medida de la tendencia de una reacción a ocurrir tal como está escrita, bajo condiciones específicas de concentraciones, temperatura y presión. Para cualquier celda: Ánodo es el electrodo donde se produce la oxidación; Cátodo es el electrodo donde ocurre la reducción. Para determinar la fuerza electromotriz o voltaje de cualquier semicelda, se usa una semicelda normal de hidrógeno tomada como patrón, a la cual se le asigna arbitrariamente potencial cero. Se conectan adecuadamente las dos semiceldas y el voltaje se le asigna a la celda que se quiere medir. Semicelda normal de hidrógeno: Un alambre de platino que termina en una lámina del mismo metal, sumergida en una solución 1 M de iones H + donde se burbujea H 2(g) a 1 atm. POTENCIAL NORMAL DE ELECTRODO 3
4 4 Pt / H 2(g, 1 atm.), H + (1 M) E o = 0,00 voltios. Medición del potencial de una semicelda de cadmio EJEMPLO: Se conecta la semicelda normal de Cu / Cu 2+ con la semicelda normal de hidrógeno Pt/H 2, H +. Al cerrar el circuito se produce una diferencia de potencial de 0,34 voltios. De esta situación se puede deducir lo siguiente: Semirreacción de oxidación (ánodo): H 2 2H e -. Semirreacción de reducción (cátodo): Cu e - Cu. Reacción neta: H 2 + Cu 2+ 2H + + Cu. La celda combinada o pila normal se representa así: Pt / H 2 (1 atm), H + (1 M) // Cu 2+ (1 M)/ Cu E o = 0,34 V Corresponde a la semirreacción Cu e - Cu. Se denomina potencial de reducción normal (se le asigna sólo a la semipila de cobre). Como E o es positivo, la reacción como está escrita es espontánea con respecto al electrodo normal de hidrógeno. Haciendo una serie de mediciones similares a la anterior se obtienen los valores de la tabla de potenciales normales de reducción a 25 º C. Todas las reacciones se escriben como reducciones. E positivo: La sustancia se reduce más fácilmente que los iones H +. E negativo: La sustancia se reduce más difícilmente que los iones H +.
5 Zn e - Zn E o = - 0,76 voltios. La semirreacción, tal como está escrita no es espontánea respecto al electrodo normal de hidrógeno. La reacción espontánea es: Zn Zn e -, E o = 0,76 V. El valor 0,76 V corresponde al potencial de oxidación del Zn. EJERCICIO: (a) Indique cuál es el cátodo, cuál el ánodo, la reacción neta y el voltaje normal, cuando se conectan adecuadamente semiceldas normales Ag +, Ag y Cu 2+, Cu. (b) Haga un esquema de la celda combinada y en él indique el flujo de los cationes, de los aniones y el de los electrones en el circuito externo. (c) Cómo se representa esta celda combinada?. 5 EJERCICIO: calcule el voltaje normal (o estándar) de la celda: Al 3+ (1 M) Al Zn Zn 2+ (1 M) La tabla de potenciales normales de reducción sirve para seleccionar las sustancias que son buenos agentes oxidantes y buenos agentes reductores: Las sustancias que aparecen a la izquierda de la doble flecha se comportan como agentes oxidantes, de ellos los que se encuentran al final de la tabla como se reducen más fácilmente son los mejores oxidantes: el F 2 es mejor oxidante que el Cl 2 ; el ion Ag + es mejor oxidante que el ion Cu 2+. Todas las medias reacciones de la tabla son reversibles. Cuando proceden de derecha a izquierda, la especie que aparece a la derecha de la tabla se comporta como agente reductor: el Li es el mejor agente reductor y el ion F - el peor. Para que una reacción sea espontánea, el E o de la oxidación más el E o de la reducción debe ser positivo. EJERCICIO: calcule el potencial estándar de la siguiente celda electroquímica Co 2+ (1 M) Co Cr (s) Cr 3+ (1 M) EJERCICIO: Determine si las siguientes reacciones son espontáneas: 1) Sn 2+ + Fe Sn + Fe 3+ 2) Pb 2+ + Cd Pb + Cd 2+ EFECTO DE LAS CONCENTRACIONES SOBRE EL POTENCIAL NORMAL. ECUACION DE NERNST. Nernst, midiendo voltajes de celdas en función de sus concentraciones, llegó a la conclusión de que para cualquier reacción general aa + bb ---> cc + dd, el voltaje E de la celda se puede expresar así: E cel = E o cel (0,059/n) log 10 ([C] c [D] d / [A] a [B] b ) donde: E cel : es el potencial a condiciones no estándar, V E o cel: es el potencial a condiciones estándar,v n: es el número de electrones transferidos [ ] = Concentraciones molares. Para sólidos y líquidos puros a 25 º C y 1 atm, la concentración se toma como la unidad.
6 6 EJERCICIO1: Para la reacción: Co + Ni > Co 2+ + Ni (a) Calcule el potencial normal de la celda. (b) Calcule el potencial de la pila cuando la concentración del Ni 2+ es 0,01 M y la de Co 2+ es 1M. EJERCICIO2: calcular el potencial de la siguiente celda Co 2+ (0,2 M) Co Cr (s) Cr 3+ (0,1 M) EJERCICIO3: calcular el potencial de la siguiente celda Al 3+ (0,01 M) Al Zn Zn 2+ (0,5 M) EJERCICIO4: calcular el potencial de la siguiente celda Fe 3+ (0,01 M),Fe 2+ (0,1 M) Cu (s) Cu 2+ (2 M)
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox)
 REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) 1 2 Tipos de reacciones redox (según su espontaneidad) Reacciones espontáneas: G
PILAS ELECTROQUIMICAS
 PILAS ELECTROQUIMICAS En las reacciones de redox existe una transferencia de electrones entre en dador (especie que se oxida) y un aceptor (especie que se reduce).esta transferencia de electrones desde
PILAS ELECTROQUIMICAS En las reacciones de redox existe una transferencia de electrones entre en dador (especie que se oxida) y un aceptor (especie que se reduce).esta transferencia de electrones desde
TEMA-11 Electroquímica
 QUÍMICA I TEMA-11 Electroquímica Tecnólogo en Minería 1 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos químicos 2 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos
QUÍMICA I TEMA-11 Electroquímica Tecnólogo en Minería 1 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos químicos 2 I n t r o d u c c i ó n Electroquímica Fenómenos eléctricos Fenómenos
OBJETIVOS ESPECÍFICOS. Al finalizar el Tema el estudiante:
 OBJETIVOS ESPECÍFICOS TEMA IV: ELECTROQUÍMICA: Al finalizar el Tema el estudiante: 1.1 Establecerá qué tipo de proceso es el que ocurre en una celda galvánica o pila. 1.2 Identificará los diferentes tipos
OBJETIVOS ESPECÍFICOS TEMA IV: ELECTROQUÍMICA: Al finalizar el Tema el estudiante: 1.1 Establecerá qué tipo de proceso es el que ocurre en una celda galvánica o pila. 1.2 Identificará los diferentes tipos
QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS
 1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
1 QUÍMICA INORGÁNICA ELECTROQUIMICA CUESTIONARIO Y RESPUESTAS 1. De qué se ocupa la electroquímica? Qué tipos de reacciones intervienen en los procesos electroquímicos? La ELECTROQUIMICA se ocupa de los
Electroquímica. Cátedra de Geoquímica
 Electroquímica Cátedra de Geoquímica 1 ELECTROQUÍMICA: Parte de la Química que estudia las reacciones en las que hay transferencia de electrones, conocidas como REDOX Dada una reacción: Identificar el
Electroquímica Cátedra de Geoquímica 1 ELECTROQUÍMICA: Parte de la Química que estudia las reacciones en las que hay transferencia de electrones, conocidas como REDOX Dada una reacción: Identificar el
ELECTROQUÍMICA. 1. Conceptos de oxidación-reducción
 ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
ELECTROQUÍMICA 1. Conceptos de oxidación-reducción Oxidación: transformación en la que una especie química pierde electrones o gana oxígeno. Reducción: transformación en la que una especie química gana
Celdas galvánicas o voltaicas
 Celdas galvánicas o voltaicas Apellidos, nombre Departamento Centro Atienza Boronat, Mª Julia (matien@qim.upv.es) Herrero Villén, Mª Asunción (maherrero@qim.upv.es) Noguera Murray, Patricia (pnoguera@qim.upv.es)
Celdas galvánicas o voltaicas Apellidos, nombre Departamento Centro Atienza Boronat, Mª Julia (matien@qim.upv.es) Herrero Villén, Mª Asunción (maherrero@qim.upv.es) Noguera Murray, Patricia (pnoguera@qim.upv.es)
Paso 2: Escribir las correspondientes semireacciones sin ajustar y. Paso 3: Ajustar en cada semireacción todos los elementos a
 Tema 21 21.1. Reacciones de oxidación-reducción Química y electricidad 21.2. Celdas electroquímicas 21.3. Potencial de electrodo 1 2 21.1. Reacciones de oxidación-reducción (redox) Son reacciones de transferencia
Tema 21 21.1. Reacciones de oxidación-reducción Química y electricidad 21.2. Celdas electroquímicas 21.3. Potencial de electrodo 1 2 21.1. Reacciones de oxidación-reducción (redox) Son reacciones de transferencia
Redox 3: Celdas electroquímicas 1
 V.Chan Celdas electroquímicas Celda electroquímica Representación simbólica de una celda Celda electroquímica: sistema en el cual se lleva a cabo una reacción redox que utiliza o consume corriente eléctrica.
V.Chan Celdas electroquímicas Celda electroquímica Representación simbólica de una celda Celda electroquímica: sistema en el cual se lleva a cabo una reacción redox que utiliza o consume corriente eléctrica.
GUÍA DE REFUERZO PRUEBA DE SÍSTESIS II SEMESTRE
 Firma Apoderado GUÍA DE REFUERZO PRUEBA DE SÍSTESIS II SEMESTRE Nombre: Curso:11 th Grade Subsector: Química Fecha: Entrega 19 de noviembre Objetivos: Evaluar los contenidos y habilidades desarrollados
Firma Apoderado GUÍA DE REFUERZO PRUEBA DE SÍSTESIS II SEMESTRE Nombre: Curso:11 th Grade Subsector: Química Fecha: Entrega 19 de noviembre Objetivos: Evaluar los contenidos y habilidades desarrollados
Prof(a). María Angélica Sánchez Palacios
 Tema 5. Oxidación Reducción Prof(a). María Angélica Sánchez Palacios Los procesos electroquímicos consisten en reacciones de oxido-reducción en las cuales: - La energía liberada por una reacción espontánea,
Tema 5. Oxidación Reducción Prof(a). María Angélica Sánchez Palacios Los procesos electroquímicos consisten en reacciones de oxido-reducción en las cuales: - La energía liberada por una reacción espontánea,
Estado de oxidación (E.O.)
 Reacciones Redox Estado de oxidación (E.O.) Es la carga que tendría un átomo si todos sus enlaces fueran iónicos. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones
Reacciones Redox Estado de oxidación (E.O.) Es la carga que tendría un átomo si todos sus enlaces fueran iónicos. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones
1. CONCEPTOS DE OXIDACIÓN Y REDUCCIÓN.
 UD. 7 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. CONCEPTOS DE OXIDACIÓN Y REDUCCIÓN. Oxidación: proceso en el que un átomo cede electrones. Reducción: proceso en el que un átomo gana electrones. Oxidante:
UD. 7 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. CONCEPTOS DE OXIDACIÓN Y REDUCCIÓN. Oxidación: proceso en el que un átomo cede electrones. Reducción: proceso en el que un átomo gana electrones. Oxidante:
Electroquímica UNIDAD XII-B QUIMICA- CPAM. 2017
 Electroquímica UNIDAD XII-B QUIMICA- CPAM. 2017 Electroquímica La electroquímica es la rama de la química que estudia la transformación entre la energía eléctrica y la energía química. Los procesos electroquímicos
Electroquímica UNIDAD XII-B QUIMICA- CPAM. 2017 Electroquímica La electroquímica es la rama de la química que estudia la transformación entre la energía eléctrica y la energía química. Los procesos electroquímicos
Tecnólogo en Minería Química I. PRÁCTICO DE LABORATORIO Reacciones Redox
 Tecnólogo en Minería Química I PRÁCTICO DE LABORATORIO Reacciones Redox I. INTRODUCCIÓN Las reacciones redox se encuentran entre las reacciones más comunes. Son aquellas que involucran la transferencia
Tecnólogo en Minería Química I PRÁCTICO DE LABORATORIO Reacciones Redox I. INTRODUCCIÓN Las reacciones redox se encuentran entre las reacciones más comunes. Son aquellas que involucran la transferencia
PILAS Y ELECTRÓLISIS. Foto: Gabriel Acquistapace
 PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
PILAS Y ELECTRÓLISIS Foto: Gabriel Acquistapace En las reacciones REDOX se produce un intercambio de electrones. Para aprovechar esta circulación de carga es necesario separar las dos semireacciones y
4. Un agente oxidante (2 correctas) A) Toma electrones de otra sustancia B) Da electrones a otra sustancia C) Se oxida D) Se reduce
 CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
CUESTIONES. EQUILIBRIO OXIDO-REDUCCIÓN ---------------------------------------------------------------------------------------------------------- 1. Las reacciones químicas que implican transferencias
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA 1 REACIONES DE OXIDACIÓNREDUCCIÓN Son aquellas en las que se produce una transferencia de electrones entre dos sustancias.
REACCIONES DE TRANSFERENCIA DE ELECTRONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA 1 REACIONES DE OXIDACIÓNREDUCCIÓN Son aquellas en las que se produce una transferencia de electrones entre dos sustancias.
REACCIONES DE OXIDACIÓN-REDUCCIÓN
 10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
Oxidación-Reducción. Oxidantes y reductores
 OxidaciónReducción Inicialmente estos conceptos se relacionaban con la cantidad de oxígeno, así la oxidación comenzó a usarse para indicar que un compuesto incrementaba la proporción de átomos de este,
OxidaciónReducción Inicialmente estos conceptos se relacionaban con la cantidad de oxígeno, así la oxidación comenzó a usarse para indicar que un compuesto incrementaba la proporción de átomos de este,
RESUMEN DE ELECTROQUÍMICA 2ºBACH
 Toda reacción redox consiste en una transferencia de electrones desde la sustancia que se oxida (reductor)a la que se reduce (oxidante.) Una reacción redox espontánea permite obtener una corriente eléctrica.
Toda reacción redox consiste en una transferencia de electrones desde la sustancia que se oxida (reductor)a la que se reduce (oxidante.) Una reacción redox espontánea permite obtener una corriente eléctrica.
Informe Electroquímica
 Informe Electroquímica Curso: Profesor: Integrante: IQ3205-1 Química Inorgánica Franciasco Santamaría Paulo Arriagada Introducción Actualmente la electricidad es la principal forma de energía utilizada
Informe Electroquímica Curso: Profesor: Integrante: IQ3205-1 Química Inorgánica Franciasco Santamaría Paulo Arriagada Introducción Actualmente la electricidad es la principal forma de energía utilizada
Tema: Electroquímica CÁTEDRA DE FISICOQUÍMICA
 Trabajo Práctico Tema: Electroquímica CÁTEDRA DE FISICOQUÍMICA UNIVERSIDAD TECNOLÓGICA NACIONAL Regional Rosario En el presente se desarrolla una propuesta de trabajo práctico para realizar con los estudiantes
Trabajo Práctico Tema: Electroquímica CÁTEDRA DE FISICOQUÍMICA UNIVERSIDAD TECNOLÓGICA NACIONAL Regional Rosario En el presente se desarrolla una propuesta de trabajo práctico para realizar con los estudiantes
Reacciones redox espontáneas
 Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
Celda galvánica o voltaica o electroquímica Pila galvánica o voltaica o electroquímica Cuba galvánica o voltaica o electroquímica Cada una de las partes se denomina: semicelda o semipila o electrodo Pila
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
REACCIONES DE TRANSFERENCIA DE ELECTRONES CONCEPTO DE OXIDACIÓNREDUCCIÓN Oxidaciónreducción: proceso en el que se producen transferencias o intercambios de electrones de unas sustancias a otras: una sustancia
6.3.- Electroquímica
 360 Reacciones de transferencia de electrones 6.3.- Electroquímica Aspectos teóricos: Procesos electroquímicos 6.3.1. Procesos electroquímicos. Potenciales de reducción estándar. Celdas galvánicas y electrolíticas.
360 Reacciones de transferencia de electrones 6.3.- Electroquímica Aspectos teóricos: Procesos electroquímicos 6.3.1. Procesos electroquímicos. Potenciales de reducción estándar. Celdas galvánicas y electrolíticas.
PILAS ELECTROQUÍMICAS
 PILAS ELECTROQUÍMICAS Las pilas electroquímicas se llaman también células galvánicas, células electroquímicas, pilas galvánicas, pilas voltaicas, pilas eléctricas o, simplemente, pilas. Como ya hemos visto,
PILAS ELECTROQUÍMICAS Las pilas electroquímicas se llaman también células galvánicas, células electroquímicas, pilas galvánicas, pilas voltaicas, pilas eléctricas o, simplemente, pilas. Como ya hemos visto,
Tema 15: Equilibrio óxido-reducción Reacciones de oxidación-reducción (redox)
 : Equilibrio óxido-reducción 15.1 Reacciones de oxidación-reducción 15.2 Ajuste de reacciones redox: método del ión-electrón 15.3 Volumetrías redox. Indicadores. 15.4 Energía eléctrica asociada a procesos
: Equilibrio óxido-reducción 15.1 Reacciones de oxidación-reducción 15.2 Ajuste de reacciones redox: método del ión-electrón 15.3 Volumetrías redox. Indicadores. 15.4 Energía eléctrica asociada a procesos
ELECTROQUÌMICA. Zn Zn 2+ (aq) Cu 2+ (aq) Cu
 ELECTROQUÌMICA - Pilas químicas ó voltaicas, producen una corriente continua mediante la utilización de una reacción redox. - Electrólisis, produce una reacción redox por medio de una corriente eléctrica
ELECTROQUÌMICA - Pilas químicas ó voltaicas, producen una corriente continua mediante la utilización de una reacción redox. - Electrólisis, produce una reacción redox por medio de una corriente eléctrica
Tema 5. Oxidación Reducción. Prof(a). María Angélica Sánchez Palacios
 Tema 5. Oxidación Reducción Prof(a). María Angélica Sánchez Palacios Los procesos electroquímicos consisten en reacciones de oxido-reducción en las cuales: - La energía liberada por una reacción espontánea
Tema 5. Oxidación Reducción Prof(a). María Angélica Sánchez Palacios Los procesos electroquímicos consisten en reacciones de oxido-reducción en las cuales: - La energía liberada por una reacción espontánea
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca
 1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
1).- La siguiente figura representa a una pila: I. galvánica. II. electrolítica. III. seca A) Solo I B) Solo II C) Solo III D) Solo I y III E) Solo II y III 2).- Aprovecha una reacción redox espontánea
QUÍMICA Reactividad y equilibrio químico. Oxido - reducción. Tutora: Romina Saavedra
 QUÍMICA Reactividad y equilibrio químico Oxido - reducción Tutora: Romina Saavedra Balance de reacciones de óxido reducción Una reacción redox o de óxido reducción se caracteriza por la existencia de dos
QUÍMICA Reactividad y equilibrio químico Oxido - reducción Tutora: Romina Saavedra Balance de reacciones de óxido reducción Una reacción redox o de óxido reducción se caracteriza por la existencia de dos
CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1)
 M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1) Cuando en una reacción química
M. C. Q. Alfredo Velásquez Márquez Profesor de la Facultad de Ingeniería de la UNAM velasquez777@yahoo.com.mx CÓMO RESOLVER ALGUNOS EJERCICIOS DE ELECTROQUÍMICA (Parte 1) Cuando en una reacción química
Métodos analíticos cuantitativos basados en las propiedades eléctricas de una solución de analito cuando forma parte de una celda electroquímica
 POTENCIOMETRÍA Química electroanalítica Métodos analíticos cuantitativos basados en las propiedades eléctricas de una solución de analito cuando forma parte de una celda electroquímica Electroquímica Conversión
POTENCIOMETRÍA Química electroanalítica Métodos analíticos cuantitativos basados en las propiedades eléctricas de una solución de analito cuando forma parte de una celda electroquímica Electroquímica Conversión
Electroquímica (II) Pilas. Potenciales redox
 Electroquímica (II) Pilas. Potenciales redox IES La Magdalena. Avilés. Asturias Las reacciones redox pueden ser utilizadas para producir diferencias de potencial entre dos puntos, entre los cuales puede
Electroquímica (II) Pilas. Potenciales redox IES La Magdalena. Avilés. Asturias Las reacciones redox pueden ser utilizadas para producir diferencias de potencial entre dos puntos, entre los cuales puede
POTENCIOMETRIA KCL. Cl - CELDAS GALVANICAS DEPOSITO DE COBRE SOBRE UNA LAMINA DE ZINC CELDA GALVANICA POTENCIALES REDOX CELDA GALVANICA
 POTENCIOMETRIA TOPICOS: Celdas galvánicas Potenciales estándar de electrodo Ecuación de Nernst Electrodos de referencia: primario y secundario Medición de ph Celdas electrolíticas Titulaciones potenciométricas
POTENCIOMETRIA TOPICOS: Celdas galvánicas Potenciales estándar de electrodo Ecuación de Nernst Electrodos de referencia: primario y secundario Medición de ph Celdas electrolíticas Titulaciones potenciométricas
QUÍMICA 2º Bachillerato Ejercicios: Electroquímica
 1(8) Ejercicio nº 1 Considera la reacción: Cu(s) + 2Ag + (aq) Cu +2 (aq) + 2Ag(s) a) Escribe las semirreacciones de oxidación y de reducción c) Escribe el esquema de la pila que se puede formar con dicha
1(8) Ejercicio nº 1 Considera la reacción: Cu(s) + 2Ag + (aq) Cu +2 (aq) + 2Ag(s) a) Escribe las semirreacciones de oxidación y de reducción c) Escribe el esquema de la pila que se puede formar con dicha
Unidad 8 Reacciones de oxidaciónreducción
 Unidad 8 Reacciones de oxidaciónreducción 1. Reacciones de Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. 2 2. Número de oxidación
Unidad 8 Reacciones de oxidaciónreducción 1. Reacciones de Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. 2 2. Número de oxidación
DEPARTAMENTO DE ELECTRÓNICA Y AUTOMÁTICA
 DEPARTAMENTO DE ELECTRÓNICA Y AUTOMÁTICA FACULTAD DE INGENIERÍA UNIVERSIDAD NACIONAL DE SAN JUAN Practica Laboratorio Nº 05 PILAS Asignatura: Química 1 Bioingeniería Autores del Grupo: Apellido, Nombre
DEPARTAMENTO DE ELECTRÓNICA Y AUTOMÁTICA FACULTAD DE INGENIERÍA UNIVERSIDAD NACIONAL DE SAN JUAN Practica Laboratorio Nº 05 PILAS Asignatura: Química 1 Bioingeniería Autores del Grupo: Apellido, Nombre
Celdas Galvánicas y Electrolíticas
 Celdas Galvánicas y Electrolíticas Reacciones de óxido-reducción Reacciones en las cuales una o más de las sustancias intervinientes modifica su estado de oxidación. Znº (s) + Cu +2 (ac) Zn 2+ (ac) + Cuº
Celdas Galvánicas y Electrolíticas Reacciones de óxido-reducción Reacciones en las cuales una o más de las sustancias intervinientes modifica su estado de oxidación. Znº (s) + Cu +2 (ac) Zn 2+ (ac) + Cuº
Tema 9: Reacciones de oxidación-reducción
 Tema 9: Reacciones de oxidación-reducción Proceso de oxidación-reducción. Ajuste de reacciones red-ox. Potencial de electrodo. Celda electroquímica. Esquema de la celda. Potenciales estandar de los electrodos.
Tema 9: Reacciones de oxidación-reducción Proceso de oxidación-reducción. Ajuste de reacciones red-ox. Potencial de electrodo. Celda electroquímica. Esquema de la celda. Potenciales estandar de los electrodos.
ELECTROQUÍMICA. 1- Concepto de potencial normal. Electrodo de referencia
 ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
ELECTROQUÍMICA 1 Concepto de potencial normal. Electrodo de referencia 2 Se forma una pila con un electrodo de níquel y otro de plata. Indica el electrodo que eléctricamente es el polo positivo, el que
 REDOX 1. Dada la ecuación redox KMnO 4 + K 2 SO 3 + HCl > MnO 2 + K 2 SO 4 + KCl + H 2 O 1. a) Deduce razonadamente la sustancia oxidante y la reductora, la que oxida y la que se reduce. b) Escribe y ajusta
REDOX 1. Dada la ecuación redox KMnO 4 + K 2 SO 3 + HCl > MnO 2 + K 2 SO 4 + KCl + H 2 O 1. a) Deduce razonadamente la sustancia oxidante y la reductora, la que oxida y la que se reduce. b) Escribe y ajusta
ELECTROQUÍMICA. CELDAS GALVÁNICAS Y CELDAS ELECTROLÍTICAS. Reacciones de óxido reducción. Cambios de la energía libre y criterios de espontaneidad
 ELECTROQUÍMICA. CELDAS GALVÁNICAS Y CELDAS ELECTROLÍTICAS Temas previos: Reacciones de óxido reducción Cambios de la energía libre y criterios de espontaneidad REACCIONES DE OXIDO-REDUCCIÓN Oxidación:
ELECTROQUÍMICA. CELDAS GALVÁNICAS Y CELDAS ELECTROLÍTICAS Temas previos: Reacciones de óxido reducción Cambios de la energía libre y criterios de espontaneidad REACCIONES DE OXIDO-REDUCCIÓN Oxidación:
Ambos procesos se pueden sintetizar en la expresión: Oxidación. OXIDANTE + n e - Reducción
 La rama de la química que se refiere a las relaciones entre electricidad y reacciones químicas es la electroquímica. Aquellas reacciones químicas en las que el número de oxidación (también denominado estado
La rama de la química que se refiere a las relaciones entre electricidad y reacciones químicas es la electroquímica. Aquellas reacciones químicas en las que el número de oxidación (también denominado estado
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2016 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 016 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 016 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 3, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción
BLOQUE IV- SEGUNDA PARTE. Prof. Dr. Mª del Carmen Clemente Jul
 BLOQUE IV- SEGUNDA PARTE Prof. Dr. Mª del Carmen Clemente Jul PILAS VOLTAICAS DISPOSITIVO EXPERIMENTAL QUE PERMITE A PARTIR DE UNA REACCIÓN REDOX GENERAR ELECTRICIDAD ELECTRODOS SEMICELDAS BARRAS DE LOS
BLOQUE IV- SEGUNDA PARTE Prof. Dr. Mª del Carmen Clemente Jul PILAS VOLTAICAS DISPOSITIVO EXPERIMENTAL QUE PERMITE A PARTIR DE UNA REACCIÓN REDOX GENERAR ELECTRICIDAD ELECTRODOS SEMICELDAS BARRAS DE LOS
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio, Opción B
ELECTROQUÍMICA. 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday.
 ELECTROQUÍMICA 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday. Química 2º bachillerato Electroquímica 1 0. CONOCIMIENTOS
ELECTROQUÍMICA 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday. Química 2º bachillerato Electroquímica 1 0. CONOCIMIENTOS
MÉTODOS ELECTROQUÍMICOS
 MÉTODOS ELECTROQUÍMICOS Técnicas instrumentales de análisis que pueden usarse para la identificación y/o cuantificación de analitos mediante mediciones de variables como: Intensidad de corriente eléctrica
MÉTODOS ELECTROQUÍMICOS Técnicas instrumentales de análisis que pueden usarse para la identificación y/o cuantificación de analitos mediante mediciones de variables como: Intensidad de corriente eléctrica
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
REACCIONES DE TRANSFERENCIA DE ELECTRONES: POTENCIALES DE ELECTRODOS. PILAS 1.-/ Cuál es el potencial normal de una pila que utiliza los pares Zn 2+ /Zn y Ag + /Ag? Cuál es la polaridad de cada electrodo?
Reacciones de transferencia de electrones
 DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO Actividades tema 8 Reacciones de transferencia de electrones Reacciones de oxidación-reducción 1.-Asigna el número
DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO Actividades tema 8 Reacciones de transferencia de electrones Reacciones de oxidación-reducción 1.-Asigna el número
REACCIONES REDOX (SOLUCIONES)
 Cuestiones y problemas de QuímicaReacciones redox REACCIONES REDOX (SOLUCIONES) 1) SO : S (+); O (). CaH : Ca (+); H (1). K Cr O 7 : K (+1); Cr (+6); O (). H CO : H (+1); C (+); O (). CH O: C (0); H (+1);
Cuestiones y problemas de QuímicaReacciones redox REACCIONES REDOX (SOLUCIONES) 1) SO : S (+); O (). CaH : Ca (+); H (1). K Cr O 7 : K (+1); Cr (+6); O (). H CO : H (+1); C (+); O (). CH O: C (0); H (+1);
Tema 6. Reacciones de transferencia de electrones. Oxidación-reducción
 Tema 6 Reacciones de transferencia de electrones Oxidación-reducción CONTENIDO 1.- Concepto tradicional de oxidación-reducción. 2.- Concepto electrónico de oxidación-reducción. 3.- Número de oxidación.
Tema 6 Reacciones de transferencia de electrones Oxidación-reducción CONTENIDO 1.- Concepto tradicional de oxidación-reducción. 2.- Concepto electrónico de oxidación-reducción. 3.- Número de oxidación.
EQUILIBRIO REDOX. Zn Zn e -
 EQUILIBRIO REDOX Con respecto a la oxidación de una sustancia, se entiende que la forma oxidada es aquella que resulta cuando la forma reducida pierde sus electrones y que se establece un equilibrio entre
EQUILIBRIO REDOX Con respecto a la oxidación de una sustancia, se entiende que la forma oxidada es aquella que resulta cuando la forma reducida pierde sus electrones y que se establece un equilibrio entre
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA
 QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
QUÍMICA de 2º de BACHILLERATO ELECTROQUÍMICA CUESTIONES RESUELTAS QUE HAN SIDO PROPUESTAS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) VOLUMEN
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 6, Opción A Reserva, Ejercicio 3, Opción
TRABAJO PRÁCTICO N 9 ÓXIDO-REDUCCIÓN
 TRABAJO PRÁCTICO N 9 ÓXIDO-REDUCCIÓN Las reacciones químicas de óxido - reducción (reacciones redox) son aquellas en las cuales se produce una transferencia de electrones. Son las reacciones donde se producen
TRABAJO PRÁCTICO N 9 ÓXIDO-REDUCCIÓN Las reacciones químicas de óxido - reducción (reacciones redox) son aquellas en las cuales se produce una transferencia de electrones. Son las reacciones donde se producen
CUESTIONES Y PROBLEMAS DEL TEMA 8 (ELECTROQUÍMICA)
 CUESTIONES Y PROBLEMAS DEL TEMA 8 (ELECTROQUÍMICA) 1.- Teniendo en cuenta los potenciales de reducción estándar de los pares E 0 (Cl 2 /Cl - ) = 1 36 V y E 0 (Cu 2+ /Cu) = 0 34 V: a) Escriba la reacción
CUESTIONES Y PROBLEMAS DEL TEMA 8 (ELECTROQUÍMICA) 1.- Teniendo en cuenta los potenciales de reducción estándar de los pares E 0 (Cl 2 /Cl - ) = 1 36 V y E 0 (Cu 2+ /Cu) = 0 34 V: a) Escriba la reacción
ELECTROQUÍMICA. Se discutirán en la clase práctica algunos de los siguientes ejercicios de Brown: Capítulo 20: 5, 7, 13, 21, 23, 33, 39, 47, 51
 REPARTIDO 8 ELECTROQUÍMICA 2007 Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Capítulo 20, 723-761 APENDICE E Ejercicios
REPARTIDO 8 ELECTROQUÍMICA 2007 Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Capítulo 20, 723-761 APENDICE E Ejercicios
Celdas galvánicas: Son dispositivos que permiten generar corriente eléctrica por medio de una reacción redox que ocurre en forma espontánea.
 Electroquímica Programa de Acceso Inclusivo, Equidad y Permanencia Celdas galvánicas: Son dispositivos que permiten generar corriente eléctrica por medio de una reacción redox que ocurre en forma espontánea.
Electroquímica Programa de Acceso Inclusivo, Equidad y Permanencia Celdas galvánicas: Son dispositivos que permiten generar corriente eléctrica por medio de una reacción redox que ocurre en forma espontánea.
Reacciones Redox. Química General e Inorgánica Ingeniería Ambiental
 Reacciones Redox Hasta esta guía hemos aprendido a balancear ecuaciones químicas sencillas por tanteo, pero muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo
Reacciones Redox Hasta esta guía hemos aprendido a balancear ecuaciones químicas sencillas por tanteo, pero muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo
MADRID / JUNIO 99. LOGSE / QUÍMICA / ELECTROQUÍMICA / OPCION A/ CUESTIÓN 3
 MADRID / JUNIO 99. LOGSE / QUÍMICA / ELECTROQUÍMICA / OPCION A/ CUESTIÓN 3 3. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado a hierro(ii)
MADRID / JUNIO 99. LOGSE / QUÍMICA / ELECTROQUÍMICA / OPCION A/ CUESTIÓN 3 3. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado a hierro(ii)
Unidad II: Eje : Electroquímica y almacenamiento de energía
 Unidad II: Eje : Electroquímica y almacenamiento de energía En tu netbook, en Escritorio del Alumno Actividades Física y Química Clases de reacciones químicas. Realiza una lectura comprensiva. Y luego,
Unidad II: Eje : Electroquímica y almacenamiento de energía En tu netbook, en Escritorio del Alumno Actividades Física y Química Clases de reacciones químicas. Realiza una lectura comprensiva. Y luego,
9. Reacciones de oxidación-reducción
 9. Reacciones oxidación-reducción Conceptos básicos. Contenidos Estado de oxidación; oxidación y reducción; semirreacción; ajuste de reacciones redox; valoraciones redox Electroquímica. Serie electromotriz:
9. Reacciones oxidación-reducción Conceptos básicos. Contenidos Estado de oxidación; oxidación y reducción; semirreacción; ajuste de reacciones redox; valoraciones redox Electroquímica. Serie electromotriz:
Introducción. Tema 9: Reacciones de oxidación-reducción
 Introducción Tema 9: Reacciones de oxidación-reducción Procesos químicos en los que hay un intercambio de electrones. Procesos homogéneos (reacciones redox) Procesos heterogéneos (electrodos) Cambio químicos
Introducción Tema 9: Reacciones de oxidación-reducción Procesos químicos en los que hay un intercambio de electrones. Procesos homogéneos (reacciones redox) Procesos heterogéneos (electrodos) Cambio químicos
Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno.
 PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
PVQ18-1.*** Estequiometría y redox del HIERRO Se dispone, como ves, de tres óxidos de hierro, con diferente contenido en oxígeno. a) Ordénalos por dicho contenido, de mayor a menor Fotografía 1 b) Indica
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
REACCIONES DE TRANSFERENCIA DE ELECTRONES
 transparent www.profesorjrc.es REACCIONES DE TRANSFERENCIA DE ELECTRONES 29 de junio de 2016 Números de oxidación Oxidación: Reducción: Átomo o grupo de átomos que pierden e, n.o. Átomo o grupo de átomos
transparent www.profesorjrc.es REACCIONES DE TRANSFERENCIA DE ELECTRONES 29 de junio de 2016 Números de oxidación Oxidación: Reducción: Átomo o grupo de átomos que pierden e, n.o. Átomo o grupo de átomos
Capítulo 20: Electroquímica
 Capítulo 20: Electroquímica Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química Quimica general II, Electroquímica p.1 Cosas importantes Electroquímica
Capítulo 20: Electroquímica Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química Quimica general II, Electroquímica p.1 Cosas importantes Electroquímica
Zn 2e Zn +2 proceso de oxidación Ánodo Polo negativo. Cu e Cu proceso de reducción Cátodo Polo positivo. Zn + Cu +2 Zn+2 + Cu
 Tema 4(II).PILAS Y CELDAS ELECTROLÍTICAS PILAS GALVÁNICAS Los procesos redox son procesos de transferencia de electrones. Podemos aprovechar tales procesos para producir corriente eléctrica si conseguimos
Tema 4(II).PILAS Y CELDAS ELECTROLÍTICAS PILAS GALVÁNICAS Los procesos redox son procesos de transferencia de electrones. Podemos aprovechar tales procesos para producir corriente eléctrica si conseguimos
QUÍMICA ANALÍTICA I. Etapa analítica. Análisis volumétrico : Titulaciones de óxido-reducción
 QUÍMICA ANALÍTICA I Etapa analítica Análisis volumétrico : Titulaciones de óxido-reducción Equilibrio Redox Ce(IV) Ce 4+ + Fe 2+ Ce 3+ + Fe 3+ Otra reacción: MnO 2-4 + 5 Fe 2+ + 8 H + Mn 2+ + 5 Fe 3+ +
QUÍMICA ANALÍTICA I Etapa analítica Análisis volumétrico : Titulaciones de óxido-reducción Equilibrio Redox Ce(IV) Ce 4+ + Fe 2+ Ce 3+ + Fe 3+ Otra reacción: MnO 2-4 + 5 Fe 2+ + 8 H + Mn 2+ + 5 Fe 3+ +
Actividad 4. Leccion evaluativa de la unidad UNO
 Actividad 4. Leccion evaluativa de la unidad UNO En una reacción de oxidación/reducción a veces llamadas reacciones redox, los electrones se transfieren de un reactivo a otro. Ocurren reacciones de oxidación
Actividad 4. Leccion evaluativa de la unidad UNO En una reacción de oxidación/reducción a veces llamadas reacciones redox, los electrones se transfieren de un reactivo a otro. Ocurren reacciones de oxidación
TEMA 8. Equilibrios Redox y de Solubilidad. Grabado de Heinrich Khunrath, Amphitheatrum Sapientiae Aeternae Hannover, 1609
 TEMA 8. Equilibrios Redox y de Solubilidad Grabado de Heinrich Khunrath, Amphitheatrum Sapientiae Aeternae Hannover, 1609 Equilibrio Redox: Estados de Oxidación ESTADOS DE OXIDACIÓN Muchos elementos forman
TEMA 8. Equilibrios Redox y de Solubilidad Grabado de Heinrich Khunrath, Amphitheatrum Sapientiae Aeternae Hannover, 1609 Equilibrio Redox: Estados de Oxidación ESTADOS DE OXIDACIÓN Muchos elementos forman
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX
 TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
TRANSFERENCIA DE ELECTRONES AJUSTE DE REACCIONES REDOX E1A.S2012 El dióxido de manganeso reacciona en medio hidróxido potásico con clorato de potasio para dar permanganato de potasio, cloruro de potasio
Capítulo 18 Electroquímica
 Capítulo 18 Electroquímica Adaptado por: Ileana Nieves Martínez Corriente Eléctrica Corriente (i) de agua cantidad de agua que pasa en un periodo de tiempo Eléctrica cantidad de carga eléctrica (Q) que
Capítulo 18 Electroquímica Adaptado por: Ileana Nieves Martínez Corriente Eléctrica Corriente (i) de agua cantidad de agua que pasa en un periodo de tiempo Eléctrica cantidad de carga eléctrica (Q) que
GUIA DE EJERCICIOS ELECTROQUÍMICA
 GUIA DE EJERCICIOS ELECTROQUÍMICA Ecuación de Nernst y Leyes de Faraday Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de electroquímica para la resolución de ejercicios, desarrollando
GUIA DE EJERCICIOS ELECTROQUÍMICA Ecuación de Nernst y Leyes de Faraday Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de electroquímica para la resolución de ejercicios, desarrollando
Introduccion al equilibrio de reacciones de oxido-reduccion
 Introduccion al equilibrio de reacciones de oxido-reduccion laborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM QU ÍM IC A A N A LÍTIC A I C LAV 142 G rupo 4, s em es tre 21-2 Resumen de celdas electroquimicas:
Introduccion al equilibrio de reacciones de oxido-reduccion laborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM QU ÍM IC A A N A LÍTIC A I C LAV 142 G rupo 4, s em es tre 21-2 Resumen de celdas electroquimicas:
Sistemas electroquímicos
 Sistemas electroquímicos Comprende varias fases (liquidos inmiscibles, solido/líquido, sólido/sólido) Contiene especies cargadas Al menos una especie cargada no puede penetrar todas las fases del sistema
Sistemas electroquímicos Comprende varias fases (liquidos inmiscibles, solido/líquido, sólido/sólido) Contiene especies cargadas Al menos una especie cargada no puede penetrar todas las fases del sistema
Práctica 5: Termoquímica: Celdas galvánicas
 Práctica 5: Termoquímica: Celdas galvánicas Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Construir, varias celdas galvánicas o voltaicas y medir el potencial
Práctica 5: Termoquímica: Celdas galvánicas Ingeniería agrónoma grado en hortofruticultura y jardinería Jorge Cerezo Martínez Objetivos Construir, varias celdas galvánicas o voltaicas y medir el potencial
REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015
 REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015 1- El permanganato de potasio actúa como oxidante en medio ácido, dando como producto Mn 2+. Por el contrario, como oxidante en medio básico el
REACCIONES DE TRANSFERENCIA DE ELECTRONES SEPTIEMBRE 2015 1- El permanganato de potasio actúa como oxidante en medio ácido, dando como producto Mn 2+. Por el contrario, como oxidante en medio básico el
OXIDACIÓN-REDUCCIÓN 1. ESTADO DE OXIDACIÓN (E.O.) (O NÚMERO DE OXIDACIÓN).
 OXIDACIÓN-REDUCCIÓN 1. ESTADO DE OXIDACIÓN (E.O.) (O NÚMERO DE OXIDACIÓN). Es la carga que tendría un átomo si todos sus enlaces fueran iónicos, es decir, considerando todos los enlaces covalentes polares
OXIDACIÓN-REDUCCIÓN 1. ESTADO DE OXIDACIÓN (E.O.) (O NÚMERO DE OXIDACIÓN). Es la carga que tendría un átomo si todos sus enlaces fueran iónicos, es decir, considerando todos los enlaces covalentes polares
OXIDACIÓN-REDUCCIÓN. PAU-tipos de problemas
 OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
OXIDACIÓN-REDUCCIÓN PAU-tipos de problemas Ajustar reacciones químicas de oxidación reducción por el método del ión-electrón y realizar cálculos estequiométricos (disoluciones, gases, sólidos, reactivos
7. Práctica 5: Celdas galvánicas.
 7. Práctica 5: Celdas galvánicas. 7.1. Fundamento teórico En esta práctica se construirán varias celdas voltaicas o galvánicas, a partir de dos semiceldas y de las conexiones apropiadas (circuito externo
7. Práctica 5: Celdas galvánicas. 7.1. Fundamento teórico En esta práctica se construirán varias celdas voltaicas o galvánicas, a partir de dos semiceldas y de las conexiones apropiadas (circuito externo
Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química
 1 Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química 1. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado
1 Problemas y cuestiones de REDOX + ficha ión-electrón 2º de bachillerato. Química 1. Deduzca razonadamente y escribiendo la reacción ajustada: a) Si el hierro en su estado elemental puede ser oxidado
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 6, Opción B Reserva 3, Ejercicio 3, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 6, Opción B Reserva 3, Ejercicio 3, Opción
Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción. Ajuste de reacciones de oxidación-reducción.
 Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción Concepto de oxidación-reducción Número de oxidación Ajuste de reacciones de oxidación-reducción. Estequiometría Electroquímica
Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción Concepto de oxidación-reducción Número de oxidación Ajuste de reacciones de oxidación-reducción. Estequiometría Electroquímica
Escuela Nacional de Ciencias Biológicas. Instituto Politécnico Nacional. Materia: Fisicoquímica II. Nombre Integrantes : González González Laura Ibeth
 Escuela Nacional de Ciencias Biológicas Instituto Politécnico Nacional Materia: Fisicoquímica II Nombre Integrantes : González González Laura Ibeth Rodríguez Ramírez Malinallitzin Prida Villagrán Angel
Escuela Nacional de Ciencias Biológicas Instituto Politécnico Nacional Materia: Fisicoquímica II Nombre Integrantes : González González Laura Ibeth Rodríguez Ramírez Malinallitzin Prida Villagrán Angel
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS REACCIONES DE TRANSFERENCIA DE ELECTRONES
 CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS 2001-2012 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. El KMnO 4, en medio ácido sulfúrico, reacciona con el H 2 O 2 para dar MnSO
CUESTIONES Y PROBLEMAS DE SELECTIVIDAD EN LAS UNIVERSIDADES ANDALUZAS 2001-2012 REACCIONES DE TRANSFERENCIA DE ELECTRONES 1. El KMnO 4, en medio ácido sulfúrico, reacciona con el H 2 O 2 para dar MnSO
Reacciones de oxido reducción
 Reacciones de oxido reducción Oxidación pérdida de electrones Reducción ganancia de electrones Las reacciones de oxido reducción tienen lugar mediante intercambio de electrones Ej.: Zn(s) + 2 H + (ac)
Reacciones de oxido reducción Oxidación pérdida de electrones Reducción ganancia de electrones Las reacciones de oxido reducción tienen lugar mediante intercambio de electrones Ej.: Zn(s) + 2 H + (ac)
QUÍMICA 2º BACHILLERATO
 REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
REACCIONES DE TRANSFERENCIA DE ELECTRONES: ELECTRÓLISIS 1.-/ Calcule la intensidad de la corriente que se necesita para descomponer 18 g de cloruro de cobre (II) en disolución acuosa, en un tiempo de 50
Teoría Redox. Química III medio
 Teoría Redox Química III medio Las reacciones de oxido-reducción son aquellas en las que existe una transferencia de electrones o un cambio en los estados de oxidación de las sustancias que forman parte
Teoría Redox Química III medio Las reacciones de oxido-reducción son aquellas en las que existe una transferencia de electrones o un cambio en los estados de oxidación de las sustancias que forman parte
OXIDACIÓN REDUCCIÓN QCA 09 ANDALUCÍA
 OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
OXIDACIÓN REDUCCIÓN QCA 9 ANDALUCÍA.- Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en
Redox 7. la única correcta, sería la: a) A b)b c)c d)d
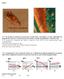 Redox 7 121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará
Redox 7 121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará
Capítulo 7: Reacciones de oxidación-reducción
 Capítulo 7: Reacciones de oxidación-reducción ACTIVIDADES DE RECAPITULACIÓN 1*. Indica, razonadamente, si cada una de las siguientes transformaciones es una reacción redox, identificando, en su caso, el
Capítulo 7: Reacciones de oxidación-reducción ACTIVIDADES DE RECAPITULACIÓN 1*. Indica, razonadamente, si cada una de las siguientes transformaciones es una reacción redox, identificando, en su caso, el
