Desconexión del cloruro de t-butilo
|
|
|
- Javier Plaza Rico
- hace 7 años
- Vistas:
Transcripción
1 Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres y compuestos relacionados. El método de la desconexión. Concepto de análisis retrosintético. El problema de la síntesis química de moléculas orgánicas se resuelve mediante el denominado análisis retrosintético. Esta metodología permite la propuesta de rutas sintéticas para una molécula objetivo mediante la desconexión de enlaces. La molécula objetivo se desconecta a moléculas más simples, que a su vez se desconectan a otras moléculas y así sucesivamente hasta llegar a compuestos comerciales o fácilmente accesibles. Sintón y equivalente sintético Cada etapa de desconexión se basa en una reacción química y formalmente supone la ruptura de un enlace para dar lugar a dos fragmentos denominados sintones. Por ejemplo, el cloruro de t-butilo se puede desconectar en el enlace C- para generar un sintón catiónico (el carbocatión t-butilo) y un sintón aniónico (el ion cloruro). Desconexión del cloruro de t-butilo sintón catiónico sintón aniónico En la desconexión del cloruro de t-butilo surgen dos sintones que tienen existencia real. El carbocatión t-butilo es una especie que se puede generar a partir de diversas fuentes, aunque su tiempo de vida media sea pequeño. El ión cloruro es el componente aniónico de las sales denominadas cloruros o el anión que se forma cuando se disuelve en agua el cloruro de hidrógeno (). La etapa contraria a la desconexión es la propia reacción. Una vez desconectada la estructura y analizados los sintones se tienen que proponer los correspondientes equivalentes sintéticos, es decir los reactivos que harán el papel de los sintones en la reacción. El carbocatión t-butilo es un sintón que tiene una existencia real pero no se encuentran fácilmente accesibles sales que contengan este catión porque es muy inestable. Todo lo contrario ocurre con el sintón cloruro. Su gran estabilidad hace que existan un gran número de sales que lo contienen. El reactivo para el sintón cloruro puede ser el que liberará en disolución acuosa -, o a que se disolverá para dar iones a y -. El reactivo para el carbocatión t-butilo no es tan evidente y dependerá de la reacción que se elija para la obtención del cloruro de t-butilo.
2 Tema 1 2 Por ejemplo, basándonos en la desconexión propuesta anteriormente se podría proponer una síntesis del cloruro de t-butilo mediante la reacción de tipo S 1 entre el t-butanol y el. 2 En estas condiciones el protona al alcohol, que pierde 2 formando el carbocatión t-butilo. A continuación, El ión cloruro ataca al carbocatión dando lugar al cloruro de t-butilo. Mecanismo de la reacción 1º. Protonación del alcohol rápida 2º. Pérdida de agua y formación del carbocatión terciario lenta 3º. Ataque nucleofílico del ión cloruro al carbocatión rápida La síntesis del cloruro de t-butilo se habría podido efectuar también empleando como material de partida 2-metilpropeno: Síntesis alternativa del cloruro de t-butilo En este caso, la reacción que permite la obtención del cloruro de t-butilo es una adición electrofílica al doble enlace. El reactivo que genera el carbocatión t-butilo es el 2-metilpropeno. La fuente del ión cloruro es, la misma que en la síntesis del cloruro de t-butilo a partir de t-butanol.
3 Síntesis rgánica 3 Mecanismo de la reacción 1º. Formación del carbocatión por protonación del doble enlace lenta 2º. Ataque nucleofílico del ión cloruro al carbocatión t-butilo rápida Por tanto, un compuesto de estructura tan simple como el cloruro de t- butilo se puede obtener mediante dos síntesis diferentes, tanto por lo que hace al sustrato carbonado (t-butanol o 2-metilpropeno) como al tipo de mecanismo que interviene en el proceso (S 1 o adición electrofílica a doble enlace). La molécula objetivo, por ejemplo el cloruro de t-butilo, marca los reactivos y por tanto el tipo de mecanismo que participará en el proceso de síntesis. La síntesis del cloruro de t-butilo a partir del t-butanol es un proceso de sustitución formal de por. En la primera síntesis propuesta el cloruro de t-butilo se obtiene mediante un proceso de tipo S 1. Se habría podido obtener el cloruro de t-butilo mediante un proceso de tipo S 2?. Para que cualquier tipo de sustitución nucleofílica funcione, ya sea mediante un mecanismo S 1 o mediante un mecanismo S 2, el sustrato debe contener un buen grupo saliente. En medio ácido el t-butanol se protona y el grupo, mal grupo saliente por que se debería eliminar como - que es una base fuerte, se transforma en un buen grupo saliente 2. Si se desea efectuar una reacción S 2 sobre un alcohol hay que activarlo previamente hacia el proceso de sustitución, bien mediante protonación o bien mediante esterificación con cloruro de p-toluensulfonilo (cloruro de tosilo) o cloruro de metanosulfonilo (cloruro de mesilo). A continuación, se indican las reacciones de conversión de alcoholes en los correspondientes tosilatos y mesilatos:
4 Tema 1 4 (piridina) S cloruro de tosilo C 3 S tosilato del alcohol C 3 cloruro de piridinio S C 3 cloruro de mesilo (piridina) S C 3 mesilato del alcohol cloruro de piridinio Una vez convertido el alcohol en un tosilato o mesilato se puede proceder a efectuar la reacción de sustitución S 2. En este tipo de sustratos el grupo hidroxilo se puede desplazar fácilmente en forma de anión tosilato o anión mesilato. Estos aniones son muy poco básicos y por tanto excelentes grupos salientes. uc S C 3 S 2 uc S C 3 anión tosilato (buen grupo saliente) uc S C 3 S 2 uc S C 3 anión mesilato (buen grupo saliente) La principal diferencia entre el cloruro de tosilo y el cloruro de mesilo es su tamaño. El cloruro de tosilo es mucho más voluminoso que el cloruro de mesilo y por tanto no es adecuado para la esterificación de hidroxilos estéricamente impedidos. Por ello, si se decidiese la activación del grupo hidroxilo del t- butanol hacia el proceso de sustitución S 2 habría que proceder a su mesilación. Admitiendo que la reacción de mesilación del t-butanol funcionase el siguiente paso en la obtención del cloruro de t-butilo, mediante una reacción S 2, sería la reacción con el nucleófilo, por ejemplo con cloruro introducido como a. La reacción se podría efectuar en dimetilformamida (DMF) que es un disolvente polar aprótico, ideal para llevar a cabo reacciones S 2 que
5 Síntesis rgánica 5 empleen sales como fuente de la especie nucleofílica. Sin embargo, la reacción está condenada al fracaso porque los procesos S 2 no tienen lugar sobre sustratos terciarios. ipotético esquema de síntesis del cloruro de t-butilo mediante un proceso S 2 1º. Formación del mesilato Ms Ms 2º. La reacción S 2 no funciona sobre un sustrato terciario! DMF Ms a ams Con este ejemplo acabado de comentar se quiere poner de manifiesto que siendo importante el proceso de desconexión, no lo es menos el proceso contrario: la propuesta de una adecuada ruta sintética.
6 Tema 1 6 Desconexiones de un grupo C-X. Síntesis de ésteres y amidas La desconexión de un éster o una amida se efectúa en el enlace entre el grupo carbonilo y el heteroátomo. Desconexiones de ésteres y amidas éster catión acilo 2 amida catión acilo 2 Como consecuencia de la desconexión surge un sintón catiónico, denominado catión acilo, que no tiene existencia real. Su equivalente sintético es el correspondiente cloruro de ácido o anhídrido de ácido. sintón equivalente sintético cloruro de ácido anhidrido De hecho, si se emplean los cloruros de ácido o los anhidridos en los procesos de esterificación o amidación, no hace falta emplear como equivalentes sintéticos de los sintones aniónicos los propios aniones que surgen de la desconexión. En estos casos los equivalentes sintéticos son el alcohol o la amina correspondiente
7 Síntesis rgánica 7 sintón 2 equivalente sintético (alcohol) 2 (amina) Por ejemplo, para el éster que se indica a continuación, el p-nitrobenzoato de etilo, la retrosíntesis sería: etrosíntesis del p-nitrobenzoato de etilo C 2 C 3 C 2 C La retrosíntesis conduce a dos sintones para los que hay que buscar los correspondientes equivalentes sintéticos: para el sintón catiónico el equivalente sintético podría ser el cloruro del ácido p-nitrobenzoico y para el sintón aniónico el equivalente sintético puede ser el propio etanol. La síntesis se efectuaría mediante reacción entre el cloruro del ácido p- nitrobenzoico y el etanol. Este tipo de esterificaciones se efectúan en presencia de una cantidad estequiométrica de piridina para neutralizar el que se genera en el proceso. Síntesis 2 C 3 C 2 2 C 2 C 3 El mecanismo de la esterificación con cloruros de ácido y alcoholes en presencia de piridina se inicia con el ataque nucleofílico del alcohol al cloruro de ácido. Esta primera reacción forma un intermedio que expulsa al ión cloruro dando lugar al éster protonado, que reacciona con el anión cloruro para dar lugar al éster neutro y a. La piridina presente en el medio de reacción es una base relativamente fuerte y va reaccionando con el (ácido fuerte) a medida que éste se va formando. Esta reacción ácido-base forma cloruro de
8 Tema 1 8 piridinio y como el proceso es irreversible decanta todos los equilibrios anteriores hacia los productos finales. Mecanismo de la reacción de esterificación 1º. Ataque nucleofílico del etanol al grupo carbonilo del cloruro de ácido 2 C 2 C 3 2 C 2 C 3 2º. Expulsión del ión cloruro y formación del éster protonado 2 C 2 C 3 2 C 2 C 3 3º. eacción ácido-base 2 C 2 C 3 2 C 2 C 3 4º. eacción ácido-base irreversible entre el y la piridina piridina (base fuerte) cloruro de hidrógeno (ácido fuerte) cloruro de piridinio anión cloruro Los cloruros de ácido se obtienen mediante la reacción de los ácidos carboxílicos con cloruro de tionilo (S 2 ). A continuación se da el mecanismo de formación de los cloruros de ácido.
9 Síntesis rgánica 9 Mecanismo de formación de cloruros de ácido con S 2 C C S S C S C cloruro de ácido S C clorosulfito de acilo protonado S S Síntesis de éteres y compuestos relacionados La desconexión de los éteres se efectúa en alguno de los dos enlaces C- : Desconexión de un éter éter Como resultado de la desconexión surge un sintón aniónico, el anión alcóxido y un sintón catiónico, un carbocatión. El equivalente sintético del anión alcóxido es el propio anión, que se genera por reacción del alcohol con una base adecuada. El equivalente sintético del carbocatión es un sustrato carbonado que contenga un buen grupo saliente (un tosilato, un mesilato o un haluro de alquilo). sintón equivalente sintético (alcohol), base X (X=Ts, Ms,,, I) Por ejemplo para el éter que se indica a continuación, el butil propil éter, la retrosíntesis sería:
10 Tema 1 10 etrosíntesis del butil propil éter butil propil éter La síntesis se efectuaría a partir del alcohol n-butílico, mediante ionización al ión n-butóxido, seguida de reacción con el tosilato (o mesilato) de propilo o con un haluro de propilo. El mecanismo de la reacción de formación del éter tendría lugar bajo un proceso S 2. La ionización de los alcoholes en las reacciones de eterificación se lleva a cabo, usualmente, con a (hidruro sódico). Con esta base se genera hidrógeno y por tanto la reacción de ionización es irreversible de manera que el alcohol, con un equivalente de a, se convierte completamente en su base conjugada, el ión alcóxido. Después de la generación del alcóxido se añade el reactivo electrofílico para que tenga lugar la reacción S 2: Síntesis del butil propil éter: 1ª etapa: ionización del alcohol a TF a 2 n-butanol n-butóxido sódico 2ª etapa: reacción S2 a bromuro de propilo butil propil éter a La retrosíntesis del butil propil éter también se puede efectuar desconectando el otro enlace C-. Esta vía de desconexión conduce al anión n-propóxido y el catión n-butilo. etrosíntesis alternativa del butil propil éter La síntesis del butil propil éter basada en la desconexión anterior sería la siguiente:
11 Síntesis rgánica 11 1ª etapa: ionización del alcohol a TF a 2 n-propanol 2º etapa: reacción S 2 a a bromuro de butilo butil propil éter La desconexión alternativa de los enlaces C- en un éter no siempre es adecuada. Por ejemplo, supongamos la síntesis del metil fenil éter. Las dos desconexiones alternativas de cada uno de los enlaces C- se indican a continuación: etrosíntesis del fenil metil éter: desconexión 1 C3 C 3 fenil metil éter ion fenóxido desconexión 2 fenil metil éter C3 C 3 ion metóxido Síntesis del fenil metil éter basada en la desconexión 1: La síntesis según la desconexión 1 no ofrece ninguna dificultad. Se efectuaría mediante ionización del fenol, seguida de reacción S 2 del ión fenóxido sobre un equivalente sintético del catión metilo, por ejemplo el yoduro de metilo (C 3 I). Como los fenoles son mucho más ácidos que los alcoholes se pueden ionizar de manera cuantitativa con bases más débiles que el a, como el K:
12 Tema ª etapa: ionización del fenol K Me K 2 fenol fenóxido de potasio 2ª etapa: reacción S 2 K 3 C I C3 KI yoduro de metilo fenil metil éter Síntesis del fenil metil éter basada en la desconexión 2 La desconexión 2 no es una desconexión adecuada porque la síntesis basada en esta desconexión no funciona. El problema de la desconexión 2 es el sintón catiónico para el que no se encuentra un equivalente sintético adecuado. Se podría pensar en un haluro de fenilo, por ejemplo el bromuro de fenilo, como equivalente sintético para el sintón catiónico de la desconexión 2. Sin embargo la reacción S 2 entre el anión metóxido y el bromuro de fenilo no tiene lugar porque el grupo saliente está enlazado a un carbono con hibridación sp 2 y las reacciones S 2 sólo funcionan sobre carbonos con hibridación sp 3. 1ª etapa: ionización del metanol C 3 metanol a TF C 3 a 2 2ª etapa: la reacción S 2 entre el metóxido y el bromuro de fenilo no funciona C 3 a no hay reacción En algunos compuestos aromáticos se pueden efectuar reacciones de sustitución nucleofílica si el anillo aromático contiene grupos fuertemente electrón-atrayentes situados en posiciones orto o para con respecto al grupo saliente. Por ejemplo, el 2,4-dinitrobromobenceno puede reaccionar con metóxido sódico para dar lugar al correspondiente aril metil éter.
13 Síntesis rgánica 13 Ejemplo de reacción de sustitución nucleofílica en un anillo aromático 2 2 C 3 a SuAr C 3 a 2 2 2,4-dinitrobromobenceno En este caso la sustitución del bromuro por el metóxido no tiene lugar según el mecanismo S 2 sino a través de un mecanismo de sustitución nucleofílica aromática (S u Ar). Este mecanismo consta de dos etapas. La primera es una etapa lenta, en la que el nucleófilo, en este caso el ión metóxido, ataca al carbono que soporta el grupo saliente. A diferencia de lo que ocurre en una reacción S 2, en una S u Ar no se produce la expulsión concomitante del grupo saliente con el ataque del nucleófilo. El ataque del nucleófilo destruye, momentáneamente, la aromaticidad del anillo colocando una carga negativa que puede estabilizarse por deslocalización electrónica. Los grupos nitro, fuertemente electrón-atrayentes situados en posiciones orto y para, ayudan a la deslocalización de la carga negativa y contribuyen a la estabilización del intermedio de la reacción. En la segunda etapa del proceso se expulsa el ión bromuro y se recupera la aromaticidad del anillo. Mecanismo de la reacción de Sustitución ucleófilica Aromática 1º. Ataque nucleofílico del metóxido al anillo aromático C 3 2 lenta C 3 C 3 C 3 2 etc º. Expulsión de bromuro y recuperación de la aromaticidad C 3 C 3 2 rápida En ausencia de los grupos nitro (caso del bromuro de fenilo) la carga negativa que se genera en el ataque del ión metóxido no puede estabilizarse adecuadamente y la reacción no funciona.
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
F FA AC C U ULTAD LTAD D D E
 FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
Reacciones de adición
 erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
o 0.96A o 1.43A 0.96A O O H CH 3 H
 Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
REACCIONES DE SÍNTESIS DE LOS ÁCIDOS CARBOXÍLICOS
 EAIES DE SÍTESIS DE LS ÁIDS ABXÍLIS 1.- xidación de los alcoholes primarios y aldehídos. En los temas anteriores ya se ha estudiado la oxidación de alcoholes primarios que mediante oxidantes fuertes se
EAIES DE SÍTESIS DE LS ÁIDS ABXÍLIS 1.- xidación de los alcoholes primarios y aldehídos. En los temas anteriores ya se ha estudiado la oxidación de alcoholes primarios que mediante oxidantes fuertes se
Conceptos basicos (III)
 erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
REACTIVIDAD DE LOS COMPUESTOS ORGÁNICOS
 REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
Reacciones de Eliminación 26/06/2012
 Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Ácido carboxílico Halogenuro de ácido Anhídrido de ácido Ester Amida O O R SR' O - R O O -
 X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES
 GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
Síntesis química de Inhibidores enzimáticos de la Pared Celular
 BLQUE TEMÁTIC 6.- Inhibidores Enzimáticos de la Pared Celular íntesis química de Inhibidores enzimáticos de la Pared Celular Daniel Collado Martín Departamento de Química rgánica Facultad de Ciencias Penicilinas
BLQUE TEMÁTIC 6.- Inhibidores Enzimáticos de la Pared Celular íntesis química de Inhibidores enzimáticos de la Pared Celular Daniel Collado Martín Departamento de Química rgánica Facultad de Ciencias Penicilinas
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
PONTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPTO. DE QUIMICA FUNDAMENTOS DE BIOLOGIA I COMPUESTOS DEL CARBONO
 PNTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPT. DE QUIMICA FUNDAMENTS DE BILGIA I CMPUESTS DEL CARBN Julio A. Pedrozo Pérez 2002 FUNCINES RGANICAS 1. Funciones oxigenadas - Alcoholes, Fenoles y
PNTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPT. DE QUIMICA FUNDAMENTS DE BILGIA I CMPUESTS DEL CARBN Julio A. Pedrozo Pérez 2002 FUNCINES RGANICAS 1. Funciones oxigenadas - Alcoholes, Fenoles y
TEMA 5. ESTRUCTURA Y PROPIEDADES MOLECULARES
 TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la
TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
C Cl 2sp 3 3p. C Br 2sp 3 4p C X = C X
 Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
ALCOHOLES. Estructura: grupo
 TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
Reacciones de Sustitución Electrofílica Aromática (S E Ar) Halogenación: Bromación y Cloración. Alquilación de Friedel-Crafts
 TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
Reacciones de reducción
 idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
ÉTERES O H H H CH H 3 C
 Teoría de Química rgánica I ÉTERES Estructura y enlace en éteres y epóxidos Los éteres pueden considerarse derivados orgánicos del agua en el que los átomos de hidrógeno han sido reemplazados por fragmentos
Teoría de Química rgánica I ÉTERES Estructura y enlace en éteres y epóxidos Los éteres pueden considerarse derivados orgánicos del agua en el que los átomos de hidrógeno han sido reemplazados por fragmentos
Adición. Eliminación. Sustitución
 Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA TANIA POZO CARRERA DE QUIMICA FARMACEUTICA ACIDEZ DE LOS ACIDOS CARBOXILICOS Los ácidos carboxílicos contienen el grupo carboxilo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA TANIA POZO CARRERA DE QUIMICA FARMACEUTICA ACIDEZ DE LOS ACIDOS CARBOXILICOS Los ácidos carboxílicos contienen el grupo carboxilo
QUÍMICA ORGÁNICA AVANZADA TEMA 08 : INTRODUCCIÓN A LA SÍNTESIS ORGÁNICA
 QUÍMICA RGÁNICA AVANZADA TEMA 08 : INTRDUCCIÓN A LA SÍNTESIS RGÁNICA 1 QUÍMICA RGÁNICA AVANZADA. TEMA 08. Juan A. Palop Programa 1. Introducción a la Síntesis rgánica. 2. Análisis retrosintético. 3. Método
QUÍMICA RGÁNICA AVANZADA TEMA 08 : INTRDUCCIÓN A LA SÍNTESIS RGÁNICA 1 QUÍMICA RGÁNICA AVANZADA. TEMA 08. Juan A. Palop Programa 1. Introducción a la Síntesis rgánica. 2. Análisis retrosintético. 3. Método
2. ACIDOS Y BASES, REACCIONES DE GRUPOS FUNCIONALES. (6 h)
 NOMBRE DE LA MATERIA: Síntesis Orgánica Avanzada CODIGO DE LA MATERIA: I6996 DEPARTAMENTO: Química CARGA TOTAL DE HORAS DE TEORIA: 68 CARGA TOTAL DE HORAS DE TRABAJO: INDEPENDIENTE: 64 TOTAL DE HORAS:
NOMBRE DE LA MATERIA: Síntesis Orgánica Avanzada CODIGO DE LA MATERIA: I6996 DEPARTAMENTO: Química CARGA TOTAL DE HORAS DE TEORIA: 68 CARGA TOTAL DE HORAS DE TRABAJO: INDEPENDIENTE: 64 TOTAL DE HORAS:
CONDENSACIONES. Nucleofilo O. O Reactante que sufre adición OH - C H. Reactante que sufre sustitución H 2 O C O -
 NDENSAINES En química orgánica, se conoce como reacciones de condensación a aquellas que se llevan a cabo entre dos compuestos, los cuales tienen el grupo funcional carbonilo dentro de su estructura (
NDENSAINES En química orgánica, se conoce como reacciones de condensación a aquellas que se llevan a cabo entre dos compuestos, los cuales tienen el grupo funcional carbonilo dentro de su estructura (
Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES
 Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES OBJETIVOS: 1. Identificar las propiedades físicas y químicas que presentan los alcoholes. 2. Aprender a reconocer entre los alcoholes primarios, secundarios
Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES OBJETIVOS: 1. Identificar las propiedades físicas y químicas que presentan los alcoholes. 2. Aprender a reconocer entre los alcoholes primarios, secundarios
OTRAS REACCIONES DE LOS ALCOHOLES
 OTRAS REACCIONES DE LOS ALCOHOLES Reacciones Típicas de los Alcoholes La figura muestra cuatro modos típicos de reaccionar de los alcoholes. En cada uno de ellos, se rompe uno ómásde los cuatro enlaces
OTRAS REACCIONES DE LOS ALCOHOLES Reacciones Típicas de los Alcoholes La figura muestra cuatro modos típicos de reaccionar de los alcoholes. En cada uno de ellos, se rompe uno ómásde los cuatro enlaces
3.- Cuál de las siguientes formulaciones es la correcta para la sal trioxoclorato (V) de litio (clorato de litio)?
 UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
TEMA 5 ESTRUCTURA Y PROPIEDADES MOLECULARES
 TEMA 5 ETRUCTURA Y PRPIEDADE MLECULARE 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la estructura
TEMA 5 ETRUCTURA Y PRPIEDADE MLECULARE 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la estructura
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
Biopolímero s (4831)
 Biopolímero s (4831) 4.3. Conceptos de catálisis química. 4.3.3. Ejemplos de tipos de catálisis. Aplicación a la catálisis enzimática Los iones metálicos como catalizadores Como se dijo anteriormente los
Biopolímero s (4831) 4.3. Conceptos de catálisis química. 4.3.3. Ejemplos de tipos de catálisis. Aplicación a la catálisis enzimática Los iones metálicos como catalizadores Como se dijo anteriormente los
BLOQUE TEMÁTICO VI. ALCOHOLES, FENOLES Y ÉTERES (Problemas)
 LQUE TEMÁTI VI LLES, FENLES Y ÉTERES (Problemas) Química rgánica I-www.sinorg.uji.es 3 Problema 6.1. Proponga mecanismos que expliquen las siguientes reacciones: a) b) Problema 6.2. eduzca cuáles serán
LQUE TEMÁTI VI LLES, FENLES Y ÉTERES (Problemas) Química rgánica I-www.sinorg.uji.es 3 Problema 6.1. Proponga mecanismos que expliquen las siguientes reacciones: a) b) Problema 6.2. eduzca cuáles serán
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN
 CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
Ecuación de Hammett 1
 Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
2ª Parte: Estructura y reactividad de
 2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
UNIDAD IV ALCOHOLES. Alcoholes: Usos, propiedades y aplicaciones. Pte. M. en C.Q. Macaria Hernández Chávez
 UNIDAD IV ALCOHOLES Alcoholes: Usos, propiedades y aplicaciones Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. La mayor parte de los alcoholes comunes, hasta con 11 ó 12 átomos de carbono,
UNIDAD IV ALCOHOLES Alcoholes: Usos, propiedades y aplicaciones Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. La mayor parte de los alcoholes comunes, hasta con 11 ó 12 átomos de carbono,
ESPECTROSCOPÍA ESPECTROMETRIA DE MASAS
 ESPECTROSCOPÍA ESPECTROMETRIA DE MASAS La espectrometría de masas es una técnica experimental que permite la medición de iones derivados de moléculas. El espectrómetro de masas es un instrumento que permite
ESPECTROSCOPÍA ESPECTROMETRIA DE MASAS La espectrometría de masas es una técnica experimental que permite la medición de iones derivados de moléculas. El espectrómetro de masas es un instrumento que permite
Tema 9.- Aldehídos y cetonas. El grupo carbonilo
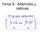 Tema 9.- Aldehídos y cetonas El grupo carbonilo Los aldehídos y cetonas son las funciones que vamos a estudiar en este Tema, probablemente uno de los más importantes de la asignatura. Nomenclatura propanal
Tema 9.- Aldehídos y cetonas El grupo carbonilo Los aldehídos y cetonas son las funciones que vamos a estudiar en este Tema, probablemente uno de los más importantes de la asignatura. Nomenclatura propanal
Química del Carbono, Curso /05/2014. Tema 9. Química del Carbono. El carbono: Z=6 A=12. C =1s 2 2s 2 p 2
 Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Los principales grupos funcionales son los siguientes:
 GRUPOS FUNCIONALES Qué es un grupo funcional? Hemos visto que los hidrógenos de los hidrocarburos pueden ser sustituidos por átomos de otro metal o por un agrupamiento de átomos para obtener compuestos
GRUPOS FUNCIONALES Qué es un grupo funcional? Hemos visto que los hidrógenos de los hidrocarburos pueden ser sustituidos por átomos de otro metal o por un agrupamiento de átomos para obtener compuestos
Plan de Estudios Licenciatura en Química
 Plan de Estudios CONTENIDOS 1) Presentación 5) Objetivos 2) Requisitos 6) Cursos Obligatorios 3) Plan de Estudios / Duración 7) Cursos Sugeridos 4) Tabla de Créditos 1) Presentación Su programa de Licenciatura
Plan de Estudios CONTENIDOS 1) Presentación 5) Objetivos 2) Requisitos 6) Cursos Obligatorios 3) Plan de Estudios / Duración 7) Cursos Sugeridos 4) Tabla de Créditos 1) Presentación Su programa de Licenciatura
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva, Ejercicio 4, Opción
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Tema 10. El empleo de nitrocompuestos en síntesis. Acidez. Alquilación de nitrocompuestos.
 Síntesis rgánica 1 Tema 10. El empleo de nitrocompuestos en síntesis. Acidez. Alquilación de nitrocompuestos. Los nitrocompuestos alifaticos se caracterizan por ser particularmente acidos. Por ejemplo,
Síntesis rgánica 1 Tema 10. El empleo de nitrocompuestos en síntesis. Acidez. Alquilación de nitrocompuestos. Los nitrocompuestos alifaticos se caracterizan por ser particularmente acidos. Por ejemplo,
TEMA 4. ESTRUCTURA DE LAS MOLÉCULAS ORGÁNICAS
 W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos
 QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
Química orgánica. Cuarto Medio 25/06
 Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
Universidad Simón Bolívar ESTRUCTURAS LEWIS Y ESTRUCTURAS RESONANTES
 ESTRUCTURAS LEWIS Y ESTRUCTURAS RESONANTES 1 Escribe las estructuras de Lewis de los siguientes compuestos, e indica qué átomos presentan cargas formales en los compuestos que sea necesario: Solución 2.1
ESTRUCTURAS LEWIS Y ESTRUCTURAS RESONANTES 1 Escribe las estructuras de Lewis de los siguientes compuestos, e indica qué átomos presentan cargas formales en los compuestos que sea necesario: Solución 2.1
3.4.3- Adición de agua. Hidratación. Ejemplo:
 Química rgánica Biología 3.4.3- Adición de agua. idratación. Ejemplo: En el caso de los alquinos la adición de agua ocurre de manera semejante a los alquenos con la única salvedad de que el producto que
Química rgánica Biología 3.4.3- Adición de agua. idratación. Ejemplo: En el caso de los alquinos la adición de agua ocurre de manera semejante a los alquenos con la única salvedad de que el producto que
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II
 SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL
 Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS
 FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular C n H 2n+2 Sufijo ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-;
FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular C n H 2n+2 Sufijo ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-;
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS
 TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
Carbocationes. sp 3. Formación de Carbocationes
 arbocationes Los carbocationes son intermediarios orgánicos en los que el carbono está cargado positivamente. Una gran cantidad de reacciones orgánicas proceden a través de la formación de carbocationes.
arbocationes Los carbocationes son intermediarios orgánicos en los que el carbono está cargado positivamente. Una gran cantidad de reacciones orgánicas proceden a través de la formación de carbocationes.
, H 2 SO 4, HSO 4-. HClO 4, ClO 4-, H 2 O, H 3 O +, OH -, S =, H 2 S, HS -, NH 3, NH 4+, CO 3 =, HCO 3
 1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
2ª Parte: Estructura y reactividad de
 2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
TEMA 4 ALCOHOLES, FENOLES, ETERES Y TIOLES
 4.1- INTRODUCCIÓN. - Alcoholes TEMA 4 ALCOLES, FENOLES, ETERES Y TIOLES Química Orgánica Biología - Cadena carbonada más larga que contenga el grupo. Cada nombre se deriva agregando al nombre del alcano
4.1- INTRODUCCIÓN. - Alcoholes TEMA 4 ALCOLES, FENOLES, ETERES Y TIOLES Química Orgánica Biología - Cadena carbonada más larga que contenga el grupo. Cada nombre se deriva agregando al nombre del alcano
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno
 Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
REACTIVIDAD DE LOS COMPUESTOS DE CARBONO
 12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
TEMA 2 CLASIFICACION Y NOMECLATURA DE LOS COMPUESTOS ORGANICOS
 TEMA LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. oncepto de radical y grupo funcional. Series homólogas.. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. Fundamentos de Química rgánica
TEMA LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. oncepto de radical y grupo funcional. Series homólogas.. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. Fundamentos de Química rgánica
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
QUÍMICA - 2º DE BACHILLERATO EJERCICIOS DE SELECTIVIDAD UNIDADES 8 Y 9: QUÍMICA ORGÁNICA CUESTIONES 1
 CUESTIONES 1 HOJA 8-1 2002 modelo: Escribe el nombre de los compuestos que se indican a continuación: a) CH 3 -CH 2 COOCH 3 b) CH 3 -CH 2 CO CH 2 CH 3 c) CH 3 CHOH- CH 2 CH = CH 2 d) CH 3 -CH 2 NH 2 e)
CUESTIONES 1 HOJA 8-1 2002 modelo: Escribe el nombre de los compuestos que se indican a continuación: a) CH 3 -CH 2 COOCH 3 b) CH 3 -CH 2 CO CH 2 CH 3 c) CH 3 CHOH- CH 2 CH = CH 2 d) CH 3 -CH 2 NH 2 e)
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
TEMA 2: COMPUESTOS OXIGENADOS
 TEMA 2: CMPUESTS XIGENADS Son compuestos constituidos por carbono, hidrógeno y oxígeno. Vamos a estudiar los compuestos oxigenados siguientes: alcoholes (y fenoles), éteres, aldehidos, cetonas, ácidos
TEMA 2: CMPUESTS XIGENADS Son compuestos constituidos por carbono, hidrógeno y oxígeno. Vamos a estudiar los compuestos oxigenados siguientes: alcoholes (y fenoles), éteres, aldehidos, cetonas, ácidos
Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales
 Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales Enrique Dans. Creative Commons. http://www.flickr.com/photos/edans/1239
Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales Enrique Dans. Creative Commons. http://www.flickr.com/photos/edans/1239
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
ESTRUCTURA DE COMPUESTOS ORGÁNICOS
 ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
ORGÁNICA I. 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua.
 ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN
 PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS.
 PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
Tema 12. PREPARACIÓN DE ALQUENOS
 Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
Primer seminario de laboratorio: Extracción. Química Orgánica I
 Primer seminario de laboratorio: Extracción Química Orgánica I Extracción Es un proceso físico en el cuál un compuesto o mezcla de compuestos se transfieren de una fase a otra. DISOLUCIÓN SELECTIVA Extración
Primer seminario de laboratorio: Extracción Química Orgánica I Extracción Es un proceso físico en el cuál un compuesto o mezcla de compuestos se transfieren de una fase a otra. DISOLUCIÓN SELECTIVA Extración
Informe del trabajo práctico nº7
 Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN INTRODUCCIÓN
 Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
2A Reacciones de Sustitución Nucleofílica Alifática. Obtención de Cloruro de ter-butilo.
 PRÁCTICA 2A Reacciones de Sustitución Nucleofílica Alifática. Obtención de Cloruro de ter-butilo. I. OBJETIVOS. a) Conocer la preparación de un haluro de alquilo terciario a partir del alcohol correspondiente,
PRÁCTICA 2A Reacciones de Sustitución Nucleofílica Alifática. Obtención de Cloruro de ter-butilo. I. OBJETIVOS. a) Conocer la preparación de un haluro de alquilo terciario a partir del alcohol correspondiente,
León Felipe Otálvaro Tamayo Química Orgánica I 1 CONCEPTOS BÁSICOS DE NOMENCLATURA
 León Felipe tálvaro Tamayo Química rgánica I 1 EPTS BÁSIS DE MELATUA MELATUA DE ALAS Existen procedimientos que se pueden seguir cuando nombramos un compuesto orgánico, y consideraremos estos casos mirando
León Felipe tálvaro Tamayo Química rgánica I 1 EPTS BÁSIS DE MELATUA MELATUA DE ALAS Existen procedimientos que se pueden seguir cuando nombramos un compuesto orgánico, y consideraremos estos casos mirando
GUÍA N 1: Enlace Químico y Grupos Funcionales
 UIVERSIDAD MAYR PRIMERA PARTE: Ejercicios de desarrollo. GUÍA : Enlace Químico y Grupos Funcionales.- Defina enlace químico y señale los tipos de enlaces químicos que se pueden presentar en una molécula
UIVERSIDAD MAYR PRIMERA PARTE: Ejercicios de desarrollo. GUÍA : Enlace Químico y Grupos Funcionales.- Defina enlace químico y señale los tipos de enlaces químicos que se pueden presentar en una molécula
EL ARCO IRIS DE LA REACTIVIDAD DE CATIONES
 EL ARC IRIS DE LA REACTIVIDAD DE CATINES RJ: REACTIVIDAD DEL HIERR CN EL SULFCIANUR El hierro, en estado de oxidación (+3), cuando está en disolución es incoloro. Este catión tiene la capacidad de combinarse
EL ARC IRIS DE LA REACTIVIDAD DE CATINES RJ: REACTIVIDAD DEL HIERR CN EL SULFCIANUR El hierro, en estado de oxidación (+3), cuando está en disolución es incoloro. Este catión tiene la capacidad de combinarse
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
Conceptos basicos del equilibrio de quimico en medio acuoso
 Conceptos basicos del equilibrio de quimico en medio acuoso Elaborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM QU ÍM IC A A N A LÍTIC A I C LAV E 1402 G rupo 4, s em es tre 2010-2 CONCEPTOS BASICOS
Conceptos basicos del equilibrio de quimico en medio acuoso Elaborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM QU ÍM IC A A N A LÍTIC A I C LAV E 1402 G rupo 4, s em es tre 2010-2 CONCEPTOS BASICOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II INTEGRANTES: Herrera Natalia Álvarez Santiago BIQUIMICA CLINICA QUIMICA NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II INTEGRANTES: Herrera Natalia Álvarez Santiago BIQUIMICA CLINICA QUIMICA NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
 REACCIONES DE TRANSFERENCIA DE PROTONES 1.-junio 1997 a) El ph de una disolución 0.2 M de ácido fórmico (ácido metanoico) cuya K a = 10-4 b) El ph y el grado de disociación del ácido fórmico cuando a 40
REACCIONES DE TRANSFERENCIA DE PROTONES 1.-junio 1997 a) El ph de una disolución 0.2 M de ácido fórmico (ácido metanoico) cuya K a = 10-4 b) El ph y el grado de disociación del ácido fórmico cuando a 40
O H O OH O OR O O C. O Cl
 Química rgánica 1 Tema 10. ompuestos carbonílicos: aldehídos y cetonas. Estructura. omenclatura. eacciones de adición nucleofílica al grupo carbonilo. Adición de agua: formación de hidratos. Adición de
Química rgánica 1 Tema 10. ompuestos carbonílicos: aldehídos y cetonas. Estructura. omenclatura. eacciones de adición nucleofílica al grupo carbonilo. Adición de agua: formación de hidratos. Adición de
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS
 CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
LAS AMINAS. Se pueden considerar compuestos derivados del amoníaco (NH 3
 LAS AMIAS Se pueden considerar compuestos derivados del amoníaco ( 3 ) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se substituyan
LAS AMIAS Se pueden considerar compuestos derivados del amoníaco ( 3 ) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se substituyan
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO.
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 010-011 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 010-011 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
los compuestos orgánicos.
 2ª Parte: Estructura y reactividad de los compuestos orgánicos. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos aromáticos. -
2ª Parte: Estructura y reactividad de los compuestos orgánicos. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos aromáticos. -
Ejercicios variados resueltos
 Ejercicios variados resueltos Programa de Acceso Inclusivo, Equidad y Permanencia 1. Cuál de los siguientes compuestos es isómero del CH 3 CH 2 COOH? a) CH 3 CO CH 2 OH b) CH 3 CH 2 CHO c) CH 2 =CH COOH
Ejercicios variados resueltos Programa de Acceso Inclusivo, Equidad y Permanencia 1. Cuál de los siguientes compuestos es isómero del CH 3 CH 2 COOH? a) CH 3 CO CH 2 OH b) CH 3 CH 2 CHO c) CH 2 =CH COOH
