Coagulación sanguínea
|
|
|
- Beatriz Rivero Bustos
- hace 7 años
- Vistas:
Transcripción
1 34 Coagulación sanguínea I. VISIÓN GENERAL La formación de coágulos sanguíneos (coagulación) tiene por objetivo detener rápidamente la hemorragia causada por la afectación de un vaso sanguíneo y mantener un volumen sanguíneo constante (hemostasia). La coagulación se consigue a través de la vasoconstricción y la formación de un coágulo (trombo) que consiste en una agregación de plaquetas y una red de la proteína fibrina que estabiliza el trombo hemostático. La coagulación está relacionada con las membranas de la superficie de las plaquetas y los vasos sanguíneos afectados (fig. 34-1). [Nota: si la formación del coágulo se produce en un vaso intacto de manera que la luz se ocluye y se impide el flujo sanguíneo, puede tener lugar una trombosis, puede producirse una afección tisular grave y puede incluso sobrevenir la muerte. Es lo que ocurre, por ejemplo, en un infarto de miocardio.] Los procesos que limitan la formación de coágulos en la zona de la afección y que eliminan el coágulo una vez iniciado el proceso de reparación del vaso también desempeñan funciones importantes en la hemostasia. [Nota: explicar por separado la formación del trombo hemostático y la formación de la red de fibrina facilita la presentación de estos procesos en los que intervienen muchos componentes y muchos pasos. No obstante, ambos están interrelacionados para mantener la hemostasia.] LUZ EL VASO Capa endotelial Eritrocito Plaqueta activada atrapado Fibrina Subendotelio Figura 34-1 Coágulo de sangre formado por un trombo de plaquetas activadas y una red de fibrina en el sitio de la lesión del vaso. II. FORMACIÓN E LA RE E FIBRINA En la formación de la red de fibrina intervienen únicamente dos vías que convergen para formar una vía común (fig. 34-2). En cada vía, los principales componentes son proteínas (llamadas factores) designadas por números romanos. Los factores son glucoproteínas sintetizadas y segregadas principalmente por el hígado. [Nota: varios factores también reciben otros nombres. Por ejemplo, el factor activo X (FXa), el punto de convergencia de la vía, también se conoce como factor Stuart.] Vía 1 FXa Vía común A. Cascada proteolítica entro de las vías, se establece una cascada en la que las proteínas pasan de una forma inactiva, o cimógeno, a una forma activa por escisión proteolítica en la que el producto proteínico de una reacción de activación inicia otra. La forma activa de un factor se designa con una «a» minúscula después del número. Las proteínas activas FIIa, FVIIa, FIXa, FXa, FXIa y FXIIa son enzimas que actúan como serina proteasas con especificidad Vía 2 Red de fibrina Figura 34-2 Las tres vías implicadas en la formación de la red de fibrina. 1 FerrierCap_online.indd 1 15/01/14 17:11
2 2 34. Coagulación sanguínea FIX (factor Christmas) FXIa 1 2 Arg 145 Arg 180 Figura 34-3 Activación del FIX (factor Christmas) mediante proteólisis por parte del factor serina proteasa FXIa. [Nota: la activación puede tener lugar por cambio conformacional de alguno de los factores.] a, activo; Arg, arginina. Puente de calcio S Fosfolípidos de membrana Gla OOC H 3 N + Polipéptido SANGRE Ca 2+ COO OOC Ca 2+ FII, FVII, FIX, FX COO S COO Figura 34-4 El Ca 2+ facilita la unión de factores que contienen γ-carboxiglutamato (Gla) a los fosfolípidos de la membrana. F, factor. H N CH CH COO C O COO Polipéptido Residuo de carboxiglutamato Figura 34-5 Residuo de γ-carboxiglutamato. como la tripsina y, por lo tanto, escinden un enlace peptídico del extremo carboxílico de un residuo de arginina o lisina en un polipéptido. Por ejemplo, el FIX (factor Christmas) se activa a través de la escisión de la arginina 145 y la arginina 180 por parte de FXIa (fig. 34-3). La cascada proteolítica produce una enorme aceleración de la velocidad, porque una proteasa activa puede producir muchas moléculas de producto activo, cada una de las cuales, a su vez, puede activar muchas moléculas de la figura siguiente en la cascada. En algunos casos, la activación puede ser debida a un cambio conformacional de la figura en ausencia de proteólisis. [Nota: las proteínas no proteolíticas constituyen proteínas accesorias (cofactores) de las vías. El FIII, el FV y el FVIII son las proteínas accesorias.] B. Función de la fosfatidilserina y el calcio La presencia del fosfolípido cargado negativamente fosfatidilserina (FS) y de los iones de calcio cargados positivamente (Ca 2+ ) acelera la velocidad de algunos pasos de la cascada. 1. Fosfatidilserina cargada negativamente: la FS se localiza principalmente en la cara intracelular (citosólica) de la membrana plasmática. Su exposición indica lesión de las células endoteliales que revisten los vasos sanguíneos. La FS también queda expuesta en la superficie de las plaquetas activadas. 2. Iones de calcio: el Ca 2+ se une a los residuos de g-carboxiglutamato (Gla) cargados negativamente que hay en determinadas serina proteasas de la coagulación (FII, FVII, FIX y FX), lo que facilita la unión de estas proteínas a los fosfolípidos expuestos (fig. 34-4). Los residuos Gla son buenos fijadores del Ca 2+ gracias a sus dos grupos contiguos carboxílicos cargados negativamente (fig. 34-5). [Nota: el uso de sustancias quelantes, tales como citrato de sodio que fija Ca 2+, en las sondas o bolsas que se utilizan para extraer sangre impide que ésta se coagule.] C. Formación de residuos de g-carboxiglutamato La g-carboxilación es una modificación postraduccional en la que los residuos de glutamato 9-12 (en el extremo amino o N de la figura diana) son carboxilados en el carbono g, por lo que se forman residuos Gla. El proceso tiene lugar en el retículo endoplásmico rugoso (RER) del hígado. 1. g-carboxilación: esta reacción de carboxilación requiere un sustrato proteínico, O 2, CO 2, γ-glutamilcarboxilasa y la forma hidroquinona de la vitamina K como coenzima (fig. 34-6). En la reacción, la forma hidroquinona de la vitamina K se oxida a su forma epóxido a medida que el O 2 se reduce a agua. [Nota: la vitamina K, una vitamina liposoluble (v. pág. 389), se reduce y pasa de la forma quinona a la forma hidroquinona de la coenzima por medio de la vitamina K reductasa (fig. 34-7).] 2. Inhibición por warfarina: la formación de residuos Gla es sensible a la inhibición por warfarina, un análogo sintético de la vitamina K que inhibe la enzima vitamina K epóxido reductasa (VKOR). Se requiere reductasa, un complejo proteínico integral de la membrana del RER, para regenerar la forma hidroquinona funcional de la vitamina K a partir de la forma epóxido generada en la reacción de g-carboxilación. Así pues, la warfarina constituye un anticoagulante que inhibe la coagulación actuando como antagonista de la vitamina K. Las sales de warfarina se utilizan desde el punto de vista terapéutico para limitar la formación de coágulos. [Nota: la warfarina se utiliza comercialmente como sustancia para controlar plagas, como es el caso del veneno para
3 II. Formación de la red de fibrina 3 Warfarina Vitamina K epóxido reductasa (forma hidroquinona) Polipéptido Vitamina K (reducida) Vitamina K (oxidada) (forma epóxido) Grupo R Glu COO O 2, CO 2 Gla + 2H 2 O γ -glutamilcarboxilasa CH COO COO Figura 34-6 γ-carboxilación de un residuo de glutamato (Glu) a γ-carboxiglutamato (Gla) por la γ -glutamilcarboxilasa que requiere vitamina K. El carbono γ aparece en color azul. ratas. Fue sintetizada por la Wisconsin Alumni Research Foundation, de ahí el nombre.]. Vías Las diferencias genéticas (genotipos) en el gen de la subunidad 1 del complejo VKOR (VKORC1) influyen en la respuesta del paciente a la warfarina. Por ejemplo, un polimorfismo en la región del promotor del gen disminuye la expresión génica, lo que hace que se forme menos VKOR y en consecuencia se requiera una menor dosis de warfarina para conseguir una concentración terapéutica. También son conocidos los polimorfismos de la enzima del citocromo P450 (CYP2C9) que metaboliza warfarina. En 2010, la Food and rug Administration de Estados Unidos añadió una tabla de dosis basada en el genotipo en el prospecto de la warfarina (dentro del envase). La influencia de la genética en la respuesta de un individuo se conoce como farmacogenética. Hay tres vías distintas que intervienen en la formación de la red de fibrina: la vía extrínseca, la vía intrínseca y la vía común. La producción de FXa por parte de las vías extrínseca e intrínseca inicia la vía común (v. fig. 34-2). 1. Vía extrínseca: en esta vía interviene una figura, el factor tisular (FT), que no está en la sangre pero que se halla expuesto cuando los vasos sanguíneos se lesionan. El FT (FIII) es una glucoproteína transmembrana abundante en el subendotelio vascular. Se trata de una proteína accesoria extravascular y no de una proteasa. Cualquier lesión que exponga FIII a la sangre rápidamente (en segundos) inicia la vía extrínseca (o del FT). Una vez expuesto, el FT se une a una proteína circulante que contiene Gla, el FVII, que se activa a través de un cambio conformacional. [Nota: el FVII también puede activarse proteolíticamente a través de la trombina (v. apartado 3 más adelante).] La unión de FVII al FT requiere la presencia de Ca 2+ y de fosfolípidos. VKOR O O Vitamina K (quinona) OH OH CH 3 R Vitamina K reductasa Vitamina K (hidroquinona) O CH 3 R γ -glutamilcarboxilasa CH 3 O R O Vitamina K (epóxido) Figura 34-7 Ciclo de la vitamina K. VKOR, vitamina K epóxido reductasa.
4 4 34. Coagulación sanguínea FVII (Gla) FT (FIII) Ca 2+, FL [FVIIa FT(FIII)] IVFT A continuación se forma el complejo FT-FVIIa y activa el FX mediante proteólisis (fig. 34-8). En consecuencia, la activación del FX por la vía extrínseca tiene lugar en asociación con la membrana. La vía extrínseca es inactivada rápidamente por el inhibidor de la vía del factor tisular (IVFT) que, por medio de un proceso dependiente de FXa, se une al complejo FT-FVIIa y evita la posterior producción de FXa. [Nota: el FT y el FVII son exclusivos de la vía extrínseca.] FX (Gla) Ca 2+ FL FXa 2. Vía intrínseca: todos los factores proteínicos que intervienen en la vía intrínseca se encuentran en la sangre y son, por lo tanto, intravasculares. La vía intrínseca consta de dos fases: la fase de contacto y la fase de activación del FX, ambas con carencias conocidas. FXI FXIIa [FVW FVIII] FVW FIX (Gla) FXIa Ca 2+ F L FVIIIa Coágulo de fibrina Figura 34-8 Vía extrínseca o del factor tisular (FT). La unión del FVII al FT expuesto (FIII) activa el FVII. [Nota: la vía se inhibe rápidamente con el inhibidor de la vía del factor tisular (IVFT).] a, activo; F, factor; FL, fosfolípido; Gla, γ-carboxiglutamato. FIXa FX (Gla) Ca 2+ FL FXa Coágulo de fibrina Figura 34-9 Fase de activación del FX de la vía intrínseca. [Nota: el factor de Von Willebrand (FVW) estabiliza el FVIII en la circulación.] a, activo; F, factor; FL, fosfolípido; Gla, γ-carboxiglutamato. a. Fase de contacto: en esta fase tiene lugar la activación del FXII (factor de Hageman) a FXIIa mediante un cambio conformacional a través de la unión a una superficie negativa. Las carencias de FXII (o de las otras proteínas de esta fase, cininógeno y precalicreína, de alto peso molecular) no causan problemas hemorrágicos, lo que cuestiona la importancia de esta fase en la coagulación. No obstante, la fase de contacto desempeña un papel clave en la inflamación. [Nota: el FXII puede activarse proteolíticamente mediante trombina (v. apartado 3 más adelante)]. b. Fase de activación del factor X: la secuencia de acontecimientos que lleva a la activación del factor X a FXa por medio de la vía intrínseca es iniciada por el FXIIa (fig. 34-9). El FXIIa activa el FXI, y el FXIa activa el FIX, una proteína que contiene Gla. El FIXa se combina con el FVIIIa (una proteína accesoria de transmisión hemática [no enzimática]), y el complejo activa el FX, una serina proteasa que contiene Gla. [Nota: el complejo que contiene FIXa, FVIIIa y FX se forma en regiones de la membrana expuestas y cargadas negativamente, y el FX es activado por el FXa. A veces se hace referencia a este complejo como Xasa. La unión del complejo a los fosfolípidos de la membrana requiere Ca 2+.] c. Carencia del factor XII: una carencia del FXII no provoca un trastorno hemorrágico. Esto es así porque el FXI, la siguiente proteína de la cascada, puede ser activada proteolíticamente por la trombina (v. apartado 3 más adelante). d. Hemofilia: la hemofilia es una coagulopatía, una alteración en la capacidad para coagular. La hemofilia A (la forma más frecuente de hemofilia) se debe a una carencia del FVIII, mientras que la carencia del FIX produce hemofilia B. Cada carencia se caracteriza por una menor capacidad para coagular o por un retraso en dicha capacidad, así como por la formación de coágulos anormalmente friables (que se rompen fácilmente). Esto puede manifestarse, por ejemplo, con hemorragia articular (fig ). El grado de alteración del factor determina la gravedad de la enfermedad. La terapia actual de la hemofilia es el tratamiento restitutivo de factores, que utiliza factores obtenidos a partir de sangre humana mezclada o mediante tecnología de AN recombinante. El objetivo es el tratamiento restitutivo de genes. Los genes de ambas proteínas se hallan en el cromosoma X, por lo que la hemofilia es un trastorno ligado a dicho cromosoma. [Nota: la carencia de FXI produce un trastorno hemorrágico al que a veces se hace referencia como hemofilia C.]
5 II. Formación de la red de fibrina 5 La inactivación de la vía extrínseca por el IVFT causa una dependencia de la vía intrínseca para la producción continuada de FXa. Esto explica por qué los sujetos con hemofilia sangran incluso aunque la vía extrínseca se mantenga intacta. 3. Vía común: el FXa producido tanto en la vía intrínseca como en la extrínseca inicia la vía común, una secuencia de acontecimientos que provoca la generación de fibrina (FIa) (fig ). El FXa se relaciona con el FVa (una proteína accesoria de transmisión hemática [no enzimática]) y, en presencia de Ca 2+ y fosfolípidos, forma un complejo unido a la membrana al que se hace referencia como protrombinasa. El complejo escinde la protrombina (FII) a trombina (FIIa). [Nota: el FVa potencia la actividad proteolítica del FXa.] La unión de Ca 2+ a los residuos Gla del FII facilita la unión del FII a la membrana y al complejo protrombinasa, con la posterior escisión a trombina. La escisión separa la región que contiene Gla, liberando trombina de la membrana y, por lo tanto, liberándola para activar fibrinógeno (FI) a la sangre. [Nota: es el único ejemplo de escisión de una proteína Gla que provoca la liberación de un péptido que contiene Gla. El péptido se desplaza al hígado donde se cree que actúa como señal para aumentar la producción de proteínas coagulantes.] Se ha aprobado el uso clínico limitado de los inhibidores orales directos del FXa como anticoagulantes. Figura Hemorragia continua a los espacios articulares (hemartros) en un sujeto con hemofilia. Una mutación puntual habitual (G20210A) en la que una adenina (A) sustituye a una guanina (G) en el nucleótido de la región sin traducir 3 del gen de la protrombina hace que la concentración de protrombina en el torrente circulatorio sea mayor. Esto produce trombofilia, una enfermedad que se caracteriza por una mayor tendencia a coagular. a. Conversión del fibrinógeno en fibrina por parte de la trombina: el fibrinógeno es una glucoproteína soluble que se sintetiza en el hígado. Consta de dímeros de tres cadenas polipeptídicas Vía intrínseca Protrombina (FII) (Gla) FXa FVa [FXa FVa] (protrombinasa) Ca 2+ FL Vía extrínseca Trombina (FIIa) + péptido que contiene Gla Fibrinógeno Fibrina (FIa) Figura Generación de fibrina por el FXa y vía común. a, activo; F, factor; FL, fosfolípido; Gla, γ-carboxiglutamato.
6 6 34. Coagulación sanguínea («Penachos» cargados negativamente) Trombina E Fibrinógeno Monómero de fibrina E E H 2 O Fibrinopéptidos (A + B) Asociación no covalente Coágulo blando de fibrina Figura Conversión del fibrinógeno en fibrina y formación del coágulo blando de fibrina. [Nota: y E hacen referencia a los dominios en la fibrina.] E [(Aa) 2 (Bb 2 (g) 2 ] unidas en los extremos N por enlaces disulfuro. [Nota: Aa y Bb representan cada una un único polipéptido.] Los extremos N de las cadenas Aa y Bb forman «penachos» en la parte central de los tres dominios globulares (fig ). Los penachos están cargados negativamente y producen repulsión entre las moléculas de fibrinógeno. La trombina escinde los penachos cargados (liberando los fibrinopéptidos A y B) y el fibrinógeno se convierte en fibrina. Como resultado de la pérdida de carga, los monómeros de fibrina pueden asociarse no covalentemente en una matriz sucesiva y se forma un coágulo de fibrina blando (soluble). b. Formación de puentes transversales en la fibrina: las moléculas de fibrina asociadas forman puentes transversales covalentes. Esto convierte el coágulo blando en un coágulo duro (insoluble). El FXIIIa, una transglutaminasa, une covalentemente el grupo g-carboxamida de un residuo de glutamina de una molécula de fibrina con el grupo e-amino de un residuo de lisina de otra molécula de fibrina por medio de un enlace isopeptídico y liberando amoníaco (fig ). [Nota: el FXIII también es activado por trombina.] c. Importancia de la trombina: la activación del FX por la vía extrínseca proporciona la «chispa» del FXa que provoca la activación inicial de la trombina. La trombina activada activa a continuación factores de las vías común (FV, FI, FXIII), intrínseca (FXI, FVIII) y extrínseca (FVII) (fig ). También activa el FXII de la fase de contacto. A continuación, la vía extrínseca inicia la coagulación mediante la generación del FXa, y la vía intrínseca amplifica y sostiene la coagulación después que la vía extrínseca haya sido inhibida por el IVFT. [Nota: la hirudina, un péptido segregado a partir de la glándula salival de sanguijuelas medicinales, es un inhibidor potente, directo y oral de la trombina. Se ha aprobado el uso clínico limitado de la hirudina recombinante.] Se consigue más interferencia entre las vías de la coagulación mediante la activación de la vía intrínseca mediada por FVIIa-FT y la activación de la vía extrínseca mediada por FXIIa. En la figura se muestra la representación completa de la coagulación sanguínea fisiológica por medio de la formación de un coágulo de fibrina duro. En la figura se muestran los factores de la cascada de la coagulación organizados por función. Lisina Grupo R Lisina FV FVa FVII FVIIa Grupo R NH 2 + NH 2 C=O Glutamina FXIIIa (transglutaminasa) Enlace isopeptídico NH C=O + NH 3 Glutamina FIa FI Trombina (IIa) FVIII FVIIIa FXI FXIa FXIIIa FXIII Figura Formación de puentes transversales en la fibrina. El FXIIIa forma un enlace isopeptídico covalente entre un residuo de lisina y un residuo de glutamina. F, factor. Figura Importancia de la trombina en la formación del coágulo de fibrina. a, activo; F, factor.
7 III. Limitación de la coagulación 7 Vía intrínseca (amplifica, mantiene) FIIa FXII FXIIa FXI FXIa FIIa Vía extrínseca (inicia) FVII FT (FIII), Ca 2+, FL FIIa FVIII FIX FIXa Ca 2+, FL FVIIa FT FIIa FVIIIa IVFT FX FXa FX Ca 2+, FL Ca 2+, FL FIIa FV FVa «chispa» Protrombina (FII) Ca 2+, FL Trombina (FIIa) + péptido Gla Fibrinógeno Fibrina (FIa) + fibrinopéptidos FIIa FXIIIa FXIII Coágulo de fibrina (con enlaces transversales) Vía común Figura Representación completa de la coagulación sanguínea fisiológica por medio de la formación de un coágulo de fibrina con enlaces transversales (duro). a, activo; F, factor; FL, fosfolípido; FT, factor tisular; Gla, γ-carboxiglutamato; IVFT, inhibidor de la vía del factor tisular. Existen pruebas analíticas para evaluar la vía extrínseca desde el inicio hasta el final pasando por la vía común (tiempo de protrombina [TP] utilizando tromboplastina y expresado como índice internacional normalizado [INR]) y la vía intrínseca desde su inicio hasta el final pasando por la vía común (tiempo de tromboplastina parcial activado [TTPa]). La tromboplastina es una combinación de fosfolípidos + FIII. Un derivado, la tromboplastina parcial, sólo contiene la parte de fosfolípidos porque no se requiere FIII para activar la vía intrínseca. III. LIMITACIÓN E LA COAGULACIÓN La capacidad de limitar la coagulación a las zonas afectadas (anticoagulación) y eliminar los coágulos una vez están en marcha los procesos de reparación (fibrinólisis) son aspectos muy importantes de la hemostasia. Estas acciones las llevan a cabo proteínas que inactivan los factores de la coagulación uniéndose a ellos y eliminándolos del torrente circulatorio o degradándolos, y proteínas que degradan la red de fibrina. Serina proteasas Proteasas que contienen Gla Proteínas accesorias II, VII, IX, X, XI, XII II, VII, IX, X III, V, VIII Figura Factores proteínicos de la cascada de la coagulación organizados por función. La forma activada debería indicarse con una a después del numeral. [Nota: el Ca 2+ es el IV. No hay VI. El I (fibrina) no es una proteasa ni una proteína accesoria. El XIII es una transglutaminasa.] Gla, γ-carboxiglutamato. A. Proteínas que inactivan Las proteínas sintetizadas por el hígado y por los propios vasos sanguíneos equilibran la necesidad de formar coágulos en los sitios del vaso donde hay lesión con la necesidad de limitar su formación más allá de la zona afectada.
8 8 34. Coagulación sanguínea FIIa (en la sangre) ATIII, heparina [FII ATIII heparina] [FII ATIII] + heparina (al hígado) Figura Inactivación del FIIa (trombina) por medio de la unión de la antitrombina III (ATIII) y el transporte al hígado. [Nota: la heparina aumenta la afinidad de la ATIII por el FIIa.] a, activo; F, factor. Fibrinógeno Proteína C Trombina (FIIa) FVa, FVIIIa Fibrina (FIa) Trombomodulina Proteína C activada (APC) (Gla) Proteína S (Gla) Complejo APC Productos peptídicos Figura Formación y acción del complejo APC. a, activo; F, factor; Gla, γ-carboxiglutamato. 1. Antitrombina: la antitrombina III (ATIII), a la que también se hace referencia simplemente como antitrombina (AT), es una proteína hepática que viaja por el torrente circulatorio. Inactiva la trombina libre uniéndose a ella y transportándola al hígado (fig ). Así pues, la ATIII elimina trombina del torrente circulatorio, impidiendo que intervenga en la coagulación. [Nota: la ATIII es un inhibidor de la serina proteasa o «serpina». Una serpina contiene un asa reactiva a la que se une una proteasa específica. Una vez unida, la proteasa escinde un enlace peptídico en la serpina provocando un cambio conformacional que incorpora la enzima en un complejo covalente. La a 1 -antitripsina (v. pág. 50) es también una serpina.] La afinidad de la ATIII por la trombina aumenta mucho cuando la ATIII se une a la heparina, un glucosaminoglucano intracelular que liberan los mastocitos en respuesta a la lesión asociado a los vasos sanguíneos. La heparina, un anticoagulante, se utiliza terapéuticamente para limitar la formación de coágulos. [Nota: a diferencia del anticoagulante warfarina, que tiene un inicio lento, una semivida larga y se administra por vía oral, la heparina es de inicio rápido, tiene una semivida corta y requiere una administración intravenosa. Es habitual recurrir a una pauta en la que se superpongan ambos fármacos para tratar la trombosis.] La ATIII también inactiva el FXa y las otras serina proteasas de la coagulación, el FIXa, el FXIa, el FXIIa y el complejo FVIIa-FT. [Nota: la AT se une a un pentasacárido específico dentro de la forma oligosacárida de la heparina. La inhibición de FIIa requiere la forma oligosacárida, mientras que la de FXa requiere sólo la pentasacárida. El fondaparinux, una versión sintética del pentasacárido, se utiliza clínicamente para inhibir el FXa.] 2. Complejo proteína C-proteína S: la proteína C, una proteína circulante que contiene Gla y se sintetiza en el hígado, es activada por la trombina asociada a trombomodulina. La trombomodulina, una proteína integral de la membrana de las células endoteliales, se une a la trombina y en consecuencia disminuye la afinidad de la trombina por el fibrinógeno y aumenta su afinidad por la proteína C. La proteína C junto con la proteína S, también una proteína que contiene Gla, forma el complejo de la proteína C activada (APC) que escinde las proteínas accesorias FVa y FVIIIa necesarias para la actividad máxima de FXa (fig ). La proteína S contribuye al anclaje del APC al coágulo. La trombomodulina modula a continuación la actividad de la trombina, convirtiéndola de una proteína coagulante a una proteína anticoagulante, y por lo tanto limita la extensión de la coagulación. El factor V Leiden es una forma mutante del FV (la glutamina es sustituida por arginina en la posición 506) que es resistente al APC. Constituye la causa hereditaria más frecuente de trombofilia en Estados Unidos, con la frecuencia más alta en la población caucásica. En los heterocigotos, el riesgo de trombosis venosa es siete veces mayor que en la población normal, y en los homocigotos este riesgo es 50 veces más alto. [Nota: las mujeres con el FV Leiden corren un riesgo incluso mayor de trombosis durante el embarazo o cuando toman estrógenos.]
9 IV. Formación del trombo hemostático 9 La trombofilia (hipercoagulabilidad) puede ser debida: a carencias de las proteínas C, S y ATIII; a la presencia del FV Leiden y a anticuerpos antifosfolípidos, y a la producción excesiva de protrombina (mutación G20210A). [Nota: la formación de un trombo en las venas profundas de la pierna (trombosis venosa profunda, o TVP) puede causar una embolia pulmonar si el coágulo (o parte del mismo) se rompe, se desplaza a los pulmones y bloquea la circulación.] Plasminógeno tpa i Fibrina Fibrina-plasminógeno Fibrina-plasmina-tPA a B. Fibrinólisis Los coágulos son parches temporales que deben eliminarse una vez que la reparación ha empezado. El coágulo de fibrina es escindido por la proteína plasmina a productos de la degradación de la fibrina (fig ). [Nota: cuantificar el dímero, un producto de la degradación de la fibrina que contiene dos dominios con puentes transversales y es liberado por acción de la plasmina, puede ser útil para evaluar la extensión de la coagulación (v. fig ).] La plasmina es una serina proteasa generada a partir del plasminógeno por activadores del plasminógeno. Éste, segregado por el hígado al torrente circulatorio, se une a la fibrina y se incorpora a los coágulos a medida que se forman. El activador tisular del plasminógeno (tpa), sintetizado por células endoteliales vasculares y segregado en una forma inactiva en respuesta a la trombina, se vuelve activo cuando se une a fibrina-plasminógeno. La plasmina unida y el tpa evitan así la acción de sus inhibidores, la a 2 -antiplasmina (una serpina) y los inhibidores del activador del plasminógeno, respectivamente. Una vez disuelto el coágulo de fibrina, la plasmina y el tpa vuelven a estar disponibles para sus inhibidores. En pacientes que han sufrido un infarto de miocardio o un ictus isquémico puede llevarse a cabo la fibrinólisis terapéutica con un tratamiento comercialmente disponible a base de tpa fabricado con técnicas de AN recombinante. [Nota: la urocinasa es un activador del plasminógeno (upa) sintetizado en una variedad de tejidos y originalmente aislado a partir de la orina. La estreptocinasa (de las bacterias) también activa el plasminógeno y actúa tanto sobre plasminógeno libre como sobre plasminógeno unido a fibrina.] Productos de degradación de la fibrina + plasmina + tpa a α 2 -antiplasmina PAI plasmina i Figura Fibrinólisis. a, activo; i, inactivo; PAI, inhibidor del activador del plasminógeno; tpa, activador tisular del plasminógeno. [Nota: la plasmina unida a fibrina evita la acción de su inhibidor.] tpa i El plasminógeno contiene motivos estructurales conocidos como dominios kringle que intervienen en las interacciones entre proteínas. La lipoproteína (a) [Lp(a)] también contiene dominios kringle y, en consecuencia, compite con el plasminógeno para unirse a la fibrina. El potencial para inhibir la fibrinólisis puede constituir la base de la asociación entre la Lp(a) elevada y el mayor riesgo de enfermedad cardiovascular (v. pág. 237). Plaquetas Leucocitos Eritrocitos IV. FORMACIÓN EL TROMBO HEMOSTÁTICO Las plaquetas (trombocitos) son pequeños fragmentos enucleados de megacariocitos que se adhieren al colágeno expuesto del endotelio dañado, se activan y se agregan para formar un trombo hemostático (fig ). Para referirse a la formación de este trombo se habla de hemostasia primaria. Figura Comparación del tamaño entre plaquetas, eritrocitos y leucocitos.
10 Coagulación sanguínea LUZ Capaa endotelial Plaquetas En un adulto normal hay plaquetas por microlitro de sangre. Tienen una semivida de hasta 10 días, período tras el cual son captadas por el hígado y el bazo y destruidas. Hay pruebas analíticas que determinan el número de plaquetas y su actividad. Plaquetas expuestas al colágeno Trombina unida a receptor activado por proteasa + Fosfolipasa C PIP 2 AG + IP 3 FVa, FXIIIa + Proteína cinasa C FVW Receptor de GPIb FVW Figura Unión de plaquetas por medio del receptor de la glucoproteína Ib (GPIb) al factor de Von Willebrand (FVW). El FVW se une al colágeno expuesto en el sitio de la lesión. esgranulación PGF AP + Liberación de Ca 2+ Fosfolipasa A 2 Serotonina TXA 2 Vasoconstricción Activación de otras plaquetas Figura Activación de las plaquetas por trombina. [Nota: los receptores activados por proteasa son un tipo de receptor acoplado a proteína G.] AP, difosfato de adenosina; AG, diacilglicerol; F, factor; FVW, factor de Von Willebrand; IP 3, trifosfato de inositol; PGF, factor de crecimiento derivado de plaquetas; PIP 2, fosfoinositol bisfosfato;txa 2, tromboxano A 2. A. Adhesión En la adhesión de plaquetas al colágeno expuesto en el sitio del vaso donde hay la lesión interviene la proteína factor de Von Willebrand (FVW). Este factor se une al colágeno y las plaquetas se unen al FVW por medio de la glucoproteína Ib (GPIb), un componente de un complejo receptor de membrana (GPIb-V-IX) situado en la superficie de la plaqueta (fig ). La unión al FVW detiene el movimiento de avance de las plaquetas. [Nota: la carencia del receptor para el FVW produce el síndrome de Bernard-Soulier, un trastorno en el que se constata una disminución en la función y el número de plaquetas.] El FVW es una glucoproteína liberada por las plaquetas que también se sintetiza y segrega en las células endoteliales. Además de intervenir en la unión de las plaquetas al colágeno, el FVW también se une al FVIII sanguíneo y lo estabiliza. La carencia de FVW produce la enfermedad de Von Willebrand (EVW), la alteración hereditaria más frecuente en la capacidad para coagular (coagulopatía). Se trata de una enfermedad debida a una menor unión de las plaquetas al colágeno y a una carencia de FVIII (debido a la mayor degradación). Las plaquetas también pueden unirse directamente al colágeno a través del receptor de membrana GPVI. Una vez adheridas, las plaquetas se activan. [Nota: la afectación del endotelio también expone FIII, lo que inicia la vía extrínseca de la coagulación sanguínea y la activación del FX (v. fig. 34-8).] B. Activación Una vez adheridas a las zonas dañadas, las plaquetas se activan. En esta activación intervienen cambios morfológicos (forma) y la desgranulación, el proceso por medio del cual las plaquetas segregan el contenido de sus gránulos a y d (o densos). Las plaquetas activadas también exponen FS en la superficie. La trombina es el activador más potente de las plaquetas, se une a receptores activados por proteasas, un tipo de receptor acoplado a proteína G (GPCR), que hay situados en la superficie de las mismas (fig ) y los activa. La trombina se asocia principalmente con proteínas G q (v. pág. 205), que provocan la activación de la fosfolipasa C y un aumento del diacilglicerol (AG) y el trifosfato de inositol (IP 3 ). [Nota: la trombomodulina, a través de su unión a trombina, disminuye la capacidad de la trombina para activar las plaquetas (v. fig ).] 1. esgranulación: el AG activa la proteína cinasa C, un fenómeno clave para la desgranulación. El IP 3 provoca la liberación de Ca 2+ (procedente de los gránulos densos). El Ca 2+ activa la fosfolipasa A 2, que
11 IV. Formación del trombo hemostático 11 escinde fosfolípidos de membrana para liberar ácido araquidónico, el sustrato para la síntesis de tromboxano A 2 (TXA 2 ) en las plaquetas activadas por ciclooxigenasa-1 (COX-1) (v. pág. 214). El TXA 2 produce vasoconstricción, aumenta la desgranulación y se une a los GPCR de las plaquetas induciendo la activación de otras plaquetas. Hay que recordar que el ácido acetilsalicílico inhibe de manera irreversible la COX y, por consiguiente, la síntesis de TXA 2, y se hace referencia al mismo como fármaco «antitrombocítico». La desgranulación también produce la liberación de serotonina y disfosfato de adenosina (AP) de los gránulos. La serotonina provoca vasoconstricción. El AP se une los GPCR de la superficie de las plaquetas y activa otras plaquetas. [Nota: algunos fármacos antitrombocíticos, como el clopidogrel, son antagonistas de los receptores de AP.] El factor de crecimiento derivado de las plaquetas (que interviene en la cicatrización de las heridas), el FVW, el FV, el FXIII y el fibrinógeno son otras proteínas liberadas de los gránulos a. [Nota: el factor activador de plaquetas (FAP) un éter fosfolípido (v. pág. 202) sintetizado por una variedad de tipos celulares tales como las células endoteliales y las plaquetas, se une a los receptores de FAP (GPCR) que hay en la superficie de las plaquetas y los activa.] 2. Cambio de forma: el cambio de forma de las plaquetas activadas, que pasan de discoidales a esféricas con prolongaciones de tipo seudópodo que facilitan las interacciones entre las plaquetas y entre éstas y la superficie (fig ), empieza con la liberación de Ca 2+ de los gránulos densos. El Ca 2+ unido a calmodulina interviene en la activación de la cinasa de la cadenas ligeras de miosina que fosforila la cadena ligera de miosina (v. pág. 151), lo que provoca una reorganización importante del citoesqueleto de las plaquetas. Plaqueta inactivada (forma discoidal) Ca 2+ Plaqueta activada (forma esférica con seudópodos) Figura Las plaquetas activadas sufren un cambio conformacional iniciado por Ca 2+. C. Agregación La activación provoca cambios drásticos en las plaquetas que llevan a su agregación. Los cambios estructurales en el receptor de la superficie (GPIIb/IIIa) exponen los sitios de unión al fibrinógeno. Las moléculas de fibrinógeno unidas juntan las plaquetas activadas entre sí (fig ), con un único fibrinógeno capaz de unir dos plaquetas. El fibrinógeno es convertido a fibrina por la trombina y a continuación se forman puentes transversales covalentes con el FXIIIa, procedente tanto de la sangre como de las plaquetas. [Nota: la exposición de FS en la superficie de las plaquetas activadas permite la formación del complejo Xasa (VIIIa, IXa, X y Ca 2+ ) con la posterior formación de FXa y la generación de trombina.] La fibrina refuerza el trombo hemostático. [Nota: la presencia poco frecuente de alteraciones en el receptor de fibrinógeno de las plaquetas produce trombastenia o enfermedad de Glanzmann (una disminución en la función de las plaquetas), mientras que los autoanticuerpos de este receptor constituyen una causa de trombocitopenia inmunitaria (disminución del número de plaquetas).] La activación innecesaria de plaquetas se impide porque: 1) una pared vascular intacta separada de la sangre por una monocapa de células endoteliales impide el contacto de las plaquetas con el colágeno; 2) las células endoteliales sintetizan prostaglandina I 2 (PGI 2, o prostaciclina) y óxido nítrico, cada uno de los cuales provoca vasodilatación, y 3) las células endoteliales tienen una APasa de la superficie celular que convierte AP a AMP.
12 Coagulación sanguínea LUZ Fibrinógeno Plaquetas GPIIb/IIIa Ib/IIIa Capa endotelial GPIb FVW Colágeno expuesto del subendotelio Figura Unión de plaquetas por fibrinógeno a través de la glucoproteína de los receptores (GP) IIb/IIIa. [Nota: las formas de la molécula de fibrinógeno representan los dos dominios y E.] FVW, factor de Von Willebrand; GPIb, receptor Ib de la glucoproteína. V. RESUMEN EL CAPÍTULO La formación de coágulos sanguíneos (coagulación) tiene por objetivo detener rápidamente la hemorragia de un vaso sanguíneo dañado para mantener un volumen de sangre constante (hemostasia). La coagulación se lleva a cabo a través de la formación de un coágulo (trombo) que consiste en una agregación de plaquetas (trombocitos) y una red de la proteína fibrina (fig ). La herida de un tejido daña los vasos sanguíneos y expone colágeno. Las plaquetas se adhieren al colágeno expuesto, se activan y se agregan para formar un trombo hemostático. En la adhesión interviene el factor de Von Willebrand (FVW). Éste se une al colágeno y las plaquetas se unen al FVW a través de la GPIb del complejo del receptor de la superficie de la plaqueta. La carencia de FVW causa la enfermedad de Von Willebrand, la coagulopatía congénita más frecuente. Una vez adheridas, las plaquetas se activan. Su activación implica cambios de forma (de discoidal a esférica con seudópodos) y la desgranulación, el proceso a través del cual las plaquetas liberan el contenido de sus gránulos. La trombina es el activador más potente de las plaquetas. Se une a receptores acoplados a proteína G y activados por proteasa que hay en la superficie de las plaquetas. Las plaquetas activadas liberan sustancias que provocan vasoconstricción (serotonina y tromboxano A 2 [TXA 2 ]), incorporan y activan otras plaquetas (difosfato de adenosina y TXA 2 ) y sostienen la formación de un coágulo de fibrina (factor [F] V, FXIII y fibrinógeno). La activación produce cambios en las plaquetas que llevan a su agregación. Los cambios estructurales en un receptor de la superficie (GPIIb/IIIa) exponen sitios a los que el fibrinógeno puede unirse. Las moléculas de fibrinógeno unen las plaquetas entre sí. El fibrinógeno es activado a fibrina por la trombina y a continuación el FXIIIa, una transglutaminasa procedente tanto de la sangre como de las plaquetas, hace que se formen puentes transversales. El trombo hemostático inicialmente laxo (hemostasia primaria) es reforzado por la red de fibrina (hemostasia secundaria). En la formación de la red de fibrina intervienen las vías extrínseca e intrínseca (y los factores proteínicos asociados) que convergen en el FXa para formar la vía común. Muchos de los factores proteínicos son serina proteasas con especificidad de tipo tripsina. El Ca 2+ se une a los residuos de g-carboxiglutamato (Gla) cargados negativamente que hay en determinadas proteínas de la coagulación (FII, FVII, FIX y FX), lo que facilita la unión de estas proteínas a la fosfatidilserina expuesta en el sitio de la lesión y en la superficie de las plaquetas. La g-glutamilcarboxilasa y su coenzima, la forma hidroquinona de la vitamina K, son necesarias para la formación de residuos Gla. En la reacción, la vitamina K se oxida a la forma no funcional epóxido. La warfarina, un análogo sintético de la vitamina K utilizado clínicamente para reducir la coagulación, inhibe la enzima vitamina K epóxido reductasa que regenera la forma reducida funcional. La vía extrínseca se inicia con la exposición de FIII (factor tisular [FT]), una proteína accesoria, en el subendotelio vascular. El FT expuesto se une a una proteína circulante que contiene Gla, el FVII, y la activa a través del cambio conformacional. A continuación el complejo FT-FVIIa se une a FX y lo activa mediante proteólisis. La vía extrínseca se inhibe rápidamente con el inhibidor de la vía del factor tisular. La vía intrínseca se inicia con el FXIIa, que activa el FXI, y el FXIa activa el FIX. El FIXa se combina con el FVIIIa (una proteína accesoria) y el complejo activa el FX. La carencia de FVIII produce hemofilia A, mientras que la carencia de FIX produce hemofilia B que es menos frecuente. El FXa se relaciona con el
13 V. Resumen del capítulo 13 Coagulación sanguínea requiere la formación de un Coágulo en la zona de la lesión por la formación de Coágulo hemostático Red de fibrina por generada por precisa Adhesión de plaquetas al colágeno expuesto a través del factor de Von Willebrand seguido de Vía intrínseca en la que intervienen Vía extrínseca en la que intervienen -carboxilación de FII, FVII, FIX, FX por Activación de plaquetas mediada por trombina en la que interviene FXI FXIIa FXIa [FII FVIIa] -glutamilcarboxilasa que requiere vitamina K inhibida por Cambio de forma de las plaquetas esgranulación (liberación de materiales) FIX FVIII FIXa FVIIIa activan Warfarina, un antagonista de la vitamina K mediado por Ca 2+ produce incluye Las carencias congénitas producen hemofilia FX mediante proteólisis FXa inicia FVa, FVIIIa degrada Complejo proteína C activada Vía común causa la formación de en la que interviene Trombomodulina Mayor cantidad FV Leiden FII (protrombina) [FVa FXa] FIIa (trombina) unida a Agregación de plaquetas mediada por Fibrinógeno y su conversión a fibrina causa Trombofilia formación de puentes transversales de fibrina mediante FI FIa (fibrina) unida a e inactivada por Antitrombina III FXIIIa El coágulo de fibrina con puentes transversales estabiliza el tapón hemostático degradado por Plasmina Figura Mapa conceptual de la coagulación sanguínea. a, activo; F, factor.
14 Coagulación sanguínea FVa (una proteína accesoria) que forma protrombinasa que escinde la protrombina (FII) para formar trombina (FIIa). A continuación, la trombina escinde el fibrinógeno para formar fibrina (FIa). Los monómeros de fibrina se asocian y forman un coágulo de fibrina soluble (blando). Las moléculas de fibrina se unen por puentes transversales por la acción del FXIIIa y se forma un coágulo de fibrina insoluble (duro). Las proteínas sintetizadas por el hígado y los propios vasos sanguíneos equilibran la coagulación con anticoagulación. La antitrombina III, un inhibidor de la serina proteasa o serpina, se une a la trombina sanguínea y la elimina. Su afinidad por la trombina aumenta con la heparina, que se utiliza terapéuticamente para limitar la formación de coágulos. La proteína C, una proteína que contiene Gla, es activada por el complejo trombina-trombomodulina. La trombomodulina disminuye la afinidad de la trombina por el fibrinógeno haciendo que pase de ser una proteína de la coagulación a una proteína de la anticoagulación. La proteína C junto con la proteína S (una proteína que contiene Gla) forma el complejo proteína C activada (APC) que escinde las proteínas accesorias FVa y FVIIIa. El factor V Leiden es resistente al APC. Constituye la enfermedad trombofílica congénita más frecuente en Estados Unidos. El coágulo de fibrina es escindido (fibrinólisis) por la proteína plasmina, una serina proteasa generada a partir de plasminógeno por activadores del plasminógeno tales como el activador tisular del plasminógeno (tpa). El tpa recombinante tiene utilidad clínica. Los trastornos hemostáticos y de la coagulación pueden provocar desviaciones en la capacidad para coagular. El tiempo de protrombina y el tiempo de tromboplastina parcial activado sirven para evaluar la cascada de la coagulación. Preguntas de estudio Elija la mejor respuesta. En el caso de las preguntas 34.1 a 34.5, hay que hacer corresponder la proteína de la coagulación más apropiada a la descripción. A. FI. F. FVIII. B. FII. G. FIX. C. FIII. H. FX.. FV. I. FXI. E. FVII. J. FXIII Este factor activa componentes de las vías intrínseca, extrínseca y común Este factor convierte el coágulo soluble en un coágulo insoluble Este factor inicia la vía común Este factor es una proteína accesoria que potencia la actividad del factor Xa Es un factor serina proteasa que contiene g-carboxiglutamato de la vía extrínseca En qué paciente el tiempo de protrombina no se vería afectado y el tiempo de tromboplastina parcial activado sería mayor? A. En un paciente tratado con ácido acetilsalicílico. B. En un paciente con una hepatopatía terminal. C. En un paciente con hemofilia.. En un paciente con trombocitopenia. Respuestas correctas = B, J, H,, E. La trombina (FII) se forma en la vía común y activa componentes en cada una de las tres vías de la cascada de la coagulación. El factor (F)XIII, una transglutaminasa, forma puentes transversales covalentes asociados a monómeros de fibrina, por lo que convierte un coágulo soluble en uno de insoluble. La generación de FXa en las vías intrínseca y extrínseca inicia la vía común. El FV aumenta la actividad del FXa. Es una de las tres proteínas accesorias (no proteasas). Las otras son el FIII (factor tisular) y el FVIII (que forma un complejo con el FIX para activar el FX). El FVII es una serina proteasa, que contiene g-carboxiglutamato, que forma complejos con el FIII en la vía extrínseca. Respuesta correcta = C. El tiempo de protrombina (TP) mide la actividad de la vía extrínseca desde el inicio hasta el final pasando por la vía común, y el tiempo de tromboplastina parcial activada (TTPa) mide la actividad de la vía intrínseca desde el inicio hasta el final pasando por la vía común. Los pacientes con hemofilia carecen del factor (F) VIII (hemofilia A) o del FIX (hemofilia B), componentes de la vía común. La vía extrínseca se mantiene intacta, por lo que el TP no se ve afectado y el TTPa es mayor. Los pacientes tratados con ácido acetilsalicílico y los que sufren trombocitopenia presentan alteraciones en la función y el número de plaquetas, respectivamente, y no en las proteínas de la cascada de la coagulación. En consecuencia, ni el TP ni el TTPa se ven afectados. Los pacientes con una hepatopatía terminal tienen reducida la capacidad para sintetizar proteínas de la coagulación. Tanto el TP como el TTPa son mayores.
15 V. Resumen del capítulo Cuál de las siguientes puede descartarse en un paciente con trombofilia? A. Una carencia de antitrombina III. B. Una carencia de factor IX. C. Una carencia de proteína C.. Un exceso de protrombina. E. La expresión del factor V Leiden Las directrices actuales para el tratamiento de pacientes con ictus isquémico agudo (un ictus causado por un coágulo de sangre que obstruye un vaso que irriga el cerebro) incluyen la recomendación de utilizar activador tisular del plasminógeno (tpa) enseguida tras el inicio de los síntomas. La recomendación se basa en que es el tpa el que activa: A. La antitrombina III. B. El complejo de la proteína C activada. C. El receptor para el factor de Von Willebrand.. La serina proteasa que degrada fibrina. E. La trombomodulina La adhesión, activación y agregación de plaquetas proporciona la agregación inicial en el sitio del vaso donde hay la lesión. Cuál de las siguientes afirmaciones con respecto a la formación de este trombo hemostático es correcta? A. Las plaquetas activadas sufren un cambio de forma que disminuye su área superficial. B. La formación de un trombo hemostático se impide en los vasos intactos mediante la producción de tromboxano A 2 por parte de las células endoteliales. C. La fase de activación requiere la producción de monofosfato de adenosina cíclico.. En la fase de adhesión interviene la unión de plaquetas al factor de Von Willebrand por medio de la glucoproteína Ib. E. La trombina activa plaquetas uniéndose a un receptor acoplado a proteína G y activado por proteasas y provocando la activación de la proteína cinasa A Varios días después de haber sometido su hogar a una desratización, los padres de una niña de 3 años están preocupados por si su hija podría haber ingerido las bolitas envenenadas. espués de llamar al servicio telefónico de intoxicaciones, deciden llevar a su hija a urgencias. Las analíticas revelan un tiempo de trombina y de tromboplastina parcial activada prolongados y una disminución de la concentración de factor (F)II, FVII, FIX y FX. Por qué la administración de vitamina K sería una estrategia razonable para tratar a esta paciente? Respuesta correcta = B. Las carencias sintomáticas de factores de la coagulación están asociadas a una menor capacidad para coagular (coagulopatía). No obstante, la trombofilia se caracteriza por una mayor tendencia a coagular. Las opciones A, C, y E producen trombofilia. Respuesta correcta =. El activador tisular del plasminógeno (tpa) convierte el plasminógeno en plasmina. La plasmina (una serina proteasa) degrada la red de fibrina, eliminando la obstrucción del flujo sanguíneo. La antitrombina III junto con la heparina se une a la trombina y la llevan al hígado, disminuyendo así su disponibilidad sanguínea. El complejo de la proteína C activada degrada las proteínas accesorias FV y FVIII. El receptor de plaquetas para el factor de Von Willebrand no se ve afectado por el tpa. La trombomodulina se une a la trombina y la convierte de una proteína de la coagulación a una de la anticoagulación disminuyendo su activación de fibrinógeno y aumentando su activación de proteína C. Respuesta correcta =. La fase de adhesión en la formación del trombo hemostático comienza con la unión de factor de Von Willebrand a un receptor (glucoproteína Ib) situado en la superficie de las plaquetas. El cambio de forma de discoidal a esférica con seudópodos aumenta el área superficial de las plaquetas. El tromboxano A 2 se sintetiza en las plaquetas. Provoca la activación de las plaquetas y vasoconstricción. El disfosfato de adenosina liberado procede de plaquetas activadas y al mismo tiempo activa plaquetas. La trombina actúa principalmente a través de receptores acoplados a proteínas G q provocando la activación de la fosfolipasa C. Muchos venenos para roedores son superwarfarinas, fármacos con una semivida prolongada en el cuerpo. La warfarina inhibe la g-carboxilación (producción de residuos g-carboxiglutamato, o Gla) y las proteínas de la coagulación, cuya cantidad se constata que es menor, son las proteasas que contienen Gla de la cascada de la coagulación. [Nota: las proteínas C y S de la anticoagulación también son proteínas que contienen Gla.] Puesto que la warfarina actúa como un antagonista de la vitamina K, la administración de vitamina K es una estrategia razonable.
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I
 Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I Tema 29 Prof. Miguel Skirzewski Prevención de la pérdida de
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I Tema 29 Prof. Miguel Skirzewski Prevención de la pérdida de
COAGULACIÓN SANGUÍNEA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la Hemostasia Vasoconstricción
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la Hemostasia Vasoconstricción
COAGULACIÓN SANGUÍNEA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la
El proceso fisiológico de la hemostasia y sus dianas terapéuticas.
 El proceso fisiológico de la hemostasia y sus dianas terapéuticas. Madrid 7-Octubre-2015 Dr. Jose A. Romero Garrido.. Hospital Universitario La Paz. INTRODUCCIÓN: Sistema Circulatorio INTRODUCCIÓN: Sangre
El proceso fisiológico de la hemostasia y sus dianas terapéuticas. Madrid 7-Octubre-2015 Dr. Jose A. Romero Garrido.. Hospital Universitario La Paz. INTRODUCCIÓN: Sistema Circulatorio INTRODUCCIÓN: Sangre
REACCION BASICA DE LA COAGULACION. cascada de la coagulación. trombina. fibrina (polímero insoluble) tico. fibrinolisis cicatrización
 HEMOSTASIA II REACCION BASICA DE LA COAGULACION fibrinógeno (proteína soluble) cascada de la coagulación trombina fibrina (polímero insoluble) tapón n plaquetario tapón n hemostático tico fibrinolisis
HEMOSTASIA II REACCION BASICA DE LA COAGULACION fibrinógeno (proteína soluble) cascada de la coagulación trombina fibrina (polímero insoluble) tapón n plaquetario tapón n hemostático tico fibrinolisis
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excresión
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excresión
CAPÍTULO 1. Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral?
 CAPÍTULOS de Anticoagulación Oral para Enfermería CAPÍTULO 1 Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral? Dra. Amparo Santamaría
CAPÍTULOS de Anticoagulación Oral para Enfermería CAPÍTULO 1 Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral? Dra. Amparo Santamaría
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Nutrición y excreción Defensa:
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Nutrición y excreción Defensa:
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS
 FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Entender los mecanismos que regulan la Hemostasia. 2.- Clasificar los fármacos
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Entender los mecanismos que regulan la Hemostasia. 2.- Clasificar los fármacos
Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE LA SANGRE
 CCáát tt eeddr raa ddee FFi iissi iiool llooggí ííaa II I TTeer rcc eer r SSeemeesst ttr ree FFaaccuul llt tt aadd ddee Meeddi iicci iinnaa,, UU...AA..EE..M... 1 Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE
CCáát tt eeddr raa ddee FFi iissi iiool llooggí ííaa II I TTeer rcc eer r SSeemeesst ttr ree FFaaccuul llt tt aadd ddee Meeddi iicci iinnaa,, UU...AA..EE..M... 1 Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE
Receptores de membrana y transduccion de la señal
 Receptores de membrana y transduccion de la señal Elementos efectores Proteínas reguladoras Transducción de la señal HORMONAS Mensajeros bioquímicos que actúan integrando las respuestas de las diferentes
Receptores de membrana y transduccion de la señal Elementos efectores Proteínas reguladoras Transducción de la señal HORMONAS Mensajeros bioquímicos que actúan integrando las respuestas de las diferentes
Lic. Jürgen Freer B.
 Lic. Jürgen Freer B. Distintos estudios han demostrado una relación entre la desestabilización del control fisiológico de la hemostasia y la incidencia de enfermedades cardiovasculares. Así la angina de
Lic. Jürgen Freer B. Distintos estudios han demostrado una relación entre la desestabilización del control fisiológico de la hemostasia y la incidencia de enfermedades cardiovasculares. Así la angina de
EL PROCESO DE LA HEMOSTASIA. DIANAS TERAPEUTICAS. Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada
 EL PROCESO DE LA HEMOSTASIA. DIANAS TERAPEUTICAS Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada FUNCIONES DE LA SANGRE - Función de transporte de oxígeno y nutrientes a las células,
EL PROCESO DE LA HEMOSTASIA. DIANAS TERAPEUTICAS Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada FUNCIONES DE LA SANGRE - Función de transporte de oxígeno y nutrientes a las células,
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS
 FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Describir el mecanismo anticoagulante de la Heparina. 2.- Valorar las reacciones
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Describir el mecanismo anticoagulante de la Heparina. 2.- Valorar las reacciones
Mecanismos de producción del coágulo
 Mecanismos de producción del coágulo Prof. Germán Detarsio Bioquímico Especialista en Hematología Cátedra y Servicio de Hematología Fac. de Cs. Bioq. y Farm. U.N.R. Argentina Mecanismo de producción de
Mecanismos de producción del coágulo Prof. Germán Detarsio Bioquímico Especialista en Hematología Cátedra y Servicio de Hematología Fac. de Cs. Bioq. y Farm. U.N.R. Argentina Mecanismo de producción de
ESTADOS DE HIPERCOAGULABILIDAD
 ESTADOS DE HIPERCOAGULABILIDAD CONGÉNITOS Y ADQUIRIDOS Esperanza Castelar Delgado Residente de Medicina Interna 22 de Noviembre de 2010 DEFINICIÓN (I) En nuestro organismo, de forma fisiológica, existe
ESTADOS DE HIPERCOAGULABILIDAD CONGÉNITOS Y ADQUIRIDOS Esperanza Castelar Delgado Residente de Medicina Interna 22 de Noviembre de 2010 DEFINICIÓN (I) En nuestro organismo, de forma fisiológica, existe
Lección 32. Antiagregantes, Anticoagulantes y Fibrinolíticos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS
 Ricardo Brage e Isabel Trapero - Lección 32 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 32 Antiagregantes, Anticoagulantes y Fibrinolíticos 1. FUNDAMENTOS 2. CLASIFICACIÓN Guión Ricardo
Ricardo Brage e Isabel Trapero - Lección 32 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 32 Antiagregantes, Anticoagulantes y Fibrinolíticos 1. FUNDAMENTOS 2. CLASIFICACIÓN Guión Ricardo
ENFERMEDAD TROMBOEMBOLICA ESTUDIO EN EL LABORATORIO
 ESTUDIO EN EL LABORATORIO Hipercoagulabilidad: desviación del balance hemostático hacia depósito intravascular de fibrina Trombofilia o estados trombofílicos Flujo sanguíneo Estructuras vasculares Factores
ESTUDIO EN EL LABORATORIO Hipercoagulabilidad: desviación del balance hemostático hacia depósito intravascular de fibrina Trombofilia o estados trombofílicos Flujo sanguíneo Estructuras vasculares Factores
Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio. Dra. Maria Mercedes Morales Hospital Roberto del Rio
 Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio Dra. Maria Mercedes Morales Hospital Roberto del Rio Síndromes Hemorrágicos. Consulta frecuente Impacto en morbi-mortalidad Diagnóstico y
Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio Dra. Maria Mercedes Morales Hospital Roberto del Rio Síndromes Hemorrágicos. Consulta frecuente Impacto en morbi-mortalidad Diagnóstico y
En el estudio de los mecanismos de acción farmacológica hay que distinguir.
 TEMA : ASPECTOS MOLECULARES DEL MECANISMO DE ACCIÓN DE LOS FÁRMACOS En el estudio de los mecanismos de acción farmacológica hay que distinguir. Fármacos de Acción Específica: son aquellos que han de interaccionar
TEMA : ASPECTOS MOLECULARES DEL MECANISMO DE ACCIÓN DE LOS FÁRMACOS En el estudio de los mecanismos de acción farmacológica hay que distinguir. Fármacos de Acción Específica: son aquellos que han de interaccionar
Hemostasia. Los fenómenos normales que ocurren tras la lesión vascular son:
 Hemostasia Se entiende como hemostasia al conjunto de mecanismos que el organismo pone para evitar la pérdida de sangre cuando se ha dañado un vaso, por diferentes causas. Los fenómenos normales que ocurren
Hemostasia Se entiende como hemostasia al conjunto de mecanismos que el organismo pone para evitar la pérdida de sangre cuando se ha dañado un vaso, por diferentes causas. Los fenómenos normales que ocurren
EL CONTROL DE LAS ACTIVIDADES CELULARES
 EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
REGULACION DE LA HEMOSTASIA SANGUÍNEA. FÁRMACOS HEMOSTÁTICOS
 Prof.ª Dra. D.ª Susana Abdala Kuri Prof. Dr. D. Domingo Martín Herrera Prof.ª Dra. D.ª Sandra Dévora Gutiérrez http://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_es REGULACION DE LA HEMOSTASIA SANGUÍNEA.
Prof.ª Dra. D.ª Susana Abdala Kuri Prof. Dr. D. Domingo Martín Herrera Prof.ª Dra. D.ª Sandra Dévora Gutiérrez http://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_es REGULACION DE LA HEMOSTASIA SANGUÍNEA.
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez 1. Lesión del vaso sanguíneo 2. Espasmo vascular 3. Formación de tapón de plaquetas 4. Coagulación. La malla de fibrina estabiliza el coágulo LESIÓN HEMORRAGIA
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez 1. Lesión del vaso sanguíneo 2. Espasmo vascular 3. Formación de tapón de plaquetas 4. Coagulación. La malla de fibrina estabiliza el coágulo LESIÓN HEMORRAGIA
ANTICOAGULANTES HIPOCOLESTEROLÉMICOS E HIPOLIPEMIANTES
 ANTICOAGULANTES HIPOCOLESTEROLÉMICOS E HIPOLIPEMIANTES 2013 ANTICOAGULANTES ACCIÓN DIRECTA: Hirudina ACCIÓN INDIRECTA: Heparina no fraccionada Heparinas de bajo peso molecular Danaparoide Dicumarol (warfarina)
ANTICOAGULANTES HIPOCOLESTEROLÉMICOS E HIPOLIPEMIANTES 2013 ANTICOAGULANTES ACCIÓN DIRECTA: Hirudina ACCIÓN INDIRECTA: Heparina no fraccionada Heparinas de bajo peso molecular Danaparoide Dicumarol (warfarina)
TRASTORNOS DE SANGRADOS.
 1 TRASTORNOS DE SANGRADOS. Una persona que sangra no únicamente puede tener como causa de su sangrado algún defecto de la coagulación, sino también de las plaquetas ó de vasos sanguíneos, de modo que lo
1 TRASTORNOS DE SANGRADOS. Una persona que sangra no únicamente puede tener como causa de su sangrado algún defecto de la coagulación, sino también de las plaquetas ó de vasos sanguíneos, de modo que lo
HEPARINA Y ANTICOAGULANTES ORALES
 HEPARINA Y ANTICOAGULANTES ORALES HEMOSTASIA Conjunto de mecanismos que intentan evitar la pérdida sanguínea tras un traumatismo vascular 1º) Hemostasia primaria: respuesta vascular y plaquetaria *Tapón
HEPARINA Y ANTICOAGULANTES ORALES HEMOSTASIA Conjunto de mecanismos que intentan evitar la pérdida sanguínea tras un traumatismo vascular 1º) Hemostasia primaria: respuesta vascular y plaquetaria *Tapón
NUEVAS TENDENCIAS EN EL TRATAMIENTO ANTICOAGULANTE ORAL. Santiago del Castillo Málaga mayo 2009
 NUEVAS TENDENCIAS EN EL TRATAMIENTO ANTICOAGULANTE ORAL Santiago del Castillo Málaga mayo 2009 CAUSAS DE MUERTE EN ESPAÑA EN 2007 En 2007 se produjeron en España 385.361 defunciones, 13.883 más que en
NUEVAS TENDENCIAS EN EL TRATAMIENTO ANTICOAGULANTE ORAL Santiago del Castillo Málaga mayo 2009 CAUSAS DE MUERTE EN ESPAÑA EN 2007 En 2007 se produjeron en España 385.361 defunciones, 13.883 más que en
Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009
 Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009 MANIFESTACIONES HEMORRÁGICAS Medidas generales a tener en cuenta en pacientes con tendencia hemorrágica Realizar un interrogatorio
Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009 MANIFESTACIONES HEMORRÁGICAS Medidas generales a tener en cuenta en pacientes con tendencia hemorrágica Realizar un interrogatorio
AUTOEVALUACION DE HEMATOLOGIA
 FACULTAD DE MEDICINA CICLO DE ESTRUCTURAS Y FUNCIONES NORMALES UTI "BIOLOGIA TISULAR" AUTOEVALUACION DE HEMATOLOGIA 1.- Con respecto a las células sanguíneas indique la o las opciones correctas: a) La
FACULTAD DE MEDICINA CICLO DE ESTRUCTURAS Y FUNCIONES NORMALES UTI "BIOLOGIA TISULAR" AUTOEVALUACION DE HEMATOLOGIA 1.- Con respecto a las células sanguíneas indique la o las opciones correctas: a) La
Capítulo 12 REGULACIÓN DE LA EXPRESIÓN GÉNICA. Factores de Transcripción. Metilación. Procesamiento del ARN. Post-traduccional
 REGULACIÓN DE LA EXPRESIÓN GÉNICA - Mecanismos de Regulación Regulación Procariontes Eucariontes Operón Lactosa Operón Triptofano Transcripcional Procesamiento del ARN Traduccional Post-traduccional Factores
REGULACIÓN DE LA EXPRESIÓN GÉNICA - Mecanismos de Regulación Regulación Procariontes Eucariontes Operón Lactosa Operón Triptofano Transcripcional Procesamiento del ARN Traduccional Post-traduccional Factores
Generalidades del sistema de la coagulación y pruebas para su estudio.
 Invest Clin 56(3): 432-454, 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro
Invest Clin 56(3): 432-454, 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Fibrinolisis y Trombolisis
 TROMBOLITICOS!1 Fibrinolisis y Trombolisis El sistema fibrinolitico disuelve coagulos como resultado del efecto de la plasmina. La plasmina es una proteasa relativamente inespecifica, que digiere coagulos
TROMBOLITICOS!1 Fibrinolisis y Trombolisis El sistema fibrinolitico disuelve coagulos como resultado del efecto de la plasmina. La plasmina es una proteasa relativamente inespecifica, que digiere coagulos
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Tema 10. Regulación de la actividad enzimática
 Tema 10. Regulación de la actividad enzimática Control de la actividad enzimática Regulación por cambios en la concentración de enzima Regulación alostérica Modificaciones covalentes reversibles Activación
Tema 10. Regulación de la actividad enzimática Control de la actividad enzimática Regulación por cambios en la concentración de enzima Regulación alostérica Modificaciones covalentes reversibles Activación
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Generalidades del sistema de la coagulación y pruebas para su estudio.
 Invest Clin 56(4): 432-454, 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro
Invest Clin 56(4): 432-454, 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro
METABOLISMO DE LIPIDOS
 METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
La severidad de la hemofilia depende del nivel plasmático del FVIII (hemofilia A) / FIX (hemofilia B): <1% de factor Entre el 1% al 5% >5% de factor
 La hemofilia es un desorden hemorrágico hereditario y congénito, originado por mutaciones en el cromosoma X y que se caracteriza por la disminución o ausencia de actividad funcional de los factores de
La hemofilia es un desorden hemorrágico hereditario y congénito, originado por mutaciones en el cromosoma X y que se caracteriza por la disminución o ausencia de actividad funcional de los factores de
Composición Líquido Elementos formes
 Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
 PLASMINÓGENO PLASMINA FIBRINA t-pa PAI Antiplasmina alfa-2 enoxaparina dalteparina tinzaparina TROMBOCITO PENIA HEMORRAGIA ACTIVA HEMOFILIA HTA SEVERA CARCINOMA ENFERMEDAD RENAL O HEPATICA LESIONES
PLASMINÓGENO PLASMINA FIBRINA t-pa PAI Antiplasmina alfa-2 enoxaparina dalteparina tinzaparina TROMBOCITO PENIA HEMORRAGIA ACTIVA HEMOFILIA HTA SEVERA CARCINOMA ENFERMEDAD RENAL O HEPATICA LESIONES
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
 SEÑALES QUÍMICAS En los organismos pluricelulares, la coordinación entre las células se realiza a través de mediadores o mensajeros de la comunicación intercelular de los que hay descritos varios centenares.
SEÑALES QUÍMICAS En los organismos pluricelulares, la coordinación entre las células se realiza a través de mediadores o mensajeros de la comunicación intercelular de los que hay descritos varios centenares.
Trastornos circulatorios locales
 Trastornos circulatorios locales Edema: -Acumulo de liq. en el intersticio. *Según su naturaleza pueden ser: -Inflamatorio: alteración en permeabilidad vascular de la mb. (exudado=liq. + proteínas que
Trastornos circulatorios locales Edema: -Acumulo de liq. en el intersticio. *Según su naturaleza pueden ser: -Inflamatorio: alteración en permeabilidad vascular de la mb. (exudado=liq. + proteínas que
Pruebas de laboratorio convencionales en hemostasia
 Pruebas de laboratorio convencionales en hemostasia J. Mateo. Unitat d Hemostàsia i Trombosi. Hospital de la Santa Creu i Sant Pau. Barcelona. Curso Anestesia. Barcelona. 2016. PREANALÍTICA Preanalítica
Pruebas de laboratorio convencionales en hemostasia J. Mateo. Unitat d Hemostàsia i Trombosi. Hospital de la Santa Creu i Sant Pau. Barcelona. Curso Anestesia. Barcelona. 2016. PREANALÍTICA Preanalítica
Pruebas básicas de Coagulación. Departamento de Hemostasia y Trombosis. IIHEMA Academia Nacional de Medicina
 Pruebas básicas de Coagulación Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina Vía Intrínseca de la coagulación Bioq.. Luis Bastos Dpto. Hemostasia y Trombosis Academia Nacional de
Pruebas básicas de Coagulación Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina Vía Intrínseca de la coagulación Bioq.. Luis Bastos Dpto. Hemostasia y Trombosis Academia Nacional de
LA COAGULACIÓN AUTORES: LAURA DELGADO CAMPOS MARIA LUISA LOPEZ HOCES ENCARNACIÓN ROMERO NARVÁEZ
 LA COAGULACIÓN AUTORES: LAURA DELGADO CAMPOS MARIA LUISA LOPEZ HOCES ENCARNACIÓN ROMERO NARVÁEZ ÍNDICE 1. LAS PLAQUETAS 3 1.1 Estructura de las plaquetas 5 1.2 Función de las plaquetas 6 1.3 Recuento de
LA COAGULACIÓN AUTORES: LAURA DELGADO CAMPOS MARIA LUISA LOPEZ HOCES ENCARNACIÓN ROMERO NARVÁEZ ÍNDICE 1. LAS PLAQUETAS 3 1.1 Estructura de las plaquetas 5 1.2 Función de las plaquetas 6 1.3 Recuento de
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA. La velocidad de reacciones químicas: Para una reacción:
 ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA La velocidad de reacciones químicas: Para una reacción: A B La velocidad depende de la concentración del reactante: v = k[a] k = constante
ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA La velocidad de reacciones químicas: Para una reacción: A B La velocidad depende de la concentración del reactante: v = k[a] k = constante
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Fisiopatología Hematológica. Depto. de Fisiopatología Hospital de Clínicas
 Fisiopatología Hematológica Depto. de Fisiopatología Hospital de Clínicas Composición de la sangre Composición de la sangre Células sanguíneas Recuento (por mm 3 ) Vida media Función Glóbulos rojos (hematíes,
Fisiopatología Hematológica Depto. de Fisiopatología Hospital de Clínicas Composición de la sangre Composición de la sangre Células sanguíneas Recuento (por mm 3 ) Vida media Función Glóbulos rojos (hematíes,
Tema 22 Hematopoyesis. Esquema general. Elementos formes de la sangre
 Tema 22 Hematopoyesis. Esquema general. Elementos formes de la sangre 1. Hematopoyesis. 2. Elementos formes de la sangre. 2.1 Eritrocitos. 2.1.1. Función de le eritropoyetina en la producción de hematíes.
Tema 22 Hematopoyesis. Esquema general. Elementos formes de la sangre 1. Hematopoyesis. 2. Elementos formes de la sangre. 2.1 Eritrocitos. 2.1.1. Función de le eritropoyetina en la producción de hematíes.
LA HEMOSTASIA EN LAS COMPLICACIONES OBSTÉTRICAS
 LA HEMOSTASIA EN LAS COMPLICACIONES OBSTÉTRICAS PROF. DELFINA ALMAGRO VÁZQUEZ Conferencia en el Taller Nacional de Mortalidad Materna. CENAPET. Sept 2005. Cambios en la hemostasia Embarazo normal Cambios
LA HEMOSTASIA EN LAS COMPLICACIONES OBSTÉTRICAS PROF. DELFINA ALMAGRO VÁZQUEZ Conferencia en el Taller Nacional de Mortalidad Materna. CENAPET. Sept 2005. Cambios en la hemostasia Embarazo normal Cambios
Introducción. Expresión génica. Regulación de la expresión génica en procariotas
 Introducción La secuencia genética siempre es la misma en todas las células y siempre está presente en organismos unicelulares, pero no se expresa igual en cada célula y en cada momento. Expresión génica
Introducción La secuencia genética siempre es la misma en todas las células y siempre está presente en organismos unicelulares, pero no se expresa igual en cada célula y en cada momento. Expresión génica
FISIOLOGIA DE LA SANGRE ASPECTOS PATOLÓGICOS Y CLÍNICOS
 FISIOLOGIA DE LA SANGRE ASPECTOS PATOLÓGICOS Y CLÍNICOS ASPECTOS HISTÓRICOS Antigua china Sangre-flujo de energía del organismo Circulación de la sangre y vasos sanguíneos 50 variaciones en el pulso diagnóstico
FISIOLOGIA DE LA SANGRE ASPECTOS PATOLÓGICOS Y CLÍNICOS ASPECTOS HISTÓRICOS Antigua china Sangre-flujo de energía del organismo Circulación de la sangre y vasos sanguíneos 50 variaciones en el pulso diagnóstico
Estructura celular. Teoría Celular. Cap. 4. Los organismos se componen de una o más células. La célula es la unidad más pequeña de la vida.
 Estructura celular Cap. 4 Teoría Celular Los organismos se componen de una o más células. Procesos metabólicos y de la herencia ocurren dentro de la célula. La célula es la unidad más pequeña de la vida.
Estructura celular Cap. 4 Teoría Celular Los organismos se componen de una o más células. Procesos metabólicos y de la herencia ocurren dentro de la célula. La célula es la unidad más pequeña de la vida.
SÍNTESIS Y DEGRADACIÓN DE GLUCÓGENO
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, UNIDAD DIDÁCTICA: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 SÍNTESIS Y DEGRADACIÓN DE GLUCÓGENO Dr. Mynor A. Leiva Enríquez
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, UNIDAD DIDÁCTICA: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 SÍNTESIS Y DEGRADACIÓN DE GLUCÓGENO Dr. Mynor A. Leiva Enríquez
Fisiología del evento ISQUEMIA / ANOXIA. Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira
 Fisiología del evento ISQUEMIA / ANOXIA Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira Porque cualquier miembro suelto, ya esté recubierto por piel o por carne,
Fisiología del evento ISQUEMIA / ANOXIA Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira Porque cualquier miembro suelto, ya esté recubierto por piel o por carne,
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
LA RESPIRACIÓN CELULAR
 LA RESPIRACIÓN CELULAR Respiración celular La degradación de la glucosa mediante el uso de oxígeno o alguna otra sustancia inorgánica, se conoce como respiración celular. La respiración celular que necesita
LA RESPIRACIÓN CELULAR Respiración celular La degradación de la glucosa mediante el uso de oxígeno o alguna otra sustancia inorgánica, se conoce como respiración celular. La respiración celular que necesita
Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones
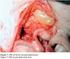 Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones Por: Dr. Carlos Eduardo Rojas Martínez Dr José Fernando García Jaramillo Índice 1. 2. 3. 4. 5 Concepto de la medicina regenerativa.
Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones Por: Dr. Carlos Eduardo Rojas Martínez Dr José Fernando García Jaramillo Índice 1. 2. 3. 4. 5 Concepto de la medicina regenerativa.
III. Inhibición enzimática
 III. Inhibición enzimática Inhibidor: Efector que hace disminuir la actividad enzimática, a través de interacciones con el centro activo u otros centros específicos. Inhibidores Inhibidores Reversibles:
III. Inhibición enzimática Inhibidor: Efector que hace disminuir la actividad enzimática, a través de interacciones con el centro activo u otros centros específicos. Inhibidores Inhibidores Reversibles:
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Glúcidos o hidratos de carbono.
 Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
III JORNADAS DE MEDICINA INTERNA PEDIATRICA AGOSTO 2012. ACV y trombofilia
 III JORNADAS DE MEDICINA INTERNA PEDIATRICA AGOSTO 2012 ACV y trombofilia Uno o más Estados Protrombóticas han sido identificados en un 20% a un 50% de los niños con AIS y 33% a 99% de los niños con CVST
III JORNADAS DE MEDICINA INTERNA PEDIATRICA AGOSTO 2012 ACV y trombofilia Uno o más Estados Protrombóticas han sido identificados en un 20% a un 50% de los niños con AIS y 33% a 99% de los niños con CVST
Glosario de términos específicos sobre Coagulación
 Glosario de términos específicos sobre Coagulación A Acetato de desmopresina: Sal de acetato de 1-desamino, 8-D-arginina vasopresina, un análogo sintético de la vasopresina, utilizado para las formas leves
Glosario de términos específicos sobre Coagulación A Acetato de desmopresina: Sal de acetato de 1-desamino, 8-D-arginina vasopresina, un análogo sintético de la vasopresina, utilizado para las formas leves
Definiciones de Inmunología
 Definiciones de Inmunología Son sustancias extrañas a nuestro organismo que desencadenan la formación de Anticuerpos (Ac). La unión entre Ag y Ac es de naturaleza no covalente. Hay complementariedad entre
Definiciones de Inmunología Son sustancias extrañas a nuestro organismo que desencadenan la formación de Anticuerpos (Ac). La unión entre Ag y Ac es de naturaleza no covalente. Hay complementariedad entre
POLIMORFISMOS EN EL GEN VKORC1 RELACIÓN CON LA TROMBOSIS VENOSA Y LA TERAPIA CON ANTICOAGULANTES ORALES
 UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS DE POSTGRADO COORDINACIÓN DE BIOLOGÍA MAESTRÍA EN CIENCIAS BIOLÓGICAS TRABAJO DE GRADO POLIMORFISMOS EN EL GEN VKORC1 RELACIÓN CON LA TROMBOSIS VENOSA Y LA
UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS DE POSTGRADO COORDINACIÓN DE BIOLOGÍA MAESTRÍA EN CIENCIAS BIOLÓGICAS TRABAJO DE GRADO POLIMORFISMOS EN EL GEN VKORC1 RELACIÓN CON LA TROMBOSIS VENOSA Y LA
FISIOLOGIA DE LA FUNCIÓN PLAQUETARIA
 FISIOLOGIA DE LA FUNCIÓN PLAQUETARIA Plaquetas: - pequeñas células anucleadas (diámetro 2 m, volúmen 7-9 fl). - concentración promedio 150-400 x 10 9 / l. - derivan de la fragmentación de los megacariocitos
FISIOLOGIA DE LA FUNCIÓN PLAQUETARIA Plaquetas: - pequeñas células anucleadas (diámetro 2 m, volúmen 7-9 fl). - concentración promedio 150-400 x 10 9 / l. - derivan de la fragmentación de los megacariocitos
Anticoagulación y Gestación. Luis Malpartida del Carpio Médico Asistente Anestesiología a y Terapia Intensiva INCOR - ESSALUD
 Anticoagulación y Gestación Luis Malpartida del Carpio Médico Asistente Anestesiología a y Terapia Intensiva INCOR - ESSALUD Vasoconstricción HEMOSTASIA PRIMARIA COAGULACION HEMOSTASIA SECUNDARIA FIBRINOLISIS
Anticoagulación y Gestación Luis Malpartida del Carpio Médico Asistente Anestesiología a y Terapia Intensiva INCOR - ESSALUD Vasoconstricción HEMOSTASIA PRIMARIA COAGULACION HEMOSTASIA SECUNDARIA FIBRINOLISIS
División de Ciencias de la Salud Facultad de Medicina. EL COMPLEJO FACTOR VIIa - FACTOR TISULAR Y SU PAPEL
 División de Ciencias de la Salud Facultad de Medicina EL COMPLEJO FACTOR VIIa - FACTOR TISULAR Y SU PAPEL COMPENSATORIO EN LAS DISFUNCIONES HEMOSTÁTICAS Tesis presentada por Raúl Tonda Hernández, licenciado
División de Ciencias de la Salud Facultad de Medicina EL COMPLEJO FACTOR VIIa - FACTOR TISULAR Y SU PAPEL COMPENSATORIO EN LAS DISFUNCIONES HEMOSTÁTICAS Tesis presentada por Raúl Tonda Hernández, licenciado
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SILDENAFIL PARA HOMBRES 50 mg COMPRIMIDOS RECUBIERTOS PARA LA DISFUNCIÓN ERÉCTIL Página 1 SILDENAFIL PARA HOMBRES
Asma Bronquial. Mg. Marta Giacomino - SPM - Lic. en Klgía y Fisiatría - FCS - UNER
 Asma Bronquial enfermedad inflamatoria de las vías aéreas a la que se asocia intensa hiperreactividad bronquial frente a estímulos diversos. Actuando conjuntamente, ambos fenómenos ocasionan la obstrucción
Asma Bronquial enfermedad inflamatoria de las vías aéreas a la que se asocia intensa hiperreactividad bronquial frente a estímulos diversos. Actuando conjuntamente, ambos fenómenos ocasionan la obstrucción
Estudio de laboratorio de la trombofilia. A quién, cuándo y cómo?
 Departamento de Hematología-Oncología Estudio de laboratorio de la trombofilia. A quién, cuándo y cómo? Dr. Jaime Pereira G. Departamento de Hematología-Oncología Escuela de Medicina Pontificia Universidad
Departamento de Hematología-Oncología Estudio de laboratorio de la trombofilia. A quién, cuándo y cómo? Dr. Jaime Pereira G. Departamento de Hematología-Oncología Escuela de Medicina Pontificia Universidad
Hematología MATERIAL INTRODUCCIÓN. CTO Medicina Francisco Silvela Madrid (España) Tfn: (34) pág.
 HEMOGRAMA A continuación tienes un listado de los valores normales de los parámetros hematológicos que más te pueden ayudar a resolver casos clínicos en el MIR: SERIE ROJA: - Hematíes: 4,2-4,9 x 106 /mm3
HEMOGRAMA A continuación tienes un listado de los valores normales de los parámetros hematológicos que más te pueden ayudar a resolver casos clínicos en el MIR: SERIE ROJA: - Hematíes: 4,2-4,9 x 106 /mm3
Definición TROMBOEMBOLIA PULMONAR. Epidemiología. >40 años >riesgo y se duplica con cada década posterior.
 Definición? TROMBOEMBOLIA PULMONAR Evelyn Aldana RII Medicina Interna Epidemiología Es la tercera enfermedad cardiovascular mas frecuente, incidencia anual global 100-200/100000 habitantes. Se estima que
Definición? TROMBOEMBOLIA PULMONAR Evelyn Aldana RII Medicina Interna Epidemiología Es la tercera enfermedad cardiovascular mas frecuente, incidencia anual global 100-200/100000 habitantes. Se estima que
Una vez identificada una mutación, es prioritario analizar de qué manera podría afectar
 8. DISCUSIÓN Una vez identificada una mutación, es prioritario analizar de qué manera podría afectar estructural y funcionalmente a la proteína. Para esto es necesario realizar diversos estudios que determinan
8. DISCUSIÓN Una vez identificada una mutación, es prioritario analizar de qué manera podría afectar estructural y funcionalmente a la proteína. Para esto es necesario realizar diversos estudios que determinan
ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO
 Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Generalidades de ENZIMAS
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Generalidades de ENZIMAS Dr. Mynor Leiva 1 ENZIMAS Proteínas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Generalidades de ENZIMAS Dr. Mynor Leiva 1 ENZIMAS Proteínas
LA RESPIRACIÓN CELULAR
 LA RESPIRACIÓN CELULAR Respiración celular La degradación de la glucosa mediante el uso de oxígeno o alguna otra sustancia inorgánica, se conoce como respiración celular. La respiración celular que necesita
LA RESPIRACIÓN CELULAR Respiración celular La degradación de la glucosa mediante el uso de oxígeno o alguna otra sustancia inorgánica, se conoce como respiración celular. La respiración celular que necesita
Osteoclasto: célula de resorción ósea
 OSTEOCLASTOS Son células gigantes capaces de resorber hueso Forman un borde rugoso cuando lo hacen Contienen bombas de protones que crean un ambiente ácido por debajo del borde rugoso Producen fosfatasa
OSTEOCLASTOS Son células gigantes capaces de resorber hueso Forman un borde rugoso cuando lo hacen Contienen bombas de protones que crean un ambiente ácido por debajo del borde rugoso Producen fosfatasa
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Acidos Nucleicos. Adenina + Ribosa Adenosina
 Dr. Luis Rebolledo Acidos Nucleicos Prof. Iván Rebolledo Introducción Los ácidos nucleicos son macromoléculas orgánicas excepcionales por la cantidad considerable de fósforo que contienen y, sobre todo,
Dr. Luis Rebolledo Acidos Nucleicos Prof. Iván Rebolledo Introducción Los ácidos nucleicos son macromoléculas orgánicas excepcionales por la cantidad considerable de fósforo que contienen y, sobre todo,
MEMBRANA PLASMÁTICA. Guía de Actividades N 10
 Guía de Actividades N 10 MEMBRANA PLASMÁTICA SECTOR EJE 1 UNIDAD 1 : CIENCIAS NATURALES - BIOLOGÍA : ESTRUCTURA Y FUNCIÓN DE LOS SERES VIVOS : ESTRUCTURA Y FUNCIÓN DE LA CÉLULA ESTUDIANTE : PROFESOR :
Guía de Actividades N 10 MEMBRANA PLASMÁTICA SECTOR EJE 1 UNIDAD 1 : CIENCIAS NATURALES - BIOLOGÍA : ESTRUCTURA Y FUNCIÓN DE LOS SERES VIVOS : ESTRUCTURA Y FUNCIÓN DE LA CÉLULA ESTUDIANTE : PROFESOR :
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA
 BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIBLIOTECA DE PRUEBAS
 BIBLIOTECA DE PRUEBAS Laboratorio de Análisis Clínicos INS AGC Laboratorio de Medicina Febrero de 2013 INDICE: ANTITROMBINA...4 FIBRINÓGENO...5 HEMOGRAMA...6 RETICULOCITOS...8 TIEMPO DE PROTROMBINA...9
BIBLIOTECA DE PRUEBAS Laboratorio de Análisis Clínicos INS AGC Laboratorio de Medicina Febrero de 2013 INDICE: ANTITROMBINA...4 FIBRINÓGENO...5 HEMOGRAMA...6 RETICULOCITOS...8 TIEMPO DE PROTROMBINA...9
Etiologia. La trombosis venosa se define como la presencia de un trombo o coágulo de sangre en una vena, sea cual sea su localización.
 TROMBOSIS VENOSA Universidad Abierta Interamericana Facultad de Medicina Carrera Licenciatura en Enfermería Materia: Ciencias Biológicas IV Prof.: Alejandro Vázquez Alumno: Miranda Lino Etiologia La trombosis
TROMBOSIS VENOSA Universidad Abierta Interamericana Facultad de Medicina Carrera Licenciatura en Enfermería Materia: Ciencias Biológicas IV Prof.: Alejandro Vázquez Alumno: Miranda Lino Etiologia La trombosis
Biosíntesis de Ácidos nucleicos (ARN) y Proteínas
 Biosíntesis de Ácidos nucleicos (ARN) y Proteínas Núcleo celular Dogma central de la Biología Molecular Repasando los Ácidos nucleicos. Empaquetamiento de ADN 46 cromosomas en las células somáticas del
Biosíntesis de Ácidos nucleicos (ARN) y Proteínas Núcleo celular Dogma central de la Biología Molecular Repasando los Ácidos nucleicos. Empaquetamiento de ADN 46 cromosomas en las células somáticas del
CAPITULO 1 FISIOLOGIA DE LA HEMOSTASIA
 CAPITULO 1 FISIOLOGIA DE LA HEMOSTASIA TROMBOPOYESIS MEGACARIOCITO. REGULACION DE LA PRODUCCION DE PLAQUETAS. DINAMICA PLAQUETARIA. ULTRAESTRUCTURA PLAQUETARIA: ZONA PERIFERICA, ZONA GEL, ZONA ORGANELAS.
CAPITULO 1 FISIOLOGIA DE LA HEMOSTASIA TROMBOPOYESIS MEGACARIOCITO. REGULACION DE LA PRODUCCION DE PLAQUETAS. DINAMICA PLAQUETARIA. ULTRAESTRUCTURA PLAQUETARIA: ZONA PERIFERICA, ZONA GEL, ZONA ORGANELAS.
TEMA 11.- CINÉTICA ENZIMÁTICA
 TEMA 11.- CINÉTICA ENZIMÁTICA Introducción: Cinética enzimática. Ecuación de Michaelis-Menten. Ecuación de Lineweaver-Burk. Reacciones con múltiples substratos. Inhibición enzimática: - Reversible Competitiva.
TEMA 11.- CINÉTICA ENZIMÁTICA Introducción: Cinética enzimática. Ecuación de Michaelis-Menten. Ecuación de Lineweaver-Burk. Reacciones con múltiples substratos. Inhibición enzimática: - Reversible Competitiva.
Análisis de genealogías con enfermedades autosómicas dominantes
 Análisis de genealogías con enfermedades autosómicas dominantes ACONDROPLASIA Enanismo acondroplásico, enfermedad que se hereda de manera autosómica dominante. ACONDROPLASIA Enfermedad autosómica dominante
Análisis de genealogías con enfermedades autosómicas dominantes ACONDROPLASIA Enanismo acondroplásico, enfermedad que se hereda de manera autosómica dominante. ACONDROPLASIA Enfermedad autosómica dominante
LA ORGANIZACIÓN DEL CUERPO HUMANO
 LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS VETERINARIAS DEPARTAMENTO DE CIENCIAS BÁSICAS FARMACOLOGÍA VETERINARIA
 UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS VETERINARIAS DEPARTAMENTO DE CIENCIAS BÁSICAS FARMACOLOGÍA VETERINARIA UCLA 3 de Febrero de 1964 ANALGÉSICOS ANTIINFLAMATORIOS NO ESTEROIDALES
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS VETERINARIAS DEPARTAMENTO DE CIENCIAS BÁSICAS FARMACOLOGÍA VETERINARIA UCLA 3 de Febrero de 1964 ANALGÉSICOS ANTIINFLAMATORIOS NO ESTEROIDALES
LOGO. Funciones del Hígado. Lic. Javier Céspedes Mata, M.E. 1
 LOGO Funciones del Hígado Lic. Javier Céspedes Mata, M.E. 1 Funciones del hígado Hígado En el adulto promedio, el hígado pesa 1,4 kg. Es el segundo órgano más grande del cuerpo. Se encuentra debajo del
LOGO Funciones del Hígado Lic. Javier Céspedes Mata, M.E. 1 Funciones del hígado Hígado En el adulto promedio, el hígado pesa 1,4 kg. Es el segundo órgano más grande del cuerpo. Se encuentra debajo del
Revisión- Opción Múltiple Procesamiento de energía
 Revisión- Opción Múltiple Procesamiento de energía 1. El mmetabolismo es considerado como las "reacciones químicas totales que ocurren dentro de un organismo". Estas reacciones químicas pueden estar vinculados
Revisión- Opción Múltiple Procesamiento de energía 1. El mmetabolismo es considerado como las "reacciones químicas totales que ocurren dentro de un organismo". Estas reacciones químicas pueden estar vinculados
Profesor Mauricio Hernández F Biología 3 Medio
 Acción Hormonal Introducción Las hormonas son moléculas o macromoléculas químicas, que participan de la regulación de numerosos procesos, manteniendo la homeostasis. Las hormonas son mensajeros químicos,
Acción Hormonal Introducción Las hormonas son moléculas o macromoléculas químicas, que participan de la regulación de numerosos procesos, manteniendo la homeostasis. Las hormonas son mensajeros químicos,
