Tema 4. Cristaloquímica. Descripción estructural y
|
|
|
- Juan Carlos Miguélez Cano
- hace 7 años
- Vistas:
Transcripción
1 Tema 4. Cristaloquímica. Descripción estructural y estructuras tipos Qué objetivos tiene la Cristaloquímica? Las fases cristalinas son componentes esenciales de los materiales, y especificamente de los cerámicos Es necesario, por tanto, disponer de un conjunto de conocimientos, incluidos en lo que se denomina Cristaloquímica, que nos permitan describir y clasificar las estructuras cristalinas establecer los factores que determinan la formación de un tipo estructural para una composición, en condiciones específicas de presión y temperatura relacionar la estructura y las propiedades Como se pueden describir las estructuras cristalinas? El modelo más directo es el de la celda unidad No obstante, necesitamos disponer de una imagen de la estructura en tres dimensiones para conseguir información sobre la disposición relativa de los átomos, número de coordinación, distancias interatómicas, etc Qué enfoques alternativos se utilizan para visualizar y comparar estructuras? Se utilizan dos modelos para describir estructuras Enfoques de máximo empaquetamiento y poliedros ocupando espacio Página 1 de 18
2 Estructuras de maximo empaquetamiento : empaquetamiento cúbico compacto y empaquetamiento hexagonal compacto La idea fundamental es que las estructuras se disponen de manera que tienen la máxima densidad, conocida como Postulado de ocupación del espacio El modo más eficiente de empaquetar esferas en dos dimensiones muestra como el número de coordinación es seis, generandose capas de máximo empaquetamiento A, en las que se presentan direcciones de máximo empaquetamiento En el empaquetamiento tridimensional de esferas la segunda capa de empaquetamiento B, se dispone de manera que ocupa un cierto tipo de huecos originados en la primera La adición de una tercera capa de empaquetamiento tiene dos posibilidades o coincidir directamente en las posiciones de la capa A, o no generando una tercera capa C, surgiendo las secuencias más simples e importantes en la química estructural ABABAB.., conocida como empaquetamiento hexagonal compacto ABCABCABC.., conocida como empaquetamiento cúbico compacto El número de coordinación en ambos empaquetamientos es 12 El politipismo se refiere a la constatación de la formación de otras secuencias más complejas, con unidades repetitivas de más de una centena de capas Qué celdas unidad corresponden a los empaquetamientos compactos? Al empaquetamiento cúbico compacto la celda cúbica centrada en las caras y al empaquetamiento hexagonal compacto la celda hexagonal La relación entre empaquetamiento cúbico compacto y la celda cúbica centrada en las caras no es inmediata ya que las caras de la celda no se corresponden con las capas de máximo empaquetamiento Página 2 de 18
3 La celda unidad cúbica centrada en las caras contiene esferas en los vértices y el centro de las caras El número de esferas por celda unidad es cuatro La celda hexagonal es más simple y en este caso los planos de la base y altura sí coinciden con capas de máximo empaquetamiento La celda unidad contiene esferas en los ocho vertices y en el interior de la celda (coordenadas 1/3, 2/3, 1/2), en total dos esferas El volumen ocupado en las estructuras de máximo empaquetamiento es máximo, aproximadamente un % de la celda! Materiales que pueden describirse como estructuras de máximo empaquetamiento Los metales y aleaciones son ejemplos de materiales cuya estructura se describe perfectamente mediante el modelo de máximo empaquetamiento Algunos metales presentan polimorfismo, presentandose en más de una estructura (formas polimórficas) El Fe se puede presentar en función de la temperatura en dos formas polimórficas con celdas unidad cúbica centrada en las caras y cúbica centrada en el cuerpo El Co se presenta en las dos estructuras de máximo empaquetamiento Aunque los dos tipos de secuencia de apilamiento de capas de máximo empaquetamiento más simples son las mencionadas ABAB.. y ABCABC.. (empaquetamiento hexagonal compacto y empaquetamiento cúbico compacto), se pueden presentar un número infinito de secuencias más complejas, generando distintos polítipos Caso del Co metálico Página 3 de 18
4 Las aleaciones son fases intermetálicas y como en los metales sus estructuras pueden ser consideradas como estructuras de máximo empaquetamiento! Se pueden considerar las estructuras iónicas como empaquetamientos compactos? Las estructuras de fases componentes de muchos materiales cerámicos, tales como Al 2 O 3, MgO, Na 2 O, ZnO,.., en las que el anión es algo mayor que el catión pueden ser consideradas como formadas por capas de máximo empaquetamiento de aniones con los cationes ocupando posiciones intersticiales Variables de las que dependen las posibles estructuras La gran variedad de tipos de estructuras se genera considerando unicamente las variables Secuencia de apilamiento de las capas de aniones, empaquetamiento hexagonal o cúbico compacto Número y tipo de posiciones intersticiales que van a ocupar los cationes Tipos de posiciones intersticiales En un empaquetamiento compacto se presentan dos tipos de posiciones intersticiales tetraédricas (T + y T - ), constituidas por tres aniones que forman la base de un tetraedro y pertenecen a una capa de máximo empaquetamiento y situando el apice del tetraedro en la capa por encima o por abajo, respectivamente están situadas a un cuarto de la distancia entre las dos capas y más proximas a la base del tetraedro octaédricas (O), coordinadas por tres aniones en cada capa están situadas a la mitad de la distancia entre las capas Página 4 de 18
5 Balance de huecos en función del número de esferas empaquetadas Por cada anión hay dos huecos tetraédricos (uno T + y otro T - ) y un hueco octaédrico (O) En general, los cationes son demasiado grandes para ocupar los huecos intersticiales, por lo que aunque la disposición de aniones puede ser la misma que la de un empaquetamiento compacto, estos pueden no estar en contacto, lo que se conoce como estructuras eutácticas! Algunas estructuras iónicas de máximo empaquetamiento. En la Tabla se presentan algunas estructuras tipo considerando las variables comentadas anteriormente Es importante tener en cuenta las siguientes consideraciones Las diferentes estequiometrías surgen en función de la fracción de posiciones intersticiales ocupadas En algunas estructuras es útil considerar los cationes como formadores de capas de máximo empaquetamiento compacto, caso de CaF 2, la antifluorita es exactamente la inversa de la fluorita, caso del K 2 O El concepto de máximo empaquetamiento puede incluir aquellas estructuras en las que las capas de máximo empaquetamiento estén constituidas por aniones y grandes cationes, caso de la perovskita CaTiO 3 Algunas estructuras pueden considerarse como de máximo empaquetamiento en las que se puede haber perdido algunos aniones, caso del ReO 3 Página 5 de 18
6 Descripción de materiales con enlaces covalentes (direccionales) mediante el enfoque del empaquetamiento compacto Estructura del diamante. Estructura eutáctica Descripción estructural mediante el modelo de máximo empaquetamiento de fases con enlace intermedio Decripción de estructuras de compuestos moleculares mediante el empaquetamiento compacto Moleculas de forma esférica, H 2, CH 4 y HCl Moleculas no esféricas basadas en octaedros y tetraedros, Al 2 Br 6 y SnBr 4 Se conocen otras disposiciones de empaquetamiento derivadas del empaquetamiento compacto? Empaquetamiento tetragonal primitivo Derivado del empaquetamiento hexagonal compacto Número de coordinnación, 11 Empaquetamiento tetragonal centrado en el cuerpo Derivado del empaquetamiento cúbico compacto Número de coordinación, 10 Descripción estructural mediante el modelo de poliedros ocupando espacio En este modelo de descripción estructural se pone el énfasis en el número de coordinación de los cationes y el modo en que las estructuras pueden considerarse formadas por poliedros unidos mediante compartición de vertices, aristas o caras En la estructura del NaCl cada catión Na+ esta rodeado de 6 aniones Cl- Página 6 de 18
7 Esto se puede representar como un octaedro con iones Cl - en los vertices y el Na + en el centro Una visión tridimensional de esta estructura consiste en una red de octaédros compartiendo aristas Cada arista esta compartida por dos octaedros El enfoque de poliedros ocupando espacio tiene la ventaja de mostrar la topología o conectividad de la red y además indica claramente la situación de las posiciones intersticiales vacias! Ejemplos de estructuras mediante poliedros ocupando espacio Variables que se presentan en esta descripción estructural Se pueden encontrar una gran variedad de poliedros, aunque los tetraedros y octaedros son los más comunes Los vértices y aristas pueden ser comunes a más de dos poliedros y obviamente sólo dos poliedros pueden compartir una cara común Es de destacar que la descripción estructural mediante este modelo no implica la existencia de tales poliedros como entidades separadas! En NaCl o SiC no podemos encontrar poliedros distintos físicamente Las estructuras que poseen poliedros con existencia separada son Los materiales moleculares, Al 2 Br 6 Los compuestos que contienen iones complejos, silicatos Estabilidad de estructuras compartiendo poliedros Variación de la distancia catión-catión respecto a la catión-anión en diferentes poliedros con varias orientaciones posibles Inestabilidad en el caso de tetraedros compartiendo caras Página 7 de 18
8 Ausencia de cristales cuyas estructuras sean equivalentes al empaquetamiento hexagonal compacto de la estructura fluorita Estabilidad de estructuras con tetraedros con cationes muy cargados Algunas estructuras tipo comunes Sal común (NaCl), blenda de zinc o esfalérita (ZnS) y antifluorita (Na 2 O) Coordenadas de posiciones intersticiales (O, T + y T - ) en la celda cúbica centrada en las caras Alternancia de huecos T + y T - en direcciones paralelas a los ejes de la celda Celdas unidades de las estructuras de sal común (NaCl), blenda de zinc o esfalérita (ZnS) y antifluorita (Na 2 O) Números de coordinación Regla general de relación entre los números de coordinación y la estequiometria en compuestos A x B y! Visualización de la coordinación del anión en la celda de antifluorita Desplazamiento de la celda unidad Nueva celda de antifluorita Intercambiabilidad de posiciones aniónicas y catiónicas en las estructuras de sal común (NaCl) y blenda de zinc (ZnS) Descripción de las estructuras de sal común (NaCl), blenda de zinc o esfalérita (ZnS) y antifluorita (Na 2 O) mediante un tercer modelo de poliedros ocupando espacio Estructura de NaCl Octaedros NaCl 6 Compartición de aristas entre dos octaedros Dificultad de representación en un dibujo Página 8 de 18
9 Orientación de las caras de los octaedros respecto las capas de máximo empaquetamiento Compuestos con estructura de sal común Estructura de esfalérita Coordinación del Zn +2 y del S -2 Poliedros de coordinación ZnS 4 y SZn 4 Orientación de las caras de los tetraedros respecto las capas de máximo empaquetamiento Compuestos con estructura esfalerita. Estructura antifluorita Poliedros de coordinación Tetraedros NaO 4 y cubos ONa 8 Descripción como red tridimensional de tetraedros o cubos Compuestos con estructuras fluorita y antifluorita Empaquetamiento compacto y estructura fluorita, Distancias Ca-Ca y F-F Estructuras wurtzita (ZnS) y arseniuro de niquel (NiAs) Estructuras descritas mediante empaquetamiento hexagonal compacto Celda unidad hexagonal Coordenadas de los aniones Relación entre c y a (c/a) cuando los aniones están en contacto Posición de los huecos tetraédricos Posición del hueco T - en la celda hexagonal compacta a c Coordenadas de las posiciones intersticiales Celdas unidad de las estructuras de wurtzita y NiAs Página 9 de 18
10 Estructura de wurtzita Poliedros de coordinación ZnS 4 y SZn 4 Diferencias entre los modelos de blenda y wurtzita Compuestos con estructura de wurtzita Estructura de NiAs Poliedros de coordinación NiAs 6 y AsNi 6 Estructura de NiAs como poliedros de coordinación octaédricos Estructura de NiAs como poliedros de coordinación prismas trigonales Representación de prismas trigonales como triángulos en proyección sobre el plano xy Compuestos con estructura de NiAs Variación de c/a en compuestos con estructura de NiAs Inestabilidad de compuestos AX 2 equivalentes a fluorita y antifluorita con empaquetamiento hexagonal Cloruro de cesio La celda unidad es cúbica primitiva Números de coordinación Diferencias de estructuras con máximo empaquetamiento Compuestos con estructura de CsCl Otras estructuras AX Estructuras AX principales Variaciones estructurales de las más conocidas. Ortorombicidad y tetragonalidad Página 10 de 18
11 Otros compuestos AX con estructuras completamente diferentes Compuestos con iones d 8 Coordinación plano-cuadrada Compuestos con iones pesados del bloque p Efecto del par inerte Estructuras rutilo (TiO 2 ), CdI 2, CdCl 2 y Cs 2 O Principales tipos de estructuras AX 2 Descripción de la estructura de rutilo Ocupación de los huecos octaédricos Poliedros de coordinación Compartición de aristas de los octaedros.paralelos al eje c Compuestos con estructura rutilo Estructura CdI 2 Diferencia con el rutilo Estructura en capas Secuencia de apilamiento en CdI 2 Compuestos con estructura CdI 2 Estructura CdCl 2 Diferencias con la estructura de CdI 2 Celda hexagonal o romboédrica Magnitud de c respecto a la celda de CdI 2 Estructura en capas Compuestos que presentan esta estructura Estructura de Cs 2 O Página 11 de 18
12 Consideración como estructura anti-cdcl 2 Entornos de coordinación del Cs + Carácter iónico del compuesto Estructuras de K 2 O y Rb 2 O, comparación con la de Cs 2 O Cálculo de parámetros en celdas ortogonales Distancias catión-catión, anión-anión y catión-anión Estructura de silicatos. Algunas indicaciones para comprenderlas Complejidad de las formulas y estructuras de silicatos Es por tanto importante obtener información estructural a partir de las formulas químicas Es generalmente aceptado que las estructuras silicato están constituidas por cationes y aniones silicato! Son posibles varios tipos de aniones silicato desde tetraedros aislados a redes tridimensionales de silicato Principios en los que se basan las estructuras silicato En general los poliedros son tetraedros, SiO 4 Los tetraedros se unen compartiendo vertices Un vertice común no se puede compartir por más de dos tetraedros Los tetraedros nunca comparten entre si aristas o caras Relación simple entre fórmula y estructura en silicatos El factor mas importante es la relación silicio/oxígeno Para establecerla debemos distinguir dos tipos de oxigenos en los aniones silicato Página 12 de 18
13 Los oxígenos puente que son los que unen o son comunes a dos tetraedros, pudiendo considerarse efectivamente que la mitad pertenecen a un silicio y la otra mitad al otro átomo de silicio Los oxígenos no puente que son aquellos que están unidos a un sólo silicio o tetraedro se silicato y pueden considerarse como oxígenos terminales, perteneciendo por tanto a un sólo átomo de silicio La relación Si/O en una estructura cristalina de silicato depende del número relativo de oxigenos puente y no puente! Ejemplos de silicatos con diferentes relaciones Si/O y estructuras Condición de que los poliedros de los tetraedros esten ocupados exclusivamente por Si Ejemplos complejos en los que se puede obtener una idea aproximada del tipo de anión Relaciones Si/O 1:2.33 y 1:2.25 Estructuras intermedias entre láminas y redes tridimensionales Casos en los que se produce sustitución de Si +4 por Al +3 Consideración de la relación (Si+Al)/O Redes tridimensionales de albita, anortita, ortoclasa, eucriptita y espodumena Casos de sustitución en estructuras en láminas: talco y flogopita Presencia de Al +3 en coordinación tetraédrica y octaédrica Necesidad de distinguir entre ambos tipos de Al +3 Estructura de la moscovita Página 13 de 18
14 Palabras clave y conceptos Cristaloquímica : Trata diferentes aspectos de la estructura de los cristales tales como la descripción y clasificación de las estructuras cristalinas, los factores que determinan la formación de una determinada estructura cristalina y la relación entre la estructura cristalina y sus propiedades físicas y químicas. Cristalografía de rayos X : Trata principalmente de los métodos experimentales para resolver la estructura cristalina. Descripción estructural : Información requerida para obtener una imagen completa y clara de la estructura en tres dimensiones. Descripción mediante la celda unidad : La estructura viene descrita por la forma y tamaño de la celda unidad, y por la posición de los átomos en la celda. Enfoque de máximo empaquetamiento : El factor determinante en este enfoque es que las estructuras se disponen de manera que tienen la máxima densidad. Postulado de ocupación de espacio : Expresa el concepto de máximo empaquetamiento y dice que la estructura más probable o estable será aquella en la que se hace un uso más económico del espacio. Empaquetamiento cúbico compacto : Modelo de empaquetamiento de esferas, especies químicas, en tres dimensiones en él que la secuencia de apilamiento de las capas es ABCABC..., es decir que la unidad de repetición es ABC. Empaquetamiento hexagonal compacto : Modelo de empaquetamiento de esferas, especies químicas, en tres dimensiones en él que la secuencia de apilamiento de las capas es ABAB..., es decir que la unidad de repetición es AB. Politipos : Tipo especial de polimorfismo, en el que las diferencias estructurales en un material surgen porque la unidad de repetición en el apilamiento de capas de máximo Página 14 de 18
15 empaquetamiento pueden contener largas secuencias constituidas por hasta varios cientos de capas, con tamaños de incluso 500 Å. Celda cúbica centrada en las caras : Es la celda unidad correspondiente a un empaquetamiento cúbico compacto. Contiene cuatro esferas, especies químicas, por celda. Celda hexagonal : Es la celda unidad correspondiente a un empaquetamiento hexagonal compacto. Contiene dos esferas, especies químicas, por celda. Descripción estructural de sólidos iónicos : Las estructuras de estos sólidos en los que él anión es algo más grande que el catión, pueden considerarse constituidas por capas de aniones de máximo empaquetamiento con los cationes ocupando posiciones intersticiales. Una gran variedad de tipos de estructuras posibles pueden surgir considerando únicamente como variables la secuencia de apilamiento de las capas de aniones y el tipo y número de posiciones intersticiales que van a ocupar los cationes. Estructuras eutácticas : Estructuras en las que la disposición de aniones es la misma que en un empaquetamiento compacto, pero en las que los iones no están necesariamente en contacto. Posiciones intersticiales : Posiciones vacantes (huecos) presentes en las estructuras de máximo empaquetamiento. Huecos tetraédricos : Posiciones vacantes constituidas por tres aniones que forman la base de un tetraedro y pertenecen a una capa de máximo empaquetamiento y otro anión, que constituye el ápice del tetraedro, en una capa por encima o por debajo. Huecos octaédricos : Posiciones vacantes constituidas por seis aniones, tres en cada una de dos capas adyacentes. Página 15 de 18
16 Estructura tipo cloruro sódico : Se puede describir como una estructura cúbica de máximo empaquetamiento de aniones, ocupando los cationes todos los huecos octaédricos. Estructura tipo esfalerita : Se puede describir como una estructura cúbica de máximo empaquetamiento de aniones, ocupando los cationes la mitad de los huecos tetraédricos, los T + o los T -. Estructura tipo antifluorita : Se puede describir como una estructura cúbica de máximo empaquetamiento de aniones, ocupando los cationes todos los huecos tetraédricos, los T + y los T -. Esta relacionada con la de fluorita, en la que las especies empaquetadas son los cationes. Estructura tipo arseniuro de níquel : Se puede describir como una estructura hexagonal de máximo empaquetamiento de aniones, ocupando los cationes todos los huecos octaédricos. Estructura tipo wurtzita : Se puede describir como una estructura hexagonal de máximo empaquetamiento de aniones, ocupando los cationes la mitad de los huecos tetraédricos, los T + o los T -. Estructura rutilo : Se puede describir como una estructura hexagonal de máximo empaquetamiento de aniones, con cierta ondulación en las capas de empaquetamiento, ocupando los cationes la mitad de los huecos octaédricos. Estructura perovsquita : Se puede describir como una estructura cúbica de máximo empaquetamiento de aniones y el catión de mayor tamaño, ocupando los cationes menores un cuarto de los huecos octaédricos disponibles. Enfoque de poliedros ocupando espacio : Esta forma de enfocar la descripción de estructuras cristalinas se basa en la consideración que dichas estructuras pueden Página 16 de 18
17 considerarse construidas por poliedros de coordinación de los cationes, unidos mediante compartición de elementos de poliedro, esto es vértices, aristas o caras. Poliedro de coordinación : Los vecinos más próximos de una especie química, catión o anión, definen un poliedro constituido por aniones o cationes. El poliedro se representa conteniendo una especie química en el centro y los vecinos más próximos centrados en los vértices. Disposición en la celda cúbica centrada en las caras de las especies empaquetadas y huecos : Las coordenadas surgen de la constatación que las esferas empaquetadas están situadas en los vértices de la celda y en el centro de las cara, las posiciones octaédricas en la mitad de las aristas y el centro de la celda, y las posiciones tetraédricas en el centro de cada uno de los cubos que surgen bisectando las aristas de la celda unidad. Disposición en la celda hexagonal de las especies empaquetadas y huecos : Las coordenadas surgen de la constatación que las esferas empaquetadas están situadas en los vértices de la celda y en el interior de la celda (posición 1/3, 2/3, 1/2), las posiciones octaédricas en el interior de la celda (posiciones 2/3, 1/3, 1/4 y 2/3, 1/3, 3/4, y las posiciones tetraédricas T + en 1/3, 2/3, 1/8 y 0, 0, 5/8, y las T - en 1/3, 2/3, 7/8 y 0, 0, 3/8. Tipos de poliedros presentes en las estructuras de máximo empaquetamiento : En función de la ocupación de los huecos, tipo y número, deben surgir disposiciones de poliedros (tetraedros u octaedros) más o menos conectados (compartiendo más o menos elementos del poliedro). No obstante, al considerar poliedros de coordinación aniónicos surgen poliedros con otras geometrias. Estructura de silicatos y fórmula química : La fórmula química de los silicatos nos da información estructural sobre el tipo de anión silicato presente. Se basa en el principio que los silicatos están constituidos por tetraedros que comparten sus vértices con otros tetraedros. Así, se distinguen oxígenos puentes y no puentes, siendo el balance total de Página 17 de 18
18 oxígenos por silicio el que nos indica el tipo de anión silicato en la estructura. Los aniones silicato que podemos encontrar en las estructuras reales van desde tetraedros aislados hasta una red tridimensional de tetraedros, pasando evidentemente por situaciones intermedias en las que los aniones sean cadenas o láminas infinitas. Página 18 de 18
Los sólidos iónicos. Estructuras características de los sólidos iónicos
 Los sólidos iónicos Los compuestos iónicos suelen presentar una serie de características físicas que los distinguen de los covalentes. Así, los sólidos iónicos como el cloruro sódico y el nitrato de potasio
Los sólidos iónicos Los compuestos iónicos suelen presentar una serie de características físicas que los distinguen de los covalentes. Así, los sólidos iónicos como el cloruro sódico y el nitrato de potasio
ESTRUCTURAS CARACTERÍSTICAS
 ESTRUCTURAS CARACTERÍSTICAS En este capítulo se describen algunas estructuras muy simples que permitirán analizar la disposición de los átomos de diversos compuestos característicos en los que el enlace
ESTRUCTURAS CARACTERÍSTICAS En este capítulo se describen algunas estructuras muy simples que permitirán analizar la disposición de los átomos de diversos compuestos característicos en los que el enlace
Estructura de sólidos
 Estructura de sólidos Química Inorgánica - 2006 Tipos de estructuras cristalinas cristal enlace características molecular covalente-baja energía cristales blandos, bajo p.f. red covalente covalente cristales
Estructura de sólidos Química Inorgánica - 2006 Tipos de estructuras cristalinas cristal enlace características molecular covalente-baja energía cristales blandos, bajo p.f. red covalente covalente cristales
Tipos de estructuras. Introducción a la Ciencia de Materiales. M. Bizarro F. M. Sánchez
 Tipos de estructuras Empaquetamiento compacto Son estructuras formadas por átomos de igual tamaño que se unen mediante enlace metálico (esferas duras) A B A : A B C : FCC vs HCP El factor de empaquetamiento
Tipos de estructuras Empaquetamiento compacto Son estructuras formadas por átomos de igual tamaño que se unen mediante enlace metálico (esferas duras) A B A : A B C : FCC vs HCP El factor de empaquetamiento
TEMA 8: SÓLIDOS INORGÁNICOS. 2.- Redes bidimensionales y tridimensionales
 TEMA 8: SÓLIDOS INORGÁNICOS 1.- Tipos de sólidos 2.- Redes bidimensionales y tridimensionales 3.- Celda unidad y sus parámetros: - nº de átomos / celda - nº de coordinación (NC) - fracción de volumen ocupado
TEMA 8: SÓLIDOS INORGÁNICOS 1.- Tipos de sólidos 2.- Redes bidimensionales y tridimensionales 3.- Celda unidad y sus parámetros: - nº de átomos / celda - nº de coordinación (NC) - fracción de volumen ocupado
Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado
 Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado Física de la Materia Condensada, Cristalografía y Mineralogía. Facultad de Ciencias. Universidad de Valladolid. Estructura
Síntesis y Caracterización Estructural de los Materiales Ángel Carmelo Prieto Colorado Física de la Materia Condensada, Cristalografía y Mineralogía. Facultad de Ciencias. Universidad de Valladolid. Estructura
Estructuras Cristalinas
 Estructuras Cristalinas Bibliografía: Solid State Chemistry: An introduction, L. Smart and E. Moore. 1992 Solid State Chemistry and its applications, A.R. West. 1984 1 Enlace en Cerámicos Iónico Mezcla
Estructuras Cristalinas Bibliografía: Solid State Chemistry: An introduction, L. Smart and E. Moore. 1992 Solid State Chemistry and its applications, A.R. West. 1984 1 Enlace en Cerámicos Iónico Mezcla
TEMA 8 ESTRUCTURA CRISTALINA
 Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Consideraciones sobre estructuras representativas
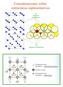 Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Ing. Fredy Velázquez Soto
 Ing. Fredy Velázquez Soto TIPOS DE SÓLIDOS Sólidos cristalinos Los átomos, iones o moléculas se empaquetan en un arreglo ordenado Sólidos covalentes ( diamante, cristales de cuarzo), sólidos metálicos,
Ing. Fredy Velázquez Soto TIPOS DE SÓLIDOS Sólidos cristalinos Los átomos, iones o moléculas se empaquetan en un arreglo ordenado Sólidos covalentes ( diamante, cristales de cuarzo), sólidos metálicos,
CAP. 1:ESTRUCTURAS CRISTALINAS
 CAP. 1:ESTRUCTURAS CRISTALINAS Sólidos cristalinos: amorfos: Disposiciones periódicas en el espacio Disposición al azar Situaciones intermedias: (no periódicas pero ordenadas) Estructuras moduladas Casicristales
CAP. 1:ESTRUCTURAS CRISTALINAS Sólidos cristalinos: amorfos: Disposiciones periódicas en el espacio Disposición al azar Situaciones intermedias: (no periódicas pero ordenadas) Estructuras moduladas Casicristales
Sólidos Arreglos y celdas unitarias. Ramón L. Hernández Castillo Enero 2012
 Sólidos Arreglos y celdas unitarias Ramón L. Hernández Castillo Enero 2012 Importancia de estudiar los sólidos cristalinos La mayoría de los compuestos inorgánicos son sólidos Casi todos los elementos
Sólidos Arreglos y celdas unitarias Ramón L. Hernández Castillo Enero 2012 Importancia de estudiar los sólidos cristalinos La mayoría de los compuestos inorgánicos son sólidos Casi todos los elementos
CRISTALOGRAFIA. Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones.
 CRISTALOGRAFIA CRISTAL SÓLIDO MONOCRISTALINO SÓLIDO POLICRISTALINO Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones. Región donde el
CRISTALOGRAFIA CRISTAL SÓLIDO MONOCRISTALINO SÓLIDO POLICRISTALINO Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones. Región donde el
TEMA 6: Unidades Secundarias de Construcción (SBU) en fosfitos
 1.) Concepto TEMA 6: Unidades Secundarias de Construcción (SBU) en fosfitos Las estructuras abiertas se pueden construir a partir de una amplia variedad de unidades estructurales. La unidad estructural
1.) Concepto TEMA 6: Unidades Secundarias de Construcción (SBU) en fosfitos Las estructuras abiertas se pueden construir a partir de una amplia variedad de unidades estructurales. La unidad estructural
Estructura Cristalina de Sólidos
 Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Igual número de cationes y aniones. Ejemplos: cloruro de sodio (NaCl), cloruro de cesio (CsCl), blenda (ZnS), etc.
 6. MATERIALES CERÁMICOS 6.1 Estructura de los cerámicos Enlace atómico: parcial o totalmente iónico Iones metálicos: cationes (ceden sus electrones, +), aniones (aceptan electrones, - ). Estructuras cristalinas,
6. MATERIALES CERÁMICOS 6.1 Estructura de los cerámicos Enlace atómico: parcial o totalmente iónico Iones metálicos: cationes (ceden sus electrones, +), aniones (aceptan electrones, - ). Estructuras cristalinas,
TECTOSILICATOS INTRODUCCIÓN GRUPO DE LA SILICE ESTRUCTURAS POLIMORFISMO. Magdalena Rodas
 TECTOSILICATOS INTRODUCCIÓN GRUPO DE LA SILICE ESTRUCTURAS POLIMORFISMO Magdalena Rodas TECTOSILICATOS Grupo de la sílice (SiO 2 ) Grupo de los feldespatos (Si 3 Al O 8 ) -1 Grupo de los feldespatóides
TECTOSILICATOS INTRODUCCIÓN GRUPO DE LA SILICE ESTRUCTURAS POLIMORFISMO Magdalena Rodas TECTOSILICATOS Grupo de la sílice (SiO 2 ) Grupo de los feldespatos (Si 3 Al O 8 ) -1 Grupo de los feldespatóides
Tema 8. Sólidos iónicos
 Tema 8. Sólidos iónicos Definiciones Estructuras iónicas Derivadas de CCP Derivadas de HCP Derivadas de empaquetamientos no compactos Racionalización de las estructuras iónicas Principios de Laves Reglas
Tema 8. Sólidos iónicos Definiciones Estructuras iónicas Derivadas de CCP Derivadas de HCP Derivadas de empaquetamientos no compactos Racionalización de las estructuras iónicas Principios de Laves Reglas
TEMA 5. Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS
 TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
Sólidos Covalentes. Tema 4: Estado Sólido. QUIMICA GENERAL Química Inorgánica Sólidos Covalentes
 Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
Sólidos Covalentes Esta obra está licenciada bajo una Licencia Creative Commons Reconocimiento-NoComercial-SinObraDerivada 3.0 España Attribution-NonCommercial-NoDerivs 3.0 Unported CC BY-NC-ND 3.0 http://creativecommons.org/licenses/by-nc-nd/3.0/es/
ENLACE IÓNICO. Dra. Silvia Elena Castillo Blum
 ENLACE IÓNICO Dra. Silvia Elena Castillo Blum Enlace Químico ENLACE IÓNICO ENLACE COVALENTE ENLACE METÁLICO 2 Definición IUPAC Hay un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas
ENLACE IÓNICO Dra. Silvia Elena Castillo Blum Enlace Químico ENLACE IÓNICO ENLACE COVALENTE ENLACE METÁLICO 2 Definición IUPAC Hay un enlace químico entre dos átomos o grupos de átomos cuando las fuerzas
Sólidos Iónicos El enlace Iónico (1)
 1 Sólidos Iónicos El enlace Iónico (1) 2 * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993. Capítulo 4. * Douglas,
1 Sólidos Iónicos El enlace Iónico (1) 2 * Huheey, J. E., Keiter, R. L., Keiter, E. A., Inorganic Chemistry: Principles of Structure and Reactivity, 4ª Ed., Harper Collins, 1993. Capítulo 4. * Douglas,
Enlace iónico. elemento poco. elemento muy + electronegativo. compuesto iónico (sal) electronegativo
 Enlace iónico Enlace iónico Necesitamos un nuevo modelo para explicar ciertas peculiaridades (Li2O). Este nuevo modelo es el enlace iónico Se forma por transferencia de electrones (no hay reparto equitativo,
Enlace iónico Enlace iónico Necesitamos un nuevo modelo para explicar ciertas peculiaridades (Li2O). Este nuevo modelo es el enlace iónico Se forma por transferencia de electrones (no hay reparto equitativo,
Cl Electrones de valencia: Cl: 7 3 = 21 P: 5 Total 26 Tres enlaces sencillos: - 6 Electrones restantes: 20
 ESTRUCTURAS DE LEWIS PARA EL ENLACE COVALENTE.- Lewis sugirió que los átomos comparten electrones para alcanzar la configuración de gas noble y tener así una estructura más estable. Salvo en el caso de
ESTRUCTURAS DE LEWIS PARA EL ENLACE COVALENTE.- Lewis sugirió que los átomos comparten electrones para alcanzar la configuración de gas noble y tener así una estructura más estable. Salvo en el caso de
EL ENLACE QUÍMICO. Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o iones.
 EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
Física Cuántica. Sólidos II. Requerimientos previos. José Manuel López y Luis Enrique González. Universidad de Valladolid. Curso p.
 Física Cuántica Sólidos II. Requerimientos previos. José Manuel López y Luis Enrique González Universidad de Valladolid Curso 2004-2005 p. 1/20 Red cristalina El primer dibujo de un cristal apareció en
Física Cuántica Sólidos II. Requerimientos previos. José Manuel López y Luis Enrique González Universidad de Valladolid Curso 2004-2005 p. 1/20 Red cristalina El primer dibujo de un cristal apareció en
IMPERFECCIONES CRISTALINAS ANA QUIGUANTAR EDWIN RODRIGUES JEISON CORDOBA
 IMPERFECCIONES CRISTALINAS ANA QUIGUANTAR EDWIN RODRIGUES JEISON CORDOBA CORPORACION UNIVERSITARIA AUTONOMA DE NARIÑO FACULTAD DE INGENIERIA MECANICA SEGUNDO SEMESTRE CIENCIA DE LOS MATERIALES SAN JUAN
IMPERFECCIONES CRISTALINAS ANA QUIGUANTAR EDWIN RODRIGUES JEISON CORDOBA CORPORACION UNIVERSITARIA AUTONOMA DE NARIÑO FACULTAD DE INGENIERIA MECANICA SEGUNDO SEMESTRE CIENCIA DE LOS MATERIALES SAN JUAN
n = = 1; 1234; 4; l l= = 0; 1; m m = = 0; 0 ; + 0; s 12; 2; = s s s = ½ ½
 ENLACE QUÍMICO 2012 6p 5d Energía 6s 4 f 5p 4d 5s 4s 4p 3d 3p 3s 2s 1s 2p nn == 4; 1; 2; 3; 0; 2; + 0; 2; ss = s= += +½ 1; ll == 1; 2; 3; 4; 0; m 2; 1; m == + 1; 0; 2; 1; s= +½ +½ ½ Enlaces según
ENLACE QUÍMICO 2012 6p 5d Energía 6s 4 f 5p 4d 5s 4s 4p 3d 3p 3s 2s 1s 2p nn == 4; 1; 2; 3; 0; 2; + 0; 2; ss = s= += +½ 1; ll == 1; 2; 3; 4; 0; m 2; 1; m == + 1; 0; 2; 1; s= +½ +½ ½ Enlaces según
Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados..
 ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados.. Son de tipo eléctrico. Al formarse un enlace
ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o cristales que son más estables que los átomos por separados.. Son de tipo eléctrico. Al formarse un enlace
4. Estructura atómica, enlaces y Ordenamiento atómico de los metales
 4. Estructura atómica, enlaces y Ordenamiento atómico de los metales Atomo Unidad estructural básica de todos los materiales. En nuestro modelo, los átomos están constituidos por tres partículas subatómicas
4. Estructura atómica, enlaces y Ordenamiento atómico de los metales Atomo Unidad estructural básica de todos los materiales. En nuestro modelo, los átomos están constituidos por tres partículas subatómicas
SOLUCIONARIO Guía Técnico Profesional
 SOLUCIONARIO Guía Técnico Profesional El enlace químico SGUICTC004TC33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 A Comprensión 4 A Comprensión 5 C Comprensión 6 D Aplicación 7
SOLUCIONARIO Guía Técnico Profesional El enlace químico SGUICTC004TC33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 A Comprensión 4 A Comprensión 5 C Comprensión 6 D Aplicación 7
Capítulo 2 La estructura de los sólidos cristalinos
 Capítulo 2 La estructura de los sólidos cristalinos TEMA 2: La estructura de los sólidos cristalinos 1. Los enlaces interatómicos 2. La estructura cristalina 3. Estructuras de empaquetamiento compacto
Capítulo 2 La estructura de los sólidos cristalinos TEMA 2: La estructura de los sólidos cristalinos 1. Los enlaces interatómicos 2. La estructura cristalina 3. Estructuras de empaquetamiento compacto
Química Inorgánica-63.13- Dra.Silvia E. Jacobo. Sólidos. Estructuras Cristalinas
 Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES
 UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
UNIDAD 3. MODIFICACIÓN DE LAS PROPIEDADES DE LOS METALES 1. GENERALIDADES... Pág. 49 2. ESTRUCTURA INTERNA DE LOS METALES... Pág. 49 2.1. Estructuras cristalinas... Pág. 49 2.2. Estructura cristalina cúbica
INO-1 PX Magdalena Rodas INOSILICATOS
 INO-1 PX Magdalena Rodas INOSILICATOS INOSILICATOS -Introducción: Rasgos estructurales básicos * Cadenas secillas: Piroxenos y piroxenoides. * Cadenas dobles: Anfíboles Silicatos con estructuras en cadenas
INO-1 PX Magdalena Rodas INOSILICATOS INOSILICATOS -Introducción: Rasgos estructurales básicos * Cadenas secillas: Piroxenos y piroxenoides. * Cadenas dobles: Anfíboles Silicatos con estructuras en cadenas
UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción En la naturaleza, son muy pocos los átomos que se encuentran libres y aislados, sólo los átomos de
UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción En la naturaleza, son muy pocos los átomos que se encuentran libres y aislados, sólo los átomos de
Tema 9. SOLIDOS COVALENTES
 Tema 9. SOLIDOS COVALENTES Introducción Estructuras de no-metales Boro Carbono Fósforo Arsénico, Antimonio y Bismuto Selenio y Telurio Estructuras de óxidos Estructuras basadas en tetraedros Estructuras
Tema 9. SOLIDOS COVALENTES Introducción Estructuras de no-metales Boro Carbono Fósforo Arsénico, Antimonio y Bismuto Selenio y Telurio Estructuras de óxidos Estructuras basadas en tetraedros Estructuras
ENLACE QUÍMICO UNIDADES ESTRUCTURALES DE LAS SUSTANCIAS IONES ÁTOMOS MOLÉCULAS ENLACE IÓNICO ENLACE METÁLICO ENLACE COVALENTE ENLACE COVALENTE
 ENLACE QUÍMICO Y TIPOS ENLACE QUÍMICO Enlace químico es la fuerza responsable de la unión entre las unidades estructurales ( iones, átomos o moléculas) que forman la materia. UNIDADES ESTRUCTURALES DE
ENLACE QUÍMICO Y TIPOS ENLACE QUÍMICO Enlace químico es la fuerza responsable de la unión entre las unidades estructurales ( iones, átomos o moléculas) que forman la materia. UNIDADES ESTRUCTURALES DE
Tema 1: Sólidos cristalinos Curso 2016/17
 Física del Estado Sólido I Tema 1: Sólidos cristalinos Curso 2016/17 Qué es un cristal? Un cristal ideal está formado por una distribución periódica tridimensional de átomos Desde hace siglos se observó
Física del Estado Sólido I Tema 1: Sólidos cristalinos Curso 2016/17 Qué es un cristal? Un cristal ideal está formado por una distribución periódica tridimensional de átomos Desde hace siglos se observó
Tipos de Enlaces Atómicos y Moleculares
 Tipos de Enlaces Atómicos y Moleculares Enlaces atómicos primarios Iónicos Covalentes Metálicos Enlaces atómicos secundarios y moleculares Dipolos permanentes Dipolos fluctuantes Enlaces Iónicos Grandes
Tipos de Enlaces Atómicos y Moleculares Enlaces atómicos primarios Iónicos Covalentes Metálicos Enlaces atómicos secundarios y moleculares Dipolos permanentes Dipolos fluctuantes Enlaces Iónicos Grandes
Empaquetamiento compacto
 Empaquetamiento compacto Energía y empaquetamiento No denso, empaquetamiento aleatorio Energy Distancia del enlace energía de enlace Denso, empaquetamiento ordenado Energy distancia del enlace r Energía
Empaquetamiento compacto Energía y empaquetamiento No denso, empaquetamiento aleatorio Energy Distancia del enlace energía de enlace Denso, empaquetamiento ordenado Energy distancia del enlace r Energía
Materiales-G704/G742. Jesús Setién Marquínez Jose Antonio Casado del Prado Soraya Diego Cavia Carlos Thomas García
 Materiales-G704/G742 Lección 3. Estructura cristalina y amorfa Jesús Setién Marquínez Jose Antonio Casado del Prado Soraya Diego Cavia Carlos Thomas García Departamento de Ciencia e Ingeniería del Terreno
Materiales-G704/G742 Lección 3. Estructura cristalina y amorfa Jesús Setién Marquínez Jose Antonio Casado del Prado Soraya Diego Cavia Carlos Thomas García Departamento de Ciencia e Ingeniería del Terreno
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias
 Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
Tema 3. (Parte 1) Enlace químico y propiedades de las sustancias ÍNDICE 3.1. Enlace y estabilidad energética 3.2. Enlace iónico Energía de red Ciclo de Born-Haber Propiedades de las sustancias iónicas
QUÍMICA. Tema 3. Enlace Químico
 Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
07/02/2015 EL ENLACE QUÍMICO. Tema 5
 EL ENLACE QUÍMICO Tema 5 Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
EL ENLACE QUÍMICO Tema 5 Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
MATERIALES CERÁMICOS
 MATERIALES CERÁMICOS Son materiales inorgánicos no metálicos, constituidos por elementos metálicos y no metálicos enlazados principalmente mediante enlaces iónicos y/o covalentes. PROPIEDADES 1.En general,
MATERIALES CERÁMICOS Son materiales inorgánicos no metálicos, constituidos por elementos metálicos y no metálicos enlazados principalmente mediante enlaces iónicos y/o covalentes. PROPIEDADES 1.En general,
QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO
 Javier Robledano Arillo Química 2º Bachillerato Enlace Químico - 1 QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO 1. Enlace químico: conjunto de fuerzas que mantienen unidos
Javier Robledano Arillo Química 2º Bachillerato Enlace Químico - 1 QUÍMICA - 2º BACHILLERATO ENLACE QUÍMICO RESUMEN CONCEPTO DE ENLACE QUÍMICO 1. Enlace químico: conjunto de fuerzas que mantienen unidos
Uniones químicas o enlaces químicos
 Uniones químicas o enlaces químicos En la naturaleza es muy difícil encontrar átomos libres de los diferentes elementos ya que la gran mayoría (excepto los átomos de los gases inertes) son muy inestables
Uniones químicas o enlaces químicos En la naturaleza es muy difícil encontrar átomos libres de los diferentes elementos ya que la gran mayoría (excepto los átomos de los gases inertes) son muy inestables
EL ENLACE QUÍMICO (FisQuiWeb)
 EL ENLACE QUÍMICO (FisQuiWeb) Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden a unirse y no permanecen
EL ENLACE QUÍMICO (FisQuiWeb) Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden a unirse y no permanecen
TEMA 4: EL ENLACE QUÍMICO
 TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
Sistemática de minerales. 2. Silicatos
 Sistemática de minerales 2. Silicatos Silicatos Enlace Si-O Geometría: tetraedros Estabilidad máxima Posibilidad polimerización Grupos de Silicatos Nesosilicatos [SiO4] -4 Grupos de Silicatos Sorosilicatos
Sistemática de minerales 2. Silicatos Silicatos Enlace Si-O Geometría: tetraedros Estabilidad máxima Posibilidad polimerización Grupos de Silicatos Nesosilicatos [SiO4] -4 Grupos de Silicatos Sorosilicatos
Enlace químico Educación Secundaria Obligatoria Física y Química
 EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
ENLACE QUÍMICO. NaCl. Grafito: láminas de átomos de carbono
 NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
NaCl Grafito: láminas de átomos de carbono Se denomina enlace químico al conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas
Ejercicios tabla periódica. Enlace 4º ESO
 1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico Compuestos iónicos y sus propiedades 2.
 1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico 2.1.1- Compuestos iónicos y sus propiedades 2.2- Enlace covalente 2.2.1-Estructura de Lewis 2.2.2- Compuestos
1- Enlaces entre átomos Por qué se unen los átomos? 2- Distintos tipos de enlaces 2.1- Enlace iónico 2.1.1- Compuestos iónicos y sus propiedades 2.2- Enlace covalente 2.2.1-Estructura de Lewis 2.2.2- Compuestos
Tema 2. La agrupación de los átomos en la materia.
 Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
UNIDAD 1: LA MATERIA CRISTALINA
 UNIDAD 1: LA MATERIA CRISTALINA CONCEPTOS MATERIA CRISTALINA: Aquella cuyas partículas están perfectamente ordenadas en el espacio, ocupando posiciones fijas y a distancias regulares unas de otras, formando
UNIDAD 1: LA MATERIA CRISTALINA CONCEPTOS MATERIA CRISTALINA: Aquella cuyas partículas están perfectamente ordenadas en el espacio, ocupando posiciones fijas y a distancias regulares unas de otras, formando
INSTITUCIÒN EDUCATIVA JUAN MARIA CESPEDES. DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
 INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
GUÍA DE EJERCICIOS ENLACE
 GUÍA DE EJERCICIOS ENLACE Área Química Resultados de aprendizaje Aplicar y analizar características de moléculas, para predecir solubilidad, tipo de enlace que la forman y estructura más estable, potenciando
GUÍA DE EJERCICIOS ENLACE Área Química Resultados de aprendizaje Aplicar y analizar características de moléculas, para predecir solubilidad, tipo de enlace que la forman y estructura más estable, potenciando
ESTRUCTURAS CRISTALINAS (P2)
 ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
1.2. Celdas Unitarias Parámetros Reticulares
 Capítulo 2 Organización Atómica 1.2. Celdas Unitarias Parámetros Reticulares 1.2.1. Celdas Unitarias La estructura atómica influye en la forma en que los átomos se unen entre sí; esto además nos ayuda
Capítulo 2 Organización Atómica 1.2. Celdas Unitarias Parámetros Reticulares 1.2.1. Celdas Unitarias La estructura atómica influye en la forma en que los átomos se unen entre sí; esto además nos ayuda
SIMETRÍA INFINITA. nt = kt
 SIMETRÍA INFINITA Al considerar el cristal como un medio periódico en el cual un grupo de átomos (el motivo) se repite en las tres dimensiones del espacio, de manera que entre dos puntos homólogos de dos
SIMETRÍA INFINITA Al considerar el cristal como un medio periódico en el cual un grupo de átomos (el motivo) se repite en las tres dimensiones del espacio, de manera que entre dos puntos homólogos de dos
TECTO-3 FELDESPATOS. M.Rodas
 TECTO-3 FELDESPATOS M.Rodas FELDESPATOS 1.- Importancia 2.- Caracterización 3.- Clasificación 4.- Estructuras: -Sanidina - Microclina -Ortosa -Albita -Anortita - Miembros intermedios. 5.- Comportamiento
TECTO-3 FELDESPATOS M.Rodas FELDESPATOS 1.- Importancia 2.- Caracterización 3.- Clasificación 4.- Estructuras: -Sanidina - Microclina -Ortosa -Albita -Anortita - Miembros intermedios. 5.- Comportamiento
10/11/2016 EL ENLACE QUÍMICO
 EL ENLACE QUÍMICO Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
EL ENLACE QUÍMICO Por qué se unen los átomos? Los átomos, moléculas e iones y se unen entre sí porque al hacerlo se llega a una situación de mínima energía, lo que equivale a decir de máxima estabilidad
CONDICIONES DE VITRIFICACION
 CONDICIONES DE VITRIFICACION No todos les materiales presentan estructura vítrea y el efecto de transición vítrea! Aun enfriando rapidamente! - un vidrio requiere de una cantidad razonable de SiO2 y/o
CONDICIONES DE VITRIFICACION No todos les materiales presentan estructura vítrea y el efecto de transición vítrea! Aun enfriando rapidamente! - un vidrio requiere de una cantidad razonable de SiO2 y/o
TEMA 2. ENLACES QUIMICOS
 TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que
TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que
ENLACE COVALENTE. Z = 1 Hidrógeno H: 1s 1 Z = 6 Carbono C: 1s 2 2s 2 2p 2 Z = 7 Nitrógeno N: 1s 2 2s 2 2p 3 Z = 8 Oxígeno O: 1s 2 2s 2 2p 4 H H H 2
 ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
ENLACE COVALENTE Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es
ENLACE QUIMICO. Q.F. Luis José Torres Santillán
 ENLACE QUIMICO Q.F. Luis José Torres Santillán Enlace Químico Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial
ENLACE QUIMICO Q.F. Luis José Torres Santillán Enlace Químico Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial
Fuerzas intermoleculares y líquidos y sólidos
 Fuerzas intermoleculares y líquidos y sólidos Capítulo 11 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Una fase es la parte homógenea de un sistema en contacto
Fuerzas intermoleculares y líquidos y sólidos Capítulo 11 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Una fase es la parte homógenea de un sistema en contacto
NESOSILICATOS-1 OLIVINO
 NESOSILICATOS-1 OLIVINO M. Rodas Tomado de :www/usuarios.lycos.es GRUPO DEL OLIVINO NESOSILICATOS GRUPO DE LOS GRANATES GRUPO DE LOS NESOSILICATOS ALUMINICOS: Andalucita, Sillimanita, Distena o cianita
NESOSILICATOS-1 OLIVINO M. Rodas Tomado de :www/usuarios.lycos.es GRUPO DEL OLIVINO NESOSILICATOS GRUPO DE LOS GRANATES GRUPO DE LOS NESOSILICATOS ALUMINICOS: Andalucita, Sillimanita, Distena o cianita
Tema 2: Fuerzas intermoleculares
 Tema 2: Fuerzas intermoleculares Fuerzas intermoleculares: ion dipolo, dipolo dipolo, dispersión de London y puentes de hidrógeno. Gases ideales y reales. Propiedades de los ĺıquidos. Presión de vapor.
Tema 2: Fuerzas intermoleculares Fuerzas intermoleculares: ion dipolo, dipolo dipolo, dispersión de London y puentes de hidrógeno. Gases ideales y reales. Propiedades de los ĺıquidos. Presión de vapor.
Enlaces entre átomos:
 Enlaces entre átomos: 1. Enlace químico 2. Formación de enlaces moleculares 3. Orbitales híbridos 4. Fórmula de las moléculas 5. Forma de las moléculas 1 En la naturaleza, los átomos no se encuentran aislados
Enlaces entre átomos: 1. Enlace químico 2. Formación de enlaces moleculares 3. Orbitales híbridos 4. Fórmula de las moléculas 5. Forma de las moléculas 1 En la naturaleza, los átomos no se encuentran aislados
Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico
 Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico Naturaleza del enlace químico Los átomos tienden a adquirir la máxima estabilidad y esto se consigue
Naturaleza del enlace químico Enlace iónico Enlace covalente Enlaces intermoleculares Enlace metálico Naturaleza del enlace químico Los átomos tienden a adquirir la máxima estabilidad y esto se consigue
El enlace químico 3 ESO SEK-CATALUNYA
 El enlace químico 3 ESO SEK-CATALUNYA Contenidos Enlace químico Enlace metálico Propiedades de los metales Enlace iónico Propiedades de los compuestos iónicos Enlace covalente Propiedades de los compuestos
El enlace químico 3 ESO SEK-CATALUNYA Contenidos Enlace químico Enlace metálico Propiedades de los metales Enlace iónico Propiedades de los compuestos iónicos Enlace covalente Propiedades de los compuestos
Física y Química 4º ESO Enlace químico página 1 de 6. Enlace químico
 Física y Química 4º ESO Enlace químico página 1 de 6 Concepto de enlace químico Enlace químico Generalmente los átomos libres tienen, por separado, una estabilidad menor que cuando están combinados. Todo
Física y Química 4º ESO Enlace químico página 1 de 6 Concepto de enlace químico Enlace químico Generalmente los átomos libres tienen, por separado, una estabilidad menor que cuando están combinados. Todo
Enlaces y Propiedades de Sólidos con esos Enlaces
 Enlaces y Propiedades de Sólidos con esos Enlaces PROPIEDADES DE CRISTALES METÁLICOS En estos cristales el enlace predominante es el metálico. 1 Conductividad eléctrica y térmica en materiales metálicos
Enlaces y Propiedades de Sólidos con esos Enlaces PROPIEDADES DE CRISTALES METÁLICOS En estos cristales el enlace predominante es el metálico. 1 Conductividad eléctrica y térmica en materiales metálicos
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
Geología de Grado en Química. Prácticas. 8. Estructuras
 Geología de Grado en Química. Prácticas. 8. Estructuras José Manuel Astilleros García-Monge. Sol López-Andrés. Cristóbal Viedma Molero. Elena Vindel Catena. Dpto. de Cristalografía y Mineralogía. Facultad
Geología de Grado en Química. Prácticas. 8. Estructuras José Manuel Astilleros García-Monge. Sol López-Andrés. Cristóbal Viedma Molero. Elena Vindel Catena. Dpto. de Cristalografía y Mineralogía. Facultad
Para qué se unen los átomos? Es la fuerza que mantiene unidos dos átomos cualesquiera.
 Es la fuerza que mantiene unidos dos átomos cualesquiera. Enlace iónico : Es la fuerza que mantiene unidos átomos de electronegatividades muy diferentes. Enlace cova1ente: Es la fuerza que mantiene unidos
Es la fuerza que mantiene unidos dos átomos cualesquiera. Enlace iónico : Es la fuerza que mantiene unidos átomos de electronegatividades muy diferentes. Enlace cova1ente: Es la fuerza que mantiene unidos
EXAMEN DE QUÍMICA DE LOS MATERIALES CERÁMICOS (19/2/00) (7/7/00) Apellidos : Nombre :
 EXAMEN DE QUÍMICA DE LOS MATERIALES CERÁMICOS (19/2/00) (7/7/00) Apellidos : Nombre : INSTRUCCIONES : a) El examen consta de dos tipos de cuestiones. En el primer tipo se incluyen las preguntas tipo test
EXAMEN DE QUÍMICA DE LOS MATERIALES CERÁMICOS (19/2/00) (7/7/00) Apellidos : Nombre : INSTRUCCIONES : a) El examen consta de dos tipos de cuestiones. En el primer tipo se incluyen las preguntas tipo test
UNIDAD 3: EL ENLACE QUÍMICO
 UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA El enlace químico Nº Ejercicios PSU 1. Con respecto a la razón por la que se enlazan los átomos, cuál de las siguientes alternativas es correcta? A) Los átomos se enlazan
Programa Técnico Profesional QUÍMICA El enlace químico Nº Ejercicios PSU 1. Con respecto a la razón por la que se enlazan los átomos, cuál de las siguientes alternativas es correcta? A) Los átomos se enlazan
CORPORACION EDUCACIONAL JUAN XXIII COLEGIO "CARDENAL RAÚL SILVA HENRÍQUEZ" DEPARTAMENTO DE CIENCIAS QUÍMICA. Teoría de Enlace
 CORPORACION EDUCACIONAL JUAN XXIII COLEGIO "CARDENAL RAÚL SILVA HENRÍQUEZ" DEPARTAMENTO DE CIENCIAS QUÍMICA Teoría de Enlace Objetivo: Establecer que la capacidad de interacción entre átomos se explica
CORPORACION EDUCACIONAL JUAN XXIII COLEGIO "CARDENAL RAÚL SILVA HENRÍQUEZ" DEPARTAMENTO DE CIENCIAS QUÍMICA Teoría de Enlace Objetivo: Establecer que la capacidad de interacción entre átomos se explica
Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO. Fundamentos y Didáctica de la Física y la Química
 Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO Fundamentos y Didáctica de la Física y la Química Según la regla del octeto, una de las estructuras más estables de los elementos es tener ocho
Maestro: Especialidad: Educación Primaria ENLACE QUÍMICO Fundamentos y Didáctica de la Física y la Química Según la regla del octeto, una de las estructuras más estables de los elementos es tener ocho
Los compuestos químicos
 Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
Química General. Clase 3 FECHA: 19/05
 Química General Clase 3 FECHA: 19/05 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura de los compuestos iónicos.
Química General Clase 3 FECHA: 19/05 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura de los compuestos iónicos.
Tema 1: Tarea para resolver en clase Química General
 Tema 1: Tarea para resolver en clase Química General 1. Para los elementos 28 24 14 Si y 12 Mg de: a) número de protones contenidos en el núcleo b) número de neutrones contenidos en el núcleo c) número
Tema 1: Tarea para resolver en clase Química General 1. Para los elementos 28 24 14 Si y 12 Mg de: a) número de protones contenidos en el núcleo b) número de neutrones contenidos en el núcleo c) número
TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES
 PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
Introducción a la Ciencia de Materiales. M. Bizarro
 Introducción a la Ciencia de Materiales M. Bizarro Orden en la materia Sin orden: Gases monoatómicos Orden de corto alcance: Materiales Amorfos Orden de largo alcance Materiales cristalinos Cristales líquidos
Introducción a la Ciencia de Materiales M. Bizarro Orden en la materia Sin orden: Gases monoatómicos Orden de corto alcance: Materiales Amorfos Orden de largo alcance Materiales cristalinos Cristales líquidos
M A T E R I A L E S ENLACES QUIMICOS
 M A T E R I A L E S ENLACES QUIMICOS I FUERZAS DE ATRACCIÓN Intramoleculares: entre átomos de una molécula Determinan tipo de sustancia y propiedades químicas. Intermoleculares: entre moléculas Determinan
M A T E R I A L E S ENLACES QUIMICOS I FUERZAS DE ATRACCIÓN Intramoleculares: entre átomos de una molécula Determinan tipo de sustancia y propiedades químicas. Intermoleculares: entre moléculas Determinan
Fisica de Celdas Fotovoltaicas. Parte I: Conceptos Previos
 Fisica de Celdas Fotovoltaicas Parte I: Conceptos Previos José L. Solis Universidad Nacional de Ingenieria Instituto Peruano de Energia Nuclear Materiales Semiconductores Los Semiconductores son un grupo
Fisica de Celdas Fotovoltaicas Parte I: Conceptos Previos José L. Solis Universidad Nacional de Ingenieria Instituto Peruano de Energia Nuclear Materiales Semiconductores Los Semiconductores son un grupo
ENLACES QUÍMICOS. Prof.: Grettel Azofeifa Lizano
 ENLACES QUÍMICOS Prof.: Grettel Azofeifa Lizano Estructura de Lewis Es una representación de símbolos y puntos, propuesta pro Gilbert Lewis. Según las configuraciones electrónicas, se tiene el tronco electrónico
ENLACES QUÍMICOS Prof.: Grettel Azofeifa Lizano Estructura de Lewis Es una representación de símbolos y puntos, propuesta pro Gilbert Lewis. Según las configuraciones electrónicas, se tiene el tronco electrónico
15/04/2011. Cristales metálicos. Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas)
 15/04/2011 Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta,
15/04/2011 Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta,
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS
 I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
TEMA 3 ENLACE QUÍMICO (PARTE 2)
 TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
Tipos de enlaces. Intramoleculares: Intermoleculares: Metálico. Iónico. Covalente. Fuerzas de Van de Waals Enlaces de hidrógeno.
 El enlace químico Tipos de enlaces Intramoleculares: Iónico. Covalente. Intermoleculares: Fuerzas de Van de Waals Enlaces de hidrógeno. Metálico. Enlace iónico Se define como la fuerza electrostática
El enlace químico Tipos de enlaces Intramoleculares: Iónico. Covalente. Intermoleculares: Fuerzas de Van de Waals Enlaces de hidrógeno. Metálico. Enlace iónico Se define como la fuerza electrostática
LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1. PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS
 LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1 PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS 1. INTRODUCCIÓN 1.1 Red de Bravais y celda primitiva unidad Uno de los conceptos fundamentales
LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1 PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS 1. INTRODUCCIÓN 1.1 Red de Bravais y celda primitiva unidad Uno de los conceptos fundamentales
Esquema del tema. Tema 4: Enlace iónico. Un poco de empirismo
 Esquema del tema Modelo iónico Características de los compuestos iónicos Corrigiendo el modelo iónico: Polarización y Módulo 12555- Química Inorgánica Título: Ingeniería Química Responsable: Juan José
Esquema del tema Modelo iónico Características de los compuestos iónicos Corrigiendo el modelo iónico: Polarización y Módulo 12555- Química Inorgánica Título: Ingeniería Química Responsable: Juan José
Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Cristales metálicos
 Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta, de manera
Estructuras Cristalinas más usuales de Metales Puros (y de sus soluciones sólidas) Reglas generales Para un cristal al equilibrio químico, los átomos se ordenarán en forma regular y compacta, de manera
