TEMA 5. ESTRUCTURA Y PROPIEDADES MOLECULARES
|
|
|
- Gustavo Rodríguez Castro
- hace 8 años
- Vistas:
Transcripción
1 TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente Fuerzas entre dipolos Fuerzas de dispersión de London Puente de hidrógeno. 2. Influencia de la estructura sobre las propiedades moleculares Puntos de ebullición Puntos de fusión Solubilidad. 3. Acidez en las moléculas orgánicas Efecto inductivo y fuerza ácida Efectos estéricos y fuerza ácida Influencia de otros efectos sobre la fuerza ácida. 4. Basicidad en las moléculas orgánicas Efecto inductivo y de solvatación en la fuerza básica Efecto resonante y fuerza básica.
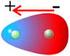
2 2 Tema 5 TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente Fuerzas entre dipolos Fuerzas de dispersión de London Puente de hidrógeno. 2. Influencia de la estructura sobre las propiedades moleculares Puntos de ebullición Puntos de fusión Solubilidad. 3. Acidez en las moléculas orgánicas Efecto inductivo y fuerza ácida Efectos estéricos y fuerza ácida Influencia de otros efectos sobre la fuerza ácida. 4. Basicidad en las moléculas orgánicas Efecto inductivo y de solvatación en la fuerza básica Efecto resonante y fuerza básica. 1. Enlaces más débiles que el enlace covalente. El enlace covalente es la unión que explica el mantenimiento de la unidad estructural de un compuesto orgánico. Además de este enlace intramolecular se pueden dar entre las moléculas una serie de interacciones, mucho más débiles que el enlace covalente, pero que a menudo son las responsables de las propiedades físicas de los compuestos orgánicos. Este tipo de interacciones intermoleculares son de especial importancia en el estado sólido y líquido, ya que las moléculas están en contacto continuo. Los puntos de fusión, de ebullición y las solubilidades de los compuestos orgánicos muestran los efectos de estas fuerzas. ay tres tipos principales de interacciones intermoleculares que hacen que las moléculas se asocien para formar sólidos y líquidos: las fuerzas entre dipolos de las moléculas polares, las fuerzas de London que afectan a todas las moléculas, y los puentes de hidrógeno que atraen moléculas que tienen grupos y N Fuerzas entre dipolos. La mayor parte de las moléculas tienen momentos bipolares permanentes como resultado de sus enlaces polares. ada momento bipolar molecular tiene un extremo positivo y otro negativo. La situación más estable es la que presenta erl extremo positivo cerca del extremo negativo de otra molécula. Las moléculas pueden girar y orientarse hacia la situación más estable que es en la orientación positivo-negativo. Las fuerzas entre dipolo-dipolo son fuerzas de atracción intermolecular. En la siguiente figura se indican las orientaciones de atracción y repulsión de las moléculas polares utilizando el clorometano como ejemplo. µ δ l l µ µ δ l l µ µ µ δ δ l l l l µ µ
3 Ampliación de química 3 omo las moléculas polares se orientan en la situación positivo-negativo de menor energía y la fuerza neta es de atracción para pasar del estado líquido al gaseoso debe superarse esta atracción, lo cual provoca mayores calores de evaporación y mayores puntos de ebullición para los compuestos de moléculas muy polares Fuerzas de dispersión de London. En las moléculas no polares, como la del tetracloruro de carbono l 4, la principal fuerza de atracción es la fuerza de dispersión de London, que surge de la interacción entre dipolos inducidos que se generan temporalmente en las moléculas. Por ejemplo, el l 4 no tiene momento bipolar permanente pero los electrones no están siempre distribuidos de manera uniforme. uando una molécula de l 4 se acerca a otra, en la que los electrones estén ligeramente desplazados, se induce un momento bipolar pequeño y temporal, de manera que los electrones en la molécula que se acerca se desplazarán ligeramente apareciendo una interacción atractiva entre dipolos.
4 4 Tema 5 Estos dipolos temporales solo duran una fracción de segundo y cambian continuamente. Sin embargo, se correlacionan de forma que su fuerza neta es de atracción. Esta fuerza de atracción depende del contacto superficial entre las moléculas y por tanto es proporcional al área molecular. El l 4 tiene un área superficial mayor que la del cloroformo (l 3 ) ya que un átomo de cloro es mayor que un átomo de hidrógeno las fuerzas intermoleculares entre las moléculas de l 4 son más fuertes que las que aparecen entre las moléculas de l 3. Las fuerzas de Van der Waals son fuerzas de atracción intermolecular entre dipolos, sean éstos permanentes o inducidos. Son fuerzas de tipo electrostático que unen a las moléculas tanto polares como apolares. Su valor oscila entre 0.1 y 35 KJ/mol Puente de hidrógeno. Un puente de hidrógeno no es un enlace verdadero sino una forma especialmente fuerte de atracción entre dipolos. Un átomo de hidrógeno puede participar en un puente de hidrógeno si está unido a oxígeno, nitrógeno o flúor, porque los enlaces -, N- y F- están muy polarizados dejando al átomo de hidrógeno con una carga parcial positiva. Este átomo de hidrógeno tiene una gran afinidad hacia electrones no compartidos y forma agregados intermoleculares con los electrones no compartidos de los átomos de oxígeno, nitrógeno y flúor. δ δ δ δ δ δ δ
5 Ampliación de química 5 puente de hidrógeno en el agua Aunque el puente de hidrógeno es una forma de atracción intermolecular es mucho más débil que un enlace covalente normal -, N- y F-. La ruptura de un puente de hidrógeno requiere de aproximadamente 5 Kcal/mol, en comparación con las 100 kcal/mol que se necesitan para romper un enlace -, N- o F-. La energía de este tipo de interacción puede oscilar entre 8 y 40 KJ/mol. El puente de hidrógeno tiene un efecto importante sobre las propiedades físicas de los compuestos orgánicos. Por ejemplo, las estructuras y puntos de ebullición del etanol ( 3 2 -) y del dimetil éter ( ), dos compuestos isoméricos son de 78º par el etanol y -25º para el dimetil éter. Estos dos isómeros poseen el mismo tamaño y peso molecular, sin embargo el etanol tiene un hidrógeno unido a oxígeno y forma puentes de hidrógeno de manera extensa. El dimetil éter no tiene hidrógeno unido a oxígeno, y por tanto no puede formar puentes de hidrógeno. omo resultado de la interacción por puente de hidrógeno el etanol presenta un punto de ebullición de mas de 100º superior al del dimetil éter.
6 6 Tema 5 δ δ 3 δ δ Influencia de la estructura sobre las propiedades moleculares Estas fuerzas intermoleculares influyen de la siguiente manera en las propiedades físicas de los compuestos orgánicos: 2.1. Puntos de ebullición El punto de ebullición de un compuesto es la temperatura a la cual el compuesto líquido se convierte en gas. Para que un compuesto se vaporice, las fuerzas que mantienen las moléculas unidas unas a otras deben romperse. Esto significa que el punto de ebullición de un compuesto depende de la tracción entre las moléculas, de manera que si las moléculas se mantienen unidas por fuertes fuerzas, se necesitará mucha energía para apartar las moléculas unas de otras y el compuesto tendrá el punto de ebullición muy alto. Por otra parte, si las fuerzas intermoleculares son débiles, una cantidad de energía relativamente baja será necesaria para separa las moléculas unas de otras, y el compuesto tendrá el punto de ebullición bajo. Los alcanos tienen punto de ebullición relativamente bajo porque como se trata de moléculas polares las fuerzas intermoleculares que actúan son las de dispersión de London entre dipolos inducidos que son las más débiles. Además estas fuerzas son mayores cuanto mayor es el área de contacto entre moléculas, por eso para moléculas lineares al aumentar el numero de (aumenta el peso molecular) el punto de ebullición también aumenta, sin embargo para un mismo número de la molécula ramificada presenta un punto de ebullición menor que la lineal. En el caso de alcoholes, éteres... (moléculas con heteroátomos) con cierto carácter polar, las fuerzas que intervienen son las dipolo-dipolo, más fuertes que las de London. Por tanto, sus puntos de ebullición serán mayores que los de los alcanos. En el caso de alcoholes y las aminas, además de estas fuerzas entre dipolos intervienen las fuerzas por puente de hidrógeno. Aunque cada puente de hidrógeno sólo supone 5 KJ/mol hay que pensar que hay al menos un puente de por cada molécula.
7 Ampliación de química 7 omo el es más electronegativo que el N el punto de ebullición de los alcoholes será mayor que el de las aminas Punto de fusión Es la temperatura a la que un sólido se convierte en líquido. En este caso el factor que influye en el valor del punto de fusión es el empaquetamiento de las moléculas. El empaquetamiento determina como se acomodan las moléculas dentro de una red cristalina. uanto mejor se ajusten al cristal mayor energía será necesaria para romper la red y, por tanto, mayor será el punto de fusión Solubilidad. Además de afectar a los puntos de ebullición y de fusión, las fuerzas intermoleculares determinan la solubilidad de los compuestos orgánicos. La regla general es que lo semejante disuelve a lo semejante, las susatancias polares se disuelven en disolventes polares y las no polares en disolventes no polares. ay cuatro casos distintos a la hora de considerar los efectos de la polaridad sobre la solubilidad. 1) Un soluto polar con un disolvente polar, como la disolución del cloruro sódico (soluto polar) en agua (disolvente polar). Se necesita una gran cantidad de energía para separar los iones del cloruro sódico pero el agua puede separarlos porque los solvata. Es decir, las moléculas de agua rodean al ión con el extremo adecuado del dipolo del agua hacia el ión. En el caso del ión positivo, el Na, el átomo de oxígeno de la molécula de agua es el que se acerca, mientras que los átomos de hidrógeno se acercan a los iones negativos cloruro (l-). omo las moléculas de agua son muy polares se libera una gran cantidad de energía, que junto con el aumento de la entropía, compensa la energía necesaria para romper la red cristalina.
8 8 Tema 5 2) Un soluto polar con un disolvente no polar, como el cloruro sódico (soluto polar) en la gasolina (disolvente no polar). En este caso no se produce la disolución del soluto porque las moléculas no polares de los hidrocarburos que constituyen las gasolinas no solvatan a los iones y no pueden superar la gran energía necesaria para romper la red cristalina. l Na l Na l Na soluto polar: Nal (red iónica) Na l Na l Na l 3 ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) 4 3 disolvente apolar: hexano (hidrocarburo) 3) Un soluto no polar con un disolvente no polar, como la cera de parafina que se disuelve en gasolina. La cera de parafina está constituida por largas moléculas de hidrocarburo y por tanto son moléculas no polares que se atraen débilmente, y estas atracciones se compensan fácilmente con las atracciones de van der Waals con el disolvente. Aunque hay poco cambio energético cuando la sustancia no polar se disuelve en el disolvente no polar, hay un gran aumento de la entropía, que hace que el proceso sea favorable.
9 Ampliación de química 9 Disolución de un soluto no polar en hexano 3 ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) ( 2 ) 4 3 4) Un soluto no polar con un disolvente polar, como la cera de parafina y el agua. Las moléculas no polares sólo se atraen débilmente y se necesita poca energía para separarlas. El problema es que las moléculas de agua se atraen fuertemente entre sí, por puentes de hidrógeno. La molécula no polar debería desplazar a estos enlaces, pero casi no se libera energía de solvatación. La red de puentes de hidrógeno de las moléculas de agua excluye a las moléculas de parafina. soluto no polar y agua 3. Acidez en las moléculas orgánicas. Según la teoría de Arrhenius, desarrollada al final del siglo XIX, un ácido es una sustancia que se ioniza en disolución dando iones y una base es una sustancia que se ioniza en disolución generando aniones hidroxilos ( - ). Esta definición ayudó a comprender el comportamiento de muchos ácidos y bases pero no explicaba la reactividad de otros compuestos, como el amoniaco N 3, que neutraliza a los ácidos pero no contiene una función hidroxilo en su fórmula molecular. En 1923 Brönsted y Löwry definieron un ácido como una sustancia capaz de ceder protones y una base como una sustancia capaz de aceptar protones. Según
10 10 Tema 5 esta definición, cualquier compuesto que contenga un puede potencialmente actuar como ácido y cualquier compuesto con un par de electrones solitario puede actuar como una base. Las dos especies, ácido y base, se necesitan en cualquier reacción de transferencia de protones, puesto que si una base cede un protón ha de haber una base que lo acepte. Por eso las reacciones de transferencia de protones se les conoce con el nombre de reacciones ácido-base. uando un compuesto pierde un protón, la especie que se genera es su base conjugada. De la misma forma, cuando un compuesto acepta un protón, la especie generada es su ácido conjugado. -A 2 A 3 ácido base conjugada B 2 B base ácido conjugado uanto más fuerte es el ácido más débil será su base conjugada y viceversa. Se podría decir que la basicidad es una medida de la capacidad que posee un compuesto para compartir sus electrones con un protón. La fuerza de un ácido depende de la capacidad para donar protones. uando un ácido se disuelve en agua se disocia hasta alcanzar un equilibrio en el que coexisten especies iniciales (ácido) y finales (base conjugada). Este equilibrio viene definido por su constante K a que se denomina constante de disociación ácida. K a -A 2 A 3 ácido base conjugada K a = [ A ] [ 3 ] [A] La constante de acidez es una medida de la fuerza del ácido, de manera que cuanto mayor sea su valor más fuerte será el ácido (mayor facilidad para donar el protón). La acidez también se puede expresar como pk a, que se define como: pk a = -log K a
11 Ampliación de química 11 uanto menor sea el pk a mayor será la acidez del compuesto. Determinados compuestos orgánicos poseen características ácidas. Los más importantes son: o Los ácidos carboxílicos (R) con pk a del orden de 3 a 5. Estos compuestos son, al igual que el agua, anfotéricos y por tanto capaces de actuar como ácidos o como bases. o Los alcoholes, mucho menos ácidos que los ácidos carboxílicos, con valores de pk a alrededor de 16. Son también de anfóteros. o Los sales de amonio, ácidos conjugados de las aminas, tienen un valor de pk a entre 5-10, y son más ácidos que los alcoholes. Especies Valores pk a Ácidos carboxílicos Alrededor de 5 Aminas protonadas Alrededor de 10 Alcoholes Alrededor de 15 Un ácido carboxílico se puede disociar en agua para dar un protón y un ión carboxilato. Normalmente, los valores de la constante de acidez (K a ) de los ácidos carboxílicos simples son de alrededor de 10-5 (pk a =5). Por ejemplo, la constante de acidez del del ácido acético ( 3 ) es de (pk a =4.7). 3 ácido acético K a = anión acetato Aunque los ácidos carboxílicos no son tan ácidos como los ácidos minerales (l, 2 S 4, N 3 ) son mucho más ácidos que los alcoholes. Por ejemplo, el ácido acético es veces más ácido que los alcoholes más ácidos. De hecho, el ácido acético concentrado puede provocar quemaduras graves en contacto con la piel. Al igual que el protón del hidroxilo del agua, el protón del hidroxilo de un alcohol es débilmente ácido. Una base fuerte puede sustraer el protón del hidroxilo de un alcohol para generar un alcóxido.
12 12 Tema 5 R B R B alcohol (ácido) base alcóxido (base conjugada) La constante de disociación de un alcohol queda definida por el siguiente equilibrio: K a R 2 R 3 K a = R R 3 La constante de disociación ácida de los alcoholes varía según su estructura desde aproximadamente para el metanol hasta aproximadamente par la mayor parte de los alcoholes terciarios. La acidez de los alcoholes disminuye a medida que aumenta el grado de sustitución en el sustituyente alquilo. Variación de la acidez de los alcoholes con el grado de sustitución > > > 3 metanol etanol isopropanol t-butanol En la siguiente tabla se indican los valores de pk a, medidos en disolución acuosa, de los alcoholes anteriores. ompuesto Fórmula pk a Agua Metanol Etanol Isopropanol ( 3 ) t-butanol ( 3 ) Este orden de acidez en disolución se explica mediante el diferente grado de
13 Ampliación de química 13 solvatación de la base conjugada del alcohol, el ión alcóxido: la solvatación tiene un efecto estabilizante sobre el anión alcóxido y cuanto más solvatado esté más desplazado hacia la derecha estará el equilibrio ácido-base. El anión metóxido, la base conjugada del metanol, es relativamente pequeño y se rodea de un número relativamente elevado de moléculas de agua de solvatación. De esta forma la densidad electrónica asociada al átomo de oxígeno se reparte entre las moléculas de agua de solvatación y la especie se estabiliza: B S B S S S S S S S metanol ión metóxido (fácil de solvatar) El anión t-butóxido es mucho más voluminoso que el anión metóxido y la aproximación de las moléculas de agua del disolvente al átomo de oxígeno que transporta la carga negativa se ve muy impedida. S B S 3 B 3 3 S S S t-butanol ión t-butóxido (difícil de solvatar) En consecuencia, el anión t butóxido está menos solvatado que el anión metóxido; la carga negativa del anión t-butóxido solvatado está menos repartida que en el anión metóxido solvatado y por tanto el anión t-butóxido se estabiliza menos por solvatación. El equilibrio ácido-base del t-butanol se desplaza menos a la derecha que en el metanol y como consecuencia el t-butanol es un ácido más débil que el metanol.
14 14 Tema Efecto inductivo y fuerza ácida. Un sustituyente que estabilice al anión carboxilato aumenta la disociación y produce un ácido más fuerte. Los átomos electronegativos aumentan la fuerza de un ácido porque su efecto inductivo electrón-atrayente contribuye a deslocalizar la carga negativa del anión carboxilato. Este efecto inductivo puede ser muy grande si están presentes uno o más grupos electrón-atrayentes en el átomo de carbono α. Por ejemplo, el ácido cloroacético (l 2 ) tiene un pk a de 2.86, lo que indica que es un ácido más fuerte que el acético (pk a =4.74). El ácido dicloroacético (l 2 ) es todavía más fuerte, con un pk a de El ácido tricloroacético (l 3 ) tiene un pk a de 0.64, comparable en fuerza a algunos de los ácidos minerales. La magnitud del efecto de un sustituyente depende de su distancia al grupo carboxilo. Los sustituyentes electrón-atrayentes en el carbono α son los más eficaces a la hora de aumentar la fuerza de un ácido. Los sustituyentes más alejados tienen efectos mucho más pequeños sobre la acidez, lo que pone de manifiesto que los efectos inductivos decrecen rápidamente con la distancia. l l l l l l ácido acético pka = 4.74 ácido cloroacético pka = 2.86 ácido dicloroacético pka = 1.26 ácido tricloroacético pk a = 0.64 l l l ácido 2-clorobutanoico pka = 2.86 ácido 3-clorobutanoico pka = 4.05 ácido 4-clorobutanoico pk a = 4.52 El aumento de la acidez provocada por el efecto electrón-atrayente también se pone de manifiesto en los alcoholes. Por ejemplo, el 2,2,2,-trifluoroetanol (F 3 2, pk a =12.8) es mas de mil veces más ácido que el etanol (pk a = 15.9), porque el anión trifluroetóxido está más estabilizado que el etóxido debido al efecto atrayente sobre la carga negativa que ejercen los átomos de halógeno pk a = 15.9 F F pka = 12.8
15 Ampliación de química 15 En la siguiente tabla se comparan las constantes de disociación ácida de algunos alcoholes. Alcohol Estructura K a pk a Metanol x Etanol x loroetanol l x ,2,2-Trifluroetanol F x Isopropanol ( 3 ) x t-butanol ( 3 ) x iclohexanol x Fenol x comparación con otros ácidos Agua x Ácido acético x Ácido clorhídrico l 1.6 x Los alcóxidos metálicos derivados de metanol y etanol se suelen generar mediante la reacción del correspondiente alcohol con sodio metálico. R Na R Na 1/2 2 on estos dos alcoholes primarios, metanol y etanol, la reacción con el sodio metálico es relativamente rápida. Los alcoholes secundarios reaccionan más lentamente y con los alcoholes terciarios, como el t-butanol, la reacción con el sodio es muy lenta y por ello se emplea potasio, más reactivo que el sodio, para generar el anión t-butóxido. La reacción de alcoholes con hidruros metálicos, como Na o K, también permite transformar cuantitativamente a los alcoholes en los correspondientes alcóxidos: R Na TF R Na 2
16 16 Tema 5 La disociación de un ácido o un alcohol implica, en ambos casos, la ruptura heterolítica de un enlace -, pero cuando la disociación se produce sobre el ácido carboxílico se genera un anión carboxilato con la carga negativa repartida por igual sobre dos átomos de oxígeno, mientras que la ionización de un alcohol genera un anión alcóxido, en el que la carga negativa se encuentra casi en su totalidad sobre un sólo átomo de oxígeno. La deslocalización de la carga en el anión carboxilato hace que éste sea mucho más estable que un aniión alcóxido y por tanto, la disociación de un ácido carboxílico es menos endotérmica que la de un alcohol. R 2 R 3 pka= 16 alcohol alcóxido R 2 R R 3 pka= 5 ácido carboxílico ion carboxilato energía R - 3 R 2 R 2 R 1/2-3 1/2-
17 Ampliación de química Efectos estéricos y fuerza ácida. Los efectos estructurales que proceden de interacciones espaciales entre los grupos se denominan efectos estéricos. Los efectos estéricos también pueden jugar un papel importante en la acidez. El impedimento estérico a la solvatación, causado por el tamaño del ácido o del disolvente, puede inhibir la estabilización de la base conjugada por parte del disolvente y, en consecuencia, disminuir la acidez. Por ejemplo, el ácido benzoico es un ácido más fuerte que el ácido 2,6-di-t-butilbenzoico ya que en el primero el grupo ácido carboxílico está rodeado tan sólo de un anillo aromático y las moléculas de agua pueden solvatar sin dificultad al anión carboxilato que se forma, sin embargo, en el caso del ácido 2,6-di-t-butilbenzoico, los dos sustituyentes, que presentan un elevado volumen, se sitúan rodeando al grupo carboxílico por lo que una vez el ácido cede el protón y se forma el anión carboxilato, las moléculas de agua no pueden acercarse a dicho anión debido debido al impedimento estérico producido por los dos grupos t-butilos. Esta incapacidad del disolvente para rodear al anión hace que el proceso de solvatación no sea efectivo y por tanto, el anión estará menos estabilizado que en el caso del ácido benzoico donde este impedimento estérico no se produce. 2 K a = ácido benzoico anión benzoato pk a = Influencia de otros efectos sobre la fuerza ácida. El ácido o-hidroxibenzoico es unas 40 veces más ácido que el ácido p- hidroxibenzoico. Esto se explica por la estabilización adicional que consigue el anión o-hidroxibenzoato por formación de un puente de hidrógeno intramolecular. Este puente de hidrógeno no se puede formar en el anión p-hidroxibenzoato. omo esta anión está menos estabilizado, el equilibrio se desplaza menos hacia la derecha y el ácido p-hidroxibenzoico es menos fuerte que el ácido o-hidoxibenzoico,
18 18 Tema Basicidad en las moléculas orgánicas Tal y como se ha descrito en el apartado anterior Brönsted y Löwry definieron un una base como una sustancia capaz de aceptar protones. Según esta definición, cualquier compuesto con un par de electrones solitario puede actuar como una base. uando un compuesto acepta un protón, la especie generada es su ácido conjugado. La fuerza básica se puede medir por la constante de basicidad K b (o pk b = -logk b ) de manera que las sustancias que presenten constantes de basicidad elevadas (pk b pequeña) se comportan como bases fuertes y si tienen constantes de basicidad pequeñas (pk b grandes) se comportan como bases débiles. K b B 2 B base ácido conjugado K b = [ B ] [ ] [ B ] Las bases más usuales de la Química rgánica son las aminas. Una amina puede comportarse como una base de Lewis debido al par de electrones no enlazantes sobre el átomo de nitrógeno. Una amina puede actuar también como base de Bronsted-Lowry aceptando el protón de un ácido.
19 Ampliación de química 19 Reacción de una amina como base R N base X ácido prótico R N X ácido conjugado omo las aminas son bases fuertes, sus disoluciones acuosas son básicas. Una amina puede sustraer un protón del agua, formando un ión amonio y un ión hidroxilo. A la constante de equilibrio de esta reacción se le llama constante de basicidad de la amina y se representa por K b. R N 2 K b 2 R N 3 K b = R N 3 R N 2 Los valores de K b para la mayoría de las aminas son del orden de 10-3 y el equilibrio de la reacción de disociación se encuentra desplazado hacia la izquierda. A continuación, se muestra un diagrama de energía para la reacción de una amina con agua. N R amina N R ion amonio energía R-N 3 R-N 2 2
20 20 Tema Efecto inductivo y de solvatación en la fuerza básica. ualquier característica estructural que estabilice al ión amonio (en relación con la amina libre) desplaza la reacción hacia la derecha, haciendo que la amina sea una base más fuerte. Por el contrario, cualquier característica estructural que tienda a estabilizar a la amina libre (en relación con el ión amonio) desplaza la reacción hacia la izquierda, haciendo que la amina sea una base más débil. Las alquilaminas son bases más fuertes que el amoniaco. Por ejemplo la metilamina (amina primaria, pk b = 4.74) es más básica que el amoniaco (pk b = 3.36). N N pk b = N 3 N pk b =3.36 La diferencia de basicidad entre la metilamina y el amoníaco se explica por el efecto electrón-dador de los grupos alquilo. En el caso de la metilamina, el grupo metilo ayuda a estabilizar la carga positiva del nitrógeno, lo que provoca una disminución de la energía potencial del catión metilamonio y desplaza el equilibrio hacia la derecha. Siguiendo el anterior razonamiento, se debería esperar que las aminas secundarias fuesen bases más fuertes que las aminas primarias, y las aminas terciarias fuesen bases más fuertes que las aminas secundarias. La situación real es más complicada debido a la solvatación. omo los iones amonio tienen carga positiva, están fuertemente solvatados por el agua y la energía de solvatación contribuye a aumentar su estabilidad. Si el átomo de nitrógeno en el catión amonio presenta muchos grupos alquilo (caso de las aminas secundarias y terciarias) la solvatación se ve dificultada porque las moléculas de agua no se pueden acercar al átomo de nitrógeno que porta la carga positiva. Por tanto, los grupos alquilo sobre los átomos de nitrógeno en las aminas ejercen dos efectos contrapuestos: por una parte estabilizan al catión amonio por efecto inductivo electrón-dador, pero por otra desestabilizan al catión amonio al impedir una buena solvatación. omo resultado de todo ello, las aminas primarias, secundarias y terciarias muestran valores semejantes de basicidad.
21 Ampliación de química 21 En fase gaseosa no puede actuar el efecto de solvatación del catión amonio y en este caso el efecto inductivo electrón-dador hace que una amina terciaria sea más básica que una amina secundaria y ésta más básica que una amina primaria Efecto resonante y fuerza básica. Las aminas aromáticas son bases mucho más débiles que las aminas alifáticas. Esta disminución de la basicidad se debe a la deslocalización por resonancia de los electrones no enlazantes de la amina. En la anilina el par aislado de electrones no enlazantes en el nitrógeno está deslocalizado sobre el sistema π del anillo aromático. Este solapamiento es imposible en el ión anilinio y por ello el reactivo está estabilizado en comparación con el producto. La reacción está desplazada hacia la izquierda y la anilina no es tan básica como las aminas alifáticas. N N anilina esabilizada por resonancia ión anilinio N 3 RN 3 estabilización por solapamiento RN 2 reacción más endotérmica (anilina menos básica) N 2
22 22 Tema 5 Los efectos de hibridación también juegan un papel en la basicidad de las aminas. Por ejemplo, la piridina es una base más débil que las aminas alifáticas, como la piperidina. En la piridina, el par de electrones no enlazantes ocupan un orbital con hibridación sp 2 y en la piperidina ocupan un orbital con hibridación sp 3. uanto mayor es el carácter s de un orbital mayor es la atracción que ejerce el núcleo sobre los electrones. En la piridina, el par electrónico solitario está en un orbital con más carácter s que el orbital que ocupa el par de electrones solitarios de la piperidina y por tanto los electrones están menos disponibles para unirse al protón. hibrido sp2 N N hibrido sp3 piridina pk b = 8.75 piperidina pk b = 2.88
TEMA 5 ESTRUCTURA Y PROPIEDADES MOLECULARES
 TEMA 5 ETRUCTURA Y PRPIEDADE MLECULARE 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la estructura
TEMA 5 ETRUCTURA Y PRPIEDADE MLECULARE 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la estructura
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
Capitulo 8 Fuerzas intermoleculares.
 Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Fuerzas de Van der Waals. Momento Dipolar
 Momento Dipolar Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad,
Momento Dipolar Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad,
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
TRABAJO PRÁCTICO: MODELOS EXTREMOS DE SUSTANCIA
 1 Complemento TRABAJO PRÁCTICO: S EXTREMOS DE SUSTANCIA FUNDAMENTOS TEÓRICOS BÁSICOS Todas las sustancias pueden considerarse formadas por un conjunto de unidades estructurales o fundamentales. La clase
1 Complemento TRABAJO PRÁCTICO: S EXTREMOS DE SUSTANCIA FUNDAMENTOS TEÓRICOS BÁSICOS Todas las sustancias pueden considerarse formadas por un conjunto de unidades estructurales o fundamentales. La clase
El H solo necesita 2 electrones en su capa de valencia como el He.
 Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
La Absorción del Agua
 La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva 4, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva 4, Ejercicio, Opción B
De cualquier manera, solo estudiaremos en esta unidad los compuestos inorgánicos.
 Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
El agua como disolvente
 hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES 2. - REACCIONES ENTRE LOS ACIDOS Y LAS BASES CH 3 COOH + NH 3 CH 3 COO - + NH 4 H 2 O OH - + H +
 1 1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES Se define un ácido como cualquier ión o molécula capaz de ceder protones. Por lo contrario, una base es cualquier ión o molécula capaz de fijar protones.
1 1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES Se define un ácido como cualquier ión o molécula capaz de ceder protones. Por lo contrario, una base es cualquier ión o molécula capaz de fijar protones.
ESTRUCTURA DE LA MATERIA QCA 09 ANDALUCÍA
 1.- Considere el elemento cuya configuración electrónica es 1s 2 2s 2 2p 6 3s 2 3p 4. a) De qué elemento se trata? b) Justifique el periodo y el grupo del sistema periódico a los que pertenece. c) Cuál
1.- Considere el elemento cuya configuración electrónica es 1s 2 2s 2 2p 6 3s 2 3p 4. a) De qué elemento se trata? b) Justifique el periodo y el grupo del sistema periódico a los que pertenece. c) Cuál
Biopolímero s (4831)
 Biopolímero s (4831) 2.2. Interacciones electrostáticas Las interacciones que se presentan entre iones, dipolos permanentes o inducidos, cuadrupolos permanentes o inducidos, etc. reciben el nombre de interacciones
Biopolímero s (4831) 2.2. Interacciones electrostáticas Las interacciones que se presentan entre iones, dipolos permanentes o inducidos, cuadrupolos permanentes o inducidos, etc. reciben el nombre de interacciones
1.- Reactividad de los compuestos orgánicos: Aspectos cinéticos y termodinámicos
 2ª Parte: Estructura y reactividad de los compuestos orgánicos. 1.- Reactividad de los compuestos orgánicos: Aspectos cinéticos y termodinámicos - Mecanismos de reacción. Principales tipos de reacciones
2ª Parte: Estructura y reactividad de los compuestos orgánicos. 1.- Reactividad de los compuestos orgánicos: Aspectos cinéticos y termodinámicos - Mecanismos de reacción. Principales tipos de reacciones
JULIO 2012. FASE ESPECÍFICA. QUÍMICA.
 JULIO 2012. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Se añaden 10 mg de carbonato de estroncio sólido, SrCO 3 (s), a 2 L de agua pura. Calcule la cantidad de SrCO 3 (s) que queda sin disolver.
JULIO 2012. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Se añaden 10 mg de carbonato de estroncio sólido, SrCO 3 (s), a 2 L de agua pura. Calcule la cantidad de SrCO 3 (s) que queda sin disolver.
www.fisicaeingenieria.es CARACTERÍSTICAS DE LOS ÁCIDOS Y LAS BASES
 CARACTERÍSTICAS DE LOS ÁCIDOS Y LAS BASES ÁCIDOS 1. Tienen sabor ácido como en el caso del ácido cítrico en la naranja. 2. Cambian el color del papel tornasol a rosado. 3. Son corrosivos. 4. Producen quemaduras
CARACTERÍSTICAS DE LOS ÁCIDOS Y LAS BASES ÁCIDOS 1. Tienen sabor ácido como en el caso del ácido cítrico en la naranja. 2. Cambian el color del papel tornasol a rosado. 3. Son corrosivos. 4. Producen quemaduras
Cómo se unen los átomos
 Nivel: 2.º Medio Subsector: Ciencias químicas Unidad temática: Los cuerpos presentan aspectos y propiedades diferentes según el tipo de átomos que los componen y según la forma en que estos se unen. Pensemos
Nivel: 2.º Medio Subsector: Ciencias químicas Unidad temática: Los cuerpos presentan aspectos y propiedades diferentes según el tipo de átomos que los componen y según la forma en que estos se unen. Pensemos
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES Lic. Lidia Iñigo Las fuerzas intermoleculares, como su nombre lo indica, son las fuerzas que unen moléculas. Ya deberías saber que no todas las sustancias forman moléculas. Existen
FUERZAS INTERMOLECULARES Lic. Lidia Iñigo Las fuerzas intermoleculares, como su nombre lo indica, son las fuerzas que unen moléculas. Ya deberías saber que no todas las sustancias forman moléculas. Existen
EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller
 2010 Reacciones de intercambio de Protones EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores Mª Teresa Gómez Ruiz IES Politécnico Cartagena.
2010 Reacciones de intercambio de Protones EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores Mª Teresa Gómez Ruiz IES Politécnico Cartagena.
Estudio de la evaporación
 Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
El agua. El agua. Se pueden ver muy bien los 4 puentes de hidrógeno que forma la molécula de agua central.
 El agua El agua es una de las sustancias más peculiares conocidas. Es una molécula pequeña y sencilla, pero tras su aparente simplicidad presenta una complejidad sorprendente que la hace especialmente
El agua El agua es una de las sustancias más peculiares conocidas. Es una molécula pequeña y sencilla, pero tras su aparente simplicidad presenta una complejidad sorprendente que la hace especialmente
Teoría de repulsión de pares electrónicos de la capa de Valencia
 Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO)
 TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO) Existen 2 clases de electrización, la positiva (que se representa con + ), y la negativa (que se representa con - ). Hay una partícula
TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO) Existen 2 clases de electrización, la positiva (que se representa con + ), y la negativa (que se representa con - ). Hay una partícula
PRUEBA ESPECÍFICA PRUEBA 201
 PRUEBA DE ACCES A LA UNIVERSIDAD MAYRES DE 5 AÑS PRUEBA ESPECÍFICA PRUEBA 01 PRUEBA SLUCINARI HAUTAPRBAK 5 URTETIK 014ko MAIATZA DE 5 AÑS MAY 014 Aclaraciones previas Tiempo de duración de la prueba: 1
PRUEBA DE ACCES A LA UNIVERSIDAD MAYRES DE 5 AÑS PRUEBA ESPECÍFICA PRUEBA 01 PRUEBA SLUCINARI HAUTAPRBAK 5 URTETIK 014ko MAIATZA DE 5 AÑS MAY 014 Aclaraciones previas Tiempo de duración de la prueba: 1
MOLÉCULAS Y FUERZAS INTERMOLECULARES
 4 MLÉULAS Y UERZAS TERMLEULARES SLUES A LAS ATVDADES DE AL DE UDAD Método RPEV e hibridación 1 Las nubes electrónicas que se dibujan en torno al átomo central en el método RPEV, son una representación
4 MLÉULAS Y UERZAS TERMLEULARES SLUES A LAS ATVDADES DE AL DE UDAD Método RPEV e hibridación 1 Las nubes electrónicas que se dibujan en torno al átomo central en el método RPEV, son una representación
Tema 7: Solubilidad. (Fundamentos de Química, Grado en Física) Equilibrio químico Enero Mayo, 2011 1 / 24
 Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
3.1. ÁCIDOS Y BASES. HA (ac) H + (ac) + A - (ac)
 3.1. ÁCIDOS Y BASES Según la teoría de Arrhenius, ácido es toda sustancia capaz de dar iones hidrógeno (H ) como uno de sus productos iónicos de disociación en agua : HA H A - El ion H, denominado protón
3.1. ÁCIDOS Y BASES Según la teoría de Arrhenius, ácido es toda sustancia capaz de dar iones hidrógeno (H ) como uno de sus productos iónicos de disociación en agua : HA H A - El ion H, denominado protón
Informe del trabajo práctico nº7
 Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
Informe del trabajo práctico nº7 Profesora : Lic. Graciela. Lic. Mariana. Alumnas: Romina. María Luján. Graciela. Mariana. Curso: Química orgánica 63.14 turno 1 OBJETIVOS Mostrar las propiedades que presentan
FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
 INTRODUCCIÓN AL ESTUDIO DE LA FISIOLOGÍA La Fisiología General es una parte de las Ciencias Fisiológicas encargada de estudiar las bases de funcionamiento de los seres vivos. Apoyándose en las leyes y
INTRODUCCIÓN AL ESTUDIO DE LA FISIOLOGÍA La Fisiología General es una parte de las Ciencias Fisiológicas encargada de estudiar las bases de funcionamiento de los seres vivos. Apoyándose en las leyes y
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
Soluciones Electrolíticas María de la Luz Velázquez Monroy & Miguel Ángel Ordorica Vargas
 Introducción Soluciones Electrolíticas María de la Luz Velázquez Monroy & Miguel Ángel Ordorica Vargas Siguiendo los trabajos de Humphrey Davy, sobre electrolisis de metales, en 1834, Michael Faraday inició
Introducción Soluciones Electrolíticas María de la Luz Velázquez Monroy & Miguel Ángel Ordorica Vargas Siguiendo los trabajos de Humphrey Davy, sobre electrolisis de metales, en 1834, Michael Faraday inició
ESTADO LÍQUIDO 26/05/2011. Características. Dependen de la naturaleza y fuerza de las partículas que los constituyen
 ESTADO LÍQUIDO Dependen de la naturaleza y fuerza de las partículas que los constituyen Características Tienen densidades mayores que los gases Volumen definido sin forma propia Son poco compresibles Fluyen
ESTADO LÍQUIDO Dependen de la naturaleza y fuerza de las partículas que los constituyen Características Tienen densidades mayores que los gases Volumen definido sin forma propia Son poco compresibles Fluyen
Dar a conocer la capacidad de disolución del agua frente a otras sustancias.
 MINISTERIO DE EDUCACION Actividad 1: Agua en la vida II. Laboratorio: Solubilidad del agua 1. Tema: AGUA DISOLVENTE UNIVERSAL 2. Objetivo: Dar a conocer la capacidad de disolución del agua frente a otras
MINISTERIO DE EDUCACION Actividad 1: Agua en la vida II. Laboratorio: Solubilidad del agua 1. Tema: AGUA DISOLVENTE UNIVERSAL 2. Objetivo: Dar a conocer la capacidad de disolución del agua frente a otras
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO
 ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
Química orgánica. Cuarto Medio 25/06
 Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
ÁCIDO BASE QCA 04 ANDALUCÍA
 ÁCIDO BASE QCA 4 ANDAUCÍA 1.- Un ácido monoprótico, HA, en disolución acuosa de concentración, se encuentra ionizado en un 5 %. Calcule: a) El ph de la disolución. b) a constante de ionización del ácido..-
ÁCIDO BASE QCA 4 ANDAUCÍA 1.- Un ácido monoprótico, HA, en disolución acuosa de concentración, se encuentra ionizado en un 5 %. Calcule: a) El ph de la disolución. b) a constante de ionización del ácido..-
EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE
 Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
a) Igualamos las unidades de los dos miembros de la ecuación:
 1 PAU Química. Junio 2010. Fase específica OPCIÓN A Cuestión 1A. Una reacción química del tipo A (g) B (g) + C (g) tiene a 25 C una constante cinética k = 5 l0 12 L mol 1 s 1. Conteste razonadamente a
1 PAU Química. Junio 2010. Fase específica OPCIÓN A Cuestión 1A. Una reacción química del tipo A (g) B (g) + C (g) tiene a 25 C una constante cinética k = 5 l0 12 L mol 1 s 1. Conteste razonadamente a
OTRAS REACCIONES DE LOS ALCOHOLES
 OTRAS REACCIONES DE LOS ALCOHOLES Reacciones Típicas de los Alcoholes La figura muestra cuatro modos típicos de reaccionar de los alcoholes. En cada uno de ellos, se rompe uno ómásde los cuatro enlaces
OTRAS REACCIONES DE LOS ALCOHOLES Reacciones Típicas de los Alcoholes La figura muestra cuatro modos típicos de reaccionar de los alcoholes. En cada uno de ellos, se rompe uno ómásde los cuatro enlaces
Ablandamiento de agua mediante el uso de resinas de intercambio iónico.
 Ablandamiento de agua por intercambio iónica página 1 Ablandamiento de agua mediante el uso de resinas de intercambio iónico. (Fuentes varias) Algunos conceptos previos: sales, iones y solubilidad. Que
Ablandamiento de agua por intercambio iónica página 1 Ablandamiento de agua mediante el uso de resinas de intercambio iónico. (Fuentes varias) Algunos conceptos previos: sales, iones y solubilidad. Que
FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
 EL AGUA: VOLÚMENES Y COMPOSICIÓN DE LOS LÍQUIDOS CORPORALES La vida comenzó en el agua del mar, y las condiciones que reinaban en aquel ambiente primigenio marcaron las características químicas de la materia
EL AGUA: VOLÚMENES Y COMPOSICIÓN DE LOS LÍQUIDOS CORPORALES La vida comenzó en el agua del mar, y las condiciones que reinaban en aquel ambiente primigenio marcaron las características químicas de la materia
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Agua. Agua. Estructura del agua. Estructura del agua. Estructura del agua. Dra. Edith Ponce A. enlace covalente polar (100 kcal/mol).
 Agua Agua Dra. Edith Ponce A. Es la sustancia más abundante en la biosfera la encontramos en sus tres estados comprende del 65 y el 95% del peso de la mayor parte de las formas vivas Sus propiedades físicas
Agua Agua Dra. Edith Ponce A. Es la sustancia más abundante en la biosfera la encontramos en sus tres estados comprende del 65 y el 95% del peso de la mayor parte de las formas vivas Sus propiedades físicas
Solubilidad. y se representa por.
 Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
TRABAJO DE RECUPERACIÓN DEL PRIMER PARCIAL 2012-2013
 TRABAJO DE RECUPERACIÓN DEL PRIMER PARCIAL 2012-2013 ÁREA: QUÍMICA CURSO: SEGUNDO DE BACHILLERATO NOMBRE: FECHA DE ENTREGA: Jueves, 22-11-2012 INDICACIONES GENERALES: El trabajo deberá ser entregado a
TRABAJO DE RECUPERACIÓN DEL PRIMER PARCIAL 2012-2013 ÁREA: QUÍMICA CURSO: SEGUNDO DE BACHILLERATO NOMBRE: FECHA DE ENTREGA: Jueves, 22-11-2012 INDICACIONES GENERALES: El trabajo deberá ser entregado a
04/11/2013 ALCOHOLES Y FENOLES
 ALCOHOLES Y FENOLES Pueden ser considerados como derivados del agua. Tienen en común, la presencia del grupo funcional OH, conocido como grupo hidroxilo ú oxhídrilo. ALCOHOLES: grupo OH-unido a radical
ALCOHOLES Y FENOLES Pueden ser considerados como derivados del agua. Tienen en común, la presencia del grupo funcional OH, conocido como grupo hidroxilo ú oxhídrilo. ALCOHOLES: grupo OH-unido a radical
Propiedades Físicas y Químicas de los Herbicidas. Lectura 2
 Físicas y Químicas de los Herbicidas Lectura 2 Conceptos Básicos Química orgánica ciencia que estudia los compuestos a base de Carbono (número atómico 6 en la Tabla Periódica) Compuestos orgánicos pueden
Físicas y Químicas de los Herbicidas Lectura 2 Conceptos Básicos Química orgánica ciencia que estudia los compuestos a base de Carbono (número atómico 6 en la Tabla Periódica) Compuestos orgánicos pueden
TEMA 5: INTROD. AL ESTADO SÓLIDO
 ESTADO SÓLIDO Figuras p1143 y p1146, Tipler 5ª Ed SEMICONDUCTORES Figuras p1141 y p1160, Tipler 5ª Ed DISPOSITIVOS http://axxon.com.ar/zap/c-zapping0127.htm Enlace químico: fuerza que mantiene unidos los
ESTADO SÓLIDO Figuras p1143 y p1146, Tipler 5ª Ed SEMICONDUCTORES Figuras p1141 y p1160, Tipler 5ª Ed DISPOSITIVOS http://axxon.com.ar/zap/c-zapping0127.htm Enlace químico: fuerza que mantiene unidos los
La electrólisis CONTENIDOS. Electrolitos. Iones. Carga eléctrica negativa. www.codelcoeduca.cl
 La electrólisis Las moléculas de ciertos compuestos químicos, cuando se encuentran en disolución acuosa, presentan la capacidad de separarse en sus estructuras moleculares más simples y/o en sus átomos
La electrólisis Las moléculas de ciertos compuestos químicos, cuando se encuentran en disolución acuosa, presentan la capacidad de separarse en sus estructuras moleculares más simples y/o en sus átomos
o 0.96A o 1.43A 0.96A O O H CH 3 H
 Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA
 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA PROGRAMA DE INGENIERIA DE ALIMENTOS 211612 TRANSFERENCIA DE MASA ACTIVIDAD 11 RECONOCIMIENTO UNIDAD 3 BOGOTA D.C. Extracción líquido - líquido La extracción líquido-líquido,
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA PROGRAMA DE INGENIERIA DE ALIMENTOS 211612 TRANSFERENCIA DE MASA ACTIVIDAD 11 RECONOCIMIENTO UNIDAD 3 BOGOTA D.C. Extracción líquido - líquido La extracción líquido-líquido,
Que es el agua? (+) (-) (104.5º) (+)
 Que es el agua? Cada molécula de oxigeno tiene 6 electrones en el último orbital, mientras que el hidrogeno tiene uno, para cumplir con la ley del octeto se necesitan dos átomos de hidrogeno para estabilizar
Que es el agua? Cada molécula de oxigeno tiene 6 electrones en el último orbital, mientras que el hidrogeno tiene uno, para cumplir con la ley del octeto se necesitan dos átomos de hidrogeno para estabilizar
Conductividad en disoluciones electrolíticas.
 Conductividad en disoluciones electrolíticas. 1.- Introducción 2.- Conductores 3.- Definición de magnitudes 3.1- Conductividad específica 3.2 Conductividad molar " 4. Variación de la conductividad (, ")
Conductividad en disoluciones electrolíticas. 1.- Introducción 2.- Conductores 3.- Definición de magnitudes 3.1- Conductividad específica 3.2 Conductividad molar " 4. Variación de la conductividad (, ")
Tema 2. El agua, el ph y los equilibrios iónicos
 Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
CARACTERÍSTICAS DE LA MATERIA
 LA MATERIA CARACTERÍSTICAS DE LA MATERIA - Todo lo que existe en el universo está compuesto de Materia. - La Materia se clasifica en Mezclas y Sustancias Puras. - Las Mezclas son combinaciones de sustancias
LA MATERIA CARACTERÍSTICAS DE LA MATERIA - Todo lo que existe en el universo está compuesto de Materia. - La Materia se clasifica en Mezclas y Sustancias Puras. - Las Mezclas son combinaciones de sustancias
IV.. ENLACES QUÍMICOS
 IV.. ENLACES QUÍMICOS OBJETIVO.- Identificar los tipos de enlace en la formación de moléculas relacionándolos con sus propiedades y las fuerzas que las unen. 1. CONCEPTO DE ENLACE QUÍMICO Los enlaces químicos,
IV.. ENLACES QUÍMICOS OBJETIVO.- Identificar los tipos de enlace en la formación de moléculas relacionándolos con sus propiedades y las fuerzas que las unen. 1. CONCEPTO DE ENLACE QUÍMICO Los enlaces químicos,
CAPÍTULO 20 ESPECTROMETRÍA DE MASAS. Rosamil Rey, Ph.D. CHEM 4160
 CAPÍTULO 20 ESPECTROMETRÍA DE MASAS Rosamil Rey, Ph.D. CHEM 4160 INTRODUCCIÓN La espectrometría de masas no es una espectroscopia de absorción como IR, RMN y UV. Es el registro gráfico que sufre una molécula
CAPÍTULO 20 ESPECTROMETRÍA DE MASAS Rosamil Rey, Ph.D. CHEM 4160 INTRODUCCIÓN La espectrometría de masas no es una espectroscopia de absorción como IR, RMN y UV. Es el registro gráfico que sufre una molécula
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
CÁTEDRA: QUIMICA GUIA DE PROBLEMAS Nº 10
 CÁTEDRA: QUIMICA GUIA DE PROBLEMAS Nº 10 TEMA: ph, NEUTRALIZACIÓN Y EQUILIBRIO ÁCIDO BASE OBJETIVOS: Clasificar ácidos y bases de acuerdo al potencial de hidrógeno. PRERREQUISITOS: Tener conocimiento de
CÁTEDRA: QUIMICA GUIA DE PROBLEMAS Nº 10 TEMA: ph, NEUTRALIZACIÓN Y EQUILIBRIO ÁCIDO BASE OBJETIVOS: Clasificar ácidos y bases de acuerdo al potencial de hidrógeno. PRERREQUISITOS: Tener conocimiento de
Hidrosfera. 1) En las aguas epicontinentales se incluyen el mar Caspio, el Aral y el mar Muerto, además de lagos, ríos, etc.
 Hidrosfera Formación Cuando la Tierra se fue formando, hace unos 4600 millones de años, las altas temperaturas hacían que toda el agua estuviera en forma de vapor. Al enfriarse por debajo del punto de
Hidrosfera Formación Cuando la Tierra se fue formando, hace unos 4600 millones de años, las altas temperaturas hacían que toda el agua estuviera en forma de vapor. Al enfriarse por debajo del punto de
INTRODUCCIÓN AL ENLACE IÓNICO
 INTRODUCCIÓN AL ENLACE IÓNICO AUTORIA SILVIA GARCÍA SEPÚLVEDA TEMÁTICA FÍSICA Y QUÍMICA ETAPA BACHILLERATO Resumen A continuación voy a pasar a describir como se lleva a cabo el estudio del enlace químico,
INTRODUCCIÓN AL ENLACE IÓNICO AUTORIA SILVIA GARCÍA SEPÚLVEDA TEMÁTICA FÍSICA Y QUÍMICA ETAPA BACHILLERATO Resumen A continuación voy a pasar a describir como se lleva a cabo el estudio del enlace químico,
Acidez y Basicidad 16/10/2015. Dra. Ana M. Bruno 2015
 Acidez y Basicidad Dra. Ana M. Bruno 2015 Teorías ácido-base 1777 Lavoisier El oxígeno es el elemento presente en los ácidos (oxígeno en griego significa formador de ácidos ). 1810 Lavy El elemento común
Acidez y Basicidad Dra. Ana M. Bruno 2015 Teorías ácido-base 1777 Lavoisier El oxígeno es el elemento presente en los ácidos (oxígeno en griego significa formador de ácidos ). 1810 Lavy El elemento común
PRINCIPIOS TEÓRICOS ENLACE QUÍMICO TIPOS DE ENLACES
 TABLA DE CONTENIDOS Carátula 1 Tabla de Contenidos 3 Introducción 4 Objetivos 5 Principios Teóricos 6 6 Tipos de Enlaces 6 Enlace Iónico 7 Estructuras de los compuestos iónicos 8 Enlace Covalente 11 Enlace
TABLA DE CONTENIDOS Carátula 1 Tabla de Contenidos 3 Introducción 4 Objetivos 5 Principios Teóricos 6 6 Tipos de Enlaces 6 Enlace Iónico 7 Estructuras de los compuestos iónicos 8 Enlace Covalente 11 Enlace
El Agua. 2H2O(l) 2H2 (g) +O2 (g) Puentes de hidrogeno
 El Agua. El agua es un compuesto covalente, formado por Hidrógeno y Oxígeno (H 2 O).Puesto que el Oxígeno es mas covalente que el Hidrógeno, el enlace O-H es covalente polar. La electrolisis (aplicación
El Agua. El agua es un compuesto covalente, formado por Hidrógeno y Oxígeno (H 2 O).Puesto que el Oxígeno es mas covalente que el Hidrógeno, el enlace O-H es covalente polar. La electrolisis (aplicación
10.8. Balances de carga y materia
 10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
4º E.S.O. Colegio San Agustín Sevilla TEMA 1: EL AGUA
 1.1. INTRODUCCIÓN 4º E.S.O. Colegio San Agustín Sevilla TEMA 1: EL AGUA El agua es una materia básica para la vida y está presente en la mayoría de los procesos físicos y químicos que se desarrollan a
1.1. INTRODUCCIÓN 4º E.S.O. Colegio San Agustín Sevilla TEMA 1: EL AGUA El agua es una materia básica para la vida y está presente en la mayoría de los procesos físicos y químicos que se desarrollan a
Lecturas previas a las clases del 14 y 20 de diciembre (Tema 20)
 Lecturas previas a las clases del 14 y 20 de diciembre (Tema 20) La lectura de los epígrafes que se indican y del resumen que sigue es indispensable para las clases magistrales del 14 y 20 de diciembre
Lecturas previas a las clases del 14 y 20 de diciembre (Tema 20) La lectura de los epígrafes que se indican y del resumen que sigue es indispensable para las clases magistrales del 14 y 20 de diciembre
TEMA 1 CONCEPTOS FUNDAMENTALES EN QUIMICA ORGANICA
 TEMA 1 EPTS FUDAMETALES E QUIMIA RGAIA 1. oncepto y origen de la Química rgánica. 2. Evolución histórica de la Química rgánica. 3. Representación de Lewis de las moléculas orgánicas. 4. Electronegatividad
TEMA 1 EPTS FUDAMETALES E QUIMIA RGAIA 1. oncepto y origen de la Química rgánica. 2. Evolución histórica de la Química rgánica. 3. Representación de Lewis de las moléculas orgánicas. 4. Electronegatividad
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS ORBITALES ATÓMICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS Integrantes: Walter Bermúdez Lizbeth Sánchez Curso: Jueves 10:00 a 12:00 ORBITALES ATÓMICOS 1.- Definición de
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS Integrantes: Walter Bermúdez Lizbeth Sánchez Curso: Jueves 10:00 a 12:00 ORBITALES ATÓMICOS 1.- Definición de
b) Para el último electrón del átomo de magnesio, los números cuánticos posibles son: n = 3; l = 1 ±.
 PRUEBA GENERAL OPCIÓN A CUESTIÓN 1.- Considerando el elemento alcalinotérreo del tercer período y el segundo elemento del grupo de los halógenos: a) Escribe sus configuraciones electrónicas. b) Escribe
PRUEBA GENERAL OPCIÓN A CUESTIÓN 1.- Considerando el elemento alcalinotérreo del tercer período y el segundo elemento del grupo de los halógenos: a) Escribe sus configuraciones electrónicas. b) Escribe
PRÁCTICA 7: EQUILIBRIO ÁCIDO-BASE
 PRÁCTICA 7: EQUILIBRIO ÁCIDO-BASE FUNDAMENTOS Concepto de ácido y base Los ácidos y las bases constituyen una clase de compuestos químicos de gran interés. El concepto de ácido y base ha evolucionado a
PRÁCTICA 7: EQUILIBRIO ÁCIDO-BASE FUNDAMENTOS Concepto de ácido y base Los ácidos y las bases constituyen una clase de compuestos químicos de gran interés. El concepto de ácido y base ha evolucionado a
2/17/2013. La fuerza que mantiene unidos a los átomos de unamolécula. Es una fuerza química o intramolecular.
 FUERZAS INTERMOLECULARES Comparación molecular de gases, líquidos y sólidos Viscosidad y tensión superficial Cambios de fase Volatilidad, presión de vapor y punto de ebullición Fuerzas intramoleculares
FUERZAS INTERMOLECULARES Comparación molecular de gases, líquidos y sólidos Viscosidad y tensión superficial Cambios de fase Volatilidad, presión de vapor y punto de ebullición Fuerzas intramoleculares
Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base. Disoluciones reguladoras del ph
 Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base IES La Magdalena. Avilés. Asturias Disoluciones reguladoras del ph Si añadimos una pequeña cantidad de ácido o base a agua pura, el
Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base IES La Magdalena. Avilés. Asturias Disoluciones reguladoras del ph Si añadimos una pequeña cantidad de ácido o base a agua pura, el
QUÍMICA. AgNO 3 (ac) Ag + (ac) + NO 3 - (ac) (0,25 puntos) 0,1 M 0,1 M 0,1 M. (0,25 puntos)
 OPCIÓN A QUÍMICA 1. (2,5 puntos) Se analiza una muestra de 10 ml de una disolución acuosa que contiene ión cloruro, Cl -, mediante la adición de una gota (0,2 ml) de disolución acuosa de nitrato de plata,
OPCIÓN A QUÍMICA 1. (2,5 puntos) Se analiza una muestra de 10 ml de una disolución acuosa que contiene ión cloruro, Cl -, mediante la adición de una gota (0,2 ml) de disolución acuosa de nitrato de plata,
ESTADOS DE AGREGACIÓN DE LA MATERIA
 ESADOS DE AGREGACIÓN DE LA MAERIA. Propiedades generales de la materia La materia es todo aquello que tiene masa y volumen. La masa se define como la cantidad de materia de un cuerpo. Se mide en kg. El
ESADOS DE AGREGACIÓN DE LA MAERIA. Propiedades generales de la materia La materia es todo aquello que tiene masa y volumen. La masa se define como la cantidad de materia de un cuerpo. Se mide en kg. El
TEMA 11. MÉTODOS FÍSICOS DE SEPARACIÓN Y PURIFICACIÓN
 TEMA 11. MÉTODOS FÍSICOS DE SEPARACIÓN Y PURIFICACIÓN 1. Destilación 2. Extracción 3. Sublimación 4. Cristalización 5. Cromatografía 6. Fórmulas empíricas y moleculares 2 Tema 11 TEMA 11. Métodos físicos
TEMA 11. MÉTODOS FÍSICOS DE SEPARACIÓN Y PURIFICACIÓN 1. Destilación 2. Extracción 3. Sublimación 4. Cristalización 5. Cromatografía 6. Fórmulas empíricas y moleculares 2 Tema 11 TEMA 11. Métodos físicos
III. ESTADOS DE LA MATERIA
 III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO
 LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO 1. Trabajo mecánico y energía. El trabajo, tal y como se define físicamente, es una magnitud diferente de lo que se entiende sensorialmente por trabajo. Trabajo
LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO 1. Trabajo mecánico y energía. El trabajo, tal y como se define físicamente, es una magnitud diferente de lo que se entiende sensorialmente por trabajo. Trabajo
TEMA 1 ESTRUCTURA Y PROPIEDADES
 TEMA 1 ESTRUCTURA Y PROPIEDADES 1. Introducción. 2. Estructura de los átomos. 3. Enlaces y moléculas. 4. Polaridad de los enlaces y las moléculas 5. Fuerzas intermoleculares. 6. Efectos estructurales.
TEMA 1 ESTRUCTURA Y PROPIEDADES 1. Introducción. 2. Estructura de los átomos. 3. Enlaces y moléculas. 4. Polaridad de los enlaces y las moléculas 5. Fuerzas intermoleculares. 6. Efectos estructurales.
La geometría molecular viene dada por la distribución de los átomos periféricos unidos al átomo central.
 Estructuras moleculares: Modelo VSPR (RPECV) Las estructuras de Lewis son útiles para establecer la distribución de los pares electrónicos en las moléculas pero no aportan nada sobre su previsible geometría.
Estructuras moleculares: Modelo VSPR (RPECV) Las estructuras de Lewis son útiles para establecer la distribución de los pares electrónicos en las moléculas pero no aportan nada sobre su previsible geometría.
2.2- FENOLES. Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH.
 2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
Estructura y propiedades físicas
 Estructura y propiedades físicas Fuerzas intermoleculares: Fuerzas de Van der Waals, atracción dipolo-dipolo, puente Hidrógeno. Punto de ebullición. Punto de fusión. Solubilidad. Solvatación de iones y
Estructura y propiedades físicas Fuerzas intermoleculares: Fuerzas de Van der Waals, atracción dipolo-dipolo, puente Hidrógeno. Punto de ebullición. Punto de fusión. Solubilidad. Solvatación de iones y
ESTADOS DE LA MATERIA
 ESTADOS DE LA MATERIA Los diferentes estados en que podemos encontrar la materia se denominan estados de agregación de la materia. Las distintas formas en que la materia se "agrega", como un conjunto de
ESTADOS DE LA MATERIA Los diferentes estados en que podemos encontrar la materia se denominan estados de agregación de la materia. Las distintas formas en que la materia se "agrega", como un conjunto de
ELECTROQUÍMICA. químicas que se producen por acción de una corriente eléctrica.
 ELECTROQUÍMICA La electroquímica estudia los cambios químicos que producen una corriente eléctrica y la generación de electricidad mediante reacciones químicas. Es por ello, que el campo de la electroquímica
ELECTROQUÍMICA La electroquímica estudia los cambios químicos que producen una corriente eléctrica y la generación de electricidad mediante reacciones químicas. Es por ello, que el campo de la electroquímica
Capítulo 9. Estados de agregación de la materia
 Capítulo 9. Estados de agregación de la materia Objetivos: Establecer las características químico-físicas de gases, líquidos y sólidos. Establecer la ecuación de estado de los gases ideales y describir
Capítulo 9. Estados de agregación de la materia Objetivos: Establecer las características químico-físicas de gases, líquidos y sólidos. Establecer la ecuación de estado de los gases ideales y describir
Propiedades periódicas
 Propiedades periódicas 1.-Radio atómico 2.-Radio iónico 3.-Potencial de ionización. 4.-Afinidad electrónica 5.-Electronegatividad y carácter metálico. El estudio de la materia y de sus propiedades en el
Propiedades periódicas 1.-Radio atómico 2.-Radio iónico 3.-Potencial de ionización. 4.-Afinidad electrónica 5.-Electronegatividad y carácter metálico. El estudio de la materia y de sus propiedades en el
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRIMERA PARTE
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Curso 2006-2007 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos partes.
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Curso 2006-2007 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos partes.
I) Biomoléculas 2) El agua I-2 EL AGUA
 I-2 EL AGUA IMPRTANCIA DEL AGUA PARA LS SERES VIVS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
I-2 EL AGUA IMPRTANCIA DEL AGUA PARA LS SERES VIVS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
UNIVERSIDAD CARLOS III DE MADRID
 UNIVERSIDAD CARLOS III DE MADRID MODELO PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS MATERIA: QUÍMICA Curso 2011-2012 INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos partes. En
UNIVERSIDAD CARLOS III DE MADRID MODELO PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS MATERIA: QUÍMICA Curso 2011-2012 INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos partes. En
Conceptos de Electricidad Básica (1ª Parte)
 Con este artículo sobre la electricidad básica tenemos la intención de iniciar una serie de publicaciones periódicas que aparecerán en esta página Web de forma trimestral. Estos artículos tienen la intención
Con este artículo sobre la electricidad básica tenemos la intención de iniciar una serie de publicaciones periódicas que aparecerán en esta página Web de forma trimestral. Estos artículos tienen la intención
JULIO 2012. FASE GENERAL QUÍMICA
 OPCIÓN A JULIO 2012. FASE GENERAL QUÍMICA 1. (2,5 puntos) A partir de los siguientes datos de energías de ruptura de enlaces (ED): Molécula Enlaces ED (kj mol -1 ) H 2 H H 436 N 2 N N 946 NH 3 N-H 389
OPCIÓN A JULIO 2012. FASE GENERAL QUÍMICA 1. (2,5 puntos) A partir de los siguientes datos de energías de ruptura de enlaces (ED): Molécula Enlaces ED (kj mol -1 ) H 2 H H 436 N 2 N N 946 NH 3 N-H 389
TEMA 6: ENLACE QUÍMICO
 I.E.S. Al-Ándalus. Dpto. de Física y Química. Química 2º Bachillerato. Tema 6. Enlace Químico - 1 - TEMA 6: ENLACE QUÍMICO 6.1. ESTABILIDAD ATÓMICA. REGLA DEL OCTETE DE LEWIS En la naturaleza conocemos
I.E.S. Al-Ándalus. Dpto. de Física y Química. Química 2º Bachillerato. Tema 6. Enlace Químico - 1 - TEMA 6: ENLACE QUÍMICO 6.1. ESTABILIDAD ATÓMICA. REGLA DEL OCTETE DE LEWIS En la naturaleza conocemos
Unidad I Sub-Unidad 1.2.
 Unidad I Sub-Unidad 1.2. Objetivos: Conocer qué es un enlace químico. Estudiar los tipos de enlaces químicos. Conocer las diferentes fuerzas intermoleculares y su importancia. Qué es un ENLACE QUÍMICO?
Unidad I Sub-Unidad 1.2. Objetivos: Conocer qué es un enlace químico. Estudiar los tipos de enlaces químicos. Conocer las diferentes fuerzas intermoleculares y su importancia. Qué es un ENLACE QUÍMICO?
TEMA 4: EL AGUA COMO BIOMOLÉCULA.
 TEMA 4: EL AGUA COMO BIOMOLÉCULA. 1 1.INTRODUCCIÓN. El agua es, con mucho, la sustancia más abundante en los sistemas vivos, constituyendo un 70% o más del peso de la mayoría de los organismos. Está presente
TEMA 4: EL AGUA COMO BIOMOLÉCULA. 1 1.INTRODUCCIÓN. El agua es, con mucho, la sustancia más abundante en los sistemas vivos, constituyendo un 70% o más del peso de la mayoría de los organismos. Está presente
QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12. Lic. Ana María Martín
 QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12 Lic. Ana María Martín Lic. Ana María Martín Introducción SOLUCIONES REGULADORAS DE ph Muchas de las reacciones químicas que se producen en
QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12 Lic. Ana María Martín Lic. Ana María Martín Introducción SOLUCIONES REGULADORAS DE ph Muchas de las reacciones químicas que se producen en
DIVERSIDAD Y ESTRUCTURA DE LA MATERIA. 2º ESO Ciencias de la naturaleza
 DIVERSIDAD Y ESTRUCTURA DE LA MATERIA 2º ESO Ciencias de la naturaleza Todo lo que vemos es materia CLASIFICACIÓN DE LA MATERIA La materia se presenta en la naturaleza en forma de sustancias puras y mezclas,
DIVERSIDAD Y ESTRUCTURA DE LA MATERIA 2º ESO Ciencias de la naturaleza Todo lo que vemos es materia CLASIFICACIÓN DE LA MATERIA La materia se presenta en la naturaleza en forma de sustancias puras y mezclas,
Unidad II Sistemas Dispersos Elaborado por: Q.F.B. Guadalupe Echeagaray Herrera
 Química II (Química General y Orgánica) Unidad II Sistemas Dispersos Elaborado por: Sistemas Dispersos istemas Dispersos: Están constituidos por dos o más sustancias puras, unidas físicamente, (mezcladas).
Química II (Química General y Orgánica) Unidad II Sistemas Dispersos Elaborado por: Sistemas Dispersos istemas Dispersos: Están constituidos por dos o más sustancias puras, unidas físicamente, (mezcladas).
TEMA 3: ENLACE QUÍMICO
 I.E.S. Al-Ándalus. Dpto. de Física y Química. Curso 2004-05 FQ 1º Bach. Tema 3. Enlace Químico - 1 - TEMA 3: ENLACE QUÍMICO 3.1 Estabilidad atómica. Regla del Octete de Lewis 3.2 Enlace iónico. Propiedades
I.E.S. Al-Ándalus. Dpto. de Física y Química. Curso 2004-05 FQ 1º Bach. Tema 3. Enlace Químico - 1 - TEMA 3: ENLACE QUÍMICO 3.1 Estabilidad atómica. Regla del Octete de Lewis 3.2 Enlace iónico. Propiedades
Orbitales híbridos. Cajón de Ciencias
 Orbitales híbridos Cajón de Ciencias Los orbitales híbridos son aquellos que se forman por la fusión de otros orbitales. Estudiarlos es un paso básico para entender la geometría y la estructura de las
Orbitales híbridos Cajón de Ciencias Los orbitales híbridos son aquellos que se forman por la fusión de otros orbitales. Estudiarlos es un paso básico para entender la geometría y la estructura de las
