UNIDAD 4: SOLUBILIDAD DE PRECIPITADOS
|
|
|
- Pablo García Soriano
- hace 7 años
- Vistas:
Transcripción
1 UNIDAD : SOLUBILIDAD DE PRECIPITADOS Las reacciones que producen sustancias de baja solubilidad tienen aplicaciones importantes en procesos analíticos. Por ejemplo: La formación de precipitados es usada para: 1) Separación de sustancias interferentes: que de alguna u otra forma pueden afectar los resultados del análisis cuantitativo. ) Análisis Gravimétrico: en el cual el analito se separa de los demás componentes presentes en una solución de la muestra, como una sustancia de baja solubilidad. ) Volumetría de precipitación: en el cual el analito se determina a través del volumen de analito requerido para formar un precipitado. Teoría del producto de solubilidad Sea un sólido de la forma A x B y poco soluble en agua. A x B y (s) XA y + + YB x kps = [A y + x [B x En términos de solubilidad (S) la concentración de cada especie es: y 1 [A y + = XS o S = [A y+ x [B x = YS o S = 1 [B x y Luego reemplazo en =(XS) x (YS) y =X x Y y S x+ y S = X+Y x X Y y
2 Para un solido tipo 1:1 AgCl, BaSO AgCl(s) Ag + + Cl S = Para solidos tipo 1: o :1 Ag SO, HgCl = 1 * Para sustancias 1: o :1 S = = 7 Para sólidos tipo : o : Ca (PO ), Al (SO ) S = 5 * = De igual manera, conociendo la solubilidad de cualquier sustancia poco soluble, se puede determinar el valor del. Para sólidos 1:1 = S 1: = S 1: = 7S : = 108S 5 Y así sucesivamente. Ejemplo: calcular la solubilidad en agua pura del = [Ca + [PO = [S [S Ca (PO ) (s) Ca + + PO S = 5 * = 5 = * S =.9*10-7 Me Cuantos gramos de Ca (PO ) se disuelven en 500 ml de agua pura. g Ca (PO ) =.9 x 10-7 mol L 198g x 0.5 L * 1 mol =.8 x 10-5 g Calcular la concentración de equilibrio del Ca + y PO [Ca + = (.9x10-7 ) y [PO = (.9x10-7 )
3 Ejercicio: La concentración de Ag + en una solución saturada de Ag + en una solución saturada de Ag CrO se encontró, por colorimetría, que tenia un valor de 1.56x10 - M calcular: 1) para el Ag CrO ) ppm de Ag + en la solución saturada Ag CrO Ecuación de equilibrio Ag CrO (s) Ag + + CrO kps =? S S = [Ag + [CrO Pero: [Ag + = S = 1.56 x10 - [CrO = S S = 1.56x10 = 7.8 x10 5 =(S) (S) = S = (7.8x10 5 ) =1.9x10-1. molag gAg ) ppm Ag + = 1.56x10 - L x + 1molAg 1000mgAg + 1gAg + Ejercicio: La solubilidad del RaSO es.1 mg/l Calcular valor del kps para el RaSO RaSO (s) Ra + + SO kps =? S S = [Ra + [SO Pero: [Ra + = S [ SO = S =S g 1mol Donde : S =.11 x l 18g = = (0.0115) = 1.x10 -
4 Predicción de la formación de precipitados cuando se mezclan soluciones electrolíticas. Para poder afirmar si se formo o no un precipitado, se plantea el producto iónico par la especie que puede formarse, el producto iónico PI tiene la siguiente expresión: PI = C x A y+ + C y B x Donde C x A y + y C y x B son las concentraciones instantáneas de las especies que forman el precipitado. En este caso, si PI > Se precipita el sólido poco soluble. Ejemplo: predecir si se forma un precipitado cuando se mezclan las siguientes soluciones: a) 0 ml de solución M a de HClO y 0 ml de solución M a C Cl HClO + H O ClO + H O C s Cl + H O Cl + C s + El sólido que se forma es el C s ClO (s) poco soluble. (C s ClO ) = x * *0.000 PI = = 5.9 x PI < no se forma el C s ClO (s). Ejemplo: la solubilidad de la sal AB (P.M = 100 g/mol) es 0.6gAB 100mlS ln Si se mezclan 0.0 ml de solución M en B con 70.0 ml solución M en A + predecir si se precipita el compuesto AB (s). AB (s) A + + B = [ H [ + B = (S)(S) = S 0.6gAB Pero S = 100mlS ln S = 0.6gAB 1molAB x 1000 x = Ma 100mlS ln 100gAB 1Lml
5 = (0.060) = 8.6 x *0.000 PI = 100 = 1.6x * En este caso PI < no se forma el precipitado AB (s) FACTORES QUE AFECTAN LA SOLUBILIDAD DE LAS SUSTANCIAS POCO SOLUBLES. Los factores que afectan la solubilidad de las sustancias poco solubles en agua pura son: 1) Efecto del ión común ) Efecto del ión diverso(o salino) ) Efecto del PH (cálculos de solubilidad a PH constante y conocido) ) Efecto de hidrólisis (cálculos de solubilidad a PH desconocido) 5) Efecto de la formación de complejos. 1) Efecto del ión común Cualquier sustancia poco soluble en agua tendrá una solubilidad menor en una solución que contenga uno de sus propios iones. Este efecto esta determinado por el principio de Lechatelier. Ejemplo: Calcúlese la solubilidad del Ba(IO ) en una solución que es M a en Ba(NO ). S = [ IO S= [Ba + IO S = Ba(IO ) (s) Ba + + IO Solubilidad de Ba(IO ) [Ba + (Porque el Bario tiene fuentes)
6 1 Solubilidad del Ba(IO ) = [ IO = [ IO [Ba + = ( [ 1 IO ) [ IO Como le es muy pequeño IO lo despreciamos como sumando. = [ IO = 1.57x10 9 [ IO = =.80x Finalmente la solubilidad Ba(IO ) = 1 (.80x10 - ) S=1.0x10 - con efecto ión común. Ahora comparemos este resultado con el de la solubilidad del Ba(IO ) (s) sin tener en cuenta el efecto del ión común. = (S)(S) = S S = Ba(IO ) (s) Ba + + IO *10 S = =7.x10 - S.sin EIC S. coneic 7.*10 1.0*10 = = 5 En este caso la solubilidad se reduce por un factor cercano a 5. ) Efecto del ión diverso (o salino) La solubilidad una sustancia poco soluble en agua también puede ser afectada por la presencia de diferentes electrolitos en la solución acuosa. La presencia de estos electrolitos afecta la fuerza iónica coeficiente de actividad de dichas especies en la solución. Por ejemplo considera la solubilidad el AgCl(s). La constante termodinámica del producto de solubilidad º es
7 º = a Ag +.a Cl = f Ag + AgCl (s) Ag + + Cl -. f Cl [Ag + [Cl El producto de solubilidad de concentración = [Ag + [Cl = º f ± El = º, para µ = 0 Un decrecimiento en el coeficiente de actividad de las especies resulta en un incremento en el. Ejercicio: Calcular la solubilidad del AgCl 0.1M en NaNO. AgCl (s) Ag + + Cl - Solución: las constantes de equilibrio listadas en los apéndices de los libros son para µ=0, o sea que estas son realmente constantes termodinámica. º = a Ag +.a Cl º = f ±[Ag + [Cl Como el NaNO es un electrolito 1:1 entonces µ = C es decir, µ = 0.1M Para µ = 0.1 f =0.75 y f Ag + Cl = = *10 (0.75)(0.76) =1.8x10-10 = S S = S = 1.8*10 10 =1.*10-5 M. Comprobando con el valor del a µ = 0 tenemos que S = 1.8*10 10 = 1.x10-5 Comparando con el valor del a µ = 0 tenemos que
8 S = 1.0 *10 10 =1.0x *10 1.0*10 %E = 5 1.0*10 5 x100 = 0% La solubilidad del AgCl en presencia de electrolitos es 0% mayor. Es decir la adición de electrolitos favorece la solubilidad. ) Efecto del PH (cálculos de solubilidad a PH constante y conocido) Los precipitados que contienen un anión con propiedades básicas, un catión con propiedades ácidas o los dos tendrán una solubilidad dependiente del PH. a) Cálculos de solubilidad a PH constante y conocido con frecuencia las precipitaciones analíticas se llevan a cabo en soluciones amortiguadoras en las que el PH se fija a un valor preestablecido. Ejemplo: Calcúlese la solubilidad del oxalato de calcio (CaC O ) en una solución amortiguadora de PH constante igual a.0 CaC O (s) Ca + + C O - (reacción de disolución) Luego K C O + H O HC O + OH Kb 1 = w Ka HC O + H O H C O + OH Kb = K w Ka 1 [ [ 1.79x10-1 OH HCO Kb 1 = [ C O [ [ 1.8X10-10 OH H CO Kb = [ HC O (1) () 1.7X10-5 = = [Ca + [C O () [Ca + = S ()
9 [C O S porque el C O se sigue disociando. [Ca + = [C O + [HC O + [H C O (5) [Ca + = [C O + Kb C O OH C O + Kb OH Pero PH=.00 POH=10.0 1x10-10 [Ca + = [C O [C O [C O [Ca + =.85 [C O [C O = ( S ) [ + = Ca.85 S.85 S =.85*1.7*10 9 = 7.0*10-5 ) Efecto de hidrólisis. Cálculos de solubilidad a PH variable Al saturar una solución no amortiguada con una sal escasamente soluble que contenga un anión básico o un catión ácido, cambiara el PH de la solución. Por ejemplo: El agua pura saturada con BaCO es básica como consecuencia de las siguientes reacciones. BaCO Ba + + CO anión básico que hidroliza. CO + H O HCO + OH HCO + H O H CO + OH A diferencia del ejercicio anterior el PH es desconocido por lo tanto desconocemos la concentración de (OH ) este sistema es difícil de
10 5) Efecto de la formación de complejos. La solubilidad de un precipitado puede aumentar en presencia de reactivos que formen complejos con el anión o con el catión del precipitado. Por ejemplo, los iones fluoruro evitan la precipitación cuantitativa del Hidróxido de aluminio. Al(OH) (s) Al + + (OH - ) + 6F AlF 6 El complejo fluoroaluminato es lo suficientemente estable para permitir que los iones F compitan ventajosamente con los iones hidróxido por los iones aluminio. EFECTOS DEL PH, CALCULOS DE SOLUBILIDAD A ph CONSTANTE. Los precipitados que presentan un anión con propiedades básicas un catión con propiedades ácidas o ambos casos, tendrán una solubilidad que dependerá del PH de la solución. Por lo general, las precipitaciones analíticas se llevan a cabo en soluciones buffer a PH constante. Ejercicio 1: Calcúlese la solubilidad del oxalato de calcio Ca C O (s) amortiguadora de PH =.00. en una solución CaC O (s) Ca + + C O C O + H O + HC O + H O Ka HC O + H O + H C O + H O Ka 1 = [Ca + [C O (1) [ [ + H O HCO Ka 1 = [ H C O [ [ + H O CO Ka = [ HC O () () S = [Ca + = [C O + [HC O + [H C O = CT ()
11 [ C O Pero = α [C O = α CT = α S CT =(S)( α S) S = α Pero.. Ka Ka 1 α = + + [ H O + Ka1[ H O + Ka1Ka + + [ H O + Ka1[ H O S = + Ka1Ka Ka Ka Ejercicio : Calcular el ph de CaF para el cual la solubilidad es de 100 ppm. = 5.x10-9 CaF (s) Ca + + F F - + H O + HF + H O Ka 1 = 7.x10 - = [Ca + [F [ [ + H O F Ka = 1 [ HF S = [Ca + 1 = ([ F + [ HF ) = CT [ F = α1 CT [ F = α 1 CT = α 1 S = (S)( α 1 S) = S α 1 α 1 = S Pero α 1 = [ H O + Ka+ Ka Ka + [ H O + Ka = S Despejo [H O + y calculo ph.
12 EFECTO DE LA HIDRÓLISIS (cálculos de solubilidad a ph variable). En una solución no amortiguada, la solubilidad de compuestos poco solubles depende de la hidrólisis del catión o del anión que hacen que la concentración del ión hidrónio sea desconocido y por lo tanto el PH variable. (Estos sistemas son difíciles de determinar pero se puede llegar a una expresión) Ejercicio : Calcular los gramos de BaCO que se puede disolver en ml de una solución saturada de esta sal en agua, teniendo en cuenta el efecto de hidrólisis. BaCO Ba + + CO CO + H O HCO + OH Kw Kb 1 = Ka HCO + H O H CO + OH Kw Kb = Ka 1 Kb 1 10, Kb 1 es el equilibrio principal. Kb =[Ba + [CO (1) [ [ OH HCO Kb 1 = [ [ CO [ OH H CO Kb = [ HCO () () Balance de masas. S = [Ba + = [CO + [HCO + [H CO () Balance de cargas [Ba + = [CO + [HCO + [OH (5) Multiplicamos la ecuación ()* y la restamos de (5) [Ba + = [CO + [HCO + [H CO - [Ba + = -[CO - [HCO - [OH 0 = [HCO + [H CO - [OH
13 Kb Pero 1 10, Kb 1 es el equilibrio principal. Kb [CO y [HCO >>[H CO.. Entonces de desprecia como sumando el [HCO. [HCO = [OH (6) Kb 1 = [ [ CO HCO [HCO = [ Kb (7) 1 CO Pero.. [CO = + Ba (8) Reemplazo (8) en (7) [HCO = Kw* Ka + [ Ba (9) Luego, reemplazo (8) y (9) en () se tiene: [Ba + = + Ba Kw * + + Ka [ Ba [Ba + = + [Ba + 1 Kw * Ka [Ba + - Kw * Ka 1 [Ba + - = 0 S - Kw * Ka S 1 - = f(s)
14 PRECIPITACIÓN SELECTIVA O PRECIPITACIÓN FRACCIONADA. Cuando se quiere separar o mas especies iónicas en solución, mediante la adición de un agente precipitante, precipitará primero aquella especie iónica que forme con el agente precipitante la sustancia menos soluble o sea que necesite menos concentración de agente precipitante. Estas precipitaciones pueden ser: 1) Por control de la concentración del agente precipitante. ) Por control de PH de la solución..1) Separación de hidróxidos..) Separación de sulfuros. Precipitación selectiva por control del agente precipitante Ejemplo: Una solución contiene los iones Ba +, Sr + y Ca +, donde sus concentraciones son 0.000Me, y Me respectivamente. Si a esta solución se le agrega K CrO puro. (Suponer que la adición del solido no se afecta el volumen de la solución) calcular. 1. Orden de precipitación de los cationes como cromatos.. Porcentaje de cada catión que queda sin precipitar inmediatamente después de que inicie la precipitación del siguiente.. Suponiendo que hay una precipitación selectiva, cuando la concentración del catión que precipita primero puede disminuirse hasta un.0 x10 - % sin que empiece a precipitar el segundo. Predecir si es factible separar selectivamente estos cationes con este criterio. Solución. 1) Plantear las reacciones electrolíticas de precipitación Ba + + CrO BaCrO (s) Sr + + CrO SrCrO (s) Ca + + CrO CaCrO (s) a) Calculemos la [CrO necesaria para iniciar la precipitación de BaCrO (s). BaCrO (s) Ba + + CrO =.1x10-10 = [Ba + [CrO.1*10 [CrO min = + = Ba = 7.0 x10-9 Por lo tanto el BaCrO precipita [CrO >7.0 x10-9 M.
15 b) La concentración de [CrO necesaria para iniciar la precipitación del SrCrO es: SrCrO Sr + + CrO =.6x10-5 = [Sr + [CrO 5.6*10 [CrO min = + = Sr = 0.1 Por lo tanto el SrCrO precipita [CrO > 0.1 c) La concentración de [CrO para iniciar la precipitación del CaCrO (s) es: CaCrO (s) Sr + + CrO = 7.1x10 - M = [Ca + [CrO 7.1*10 [CrO = + = Ca = 7.1x10 - Por lo tanto el CaCrO (s) precipita [CrO > 7.1x10 - M. Según lo anterior, el orden de precipitación es: 1) BaCrO. Este precipita primero porque necesita menos agente precipitante. ) CaCrO. ) SrCrO. ) Porcentaje de Ba + que queda sin precipitar cuando empieza a precipitar el CaCrO (s) [Ba + = [ CrO.1*10 7.1*10 10 = =.9 x 10-9 Me Esta es la concentración de CrO a la cual inicia a precipitar el CaCrO % Ba + 9.9*10 = * 100= 9.9 x10-6 %
16 Porcentaje de Ca + que queda en la solución cuando empieza a precipitar el SrCrO (s). [Ca + = [ CrO 5.9*10 = = 59.0 % 0.01 ) Sin aplicar el criterio de separación selectiva, puedo separar el Ba + del Ca + en el rango. 7.1x10-9 < [CrO <7.1x10- Mientras que separar Ca + del Sr +, el rango es: 7.1x10 - < [CrO <0.1 Aplicando el criterio de separación para el Ba +, la concentración del Ba + disminuirse hasta que esta sea: debe [Ba + = 0.00 x.0* = 9.0x10-8 Me. En este caso la concentración de [CrO necesaria para disminuir la concentración del [Ba + hasta 9.0 x10-8 Me es 10 [CrO =.1* *10 =. x 10 - Como. x 10 - < 7.1x10 - Me, se puede separar el Ba + del Ca + Dentro de un rango de concentración con este criterio..x10 - Me < [CrO < 7.1x10- Me Propuesto: calcular la separación de los mismos cationes (Ba +, Sr +, Ca + ) usando PO Como agente precipitante y teniendo en cuenta el criterio de separación del % del catión que precipita primero. Precipitación selectiva por control del ph de la solución Esta se usa generalmente para separar cationes en solución como hidróxidos o sulfuros principalmente. Para separar cationes presentes en solución en forma de sulfuros metálicos, se utiliza como agente precipitante una solución saturada de H S, Tioacetamida H S +H O HS + H O + Ka 1 HS +H O S + H O + Ka H S +H O S + H O + Ka 1 Ka = β
17 + Pero β = Ka 1 Ka = [ H O [. S [ H S En soluciones saturadas de H S, la concentración molar de H S es constante y tiene un valor de Ma Despejando [H O + tenemos [H O + = KaKa 1 [ S [ H S Pero [H S M HS porque Ka 1 y Ka muy pequeños Ka 1 Ka M HS =6.8x10 - Ka Ka M 1 H [H O + = [ S S Ejercicio: Se desea separar selectivamente el La + y Mn + de una solución en la cual la concentración de cada catión es Me en forma de sulfuros con una solución saturada de H S Ma. Si se supone que disminuyendo hasta 1.0x10-6 Me la concentración del catión que precipita primero constituye un criterio de separación selectiva, determinar si es posible separar selectivamente como sulfuros estos dos cationes y establecer el rango de PH dentro del cual tiene lugar dicha separación. Solución: La + + S La S (s) Mn + S MnS (s) Calculemos [S min necesaria para iniciar la precipitación del La S (s) La S (s) La + + S =.5x10-1 = [La + [S [S min = + [ La =.5*10 1 ( ) =.6x10 - Me Por la tanto La S precipita a [S >1.0x10 -
18 Calculemos [S min necesaria para iniciar la precipitación del MnS (s) MnS (s) Mn + + S = 8.0x10-1 = [Mn + [S [S min = + [ Mn = 1 8.0*10 = 1.6x10-1 Me Por lo tanto el MnS(s) precipita a [S >1.6x10-1 Me De acuerdo con lo anterior, el catión que precipita primero es el que requiere menos cantidad de [S. Orden de precipitación 1) MnS ) La S Sin aplicar criterio de separación, puedo separar el Mn + del La + en el rango de concentraciones de S 1.6x10-1 < [S <.6x10 - Aplicando el criterio de separación para el catión que precipita primero (Mn + ), es decir hasta que la concentración del Mn + se reduzca a 1.0x10-6 Me, antes de que precipite el La + se tiene *10 [S Criterio = = 8.0*10-8 Me 6 1.0*10 En este caso 8.0x10-8 Me <.6x10 - Me, por lo tanto se puede separar selectivamente el Mn + del La +, dentro de un rango de concentraciones. Entonces el rango de ph varia entre 8.0x10-8 < [S <.6x10-6.8* *10 8 < [H O + 6.8*10 >.6* < ph > 8.5
9. Cuál es la solubilidad del sulfato de estroncio, SrSO 4? K ps = A) M B) M C) M D) 2.
 Equilibrio de precipitación ---------------------------------------------------------------------------------------------------------- 1. El producto de solubilidad de un sólido es: A) Una constante de
Equilibrio de precipitación ---------------------------------------------------------------------------------------------------------- 1. El producto de solubilidad de un sólido es: A) Una constante de
PROBLEMARIO (Solubilidad)
 PROBLEMARIO (Solubilidad) 1. Una disolución saturada de fosfato de plata, Ag 3 PO 4, contiene 3.4X10 5 moles por litro de ion fosfato (s de PO 4 3- = 3.4X10 5 ). Calcula el producto de solubilidad de dicha
PROBLEMARIO (Solubilidad) 1. Una disolución saturada de fosfato de plata, Ag 3 PO 4, contiene 3.4X10 5 moles por litro de ion fosfato (s de PO 4 3- = 3.4X10 5 ). Calcula el producto de solubilidad de dicha
Tema 6. Equilibrios de precipitación
 Tema 6. Equilibrios de precipitación 1. Introducción. 2. Solubilidad y Constante de solubilidad. 3. Sales poco solubles. 4. Factores que afectan a la solubilidad. 5. Predicción de las reacciones de precipitación.
Tema 6. Equilibrios de precipitación 1. Introducción. 2. Solubilidad y Constante de solubilidad. 3. Sales poco solubles. 4. Factores que afectan a la solubilidad. 5. Predicción de las reacciones de precipitación.
INTRODUCCION AL EQUILIBRIO PRECIPITACIÓN - SOLUBILIZACIÓN
 INTRODUCCION AL EQUILIBRIO PRECIPITACIÓN - SOLUBILIZACIÓN Lo básico que debes saber de Química General 14-1 LA SOLUBILIDAD DE ELECTROLITOS FUERTES POCO SOLUBLES Compuesto Solubilidad Electrolito NaCl BaSO
INTRODUCCION AL EQUILIBRIO PRECIPITACIÓN - SOLUBILIZACIÓN Lo básico que debes saber de Química General 14-1 LA SOLUBILIDAD DE ELECTROLITOS FUERTES POCO SOLUBLES Compuesto Solubilidad Electrolito NaCl BaSO
Núcleo Temático 8 opasdfghjklzxcvbnmqwertyuiopasdfg. 03/02/2010 Equilibrio de Precipitación
 qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq wertyuiopasdfghjklzxcvbnmqwertyui Núcleo Temático 8 opasdfghjklzxcvbnmqwertyuiopasdfg
qwertyuiopasdfghjklzxcvbnmqwerty uiopasdfghjklzxcvbnmqwertyuiopasd fghjklzxcvbnmqwertyuiopasdfghjklzx cvbnmqwertyuiopasdfghjklzxcvbnmq wertyuiopasdfghjklzxcvbnmqwertyui Núcleo Temático 8 opasdfghjklzxcvbnmqwertyuiopasdfg
TEMA VII: SOLUBILIDAD
 TEA VII: SOLUBILIDAD 1.- Defina el concepto de solubilidad. Exprese la relación existente entre la solubilidad y el producto de la solubilidad para una sal A m B n. Se define Solubilidad, (S), a la cantidad
TEA VII: SOLUBILIDAD 1.- Defina el concepto de solubilidad. Exprese la relación existente entre la solubilidad y el producto de la solubilidad para una sal A m B n. Se define Solubilidad, (S), a la cantidad
Universidad de Concepción Facultad de Ciencias Químicas. Química General para Ingeniería
 Universidad de Concepción Facultad de Ciencias Químicas Química General para Ingeniería Tema: Equilibrios de solubilidad 1 . Equilibrios de compuestos iónicos ligeramente solubles. Solubilidad. Reacción
Universidad de Concepción Facultad de Ciencias Químicas Química General para Ingeniería Tema: Equilibrios de solubilidad 1 . Equilibrios de compuestos iónicos ligeramente solubles. Solubilidad. Reacción
Tema 7: Equilibrio en fase acuosa. Reacciones de precipitación
 Tema 7: Equilibrio en fase acuosa. Reacciones de precipitación 7.1 Introducción 7.2 El producto de solubilidad 7.3 Solubilidad y solubilidad molar 7.4 Reglas de solubilidad 7.5 Precipitación selectiva
Tema 7: Equilibrio en fase acuosa. Reacciones de precipitación 7.1 Introducción 7.2 El producto de solubilidad 7.3 Solubilidad y solubilidad molar 7.4 Reglas de solubilidad 7.5 Precipitación selectiva
Equilibrio de solubilidad Kps:
 Equilibrio de solubilidad Kps: 1. Escribir las ecuaciones de disociación y la expresión del producto de solubilidad (Kps) para las siguientes sales: CaF 2 ; PbSO 4 ; AgCl; Fe(OH) 3 ; Ag 2 CO 3. Estos son
Equilibrio de solubilidad Kps: 1. Escribir las ecuaciones de disociación y la expresión del producto de solubilidad (Kps) para las siguientes sales: CaF 2 ; PbSO 4 ; AgCl; Fe(OH) 3 ; Ag 2 CO 3. Estos son
EQUILIBRIOS DE SOLUBILIDAD
 EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene 3,4 1 moles por litro de ion fosfato. Calcula el producto de solubilidad
EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene 3,4 1 moles por litro de ion fosfato. Calcula el producto de solubilidad
GUÍA DE EJERCICIOS Kps (EQUILIBRIO DE SOLUBILIDAD)
 GUÍA DE EJERCICIOS Kps (EQUIIBRIO DE SOUBIIDAD) Área Química Resultados de aprendizaje Identifica, aplica y analiza conceptos básicos relacionados con equilibrio de solubilidad para la resolución de ejercicios,
GUÍA DE EJERCICIOS Kps (EQUIIBRIO DE SOUBIIDAD) Área Química Resultados de aprendizaje Identifica, aplica y analiza conceptos básicos relacionados con equilibrio de solubilidad para la resolución de ejercicios,
OBJETIVOS ESPECÍFICOS. Al finalizar el Tema el estudiante: 2.1 Identificará en una reacción ácido-base pares ácido-base conjugados.
 OBJETIVOS ESPECÍFICOS TEMA III: EQUILIBRIO IONICO: Al finalizar el Tema el estudiante: 1.1 Establecerá la expresión de la constante de equilibrio para la reacción de autoionización del agua. 1.2 Concluirá
OBJETIVOS ESPECÍFICOS TEMA III: EQUILIBRIO IONICO: Al finalizar el Tema el estudiante: 1.1 Establecerá la expresión de la constante de equilibrio para la reacción de autoionización del agua. 1.2 Concluirá
QUÍMICA I. TEMA 10 Equilibrio de solubilidad. Tecnólogo en Minería
 QUÍMICA I TEMA 10 Equilibrio de solubilidad Tecnólogo en Minería O b j e t i v o Examinar las propiedades físicas de las disoluciones y compararlas con las de sus componentes Disoluciones acuosas de sustancias
QUÍMICA I TEMA 10 Equilibrio de solubilidad Tecnólogo en Minería O b j e t i v o Examinar las propiedades físicas de las disoluciones y compararlas con las de sus componentes Disoluciones acuosas de sustancias
EQUILIBRIOS DE SOLUBILIDAD
 EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene 3,4 1 5 moles por litro de ion fosfato. Calcula el producto de solubilidad
EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene 3,4 1 5 moles por litro de ion fosfato. Calcula el producto de solubilidad
Equilibrio de solubilidad. Prof. Dra. Marisa Repetto Química General e Inorgánica Primer cuatrimestre 2016
 Equilibrio de solubilidad Prof. Dra. Marisa Repetto Química General e Inorgánica Primer cuatrimestre 2016 Cuáles son los factores que condicionan el proceso de disolución? Interacciones soluto solvente
Equilibrio de solubilidad Prof. Dra. Marisa Repetto Química General e Inorgánica Primer cuatrimestre 2016 Cuáles son los factores que condicionan el proceso de disolución? Interacciones soluto solvente
186 Equilibrio químico. Precipitación
 186 Equilibrio químico 4.9 Equilibrios de precipitación Precipitación Un caso particular de equilibrio heterogéneo se presenta cuando, en el transcurso de una reacción en disolución acuosa, se forma un
186 Equilibrio químico 4.9 Equilibrios de precipitación Precipitación Un caso particular de equilibrio heterogéneo se presenta cuando, en el transcurso de una reacción en disolución acuosa, se forma un
ENUNCIADOS DE LOS PROBLEMAS RESUELTOS SOBRE PRECIPITACIÓN
 ENUNCIADOS DE LOS PROBLEMAS RESUELTOS SOBRE PRECIPITACIÓN 1- Disponemos de una disolución saturada de hidróxido de aluminio a 25ºC. Teniendo en cuenta que a dicha - 15 temperatura el producto de solubilidad
ENUNCIADOS DE LOS PROBLEMAS RESUELTOS SOBRE PRECIPITACIÓN 1- Disponemos de una disolución saturada de hidróxido de aluminio a 25ºC. Teniendo en cuenta que a dicha - 15 temperatura el producto de solubilidad
El hidróxido de magnesio es una sustancia ligeramente soluble en agua. El ph de una disolución saturada de dicho hidróxido es de 10,38.
 Calcula la solubilidad en g/l del fosfato de plomo (II) sabiendo que su producto de solubilidad es 1,5.10-32. Datos: Pb = 207,2; P = 31; O = 16. Sol: 1,37.10-11 g/l. Sabiendo que la solubilidad en g/l
Calcula la solubilidad en g/l del fosfato de plomo (II) sabiendo que su producto de solubilidad es 1,5.10-32. Datos: Pb = 207,2; P = 31; O = 16. Sol: 1,37.10-11 g/l. Sabiendo que la solubilidad en g/l
11. EQUILIBRIOS DE SOLUBILIDAD
 - 210-11. EQUILIBRIOS DE SOLUBILIDAD Muchos compuestos iónicos son insolubles o ligeramente solubles en agua. Un equilibrio de solubilidad es el equilibrio que existe entre un sólido iónico y sus iones
- 210-11. EQUILIBRIOS DE SOLUBILIDAD Muchos compuestos iónicos son insolubles o ligeramente solubles en agua. Un equilibrio de solubilidad es el equilibrio que existe entre un sólido iónico y sus iones
EQUILIBRIO IÓNICO EN SOLUCIONES ACUOSAS
 EQUILIBRIO IÓNICO EN SOLUCIONES ACUOSAS Equilibrio entre una sal sólida poco soluble y sus iones en solución Producto de solubilidad (Kps) Muchos compuestos (sales, hidróxidos) son levemente solubles en
EQUILIBRIO IÓNICO EN SOLUCIONES ACUOSAS Equilibrio entre una sal sólida poco soluble y sus iones en solución Producto de solubilidad (Kps) Muchos compuestos (sales, hidróxidos) son levemente solubles en
Guía de ejercicios equilibrio químico
 Guía de ejercicios equilibrio químico Profesor Edwar Fuentes Química Analítica I Semestre primavera 2011 1.- Conociendo el valor de las constantes de equilibrio para las reacciones individuales, calcule
Guía de ejercicios equilibrio químico Profesor Edwar Fuentes Química Analítica I Semestre primavera 2011 1.- Conociendo el valor de las constantes de equilibrio para las reacciones individuales, calcule
Tema 8: Equilibrios de solubilidad y de formación de complejos
 Tema 8: Equilibrios de solubilidad y de formación de complejos Equilibrio de solubilidad: conceptos básicos. Producto de solubilidad: K s. Solubilidad. Efecto del ión común. Precipitación. Equilibrios
Tema 8: Equilibrios de solubilidad y de formación de complejos Equilibrio de solubilidad: conceptos básicos. Producto de solubilidad: K s. Solubilidad. Efecto del ión común. Precipitación. Equilibrios
PREGUNTAS DE TEST SOBRE PRECIPITACIÓN (2015)
 PREGUNTAS DE TEST SOBRE PRECIPITACIÓN (2015) Grupo A- CONCEPTO DE SOLUBILIDAD Y PRODUCTO DE SOLUBILIDAD: Grupo B- SOLUBILIDAD Grupo C- EFECTO DE ION COMUN: Grupo D- PROBLEMAS SOBRE PRECIPITACIÓN CON RESPUESTAS
PREGUNTAS DE TEST SOBRE PRECIPITACIÓN (2015) Grupo A- CONCEPTO DE SOLUBILIDAD Y PRODUCTO DE SOLUBILIDAD: Grupo B- SOLUBILIDAD Grupo C- EFECTO DE ION COMUN: Grupo D- PROBLEMAS SOBRE PRECIPITACIÓN CON RESPUESTAS
Reacciones de precipitación Solubilidad y producto de solubilidad
 Reacciones de precipitación Recibe el nombre de precipitación la aparición de una fase sólida en el seno de un líquido, bien por adición de un reactivo que forme un producto insoluble con alguno de los
Reacciones de precipitación Recibe el nombre de precipitación la aparición de una fase sólida en el seno de un líquido, bien por adición de un reactivo que forme un producto insoluble con alguno de los
Equilibrios de solubilidad
 Equilibrios de solubilidad Apellidos, nombre Departamento Centro Atienza Boronat, Julia (matien@qim.upv.es) Morais Ezquerro, Sergi (smorais@qim.upv.es) Departamento de Química ETSIAMN (Universitat Politècnica
Equilibrios de solubilidad Apellidos, nombre Departamento Centro Atienza Boronat, Julia (matien@qim.upv.es) Morais Ezquerro, Sergi (smorais@qim.upv.es) Departamento de Química ETSIAMN (Universitat Politècnica
Equilibrios de solubilidad. 2 Fe (ac) 3 CO (ac) Fe CO (s)
 IES a Magdalena. Avilés. Asturias Se dice que aparece un precipitado cuando en una disolución acuosa, y como consecuencia de una reacción química, se forma un compuesto sólido insoluble. En la imagen de
IES a Magdalena. Avilés. Asturias Se dice que aparece un precipitado cuando en una disolución acuosa, y como consecuencia de una reacción química, se forma un compuesto sólido insoluble. En la imagen de
Equilibrios de solubilidad. 2 Fe (ac) 3 CO (ac) Fe CO (s)
 IES a Magdalena. Avilés. Asturias Se dice que aparece un precipitado cuando en una disolución acuosa, y como consecuencia de una reacción química, se forma un compuesto sólido insoluble. En la imagen de
IES a Magdalena. Avilés. Asturias Se dice que aparece un precipitado cuando en una disolución acuosa, y como consecuencia de una reacción química, se forma un compuesto sólido insoluble. En la imagen de
Kps, equilibrio de precipitación y efecto de ión común
 Material recopilado por Victoria Chan Page 1 of 6 Kps, equilibrio de precipitación y efecto de ión común 1. Escriba las ecuaciones balanceadas que representan la disociación ó la ionización de las siguientes
Material recopilado por Victoria Chan Page 1 of 6 Kps, equilibrio de precipitación y efecto de ión común 1. Escriba las ecuaciones balanceadas que representan la disociación ó la ionización de las siguientes
EQUILIBRIO IONICO. Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico
 Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico EQUILIBRIO IONICO Es una aplicación de equilibrio químico a las reacciones donde participan soluciones
Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico EQUILIBRIO IONICO Es una aplicación de equilibrio químico a las reacciones donde participan soluciones
Equilibrios ácido-base y equilibrios de solubilidad
 Equilibrios ácido-base y equilibrios de solubilidad Capítulo 16 El efecto del ión común es el cambio en equilibrio causado por el añadir un compuesto que tiene un ión común con la sustancia disuelta. La
Equilibrios ácido-base y equilibrios de solubilidad Capítulo 16 El efecto del ión común es el cambio en equilibrio causado por el añadir un compuesto que tiene un ión común con la sustancia disuelta. La
Tabla 4.1. Reglas de solubilidad para compuestos iónicos a 25ºC
 La disolución y la precipitación de compuestos son fenómenos que se presentan corrientemente en la naturaleza. Por ejemplo la preparación de muchos productos químicos industriales, como el Na 2 CO 3, está
La disolución y la precipitación de compuestos son fenómenos que se presentan corrientemente en la naturaleza. Por ejemplo la preparación de muchos productos químicos industriales, como el Na 2 CO 3, está
Página 1
 TEMA 5. CINÉTICA QUÍMICA Y EQUILIBRIO QUÍMICO 6.2) A una hipotética reacción química A + B C le corresponde la siguiente ecuación de velocidad: v = k [A] [B]. Indique: a) El orden de la reacción respecto
TEMA 5. CINÉTICA QUÍMICA Y EQUILIBRIO QUÍMICO 6.2) A una hipotética reacción química A + B C le corresponde la siguiente ecuación de velocidad: v = k [A] [B]. Indique: a) El orden de la reacción respecto
DISOLUCIÓN Y PRECIPITACIÓN DE SALES CAPITULO V. 5.1. Solubilidad 5.2. Disolución de compuestos poco solubles. 5.3. Precipitación Fraccionada
 CAPITULO V DISOLUCIÓN Y PRECIPITACIÓN DE SALES 5.1. Solubilidad 5.2. Disolución de compuestos poco solubles. 5.3. Precipitación Fraccionada El fenómeno de precipitación, así como el de disolución de precipitados
CAPITULO V DISOLUCIÓN Y PRECIPITACIÓN DE SALES 5.1. Solubilidad 5.2. Disolución de compuestos poco solubles. 5.3. Precipitación Fraccionada El fenómeno de precipitación, así como el de disolución de precipitados
Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación
 Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación Los equilibrios heterogéneos son aquellos en los cuales los reactivos y productos se presentan en distintos estados de agregación (sólido,
Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación Los equilibrios heterogéneos son aquellos en los cuales los reactivos y productos se presentan en distintos estados de agregación (sólido,
SEMINARIOS (ÁCIDO-BASE Kps REDOX) QUÍMICA GENERAL II OTOÑO 2012
 SEMINARIOS (ÁCIDO-BASE Kps REDOX) QUÍMICA GENERAL II OTOÑO 2012 I. EQUILIBRIO ÁCIDO-BASE 1. Para las siguientes compuestos: NaCl, NaOH, HCl, CH 3 COOH, NH 3, FeCl 3, Na 2 CO 3, H 3 PO 4 : a) Clasifíquelos
SEMINARIOS (ÁCIDO-BASE Kps REDOX) QUÍMICA GENERAL II OTOÑO 2012 I. EQUILIBRIO ÁCIDO-BASE 1. Para las siguientes compuestos: NaCl, NaOH, HCl, CH 3 COOH, NH 3, FeCl 3, Na 2 CO 3, H 3 PO 4 : a) Clasifíquelos
REACCIONES DE PRECIPITACIÓN
 TEMA 12 REACCIONES DE PRECIPITACIÓN Las reacciones de disolución/precipitación en las que un sólido pasa a la disolución o viceversa afectan profundamente la ecología de ríos, lagos y océanos ya que controlan
TEMA 12 REACCIONES DE PRECIPITACIÓN Las reacciones de disolución/precipitación en las que un sólido pasa a la disolución o viceversa afectan profundamente la ecología de ríos, lagos y océanos ya que controlan
2º de Bachillerato EQUILIBRIOS DE SOLUBILIDAD
 º de Bachillerato EQUILIBRIOS DE SOLUBILIDAD Indice 1. Equilibrios heterogéneos.. Solubilidad. Reglas de solubilidad. 3. Reacciones de precipitación. 4. Producto de solubilidad. 5. Factores que modifican
º de Bachillerato EQUILIBRIOS DE SOLUBILIDAD Indice 1. Equilibrios heterogéneos.. Solubilidad. Reglas de solubilidad. 3. Reacciones de precipitación. 4. Producto de solubilidad. 5. Factores que modifican
M M M M S. Precipitación selectiva: V F Equilibrio. Inicio. % de solubilidad límite:
 M N 0 0 M N sat eq M M Total M N N Total % de solubilidad límite: V 0 Inicio VF % SL 100 V % de precipitación límite: 0 0 M M sat 0 0 % PL 100 % SL V F Equilibrio M M S eq sat V 0 N N eq 0 V F M Si logramos
M N 0 0 M N sat eq M M Total M N N Total % de solubilidad límite: V 0 Inicio VF % SL 100 V % de precipitación límite: 0 0 M M sat 0 0 % PL 100 % SL V F Equilibrio M M S eq sat V 0 N N eq 0 V F M Si logramos
BLOQUE 3 (segunda parte) Profesor: Mª del Carmen Clemente Jul
 BLOQUE (segunda parte) Profesor: Mª del Carmen Clemente Jul DISOLUCIONES REGULADORAS: ÁCIDO DÉBIL Y SU SAL PREPARACIÓN: NaAc HCl NaAc exc HAc NaCl TAMPÓN HCOOCH COOCH (-) H () NaCOOCH Na CH -COO (-) H
BLOQUE (segunda parte) Profesor: Mª del Carmen Clemente Jul DISOLUCIONES REGULADORAS: ÁCIDO DÉBIL Y SU SAL PREPARACIÓN: NaAc HCl NaAc exc HAc NaCl TAMPÓN HCOOCH COOCH (-) H () NaCOOCH Na CH -COO (-) H
REACCIONES DE TRANSFERENCIA DE PROTONES ELECTROLITOS
 REACCIONES DE TRANSFERENCIA DE PROTONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA ELECTROLITOS Un electrolito es una sustancia que al disolverse en agua experimenta una disociación (o ionización) total
REACCIONES DE TRANSFERENCIA DE PROTONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA ELECTROLITOS Un electrolito es una sustancia que al disolverse en agua experimenta una disociación (o ionización) total
ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 a.- b.- c.- d.- Datos.- Julio 2017; Opción A; Problema 4 a M b % Datos.
 ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 Justifique si las siguientes afirmaciones son verdaderas o falsas: a.- La mezcla de 10 ml de HCl 0,1 M con 20 ml de NaOH 0,1 M será una disolución neutra. F
ÁCIDO BASE. Julio 2017; Opción B; Cuestión 3 Justifique si las siguientes afirmaciones son verdaderas o falsas: a.- La mezcla de 10 ml de HCl 0,1 M con 20 ml de NaOH 0,1 M será una disolución neutra. F
Tema II (segunda parte).equilibrios de solubilidad IES As Telleiras
 REACCIONES DE PRECIPITACIÓN Solubilidad y precipitación Cuando se van añadiendo cantidades sucesivas de un sólido ( soluto) a un disolvente a una determinada temperatura, se alcanza un punto en que ya
REACCIONES DE PRECIPITACIÓN Solubilidad y precipitación Cuando se van añadiendo cantidades sucesivas de un sólido ( soluto) a un disolvente a una determinada temperatura, se alcanza un punto en que ya
GUÍA DE EJERCICIOS N 4: Ácido-base, neutralización y buffer. 1.- Defina los ácidos y bases según las teorías ácido-base de Arrhenius y Brönsted-Lowry
 1 GUÍA DE EJERCICIOS N 4: Ácido-base, neutralización y buffer PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los ácidos y bases según las teorías ácido-base de Arrhenius y Brönsted-Lowry 2.- Defina
1 GUÍA DE EJERCICIOS N 4: Ácido-base, neutralización y buffer PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los ácidos y bases según las teorías ácido-base de Arrhenius y Brönsted-Lowry 2.- Defina
CARACTERÍSTICAS ÁCIDOS: BASES:
 EQUILIBRIO IÓNICO CARACTERÍSTICAS ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
EQUILIBRIO IÓNICO CARACTERÍSTICAS ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
CÁLCULOS SOBRE PREPARACIÓN DE SOLUCIONES Y EXPRESIÓN DE RESULTADOS
 CÁLCULOS SOBRE PREPARACIÓN DE SOLUCIONES Y EXPRESIÓN DE RESULTADOS 1- Calcule el número de moles presentes en cada uno de los siguientes ejemplos: a) 148,2 g de Ca(HO) 2 b) 50 g de CuSO 4.5 H 2 O c) 57
CÁLCULOS SOBRE PREPARACIÓN DE SOLUCIONES Y EXPRESIÓN DE RESULTADOS 1- Calcule el número de moles presentes en cada uno de los siguientes ejemplos: a) 148,2 g de Ca(HO) 2 b) 50 g de CuSO 4.5 H 2 O c) 57
Principio del producto de solubilidad
 Pricipio del producto de solubilidad 13.1. Cocepto de precipitació y solubilidad 13.1.1. Equilibrio de precipitació 13.2. Solubilidad y producto de solubilidad 13.3. Factores que afecta a la solubilidad
Pricipio del producto de solubilidad 13.1. Cocepto de precipitació y solubilidad 13.1.1. Equilibrio de precipitació 13.2. Solubilidad y producto de solubilidad 13.3. Factores que afecta a la solubilidad
Equilibrio en Soluciones Acuosas
 Equilibrio en Soluciones Acuosas Contenido I Pág. 1. Equilibrio en Soluciones Acuosas (Resumen) 1 1.1. Propiedades Electrolíticas 1 1.2. Compuestos iónicos en agua 2 1.3. Compuestos moleculares en agua
Equilibrio en Soluciones Acuosas Contenido I Pág. 1. Equilibrio en Soluciones Acuosas (Resumen) 1 1.1. Propiedades Electrolíticas 1 1.2. Compuestos iónicos en agua 2 1.3. Compuestos moleculares en agua
8. Equilibrios de solubilidad y de formación de complejos
 8. Equilibrios de solubilidad y de formación de complejos Química (1S, Grado Biología) UAM 8. Equilibrios de solubilidad y de formación de complejos Contenidos Equilibrios de solubilidad Solubilidad Producto
8. Equilibrios de solubilidad y de formación de complejos Química (1S, Grado Biología) UAM 8. Equilibrios de solubilidad y de formación de complejos Contenidos Equilibrios de solubilidad Solubilidad Producto
Equilibrio Químico. Aspectos Teóricos
 Equilibrio Químico Aspectos Teóricos 4.1 Introducción En los problemas de cálculos estequiométricos tratados en el tema 1, hemos supuesto que las reacciones químicas se detienen cuando uno o más reactivos
Equilibrio Químico Aspectos Teóricos 4.1 Introducción En los problemas de cálculos estequiométricos tratados en el tema 1, hemos supuesto que las reacciones químicas se detienen cuando uno o más reactivos
CAPÍTULO 1: DISOLVENTES, DISOLUCIONES Y ELECTROLITOS...
 Índice CAPÍTULO 1: DISOLVENTES, DISOLUCIONES Y ELECTROLITOS... 11 1.1. INTRODUCCIÓN... 11 1.2. DISOLUCIONES... 11 1.2.a. Clases de disolventes y propiedades... 12 1.2.a.1. Disolventes ionizantes... 12
Índice CAPÍTULO 1: DISOLVENTES, DISOLUCIONES Y ELECTROLITOS... 11 1.1. INTRODUCCIÓN... 11 1.2. DISOLUCIONES... 11 1.2.a. Clases de disolventes y propiedades... 12 1.2.a.1. Disolventes ionizantes... 12
QUÍMICA 2º Bachillerato Ejercicios: Reacciones Ácido Base
 1(8) Ejercicio nº 1 Completa las siguientes reacciones ácido-base, indicando qué especies químicas son el ácido y la base, y cuáles sus conjugados: a) HA + B b) HCl + NH 3 c) HNO 3 + H 2 O Ejercicio nº
1(8) Ejercicio nº 1 Completa las siguientes reacciones ácido-base, indicando qué especies químicas son el ácido y la base, y cuáles sus conjugados: a) HA + B b) HCl + NH 3 c) HNO 3 + H 2 O Ejercicio nº
PRACTICA N 4 REACCIONES QUÍMICAS
 PRACTICA N 4 REACCIONES QUÍMICAS I. OBJETIVO GENERAL Adquirir las destrezas necesaria en la realización de reacciones químicas sencillas. II. OBJETIVOS ESPECÍFICOS Al finalizar la práctica el estudiante
PRACTICA N 4 REACCIONES QUÍMICAS I. OBJETIVO GENERAL Adquirir las destrezas necesaria en la realización de reacciones químicas sencillas. II. OBJETIVOS ESPECÍFICOS Al finalizar la práctica el estudiante
Tema 7: Solubilidad. (Fundamentos de Química, Grado en Física) Equilibrio químico Enero Mayo, 2011 1 / 24
 Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 2
 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 2 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: QUIMICA INORGANICA EQUILIBRIO QUIMICO 1 SEMANAS
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 2 NOMBRE DE LA ASIGNATURA: TÍTULO: DURACIÓN: BIBLIOGRAFÍA SUGERIDA: QUIMICA INORGANICA EQUILIBRIO QUIMICO 1 SEMANAS
TEMA 6. ÁCIDOS Y BASES
 TEMA 6. ÁCIDOS Y BASES 9.1) Responda a las siguientes cuestiones: a) Defina el concepto de ácido y base según la teoría de Arrhenius. b) Clasifique, según la definición anterior, las siguientes especies,
TEMA 6. ÁCIDOS Y BASES 9.1) Responda a las siguientes cuestiones: a) Defina el concepto de ácido y base según la teoría de Arrhenius. b) Clasifique, según la definición anterior, las siguientes especies,
Tema Equilibrio Heterogéneo Factores que modifican la solubilidad
 Tema Equilibrio Heterogéneo Factores que modifican la solubilidad Generales De Equilibrio Precipitación Fraccionada o diferencial Curvas de valoracion Metodos utilizados según deteccion punto final Mohr
Tema Equilibrio Heterogéneo Factores que modifican la solubilidad Generales De Equilibrio Precipitación Fraccionada o diferencial Curvas de valoracion Metodos utilizados según deteccion punto final Mohr
8. Equilibrios de solubilidad y de formación de complejos. Química (1S, Grado Biología) UAM 8. Equilibrios de solubilidad y de formación de complejos
 8. Equilibrios de solubilidad y de formación de complejos Contenidos Equilibrios de solubilidad Solubilidad Producto de solubilidad Equilibrios de formación de iones complejos Bibliografía recomendada
8. Equilibrios de solubilidad y de formación de complejos Contenidos Equilibrios de solubilidad Solubilidad Producto de solubilidad Equilibrios de formación de iones complejos Bibliografía recomendada
QUÍMICA ANALÍTICA I. Etapa analítica. Análisis Gravimétrico
 QUÍMICA ANALÍTICA I Etapa analítica Análisis Gravimétrico Análisis Gravimétrco Se basa en las medidas de masa. Requiere fundamentalmente dos medidas experimentales: Peso de la muestra analizada. Peso del
QUÍMICA ANALÍTICA I Etapa analítica Análisis Gravimétrico Análisis Gravimétrco Se basa en las medidas de masa. Requiere fundamentalmente dos medidas experimentales: Peso de la muestra analizada. Peso del
Capítulo 5: Equilibrio químico
 Capítulo 5: Equilibrio químico ACTIVIDADES DE RECAPITULACIÓN 1. Explica brevemente el significado de los siguientes conceptos: a) Velocidad de reacción. b) Ecuación cinética de velocidad. c) Energía de
Capítulo 5: Equilibrio químico ACTIVIDADES DE RECAPITULACIÓN 1. Explica brevemente el significado de los siguientes conceptos: a) Velocidad de reacción. b) Ecuación cinética de velocidad. c) Energía de
IES RIBERA DE CASTILLA UNIDAD 4 EQUILIBRIOS ÁCIDO BASE OBJETIVOS
 UNIDAD 4 EQUILIBRIOS ÁCIDOBASE OBJETIVOS Disoluciones de compuestos iónicos. Ionización. Electrólitos Ácidos y bases. Propiedades generales. Teoría de Arrhenius. El ión hidronio. Neutralización. Teoría
UNIDAD 4 EQUILIBRIOS ÁCIDOBASE OBJETIVOS Disoluciones de compuestos iónicos. Ionización. Electrólitos Ácidos y bases. Propiedades generales. Teoría de Arrhenius. El ión hidronio. Neutralización. Teoría
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO
 Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. En un recipiente de 10,0 L se introducen 0,61 moles de CO 2 y 0,39 moles de H 2 calentando hasta 1250 ºC. Una vez alcanzado
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. En un recipiente de 10,0 L se introducen 0,61 moles de CO 2 y 0,39 moles de H 2 calentando hasta 1250 ºC. Una vez alcanzado
Disoluciones. Tema 8. Una disolución es una mezcla homogénea de dos o más sustancias. disolución
 Disoluciones Tema 8 Química General e Inorgánica A Una disolución es una mezcla homogénea de dos o más sustancias disolución soluto disolvente El soluto es la sustancia que se encuentra en menor cantidad
Disoluciones Tema 8 Química General e Inorgánica A Una disolución es una mezcla homogénea de dos o más sustancias disolución soluto disolvente El soluto es la sustancia que se encuentra en menor cantidad
Problemas resueltos de Solubilidad
 Problemas resueltos de Solubilidad Cálculo de conociendo s. Al disolver en un litro de agua 2,0 10 moles de se produce una disolución saturada. Cuál es la del compuesto? El dato que da el problema es la
Problemas resueltos de Solubilidad Cálculo de conociendo s. Al disolver en un litro de agua 2,0 10 moles de se produce una disolución saturada. Cuál es la del compuesto? El dato que da el problema es la
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES
 TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
PRÁCTICA 18 EQUILIBRIOS DE SOLUBILIDAD. ESTIMACIÓN DEL PRODUCTO DE SOLUBILIDAD DEL HIDRÓXIDO DE ZINC.
 PRÁCTICA 18 EQUILIBRIOS DE SOLUBILIDAD. ESTIMACIÓN DEL PRODUCTO DE SOLUBILIDAD DEL HIDRÓXIDO DE ZINC. OBJETIVOS Determinar experimentalmente si se forma o no un determinado compuesto insoluble. Determinar
PRÁCTICA 18 EQUILIBRIOS DE SOLUBILIDAD. ESTIMACIÓN DEL PRODUCTO DE SOLUBILIDAD DEL HIDRÓXIDO DE ZINC. OBJETIVOS Determinar experimentalmente si se forma o no un determinado compuesto insoluble. Determinar
PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES
 PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES 2015 1) a) A 25 ºC la constante de basicidad del NH 3 es 1,8 10 5. Si se tiene una disolución 0,1 M, calcula el grado de disociación. b) Calcula la concentración
PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES 2015 1) a) A 25 ºC la constante de basicidad del NH 3 es 1,8 10 5. Si se tiene una disolución 0,1 M, calcula el grado de disociación. b) Calcula la concentración
EQUILIBRIOS DE SOLUBILIDAD
 EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS PROBLEMA 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene, 10 5 moles por litro de ion fosfato. Calcula el producto de solubilidad
EQUILIBRIOS DE SOLUBILIDAD EJERCICIOS Y PROBLEMAS RESUELTOS PROBLEMA 1.- Una disolución saturada de tetraoxofosfato (V) de plata, contiene, 10 5 moles por litro de ion fosfato. Calcula el producto de solubilidad
GUÍA DE EJERCICIOS ADICIONALES N 2 Acido-base, neutralización y buffer
 1 GUÍA DE EJERCICIOS ADICIONALES N 2 Acido-base, neutralización y buffer 1.- Un ácido según la teoría de Arrhenius es aquella sustancia que: a) Libera uno o más iones hidroxilos (OH - ) por cada molécula
1 GUÍA DE EJERCICIOS ADICIONALES N 2 Acido-base, neutralización y buffer 1.- Un ácido según la teoría de Arrhenius es aquella sustancia que: a) Libera uno o más iones hidroxilos (OH - ) por cada molécula
Acuerdo 286. Química. Disoluciones. Recopiló: M.C. Macaria Hernández Chávez
 Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Acuerdo 286 Química Disoluciones Recopiló: M.C. Macaria Hernández Chávez Disolución: Es una mezcla homogénea de dos o más sustancias. La sustancia que se encuentra en mayor proporción se llama disolvente
Reacciones de transferencia de protones
 Reacciones de transferencia de protones Electrolito Es toda sustancia que, disuelta en agua, hace que la disolución conduzca la electricidad. Se debe a que el electrolito se disocia en iones: AB A + (aq)
Reacciones de transferencia de protones Electrolito Es toda sustancia que, disuelta en agua, hace que la disolución conduzca la electricidad. Se debe a que el electrolito se disocia en iones: AB A + (aq)
Reacciones de precipitación
 Reacciones de precipitación Criterios de evaluación Aplicar el concepto de equilibrio químico para predecir la evolución de un sistema y resolver problemas de equilibrios homogéneos, en particular en reacciones
Reacciones de precipitación Criterios de evaluación Aplicar el concepto de equilibrio químico para predecir la evolución de un sistema y resolver problemas de equilibrios homogéneos, en particular en reacciones
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE
 A 1000 º C, K p = 1,65 atm para la reacción CO 2 (g) + C (s) 2 CO (g). Si en el equilibrio la presión total es de 5 atm, calcula el tanto por ciento de dióxido de carbono que ha reaccionado. J 01 A 800
A 1000 º C, K p = 1,65 atm para la reacción CO 2 (g) + C (s) 2 CO (g). Si en el equilibrio la presión total es de 5 atm, calcula el tanto por ciento de dióxido de carbono que ha reaccionado. J 01 A 800
LABORATORIO N 3 SOLUCIONES ACIDO-BASE Y BUFFER
 LABORATORIO N 3 SOLUCIONES ACIDO-BASE Y BUFFER 1.- INTRODUCCIÓN Soluciones Ácido-Base Los solutos disueltos en agua pueden clasificarse como electrolitos y no electrolitos en función de su capacidad de
LABORATORIO N 3 SOLUCIONES ACIDO-BASE Y BUFFER 1.- INTRODUCCIÓN Soluciones Ácido-Base Los solutos disueltos en agua pueden clasificarse como electrolitos y no electrolitos en función de su capacidad de
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE
 A 1000 º C, K p = 1,65 atm para la reacción CO 2 (g) + C (s) 2 CO (g). Si en el equilibrio la presión total es de 5 atm, calcula el tanto por ciento de dióxido de carbono que ha reaccionado. J 01 A 800
A 1000 º C, K p = 1,65 atm para la reacción CO 2 (g) + C (s) 2 CO (g). Si en el equilibrio la presión total es de 5 atm, calcula el tanto por ciento de dióxido de carbono que ha reaccionado. J 01 A 800
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
TEMA 5: REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule
Reacciones Ácido Base
 Reacciones Ácido Base Prof. Sergio Casas-Cordero E. sacce Contenido: (parte uno) 1. Definiciones 2. Equilibrio iónico del agua 3. Potencial de acidez; escala de ph 4. Fuerza de ácidos y bases 5. Medición
Reacciones Ácido Base Prof. Sergio Casas-Cordero E. sacce Contenido: (parte uno) 1. Definiciones 2. Equilibrio iónico del agua 3. Potencial de acidez; escala de ph 4. Fuerza de ácidos y bases 5. Medición
Solución [ ] [ ] = = = 2HI(g) Solución = = = = =
![Solución [ ] [ ] = = = 2HI(g) Solución = = = = = Solución [ ] [ ] = = = 2HI(g) Solución = = = = =](/thumbs/75/72390855.jpg) + 2 2 3 1 [ 2 ] [ 2 ] 1 [ 3 ] = = = 3 2 2 3 2HI(g) [ ] [ ] 1 2 1 3 = = 3 2 [ 2 ] [ 2 ] 1 [ ] = = = 2 [ ] [ ] 2 v = k A B k = Ae Ea RT = [ ][ ] k = Ae Ea RT v = k [ A] v = k A B [ ][ ] k = Ae Ea RT C 2H
+ 2 2 3 1 [ 2 ] [ 2 ] 1 [ 3 ] = = = 3 2 2 3 2HI(g) [ ] [ ] 1 2 1 3 = = 3 2 [ 2 ] [ 2 ] 1 [ ] = = = 2 [ ] [ ] 2 v = k A B k = Ae Ea RT = [ ][ ] k = Ae Ea RT v = k [ A] v = k A B [ ][ ] k = Ae Ea RT C 2H
Reacciones de transferencia de protones
 Reacciones de transferencia de protones Electrolito Es toda sustancia que, disuelta en agua, hace que la disolución conduzca la electricidad. Se debe a que el electrolito se disocia en iones: AB A + (aq)
Reacciones de transferencia de protones Electrolito Es toda sustancia que, disuelta en agua, hace que la disolución conduzca la electricidad. Se debe a que el electrolito se disocia en iones: AB A + (aq)
OPCIÓN A. S = 4 = 4, moles L 1.
 OPCIÓN A CUESTIÓN 1.- a) Razona con los correspondientes equilibrios en disolución acuosa si las siguientes especies tienen carácter ácido, básico o anfótero: ion hidrogenocarbonato, ion hidrogenosulfuro
OPCIÓN A CUESTIÓN 1.- a) Razona con los correspondientes equilibrios en disolución acuosa si las siguientes especies tienen carácter ácido, básico o anfótero: ion hidrogenocarbonato, ion hidrogenosulfuro
DISOLUCION DE PIEZAS DENTALES
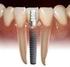 DISOLUCION DE PIEZAS DENTALES Agua ph=7 T 20 C 1. Cuanto dura la pieza dental en contacto con agua? 2. Cuales serian los factores que determinan que se solubilice? 3. En que condiciones se disuelve en
DISOLUCION DE PIEZAS DENTALES Agua ph=7 T 20 C 1. Cuanto dura la pieza dental en contacto con agua? 2. Cuales serian los factores que determinan que se solubilice? 3. En que condiciones se disuelve en
HOJA DE PROBLEMAS 7: ENUNCIADOS
 Tema: ÁCIDOS Y BASES HOJA DE PROBLEMAS 7: ENUNCIADOS 1. ( ) Calcular el ph de las siguientes disoluciones: a) ácido clorhídrico 0,2 N; b) ácido sulfúrico 0,05 M. 2. ( ) Calcular el ph de una disolución
Tema: ÁCIDOS Y BASES HOJA DE PROBLEMAS 7: ENUNCIADOS 1. ( ) Calcular el ph de las siguientes disoluciones: a) ácido clorhídrico 0,2 N; b) ácido sulfúrico 0,05 M. 2. ( ) Calcular el ph de una disolución
QUIMICA GENERAL GUIA DE EJERCICIOS Nº4 Soluciones Ácido-base. 1.- Defina los ácidos y bases según las teorías ácido base que usted conoce.
 1 QUIMICA GENERAL GUIA DE EJERCICIOS Nº4 Soluciones Ácido-base PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los ácidos y bases según las teorías ácido base que usted conoce. 2.- Defina el ph y poh.
1 QUIMICA GENERAL GUIA DE EJERCICIOS Nº4 Soluciones Ácido-base PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los ácidos y bases según las teorías ácido base que usted conoce. 2.- Defina el ph y poh.
4. SÓLIDOS EN CONTACTO CON AGUAS NATURALES
 1 4. SÓLIDOS EN CONTACTO CON AGUAS NATURALES 4.1 INTRODUCCIÓN... 2 4.2 EQUILIBRIOS EN FASE SÓLIDA... 4 4.2.1. PRODUCTO DE SOLUBILIDAD... 5 4.2.2 EFECTO DEL IÓN COMÚN... 6 4.3 SOLUBILIDAD DE ÓXIDOS E HIDRÓXIDOS
1 4. SÓLIDOS EN CONTACTO CON AGUAS NATURALES 4.1 INTRODUCCIÓN... 2 4.2 EQUILIBRIOS EN FASE SÓLIDA... 4 4.2.1. PRODUCTO DE SOLUBILIDAD... 5 4.2.2 EFECTO DEL IÓN COMÚN... 6 4.3 SOLUBILIDAD DE ÓXIDOS E HIDRÓXIDOS
Tema 6: Equilibrio ácido-base
 Tema 6: Equilibrio ácido-base Equilibrios en disolución. Producto iónico del agua. Disoluciones neutras, ácidas y básicas. Concepto de ph. Modelos ácido-base. Ácidos y bases fuertes y débiles: K a y K
Tema 6: Equilibrio ácido-base Equilibrios en disolución. Producto iónico del agua. Disoluciones neutras, ácidas y básicas. Concepto de ph. Modelos ácido-base. Ácidos y bases fuertes y débiles: K a y K
,1752'8&&,21. Ag +, Fe 2+, Cu 2+, Al 3+ HCl. AgCl Fe 2+, Cu 2+, Al 3+ NH 3. Al(OH) 3 Fe 2+, Cu 2+ NaOH. Cu 2+ (Cu(NH 3.
 (48,/,%5,26'(35(&,3,7$&,21,1752'8&&,21 62/8%,/,'$'
(48,/,%5,26'(35(&,3,7$&,21,1752'8&&,21 62/8%,/,'$'
QUÍMICA ANALÍTICA I. Etapa analítica. Contenidos. Análisis volumétrico: Titulaciones complejométricas
 QUÍMICA ANALÍTICA I Etapa analítica Análisis volumétrico: Titulaciones complejométricas Contenidos Aspectos generales de las volumetrías por formación de complejos Requisitos de la reacción Cálculos volumétricos
QUÍMICA ANALÍTICA I Etapa analítica Análisis volumétrico: Titulaciones complejométricas Contenidos Aspectos generales de las volumetrías por formación de complejos Requisitos de la reacción Cálculos volumétricos
EQUILIBRIO QUIMICO E IONICO
 EQUILIBRIO QUIMICO E IONICO RECORDATORIO: Escribir la ecuación química balanceada. Las concentraciones deben estar expresadas en MOLARIDAD, si no es así se deben calcular. Plantear las concentraciones
EQUILIBRIO QUIMICO E IONICO RECORDATORIO: Escribir la ecuación química balanceada. Las concentraciones deben estar expresadas en MOLARIDAD, si no es así se deben calcular. Plantear las concentraciones
Gravimetría. Se basa en las medidas de masa donde requiere fundamentalmente dos medidas experimentales
 Gravimetría Se basa en las medidas de masa donde requiere fundamentalmente dos medidas experimentales peso de la muestra analizada peso del analito o de una sustancia de composición química conocida que
Gravimetría Se basa en las medidas de masa donde requiere fundamentalmente dos medidas experimentales peso de la muestra analizada peso del analito o de una sustancia de composición química conocida que
QUÍMICA 2º BACHILLERATO SOLUCIONES EQUILIBRIO ÁCIDO - BASE. / NH 3 ; HCl / Cl ; CH 3 COOH / CH 3 COO. 14.-/ a) ph = 1 b) ph = 2 c) ph = 13 d) ph = 12
 SOLUCIONES EQUILIBRIO ÁCIDO - BASE HOJA Nº 11 1.-/ α = 2,19 10-3 % 2.-/ c = 3,6 10-4 M. 3.-/ a) 7,15 10-3 M b) ph = 3,46 c) α = 4,89 % 4.-/ ph = 2,41 5.-/ K a = 1,77 10-5 6.-/ a) K a = 1,76 10-5 b) ph
SOLUCIONES EQUILIBRIO ÁCIDO - BASE HOJA Nº 11 1.-/ α = 2,19 10-3 % 2.-/ c = 3,6 10-4 M. 3.-/ a) 7,15 10-3 M b) ph = 3,46 c) α = 4,89 % 4.-/ ph = 2,41 5.-/ K a = 1,77 10-5 6.-/ a) K a = 1,76 10-5 b) ph
HOJA DE TRABAJO No. 10 DISOLUCIONES PESO EQUIVALENTE
 HOJA DE TRABAJO No. 10 DISOLUCIONES PESO EQUIVALENTE 1. Realice los cálculos necesarios para llenar el siguiente cuadro (asuma neutralización completa para ácidos y bases): HNO 2 H 4 P 2 O 7 Al(OH) 3 Ba(OH)
HOJA DE TRABAJO No. 10 DISOLUCIONES PESO EQUIVALENTE 1. Realice los cálculos necesarios para llenar el siguiente cuadro (asuma neutralización completa para ácidos y bases): HNO 2 H 4 P 2 O 7 Al(OH) 3 Ba(OH)
6,5408 ml i. básica, neutro, ácido, básico i. Kb=0, , ph=12,176 i M ii. ph=11,377 i. NaOH i ii. 4,597 %
 ÁCIDO BASE 1. Se toman 20 ml de una disolución de 4,0 M de Ca(OH)2 y se les añade agua hasta obtener 100 ml de disolución. Calcule los ml de ácido clorhídrico del 25% en peso y de 1,12 g/ml de densidad
ÁCIDO BASE 1. Se toman 20 ml de una disolución de 4,0 M de Ca(OH)2 y se les añade agua hasta obtener 100 ml de disolución. Calcule los ml de ácido clorhídrico del 25% en peso y de 1,12 g/ml de densidad
ÁCIDOS Y BASES: DEFINICIÓN Y DISOLUCIONES. CONCEPTO DE ph.
 UNIDAD 4 PROCESOS DE EQUILIBRIO ÁCIDOS Y BASES: DEFINICIÓN Y DISOLUCIONES. CONCEPTO DE ph. Un ácido es una sustancia que, al ser añadida al agua, produce iones hidrógeno (H + ) /hidronio (H 3 O + ). Una
UNIDAD 4 PROCESOS DE EQUILIBRIO ÁCIDOS Y BASES: DEFINICIÓN Y DISOLUCIONES. CONCEPTO DE ph. Un ácido es una sustancia que, al ser añadida al agua, produce iones hidrógeno (H + ) /hidronio (H 3 O + ). Una
Normalidad (definición, problemas y estequiometría), fracción molar, molalidad e interconversión de unidades. Química General II 2011
 Normalidad (definición, problemas y estequiometría), fracción molar, molalidad e interconversión de unidades. Química General II 2011 Normalidad Unidad de concentración del soluto en una disolución. No
Normalidad (definición, problemas y estequiometría), fracción molar, molalidad e interconversión de unidades. Química General II 2011 Normalidad Unidad de concentración del soluto en una disolución. No
Reacciones de transferencia de protones Ácidos y bases
 Tema 6 Reacciones de transferencia de protones Ácidos y bases Probablemente no haya otro tipo de equilibrio tan importante con el de ácidos y bases B. M. Mahan y R. J. Myers Química. Curso Universitario
Tema 6 Reacciones de transferencia de protones Ácidos y bases Probablemente no haya otro tipo de equilibrio tan importante con el de ácidos y bases B. M. Mahan y R. J. Myers Química. Curso Universitario
Capítulo 16 Equilbrio Iónico Acuoso
 apítulo 16 Equilbrio Iónico Acuoso Adaptado por: Ileana Nieves Martínez opyright 011 Pearson Education, Inc. Amortiguadores Amortiguador o Buffers Soluciones que resisten ph cuando se añade ácido base
apítulo 16 Equilbrio Iónico Acuoso Adaptado por: Ileana Nieves Martínez opyright 011 Pearson Education, Inc. Amortiguadores Amortiguador o Buffers Soluciones que resisten ph cuando se añade ácido base
Características ÁCIDOS: BASES:
 ÁCIDOS Y BASES Características ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
ÁCIDOS Y BASES Características ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
Septiembre ) Sabiendo que las reacciones indicadas se producen espontáneamente (en el sentido de izquierda a derecha) H 2 SO 4 + H 2 O HSO 4
 Ejercicios PAU sobre acidez y disociaciones Septiembre 2012 1) Sabiendo que las reacciones indicadas se producen espontáneamente (en el sentido de izquierda a derecha) H 2 SO 4 + H 2 O HSO 4 + H 3 O +
Ejercicios PAU sobre acidez y disociaciones Septiembre 2012 1) Sabiendo que las reacciones indicadas se producen espontáneamente (en el sentido de izquierda a derecha) H 2 SO 4 + H 2 O HSO 4 + H 3 O +
Reacciones ácido-base: equilibrios cotidianos. Prof: Mario Azan
 Reacciones ácido-base: equilibrios cotidianos Prof: Mario Azan Diferenciando ácidos y bases Indicadores ácido-base Extracto vegetal, el cual adquiere dos colores claramente diferenciados según se encuentre
Reacciones ácido-base: equilibrios cotidianos Prof: Mario Azan Diferenciando ácidos y bases Indicadores ácido-base Extracto vegetal, el cual adquiere dos colores claramente diferenciados según se encuentre
V solución Ba(II) + V solución ion sulfato = V total 15 ml + 20 ml = 35 ml. Esta sal se disocia completamente y por lo tanto la [ Ba 2+ ] = 4,3 10-4 M
![V solución Ba(II) + V solución ion sulfato = V total 15 ml + 20 ml = 35 ml. Esta sal se disocia completamente y por lo tanto la [ Ba 2+ ] = 4,3 10-4 M V solución Ba(II) + V solución ion sulfato = V total 15 ml + 20 ml = 35 ml. Esta sal se disocia completamente y por lo tanto la [ Ba 2+ ] = 4,3 10-4 M](/thumbs/40/21002473.jpg) Compuestos Poco Solubles 227 17. Determinar cuanto precipitado se formará al mezclar 15 ml de BaCl 2 0,001 M con 20 ml de Na 2 SO 4 0,009 M. Calcule, además las concentraciones de los iones en solución.
Compuestos Poco Solubles 227 17. Determinar cuanto precipitado se formará al mezclar 15 ml de BaCl 2 0,001 M con 20 ml de Na 2 SO 4 0,009 M. Calcule, además las concentraciones de los iones en solución.
