Profesora: Teresa Esparza Araña LA CANTIDAD DE SUSTANCIA EN QUÍMICA. UNIDAD 5: La cantidad de sustancia. El mol
|
|
|
- Salvador Lozano Sáez
- hace 7 años
- Vistas:
Transcripción
1 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla LA CANTIDAD DE SUSTANCIA EN QUÍMICA UNIDAD 5: La cantidad de sustancia. El mol
2
3 CLASIFICACIÓN DE LA MATERIA Las unidades más pequeñas que constituyen los elementos son los átomos y una agrupación de átomos (de igual o diferente tipo) forman una molécula. Una molécula se caracteriza porque mantiene íntegras todas las propiedades de la sustancia original. La materia está formada por combinaciones de moléculas y/o átomos, y en ocasiones nos encontramos un solo tipo de molécula o átomo en determinadas sustancias. Atendiendo a esto, la materia se clasifica en: Sustancias puras, cada una de las cuales tiene una composición fija y un único conjunto de propiedades. Mezclas, compuestas de dos o más sustancias puras. Las sustancias puras pueden ser elementos o compuestos, mientras que las mezclas pueden ser homogéneas o heterogéneas: Mezclas: Una mezcla es una porción de materia formada por dos o más componentes. Nos podemos encontrar con dos tipos de mezclas. a. Mezclas homogéneas (disoluciones): Se caracterizan por estar formadas por dos o más componentes que no se pueden distinguir visualmente. Otros ejemplos: agua +alcohol; latón (cobre +cinc); aire Las mezclas homogéneas presentan las mismas propiedades en todas sus partes. b. Mezclas heterogéneas: Se caracterizan por estar formadas por dos o más porciones fácilmente distinguibles a simple vista. Otros ejemplos: Gasolina +agua ; arena +sal; granito 1
4 En las mezclas heterogéneas, las propiedades varían de una parte a otra de la muestra. En general, los componentes de una mezcla pueden hallarse en cualquier proporción, y se pueden recuperar empleando métodos físicos de separación. Sustancias puras: Una sustancia pura es una porción de materia que está formada por un solo tipo de partícula (átomos o moléculas) y por ello, tiene las mismas propiedades en todas sus partes. Las propiedades físicas características, densidad, temperatura de fusión, temperatura de ebullición, etc. permanecen invariables en todas sus partes. Las sustancias puras se pueden clasificar en: a. Elementos: Son sustancias puras que no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Ejemplos: Todos los elementos de la tabla periódica: Oxígeno, hierro, carbono, sodio, cloro, cobre, etc. Se representan mediante su símbolo químico. b. Compuestos: Son sustancias puras formadas por dos o más elementos y pueden descomponerse en éstos empleando procedimientos químicos. Ejemplos: Agua (H 2O), azúcar (C 6H 12O 6), sulfuro de hierro (II) (FeS),... 2
5 MASA ATÓMICA Y MASA MOLECULAR Es fácil contar los garbanzos que hay en un puñado. Para contar los granos que hay en una taza de arroz, hay que tener más paciencia. Con una balanza de las que se utilizan en casa puede que no podamos medir la masa de un garbanzo, pero si suponemos que todos los garbanzos tienen la misma masa, podemos pesar un puñado de garbanzos, contarlos y dividir la masa del puñado entre el número de garbanzos y, así, sabríamos cuánto pesa un sólo garbanzo. El mismo razonamiento se utiliza en Química para calcular cantidades de sustancia. Cómo se mide la masa de los átomos? Es imposible contar las moléculas que hay en un vaso de agua. También es imposible contar los átomos que hay en una viga de hierro. Los átomos son extraordinariamente pequeños y su masa, en consecuencia, es pequeñísima. Tanto que si usamos como unidad para medirla las unidades de masa a las que estamos acostumbrados, obtendríamos valores muy pequeños, difícilmente manejables. Por ejemplo, el átomo de hidrógeno tiene una masa de 1, kg y el de carbono 2, kg. Por esta razón para medir la masa de los átomos se adopta una nueva unidad: la unidad de masa atómica (uma o u) La uma se define de la siguiente manera: Consideremos un átomo del isótopo más abundante de C: el 12 C, lo dividimos en doce partes iguales y tomamos una de ellas. La masa de esta parte sería la unidad de masa atómica. Unidad de masa atómica 1/12 parte del átomo de 12 C (1, kg) Considerando esta nueva unidad el 12 C tiene una masa de 12 u. Como nuestras balanzas no miden umas sino gramos, es lógico que relacionemos u (umas) con gramos. Se define la unidad de masa atómica como la doceava parte de la masa del átomo de 12 C 1 u = masa de un átomo del isótopo 12 = 1, g La masa de los átomos se determina comparándola con la de la unidad de masa atómica. 3
6 Imaginemos una balanza capaz de pesar átomos (es una ficción, no es real). Si quisiéramos determinar la masa de un átomo de oxígeno lo pondríamos en un platillo e iríamos añadiendo unidades de masa atómica al otro. Cuando se equilibrara la balanza sólo tendríamos que contar cuántas umas hemos colocado en el otro platillo y tendríamos la masa del átomo de oxígeno en umas o u. En el ejemplo de la derecha, la masa del átomo de oxígeno considerado serían dieciséis umas (16 u). Cuando se habla de la masa atómica de un elemento hemos de tener en cuenta que los átomos de un mismo elemento no son exactamente iguales. Existen isótopos que, aunque tienen idéntico comportamiento químico, son un poco más pesados unos que otros (ya que tienen distinto número de neutrones). La masa atómica se obtiene entonces como media ponderada de los isótopos naturales del elemento. Ejemplo: El cloro se encuentra en la naturaleza como mezcla de dos isótopos: 35 Cl y 37 C. El primero de ellos tiene una masa de 34,97 u y una abundancia del 75,53%, mientras que el segundo tiene una masa atómica de 36,97 u y una abundancia de 24,47%. Teniendo en cuenta estos datos la masa del elemento cloro se calcula de la siguiente forma: (0,7553 x 34,97) + (0,2447 x 36,97) = 35,46 u La masa molecular de un compuesto se obtiene sumando las masas atómicas de los elementos que forman ese compuesto. Ejemplos: El NÚMERO DE AVOGADRO (N A) Teniendo en cuenta lo anterior podríamos preguntarnos: Cuántos átomos de 12 C sería necesario reunir para tener una masa manejable en el laboratorio, por ejemplo, 12,0 g (valor de la masa atómica expresada en gramos)? 4
7 El número 6, es muy importante en Química. Recibe el nombre de Número o Constante de Avogadro (N A) Es el número de átomos de C que hay que reunir para que su masa sea igual a 12 g (el valor de la masa atómica en gramos).por tanto: Comparemos ahora las masas de un átomo de C y uno de H: Masa de 1 átomo de C: 12 u Masa de 1 átomo de H: 1 u Observa que un átomo de H tiene una masa 12 veces inferior a uno de C. Si ahora tomamos 6, átomos de C y el mismo número de átomos de H, resultará que éstos tendrán una masa 12 veces menor: Masa de 6, átomos de C: 12,0 g Masa de 6, átomos de H: 1,0 g Si repetimos este razonamiento para otros átomos llegaríamos a idénticas conclusiones: Masa de 6, átomos de O: 16,0 g Masa de 6, átomos de N: 14,0 g Masa de 6, átomos de S: 32,0 g Como se ha dicho antes, si se toma una cantidad de carbono, tal que contenga 6, átomos, y la pesamos, su masa será de 12,0 g. Invirtiendo el razonamiento: si pesamos 12,0 g de carbono, podemos asegurar que en esa cantidad habrá 6, átomos de C. EL MOL Se define el mol como la cantidad de sustancia que contiene 6, unidades elementales. Cuando se usa el mol las unidades elementales pueden ser átomos, moléculas, iones etc. El mol es la unidad de cantidad de sustancia del Sistema Internacional de Unidades (S.I.) 1 mol = 6, unidades (un 6 seguido de 23 ceros, de átomos, moléculas...) es decir, seiscientos dos mil trillones! 5
8 Debe quedar claro que un mol es una unidad de cantidad, como el par, la docena o la gruesa, pero referida a una muestra de sustancia. Como se trata de cantidades muy grandes de partículas, el mol es un número muy grande. La masa de 1 mol de sustancia es su masa atómica (si se trata de un elemento) o molecular (si se trata de un compuesto) expresada en gramos. 6
9 FÓRMULAS QUÍMICAS. INFORMACIÓN QUE SUMINISTRAN Las fórmulas usadas en química suministran gran información sobre los compuestos que representan. Ejemplo: H 2 CO 3 La fórmula representa una molécula (unidad básica de un compuesto) de ácido carbónico. Esta molécula está formada por 2 átomos de H, 1 de C y 3 de O unidos mediante enlace covalente. La masa de una molécula de H 2 CO 3 es 62,0 u (sumando las masas de los átomos) La masa de 1 mol (de moléculas) será 62,0 g a. Cálculo de la composición centesimal de un compuesto: Apoyándonos en la fórmula podemos establecer la composición centesimal del compuesto. Esto es, su composición en tanto por ciento. Ejemplo 1 Obtener la composición centesimal del ácido carbónico (H 2 CO 3 ) Solución: Calculamos primero la masa molecular del compuesto: H : 1. 2 = 2 u La masa de un mol de H 2 CO 3 es 62 g. H 2 CO 3 C: 12.1 = 12 u O: 16.3 = 48 u 62 u Esos 62 g, se distribuyen de la siguiente manera: 2 g de H 12 g de C 48 g de O Podemos plantear, por tanto, los siguientes cálculos para establecer el tanto por ciento de cada elemento: 62 g de 2g de H = 100 g de x x = / 62 = 3,23 3,23 % de H 62 g de 12g de C = 100 g de x x = / 62 = 19,35 19,35 % de C 62 g de 48g de O = 100 g de x x = / 62 = 77,42 19,35 % de O 7
10 Ejemplo 2 Qué compuesto es más rico en oxígeno el KClO 3 o el N 2O 4? K ClO 3 K : 39,1. 1 = 39,1 u Cl: 35,5.1 = 35,5 u N 2 O 4 N : = 28 u O: = 48 u O: 16.4 = 64 u 122,6 u 92 u 1 mol de K ClO3 = 122, 6 g 1 mol de N2 O4 = 92 g En 122, 6 g hay: 48 g de O En 92 g hay 64 g de O 122,6 g de 48g de O = 100 g de x x = / 122,6 = 39,15 39,15 % de O en 92 g de 64g de O = 100 g de x x = / 92 = 69,57 69,57 % de O en N 2 O 4 Es más rico en O el N 2O 4 b. Determinación de la fórmula de un compuesto conocida su composición centesimal Ejemplo 3 Se analiza un compuesto de C e H obteniéndose un 80,0 % de C y un 20,0 % de hidrógeno. La determinación de su masa molecular dio un valor de 30 g/mol. Determinar la fórmula de la sustancia. Partimos del significado de la composición centesimal. Que el compuesto tenga un 80 % de C y un 20% de H, significa que si tomamos 100,0 g de compuesto, 80,0 g serán de C, y 20,0 g de H. Calculamos a continuación los moles de cada elemento contenidos en 100 g de compuesto. Para ello, dividimos el % de cada elemento entre su masa atómica: moles de C = 80/ 12 = 6,67 moles de H = 20/ 1 = 20 Luego los átomos contenidos en 100,0 g de compuesto estarán en esa relación. Si tomamos el más pequeño de los valores como unidad, podemos determinar en qué relación están combinados. Para lograrlo dividimos todos los valores por el menor y aproximamos al valor entero: C : 6, ,67 H : 20,0 2,9 3 6,67 Por tanto una fórmula posible para la molécula será CH 3, pero hay que tener en cuenta que en las siguientes moléculas: C 2 H 6 C 3 H 9 y C 4 H 12, también los átomos están combinados en proporción 1 : 3. Es decir, si no conocemos más datos sólo podemos afirmar que la fórmula probable o empírica del compuesto será (CH 3 ) n 8
11 El conocimiento de la masa molecular del compuesto permite establecer cuál es la fórmula molecular: n = Mm del compuesto / Mm de la f. empírica = 30/15 = 2 La fórmula molecular será: (CH 3) 2 = C 2H 6 9
Profesora: Teresa Esparza Araña ASPECTOS CUANTITATIVOS DE LA QUÍMICA. UNIDAD 1: La cantidad de sustancia. El mol
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 1: La cantidad de sustancia. El mol ÍNDICE CLASIFICACIÓN DE LA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 1: La cantidad de sustancia. El mol ÍNDICE CLASIFICACIÓN DE LA
CANTIDAD DE SUSTANCIA. EL MOL. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 CANTIDAD DE SUSTANCIA. EL MOL Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Es fácil contar los garbanzos que hay en un puñado de esta legumbre. Hay que tener más paciencia para contar
CANTIDAD DE SUSTANCIA. EL MOL Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Es fácil contar los garbanzos que hay en un puñado de esta legumbre. Hay que tener más paciencia para contar
CONCEPTOS BÁSICOS DE QUÍMICA
 CONCEPTOS BÁSICOS DE QUÍMICA IES La Magdalena. Avilés. Asturias Los átomos de distintos elementos pueden unirse mediante un enlace (iónico o covalente) formando un compuesto. Cuando se forma un compuesto
CONCEPTOS BÁSICOS DE QUÍMICA IES La Magdalena. Avilés. Asturias Los átomos de distintos elementos pueden unirse mediante un enlace (iónico o covalente) formando un compuesto. Cuando se forma un compuesto
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES
 GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
Principios y conceptos básicos de Química
 Principios y conceptos básicos de Química Se estudiarán durante las dos primeras quincenas, estos contenidos están en el tema 2 del libro de texto. Quincena 1ª - Repaso de conceptos estudiados en ESO (Densidad,
Principios y conceptos básicos de Química Se estudiarán durante las dos primeras quincenas, estos contenidos están en el tema 2 del libro de texto. Quincena 1ª - Repaso de conceptos estudiados en ESO (Densidad,
La materia. Elaborado por: Nubia Ortega N.
 La materia. Elaborado por: Nubia Ortega N. La materia. Clasificación. Leyes Ponderales: Son las leyes generales que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente
La materia. Elaborado por: Nubia Ortega N. La materia. Clasificación. Leyes Ponderales: Son las leyes generales que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente
U1 T3. Concepto de mol. Masas atómicas y moleculares
 1 de 16 08/07/2013 14:52 U1 T3. Concepto de mol. Masas atómicas y moleculares Los átomos son muy pequeños. Para que te hagas una idea, el átomo de calcio tiene un radio de 2 por 10-8 cm, por lo que para
1 de 16 08/07/2013 14:52 U1 T3. Concepto de mol. Masas atómicas y moleculares Los átomos son muy pequeños. Para que te hagas una idea, el átomo de calcio tiene un radio de 2 por 10-8 cm, por lo que para
I. TEORÍA ATÓMICO-MOLECULAR
 Índice 1. La materia 2. Clasificación de la materia 3. Leyes ponderales 4. Teoría atómica de Dalton 5. Leyes volumétricas 6. La unidad de cantidad de materia: el mol 2 1 La materia Materia es todo aquello
Índice 1. La materia 2. Clasificación de la materia 3. Leyes ponderales 4. Teoría atómica de Dalton 5. Leyes volumétricas 6. La unidad de cantidad de materia: el mol 2 1 La materia Materia es todo aquello
Conceptos básicos en estequiometría
 Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA
 U.N.P.S.J.B. FACULTAD DE CIENCIAS NATURALES SEDE TRELEW CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA AÑO 2015 Lic. Maite L. Domínguez Ing. Sebastián Polacco RELACIONES DE MASA EN LAS REACCIONES
U.N.P.S.J.B. FACULTAD DE CIENCIAS NATURALES SEDE TRELEW CURSO DE NIVELACIÓN EN QUÍMICA INTRODUCCIÓN A LA QUÍMICA AÑO 2015 Lic. Maite L. Domínguez Ing. Sebastián Polacco RELACIONES DE MASA EN LAS REACCIONES
EJERCICIOS RESUELTOS DE LA UNIDAD 1
 1 EJERCICIOS RESUELTOS DE LA UNIDAD 1 A) Masas moleculares 1. Si las masas atómicas del carbono (C), oxígeno (O) e hidrógeno (H) son 12, 16 y 1 u, respectivamente, calcula las masas moleculares, y la masa
1 EJERCICIOS RESUELTOS DE LA UNIDAD 1 A) Masas moleculares 1. Si las masas atómicas del carbono (C), oxígeno (O) e hidrógeno (H) son 12, 16 y 1 u, respectivamente, calcula las masas moleculares, y la masa
Mol-Peso atómico-peso. Molecular- Na
 Mol-Peso atómico-peso Molecular- Na El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos que hay en exactamente 12 gramos de 12 C. Se ha demostrado que
Mol-Peso atómico-peso Molecular- Na El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos que hay en exactamente 12 gramos de 12 C. Se ha demostrado que
10 Naturaleza de la materia
 10 Naturaleza de la materia ACTIVIDADES Actividades DE del LADILL interior DE LA UNIDAD de la unidad DIEZ 1. El oígeno se combina con el silicio en una relación de masa 1,14 : 1: a) Qué masa de silicio
10 Naturaleza de la materia ACTIVIDADES Actividades DE del LADILL interior DE LA UNIDAD de la unidad DIEZ 1. El oígeno se combina con el silicio en una relación de masa 1,14 : 1: a) Qué masa de silicio
La uma, por ser una unidad de masa, tiene su equivalencia en gramos:
 UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
Leyes clásicas de las reacciones químicas
 Leyes clásicas de las reacciones químicas Leyes ponderales Relativas a la masa de reactivos y productos en un reacción química. Instrumento de medida. La balanza - Ley de conservación de la masa. Lavoisier
Leyes clásicas de las reacciones químicas Leyes ponderales Relativas a la masa de reactivos y productos en un reacción química. Instrumento de medida. La balanza - Ley de conservación de la masa. Lavoisier
MAGNITUDES ATÓMICO MOLECULARES
 MAGNITUDES ATÓMICO MOLECULARES Lic. Lidia Iñigo Verás que el texto Temas de Química General comienza por donde históricamente comenzó la Química, o sea, por las leyes gravimétricas. Hoy en día con los
MAGNITUDES ATÓMICO MOLECULARES Lic. Lidia Iñigo Verás que el texto Temas de Química General comienza por donde históricamente comenzó la Química, o sea, por las leyes gravimétricas. Hoy en día con los
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
CONCEPTOS ELEMENTALES
 CONCEPTOS ELEMENTALES 1. Medida de la masa. 2. Clasificación de la materia. 3. Representación de fórmulas químicas. 4. Leyes de los gases. 5. Leyes ponderales y volumétricas. 6. Disoluciones. 7. Reacciones
CONCEPTOS ELEMENTALES 1. Medida de la masa. 2. Clasificación de la materia. 3. Representación de fórmulas químicas. 4. Leyes de los gases. 5. Leyes ponderales y volumétricas. 6. Disoluciones. 7. Reacciones
Estequiometría. Química General I 2013
 Estequiometría Química General I 2013 Estequiometría Es el estudio cuantitativo de reactivos y productos en una reacción química. Conceptos importantes Masa atómica Mol Peso molecular Masa atómica En química
Estequiometría Química General I 2013 Estequiometría Es el estudio cuantitativo de reactivos y productos en una reacción química. Conceptos importantes Masa atómica Mol Peso molecular Masa atómica En química
PPTCCO007CB33-A17V1 Clase. Leyes y conceptos de la estequiometría
 PPTCCO007CB33-A17V1 Clase Leyes y conceptos de la estequiometría Resumen de la clase anterior El átomo Representado por Divisible en Participan en Protón Neutrón Electrón Caracterizados por Modelos atómicos
PPTCCO007CB33-A17V1 Clase Leyes y conceptos de la estequiometría Resumen de la clase anterior El átomo Representado por Divisible en Participan en Protón Neutrón Electrón Caracterizados por Modelos atómicos
Procedimiento alterno
 36 Estequiometría Por lo anterior, tenemos que: 110 g de C 0.375 mol de C 8 ( 8 ) 41.25 g de C H 8 14 Procedimiento alterno En el caso anterior la relación molar existente es:, o bien, Para calcular el
36 Estequiometría Por lo anterior, tenemos que: 110 g de C 0.375 mol de C 8 ( 8 ) 41.25 g de C H 8 14 Procedimiento alterno En el caso anterior la relación molar existente es:, o bien, Para calcular el
Unidad 0 CÁLCULOS QUÍMICOS. Unidad 0. Cálculos químicos
 Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
La unidad de masa atómica (uma) provee una escala relativa para las masa atómicas. En el laboratorio uno se enfrenta con muestras. átomos.
 LEYES DEL CAMBIO QUIMICO Fórmulas Químicas Estequiometria de Rx EL MOL La unidad de masa atómica (uma) provee una escala relativa para las masa atómicas. En el laboratorio uno se enfrenta con muestras
LEYES DEL CAMBIO QUIMICO Fórmulas Químicas Estequiometria de Rx EL MOL La unidad de masa atómica (uma) provee una escala relativa para las masa atómicas. En el laboratorio uno se enfrenta con muestras
LEYES PONDERALES. ESTEQUIOMETRÍA
 LEYES PONDERALES. ESTEQUIOMETRÍA 1 Vamos a aprender Qué son las leyes ponderales. Cómo contribuyeron al establecimiento de las bases de la Química. La importancia del mol como unidad de medida para la
LEYES PONDERALES. ESTEQUIOMETRÍA 1 Vamos a aprender Qué son las leyes ponderales. Cómo contribuyeron al establecimiento de las bases de la Química. La importancia del mol como unidad de medida para la
IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO
 IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO Tema 1: Medida y método científico. 1. Transforme las siguientes magnitudes al S.I de unidades: a) 228 Gm b) 436 ns
IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO Tema 1: Medida y método científico. 1. Transforme las siguientes magnitudes al S.I de unidades: a) 228 Gm b) 436 ns
 TALLER: TEMAS IMPORTANTES DE QUIMICA http://cap7-teoriacuantica.blogspot.com/p/s-isoelectronicos.html Refuerzo, ver video: http://www.quimitube.com/videos/comparacion-radio-ionicoiones-isoelectronico/
TALLER: TEMAS IMPORTANTES DE QUIMICA http://cap7-teoriacuantica.blogspot.com/p/s-isoelectronicos.html Refuerzo, ver video: http://www.quimitube.com/videos/comparacion-radio-ionicoiones-isoelectronico/
Los compuestos químicos
 Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
Los compuestos químicos Física y Química Compuestos formados por moléculas Oxford University Press España, S. A. Física y Química 3º ESO 2 Un compuesto químico es una sustancia pura formada por dos o más
1 uma = 1,66054 x g = 6,02214 x uma
 MASAS ATOMICAS Los científicos del siglo XIX no tenían conocimiento de la existencia de las partículas subatómicas. Sin embargo, el segundo postulado de la teoría atómica indica que los átomos de diferentes
MASAS ATOMICAS Los científicos del siglo XIX no tenían conocimiento de la existencia de las partículas subatómicas. Sin embargo, el segundo postulado de la teoría atómica indica que los átomos de diferentes
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
Cuestiones del Tema 1: Aspectos cuantitativos en Química
 Cuestiones del Tema 1: Aspectos cuantitativos en Química 1.- La fórmula empírica de un compuesto orgánico es C 2H 4O. Si su masa molecular es 88: a) Determine su fórmula molecular. b) Calcule el número
Cuestiones del Tema 1: Aspectos cuantitativos en Química 1.- La fórmula empírica de un compuesto orgánico es C 2H 4O. Si su masa molecular es 88: a) Determine su fórmula molecular. b) Calcule el número
4 ESO. Fundamentos de química: masa atómica, masa molecular, el MOL
 Al igual que ocurre en la materia ordinaria es conveniente distinguir a los distintos tipos de átomos no sólo por su número atómico Z y su número másico A, sino también por su masa. Si se elige el kilogramo,
Al igual que ocurre en la materia ordinaria es conveniente distinguir a los distintos tipos de átomos no sólo por su número atómico Z y su número másico A, sino también por su masa. Si se elige el kilogramo,
Universidad Técnica Nacional
 Universidad Técnica Nacional Química I-CB005 Unidad III Estequiometría: Cálculos con fórmulas y ecuaciones químicas Masa atómica Promedio ponderado de la masa y abundancia de los isótopos naturales del
Universidad Técnica Nacional Química I-CB005 Unidad III Estequiometría: Cálculos con fórmulas y ecuaciones químicas Masa atómica Promedio ponderado de la masa y abundancia de los isótopos naturales del
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
Introducción. Compuestos químicos. Reacciones químicas
 Introducción Compuestos químicos Reacciones químicas Metales Alcalinos Tabla Periódica Gases Nobles Alcalino-térreos Halógenos Grupo Principal Metales de transición Grupo Principal Lantanidos y Actinidos
Introducción Compuestos químicos Reacciones químicas Metales Alcalinos Tabla Periódica Gases Nobles Alcalino-térreos Halógenos Grupo Principal Metales de transición Grupo Principal Lantanidos y Actinidos
25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL INICIAL
 25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL INICIAL (Utiliza solamente la tabla periódica suministrada por los docentes para resolver el examen) 1. Indica si
25ª OLIMPÍADA ARGENTINA DE QUÍMICA 1 DE SEPTIEMBRE DE 2015 CERTAMEN INTERCOLEGIAL NIVEL INICIAL (Utiliza solamente la tabla periódica suministrada por los docentes para resolver el examen) 1. Indica si
2. Métodos de separación de los componentes de una mezcla.
 TEMA 3: Mezclas, disoluciones y sustancias puras. 1. Clasificación de la materia. 2. Métodos de separación de los componentes de una mezcla. 3. Disoluciones. a) Definición. b) Cómo se preparan. c) Concentración.
TEMA 3: Mezclas, disoluciones y sustancias puras. 1. Clasificación de la materia. 2. Métodos de separación de los componentes de una mezcla. 3. Disoluciones. a) Definición. b) Cómo se preparan. c) Concentración.
GUÍA DE EJERCICIOS FÓRMULA EMPÍRICA Y MOLÉCULAR
 GUÍA DE EJERCICIOS FÓRMULA EMPÍRICA Y MOLÉCULAR Área Química Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento
GUÍA DE EJERCICIOS FÓRMULA EMPÍRICA Y MOLÉCULAR Área Química Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
GUÍA EJERCICIOS FÓRMULA EMPÍRICA Y MOLECULAR
 GUÍA EJERCICIOS FÓRMULA EMPÍRICA Y MOLECULAR Resultados de aprendizaje Área Química Conoce y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y sistemático.
GUÍA EJERCICIOS FÓRMULA EMPÍRICA Y MOLECULAR Resultados de aprendizaje Área Química Conoce y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y sistemático.
Aspectos cuantitativos de la Química(I).1º bachillerato.
 TEORÍA ATÓMICA DE DALTON La teoría atómica de Dalton (1808)fue el primer intento para describir toda la materia en términos de los átomos y sus propiedades. La primera parte de su teoría establece que
TEORÍA ATÓMICA DE DALTON La teoría atómica de Dalton (1808)fue el primer intento para describir toda la materia en términos de los átomos y sus propiedades. La primera parte de su teoría establece que
FÍSICA Y QUÍMICA 2º ESO Tema 2: LA MATERIA Mezclas y Soluciones. Sustancias puras y mezclas
 Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
Estequiometría -Mol - Masa
 Estequiometría -Mol - Masa 3.1: Mol 3.2: Determinación de la Formula de un compuesto 3.3: Plantear y Balancear Ecuaciones Químicas 3.4: Calcular la cantidad de reactantes y productos 3.5: Fundamentos de
Estequiometría -Mol - Masa 3.1: Mol 3.2: Determinación de la Formula de un compuesto 3.3: Plantear y Balancear Ecuaciones Químicas 3.4: Calcular la cantidad de reactantes y productos 3.5: Fundamentos de
Teoría es un principio unificador que explica un conjunto de hechos y aquellas leyes que se basan en ellos.
 Página 1 de 6 Repaso de Química 105 I. Método científico Pasos Basicos Observación Representación Interpretación Hipótesis explicación tentativa de un problema. Nos guia para planear experimentos adicionales.
Página 1 de 6 Repaso de Química 105 I. Método científico Pasos Basicos Observación Representación Interpretación Hipótesis explicación tentativa de un problema. Nos guia para planear experimentos adicionales.
Materia: FÍSICA Y QUÍMICA 3º E.S.O Curso
 ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
TEMA 2. COMPOSICIÓN DE LA MATERIA
 TEMA 2. COMPOSICIÓN DE LA MATERIA 1 COMPOSICIÓN DE LA MATERIA La materia se presenta en pedazos o porciones limitadas que llamamos cuerpos o sistemas materiales. Por lo tanto un sistema material es un
TEMA 2. COMPOSICIÓN DE LA MATERIA 1 COMPOSICIÓN DE LA MATERIA La materia se presenta en pedazos o porciones limitadas que llamamos cuerpos o sistemas materiales. Por lo tanto un sistema material es un
Departamento Ciencias. Física y Química MATERIA. se clasifica en. SUSTANCIAS PURAS pueden ser. por métodos. físicos originan. Compuestos.
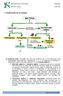 1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
TEMA 1 1.CONSIDERACIONES SOBRE LA QUIMICA 1.1 QUE ES LA QUIMICA? 1.2 CLASIFICACIÓN DE LA QUÍMICA 1.3 PROCESOS QUIMICOS: SINTESIS Y ANÁLISIS
 TEMA 1 1.CONSIDERACIONES SOBRE LA QUIMICA 1.1 QUE ES LA QUIMICA? 1.2 CLASIFICACIÓN DE LA QUÍMICA 1.3 PROCESOS QUIMICOS: SINTESIS Y ANÁLISIS 2.CONCEPTOS BASICOS 1.1 ELEMENTOS, ISOTOPOS, U.M.A. Y PESOS ATOMICOS
TEMA 1 1.CONSIDERACIONES SOBRE LA QUIMICA 1.1 QUE ES LA QUIMICA? 1.2 CLASIFICACIÓN DE LA QUÍMICA 1.3 PROCESOS QUIMICOS: SINTESIS Y ANÁLISIS 2.CONCEPTOS BASICOS 1.1 ELEMENTOS, ISOTOPOS, U.M.A. Y PESOS ATOMICOS
1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F. 4 - Expresa en moles: 4,5 g de agua; 0,3 g de hidrógeno; 440 g de dióxido de carbono
 ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
c) Los componentes de una se pueden separar por métodos sencillos. a) Sustancia pura. b) Sustancia pura. c) Mezcla.
 ACTIVIDADES Actividades DE del FINALfinal DE LAde UNIDAD la unidad 1 Indica si las siguientes frases incompletas hacen referencia a una mezcla o a una sustancia pura: a) Una tiene propiedades fijas en
ACTIVIDADES Actividades DE del FINALfinal DE LAde UNIDAD la unidad 1 Indica si las siguientes frases incompletas hacen referencia a una mezcla o a una sustancia pura: a) Una tiene propiedades fijas en
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Estequiometría I: leyes y conceptos de la estequiometría Nº Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema
Programa Técnico Profesional QUÍMICA Estequiometría I: leyes y conceptos de la estequiometría Nº Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema
EL ÁTOMO ( I ). Conceptos fundamentales
 EL ÁTOMO ( I ). onceptos fundamentales Núcleo del átomo Dimensiones muy reducidas comparadas con el tamaño del átomo En el núcleo radica la masa del átomo Partículas: protones y neutrones (nucleones).
EL ÁTOMO ( I ). onceptos fundamentales Núcleo del átomo Dimensiones muy reducidas comparadas con el tamaño del átomo En el núcleo radica la masa del átomo Partículas: protones y neutrones (nucleones).
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE
 ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE Los alumnos que hallan suspendido la asignatura de Física y Química de 3º deberán entregar, el día del examen de la asignatura,
ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE Los alumnos que hallan suspendido la asignatura de Física y Química de 3º deberán entregar, el día del examen de la asignatura,
MOL. Nº AVOGADRO GASES. TEMA 4 Pág. 198 libro (Unidad 10)
 MOL. Nº AVOGADRO GASES TEMA 4 Pág. 198 libro (Unidad 10) CONCEPTOS PREVIOS Supuestos de Dalton Teoría atómica de Dalton Elementos constituidos por átomos, partículas separadas e indivisibles Átomos de
MOL. Nº AVOGADRO GASES TEMA 4 Pág. 198 libro (Unidad 10) CONCEPTOS PREVIOS Supuestos de Dalton Teoría atómica de Dalton Elementos constituidos por átomos, partículas separadas e indivisibles Átomos de
CLASE Nº 2 ESTEQUIOMETRÍA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
Tema 0. Conceptos Básicos en Química
 Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas empíricas y moleculares Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que estudia la composición
Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas empíricas y moleculares Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que estudia la composición
4.4. MOLES Y MOLÉCULAS.
 4.4. MOLES Y MOLÉCULAS. 4.4.1. MASA ATÓMICA Y MASA MOLECULAR Las moléculas están formadas por la unión de átomos que se unen mediante enlace químico. Esto significa que los átomos son difíciles de separar
4.4. MOLES Y MOLÉCULAS. 4.4.1. MASA ATÓMICA Y MASA MOLECULAR Las moléculas están formadas por la unión de átomos que se unen mediante enlace químico. Esto significa que los átomos son difíciles de separar
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
UNIDAD I. TEMA III. ESTEQUIOMETRÍA
 REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD EXPERIMENTAL SUR DEL LAGO Jesús María Semprúm PROGRAMA DE INGENIERIA DE ALIMENTOS UNIDAD CURRICULAR: QUIMICA GENERAL UNIDAD I. TEMA III. ESTEQUIOMETRÍA Prof.
REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD EXPERIMENTAL SUR DEL LAGO Jesús María Semprúm PROGRAMA DE INGENIERIA DE ALIMENTOS UNIDAD CURRICULAR: QUIMICA GENERAL UNIDAD I. TEMA III. ESTEQUIOMETRÍA Prof.
Relación entre mol y constante de Avogadro
 Relación entre mol y constante de Avogadro Los químicos trabajan con aspectos cuantitativos que pueden ser vistos y tocados, es decir, cantidades macroscópicas, tales como masa en gramos y volumen en litros,
Relación entre mol y constante de Avogadro Los químicos trabajan con aspectos cuantitativos que pueden ser vistos y tocados, es decir, cantidades macroscópicas, tales como masa en gramos y volumen en litros,
QUÍMICA 2º BACHILLERATO
 CONCEPTO DE. ISÓTOPOS. 1.-/ Cuántas moléculas de agua hay en un matraz que contiene 250 ml, si la densidad del agua es 1,00 g/ml? 2.-/ Cuántos átomos de oxígeno hay en medio litro de oxígeno medidos a
CONCEPTO DE. ISÓTOPOS. 1.-/ Cuántas moléculas de agua hay en un matraz que contiene 250 ml, si la densidad del agua es 1,00 g/ml? 2.-/ Cuántos átomos de oxígeno hay en medio litro de oxígeno medidos a
TEMA 7: Problemas de Química
 TEMA 7: Problemas de Química Tema 7: Problemas de Química 1 1.- REACCIONES QUÍMICAS Una reacción química es un proceso en el que se unen varias sustancias llamadas reactivos y se transforman en otras sustancias
TEMA 7: Problemas de Química Tema 7: Problemas de Química 1 1.- REACCIONES QUÍMICAS Una reacción química es un proceso en el que se unen varias sustancias llamadas reactivos y se transforman en otras sustancias
TEMA 3: Composición de la Materia
 TEMA 3: Composición de la Materia 1. Mezclas homogéneas y heterogéneas Una mezcla es una composición de varias sustancias con distintas propiedades. Distinguimos dos tipos de mezclas: Mezclas homogéneas:
TEMA 3: Composición de la Materia 1. Mezclas homogéneas y heterogéneas Una mezcla es una composición de varias sustancias con distintas propiedades. Distinguimos dos tipos de mezclas: Mezclas homogéneas:
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
TEMA 3 LA MATERIA Y SU ESTRUCTURA
 TEMA 3 LA MATERIA Y SU ESTRUCTURA 1. Clasificación de la materia (página 58) Def. Sistema material: Es una porción de materia seleccionada para su estudio. Def. Sustancia pura: Decimos que una sustancia
TEMA 3 LA MATERIA Y SU ESTRUCTURA 1. Clasificación de la materia (página 58) Def. Sistema material: Es una porción de materia seleccionada para su estudio. Def. Sustancia pura: Decimos que una sustancia
Clasificación de la materia
 Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
Clasificación de la materia Sustancias Puras Son caracterizados por su composición y propiedades definidas y constantes bajo condiciones determinadas. Sustancias puras: Elementos Son sustancias puras formadas
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
SISTEMAS MATERIALES. Qué ejemplos podés dar de un mismo cuerpo formado por distintos materiales y de distintos cuerpos formados por un mismo material?
 SISTEMAS MATERIALES Lic. Lidia Iñigo Se denomina MATERIA a todo lo que forma los distintos objetos o cuerpos que nos rodean, ya sean inertes o seres vivos. La materia se caracteriza por ocupar un lugar
SISTEMAS MATERIALES Lic. Lidia Iñigo Se denomina MATERIA a todo lo que forma los distintos objetos o cuerpos que nos rodean, ya sean inertes o seres vivos. La materia se caracteriza por ocupar un lugar
UNIDAD 4 Relaciones de masa en las reacciones químicas
 UNIDAD 4 Relaciones de masa en las reacciones químicas QUIMICA-CPAM. FCMUNA 2016 Masa de los átomos Los científicos de los siglos XVIII y XIX no contaban con medios para medir la masa de cada tipo de átomo,
UNIDAD 4 Relaciones de masa en las reacciones químicas QUIMICA-CPAM. FCMUNA 2016 Masa de los átomos Los científicos de los siglos XVIII y XIX no contaban con medios para medir la masa de cada tipo de átomo,
IES La Magdalena. Avilés. Asturias. El átomo
 El átomo IES La Magdalena. Avilés. Asturias En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia
El átomo IES La Magdalena. Avilés. Asturias En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia. Demócrito consideraba que la materia
MOL. Nº AVOGADRO DISOLUCIONES. TEMA 4 Pág. 198 libro (Unidad 10)
 MOL. Nº AVOGADRO DISOLUCIONES TEMA 4 Pág. 198 libro (Unidad 10) CONCEPTOS PREVIOS Supuestos de Dalton Teoría atómica de Dalton Elementos consitudios por átomos, partícuals separads e indivisibles Átomos
MOL. Nº AVOGADRO DISOLUCIONES TEMA 4 Pág. 198 libro (Unidad 10) CONCEPTOS PREVIOS Supuestos de Dalton Teoría atómica de Dalton Elementos consitudios por átomos, partícuals separads e indivisibles Átomos
QUÍMICA GENERAL Y ORGÁNICA
 UNIVERSIDAD LA REPÚBLICA SEDE SANTIAGO ENFERMERÍA Y SALUD PÚBLICA Y KINESIOLOGÍA QUÍMICA GENERAL Y ORGÁNICA TEORIA: TEL : 500 Prof. Carlos Urzúa Stricker E-mail: carlos.urzua@ulare.cl PROGRAMA ASIGNATURA
UNIVERSIDAD LA REPÚBLICA SEDE SANTIAGO ENFERMERÍA Y SALUD PÚBLICA Y KINESIOLOGÍA QUÍMICA GENERAL Y ORGÁNICA TEORIA: TEL : 500 Prof. Carlos Urzúa Stricker E-mail: carlos.urzua@ulare.cl PROGRAMA ASIGNATURA
LEYES FUNDAMENTALES DE LA QUÍMICA
 CONTENIDOS LEYES FUNDAMENTALES DE LA QUÍMICA 1.- La Química en la antigüedad. La Alquimia. 2.- Sustancias homogéneas y heterogéneas. Elementos y compuestos. (Repaso)..- Leyes fundamentales de la Química..1.
CONTENIDOS LEYES FUNDAMENTALES DE LA QUÍMICA 1.- La Química en la antigüedad. La Alquimia. 2.- Sustancias homogéneas y heterogéneas. Elementos y compuestos. (Repaso)..- Leyes fundamentales de la Química..1.
RESPUESTAS DE LOS EJERCICIOS DE APLICACIÓN DEL LIBRO UN ACERCAMIENTO A LA QUÍMICA CAPÍTULO N 1: LOS SISTEMAS MATERIALES
 RESPUESTAS DE LOS EJERCICIOS DE APLICACIÓN DEL LIBRO UN ACERCAMIENTO A LA QUÍMICA ACLARACIÓN: Las respuestas que pudieren faltar de algunos ejercicios serán agregadas en futuras actualizaciones. CAPÍTULO
RESPUESTAS DE LOS EJERCICIOS DE APLICACIÓN DEL LIBRO UN ACERCAMIENTO A LA QUÍMICA ACLARACIÓN: Las respuestas que pudieren faltar de algunos ejercicios serán agregadas en futuras actualizaciones. CAPÍTULO
1. a) Define a la unidad de masa atómica. b) Explica porqué cuando en los datos se indica la masa atómica de los elementos no se le pone unidades.
 NÚMERO DE AVOGADRO / MOL 1. a) Define a la unidad de masa atómica. b) Explica porqué cuando en los datos se indica la masa atómica de los elementos no se le pone unidades. a) La uma es la doceava parte
NÚMERO DE AVOGADRO / MOL 1. a) Define a la unidad de masa atómica. b) Explica porqué cuando en los datos se indica la masa atómica de los elementos no se le pone unidades. a) La uma es la doceava parte
La materia y sus propiedades
 La materia y sus propiedades Las sustancias puras simples: ELEMENTOS QUÍMICOS Los elementos químicos Algunos pueden encontrarse fácilmente en nuestro entorno Hierro (Fe) Cobre (Cu) ASPECTO HOMOGÉNEO Oxígeno
La materia y sus propiedades Las sustancias puras simples: ELEMENTOS QUÍMICOS Los elementos químicos Algunos pueden encontrarse fácilmente en nuestro entorno Hierro (Fe) Cobre (Cu) ASPECTO HOMOGÉNEO Oxígeno
Concepto de mol. Concepto de mol. Número de Avogadro
 Concepto de mol Concepto de mol. Número de Avogadro La masa de los átomos es muy pequeña. Si se toma como ejemplo el átomo de calcio, cuyo radio es de 2.10-8 cm, para completar una distancia de un centímetro
Concepto de mol Concepto de mol. Número de Avogadro La masa de los átomos es muy pequeña. Si se toma como ejemplo el átomo de calcio, cuyo radio es de 2.10-8 cm, para completar una distancia de un centímetro
Las reacciones químicas
 Las reacciones químicas Conceptos previos Anteriormente estudiamos con la teoría de Dalton que una reacción química consiste en una reordenación de átomos. En una reacción química sólo cambia la forma
Las reacciones químicas Conceptos previos Anteriormente estudiamos con la teoría de Dalton que una reacción química consiste en una reordenación de átomos. En una reacción química sólo cambia la forma
DEFINICIONES ELEMENTALES
 DEFINICIONES ELEMENTALES A partir de las leyes pónderales y de la ley de Lavoisier aparece el concepto de peso equivalente ó peso de combinación, que es el peso de un elemento que se combina con un peso
DEFINICIONES ELEMENTALES A partir de las leyes pónderales y de la ley de Lavoisier aparece el concepto de peso equivalente ó peso de combinación, que es el peso de un elemento que se combina con un peso
Bachillerato. todos los derechos reservados, Macmillan Profesional. QUIMI
 QUIMI A2 Masa molar y su uso como concepto 1 La masa molar es la masa expresada en gramos que hay en un mol de una sustancia pura. La unidad de medida usada comúnmente para la masa molar es gramos/mol
QUIMI A2 Masa molar y su uso como concepto 1 La masa molar es la masa expresada en gramos que hay en un mol de una sustancia pura. La unidad de medida usada comúnmente para la masa molar es gramos/mol
COLEGIO SAN JOSÉ - Hijas de María Auxiliadora C/ Emilio Ferrari, 87 - Madrid Departamento de Ciencias Naturales
 TEMA 4. CÁLCULOS QUÍMICOS SOLUCIONES 3. Concepto de mol 1. Cuánto pesan 1,5 moles de óxido de hierro (III)? Datos de masa atómica: O = 16 u, Fe = 55,85 u - Peso Molecular Fe 2 O 3 = (2 55,85) + (3 16)
TEMA 4. CÁLCULOS QUÍMICOS SOLUCIONES 3. Concepto de mol 1. Cuánto pesan 1,5 moles de óxido de hierro (III)? Datos de masa atómica: O = 16 u, Fe = 55,85 u - Peso Molecular Fe 2 O 3 = (2 55,85) + (3 16)
La materia Materia es todo lo que tiene masa y ocupa un lugar en el espacio. La materia está formada por átomos y moléculas. Todo lo que nos rodea e i
 La materia Materia es todo lo que tiene masa y ocupa un lugar en el espacio. La materia está formada por átomos y moléculas. Todo lo que nos rodea e incluso nosotros mismos estamos hechos por materia.
La materia Materia es todo lo que tiene masa y ocupa un lugar en el espacio. La materia está formada por átomos y moléculas. Todo lo que nos rodea e incluso nosotros mismos estamos hechos por materia.
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
La clasificación básica de la materia muestra a los elementos y compuestos. Mezclas Heterogénea heterogéneas Mezclas. Soluciones
 La clasificación básica de la materia muestra a los elementos y compuestos. Materia Mezclas Heterogénea heterogéneas Mezclas Homogénea Soluciones Sustancias Compuestos Elementos Hemos visto que las soluciones
La clasificación básica de la materia muestra a los elementos y compuestos. Materia Mezclas Heterogénea heterogéneas Mezclas Homogénea Soluciones Sustancias Compuestos Elementos Hemos visto que las soluciones
ACTIVIDADES PARA RECUPERAR FÍSICA Y QUÍMICA DE 3º DE ESO ACTIVIDADES TEMA 1
 Departamento de Física y Química IES Blas Infante (Córdoba) Curso 2017/2018 ACTIVIDADES PARA RECUPERAR Nombre: FÍSICA Y QUÍMICA DE 3º DE ESO ACTIVIDADES TEMA 1 1. Calcula y expresa correctamente los resultados
Departamento de Física y Química IES Blas Infante (Córdoba) Curso 2017/2018 ACTIVIDADES PARA RECUPERAR Nombre: FÍSICA Y QUÍMICA DE 3º DE ESO ACTIVIDADES TEMA 1 1. Calcula y expresa correctamente los resultados
Reacciones Químicas. Homogéneas.
 Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
Como se sabe, la materia está formada por partículas, dependiendo el comportamiento de esta (la materia) del estado físico en que se encuentran las partículas. Igualmente, sabemos que la materia no es
MASAS ATOMICAS. 1 u = 1, g 1 g = 6, u
 MASAS ATOMICAS Escala de masa atómica Se define la masa del isótopo 1 C como equivalente a 1 unidades de masa atómica (u) 1 u = 1,6605 10 - g 1 g = 6,01 10 u De esta forma puede construirse una escala
MASAS ATOMICAS Escala de masa atómica Se define la masa del isótopo 1 C como equivalente a 1 unidades de masa atómica (u) 1 u = 1,6605 10 - g 1 g = 6,01 10 u De esta forma puede construirse una escala
FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA
 FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA 1) MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Una mezcla es una composición de sustancias con distintas propiedades. Una mezcla es homogénea si está formada
FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA 1) MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Una mezcla es una composición de sustancias con distintas propiedades. Una mezcla es homogénea si está formada
DEPARTAMENTO DE FÍSICA Y QUÍMICA RECUPERACIÓN DE MATERIA PENDIENTE DE FÍSICA Y QUÍMICA. ZnO SO2. KH SnH4 BeO. HgH2 FeH3. PbO AgH HCl.
 FORMULACIÓN 1. Escribe o formula. Óxido de disodio Óxido de cloro (V) Dióxido de nitrógeno Hidruro de magnesio Hidruro de hierro (III) Trióxido de dialuminio Hidruro de plata Cloruro de cobre (II) Óxido
FORMULACIÓN 1. Escribe o formula. Óxido de disodio Óxido de cloro (V) Dióxido de nitrógeno Hidruro de magnesio Hidruro de hierro (III) Trióxido de dialuminio Hidruro de plata Cloruro de cobre (II) Óxido
Capítulo 3: La cantidad en química
 Capítulo 3: La cantidad en química ACTIVIDADES DE RECAPITULACIÓN 1. Las masas atómicas del hidrógeno y del helio son 1 y 4, respectivamente. Indica, razonadamente, si las siguientes afirmaciones son verdaderas
Capítulo 3: La cantidad en química ACTIVIDADES DE RECAPITULACIÓN 1. Las masas atómicas del hidrógeno y del helio son 1 y 4, respectivamente. Indica, razonadamente, si las siguientes afirmaciones son verdaderas
QUÍMICA GENERAL QQ 103 TEORIA ATÓMICA LEYES FUNDAMENTALES DE LA MATERIA, PROPORCIONES DEFINIDAS Y MÚLTIPLES
 QUÍMICA GENERAL QQ 103 TEORIA ATÓMICA LEYES FUNDAMENTALES DE LA MATERIA, PROPORCIONES DEFINIDAS Y MÚLTIPLES Leyes y teorias Leyes son afirmaciones que resumen hechos experimentales referentes a la naturaleza,
QUÍMICA GENERAL QQ 103 TEORIA ATÓMICA LEYES FUNDAMENTALES DE LA MATERIA, PROPORCIONES DEFINIDAS Y MÚLTIPLES Leyes y teorias Leyes son afirmaciones que resumen hechos experimentales referentes a la naturaleza,
