COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE NAVARRA INFORME DE EVALUACIÓN ÁCIDO ZOLEDRÓNICO EN EL TRATAMIENTO DE LA OSTEOPOROSIS
|
|
|
- Natalia María Teresa Parra Alcaraz
- hace 7 años
- Vistas:
Transcripción
1 COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE NAVARRA INFORME DE EVALUACIÓN ÁCIDO ZOLEDRÓNICO EN EL TRATAMIENTO DE LA OSTEOPOROSIS Principio activo Nombre Comercial y presentaciones ZOLEDRÓNICO Aclasta 5 mg (Novartis) SOLUCION PARA PERFUSION IV (417,45 ) Grupo terapéutico M05BA (BISFOSFONATOS) Condiciones de dispensación Con receta médica. Uso Hospitalario Procedimiento de autorización Centralizado Fecha de autorización Julio 2005 Fecha de comercialización Junio 2008 Fecha de evaluación Febrero 2009 INDICACIONES TERAPÉUTICAS 1 Tratamiento de la osteoporosis en mujeres postmenopáusicas en hombres con riesgo elevado de fractura, incluido aquellos pacientes con una fractura de cadera por traumatismo de bajo impacto reciente. MECANISMO DE ACCIÓN 1 El ácido zoledrónico pertenece a la clase de los bisfosfonatos actúa principalmente en el hueso. Es un inhibidor de la resorción ósea mediada por osteoclastos. FARMACOCINÉTICA 1 Después de iniciar la perfusión de ácido zoledrónico, las concentraciones plasmáticas del ácido zoledrónico aumentan rápidamente, alcanzando el pico al final del periodo de perfusión, seguido de un rápido descenso hasta < 10% del pico después de 4 horas y < 1% del pico después de 24 horas. No se metaboliza y se excreta inalterado por vía renal. Durante las primeras 24 horas, el 39 ± 16% de la dosis administrada se recupera en la orina, mientras que la restante se une principalmente al tejido óseo. Del tejido óseo se libera muy lentamente, volviendo a la circulación sistémica y se elimina por vía renal. El aclaramiento corporal total es 5,04 ± 2,5 l/h, independiente de la dosis, y no está afectado por el sexo, edad, raza ni peso corporal. 1
2 POSOLOGÍA Y FORMA DE ADMINISTRACIÓN 1 La dosis recomendada para el tratamiento de la osteoporosis postmenopáusica y la osteoporosis en hombres es una perfusión intravenosa única de 5 mg administrada una vez al año. En pacientes con una fractura de cadera por traumatismo de bajo impacto reciente, se recomienda administrar la perfusión dos o más semanas después de la reparación quirúrgica. Se administra mediante un sistema de perfusión con toma de aire y a una velocidad de perfusión constante. El tiempo de perfusión no debe ser inferior a 15 minutos. Se recomienda un adecuado aporte de calcio y vitamina D y en pacientes con una fractura de cadera por traumatismo de bajo impacto reciente, se recomienda administrar una dosis de carga de a UI de vitamina D oral o por vía intramuscular antes de la primera perfusión EFICACIA CLÍNICA La eficacia clínica del ácido zoledrónico en la disminución de las fracturas se ha evaluado en dos ensayos multicéntricos, aleatorizados, doble ciego frente a placebo. En el primer ensayo HORIZON 2,3,4 participaron mujeres postmenopáusicas con edades comprendidas entre los 65 y los 89 años, y con densidad mineral ósea (DMO) en cuello femoral < -2,5 desviaciones estándar (DE) con o sin fracturas vertebrales o DMO cuello femoral < -1,5 DE y dos fracturas vertebrales leves o una moderada. Se comparó una infusión anual intravenosa de 5 mg de ácido zoledrónico frente a placebo durante 3 años. Todos los pacientes recibieron diariamente entre y mg de calcio y entre 400 y UI de vitamina D. La población estudiada tenía una media de 73 años, el 72% de los pacientes tenia una DMO de cuello femoral < -2,5 DE y más del 63,25% tenían al menos una fractura vertebral previa. El 14,5% de las pacientes estaban en tratamiento previamente con bisfosfonatos y tuvieron un periodo de lavado que dependió del tiempo en tratamiento con bisfosfonatos (ej. Si habían estado mas de 48 semanas de tratamiento el periodo de lavado fue de 2 años). Se diferenciaron dos grupos (estratos), el 1 si no tomaban ninguna medicación para la osteoporosis (79% de la muestra) y el 2 si en el inicio del ensayo recibían alguna medicación para la osteoporosis (terapia hormonal sustitutiva, raloxifeno, calcitonina, tibolona, tamoxifeno, dihidroepiandrosterona, ipriflavona y medroxiprogesterona) ya que estas se permitían continuar con el mismo (21% de la muestra). Las variables principales fueron la incidencia de fracturas vertebrales morfométricas (FVM) en el estrato 1 y el tiempo hasta la primera fracturas de cadera en toda la muestra. Entre las variables secundarias estaban la incidencia de fracturas no vertebrales y el tiempo hasta la primera fractura clínica. El ácido zoledrónico fue en todas ellas superior estadísticamente frente al placebo. 2
3 Variable Variable principal Placebo Zoledrónico RR o HR (Intervalo de confianza 95%) FVM (estrato 1) 310 (10,9) 92 (3,3) 0,30 (0,24-0,38) 13 Fracturas de cadera 88 (2,5) 52 (1,4) 0,59 (0,42-0,83) 107 Variables secundarias Fracturas no vertebrales 388 (10,7) 292 (8,0) 0,75 (0,64 0,87) 40 Fracturas clínicas 456 (12,8) 308 (8,4) 0,67 (0,58 0,77) 26 Número necesario a tratar* * Los NNT se han calculado como el inverso de la diferencia de riesgos absolutos teniendo en cuenta la incidencia absoluta de los diferentes acontecimientos. En el informe de la EMEA 4 se aportan datos de la eficacia del ácido zoledrónico en diferentes subgrupos que no aparecen en la publicación del estudio 2. Aunque este estudio no tenía potencia suficiente para estudiar diferencias entre los subgrupos, alguno de ellos eran muy reducidos, si se identificaron alguna de las variables que modificaban los resultados y que sirven para generar nuevas hipótesis. El ácido zoledrónico disminuyó las fracturas vertebrales morfométricas en todos los subgrupos predefinidos (edad, DMO de cuello femoral basales, IMC, uso previo de bisfosfonatos, función renal previa o número de fracturas vertebrales basal). Con respecto a las fracturas de cadera, sí hubo diferencias entre los pacientes tratados previamente con bisfosfonatos frente a los que no 4 Variable Fracturas de cadera N= población Sin tto con bisfosfonatos previo (n=6.614) Placebo Zoledrónico HR (Intervalo de confianza 95%) 80 (2,66) 39 (1,25) 0,49 (0,33-0,72) Con tto previo (n=1.122) 8 (1,58) 12 (2,38) 1,49 (0,61-3,64) y entre los diferentes grupos etarios 4. Variable Fracturas de cadera N= población Placebo Zoledrónico HR (Intervalo de confianza 95%) Edad < 70 (n=2.314) 24 (2,13) 7 (0,65) 0,30 (0,13-0,70) Edad ( n=2.473) 25 (2,30) 13 (1,10) 0,53 (0,27-1,03) Edad >75 (n=2.949) 39 (2,96) 32 (2,36) 0,82 (0,51-1,32) En este análisis de subgrupos se observó una aparente disminución de la eficacia con el incremento de la edad que no fue estadísticamente significativa (p=0,1222). Esta tendencia no se observó en las incidencias de otras fracturas no vertebrales ni en las fracturas clínicas. 3
4 En el caso de los pacientes tratados previamente con bisfosfonatos, aunque el número de pacientes era muy bajo (15% de la muestra), también se vio un menor efecto del ácido zoledrónico en el tiempo hasta la primera fractura clínica y no fue estadísticamente significativo mejor que placebo. Variable Fracturas clínicas N= población Sin tto con bisfosfonatos previo (n=6.614) Placebo Zoledrónico HR (Intervalo de confianza 95%) 392 (12,89) 251 (8,06) 0,63 (0,54-0,74) Con tto previo (n=1.122) 63 (12,75) 56 (10,51) 0,88 (0,61-1,26) Hubo una mayor mortalidad en el grupo tratado con zoledrónico 130 fallecimientos (3,4%) que en el grupo placebo 112 (2,9%) que no fue estadísticamente significativa. [p=0,27]. El ácido zoledrónico fue superior al placebo en el incremento o mantenimiento de las DMO a nivel distal, de columna lumbar, cuello femoral y de cadera. También redujo la magnitud de la disminución de la altura en los sujetos del ensayo y disminuyó el número de días de actividad limitada y de reposo en cama debido a las fracturas o al dolor de espalda en comparación con el placebo. El otro ensayo en el que se evaluó la disminución de la incidencia de fracturas óseas fue el ensayo HORIZON de fracturas recurrentes (HORIZON-FR) en pacientes con fractura de cadera 5,3. En este estudio participaron pacientes mayores de 50 años, media de edad 74,5 años y 76% mujeres, que habían tenido una fractura de cadera de bajo impacto en los 90 días previos a su inclusión y antes de la fractura deambulaban. Estos pacientes no deseaban o no podían tomar bisfosfonatos orales. Se comparó una infusión anual intravenosa de 5 mg de ácido zoledrónico frente a placebo. Todos los pacientes recibieron diariamente entre y mg de calcio y entre 800 y UI de vitamina D. La variable principal fue la incidencia de nuevas fracturas clínicas, excluyendo las faciales, digitales y en huesos con deformidades. Dentro de las variables secundarias se evaluó la incidencia de fracturas vertebrales nuevas, no vertebrales y de cadera además del incremento de la DMO en la cadera no fracturada. Como variable de seguridad se evaluó la mortalidad. El ensayo se paró con una mediana de seguimiento de 1,9 años después de que en el análisis intermedio se demostrara los beneficios del tratamiento con zoledrónico. El ácido zoledrónico disminuyó la incidencia de fracturas clínicas, según se puede observar en la tabla siguiente: Variable Variable principal Placebo Zoledrónico HR (Intervalo de confianza 95%) Fracturas clínicas 139 (13,9) 92 (8,6) 0,65 (0,50-0,84) 22 Variables secundarias Fracturas no vertebrales 107 (10,7) 79 (7,6) 0,73 (0,55-0,98) 37 Fracturas vertebrales 39 (3,8) 21 (1,7) 0,54 (0,32 0,92) 59 Número necesario a tratar* 4
5 * Los NNT se han calculado como el inverso de la diferencia de riesgos absolutos teniendo en cuenta la incidencia absoluta de los diferentes acontecimientos. No hubo diferencias estadísticamente significativas en la incidencia de nuevas fracturas de cadera. Variable Placebo Zoledrónico HR (Intervalo de confianza 95%) Fracturas de cadera 33 (3,5) 23 (2,0) 0,70 (0,41 1,19) En el informe de la EMEA 3 se advierte que hubo una clara correlación entre la eficacia del tratamiento y el tiempo que pasó desde la fractura de cadera y la primera infusión con ácido zoledrónico. Aunque no es fácil determinar un punto de corte, sí hay una disminución consistente en la eficacia del fármaco cuando la infusión se realizó en las primeras 6 semanas tras la fractura. En los pacientes que recibieron la infusión en las 2 primeras semanas tras la fractura de cadera se observó un incremento en la incidencia de fracturas de cadera y vertebrales. La mortalidad total fue menor en el grupo tratado con zoledrónico (9,6%) que en el grupo del placebo (13,3%), HR = 0,70 (IC95% 0,56 0,93). No hay una clara explicación acerca de la disminución de la mortalidad y no se puede sacar ninguna conclusión sobre una posible asociación con el tratamiento y/o con la disminución de las fracturas. Por ello el informe de la EMEA 3 comenta que aunque se pueda deber al azar es un área interesante en la que se debe continuar investigando. Eficacia clínica en hombres 3 Tan sólo hay dos ensayos en los que se evaluó la eficacia del zoledrónico en varones. En el ensayo HORIZON-FR fueron aleatorizados 508 hombres (24% de la muestra), y se determinó la DMO a 185 de ellos. A los 24 meses se observó un aumento significativo en la DMO de cuello femoral en los pacientes tratados con zoledrónico en comparación con el placebo. El ensayo no fue diseñado para mostrar una reducción en las fracturas clínicas en hombres. La incidencia de fracturas clínicas fue de 7,5% en hombres tratados con zoledrónico frente a un 8,7% de los tratados con placebo, que se tradujo en una disminución no estadísticamente significativa del 15% en la incidencia de fracturas clínicas frente a la disminución del 39%, estadísticamente significativa, que se observó en las mujeres. No se observaron tampoco diferencias estadísticamente significativas en ninguna de las otras variables, fractura de cadera, no vertebrales o vertebrales. Hay que tener en cuenta el pequeño número de fracturas (16 con zoledrónico y 20 con placebo). En el otro ensayo 3 se aleatorizaron 302 hombres con osteoporosis a recibir una inyección de zoledrónico 5 mg o alendrónico 70 mg / 7días, se observó un incremento en la DMO espinal de cadera y en la de cuello femoral comparables a los obtenidos en el estudio anterior, por lo que aunque no hubo grupo placebo la EMEA lo consideró debido a que aportaba datos del incremento de la DMO espinal que no existían en el HORIZON-FR. 5
6 SEGURIDAD Efectos adversos 1 Los efectos adversos más frecuentes en los ensayos clínicos fueron los síntomas postadministración. El global de pacientes que los experimentaron fue de un 44,7%, un 16,7% y un 10,2% después de la primera, segunda y tercera perfusión, respectivamente. La incidencia de síntomas individuales después de la primera perfusión fue: fiebre (17,1%), mialgia (7,8%), síntomas similares a la gripe (6,7%), artralgia (4,8%) y cefalea (5,1%). La mayoría de estos síntomas aparecen durante los tres primeros días siguientes a la administración. La mayoría de estos síntomas fueron de leves a moderados y se resolvieron durante los tres días posteriores a su aparición. Se han observado las siguientes reacciones adversas: fiebre (muy frecuentes: 1/10); fibrilación auricular, cefalea, mareos, nauseas, vómitos, mialgia, artralgia, dolor óseo de espalda o en extremidades, dolor, malestar (frecuentes 1/100, <1/10); incremento de la presión arterial, letargia, somnolencia, parestesia, temblor, síncopes, conjuntivitis, dolor ocular, disnea, diarrea, dispepsia, dolor abdominal, sequedad de boca, erupción cutánea, sudoración nocturna, hiperhidrosis, prurito, eritema, dolor torácico, de cuello, rigidez o dolor musculoesquelético, espasmos o rigidez muscular, anorexia, apetito disminuido, hipertensión, rubor, edema periférico, sed, insomnio (poco frecuentes 1/1000, <1/100); uveítis, episcleritis, iritis (raras: 1/10.000, <1/1.000); y reacciones de hipersensibilidad incluyendo casos raros de broncoconstricción, urticaria y angioedema y casos muy raros de reacción/choque anafiláctico (frecuencia no conocida, no puede estimarse a partir de los datos disponibles En pacientes tratados con bisfosfonato, se han notificado casos graves y ocasionalmente incapacitantes de dolor óseo, articular y/o muscular 6. En el ensayo HORIZON, según el informe de evaluación de la FDA 7, el 5,7% de los pacientes del grupo zoledrónico presentaron dolor óseo frente al 2,3% del grupo placebo. Osteonecrosis de la mandíbula (OM) De forma poco frecuente, se han descrito casos de osteonecrosis en la mandíbula, predominantemente en pacientes con cáncer tratados con bisfosfonatos, incluyendo ácido zoledrónico. En el ensayo HORIZON, con una duración de 3 años, no se observó un incremento en la incidencia de osteonecrosis. Se ha observado en los pacientes con neoplasias que al incrementarse el numero de infusiones (dosis acumulada) aumentaba el riesgo de padecer OM, por lo que es muy importante disponer de datos a largo plazo 4. Fibrilación auricular En el ensayo HORIZON se observó una mayor incidencia de fibrilación auricular tanto en las graves (1,3% frente a 0,5% del grupo placebo) como en la incidencia global (2,5% frente a 1,9%). Al realizar la evaluación conjunta de los principales ensayos sobre osteoporosis 2,5 se observó un incremento de las reacciones adversas graves de fibrilación auricular, 1,3% para zoledrónico y 0,8% para placebo, siendo las incidencias conjuntas de fibrilación auricular comparables (zoledrónico 2,6% y placebo 2,1%). La mayor parte de las fibrilaciones ocurrieron más de 30 días después de la infusión. Se desconoce el mecanismo causante del aumento de la incidencia de fibrilación auricular. 6
7 Seguridad renal El ácido zoledrónico se ha asociado con insuficiencia renal manifestada como deterioro de la función renal y en casos raros como insuficiencia renal aguda. La insuficiencia renal se ha observado tras la administración de ácido zoledrónico, especialmente en pacientes con compromiso renal previo o factores de riesgo adicionales (pacientes oncológicos con quimioterapia, medicación nefrotóxica concomitante, deshidratación grave) 1. Se ha postulado que pudieran ser más frecuentes estos problemas renales que en el resto de bisfosfonatos 8. En el ensayo Horizon 2,4,9 se observó una mayor incidencia de complicaciones renales (2,2% frente a 1,6%) principalmente debido a un aumento transitorio de la creatinina sérica dentro de los 10 días (1,8% de los pacientes tratados con zoledrónico frente a un 0,8% de los pacientes tratados con placebo), en la proteinuria (1,8% frente a 0,18%) y también en la incidencia de glomerulonefritis transitoria 4. No se observaron diferencias en los efectos a largo plazo, a lo largo de los 36 meses, en la disminución del aclaramiento de creatinina, en el incremento de la creatinina sérica ni en la proteinuria. Se notificaron 8 casos de fallo renal agudo en el grupo del zoledrónico frente a 1 caso en el grupo del placebo 4. En el ensayo HORIZON-FR 5 no se observaron diferencias en la incidencia de complicaciones renales o urinarias. Pero en este último ensayo no se valoró la función renal dentro de los 10 primeros días tras la infusión. No se sabe cuáles pueden ser las complicaciones a largo plazo de estas elevaciones transitorias de la creatinina 3. El Plan de gestión de riesgos de la Agencia Europea de Medicamentos incluye: síntomas post-administración, alteraciones renales, complicaciones oftalmológicas, hipocalcemias, osteonecrosis de mandíbula, necrosis avascular pseudoartrosis o retraso en la consolidación de las fracturas, fibrilación auricular, acontecimientos adversos cerebrovasculares o gastrointestinales 3. Contraindicaciones 1 Hipersensibilidad al principio activo o a alguno de los excipientes o a cualquier bisfosfonato. Pacientes con hipocalcemia. Mujeres embarazadas y en periodo de lactancia. Precauciones especiales de empleo 1 Debe hidratarse adecuadamente a los pacientes. Esto es especialmente importante para los pacientes de edad avanzada y para los que reciben tratamiento con diuréticos. También, se debe realizar una determinación del nivel de creatinina sérica a los pacientes antes de su administración. Antes de iniciar el tratamiento debe tratarse la hipocalcemia preexistente mediante el aporte adecuado de calcio y vitamina D. También deben tratarse eficazmente otras alteraciones del metabolismo mineral (p.ej. disminución en la reserva paratiroidea, malabsorción intestinal de calcio). Debido al riesgo de padecer una osteonecrosis de mandíbula. En aquellos pacientes con factores de riesgo concomitantes (p.ej. cáncer, quimioterapia, corticosteroides, una higiene oral pobre) debe considerarse un examen dental con una adecuada odontología preventiva antes del tratamiento con bisfosfonatos. Durante el tratamiento estos pacientes deben evitar, si es posible, procedimientos dentales invasivos. Hay 7
8 que tener en cuenta que, su utilización a dosis superiores y en pacientes oncológicos se ha asociado a las osteonecrosis de mandíbula 10. Utilización en situaciones especiales 1 Insuficiencia renal: No se recomienda su uso en pacientes con aclaramiento de creatinina < 35 ml/min debido a la limitada experiencia clínica en este grupo de población. No es necesario un ajuste de dosis en pacientes con aclaramiento de creatinina 35 ml/min. Insuficiencia hepática: No es necesario ningún ajuste de dosis Mayores de 65 años: No es necesario ajustar la dosis Menores de 18 años: no está recomendado para uso en niños y adolescentes menores de 18 años debido a la ausencia de datos sobre seguridad y eficacia. Embarazo: Esta contraindicado. No existen datos suficientes sobre la utilización de ácido zoledrónico en mujeres embarazadas. Los estudios en animales con ácido zoledrónico han mostrado efectos de toxicidad en la reproducción incluyendo malformaciones Lactancia: Esta contraindicado. Se desconoce si el ácido zoledrónico se excreta en la leche materna. Interacciones 1 Se debe tener precaución cuando se administra conjuntamente con medicamentos que pueden afectar significativamente a la función renal (p.ej. aminoglucósidos o diuréticos que pueden causar deshidratación). No se han realizado estudios específicos de interacción fármaco-fármaco con ácido zoledrónico. El ácido zoledrónico no se metaboliza sistémicamente y no afecta las enzimas humanas del citocromo P450 in vitro, tampoco se une considerablemente a proteínas plasmáticas (aproximadamente un 43-55%) por lo que son improbables las interacciones debidas al desplazamiento de medicamentos altamente unidos a proteínas. LUGAR EN TERAPÉUTICA El ácido zoledrónico (Aclasta ) es un bisfosfonato inyectable que ha recibido la indicación de tratamiento de la osteoporosis. Este principio activo ya estaba en el mercado (Zometa ) para el tratamiento de la hipercalcemia inducida por tumores. El tratamiento de elección de los pacientes con alto riesgo de padecer fracturas osteoporóticas son los bisfosfonatos 11,12,13. El ácido zoledrónico no se ha comparado con otros bisfosfonatos en los ensayos en los que se evaluó la eficacia en la disminución de la incidencia de fracturas, ya que solo se ha ensayado frente a placebo. Las comparaciones indirectas son difíciles ya que las poblaciones de los diferentes estudios no eran iguales. Hay que tener en cuenta que la ausencia de un brazo comparador nos impide tener una certeza de si el ácido zoledrónico es no inferior a otros bisfosfonatos, pero los datos obtenidos son similares a los obtenidos por alendronato o risedronato. De los bisfosfonatos orales que tienen la indicación, del tratamiento de la osteoporosis, el ibandronato ni en la presentación oral ni en la intravenosa ha demostrado ser eficaz en la reducción de las fracturas de cuello femoral. 8
9 En el caso de los varones tan sólo hay datos de incremento de DMO y se extrapolan los teóricos beneficios observados en las mujeres, pero no hay evidencia de que disminuyan las fracturas y menos de que el efecto sea equivalente al observado en el caso de las mujeres. Con respecto a su perfil de seguridad hay que destacar, además de la alta incidencia de efectos post administración de carácter generalmente leves o moderados, las importantes incertidumbres que hay acerca del incremento de la fibrilación auricular, de la seguridad renal a largo plazo y el efecto que pueda tener el tratamiento a largo plazo en la incidencia de osteonecrosis de mandíbula, en las consolidaciones de las fracturas o en la incidencia de fracturas femorales atípicas. No hay datos sobre sus efectos a más de tres años. Este es un punto trascendental que, a pesar de los numerosos ensayos realizados y el importante coste económico que tienen estos tratamientos en los sistemas de salud, aún no hay información suficiente. Se sigue sin saber, cuál es la eficacia de los tratamientos para la osteoporosis en la prevención de las fracturas a largo plazo. No son nada tranquilizantes los datos aportados en el informe de la EMEA sobre la diferente eficacia del tratamiento en el subgrupo de los pacientes tratados previamente con bisfosfonatos y los datos del único ensayo a largo plazo, el ensayo FLEX 14. En este último, no había diferencias en la incidencia de fracturas totales ni en las no vertebrales entre el grupo tratado con alendrónico durante 10 años frente al tratado durante cinco años con bisfosfonato y posteriormente otros 5 con placebo. Hasta que no se disponga de nuevas evidencias la eficacia de estos tratamientos a largo plazo (más allá de tres-cinco años) en la prevención de fracturas totales sigue sin estar probada ni siquiera en los pacientes de más alto riesgo. El tratamiento anual con ácido zoledrónico es un 36% más caro que el coste anual del tratamiento con ácido alendrónico. A esto habría que añadir los importantes costes hospitalarios que supone su administración y control. RESUMEN ANÁLISIS COMPARATIVO INDICACIÓN: tratamiento de la Osteoporosis Fármaco comparador: bisfosfonatos orales (alendronato y risedronato). Eficacia: similar. No hay comparaciones directas con otros bisfosfonatos. En las comparaciones indirectas la reducción de las fracturas es similar. No hay datos sobre sus efectos a más de tres años. Seguridad: similar o inferior. No se disponen de datos a medio o largo plazo en los que se compare frente a bisfosfonatos orales. No hay datos de la seguridad a largo plazo del tratamiento de la osteoporosis con ácido zoledrónico y han ocurrido graves complicaciones en el tratamiento de pacientes con enfermedades malignas en otras indicaciones. Pauta: diferente. Presenta la ventaja de una sola administración al año y el inconveniente de ser intravenoso. Es el único bisfosfonato intravenoso autorizado para el tratamiento de la osteoporosis. Coste: Superior 9
10 Principio activo Presentación Coste tratamiento año ( ) Ac. alendrónico 70 mg / 7 días v.o 269 Ac risedrónico 35 mg / 7 días v.o 482 Ac risedrónico 75 mg (2) / mes v.o 416 Ac. ibandrónico 3 mg / 3 mes i.v 475 Ac. zoledrónico 5 mg / año i.v 416 Teriparatida 20 mcg / día s.c Ranelato de estroncio 2 g / día v.o 452 CONCLUSIONES El ácido zoledrónico es un bisfosfonato que se ha utilizado para el tratamiento de las hipercalcemias en los pacientes oncológicos y que a la dosis de 5 mg una vez al año está indicada para el tratamiento de la osteoporosis. Ha demostrado una disminución de la incidencia de fracturas similares a las observadas por otros bisfosfonatos orales como risedronato y alendronato en otros ensayos y en otras poblaciones. No existe ningún ensayo con un tamaño muestral suficiente para comparar la eficacia y seguridad del ácido zoledrónico frente a estos bisfosfonatos orales, o sobre los teóricos beneficios de incremento del cumplimiento. En cuanto a su seguridad, queda por aclarar el posible incremento de la fibrilación auricular y el efecto a largo plazo sobre la función renal y el metabolismo óseo (por ejemplo, las osteonecrosis de mandíbula, los problemas en la consolidación de las fracturas o las fracturas atípicas). Estos últimos se han visto a dosis superiores y en pacientes oncológicos con el mismo principio activo. La vía de administración, intravenosa, es más incomoda y peligrosa y el coste es superior, por lo que es un fármaco que no ha demostrado ser superior a los bisfosfonatos orales que disponemos. Es imprescindible disponer de datos de seguridad y eficacia a largo plazo de los bisfosfonatos. CALIFICACIÓN: NO SUPONE UN AVANCE TERAPÉUTICO La evaluación de novedades terapéuticas en el momento de su comercialización se apoya en información cuya validez puede verse limitada con el paso del tiempo, por lo que debe ser empleada con precaución. Esta evaluación ha sido realizada de acuerdo con el Procedimiento Normalizado de Trabajo de los Comités de Evaluación de Nuevos Medicamentos de Andalucía, País Vasco, Cataluña, Aragón y Navarra 10
11 Referencia (Autor, publicación ) Black MD et al NEnglJMed 2007; 356: Ref. 2 Financiado por Novartis Tipo de estudio y objetivo ECA doble ciego controlado con placebo multicéntrico Objetivo: evaluar la eficacia y seguridad del zoledrónico comparado con placebo en el tratamiento de la osteoporosis en mujeres postmenopaúsicas Población estudiada (Criterios de inclusión/exclusión) Pacientes 65 años y < 89 años Con DMO en el cuello femoral < -2,5 DE con o sin fracturas vertebrales o DMO cuello femoral < -1,5 DE y 2 fracturas vertebrales leves o 1 moderada n=7.756 mujeres (población ITT=7.736) Criterios de exclusión: Uso anterior de NaF, hormona paratiroidea o ranelato de estroncio; uso en los 6 meses previos de esteroides u hormona del crecimiento, o corticoides sistémicos en los 12 meses previos. Pacientes con Ca sérico > 2,75 mmol/l o < 2,00 mmol/l, o con aclaramiento de la creatinina < 30 ml*min o con un resultado en la tira de urea de 2+ para las proteínas Pauta de tratamiento Variables de medida (end-point) Zoledrónico 5 mg/año (n=3.889) Placebo (n=3.876) Todos los pacientes recibieron calcio ( mg/día) y vitamina D ( UI/día) Duración: 3 años Pérdidas similares todos grupos Variable principal: Reducción de las nuevas fracturas vertebrales morfométricas en los pacientes que no estaban tomando medicación para la osteoporosis en el momento de la aleatorización Reducción de las nuevas fracturas de cadera incluyendo todos los pacientes Efectos adversos (EA) Resultados (tamaño del efecto/ valores p/ intervalos de confianza) Zol 3,3 % PBO 10,9 % RR 0,30 (IC95% 0,24-0,38) Zol 2,5 % PBO 1,4 % HR 0,59 (0,42-0,83) Calidad del estudio (escala Jadad) Aleatoriz.: 1+1 Ciego: 1 Pérdidas: 1 Total: 4 Cualquier EA Zol 93,9 % PBO 95,5 % Muerte Zol 2,9 % PBO 3,4 % 11
12 Referencia (Autor, publicación ) Lyles KW et al NEnglJMed 2007; 357: Ref. 4 Financiado por Novartis Tipo de estudio y objetivo ECA doble ciego controlado con placebo multicéntrico Objetivo: evaluar la eficacia y seguridad del zoledrónico comparado con placebo en el tratamiento de los pacientes con fracturas de cadera previas. Población estudiada (Criterios de inclusión/exclusión) Pacientes 50 años que han tenido una fractura de cadera de bajo impacto en los 90 días previos a su inclusión y deambulaban antes de la fractura n=2.127 (población ITT=2.127) Criterios de exclusión: hipersensibilidad previa a bifosfonatos, embarazadas, con cancer activo, con enfermedades metabólicas oseas distintas de la osteoporosis, con Ca sérico > 2,8 mmol/l o < 2,00 mmol/l, o con aclaramiento de la creatinina < 30 ml*min o con esperanza de vida a juicio del investigador menor de 6 meses Pauta de tratamiento Variables de medida (end-point) Zoledrónico 5 mg/año (n=1.065) Placebo (n=1.062) Todos los pacientes recibieron calcio ( mg/día) y vitamina D ( UI/día) Duración: mediana de 1,9 años Pérdidas similares todos grupos Variable principal: Reducción de las nuevas fracturas excluyendo las faciales, las digitales y en huesos con deformidades (EJ con metastasis) Variables secundarias: Fracturas no vertebrales Fracturas de cadera Fracturas vertebrales Resultados (tamaño del efecto/ valores p/ intervalos de confianza) Zol 8,6 % PBO 13,9 % HR 0,65 (IC95% 0,50-0,84) Zol 7,6 % PBO 10,7 % HR 0,73 (IC95% 0,55-0,98) Zol 2,0 % PBO 3,5 % HR 0,70 (IC95% 0,41-1,19) Zol 3,8 % PBO 9,6 % HR 0,54 (IC95% 0,32-0,92) Calidad del estudio (escala Jadad) Aleatoriz.: 1+1 Ciego: 1 Pérdidas: 1 Total: 4 Efectos adversos (EA) Cualquier EA Zol 82,3 % PBO 80,6 % Muerte Zol 9,6 % PBO 13,3 % HR 0,72 (IC95% 0,56-0,93) 12
13 13
14 BIBLIOGRAFÍA 1 Ficha Técnica de Zoledrónico. Laboratorio Novartis. Disponible en URL [consultado enero 2009]. 2 Black DM et al. Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. N Engl J Med. 2007; 356: European Public Assessment Report (EPAR). Zoledrónico. Scientific discussion. London (UK): European Medicines Agency; 2007 Sep. Procedure N.º: EMEA/H/C/595/II/16. Disponible en 4 European Public Assessment Report (EPAR). Zoledrónico. Scientific discussion. London (UK): European Medicines Agency; 2007 Sep. Procedure N.º: EMEA/H/C/595/II/10. Disponible en 5 Lyles KW et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med 2007; 357: FDA Alert (1/07/2008) Information on Bisphosphonates 7 Lubas W. Clinical Review Reclast center for drug evaluation and research. Fda (Accedido el 2 de abril de 2009) 8 Topliss D et al. Renal impairment with zoledronic acid. Australian adverse drug reaction bulletin. 2007;5: Boonen S et al. Renal safety of annual zoledrónico acid infusión in osteoporotic postmenopausal women. Kidney Int. 2008;74: Woo SB. Et al. Systematic Review: Bisphosphonates and Osteonecrosis of the Jaws. Ann Intern Med 2006; 144: Qaseem A et al. Pharmacologic Treatment of Low Bone Density or Osteoporosis to Prevent Fractures: A Clinical Practice Guideline from the American College of Physicians. Ann Intern Med 2008; 149: NICE technology appraisal guidance 160 Alendronate, etidronate, risedronate, raloxifene and strontium ranelate for the primary prevention of osteoporotic fragility fractures in postmenopausal women (Accedido el 3 de febrero de 2009) 13 NICE technology appraisal guidance 161 Alendronate, etidronate, risedronate, raloxifene, strontium ranelate and teriparatide for the secondary prevention of osteoporotic fragility fractures in postmenopausal women. (Accedido el 3 de febrero de 2009) 14 Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of treatment. The Fracture Intervention Trial Long-term Extension (FLEX): A Randomized Trial. JAMA. 2006;296(24):
TRATAMIENTOS ANTI-REABSORTIVOS: CUANTO TIEMPO DARLOS Y POR QUE?
 TRATAMIENTOS ANTI-REABSORTIVOS: CUANTO TIEMPO DARLOS Y POR QUE? DR. HECTOR GAJARDO LAMAS DIRECTOR, SOCIEDAD CHILENA DE OSTEOLOGIA Y METABOLISMO MINERAL DIRECTOR, SOCIEDAD CHILENA DE ENDOCRINOLOGIA Y DIABETES
TRATAMIENTOS ANTI-REABSORTIVOS: CUANTO TIEMPO DARLOS Y POR QUE? DR. HECTOR GAJARDO LAMAS DIRECTOR, SOCIEDAD CHILENA DE OSTEOLOGIA Y METABOLISMO MINERAL DIRECTOR, SOCIEDAD CHILENA DE ENDOCRINOLOGIA Y DIABETES
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
IBANDRONATO INTRAVENOSO
 IBANDRONATO INTRAVENOSO en osteoporosis en mujeres posmenopáusicas con elevado riesgo de fractura. (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias) Fecha
IBANDRONATO INTRAVENOSO en osteoporosis en mujeres posmenopáusicas con elevado riesgo de fractura. (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias) Fecha
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
Ácido Zoledrónico. Servei de Farmàcia Centre d Informació de Medicaments Informe CFT: Ácido Zoledrónico 1/7
 Centre d Informació de Medicaments Informe CFT: Ácido Zoledrónico 1/7 Ácido Zoledrónico Tratamiento de la enfermedad de Paget Informe para la Comisión Farmacoterapéutica del Hospital Universitario Vall
Centre d Informació de Medicaments Informe CFT: Ácido Zoledrónico 1/7 Ácido Zoledrónico Tratamiento de la enfermedad de Paget Informe para la Comisión Farmacoterapéutica del Hospital Universitario Vall
FÁRMACOS ANTIRRESORTIVOS
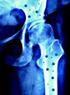 FÁRMACOS ANTIRRESORTIVOS Dra. Esther Álvarez Rodríguez Coordinadora de Formación del Área de Urgencias Hospital Universitario Severo Ochoa Leganés (Madrid) Raloxifeno Bazedoxifeno Alendronato Risedronato
FÁRMACOS ANTIRRESORTIVOS Dra. Esther Álvarez Rodríguez Coordinadora de Formación del Área de Urgencias Hospital Universitario Severo Ochoa Leganés (Madrid) Raloxifeno Bazedoxifeno Alendronato Risedronato
Osteoporosis en Hombres. Dra. Sofía Oviedo G.
 Osteoporosis en Hombres Dra. Sofía Oviedo G. Osteoporosis en Hombres Fracturas vertebrales: 2% en hombres Fracturas de cadera: 3% en hombres Prevalencia (5 años) Riesgo Fractura Mujeres: 35% 39.7% Hombres:
Osteoporosis en Hombres Dra. Sofía Oviedo G. Osteoporosis en Hombres Fracturas vertebrales: 2% en hombres Fracturas de cadera: 3% en hombres Prevalencia (5 años) Riesgo Fractura Mujeres: 35% 39.7% Hombres:
INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS
 INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS Principio activo: Nombre Comercial y presentación: ALENDRONATO Semanal FOSAMAX Semanal 70 mg (Merck Sharp & Dohme de España, S.A) 70 mg
INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS Principio activo: Nombre Comercial y presentación: ALENDRONATO Semanal FOSAMAX Semanal 70 mg (Merck Sharp & Dohme de España, S.A) 70 mg
ENFERMEDAD CELIACA Y OSTEOPOROSIS. José Luis Perez Castrillón Servicio Medicina Interna Hospital Rio Hortega Valladolid
 ENFERMEDAD CELIACA Y OSTEOPOROSIS José Luis Perez Castrillón Servicio Medicina Interna Hospital Rio Hortega Valladolid OSTEOPOROSIS Y ENFERMEDAD CELIACA Hay una mayor incidencia de osteoporosis en los
ENFERMEDAD CELIACA Y OSTEOPOROSIS José Luis Perez Castrillón Servicio Medicina Interna Hospital Rio Hortega Valladolid OSTEOPOROSIS Y ENFERMEDAD CELIACA Hay una mayor incidencia de osteoporosis en los
Bisfosfonatos intravenosos y osteoporosis
 SECCIÓN IV: OSTEOPOROSIS. PREVENCIÓN Y TRATAMIENTO CAPÍTULO 35 Bisfosfonatos intravenosos y osteoporosis José Luis Hernández Hernández La principal limitación de los bisfosfonatos orales es su pobre absorción
SECCIÓN IV: OSTEOPOROSIS. PREVENCIÓN Y TRATAMIENTO CAPÍTULO 35 Bisfosfonatos intravenosos y osteoporosis José Luis Hernández Hernández La principal limitación de los bisfosfonatos orales es su pobre absorción
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg. COMPOSICIÓN Cada comprimido recubierto contiene: Excipientes: Según lo aprobado en Registro
 ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM
 FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM 1.1 Acción: Antidepresivo. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Inhibe la recaptación de serotonina a nivel de la membrana neuronal,
FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM 1.1 Acción: Antidepresivo. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Inhibe la recaptación de serotonina a nivel de la membrana neuronal,
Frecuencia y vía de administración. 500 mg Equinos Una vez (el tratamiento puede repetirse si lo recomienda el veterinario) Vía intravenosa
 Anexo I Relación de los nombres, formas farmacéuticas y dosis de los medicamentos veterinarios, y de las especies animales, vías de administración y titulares de la autorización de comercialización en
Anexo I Relación de los nombres, formas farmacéuticas y dosis de los medicamentos veterinarios, y de las especies animales, vías de administración y titulares de la autorización de comercialización en
Guía Europea para el diagnóstico y tratamiento de la osteoporosis en la mujer postmenopáusica
 THE EUROPEAN SOCIETY FOR CLINICAL AND ECONOMIC ASPECTS OF OSTEOPOROSIS AND OSTEOARTHRITIS Guía Europea para el diagnóstico y tratamiento de la osteoporosis en la mujer postmenopáusica Produced by JA Kanis,
THE EUROPEAN SOCIETY FOR CLINICAL AND ECONOMIC ASPECTS OF OSTEOPOROSIS AND OSTEOARTHRITIS Guía Europea para el diagnóstico y tratamiento de la osteoporosis en la mujer postmenopáusica Produced by JA Kanis,
FICHA TECNICA. Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ZULEX 333 mg, Comprimidos recubiertos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ZULEX 333 mg, Comprimidos recubiertos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Acamprosato 333 mg Para consultar la lista completa de excipientes, ver sección 6.1
FICHA TÉCNICA. Adultos y niños mayores de 12 años: máximo 10 mg al día en una única toma
 1. NOMBRE DEL MEDICAMENTO REACTINE 10 mg Comprimidos FICHA TÉCNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de cetirizina (DOE) dihidrocloruro Lista de excipientes, en 6.1
1. NOMBRE DEL MEDICAMENTO REACTINE 10 mg Comprimidos FICHA TÉCNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de cetirizina (DOE) dihidrocloruro Lista de excipientes, en 6.1
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Grupo Terapéutico: M05BA04. Agentes que afectan la estructura ósea y la mineralización.
 ALENDRONATO + VITAMINA D 3 NO APORTA NADA NUEVO Fecha de elaboración: marzo 2006 Nueva asociación Marca registrada (Laboratorio): Fosavance (MSD) Fecha autorización (procedimiento): agosto 2005 (centralizado)
ALENDRONATO + VITAMINA D 3 NO APORTA NADA NUEVO Fecha de elaboración: marzo 2006 Nueva asociación Marca registrada (Laboratorio): Fosavance (MSD) Fecha autorización (procedimiento): agosto 2005 (centralizado)
COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE ARAGÓN INFORME DE EVALUACIÓN
 COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE ARAGÓN INFORME DE EVALUACIÓN Principio activo Nombre comercial y presentaciones DENOSUMAB PROLIA 60mg jeringa precargada 1ml sol inyectable (Amgen Europe
COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE ARAGÓN INFORME DE EVALUACIÓN Principio activo Nombre comercial y presentaciones DENOSUMAB PROLIA 60mg jeringa precargada 1ml sol inyectable (Amgen Europe
AutorSPCosteoporVar.FT.doc FICHA TÉCNICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO OSTEOPOR 830 mg comprimidos recubiertos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Complejo de oseína-hidroxiapatita (COH) 830 mg, compuesto por: 75 mg de péptidos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO OSTEOPOR 830 mg comprimidos recubiertos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Complejo de oseína-hidroxiapatita (COH) 830 mg, compuesto por: 75 mg de péptidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TÉCNICA. LORATADINA KERN PHARMA está indicado para el tratamiento sintomático de rinitis alérgica y urticaria idiopática crónica.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
ZOLNIC Ácido Zoledrónico Solución Inyectable
 Información para prescribir Reducida ZOLNIC Ácido Zoledrónico Solución Inyectable FORMA FARMACÉUTICA Y FORMULACIÓN Cada frasco ámpula contiene: Ácido zoledrónico monohidratado equivalente a... 4 mg de
Información para prescribir Reducida ZOLNIC Ácido Zoledrónico Solución Inyectable FORMA FARMACÉUTICA Y FORMULACIÓN Cada frasco ámpula contiene: Ácido zoledrónico monohidratado equivalente a... 4 mg de
OSTEOPOROSIS O L I V E R T O S T E - B E L L O D O R T A R 2 M F Y C T U T O R A : M ª J O S E M O N E D E R O M I R A C S R A F A L A F E N A
 OSTEOPOROSIS O L I V E R T O S T E - B E L L O D O R T A R 2 M F Y C T U T O R A : M ª J O S E M O N E D E R O M I R A C S R A F A L A F E N A S E P T I E M B R E 2 0 1 5 Qué es? Alteración de la estructura
OSTEOPOROSIS O L I V E R T O S T E - B E L L O D O R T A R 2 M F Y C T U T O R A : M ª J O S E M O N E D E R O M I R A C S R A F A L A F E N A S E P T I E M B R E 2 0 1 5 Qué es? Alteración de la estructura
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Ácido zoledrónico Actavis 4 mg/5 ml concentrado para solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Ácido zoledrónico Actavis 4 mg/5 ml concentrado para solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA
APROXIMACIÓN PRÁCTICA AL DIAGNÓSTICO Y TRATAMIENTO DE LA OSTEOPOROSIS
 APROXIMACIÓN PRÁCTICA AL DIAGNÓSTICO Y TRATAMIENTO DE LA OSTEOPOROSIS José M. Olmos Dpto. Medicina Interna Hospital Universitario M. Valdecilla Universidad de Cantabria. Santander. Definición de osteoporosis
APROXIMACIÓN PRÁCTICA AL DIAGNÓSTICO Y TRATAMIENTO DE LA OSTEOPOROSIS José M. Olmos Dpto. Medicina Interna Hospital Universitario M. Valdecilla Universidad de Cantabria. Santander. Definición de osteoporosis
INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS
 INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS Principio activo HORMONA PARATIROIDEA HUMANA RECOMBINANTE rpth (1-84) Nombre Comercial y presentaciones Preotact (Nycomed Danmark ApS)
INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS Principio activo HORMONA PARATIROIDEA HUMANA RECOMBINANTE rpth (1-84) Nombre Comercial y presentaciones Preotact (Nycomed Danmark ApS)
Jornadas Osatzen 2008
 PERFIL DE LAS PERSONAS CONSUMIDORAS DE FÁRMACOS RELACIONADOS CON LA OSTEOPOROSIS Grupo investigación Comarca Oeste Gipuzkoa Jornadas Osatzen 2008 Definiciones OSTEOPOROSIS (OMS1993) Enfermedad sistémica
PERFIL DE LAS PERSONAS CONSUMIDORAS DE FÁRMACOS RELACIONADOS CON LA OSTEOPOROSIS Grupo investigación Comarca Oeste Gipuzkoa Jornadas Osatzen 2008 Definiciones OSTEOPOROSIS (OMS1993) Enfermedad sistémica
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Ácido alendrónico semanal Kern Pharma 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido alendrónico semanal Kern Pharma 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene el equivalente de 70 mg de ácido alendrónico
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido alendrónico semanal Kern Pharma 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene el equivalente de 70 mg de ácido alendrónico
Cada comprimido contiene 70 mg de ácido alendrónico (como alendronato sódico trihidrato).
 1. NOMBRE DEL MEDICAMENTO Ácido alendrónico semanal STADA 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 70 mg de ácido alendrónico (como alendronato sódico trihidrato).
1. NOMBRE DEL MEDICAMENTO Ácido alendrónico semanal STADA 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 70 mg de ácido alendrónico (como alendronato sódico trihidrato).
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
INTRODUCCION neoplasias 20-30 %
 HIPERCALCEMIA INTRODUCCION - El hiperparatiroidismo primario y las neoplasias representan el 90 % de los casos de hipercalcemia. - Las neoplasias son la causa más frecuente de hipercalcemia en el paciente
HIPERCALCEMIA INTRODUCCION - El hiperparatiroidismo primario y las neoplasias representan el 90 % de los casos de hipercalcemia. - Las neoplasias son la causa más frecuente de hipercalcemia en el paciente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: ACIDO ALENDRONICO SEMANAL KERN PHARMA 70 mg Forma farmacéutica: Comprimido Fortaleza: 70,0 mg Presentación: Estuche por un blíster de PVC/PVDC/AL
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: ACIDO ALENDRONICO SEMANAL KERN PHARMA 70 mg Forma farmacéutica: Comprimido Fortaleza: 70,0 mg Presentación: Estuche por un blíster de PVC/PVDC/AL
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
Ácido cítrico anhidro mg
 DIFENHIDRAMINA CLORHIDRATO Solución (Jarabe) Control Médico Recomendado Industria Argentina Cada 100 ml de jarabe contiene: DIFENHIDRAMINA CLORHIDRATO.. 250 mg Ácido cítrico anhidro... 400 mg 1 / 9 Benzoato
DIFENHIDRAMINA CLORHIDRATO Solución (Jarabe) Control Médico Recomendado Industria Argentina Cada 100 ml de jarabe contiene: DIFENHIDRAMINA CLORHIDRATO.. 250 mg Ácido cítrico anhidro... 400 mg 1 / 9 Benzoato
ESTATINAS EN PERSONAS MAYORES
 ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
Prospecto: información para el paciente. Ácido Zoledrónico Accord 4 mg/100 ml solución para perfusión EFG
 Prospecto: información para el paciente Ácido Zoledrónico Accord 4 mg/100 ml solución para perfusión EFG Lea todo el prospecto detenidamente antes de empezar a usar este medicamento. Conserve este prospecto,
Prospecto: información para el paciente Ácido Zoledrónico Accord 4 mg/100 ml solución para perfusión EFG Lea todo el prospecto detenidamente antes de empezar a usar este medicamento. Conserve este prospecto,
DIAGNOSTICO Y TRATAMIENTO DE LAS FRACTURAS VERTEBRALES
 DIAGNOSTICO Y TRATAMIENTO DE LAS FRACTURAS VERTEBRALES Carlos Vitoviz R2 Reumatología DEFINICIÓN DE OSTEOPOROSIS Es una enfermedad esquelética caracterizada por una pérdida de masa ósea, deterioro de
DIAGNOSTICO Y TRATAMIENTO DE LAS FRACTURAS VERTEBRALES Carlos Vitoviz R2 Reumatología DEFINICIÓN DE OSTEOPOROSIS Es una enfermedad esquelética caracterizada por una pérdida de masa ósea, deterioro de
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
ANEXO III RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO III RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nota: Este RCP es el que estaba anexo a la Decisión de la Comisión de esta remisión conforme al Artículo 31 de los medicamentos que contienen calcitonina.
ANEXO III RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nota: Este RCP es el que estaba anexo a la Decisión de la Comisión de esta remisión conforme al Artículo 31 de los medicamentos que contienen calcitonina.
ACLASTA 5 mg/100 ml ACIDO ZOLEDRONICO Solución para infusión
 Novartis ACLASTA 5 mg/100 ml ACIDO ZOLEDRONICO Solución para infusión Venta bajo receta archivada Industria Suiza FORMULA Cada frasco ampolla de 100 ml contiene: Acido zoledrónico (como ácido zoledrónico
Novartis ACLASTA 5 mg/100 ml ACIDO ZOLEDRONICO Solución para infusión Venta bajo receta archivada Industria Suiza FORMULA Cada frasco ampolla de 100 ml contiene: Acido zoledrónico (como ácido zoledrónico
FICHA DE INFORMACIÓN AL PACIENTE: ESPIRONOLACTONA
 FICHA DE INFORMACIÓN AL PACIENTE: ESPIRONOLACTONA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Diurético y antihipertensivo, por alteración del mecanismo de funcionamiento renal con aumento de la eliminación
FICHA DE INFORMACIÓN AL PACIENTE: ESPIRONOLACTONA 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Diurético y antihipertensivo, por alteración del mecanismo de funcionamiento renal con aumento de la eliminación
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
MUCOSEC Ambroxol clorhidrato 300 mg Jarabe
 MUCOSEC Ambroxol clorhidrato 300 mg Jarabe MUCOSEC PEDIÁTRICO 15 mg / 5 ml JARABE Ambroxol clorhidrato EXPECTORANTE MUCOLÍTICO COMPOSICIÓN: Cada 100 ml contiene: Ambroxol clorhidrato...300 mg Excipientes...c.s.p.
MUCOSEC Ambroxol clorhidrato 300 mg Jarabe MUCOSEC PEDIÁTRICO 15 mg / 5 ml JARABE Ambroxol clorhidrato EXPECTORANTE MUCOLÍTICO COMPOSICIÓN: Cada 100 ml contiene: Ambroxol clorhidrato...300 mg Excipientes...c.s.p.
INTRODUCCIÓN. Otras investigaciones mostraron que el incremento de la glicemia basal en ayunas en hipertiroideos fue más alta que en normales (4,5,6).
 INTRODUCCIÓN La alteración en el metabolismo de la glucosa ha sido descrita en pacientes con hipertiroidismo; muchas investigaciones se han realizado al respecto, siendo sus resultados controversiales.
INTRODUCCIÓN La alteración en el metabolismo de la glucosa ha sido descrita en pacientes con hipertiroidismo; muchas investigaciones se han realizado al respecto, siendo sus resultados controversiales.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
Uteroinhibidores. Dra. Josefina Tarigo Julio 2015
 Uteroinhibidores Dra. Josefina Tarigo Julio 2015 Introducción El parto pretérmino es una de las principales causas de morbimortalidad neonatal. Ocurre en aproximadamente 10% de los nacimientos. Ocurre
Uteroinhibidores Dra. Josefina Tarigo Julio 2015 Introducción El parto pretérmino es una de las principales causas de morbimortalidad neonatal. Ocurre en aproximadamente 10% de los nacimientos. Ocurre
FRACTURA VERTEBRAL CASO CLINICO
 FRACTURA VERTEBRAL CASO CLINICO Mujeres de 65 años Tras cargar peso nota un dolor agudo en región dorsal baja De urgencias la derivan a la consulta con la siguiente radiografía FRACTURA VERTEBRAL Qué actitud
FRACTURA VERTEBRAL CASO CLINICO Mujeres de 65 años Tras cargar peso nota un dolor agudo en región dorsal baja De urgencias la derivan a la consulta con la siguiente radiografía FRACTURA VERTEBRAL Qué actitud
Osteoporosis: preguntas y respuestas
 Osteoporosis: preguntas y respuestas Qué es la osteoporosis? La conferencia de consenso de la NIH (National Institute of Health) la define como: Es una enfermedad esquelética caracterizada por una resistencia
Osteoporosis: preguntas y respuestas Qué es la osteoporosis? La conferencia de consenso de la NIH (National Institute of Health) la define como: Es una enfermedad esquelética caracterizada por una resistencia
TRATAMIENTO DE LA OSTEOPOROSIS
 TRATAMIENTO DE LA RESUMEN DE LOS PRINCIPIOS DE LA MEDICINA BASADA EN EVIDENCIAS Jerarquía de las evidencias en investigación. Importancia del juicio clínico. Ambos principios deben ser usados en el día
TRATAMIENTO DE LA RESUMEN DE LOS PRINCIPIOS DE LA MEDICINA BASADA EN EVIDENCIAS Jerarquía de las evidencias en investigación. Importancia del juicio clínico. Ambos principios deben ser usados en el día
GUÍAS DE PRACTICA CLÍNICA
 GUÍAS DE PRACTICA CLÍNICA Conjunto de: instrucciones,directrices,afirmaciones o recomendaciones, desarrolladas de forma sistemática cuyo propósito es ayudar a médicos y a pacientes a tomar decisiones,
GUÍAS DE PRACTICA CLÍNICA Conjunto de: instrucciones,directrices,afirmaciones o recomendaciones, desarrolladas de forma sistemática cuyo propósito es ayudar a médicos y a pacientes a tomar decisiones,
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO. FOSATUR 40 UI Solución para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. DENOMINACIÓN DEL MEDICAMENTO FICHA TÉCNICA FOSATUR 40 UI Solución para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Elcatonina es un análogo de la calcitonina de anguila. Una pulverización
1. DENOMINACIÓN DEL MEDICAMENTO FICHA TÉCNICA FOSATUR 40 UI Solución para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Elcatonina es un análogo de la calcitonina de anguila. Una pulverización
EPIDEMIOLOGÍA Y FISIOPATOLOGÍA DE LA
 EPIDEMIOLOGÍA Y FISIOPATOLOGÍA DE LA FRACTURA VERTEBRAL OSTEPORÓTICA DEFINICIÓN - Situación patológica que supone una disminución en cantidad y calidad de la masa ósea. Fractura vertebral espontánea o
EPIDEMIOLOGÍA Y FISIOPATOLOGÍA DE LA FRACTURA VERTEBRAL OSTEPORÓTICA DEFINICIÓN - Situación patológica que supone una disminución en cantidad y calidad de la masa ósea. Fractura vertebral espontánea o
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Calcitonina Hubber 200 UI solución para pulverización nasal en envase unidosis
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Calcitonina Hubber 200 UI solución para pulverización nasal en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Calcitonina Hubber 200 UI solución para pulverización nasal en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
3 de noviembre de 2014. Manuel Mesa Ramos Presidente de la SATO
 ALGORITMOS DE TRATAMIENTO MÉDICO POR OSTEOPOROSIS A PACIENTES CON ALTO RIESGO DE FRACTURA OSTEOPORÓTICA Y A PACIENTES CON FRACTURA DE CADERA OSTEOPORÓTICA Grupo de consenso: Por la SECOT-GEIOS: Dr. José
ALGORITMOS DE TRATAMIENTO MÉDICO POR OSTEOPOROSIS A PACIENTES CON ALTO RIESGO DE FRACTURA OSTEOPORÓTICA Y A PACIENTES CON FRACTURA DE CADERA OSTEOPORÓTICA Grupo de consenso: Por la SECOT-GEIOS: Dr. José
FICHA TÉCNICA. Excipientes con efecto conocido 1,38 g de sacarosa y 1,10 g glucosa. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
LAMOTRIGINA STADA comprimidos dispersables RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO LAMOTRIGINA STADA comprimidos dispersables RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Lamotrigina STADA comprimidos dispersables se ha realizado siguiendo las Directrices
OBJETIVO LAMOTRIGINA STADA comprimidos dispersables RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Lamotrigina STADA comprimidos dispersables se ha realizado siguiendo las Directrices
FICHA TÉCNICA. Cada comprimido de Ácido Alendrónico Semanal Qualigen contiene 91,37 mg de alendronato sódico trihidratado.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido Alendrónico Semanal Qualigen 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Ácido Alendrónico Semanal Qualigen contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido Alendrónico Semanal Qualigen 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Ácido Alendrónico Semanal Qualigen contiene
Bonviva Ácido ibandrónico
 Bonviva Ácido ibandrónico FOLLETO DE INFORMACION AL PROFESIONAL Bisfosfonato. Fármaco para el tratamiento de enfermedades óseas (M05) 1. DESCRIPCIÓN 1.1 Grupo farmacoterapéutico Bonviva es un bisfosfonato
Bonviva Ácido ibandrónico FOLLETO DE INFORMACION AL PROFESIONAL Bisfosfonato. Fármaco para el tratamiento de enfermedades óseas (M05) 1. DESCRIPCIÓN 1.1 Grupo farmacoterapéutico Bonviva es un bisfosfonato
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 PARACETAMOL 125 mg / 5 ml JARABE ANALGÉSICO ANTIPIRÉTICO Página 1 PARACETAMOL 125 mg / 5 ml Jarabe Principio Activo
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 PARACETAMOL 125 mg / 5 ml JARABE ANALGÉSICO ANTIPIRÉTICO Página 1 PARACETAMOL 125 mg / 5 ml Jarabe Principio Activo
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. 1. NOMBRE DEL MEDICAMENTO Ácido Zoledrónico FARMAGES 4 mg/5 ml concentrado para solución para perfusión EFG
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido Zoledrónico FARMAGES /5 ml concentrado para solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un vial con 5 ml de concentrado contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido Zoledrónico FARMAGES /5 ml concentrado para solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un vial con 5 ml de concentrado contiene
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 MEBENDAZOL 100 mg COMPRIMIDOS RECUBIERTOS ANTIHELMÍNTICO Página 1 MEBENDAZOL 100 mg Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 MEBENDAZOL 100 mg COMPRIMIDOS RECUBIERTOS ANTIHELMÍNTICO Página 1 MEBENDAZOL 100 mg Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
La densitometria osea mide el contenido mineral en el hueso por unidad de area.
 La densitometria osea mide el contenido mineral en el hueso por unidad de area. Densitometría ósea Mide la densidad osea directamente en sitios en que se producen fracturas osteoporoticas. Minima radiacion
La densitometria osea mide el contenido mineral en el hueso por unidad de area. Densitometría ósea Mide la densidad osea directamente en sitios en que se producen fracturas osteoporoticas. Minima radiacion
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
AMOXICILINA/ÁCIDO CLAVULÁNICO STADA 875/125 mg polvo para suspensión oral EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 AMOXICILINA/ÁCIDO CLAVULÁNICO STADA 875/125 mg polvo para suspensión oral EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Amoxicilina/Ácido Clavulánico STADA 875/125
AMOXICILINA/ÁCIDO CLAVULÁNICO STADA 875/125 mg polvo para suspensión oral EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Amoxicilina/Ácido Clavulánico STADA 875/125
Antihiperkalémico - Antihipermagnesémico. Composición. Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g. Excipientes:
 Antihiperkalémico - Antihipermagnesémico. Composición Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g Excipientes: 1 / 21 Sacarato de calcio agua para inyectables c.s. Proporciona: Calcio 0.465
Antihiperkalémico - Antihipermagnesémico. Composición Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g Excipientes: 1 / 21 Sacarato de calcio agua para inyectables c.s. Proporciona: Calcio 0.465
GPC. Guía de Referencia Rápida. Diagnóstico y Tratamiento de Osteoporosis en el Adulto
 Guía de Referencia Rápida Diagnóstico y Tratamiento de Osteoporosis en el Adulto GPC Guía de Práctica Clínica Catalogo Maestro de Guías de Práctica Clínica IMSS-083-08 Guía de Referencia Rápida M 81. X
Guía de Referencia Rápida Diagnóstico y Tratamiento de Osteoporosis en el Adulto GPC Guía de Práctica Clínica Catalogo Maestro de Guías de Práctica Clínica IMSS-083-08 Guía de Referencia Rápida M 81. X
FLUCONAZOL. Solución para infusión IV. 200 mg. ALFARMA S.A., PANAMÁ, REPÚBLICA DE PANAMÁ. Fabricante, país:
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
CIRROSIS BILIAR PRIMARIA
 CIRROSIS BILIAR PRIMARIA TRATAMIENTO Nestor Alberto Sanchez Bartra,, M.D. Hospital Nacional Arzobispo Loayza Perú TRATAMIENTO DE SINTOMAS Y COMPLICACIONES TRATAMIENTO ESPECIFICO TRATAMIENTO DE SINTOMAS
CIRROSIS BILIAR PRIMARIA TRATAMIENTO Nestor Alberto Sanchez Bartra,, M.D. Hospital Nacional Arzobispo Loayza Perú TRATAMIENTO DE SINTOMAS Y COMPLICACIONES TRATAMIENTO ESPECIFICO TRATAMIENTO DE SINTOMAS
Anexo II. Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto
 Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg
 KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg Venta bajo receta Industria Argentina Comprimidos recubiertos FÓRMULA CUALICUANTITATIVA: Cada comprimido recubierto de 50 mg contiene: Losartán potásico 50 mg Excipientes:
KLOSARTAN LOSARTÁN POTÁSICO 50/100 mg Venta bajo receta Industria Argentina Comprimidos recubiertos FÓRMULA CUALICUANTITATIVA: Cada comprimido recubierto de 50 mg contiene: Losartán potásico 50 mg Excipientes:
INFORME DE EVALUACIÓN
 COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE EUSKADI INFORME DE EVALUACIÓN RANELATO DE ESTRONCIO (DCI) Principio activo: Nombre Comercial y presentación: EXPERIENCIA CLÍNICA INSUFICIENTE RANELATO DE
COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE EUSKADI INFORME DE EVALUACIÓN RANELATO DE ESTRONCIO (DCI) Principio activo: Nombre Comercial y presentación: EXPERIENCIA CLÍNICA INSUFICIENTE RANELATO DE
ácido ibandrónico cinfa 150 mg comprimidos recubiertos con película EFG Excipientes: cada comprimido contiene 162,77 mg de lactosa monohidrato.
 1. NOMBRE DEL MEDICAMENTO ácido ibandrónico cinfa 150 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 150 mg de ácido
1. NOMBRE DEL MEDICAMENTO ácido ibandrónico cinfa 150 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 150 mg de ácido
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
Adultos y niños mayores de 12 años 10 mg una vez al día (una cápsula). Las cápsulas se pueden tomar con independencia de las comidas.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Farmalider 10 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula blanda de Loratadina Farmalider 10 mg contiene: Loratadina...10
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Loratadina Farmalider 10 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula blanda de Loratadina Farmalider 10 mg contiene: Loratadina...10
FICHA TÉCNICA. Ácido Alendrónico Semanal Actavis 70 mg comprimidos recubiertos con película EFG
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido Alendrónico Semanal Actavis 70 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene el equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido Alendrónico Semanal Actavis 70 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene el equivalente
Morera T, Jaureguizar N. OCW UPV/EHU Farmacología Aplicada en Odontología
 Morera T, Jaureguizar N. OCW UPV/EHU 2016 Farmacología Aplicada en Odontología 1. La ansiedad en la consulta odontológica 2. Prescripción de fármacos ansiolíticos A. Características farmacocinéticas B.
Morera T, Jaureguizar N. OCW UPV/EHU 2016 Farmacología Aplicada en Odontología 1. La ansiedad en la consulta odontológica 2. Prescripción de fármacos ansiolíticos A. Características farmacocinéticas B.
FICHA TÉCNICA. Comprimidos de color blanco, ovalados y planos, marcados en una cara con 70.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido Alendrónico Semanal ratio 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene el equivalente de 70 mg de ácido alendrónico
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ácido Alendrónico Semanal ratio 70 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene el equivalente de 70 mg de ácido alendrónico
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA
 DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
DIRECCION REGULACION DE LA SALUD CENTRO NACIONAL DE FARMACOVIGILANCIA Comunicación sobre cambios en la información de seguridad de Sibutramina para profesionales sanitarios Mayo de 2010 NOTA INFORMATIVA
REGULADOR DE CALCIO ÓSEO
 REGULADOR DE CALCIO ÓSEO ZONDRA Ácido Alendrónico Tabletas FORMA FARMACÉUTICA Y FORMULACIÓN: Cada Tableta contiene: Alendronato Sódico Equivalente a --------------------------------- 10, 35 y 70 mg de
REGULADOR DE CALCIO ÓSEO ZONDRA Ácido Alendrónico Tabletas FORMA FARMACÉUTICA Y FORMULACIÓN: Cada Tableta contiene: Alendronato Sódico Equivalente a --------------------------------- 10, 35 y 70 mg de
ANASTROZOL 1 mg Tabletas
 ANASTROZOL 1 mg Tabletas ANASTROZOL 1 mg Tabletas Anticanceroso COMPOSICIÓN: Cada tableta contiene: Anastrozol...1 mg Excipientes c.s. ACCIÓN FARMACOLÓGICA: Anastrozol es un inhibidor no esteroidal de
ANASTROZOL 1 mg Tabletas ANASTROZOL 1 mg Tabletas Anticanceroso COMPOSICIÓN: Cada tableta contiene: Anastrozol...1 mg Excipientes c.s. ACCIÓN FARMACOLÓGICA: Anastrozol es un inhibidor no esteroidal de
Lección 40 Metabolismo óseo. Tratamiento farmacológico de la osteoporosis
 Ricardo Brage e Isabel Trapero - Lección 40 UNIDAD X: PROBLEMAS ENDOCRINOS Lección 40 Metabolismo óseo. Tratamiento farmacológico de la osteoporosis Guión Ricardo Brage e Isabel Trapero - Lección 40 1.
Ricardo Brage e Isabel Trapero - Lección 40 UNIDAD X: PROBLEMAS ENDOCRINOS Lección 40 Metabolismo óseo. Tratamiento farmacológico de la osteoporosis Guión Ricardo Brage e Isabel Trapero - Lección 40 1.
Monitorización de niveles de vancomicina en Pediatría
 Monitorización de niveles de vancomicina en Pediatría Chevorn Suzette Adams (R3 Pediatría) María Luz Boquera Ferrer (R4 Farmacia Hospitalaria) Tutor: Dr. Luis Moral 3 febrero, 2016, HGUA. Objetivo Repasar
Monitorización de niveles de vancomicina en Pediatría Chevorn Suzette Adams (R3 Pediatría) María Luz Boquera Ferrer (R4 Farmacia Hospitalaria) Tutor: Dr. Luis Moral 3 febrero, 2016, HGUA. Objetivo Repasar
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS
 ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS C03-. DIURÉTICOS Clasificación ATC C03A-. DIURÉTICOS DE BAJO TECHO, TIAZIDAS C03AA.Tiazidas solas C03AX.Tiazidas asociadas a otras sustancias concentrado
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS C03-. DIURÉTICOS Clasificación ATC C03A-. DIURÉTICOS DE BAJO TECHO, TIAZIDAS C03AA.Tiazidas solas C03AX.Tiazidas asociadas a otras sustancias concentrado
PVP con IVA Vial 5 mg/ 100 ml ,45 369,70
 Ácido Zoledrónico En el tratamiento de la osteoporosis en mujeres post menopausicas (Informe para la Comisión de Farmacia y Terapéutica del Hospital Virgen de las Nieves) Fecha 10/02/2009 1.- IDENTIFICACIÓN
Ácido Zoledrónico En el tratamiento de la osteoporosis en mujeres post menopausicas (Informe para la Comisión de Farmacia y Terapéutica del Hospital Virgen de las Nieves) Fecha 10/02/2009 1.- IDENTIFICACIÓN
Cada dosis única de 100 ml contiene 70 mg de ácido alendrónico (como 91,35 mg de alendronato sódico trihidrato)
 1 NOMBRE DEL MEDICAMENTO Soludronate Semanal 70 mg solución oral 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis única de 100 ml contiene 70 mg de ácido alendrónico (como 91,35 mg de alendronato sódico
1 NOMBRE DEL MEDICAMENTO Soludronate Semanal 70 mg solución oral 2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis única de 100 ml contiene 70 mg de ácido alendrónico (como 91,35 mg de alendronato sódico
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
SERPIENTES Definición:
 SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS BECAPLERMINA
 INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS Principio activo: BECAPLERMINA Nombre Comercial y presentación: REGRANEX (Vita) 0,01% 15 g gel (351,69 ) Conservación: Entre 2ºC y 8ºC.
INFORME DE EVALUACIÓN COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS Principio activo: BECAPLERMINA Nombre Comercial y presentación: REGRANEX (Vita) 0,01% 15 g gel (351,69 ) Conservación: Entre 2ºC y 8ºC.
