Manual Toma de Muestras Análisis Genéticos Humanos
|
|
|
- Mariano Villanueva Naranjo
- hace 7 años
- Vistas:
Transcripción
1 Manual Toma de Muestras
2 Gastrointestinal Muestras Gastrointestinal Contenido 1. Introducción Materia fecal... 1 a) Heces... 1 b) Tórula rectal Muestras digestivas altas... 2 a) Aspirado gástrico... 2 b) Biopsia gástrica/antral obtenida por endoscopia Muestras digestivas bajas... 3 a) Biopsia rectal y sigmoidoscopia Bibliografía Introducción Las infecciones gastrointestinales agudas presentan una incidencia muy variable y pueden ser provocadas por una gran cantidad de patógenos como bacterias, virus o protozoos. Clínicamente se presentan como trastornos funcionales leves, poco molestos y autolimitados, o pueden convertirse en un proceso grave, con importantes cuadros de deshidratación y desnutrición y severos desequilibrios hidroelectrolíticos que pueden poner en peligro la vida del enfermo. En los países subdesarrollados, la gastroenteritis aguda asociada a diarrea es una causa importante de morbilidad en todas las edades y de mortalidad en lactantes y niños pequeños. 2. Materia fecal a) Heces En el caso de pacientes pediátricos, si no es posible recoger muestra de materia fecal se puede tomar la muestra a través de frotis rectal. Recolectar en lo posible más de 2 cc o gramos de materia fecal. Guantes. Frasco plástico limpio, de boca ancha. temperatura ambiente durante 48 horas. Posteriormente debe b) Tórula rectal Recomendado en pacientes pediátricos y adultos incapaces de recolectar muestra de materia fecal.
3 Gastrointestinal Muestras Gastrointestinal Cuidadosamente introducir la tórula 2 cm en el esfínter anal. Rotar suavemente la tórula para obtener la muestra. Guantes no estériles. Tórulas. Tubo estéril con tapa rosca o tapón de caucho. temperatura ambiente durante 48 horas. Posteriormente debe 3. Muestras digestivas altas a) Aspirado gástrico La sonda se debe fijar y marcar al nivel que se introdujo, con el fin de evaluar si se movilizó durante la noche. Dejar cerrada durante la noche. Recolectar la muestra de la mañana, luego de 6 horas de ayuno. Tomar la muestra con el paciente en reposo. Pasar una sonda nasogástrica la noche anterior y explicar la finalidad de la misma. En la mañana y con el paciente en reposo, aspirar de 5 a 10 ml de contenido gástrico con una jeringa estéril. Depositar la muestra en recipiente estéril. Posteriormente instilar de 25 a 50 ml de agua destilada y aspirar 20 ml de contenido gástrico. Agregar al recipiente estéril con la muestra inicial y tapar herméticamente. Jeringa de 10 ml. Guantes no estériles. Recipiente de boca ancha estéril de tapa rosca con capacidad para 50 ml. Sonda nasogástrica. Agua destilada. temperatura ambiente durante 48 horas. Posteriormente debe b) Biopsia gástrica/antral obtenida por endoscopia Se usa para la detección de Helicobacter
4 Gastrointestinal Muestras Gastrointestinal pylori, agente causal en casos de úlceras duodenales o gástricas. Es fundamental obtener varias muestras tanto de la base como de los cuatro cuadrantes del margen de la úlcera, sin olvidar la biopsia de la mucosa antral. Este procedimiento debe ser realizado por el médico. Seccionar la muestra en fresco para enviar al laboratorio clínico. Fibrogastroscopio y material complementario. Tubos con suero fisiológico (1 ml) para pequeñas muestras. temperatura ambiente durante 48 horas. Posteriormente debe 4. Muestras digestivas bajas a) Biopsia rectal y sigmoidoscopia La biopsia rectal es normalmente empleada para la detección de Entamoeba histolytica, el HSV y Balantidium coli. Las muestras tomadas por sigmoidoscopia se usan en la detección de E.histolytica, micobacterias y colitis seudomembranosa por C. difficile y S. aureus. Biopsia rectal: emplear pinzas para tomar muestras de las lesiones o de la mucosa rectal posterior a unos 7-10 cm del esfínter anal. Sigmoidoscopia: toma con pinzas o con pipeta. Sigmoidoscopio, rectoscopio y material complementario. Pipetas. Tubos de tapa rosca estériles con o sin solución salina. temperatura ambiente durante 48 horas. Posteriormente debe
5 Gastrointestinal Muestras Gastrointestinal 5. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois CercenadoE, Cantón R. Procedimientos en microbiología clínica. SEIMC. España, Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias
6 Genitourinarias Muestras Genitourinarioas Contenido Contenido Introducción Genitales femeninos... 2 a) Secreciones cervicales... 2 b) Secreciones vaginales... 2 c) Secreciones uretrales Genitales masculinos... 3 a) Secreciones uretrales... 3 b) Secreción prostática... 4 c) Lesiones genitales... 4 d) Semen Orina... 5 a) Orina de micción espontánea... 5 b) Orina obtenida a través de cateterismo transuretral... 5 c) Orina obtenida a través de sonda vesical permanente... 6 d) Orina obtenida en pacientes pediátricos 6 e) Orina obtenida a través de sonda de urostomía y nefrostomía... 7 f) Orina obtenida por punción suprapúbica 7 5. Bibliografía... 8
7 Genitourinarias Muestras Genitourinarioas 1. Introducción La gravedad de una enfermedad urinaria depende de la zona del aparato urinario que se infecte. Las infecciones en la zona baja, como vejiga y uretra, son comunes y no dejan secuelas, aunque pueden ser muy molestas. Las infecciones que afectan al tracto superior, como los riñones y uréteres, presentan síntomas más graves como fiebre y vómitos. Las bacterias presentes en los riñones pueden diseminarse por la sangre, causando una infección potencialmente mental. 2. Genitales femeninos a) Secreciones cervicales La paciente debe haber suspendido el tratamiento antibiótico, aplicación de óvulos o duchas vaginales 3 días antes de la toma de la muestra. Evitar tener relaciones sexuales 3 días antes de la toma de la muestra y no realizar la toma durante el sangrado menstrual. Este procedimiento está contraindicado en pacientes embarazadas. Utilizar espéculo estéril o desechable. No usar lubricantes durante el procedimiento. Con la paciente en posición ginecológica introducir un espéculo. Con un primera torula estéril remover moco y secreciones del orificio de entrada del cuello cervical, y desecharlo. Con una nueva torula estéril tome cuidadosamente la muestra del canal endocervical y colóquelo en tubo estéril con tapa rosca o tapón de caucho. Guantes no estériles. Tórula estéril. Tubo estéril con tapa rosca o tapón de caucho. temperatura ambiente durante 48 horas. Posteriormente debe b) Secreciones vaginales La paciente no debe aplicar óvulos o duchas vaginales 24 horas antes de la toma de la muestra. Verificar que se haya realizado una limpieza adecuada de los genitales externos previamente, para eliminar secreciones contaminantes. Con la paciente en posición ginecológica introducir un espéculo, recoger la muestra, bajo visión directa, con una tórula seca. Tomar la muestra en la zona de mayor exudado o del fondo del saco vaginal, realizar suaves movimientos de rotación. Colóquelo en tubo estéril con tapa rosca o tapón de caucho.
8 Genitourinarias Muestras Genitourinarioas Tórulas estériles. Tubo estéril. Solución salina. temperatura ambiente durante 48 horas. Posteriormente debe c) Secreciones uretrales Verificar que se haya realizado una limpieza adecuada de los genitales externos previamente, para eliminar secreciones contaminantes. La muestra se debe tomar al menos una hora después de que el paciente haya orinado. Inserte una tórula estéril pequeña 1 a 2 cm dentro de la uretra, rótela y déjela introducida al menos por 2 segundos para facilitar la absorción. Equipo para higiene externa (jabón antiséptico, gasas, jarra con agua). Tórulas uretrales finas estériles. Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe 3. Genitales masculinos a) Secreciones uretrales Verificar que se haya realizado una limpieza adecuada de los genitales externos previamente, para eliminar secreciones contaminantes. La muestra se debe tomar al menos una hora después de que el paciente haya orinado. Realice masaje prostático para tomar la muestra; si se observa la salida de material por la uretra, recoléctelo en un tubo seco estéril. En caso de no obtener drenaje con el masaje uretral, realice lavado en el área periuretral con antiséptico y enjuague con agua. Inserte una tórula estéril pequeña 2 a 4 cm dentro de la uretra, rótela y déjela introducido al menos por 2 segundos para facilitar la absorción. Equipo para higiene externa (jabón antiséptico, gasas, jarra con agua). Tórulas estériles.
9 Genitourinarias Muestras Genitourinarioas Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe b) Secreción prostática Verificar que el paciente haya evacuado la vejiga. Realice la limpieza del meato uretral con agua y jabón. Realice masaje prostático a través del recto y recolecte el fluido expulsado a través de la uretra en un tubo estéril o recolecte más de un mililitro. Guantes no estériles. Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe c) Lesiones genitales Realice limpieza de las lesiones con solución salina estéril antes de tomar la muestra. Los virus aislados con mayor frecuencia de lesiones genitales son HSV-1 y HSV-2, CMV y virus de papiloma humano. Con una hoja de bisturí remueva la superficie de la lesión. Mientras presiona firmemente la base de la lesión, permita que el trasudado se acumule y con la tórula estéril recolecte la muestra y colóquela en tubo estéril. Guantes no estériles. Torula estéril. Tubo estéril. temperatura ambiente durante 48 horas. Posteriormente debe d) Semen Lavarse cuidadosamente las manos con agua y jabón. Limpiar la zona genital. Recoger la muestra obtenida por masturbación en recipiente estéril.
10 Genitourinarias Muestras Genitourinarioas Frasco estéril. temperatura ambiente durante 48 horas. Posteriormente debe 4. Orina a) Orina de micción espontánea Realizar higiene de genitales: en mujeres, es necesario lavar el vestíbulo vaginal y la entrada de la uretra con agua jabonosa, enjuagar con abundante agua. Secar y separar los labios e iniciar la micción. En el hombre se debe hacer retracción del prepucio y lavar el meato urinario con agua jabonosa, enjuagar con abundante agua y secar. Con el prepucio retraído iniciar la recolección de la orina. En pacientes ambulatorios es ideal recoger la muestra de la primera micción del día. Instruir al paciente para que inicie la micción, desechar la primera parte de la orina. Recoger la parte media de la orina en el frasco colector sin detener el flujo urinario (5-10 ml) Terminar de eliminar en el sanitario o pato. Tapar el frasco sin contaminar la muestra. Frasco recolector estéril de boca ancha de tapa rosca. Equipo de higiene: jabón, gasas. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. b) Orina obtenida a través de cateterismo transuretral Realizar higiene de genitales con guantes no estériles. Retirar y desechar los guantes; realizar lavado de manos clínico, usar guantes estériles e insertar el catéter urinario asépticamente. La confiabilidad diagnóstica es cercana a una sensibilidad de 95% y especificidad del 99%, constituyendo una buena alternativa en niños sin control de esfínteres. El riesgo de introducir la infección durante el cateterismo o de otras complicaciones es bajo si el personal entrenado emplea la técnica correcta. Eliminar la primera porción de orina obtenida, colectar la siguiente porción de orina (5-10 ml) en el frasco estéril, retirar la sonda de nélaton y tapar el frasco.
11 Genitourinarias Muestras Genitourinarioas Frasco recolector estéril de boca ancha de tapa rosca. Equipo de higiene: jabón, gasas. Sonda de Nelaton (No adultos, No. 6-8 en niños). Guantes estériles y no estériles. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. c) Orina obtenida a través de sonda vesical permanente Pinzar la sonda durante 30 a 60 minutos antes de obtener la muestra. Realizar desinfección del puerto en Y de la sonda de foley con alcohol al 70%. Verificar el retiro de la pinza de la sonda después de obtener la muestra. No utilizar orina que ha estado depositada por varias horas en bolsas o frascos colectores. Los pacientes con catéter vesical por largo tiempo, siempre tienen microorganismos en la vejiga. No se recomienda recolectar orina de estos pacientes, a menos que se sospeche que el foco infeccioso es urinario. Puncionar la sonda con jeringa estéril con aguja de calibre pequeño, aspirar 5 a 10 ml de orina, retirar jeringa. Envasar en el frasco estéril, manteniendo la técnica aséptica. Frasco recolector estéril de boca ancha de tapa rosca. Guantes no estériles, gasas estériles, alcohol al 70%. Jeringa estéril. Guantes estériles. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. d) Orina obtenida en pacientes pediátricos Pacientes con control de esfínter: realizar higiene de genitales con guantes no estériles. Secar adecuadamente el área genital. El paciente elimina en un recipiente limpio, de este recipiente se reenvasa en un frasco limpio de tapa rosca. Pacientes sin control de esfínter: realizar higiene de genitales con guantes no estériles. Secar adecuadamente el área genital. Si el niño no tiene control de esfínteres y no se puede realizar punción suprapúbica debe tomarse la muestra por sonda vesical. Otra método es colocar bolsa recolectora, si la micción no se da en 20 minutos se deberá repetir el aseo y colocar nueva bolsa. La bolsa recolectora es el método menos traumático de obtener la muestra de orina, ofrece más alto riesgo de contaminación
12 Genitourinarias Muestras Genitourinarioas comparado con la punción suprapúbica y el cateterismo transuretral Colocar bolsa plástica adherente, verificando ausencia de fugas. Estar atento cuando el niño elimine, para retirar pronto la bolsa y evitar derramamiento o contaminación de la muestra. Son suficientes 5-10 ml de orina. Bolsa plástica recolectora estéril. Equipo de higiene: jabón, gasas. Se recomienda en los primeros 15 minutos de la recolección, no exceder de dos horas y a temperatura ambiente. e) Orina obtenida a través de sonda de urostomía y nefrostomía Mantener técnica aséptica para la manipulación de este tipo de catéteres. No se recomienda puncionar ni colapsar el trayecto del catéter. Realizar limpieza del trayecto del sitio de unión entre el catéter, la llave de tres vías y el sistema colector. Insertar jeringa a la llave de tres vías y extraer 5-10 ml de orina. Envasar en el frasco colector estéril. Volver a comunicar el trayecto entre el catéter y el sistema colector. Guantes estériles. Gasas estériles. Jeringa estéril. Frasco estéril de boca ancha. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. f) Orina obtenida por punción suprapúbica Este procedimiento debe realizarlo personal médico entrenado, previa preparación de la piel con técnica aséptica. Las complicaciones si se sigue una técnica adecuada son muy raras. En lactantes con micciones frecuentes la punción suprapúbica puede fallar si al realizarla hay escasa orina en la vejiga; en estos casos se recomienda tomar la muestra por cateterismo vesical transuretral. Puncionar con jeringa estéril sobre la línea media en tercio medio entre el ombligo y la sínfisis púbica. Aspirar 5 a 10 ml de
13 Genitourinarias Muestras Genitourinarioas orina. Envasar en frasco estéril o llevar directamente en la jeringa. Frasco recolector estéril de boca ancha de tapa rosca. Equipo de preparación de la piel. Jeringa estéril. Guantes estériles. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. 5. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois CercenadoE, Cantón R. Procedimientos en microbiología clínica. SEIMC. España, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH,
14 Hepatitis Muestras Hepatitis Contenido 1. Introducción... 1 a) Sangre obtenida a través de punción periférica Bibliografía Introducción Los virus de la hepatitis son al menos seis tipos (A a E y G) que afectan al hígado y comparten ciertos síntomas de la infección. Sin embargo, son distintos tanto en su estructura, mecanismo de replicación y transmisión como en la evolución y consecuencias de la enfermedad. a) Sangre obtenida a través de punción periférica Realizar lavado de manos quirúrgico. Mantener técnica aséptica durante todo el procedimiento. Utilizar campo estéril para evitar tener contacto con áreas circundantes que ofrezca el riesgo de contaminación. Colocar mascarilla al paciente. Realizar antisepsia de la zona a puncionar; no palpe la vena sin guantes estériles una vez preparada la piel. Utilizar otros guantes estériles para cada punción. POR ÉSTE MÉTODO NO PUEDEN SER PROCESADAS MUESTRAS CON HEPARINA. En pacientes heparinizados, la toma de muestra debe realizarse en el momento más alejado de la administración del medicamento. La toma deberá hacerse en un lugar perfectamente iluminado y con el paciente cómodamente sentado. Localizar una vena adecuada en la cara anterior del codo y colocar el torniquete en la parte media del brazo. Desinfectar el área con un algodón humedecido con alcohol al 70% e introducir la aguja con el bisel hacia arriba. Si la sangre no fluye espontáneamente y se está utilizando una jeringa, jalar el émbolo y aspirar con suavidad; si se está empleando equipo al vacío presionar el tubo de ensaye hacia arriba. Al empezar a fluir la sangre retirar el torniquete. Una vez que se haya obtenido entre 5-8 ml de sangre, retirar la aguja y colocar una tórula con alcohol sobre el sitio de punción ejerciendo presión para detener la hemorragia. En recién nacidos y lactantes, donde no es fácil obtener tanta cantidad de muestra, debe enviarse como mínimo ml de sangre completa. Si la toma se hizo con jeringa, retirar la aguja y verter la sangre a un tubo estéril, dejándola resbalar lentamente por la pared para evitar hemólisis. Tapar el tubo cuidadosamente. Si la muestra necesaria es sangre total utilizar un tubo de hematología con EDTA (venoject ó vacutainer TAPA MORADA).
15 Hepatitis Muestras Hepatitis Bata y campos estériles. Gorro y mascarilla con protección ocular. Guantes estériles. Equipo de asepsia (antiséptico, gasas y guantes estériles). Tubo de hematología con EDTA. Jeringas estériles. La muestra debe ser analizada dentro de las 24 hrs. siguientes, en caso contrario puede mantenerse refrigerada a 4ºC hasta una semana. Se recomienda no congelar. 2. Bibliografía Carlberg, D. Cleanroom microbiology for the non microbiologist. Interpharm Press. INC. Buffalo Grove, Illinois CercenadoE, Cantón R. Procedimientos en microbiología clínica. SEIMC. España, Collins CH, Lyne PM, Grange JM. Microbiological methods. 7ma edition. Oxford editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Guerrero Gómez C; Sánchez Carrillo C. Procedimientos en microbiología clínica. Recogida, transporte y procesamientos general de las muestras en el laboratorio de microbiología, Miller JM, Holmes HT. General principles in specimen collection, transport and storage. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Organización Mundial de la Salud. Guía para transporte seguro de sustancias infecciosas y especímenes. Ginebra (Suiza): WHO/EMC/97.3; Thomson BR (JR.), and Miller M. Specimen collection, transport, and processing: Bacteriology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of clinical microbiology. 8th ed. Washington: ASM Press; Forman MS, Valsamakis A, Specimen collection, transport, and processing: Virology. En Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH,
16 Herpesvirus Muestras Herpesvirus Contenido 1. Introducción Herpesvirus humano 1 y herpesvirus humano a) Sangre obtenida a través de punción periférica... 2 b) Líquido pleural, pericárdico, peritoneal,, culdocentesis, amniótico... 3 c) Líquido cefalorraquídeo (LCR)... 4 d) Secreción de área nasofaríngea... 4 e) Aspirado nasofaringe... 5 f) Secreción de la faringe... 6 g) Esputo por expectoración espontánea... 6 h) Esputo inducido... 7 i) Secreción traqueal... 7 j) Lavado o cepillado broncoalveolar.. 8 k) Muestras obtenidas por abordaje percutáneo... 9 l) Orina de micción espontánea... 9 m) Secreción conjuntival Herpesvirus humano tipo a) Sangre obtenida a través de punción periférica 11 b) Líquido cefalorraquídeo (LCR) Herpesvirus humano a) Líquido cefalorraquídeo (LCR) Herpesvirus humano a) Sangre obtenida a través de punción periférica..13 b) Biopsia de tejido de cualquier sitio anatómico Herpesvirus humano a) Sangre obtenida a través de punción periférica.15 b) Líquido cefalorraquídeo (LCR) 16 c) Lavado o cepillado broncoalveolar 16 d) Líquido pleural Herpesvirus humano a) Sangre obtenida a través de punción periférica b) Líquido cefalorraquídeo (LCR) c) Lavado o cepillado broncoalveolar 19 d) Líquido pleural Herpesvirus humano
17 Herpesvirus Muestras Herpesvirus a) Sangre obtenida a través de punción periférica.. 20 b) Líquido cefalorraquídeo (LCR)...22 c) Lavado o cepillado broncoalveolar.22 d) Líquido pleural Bibliografía Introducción Los herpesvirus son miembros de la familia Herpesviridae, capaces de causar enfermedades en múltiples animales, incluido el hombre. Se encuentran ampliamente diseminados en el mundo, pudiendo establecer latencia en las células de los individuos infectados. Al estar latentes no se detectan partículas virales, pero su ADN se encuentra en el núcleo celular. La reactivación de los virus latentes se ha relacionado con ciertas patologías. En ciertas condiciones puede reactivarse, replicándose y formando nuevos virus, a menudo con resultado de muerte celular. 2. Herpesvirus humano 1 y herpesvirus humano 2 a) Sangre obtenida a través de punción periférica Realizar lavado de manos quirúrgico. Mantener técnica aséptica durante todo el procedimiento. Utilizar campo estéril para evitar tener contacto con áreas circundantes que ofrezca el riesgo de contaminación. Colocar mascarilla al paciente. Realizar antisepsia de la zona a puncionar; no palpe la vena sin guantes estériles una vez preparada la piel. Utilizar otros guantes estériles para cada punción. POR ÉSTE MÉTODO NO PUEDEN SER PROCESADAS MUESTRAS CON HEPARINA. En pacientes heparinizados, la toma de muestra debe realizarse en el momento más alejado de la administración del medicamento. La toma deberá hacerse en un lugar perfectamente iluminado y con el paciente cómodamente sentado. Localizar una vena adecuada en la cara anterior del codo y colocar el torniquete en la parte media del brazo. Desinfectar el área con un algodón humedecido con alcohol al 70% e introducir la aguja con el bisel hacia arriba. Si la sangre no fluye
18 Herpesvirus Muestras Herpesvirus espontáneamente y se está utilizando una jeringa, jalar el émbolo y aspirar con suavidad; si se está empleando equipo al vacío presionar el tubo de ensaye hacia arriba. Al empezar a fluir la sangre retirar el torniquete. Una vez que se haya obtenido entre 5-8 ml de sangre, retirar la aguja y colocar una tórula con alcohol sobre el sitio de punción ejerciendo presión para detener la hemorragia. En recién nacidos y lactantes, donde no es fácil obtener tanta cantidad de muestra, debe enviarse como mínimo 1 ml de sangre completa. Si la toma se hizo con jeringa, retirar la aguja y verter la sangre a un tubo estéril, dejándola resbalar lentamente por la pared para evitar hemólisis. Tapar el tubo cuidadosamente. Si la muestra necesaria es sangre total utilizar un tubo de hematología con EDTA (venoject ó vacutainer TAPA MORADA). Bata y campos estériles. Gorro y mascarilla con protección ocular. Guantes estériles. Equipo de asepsia (antiséptico, gasas y guantes estériles). Tubo de hematología con EDTA. Jeringas estériles. La muestra debe ser analizada dentro de las 24 hrs. siguientes, en caso contrario puede mantenerse refrigerada a 4ºC hasta una semana. Se recomienda no congelar. b) Líquido pleural, pericárdico, peritoneal,, culdocentesis, amniótico La recolección de muestras de este origen está reservada estrictamente al médico especialista. No se recomienda usar tórulas, la muestra debe ser obtenida por aspirado o drenaje quirúrgico. Los líquidos susceptibles de formar coágulo deben ser colectados en tubos con anticoagulante EDTA (ácido etilendiaminotetracético). En el líquido amniótico los virus que causan infección en el útero son CMV, Parvovirus B-19 y VIH, menos frecuentemente observados virus herpes simplex (HSV) y virus Zoster (VZV). Realice preparación de la piel con técnica aséptica.
19 Herpesvirus Muestras Herpesvirus Puncionar con jeringa y aguja estéril, y recoger entre 1 y 5 ml de líquido. Recolectar en frasco seco. Equipo de preparación de piel y anestesia local. Jeringa y aguja estéril. Tubo estéril seco. temperatura ambiente durante 48 horas y refrigerada hasta por 2 En el caso del líquido amniótico puede almacenarse a temperatura ambiente por 8 horas y refrigerado a 4ºC hasta por 1 semana. c) Líquido cefalorraquídeo (LCR) Enviar con resumen de historia clínica. Procedimiento realizado por personal médico. Preparación aséptica de la piel: el paciente debe estar recostado sobre un costado con el torso doblado hacia delante. Bajo anestesia local se introduce una aguja larga en el conducto espinal; no necesita ser aspirado, fluye por presión en individuos sanos. Obtener mínimo 3 ml de LCR en tubo estéril tapa rosca. Equipo de asepsia: mascarilla, guantes y campo estériles. Equipo de punción lumbar. temperatura ambiente durante 8 horas. Puede mantenerse refrigerada a 4ºC hasta por 1 semana. d) Secreción de área nasofaríngea La persona que obtiene la muestra debe usar barreras de protección (mascarilla, protección ocular). No hacer gárgaras ni limpieza con ninguna solución bucofaríngea. Tomar la muestra preferiblemente en ayunas.
20 Herpesvirus Muestras Herpesvirus Colocar al paciente bajo una buena fuente de luz. Introducir la tórula flexible hasta la nasofaringe posterior evitando trauma. Rotar la tórula por 10 a 15 segundos para permitir la impregnación del hisopo y retirar lentamente Barreras de protección (mascarilla y protección ocular). Guantes no estériles. Tórulas estériles flexibles. Tubo estéril. temperatura ambiente durante 48 horas. Puede mantenerse refrigerada a 4ºC hasta por dos e) Aspirado nasofaringe La persona que obtiene la muestra debe usar barreras de protección (mascarilla, protección ocular). No hacer gárgaras ni limpieza con ninguna solución bucofaríngea Tomar la muestra preferiblemente en ayunas. Es colectado mediante el paso de una sonda nelaton de un calibre apropiado dentro de la nasofaringe. Aspirar luego el material con una jeringa estéril u otro mecanismo de succión y colocarlo en tubo estéril seco. En caso de no poder recolectar la muestra en la jeringa, envíe el extremo distal de la sonda con el material aspirado en el tubo estéril seco. Barreras de protección (mascarilla y protección ocular). Guantes no estériles. Tubo estéril seco o medio de transporte para virus. Sonda nelaton. Jeringa estéril. temperatura ambiente durante 48 horas. Puede mantenerse refrigerada a 4ºC hasta por dos
21 Herpesvirus Muestras Herpesvirus f) Secreción de la faringe No contaminar la tórula con secreción de cavidad oral o dientes. El hisopado de garganta está contraindicado en pacientes con diagnóstico de epiglotitis. No hacer gárgaras ni limpieza con ninguna solución bucofaríngea. Colocar al paciente bajo una buena fuente de luz. Con un bajalenguas, presionar la lengua hacia abajo para visualizar los pilares de la faringe y del área tonsilar para localizar el área de inflamación y exudado. Rotar la tórula estéril sobre el área. Guantes. Tórulas estériles. temperatura ambiente durante 48 horas. Puede mantenerse refrigerada a 4ºC hasta por dos g) Esputo por expectoración espontánea El esputo no es la muestra ideal para el diagnóstico de neumonía; se recomienda preferiblemente el lavado broncoalveolar. Recolectar la muestra en la mañana, en ayunas preferiblemente. Instruir al paciente para realizar cepillado de dientes y lavado de la lengua sólo con agua para remover el exceso de flora oral y retirar prótesis dental en pacientes de edad. Para pacientes pediátricos incapaces de producir un esputo, la terapeuta respiratoria debe obtener la muestra a través de succión. En pacientes ambulatorios sintomáticos respiratorios con sospecha de tuberculosis, la primera muestra se toma el día de la consulta médica y las otras dos al día siguiente, cumpliendo las recomendaciones descritas para paciente hospitalizado. Instruir al paciente para que tosa con fuerza y profundamente, con el fin de obtener una muestra que provenga del tracto respiratorio inferior, libre de saliva contenida en
22 Herpesvirus Muestras Herpesvirus la cavidad oral, la cual debe expectorar directamente en un recipiente estéril de boca ancha de tapa rosca. Frasco estéril de boca ancha, de 5 cm de diámetro, de tapa rosca, con capacidad de 30 a 50 ml, de material fácil de rotular. temperatura ambiente durante 48 horas. Puede mantenerse refrigerada a 4ºC hasta por dos h) Esputo inducido Instruir al paciente para realizar cepillado de dientes y lavado de lengua solo con agua. Realizar nebulización con solución salina normal. Para pacientes pediátricos incapaces de producir un esputo, la terapeuta respiratoria debe obtener la muestra a través de succión. Instruir al paciente para que tosa con fuerza y profundamente, con el fin de obtener una muestra que provenga del tracto respiratorio inferior, libre de saliva contenida en la cavidad oral, la cual debe expectorar directamente en un recipiente estéril de boca ancha de tapa rosca. Frasco estéril de boca ancha de tapa rosca de 5 cm de diámetro, con una capacidad de 30 a 50 ml y material fácil de rotular. Nebulizador. Solución salina normal. temperatura ambiente durante 48 horas. Puede mantenerse refrigerada a 4ºC hasta por dos i) Secreción traqueal Realice el procedimiento con técnica aséptica. De acuerdo con las características de las secreciones, irrigar con solución salina normal previo a realizar el procedimiento. Introducir la sonda sin hacer succión a través del tubo endotraqueal o cánula de
23 Herpesvirus Muestras Herpesvirus traquestomía, hasta ubicarla en el espacio traqueal. Ocluya el orificio distal de la sonda y comience a succionar, retire la sonda lentamente mientras la va limpiando externamente con una gasa estéril. Tenga precaución de suspender la succión, retirando la oclusión de la sonda para que se conserve la muestra obtenida en el trayecto de la misma. Coloque la muestra obtenida en frasco estéril cortando el segmento distal de la sonda, si no es posible el depósito de la muestra sola, para lo cual retira la presión en el orificio de la sonda lo que permitirá la expulsión de la muestra en el recipiente. Guantes estériles. Mascarilla con protección ocular. Sonda de nelaton. Hoja de bisturí. Solución salina normal. Gasas estériles. Frasco de boca ancha estéril o trampa recolectora. temperatura ambiente durante 48 horas. Puede mantenerse refrigerada a 4ºC hasta por dos j) Lavado o cepillado broncoalveolar El paciente debe estar en ayunas para realizar el procedimiento, ya que se requiere de sedación. A través de técnica de fibrobroncoscopia. Conecte una trampa de Lukens al fibrobroncoscopio. Irrigar con 10 ml de solución salina a través del canal abierto. Succione para obtener la muestra en dos frascos estériles de boca ancha. Equipos de fibrobroncoscopia. Sistema de succión. Recipiente de boca ancha estéril de tapa rosca. temperatura ambiente durante 48 horas. Puede mantenerse refrigerada a 4ºC hasta por dos
24 Herpesvirus Muestras Herpesvirus k) Muestras obtenidas por abordaje percutáneo Son todos procedimientos médicos. Dentro de las técnicas invasivas son las que permiten la obtención de muestras más representativas del parénquima pulmonar, no obstante, sólo deben emplearse cuando fracasen otros métodos menos invasivos o cuando la situación del enfermo haga imprescindible conocer el diagnóstico etiológico. Técnica a realizar por personal entrenado. Pueden emplearse las siguientes: i. Punción pulmonar aspirativa transtorácica: Obtención del exudado de las lesiones pulmonares a través de una punción transtorácica con aguja ultrafina con control radioscópico o ecográfico. Debe aplicarse ante infiltraciones densas (no intersticiales) y sobre todo si son periféricas. Contraindicado en pacientes con bullas, trastornos de coagulación y sospecha de hidatidosis. Posibles complicaciones, como neumotórax y hemoptisis. Es una muestra ideal para estudio en infección anaerobia grave en niños, especialmente en edades tempranas. ii. Punción biópsica pulmonar Biopsia transtorácica con trocar. Sólo en casos excepcionales y en caso de lesiones muy periféricas debido al alto riesgo de neumotórax. iii. Biopsia pulmonar por toracotomía Permite la selección visual del área neumónica a cielo abierto. temperatura ambiente durante 48 horas. Puede mantenerse refrigerada a 4ºC hasta por dos l) Orina de micción espontánea Realizar higiene de genitales: en mujeres, es necesario lavar el vestíbulo vaginal y la entrada de la uretra con agua jabonosa, enjuagar con abundante agua. Secar y separar los labios e iniciar la micción. En el hombre se debe hacer retracción del prepucio y lavar el meato urinario con agua jabonosa, enjuagar con abundante agua y secar. Con el prepucio retraído iniciar la recolección de la orina.
25 Herpesvirus Muestras Herpesvirus En pacientes ambulatorios es ideal recoger la muestra de la primera micción del día. Instruir al paciente para que inicie la micción, desechar la primera parte de la orina. Introducir el frasco colector, recoger la parte media de la orina sin detener el flujo urinario (5-10 ml) Terminar de eliminar en el sanitario o pato. Tapar el frasco sin contaminar la muestra. Frasco recolector estéril de boca ancha de tapa rosca. Equipo de higiene: jabón, gasas. temperatura ambiente durante 24 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. m) Secreción conjuntival No usar gotas oftálmicas 18 a 24 horas antes de la muestra. Ausencia de cualquier cosmético. No tomar antibióticos 24 a 48 horas antes. No usar anestésicos que posean actividad antimicrobiana. Deberá utilizarse una tórula para cada ojo. Tome una muestra por cada ojo con tórula previamente humedecidas con suero fisiológico. Obtener la secreción con tórula estéril frotando la conjuntiva tarsal inferior y el fórnix de afuera hacia adentro. Rotar la tórula suavemente para que toda la superficie del algodón se empape de la secreción purulenta. Guantes estériles Tórula estéril, jeringa y aguja estériles. temperatura ambiente durante 48 horas.
26 Herpesvirus Muestras Herpesvirus Posteriormente debe mantenerse refrigerada a 4ºC hasta por dos 3. Herpesvirus humano tipo 3 a) Sangre obtenida a través de punción periférica Realizar lavado de manos quirúrgico. Mantener técnica aséptica durante todo el procedimiento. Utilizar campo estéril para evitar tener contacto con áreas circundantes que ofrezca el riesgo de contaminación. Colocar mascarilla al paciente. Realizar antisepsia de la zona a puncionar; no palpe la vena sin guantes estériles una vez preparada la piel. Utilizar otros guantes estériles para cada punción. POR ÉSTE MÉTODO NO PUEDEN SER PROCESADAS MUESTRAS CON HEPARINA. En pacientes heparinizados, la toma de muestra debe realizarse en el momento más alejado de la administración del medicamento. La toma deberá hacerse en un lugar perfectamente iluminado y con el paciente cómodamente sentado. Localizar una vena adecuada en la cara anterior del codo y colocar el torniquete en la parte media del brazo. Desinfectar el área con un algodón humedecido con alcohol al 70% e introducir la aguja con el bisel hacia arriba. Si la sangre no fluye espontáneamente y se está utilizando una jeringa, jalar el émbolo y aspirar con suavidad; si se está empleando equipo al vacío presionar el tubo de ensaye hacia arriba. Al empezar a fluir la sangre retirar el torniquete. Una vez que se haya obtenido entre 5-8 ml de sangre, retirar la aguja y colocar una tórula con alcohol sobre el sitio de punción ejerciendo presión para detener la hemorragia. En recién nacidos y lactantes, donde no es fácil obtener tanta cantidad de muestra, debe enviarse como mínimo 1 ml de sangre completa. Si la toma se hizo con jeringa, retirar la aguja y verter la sangre a un tubo estéril, dejándola resbalar lentamente por la pared para evitar hemólisis. Tapar el tubo cuidadosamente. Si la muestra necesaria es sangre total utilizar un tubo de hematología con
27 Herpesvirus Muestras Herpesvirus EDTA (venoject ó vacutainer TAPA MORADA). Bata y campos estériles. Gorro y mascarilla con protección ocular. Guantes estériles. Equipo de asepsia (antiséptico, gasas y guantes estériles). Tubo de hematología con EDTA. Jeringas estériles. La muestra debe ser analizada dentro de las 24 hrs. siguientes, en caso contrario puede mantenerse refrigerada a 4ºC hasta una semana. Se recomienda no congelar. b) Líquido cefalorraquídeo (LCR) Enviar con resumen de historia clínica. Procedimiento realizado por personal médico. Preparación aséptica de la piel: el paciente debe estar recostado sobre un costado con el torso doblado hacia delante. Bajo anestesia local se introduce una aguja larga en el conducto espinal; no necesita ser aspirado, fluye por presión en individuos sanos. Obtener mínimo 3 ml de LCR en tubo estéril tapa rosca. Equipo de asepsia: mascarilla, guantes y campo estériles. Equipo de punción lumbar. temperatura ambiente durante 8 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. 4. Herpesvirus humano 4 a) Líquido cefalorraquídeo (LCR) Enviar con resumen de historia clínica. Procedimiento realizado por personal médico.
28 Herpesvirus Muestras Herpesvirus Preparación aséptica de la piel: el paciente debe estar recostado sobre un costado con el torso doblado hacia delante. Bajo anestesia local se introduce una aguja larga en el conducto espinal; no necesita ser aspirado, fluye por presión en individuos sanos. Obtener mínimo 3 ml de LCR en tubo estéril tapa rosca. Equipo de asepsia: mascarilla, guantes y campo estériles. Equipo de punción lumbar. temperatura ambiente durante 8 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. 5. Herpesvirus humano 5 a) Sangre obtenida a través de punción periférica Realizar lavado de manos quirúrgico. Mantener técnica aséptica durante todo el procedimiento. Utilizar campo estéril para evitar tener contacto con áreas circundantes que ofrezca el riesgo de contaminación. Colocar mascarilla al paciente. Realizar antisepsia de la zona a puncionar; no palpe la vena sin guantes estériles una vez preparada la piel. Utilizar otros guantes estériles para cada punción. POR ÉSTE MÉTODO NO PUEDEN SER PROCESADAS MUESTRAS CON HEPARINA. En pacientes heparinizados, la toma de muestra debe realizarse en el momento más alejado de la administración del medicamento. La toma deberá hacerse en un lugar perfectamente iluminado y con el paciente cómodamente sentado. Localizar una vena adecuada en la cara anterior del codo y colocar el torniquete en la parte media del brazo. Desinfectar el área con un algodón humedecido con alcohol al 70% e introducir la aguja con el bisel hacia arriba. Si la sangre no fluye espontáneamente y se está
29 Herpesvirus Muestras Herpesvirus utilizando una jeringa, jalar el émbolo y aspirar con suavidad; si se está empleando equipo al vacío presionar el tubo de ensaye hacia arriba. Al empezar a fluir la sangre retirar el torniquete. Una vez que se haya obtenido entre 5-8 ml de sangre, retirar la aguja y colocar una tórula con alcohol sobre el sitio de punción ejerciendo presión para detener la hemorragia. En recién nacidos y lactantes, donde no es fácil obtener tanta cantidad de muestra, debe enviarse como mínimo 1 ml de sangre completa. Si la toma se hizo con jeringa, retirar la aguja y verter la sangre a un tubo estéril, dejándola resbalar lentamente por la pared para evitar hemólisis. Tapar el tubo cuidadosamente. Si la muestra necesaria es sangre total utilizar un tubo de hematología con EDTA (venoject ó vacutainer TAPA MORADA). Bata y campos estériles. Gorro y mascarilla con protección ocular. Guantes estériles. Equipo de asepsia (antiséptico, gasas y guantes estériles). Tubo de hematología con EDTA. Jeringas estériles. La muestra debe ser analizada dentro de las 24 hrs. siguientes, en caso contrario puede mantenerse refrigerada a 4ºC hasta una semana. Se recomienda no congelar. b) Biopsia de tejido de cualquier sitio anatómico Realizar preparación antiséptica del área de donde se va a tomar la biopsia. Conservar la esterilidad de la muestra hasta su recepción en el laboratorio clínico o de patología. Se recomienda tomar biopsia de tejido para lesiones relacionadas con úlceras de presión, úlceras varicosas, quemaduras y pie diabético, realizar limpieza previa con solución salina estéril. Si la biopsia de tejido no es posible de realizar, aspire material inflamatorio de la base de la lesión. Este procedimiento debe ser realizado por el médico. Seccionar la muestra en fresco para enviar al laboratorio clínico.
30 Herpesvirus Muestras Herpesvirus Equipo para preparación de piel. Frasco estéril para la muestra microbiológica. La muestra debe ser analizada dentro de las 24 hrs. siguientes, en caso contrario puede mantenerse refrigerada a 4ºC hasta una semana. Se recomienda no congelar. 6. Herpesvirus humano 6 a) Sangre obtenida a través de punción periférica Realizar lavado de manos quirúrgico. Mantener técnica aséptica durante todo el procedimiento. Utilizar campo estéril para evitar tener contacto con áreas circundantes que ofrezca el riesgo de contaminación. Colocar mascarilla al paciente. Realizar antisepsia de la zona a puncionar; no palpe la vena sin guantes estériles una vez preparada la piel. Utilizar otros guantes estériles para cada punción. POR ÉSTE MÉTODO NO PUEDEN SER PROCESADAS MUESTRAS CON HEPARINA. En pacientes heparinizados, la toma de muestra debe realizarse en el momento más alejado de la administración del medicamento. La toma deberá hacerse en un lugar perfectamente iluminado y con el paciente cómodamente sentado. Localizar una vena adecuada en la cara anterior del codo y colocar el torniquete en la parte media del brazo. Desinfectar el área con un algodón humedecido con alcohol al 70% e introducir la aguja con el bisel hacia arriba. Si la sangre no fluye espontáneamente y se está utilizando una jeringa, jalar el émbolo y aspirar con suavidad; si se está empleando equipo al vacío presionar el tubo de ensaye hacia arriba. Al empezar a fluir la sangre retirar el torniquete. Una vez que se haya obtenido entre 5-8 ml de sangre, retirar la aguja y colocar una tórula con alcohol sobre el sitio de punción ejerciendo presión para detener la hemorragia. En recién nacidos y lactantes, donde no es fácil obtener tanta cantidad de muestra, debe enviarse como mínimo 1 ml de sangre completa.
31 Herpesvirus Muestras Herpesvirus Si la toma se hizo con jeringa, retirar la aguja y verter la sangre a un tubo estéril, dejándola resbalar lentamente por la pared para evitar hemólisis. Tapar el tubo cuidadosamente. Si la muestra necesaria es sangre total utilizar un tubo de hematología con EDTA (venoject ó vacutainer TAPA MORADA). Bata y campos estériles. Gorro y mascarilla con protección ocular. Guantes estériles. Equipo de asepsia (antiséptico, gasas y guantes estériles). Tubo de hematología con EDTA. Jeringas estériles. La muestra debe ser analizada dentro de las 24 hrs. siguientes, en caso contrario puede mantenerse refrigerada a 4ºC hasta una semana. Se recomienda no congelar. b) Líquido cefalorraquídeo (LCR) Enviar con resumen de historia clínica. Procedimiento realizado por personal médico. Preparación aséptica de la piel: el paciente debe estar recostado sobre un costado con el torso doblado hacia delante. Bajo anestesia local se introduce una aguja larga en el conducto espinal; no necesita ser aspirado, fluye por presión en individuos sanos. Obtener mínimo 3 ml de LCR en tubo estéril tapa rosca. Equipo de asepsia: mascarilla, guantes y campo estériles. Equipo de punción lumbar. temperatura ambiente durante 8 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana. c) Lavado o cepillado broncoalveolar
32 Herpesvirus Muestras Herpesvirus El paciente debe estar en ayunas para realizar el procedimiento, ya que se requiere de sedación. A través de técnica de fibrobroncoscopia. Conecte una trampa de Lukens al fibrobroncoscopio. Irrigar con 10 ml de solución salina a través del canal abierto. Succione para obtener la muestra en dos frascos estériles de boca ancha. Equipos de fibrobroncoscopia. Sistema de succión. Recipiente de boca ancha estéril de tapa rosca. temperatura ambiente durante 48 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por dos d) Líquido pleural La recolección de muestras de este origen está reservada estrictamente al médico especialista. No se recomienda usar tórulas, la muestra debe ser obtenida por aspirado o drenaje quirúrgico. Los líquidos susceptibles de formar coágulo deben ser colectados en tubos con anticoagulante EDTA (ácido etilendiaminotetracético). En el líquido amniótico los virus que causan infección en el útero son CMV, Parvovirus B-19 y VIH, menos frecuentemente observados virus herpes simplex (HSV) y virus Zoster (VZV). Realice preparación de la piel con técnica aséptica. Puncionar con jeringa y aguja estéril, y recoger entre 1 y 5 ml de líquido. Recolectar en frasco seco. Equipo de preparación de piel y anestesia local. Jeringa y aguja estéril. Tubo estéril seco. temperatura ambiente durante 4 horas. Posteriormente debe mantenerse refrigerada a 4ºC hasta por una semana.
33 Herpesvirus Muestras Herpesvirus 7. Herpesvirus humano 7 a) Sangre obtenida a través de punción periférica Realizar lavado de manos quirúrgico. Mantener técnica aséptica durante todo el procedimiento. Utilizar campo estéril para evitar tener contacto con áreas circundantes que ofrezca el riesgo de contaminación. Colocar mascarilla al paciente. Realizar antisepsia de la zona a puncionar; no palpe la vena sin guantes estériles una vez preparada la piel. Utilizar otros guantes estériles para cada punción. POR ÉSTE MÉTODO NO PUEDEN SER PROCESADAS MUESTRAS CON HEPARINA. En pacientes heparinizados, la toma de muestra debe realizarse en el momento más alejado de la administración del medicamento. La toma deberá hacerse en un lugar perfectamente iluminado y con el paciente cómodamente sentado. Localizar una vena adecuada en la cara anterior del codo y colocar el torniquete en la parte media del brazo. Desinfectar el área con un algodón humedecido con alcohol al 70% e introducir la aguja con el bisel hacia arriba. Si la sangre no fluye espontáneamente y se está utilizando una jeringa, jalar el émbolo y aspirar con suavidad; si se está empleando equipo al vacío presionar el tubo de ensaye hacia arriba. Al empezar a fluir la sangre retirar el torniquete. Una vez que se haya obtenido entre 5-8 ml de sangre, retirar la aguja y colocar una tórula con alcohol sobre el sitio de punción ejerciendo presión para detener la hemorragia. En recién nacidos y lactantes, donde no es fácil obtener tanta cantidad de muestra, debe enviarse como mínimo 1 ml de sangre completa. Si la toma se hizo con jeringa, retirar la aguja y verter la sangre a un tubo estéril, dejándola resbalar lentamente por la pared para evitar hemólisis. Tapar el tubo cuidadosamente. Si la muestra necesaria es sangre total utilizar un tubo de hematología con EDTA (venoject ó vacutainer TAPA MORADA). Bata y campos estériles.
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit Contenido 1. Introducción... 1 2. Materia fecal... 1 a) Heces... 1 b) Tórula rectal... 1 3. Muestras digestivas altas... 2 a) Aspirado gástrico... 2 b) Biopsia gástrica/antral
Manual Toma de Muestras Human PCR Kit Contenido 1. Introducción... 1 2. Materia fecal... 1 a) Heces... 1 b) Tórula rectal... 1 3. Muestras digestivas altas... 2 a) Aspirado gástrico... 2 b) Biopsia gástrica/antral
Manual Toma de Muestras. Infecciones Gastrointestinales. Bioingentech Ltd. Teléfono (56)-(41)
 Manual Toma de Muestras Exámenes Genéticos por PCR Infecciones Gastrointestinales Bioingentech Ltd. Teléfono (56)-(41)-2790435 www.labgenetico.com info@labgenetico.com Muestras Genitourinarioas 1. Introducción
Manual Toma de Muestras Exámenes Genéticos por PCR Infecciones Gastrointestinales Bioingentech Ltd. Teléfono (56)-(41)-2790435 www.labgenetico.com info@labgenetico.com Muestras Genitourinarioas 1. Introducción
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit Contenido Contenido... 1 1. Introducción... 2 2. Genitales femeninos... 2 a) Secreciones cervicales... 2 b) Secreciones vaginales... 2 c) Secreciones uretrales...
Manual Toma de Muestras Human PCR Kit Contenido Contenido... 1 1. Introducción... 2 2. Genitales femeninos... 2 a) Secreciones cervicales... 2 b) Secreciones vaginales... 2 c) Secreciones uretrales...
Manual Toma de Muestras Exámenes Genéticos por PCR Periodontal Bioingentech Ltd. Teléfono (56)-(41)
 Manual Toma de Muestras Exámenes Genéticos por PCR Periodontal Bioingentech Ltd. Teléfono (56)-(41)-2790435 www.labgenetico.com info@labgenetico.com Muestras Periodontal 1. Introducción El sistema inmune
Manual Toma de Muestras Exámenes Genéticos por PCR Periodontal Bioingentech Ltd. Teléfono (56)-(41)-2790435 www.labgenetico.com info@labgenetico.com Muestras Periodontal 1. Introducción El sistema inmune
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit Contenido 1. Introducción... 2 2. Herpesvirus humano 1 y herpesvirus humano 2... 2 a) Sangre obtenida a través de punción periférica... 2 b) Líquido pleural, pericárdico,
Manual Toma de Muestras Human PCR Kit Contenido 1. Introducción... 2 2. Herpesvirus humano 1 y herpesvirus humano 2... 2 a) Sangre obtenida a través de punción periférica... 2 b) Líquido pleural, pericárdico,
Manual Toma de Muestras Exámenes Genéticos por PCR Herpesvirus Bioingentech Ltd. Teléfono (56)-(41)
 Manual Toma de Muestras Exámenes Genéticos por PCR Herpesvirus Bioingentech Ltd. Teléfono (56)-(41)-2790435 www.labgenetico.com info@labgenetico.com Muestras Herpesvirus 1. Introducción Los herpesvirus
Manual Toma de Muestras Exámenes Genéticos por PCR Herpesvirus Bioingentech Ltd. Teléfono (56)-(41)-2790435 www.labgenetico.com info@labgenetico.com Muestras Herpesvirus 1. Introducción Los herpesvirus
Manual Toma de Muestras. Meningitis. Bioingentech Ltd. Teléfono (56)-(41) Exámenes Genéticos por PCR
 Manual Toma de Muestras Exámenes Genéticos por PCR Meningitis Bioingentech Ltd. Teléfono (56)-(41)-2790435 www.labgenetico.com info@labgenetico.com Muestras Meningitis 1. Introducción Principalmente la
Manual Toma de Muestras Exámenes Genéticos por PCR Meningitis Bioingentech Ltd. Teléfono (56)-(41)-2790435 www.labgenetico.com info@labgenetico.com Muestras Meningitis 1. Introducción Principalmente la
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit Tabla de contenido 1. Introducción... 1 2. Infecciones del tracto respiratorio superior... 1 a. Secreción de la zona nasal... 1 b. Secreción de área nasofaríngea...
Manual Toma de Muestras Human PCR Kit Tabla de contenido 1. Introducción... 1 2. Infecciones del tracto respiratorio superior... 1 a. Secreción de la zona nasal... 1 b. Secreción de área nasofaríngea...
Manual Toma de Muestras
 Biotechnology company 2013 Manual Toma de Muestras Sistema Nervioso Central Muestras Sistema Nervioso Central Contenido 1. Introducción... 1 a) Líquido cefalorraquídeo (LCR)... 1 b) Sangre obtenida a través
Biotechnology company 2013 Manual Toma de Muestras Sistema Nervioso Central Muestras Sistema Nervioso Central Contenido 1. Introducción... 1 a) Líquido cefalorraquídeo (LCR)... 1 b) Sangre obtenida a través
Manual Toma de Muestras Human PCR Kit
 Manual Toma de Muestras Human PCR Kit 1. Materia fecal... 9 Contenido MUESTRAS GENITOURINARIAS... 2 1. Genitales femeninos... 2 A. Secreciones cervicales... 2 B. Secreciones vaginales... 3 C. Secreciones
Manual Toma de Muestras Human PCR Kit 1. Materia fecal... 9 Contenido MUESTRAS GENITOURINARIAS... 2 1. Genitales femeninos... 2 A. Secreciones cervicales... 2 B. Secreciones vaginales... 3 C. Secreciones
Toma de Muestras Microbiológicas
 Toma de Muestras Microbiológicas MICROBIOLOGÍA CLÍNICA DIAGNÓSTICO DE ENFERMEDADES INFECCIOSAS MUESTRA AISLAMIENTO IDENTIFICACIÓN SENSIBILIDAD A ANTIMICROBIANOS Detección de anticuerpos, antígenos y ácidos
Toma de Muestras Microbiológicas MICROBIOLOGÍA CLÍNICA DIAGNÓSTICO DE ENFERMEDADES INFECCIOSAS MUESTRA AISLAMIENTO IDENTIFICACIÓN SENSIBILIDAD A ANTIMICROBIANOS Detección de anticuerpos, antígenos y ácidos
GUIA CLINICA TOMA DE MUESTRA DE ORINA
 Pág. 1 de 12 1. OBJETIVO El objetivo de este procedimiento es la recolección de orina con fines diagnósticos que permitan identificar microorganismos patógenos y otros elementos significativos de enfermedad.
Pág. 1 de 12 1. OBJETIVO El objetivo de este procedimiento es la recolección de orina con fines diagnósticos que permitan identificar microorganismos patógenos y otros elementos significativos de enfermedad.
Trabajo Práctico Nº4: OBTENCIÓN Y PROCESAMIENTO DE MUESTRAS CLÍNICAS DESTINADAS AL ANÁLISIS MICROBIOLÓGICO. (Lic en Enfermería y Lic en Obstetricia)
 Trabajo Práctico Nº4: OBTENCIÓN Y PROCESAMIENTO DE MUESTRAS CLÍNICAS DESTINADAS AL ANÁLISIS MICROBIOLÓGICO. (Lic en Enfermería y Lic en Obstetricia) INTRODUCCIÓN La actividad que desarrolla el laboratorio
Trabajo Práctico Nº4: OBTENCIÓN Y PROCESAMIENTO DE MUESTRAS CLÍNICAS DESTINADAS AL ANÁLISIS MICROBIOLÓGICO. (Lic en Enfermería y Lic en Obstetricia) INTRODUCCIÓN La actividad que desarrolla el laboratorio
CATETERISMO VESICAL ELABORADO: CATETERISMO VESICAL
 PAGINA: 1 de 6 REVISADO: COORDINADOR DE CALIDAD ELABORADO: ENFERMERO JEFE COORDINADOR URGENCIAS CATETERISMO VESICAL 1. DEFINICION: Es la introducción de una sonda o catéter a la vejiga por el orificio
PAGINA: 1 de 6 REVISADO: COORDINADOR DE CALIDAD ELABORADO: ENFERMERO JEFE COORDINADOR URGENCIAS CATETERISMO VESICAL 1. DEFINICION: Es la introducción de una sonda o catéter a la vejiga por el orificio
GUÍA A PARA RECOGIDA Y TRANSPORTE DE MUESTRAS SECCIÓN N DE MICROBIOLOGÍA A H. G. U. A REVISIÓN N 2010
 GUÍA A PARA RECOGIDA Y TRANSPORTE DE MUESTRAS SECCIÓN N DE MICROBIOLOGÍA A H. G. U. A REVISIÓN N 2010 NORMAS GENERALES PARA RECOGIDA DE MUESTRAS RECOGER LA MUESTRA SI ES POSIBLE, ANTES DE LA ADMINISTRACI
GUÍA A PARA RECOGIDA Y TRANSPORTE DE MUESTRAS SECCIÓN N DE MICROBIOLOGÍA A H. G. U. A REVISIÓN N 2010 NORMAS GENERALES PARA RECOGIDA DE MUESTRAS RECOGER LA MUESTRA SI ES POSIBLE, ANTES DE LA ADMINISTRACI
TOMA DE MUESTRAS MICROBIOLOGICAS. Dra. Dona Benadof Microbiología Hospital Roberto del Río Comité Vigilancia Infecciones Intrahospitalarias
 TOMA DE MUESTRAS MICROBIOLOGICAS Dra. Dona Benadof Microbiología Hospital Roberto del Río Comité Vigilancia Infecciones Intrahospitalarias INTRODUCCIÓN La confiabilidad de los resultados del estudio microbiológico
TOMA DE MUESTRAS MICROBIOLOGICAS Dra. Dona Benadof Microbiología Hospital Roberto del Río Comité Vigilancia Infecciones Intrahospitalarias INTRODUCCIÓN La confiabilidad de los resultados del estudio microbiológico
18 CURSO DE ACTUALIZACION EN EL DIAGNÓSTICO Y TRATAMIENTO DE LA TUBERCULOSIS EN EL NIÑO Y EL ADULTO
 18 CURSO DE ACTUALIZACION EN EL DIAGNÓSTICO Y TRATAMIENTO DE LA TUBERCULOSIS EN EL NIÑO Y EL ADULTO MUESTRA BIOLOGICA ADECUADA, ESENCIAL PARA EL DIAGNOSTICO DE LA TUBERCULOSIS InDRE Departamento de Bacteriología
18 CURSO DE ACTUALIZACION EN EL DIAGNÓSTICO Y TRATAMIENTO DE LA TUBERCULOSIS EN EL NIÑO Y EL ADULTO MUESTRA BIOLOGICA ADECUADA, ESENCIAL PARA EL DIAGNOSTICO DE LA TUBERCULOSIS InDRE Departamento de Bacteriología
GUÍA PARA RECOGIDA Y TRANSPORTE DE MUESTRAS
 GUÍA PARA RECOGIDA Y TRANSPORTE DE MUESTRAS SECCIÓN DE MICROBIOLOGÍA H. G. U. A REVISIÓN 2012 Supervisora de Microbiología Mª Ángeles Lillo Hernández NORMAS GENERALES PARA RECOGIDA DE MUESTRAS RECOGER
GUÍA PARA RECOGIDA Y TRANSPORTE DE MUESTRAS SECCIÓN DE MICROBIOLOGÍA H. G. U. A REVISIÓN 2012 Supervisora de Microbiología Mª Ángeles Lillo Hernández NORMAS GENERALES PARA RECOGIDA DE MUESTRAS RECOGER
TEMA 8 RECOLECCIÓN, SELECCIÓN Y TRANSPORTE DE MUESTRAS PARA DIAGNÓSTICO MICROBIOLÓGICO
 TEMA 8 RECOLECCIÓN, SELECCIÓN Y TRANSPORTE DE MUESTRAS PARA DIAGNÓSTICO MICROBIOLÓGICO CONCEPTOS FUNDAMENTALES SOBRE LA RECOGIDA DE MUESTRAS Importancia de la recogida correcta de la muestra Conceptos
TEMA 8 RECOLECCIÓN, SELECCIÓN Y TRANSPORTE DE MUESTRAS PARA DIAGNÓSTICO MICROBIOLÓGICO CONCEPTOS FUNDAMENTALES SOBRE LA RECOGIDA DE MUESTRAS Importancia de la recogida correcta de la muestra Conceptos
Técnica para la obtención de la muestra
 Técnica para la obtención de la muestra Luz Yanet Maldonado C Bacterióloga MSc. Microbiología Laboratorio Salud Publica Bogotá TIPO DE MUESTRA Pacientes hospitalizados (Niños): Aspirado nasofaríngeo diluyéndolo
Técnica para la obtención de la muestra Luz Yanet Maldonado C Bacterióloga MSc. Microbiología Laboratorio Salud Publica Bogotá TIPO DE MUESTRA Pacientes hospitalizados (Niños): Aspirado nasofaríngeo diluyéndolo
Estudios microbiológicos.procedimientos. 1. Urocultivos
 Estudios microbiológicos.procedimientos 1. Urocultivos Se realizará el cultivo de orina a todas las muestras llegadas al laboratorio, que cumplan con los requisitos para la toma, conservación y transporte
Estudios microbiológicos.procedimientos 1. Urocultivos Se realizará el cultivo de orina a todas las muestras llegadas al laboratorio, que cumplan con los requisitos para la toma, conservación y transporte
INDICACIONES PARA TOMA DE MUESTRA
 Página 1 de 8 INDICACIONES PARA TOMA DE MUESTRA 1-UROCULTIVO DEBE REMITIRSE EN UN FRASCO ESTERIL (COMERCIAL) 1º orina de la mañana o con 3 hs. de retención urinaria Enviar al laboratorio inmediatamente,
Página 1 de 8 INDICACIONES PARA TOMA DE MUESTRA 1-UROCULTIVO DEBE REMITIRSE EN UN FRASCO ESTERIL (COMERCIAL) 1º orina de la mañana o con 3 hs. de retención urinaria Enviar al laboratorio inmediatamente,
La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la noche.
 INSTRUCCCIONES PARA LA TOMA DE MUESTRA DE ORINAS Y HECES ORINA 1. ORINA PARCIAL Y UROCULTIVO La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la
INSTRUCCCIONES PARA LA TOMA DE MUESTRA DE ORINAS Y HECES ORINA 1. ORINA PARCIAL Y UROCULTIVO La muestra idónea es la primera orina de la mañana, ya que permite la multiplicación de bacterias durante la
Manual de Toma y transporte de muestras microbiológicas
 Página 1 de 29 Página 2 de 29 3. Responsabilidades: Actividad Responsable Médico Servicio EU/Mat/KNS Servicio TPM Servicio Recepción de Muestras Lab. Médico Laboratorio Microbiología TM Microbiología TPM
Página 1 de 29 Página 2 de 29 3. Responsabilidades: Actividad Responsable Médico Servicio EU/Mat/KNS Servicio TPM Servicio Recepción de Muestras Lab. Médico Laboratorio Microbiología TM Microbiología TPM
PREVENCION DE INFECCIONES ASOCIADAS A CATETER URINARIO PERMANENTE HOSPITAL DR. ERNESTO TORRES GALDAMES IQUIQUE
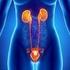 PREVENCION DE INFECCIONES ASOCIADAS A CATETER URINARIO HOSPITAL DR. ERNESTO TORRES GALDAMES IQUIQUE 2013 Página: 2 de 12 INDICE INTRODUCCION 3 PROPOSITO 4 OBJETIVO GENERAL 4 ALCANCE 4 RESPONSABLES 4 DESARROLLO
PREVENCION DE INFECCIONES ASOCIADAS A CATETER URINARIO HOSPITAL DR. ERNESTO TORRES GALDAMES IQUIQUE 2013 Página: 2 de 12 INDICE INTRODUCCION 3 PROPOSITO 4 OBJETIVO GENERAL 4 ALCANCE 4 RESPONSABLES 4 DESARROLLO
TOMA DE MUESTRAS MICROBIOLOGICAS. Dra. Dona Benadof Microbiología Hospital Roberto del Río
 TOMA DE MUESTRAS MICROBIOLOGICAS Dra. Dona Benadof Microbiología Hospital Roberto del Río Temario Definiciones Requisitos Procedimientos de toma de muestras Ejemplos INTRODUCCIÓN La confiabilidad de los
TOMA DE MUESTRAS MICROBIOLOGICAS Dra. Dona Benadof Microbiología Hospital Roberto del Río Temario Definiciones Requisitos Procedimientos de toma de muestras Ejemplos INTRODUCCIÓN La confiabilidad de los
Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención
 Guía de Referencia Rápida Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención Guía de Referencia Rápida
Guía de Referencia Rápida Prevención, Diagnóstico y Tratamiento de la Infección de Vías Urinarias No Complicada en Menores de 18 años en el Primero y Segundo Nivel de Atención Guía de Referencia Rápida
Extracción de Sangre Venosa Periférica
 Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO
 TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO GEMA GÓMEZ LAJARA TEL TEL SERVICIO SERVICIO DE DE LABORATORIO LABORATORIO HOSPITAL SANTA BARBARA. PUERTOLLANO. HOSPITAL SANTA BARBARA. PUERTOLLANO.
TRATAMIENTO Y RECOGIDA DE MUESTRAS EN EL LABORATORIO GEMA GÓMEZ LAJARA TEL TEL SERVICIO SERVICIO DE DE LABORATORIO LABORATORIO HOSPITAL SANTA BARBARA. PUERTOLLANO. HOSPITAL SANTA BARBARA. PUERTOLLANO.
PROCEDIMIENTO DE TOMA DE MUESTRAS PARA UROCULTIVO PROLAB S.A.S LABORATORIO CLÍNICO PARA INSTITUCIONES HOSPITALARIAS
 PROCEDIMIENTO DE TOMA DE MUESTRAS PARA UROCULTIVO PROLAB S.A.S LABORATORIO CLÍNICO PARA INSTITUCIONES HOSPITALARIAS Es importante anotar los datos personales y de la historia clínica del paciente, pues
PROCEDIMIENTO DE TOMA DE MUESTRAS PARA UROCULTIVO PROLAB S.A.S LABORATORIO CLÍNICO PARA INSTITUCIONES HOSPITALARIAS Es importante anotar los datos personales y de la historia clínica del paciente, pues
LIMPIEZA Y DESINFECCION
 PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
PAGINA: 1 de 7 1. DEFINICION: Es el procedimiento, mediante el cual son eliminados los diferentes desechos generados en los procesos de recolección y procesamiento de muestras; y además se describe el
NOMBRE TOMA DE HEMOCULTIVOS Página 1 de 12 ESTADO DOCUMENTAL EL PORTADOR DE ESTA INFORMACION NO ESTA AUTORIZADO A SACAR COPIAS
 NOMBRE TOMA DE HEMOCULTIVOS Página 1 de 12 ESTADO 1. VALIDACION JERARQUIA NOMBRE CARGO FECHA FIRMA ELABORO PATRICIA SABOGAL ENFERMERA VALIDO ALBERTO VALDERRAMA ENFEMERO VIGILANCIA E APROBO DIANA SOTO COORDINACION
NOMBRE TOMA DE HEMOCULTIVOS Página 1 de 12 ESTADO 1. VALIDACION JERARQUIA NOMBRE CARGO FECHA FIRMA ELABORO PATRICIA SABOGAL ENFERMERA VALIDO ALBERTO VALDERRAMA ENFEMERO VIGILANCIA E APROBO DIANA SOTO COORDINACION
Universidad de Buenos Aires, Facultad de Medicina. Departamento de Microbiología, Parasitología e Inmunología. Cátedra 1 Microbiología II
 Universidad de Buenos Aires, Facultad de Medicina Departamento de Microbiología, Parasitología e Inmunología Cátedra 1 Microbiología II Teórico 1 Diagnóstico Bacteriológico Cristina Cerquetti ccerquetti@yahoo.com.ar
Universidad de Buenos Aires, Facultad de Medicina Departamento de Microbiología, Parasitología e Inmunología Cátedra 1 Microbiología II Teórico 1 Diagnóstico Bacteriológico Cristina Cerquetti ccerquetti@yahoo.com.ar
Recomendaciones para una buena toma de muestra. Síganos en
 Recomendaciones para una buena toma de muestra Síganos en Recomendaciones para una buena toma de muestra Antes de la consulta No realizar ejercicios vigorosos No fumar una hora antes Si se ha realizado
Recomendaciones para una buena toma de muestra Síganos en Recomendaciones para una buena toma de muestra Antes de la consulta No realizar ejercicios vigorosos No fumar una hora antes Si se ha realizado
FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO. Claudia Isabel Bedoya C. Bacterióloga
 FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO Claudia Isabel Bedoya C. Bacterióloga FASE PREANALÍTICA EN EL PROCESAMIENTO DE LAS MUESTRAS Procedimiento especializado que consiste en la obtención
FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO Claudia Isabel Bedoya C. Bacterióloga FASE PREANALÍTICA EN EL PROCESAMIENTO DE LAS MUESTRAS Procedimiento especializado que consiste en la obtención
POR QUÉ LLEVO UN CATÉTER?
 Lea atentamente las siguientes instrucciones, y si tiene alguna duda consulte con su enfermera. POR QUÉ LLEVO UN CATÉTER? Usted lleva un catéter central de larga duración, para que en el tiempo que dure
Lea atentamente las siguientes instrucciones, y si tiene alguna duda consulte con su enfermera. POR QUÉ LLEVO UN CATÉTER? Usted lleva un catéter central de larga duración, para que en el tiempo que dure
ESTUDIO PARASITOLOGICO DE HECES.
 ESTUDIO PARASITOLOGICO DE HECES. DE MUESTRAS. A:PREPARACIÓN 3 DÍAS ANTES DE LA RECOGIDA DE LAS HECES DEBE SUPRIMIRSE: 1. MEDICAMENTOS QUE CONTENGAN CARBÓN VEGETAL, SALES DE BISMUTO, DE MAGNESIO, CAOLÍN,
ESTUDIO PARASITOLOGICO DE HECES. DE MUESTRAS. A:PREPARACIÓN 3 DÍAS ANTES DE LA RECOGIDA DE LAS HECES DEBE SUPRIMIRSE: 1. MEDICAMENTOS QUE CONTENGAN CARBÓN VEGETAL, SALES DE BISMUTO, DE MAGNESIO, CAOLÍN,
UNIDAD DIDÁCTICA III: INFECCIONES ASOCIADAS A LA ATENCIÓN SANITARIA
 UNIDAD DIDÁCTICA III: INFECCIONES ASOCIADAS A LA ATENCIÓN SANITARIA Apartados de información del Unidad Didáctica III De qué estamos hablando cuando decimos infecciones asociadas a la atención sanitaria?
UNIDAD DIDÁCTICA III: INFECCIONES ASOCIADAS A LA ATENCIÓN SANITARIA Apartados de información del Unidad Didáctica III De qué estamos hablando cuando decimos infecciones asociadas a la atención sanitaria?
GenPE: estudio Internacional de Genética en Preeclampsia
 GenPE: estudio Internacional de Genética en Preeclampsia INSTRUCTIVO Toma de muestra proyecto GenPE PAQUETE PARA CAPTACIÓN DE PACIENTE Y TOMA DE MUESTRA. Cuando llegue a su institución la caja del proyecto
GenPE: estudio Internacional de Genética en Preeclampsia INSTRUCTIVO Toma de muestra proyecto GenPE PAQUETE PARA CAPTACIÓN DE PACIENTE Y TOMA DE MUESTRA. Cuando llegue a su institución la caja del proyecto
LABORATORIO DE ANALISIS CLINICOS,BACTERIOLOGICOS Y ENDOCRINOLOGICOS DR. CARLOS GUZZETTI
 LABORATORIO DE ANALISIS CLINICOS,BACTERIOLOGICOS Y ENDOCRINOLOGICOS DR. CARLOS GUZZETTI Horario de toma de muestra (extraccion de sangre) Lunes a Viernes de 8.15:00 a 10.30 hs Retiro de informes: 10.30
LABORATORIO DE ANALISIS CLINICOS,BACTERIOLOGICOS Y ENDOCRINOLOGICOS DR. CARLOS GUZZETTI Horario de toma de muestra (extraccion de sangre) Lunes a Viernes de 8.15:00 a 10.30 hs Retiro de informes: 10.30
Procedimientos Hoja 1 de 5 Servicio de Cardiología Unidad Coronaria
 Procedimientos Hoja 1 de 5 Norma de Prevención de la infección urinaria Objetivo Establecer medidas para prevenir las complicaciones infecciosas relacionadas al cateterismo vesical Introducción La infección
Procedimientos Hoja 1 de 5 Norma de Prevención de la infección urinaria Objetivo Establecer medidas para prevenir las complicaciones infecciosas relacionadas al cateterismo vesical Introducción La infección
CONDICIONES GENERALES PARA TOMA DE MUESTRAS LABORATORIO CLINICO
 EXAMEN CONDICIONES HEMATOLOGIA PRUEBAS DE COAGULACION (PT, PTT, FIBRINOGENO, DIMERO D) No tomar el anticoagulante hasta después de la toma de Informar que anticoagulante está usando. HEMOGRAMA No es necesario
EXAMEN CONDICIONES HEMATOLOGIA PRUEBAS DE COAGULACION (PT, PTT, FIBRINOGENO, DIMERO D) No tomar el anticoagulante hasta después de la toma de Informar que anticoagulante está usando. HEMOGRAMA No es necesario
Código: PM-IS PT-1 Versión:1 Fecha Vigencia:
 1 de 7 1. PROCESO/SUBPROCESO RELACIONADO: Gestión de la Interacción Social/Servicios de Salud a la Comunidad 2. RESPONSABLE(S):. 3. OBJETIVO: Evacuar la orina retenida en la vejiga, utilizando la técnica
1 de 7 1. PROCESO/SUBPROCESO RELACIONADO: Gestión de la Interacción Social/Servicios de Salud a la Comunidad 2. RESPONSABLE(S):. 3. OBJETIVO: Evacuar la orina retenida en la vejiga, utilizando la técnica
GUIA Nº2: POSTURA DE GUANTES DE PROCEDIMIENTO Y ESTERILES
 FACULTAD DE ENFERMERÍA ASIGNATURA: CUIDADOS DE ENFERMERÍA EN EL CICLO VITAL I (ENFE-6013) CREADO EQUIPO DOCENTE PAE 1 (2010) ACTUALIZADO EQUIPO DOCENTE CICLO VITAL I (2012-1) TALLER Nº 1 GUIA Nº2: POSTURA
FACULTAD DE ENFERMERÍA ASIGNATURA: CUIDADOS DE ENFERMERÍA EN EL CICLO VITAL I (ENFE-6013) CREADO EQUIPO DOCENTE PAE 1 (2010) ACTUALIZADO EQUIPO DOCENTE CICLO VITAL I (2012-1) TALLER Nº 1 GUIA Nº2: POSTURA
ALGORITMOS DE ACTUACIÓN EN CASO DE INFECCIÓN URINARIA EN PEDIATRÍA
 ALGORITMOS DE ACTUACIÓN EN CASO DE INFECCIÓN URINARIA EN PEDIATRÍA SERVICIO DE PEDIATRÍA SERVICIO DE URGENCIAS HOSPITAL DE SAGUNTO 2013 1. SOSPECHA CLÍNICA Menores de 2 años con fiebre sin foco. Síntomas
ALGORITMOS DE ACTUACIÓN EN CASO DE INFECCIÓN URINARIA EN PEDIATRÍA SERVICIO DE PEDIATRÍA SERVICIO DE URGENCIAS HOSPITAL DE SAGUNTO 2013 1. SOSPECHA CLÍNICA Menores de 2 años con fiebre sin foco. Síntomas
PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES
 PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES 1 El procedimiento agrupa tres etapas: 1. Procedimiento previo a la punción capilar. 2. Procedimiento de la punción
PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES 1 El procedimiento agrupa tres etapas: 1. Procedimiento previo a la punción capilar. 2. Procedimiento de la punción
Instructivo. Manejo de los Residuos Infecciosos
 Página 1 de 5 1. Objetivo Describir las actividades necesarias (clasificación, almacenamiento, tratamiento y eliminación), para realizar el manejo de los residuos infeciosos. 2. Alcance Se aplica a todas
Página 1 de 5 1. Objetivo Describir las actividades necesarias (clasificación, almacenamiento, tratamiento y eliminación), para realizar el manejo de los residuos infeciosos. 2. Alcance Se aplica a todas
114. Señala a continuación, sistemas de eliminación de líquidos: a) Pulmones. b) Vómitos. c) Intestino. d) Todos son sistemas de eliminación.
 1 111. En condiciones normales el cuerpo elimina un volumen de líquido que oscila entre: a) 2400 y 2500 ml. b) 2300 y 2500 ml. c) 2300 y 2600 ml. d) 2400 y 2700 ml. 112. Qué es el balance?: a) Es el resultado
1 111. En condiciones normales el cuerpo elimina un volumen de líquido que oscila entre: a) 2400 y 2500 ml. b) 2300 y 2500 ml. c) 2300 y 2600 ml. d) 2400 y 2700 ml. 112. Qué es el balance?: a) Es el resultado
Instalación de Catéter Urinario Permanente en HRR
 en HRR Elaborado por : Revisado por : Aprobado por : Verónica Torres Mónica Rubio Gabriela García Roxana González Enfermeras Dr. Sonia Correa Comité IAAS Carmen Gloria Díaz Calidad y Seguridad del Paciente
en HRR Elaborado por : Revisado por : Aprobado por : Verónica Torres Mónica Rubio Gabriela García Roxana González Enfermeras Dr. Sonia Correa Comité IAAS Carmen Gloria Díaz Calidad y Seguridad del Paciente
Normas para la Toma de Muestras. Mediante una torunda estéril se procederá de la siguiente forma:
 Anexo 1: Normas para la Toma de Muestras a) Toma de Frotis Faríngeo: - Se realizará un escobillado (frotado) con hisopo preferiblemente de materia sintético (Ej: tipo Dacron), de la faringe, pilares y
Anexo 1: Normas para la Toma de Muestras a) Toma de Frotis Faríngeo: - Se realizará un escobillado (frotado) con hisopo preferiblemente de materia sintético (Ej: tipo Dacron), de la faringe, pilares y
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Infección de vías urinarias asociada a sonda vesical
 Infección de vías urinarias asociada a sonda vesical Objetivo: Prevenir el desarrollo de infecciones de vías urinarias relacionadas con la presencia de sonda vesical a permanencia en pacientes hospitalizados,
Infección de vías urinarias asociada a sonda vesical Objetivo: Prevenir el desarrollo de infecciones de vías urinarias relacionadas con la presencia de sonda vesical a permanencia en pacientes hospitalizados,
INDICACIONES PARA LA HIGIENE DE MANOS
 Medicina Preventiva y Salud Pública H.C.U.V. Actualizado 2010 INDICACIONES PARA LA HIGIENE DE MANOS Debe realizarse higiene de las manos por parte del personal sanitario en las siguientes situaciones A.
Medicina Preventiva y Salud Pública H.C.U.V. Actualizado 2010 INDICACIONES PARA LA HIGIENE DE MANOS Debe realizarse higiene de las manos por parte del personal sanitario en las siguientes situaciones A.
CONDICIONES GENERALES PARA TOMA DE MUESTRAS LABORATORIO CLINICO
 CONDICIONES GENERALES PARA TOMA DE MUESTRAS LABORATORIO CLINICO EXAMEN PRUEBAS DE COAGULACION (PT, PTT, FIBRINOGENO, DIMERO D) HEMATOLOGIA CONDICIONES Ayuno o desayuno muy liviano y no reciente a la toma
CONDICIONES GENERALES PARA TOMA DE MUESTRAS LABORATORIO CLINICO EXAMEN PRUEBAS DE COAGULACION (PT, PTT, FIBRINOGENO, DIMERO D) HEMATOLOGIA CONDICIONES Ayuno o desayuno muy liviano y no reciente a la toma
Dirección de Redes en Salud Pública
 Dirección de Redes en Salud Pública Recolección de muestras para el estudio de Microcefalias y otras mal formaciones del SNC posiblemente asociadas a infección por virus Zika 22 de Febrero de 2016 Confirmación
Dirección de Redes en Salud Pública Recolección de muestras para el estudio de Microcefalias y otras mal formaciones del SNC posiblemente asociadas a infección por virus Zika 22 de Febrero de 2016 Confirmación
AISLAMIENTO UNIVERSAL
 AISLAMIENTO UNIVERSAL OBJETIVO: Llevar a cabo las medidas de protección que deben observarse de forma sistemática y generalizada en el ámbito hospitalario. 1 EQUIPAMIENTO NECESARIO: Jabón antiséptico y
AISLAMIENTO UNIVERSAL OBJETIVO: Llevar a cabo las medidas de protección que deben observarse de forma sistemática y generalizada en el ámbito hospitalario. 1 EQUIPAMIENTO NECESARIO: Jabón antiséptico y
TIPO DE DOCUMENTO TOMA DE MUESTRAS PARA LABORATORIO 1. TOMA DE MUESTRAS PARA LABORATORIO CLINICO
 ACTM 001 1. CLINICO 1.1. DEFINICIÓN Es la introducción de un Venocath o Jeringa directamente en el torrente sanguíneo, con el fin de extraer una muestra de sangre del paciente para su análisis posterior
ACTM 001 1. CLINICO 1.1. DEFINICIÓN Es la introducción de un Venocath o Jeringa directamente en el torrente sanguíneo, con el fin de extraer una muestra de sangre del paciente para su análisis posterior
APÉNDICE B. INSTRUCTIVO DE RECOLECCIÓN Y ENVÍO DE MUESTRAS PARA LOS LABORATO- RIOS DE APOYO A VIGILANCIA EPIDEMIOLÓGICA.
 APÉNDICE B. INSTRUCTIVO DE RECOLECCIÓN Y ENVÍO DE MUESTRAS PARA LOS LABORATO- RIOS DE APOYO A VIGILANCIA EPIDEMIOLÓGICA. La selección, la recolección y el transporte apropiados de especimenes al laboratorio
APÉNDICE B. INSTRUCTIVO DE RECOLECCIÓN Y ENVÍO DE MUESTRAS PARA LOS LABORATO- RIOS DE APOYO A VIGILANCIA EPIDEMIOLÓGICA. La selección, la recolección y el transporte apropiados de especimenes al laboratorio
INSTRUCCIONES DE USO
 1/4 INSTRUCCIONES DE USO (IMPROMINI TUBOS PARA LA RECOLECCION DE SANGRE CAPILAR PARA UN UNICO USO) Fabricante Guangzhou Improve Medical Instruments Co., Ltd Nombre del Producto Capillary Blood Collection
1/4 INSTRUCCIONES DE USO (IMPROMINI TUBOS PARA LA RECOLECCION DE SANGRE CAPILAR PARA UN UNICO USO) Fabricante Guangzhou Improve Medical Instruments Co., Ltd Nombre del Producto Capillary Blood Collection
Requisitos para toma de muestra
 Requisitos para toma de muestra PARA TOMA DE MUESTRAS DE HEMOGRAMA y COAGULOGRAMA: No requiere ayuno, puede ser tomado a cualquier hora del dia. PARA TOMA DE MUESTRAS de QUÍMICA SANGUÍNEA (serología, infectología,
Requisitos para toma de muestra PARA TOMA DE MUESTRAS DE HEMOGRAMA y COAGULOGRAMA: No requiere ayuno, puede ser tomado a cualquier hora del dia. PARA TOMA DE MUESTRAS de QUÍMICA SANGUÍNEA (serología, infectología,
Materiales para el docente:
 CURSO: CLÍNICA BÁSICA GUÍA Nº 1 CÓDIGO: 501051 NOMBRE DEL PROCEDIMIENTO: PROCEDIMIENTOS DE TÉCNICA ASÉPTICA OBJETIVOS DE LA PRÁCTICA DE LABORATORIO: Adquirir habilidad previa en los procedimientos relacionados
CURSO: CLÍNICA BÁSICA GUÍA Nº 1 CÓDIGO: 501051 NOMBRE DEL PROCEDIMIENTO: PROCEDIMIENTOS DE TÉCNICA ASÉPTICA OBJETIVOS DE LA PRÁCTICA DE LABORATORIO: Adquirir habilidad previa en los procedimientos relacionados
Toma de muestra, conservación y transporte para estudios microbiológicos Departamento de Microbiología
 , conservación y transporte para estudios microbiológicos Departamento de Microbiología Indice I- INTRODUCCION I 01 II- ORINA A- Urocultivo Instructivo para laboratorio derivante: II 01 Pacientes que controlan
, conservación y transporte para estudios microbiológicos Departamento de Microbiología Indice I- INTRODUCCION I 01 II- ORINA A- Urocultivo Instructivo para laboratorio derivante: II 01 Pacientes que controlan
PROCEDIMIENTO ENEMA EVACUADOR
 Pág.1 de 6 REALIZADO por REVISADO por APROBADO por Nombre: Beatriz Bagnasco Nombre: Silvia de León Nombre: Miriam Gorrasi Lic.Enf.Esp. Directora Dpto. Educación Nombre: Ana Díaz Nombre: Cristina D Esteban
Pág.1 de 6 REALIZADO por REVISADO por APROBADO por Nombre: Beatriz Bagnasco Nombre: Silvia de León Nombre: Miriam Gorrasi Lic.Enf.Esp. Directora Dpto. Educación Nombre: Ana Díaz Nombre: Cristina D Esteban
Epidemiología INFECCIONES DEL TRACTO URINARIO. Bacteriuria
 INFECCIONES DEL TRACTO URINARIO Bacteriuria Presencia de bacterias en la orina La probabilidad de que la orina de la vejiga esté infectada se determina por medio de la cuantificación del número de bacterias
INFECCIONES DEL TRACTO URINARIO Bacteriuria Presencia de bacterias en la orina La probabilidad de que la orina de la vejiga esté infectada se determina por medio de la cuantificación del número de bacterias
Coordinador de Enfermería
 Alejandra Abril Tirado Enfermera CS Torreblanca Julián Rosselló Llerena Coordinador de Enfermería CS Illes Columbretes 1 Definición de retención aguda de orina Acumulación de orina en la vejiga urinaria
Alejandra Abril Tirado Enfermera CS Torreblanca Julián Rosselló Llerena Coordinador de Enfermería CS Illes Columbretes 1 Definición de retención aguda de orina Acumulación de orina en la vejiga urinaria
PROTOCOLO PREVENCION DE INFECCIONES URINARIAS EN PACIENTES ADULTOS CON CATETER URINARIO PERMANENTE
 PROTOCOLO PREVENCION DE INFECCIONES URINARIAS EN PACIENTES ADULTOS CON CATETER URINARIO PERMANENTE Dr. Luis Tisné Brousse AÑO 2013 INDICE I. INTRODUCCION 3 II. OBJETIVO GENERAL 3 III. OBJETIVOS ESPECÍFICOS
PROTOCOLO PREVENCION DE INFECCIONES URINARIAS EN PACIENTES ADULTOS CON CATETER URINARIO PERMANENTE Dr. Luis Tisné Brousse AÑO 2013 INDICE I. INTRODUCCION 3 II. OBJETIVO GENERAL 3 III. OBJETIVOS ESPECÍFICOS
2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias
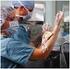 2. PRECAUCIONES DE RUTINA PARA EL CONTROL DE INFECCIONES DE ENFERMEDADES RESPIRATORIAS 2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias Precauciones estándar Las precauciones
2. PRECAUCIONES DE RUTINA PARA EL CONTROL DE INFECCIONES DE ENFERMEDADES RESPIRATORIAS 2. Precauciones de Rutina para el Control de Infecciones de Enfermedades Respiratorias Precauciones estándar Las precauciones
TOMA DE MUESTRAS MICROBIOLÓGICAS
 TOMA DE MUESTRAS MICROBIOLÓGICAS Fecha de actualización: Abril de 2008 En vigencia desde: Junio de 2008 DIRIGIDO A: Médicos Enfermeras Matronas Tecnólogos Médicos Técnicos Paramédicos OBJETIVOS: Identificar
TOMA DE MUESTRAS MICROBIOLÓGICAS Fecha de actualización: Abril de 2008 En vigencia desde: Junio de 2008 DIRIGIDO A: Médicos Enfermeras Matronas Tecnólogos Médicos Técnicos Paramédicos OBJETIVOS: Identificar
Obtener una muestra biológica en condiciones óptimas para su proceso analítico de acuerdo al examén solicitado.
 Código: I-CIRB-AADC-02 Revisión: 03 Página: 1 de 7 1.- OBJETIVO Obtener una muestra biológica en condiciones óptimas para su proceso analítico de acuerdo al examén solicitado. 2.- ALCANCE Aplica para la
Código: I-CIRB-AADC-02 Revisión: 03 Página: 1 de 7 1.- OBJETIVO Obtener una muestra biológica en condiciones óptimas para su proceso analítico de acuerdo al examén solicitado. 2.- ALCANCE Aplica para la
DECRETO N /2.013 ARICA, 16 de Diciembre de 2013.
 DECRETO N 1 7.453/2.013 ARICA, 16 de Diciembre de 2013. a) Lo dispuesto en la Ley N 19.937 de Autoridad Sanitaria de Febrero 2004 b) Lo dispuesto en la Ley N 19.966 de Régimen de Garantías Explícitas en
DECRETO N 1 7.453/2.013 ARICA, 16 de Diciembre de 2013. a) Lo dispuesto en la Ley N 19.937 de Autoridad Sanitaria de Febrero 2004 b) Lo dispuesto en la Ley N 19.966 de Régimen de Garantías Explícitas en
Ejemplos de recolección, conservación, envase y transporte de muestras de alimentos MANEJO EN EL MUESTRAS CONSERVACIÓN
 VI. Ejemplos de recolección, conservación, envase y transporte de muestras de alimentos RECOLECCIÓN Y Y DESECHO sólidos o mezcla de dos alimentos Realice cortes o tomar porciones de los alimentos utilizando
VI. Ejemplos de recolección, conservación, envase y transporte de muestras de alimentos RECOLECCIÓN Y Y DESECHO sólidos o mezcla de dos alimentos Realice cortes o tomar porciones de los alimentos utilizando
TOMA DE MUESTRA SANGUINEA
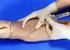 DEFINICIÓN: TOMA DE MUESTRA Procedimiento que permite acceder al torrente sanguíneo para extraer una pequeña muestra de sangre, que será utilizada en diversas pruebas. Dr. Eddie Alonzo RIII Medicina Interna
DEFINICIÓN: TOMA DE MUESTRA Procedimiento que permite acceder al torrente sanguíneo para extraer una pequeña muestra de sangre, que será utilizada en diversas pruebas. Dr. Eddie Alonzo RIII Medicina Interna
Sistema Renal. Técnica de colocación de Sonda vesical. Prof. Lic. Vanesa Arzamendia. Escuela Superior de Enfermería Cecilia Grierson
 Escuela Superior de Enfermería Cecilia Grierson Adulto y Anciano I Turno Tarde Sistema Renal Técnica de colocación de Sonda vesical Prof. Lic. Vanesa Arzamendia Anatomía y fisiología renal Anatomía y fisiología
Escuela Superior de Enfermería Cecilia Grierson Adulto y Anciano I Turno Tarde Sistema Renal Técnica de colocación de Sonda vesical Prof. Lic. Vanesa Arzamendia Anatomía y fisiología renal Anatomía y fisiología
PMD: CARLOS ANDRES SAMBONI PMD: CARLOS ANDRES SAMBONI
 PMD: CARLOS ANDRES SAMBONI PMD: CARLOS ANDRES SAMBONI PRINCIPIO UNIVERSAL DE BIOSEGURIDAD TODOS LOS PACIENTES Y SUS FLUIDOS CORPORALES INDEPENDIENTEMENTE DEL DIAGNOSTICO O MOTIVO DE INGRESO, DEBERAN SER
PMD: CARLOS ANDRES SAMBONI PMD: CARLOS ANDRES SAMBONI PRINCIPIO UNIVERSAL DE BIOSEGURIDAD TODOS LOS PACIENTES Y SUS FLUIDOS CORPORALES INDEPENDIENTEMENTE DEL DIAGNOSTICO O MOTIVO DE INGRESO, DEBERAN SER
PROCEDIMIENTO HIGIENE BUCAL
 Pág. 1 de 6 REALIZADO por REVISADO por APROBADO por Nombre: Rocío González Nombre: Silvia de León Nombre: Miriam Gorrasi Asistencial Directora Dpto. Educación Nombre: Silvia Esquibel Nombre: Ana Díaz Nombre:
Pág. 1 de 6 REALIZADO por REVISADO por APROBADO por Nombre: Rocío González Nombre: Silvia de León Nombre: Miriam Gorrasi Asistencial Directora Dpto. Educación Nombre: Silvia Esquibel Nombre: Ana Díaz Nombre:
EL LAVADO GASTRICO EN EL NEONATO
 PROCEDIMIENTOS DE ENFERMERIA EL LAVADO GASTRICO EN EL NEONATO DEFINICION Es un procedimiento que consiste en la introducción de una sonda hueca, multiperforada en su extremo distal, que se llevará hasta
PROCEDIMIENTOS DE ENFERMERIA EL LAVADO GASTRICO EN EL NEONATO DEFINICION Es un procedimiento que consiste en la introducción de una sonda hueca, multiperforada en su extremo distal, que se llevará hasta
Calor húmedo (autoclave) 2 Radiaciones i UV. 3 Incineración. 4 Ebullición 5 Calor seco (horno)
 ESTERILIZACIÓN Definición: Ausencia de toda forma de vida (por medio de agentes físicos) AGENTES FÍSICOS 1 1 Calor húmedo (autoclave) 2 Radiaciones i UV 3 Incineración 4 Ebullición 5 Calor seco (horno)
ESTERILIZACIÓN Definición: Ausencia de toda forma de vida (por medio de agentes físicos) AGENTES FÍSICOS 1 1 Calor húmedo (autoclave) 2 Radiaciones i UV 3 Incineración 4 Ebullición 5 Calor seco (horno)
3.- Higiene de manos y Antisepsia cutánea
 Higiene de manos La medida más sencilla y eficaz para reducir la infección asociada a la asistencia sanitaria Transmisión cruzada de microorganismos a través de las manos: Las manos de los profesionales
Higiene de manos La medida más sencilla y eficaz para reducir la infección asociada a la asistencia sanitaria Transmisión cruzada de microorganismos a través de las manos: Las manos de los profesionales
Recogida de Muestras en Pediatría
 Recogida de Muestras en Pediatría Sr. Juan Jareño Talero Supervisor de Urgencias Pediátricas del Hospital Son Dureta Palma de Mallorca Muestras de sangre venosa Hemocultivo Sist. BACTEC Bioquímica Hematología
Recogida de Muestras en Pediatría Sr. Juan Jareño Talero Supervisor de Urgencias Pediátricas del Hospital Son Dureta Palma de Mallorca Muestras de sangre venosa Hemocultivo Sist. BACTEC Bioquímica Hematología
PROCEDIMIENTO OPERACIONAL TÉCNICO DRENAJE DE HEMATOMA
 Responsable: Ortopedia, Cirugía plástica, Cirugía general Personal médico y de enfermería Actualizó: Carlos Alberto Velásquez Córdoba PROCEDIMIENTO OPERACIONAL TÉCNICO MACROPROCESO: Atención al cliente
Responsable: Ortopedia, Cirugía plástica, Cirugía general Personal médico y de enfermería Actualizó: Carlos Alberto Velásquez Córdoba PROCEDIMIENTO OPERACIONAL TÉCNICO MACROPROCESO: Atención al cliente
Norma/Política Manejo y descarte adecuado de Dispositivos Cortopunzantes
 01.00 Dispositivos Cortopunzantes 53/13 de / Modificación: 01/00 Fecha de Vigencia: 29/01/14 Responsable de Gestión de la norma/política: Inés Staneloni/ Int. 8165 Mail: maria.staneloni@hospitalitaliano.org.ar
01.00 Dispositivos Cortopunzantes 53/13 de / Modificación: 01/00 Fecha de Vigencia: 29/01/14 Responsable de Gestión de la norma/política: Inés Staneloni/ Int. 8165 Mail: maria.staneloni@hospitalitaliano.org.ar
PROCEDIMIENTO DE MANEJO DE PACIENTES CON INFECCIONES VIRALES UNIDAD DE HEMODIÁLISIS HOSPITAL REGIONAL RANCAGUA
 PACIENTES CON INFECCIONES HOSPITAL REGIONAL RANCAGUA Página: 1 de 7 1.- OBJETIVO: Prevenir Infecciones cruzadas por Virus hepatitis B, hepatitis C y VIH en Hemodiálisis 2.- ALCANCE: Aplica a la prevención
PACIENTES CON INFECCIONES HOSPITAL REGIONAL RANCAGUA Página: 1 de 7 1.- OBJETIVO: Prevenir Infecciones cruzadas por Virus hepatitis B, hepatitis C y VIH en Hemodiálisis 2.- ALCANCE: Aplica a la prevención
DRENAJES DE HERIDAS. Proporcionar los cuidados necesarios para el funcionamiento óptimo del drenaje y evitar complicaciones.
 Página 1 de 7 DRENAJES DE HERIDAS 1.-OBJETIVO Proporcionar los cuidados necesarios para el funcionamiento óptimo del drenaje y evitar complicaciones. 2.-DEFINICIÓN Drenaje: sistema mecánico de eliminación
Página 1 de 7 DRENAJES DE HERIDAS 1.-OBJETIVO Proporcionar los cuidados necesarios para el funcionamiento óptimo del drenaje y evitar complicaciones. 2.-DEFINICIÓN Drenaje: sistema mecánico de eliminación
Catéteres venosos centrales de corta duración
 Catéteres venosos centrales de corta duración Mª Luisa Villaseñor Herrera. Supervisora de Área de Servicios Especiales. Complejo Hospitalario de Badajoz Jornada Extremeña de Actualización en terapia IV.
Catéteres venosos centrales de corta duración Mª Luisa Villaseñor Herrera. Supervisora de Área de Servicios Especiales. Complejo Hospitalario de Badajoz Jornada Extremeña de Actualización en terapia IV.
MANUAL DE TOMA DE MUESTRAS DE BACTERIOLOGIA - LABICO
 05-07-2013 MANUAL DE TOMA DE MUESTRAS DE BACTERIOLOGIA - LABICO 1- HEMOCULTIVO Introducir la sangre en las botellas, con la jeringa en posición vertical. Mover las botellas para que la sangre y el medio
05-07-2013 MANUAL DE TOMA DE MUESTRAS DE BACTERIOLOGIA - LABICO 1- HEMOCULTIVO Introducir la sangre en las botellas, con la jeringa en posición vertical. Mover las botellas para que la sangre y el medio
La excelencia no es una acción, es un hábito Aristóteles
 RECOMENDACIONES PARA LA TOMA DE MUESTRAS EN BACTERIOLOGÍA CLÍNICA. La excelencia no es una acción, es un hábito Aristóteles ÍNDICE 1. HERIDAS SUPERFICIALES Y ABSCESOS ABIERTOS. 2. ABSCESOS CERRADOS. 3.
RECOMENDACIONES PARA LA TOMA DE MUESTRAS EN BACTERIOLOGÍA CLÍNICA. La excelencia no es una acción, es un hábito Aristóteles ÍNDICE 1. HERIDAS SUPERFICIALES Y ABSCESOS ABIERTOS. 2. ABSCESOS CERRADOS. 3.
TOMA DE MUESTRA 22/02/2016. Objetivos. Factores Que Intervienen En La Toma De Muestra. Importancia Toma de Muestra
 TOMA DE MUESTRA Objetivos Establecer el agente causal de la infección para su adecuado tratamiento. Mejorar la calidad en la toma de muestra. Disminuir el riesgo de contaminación durante el Lda. María
TOMA DE MUESTRA Objetivos Establecer el agente causal de la infección para su adecuado tratamiento. Mejorar la calidad en la toma de muestra. Disminuir el riesgo de contaminación durante el Lda. María
Cuidados enfermeros en los problemas renales
 Cuidados enfermeros en los problemas renales Pregunta 1 Incorrecta Puntúa 0,00 sobre 1,00 Señale la respuesta correcta cuando se procede insertar la sonda en el orificio uretral en la mujer: a. Se debe
Cuidados enfermeros en los problemas renales Pregunta 1 Incorrecta Puntúa 0,00 sobre 1,00 Señale la respuesta correcta cuando se procede insertar la sonda en el orificio uretral en la mujer: a. Se debe
LISTA DE DISPOSITIVOS MÉDICOS ESENCIALE PARA EVENTOS SÍSMICOS
 MINISTERIO DE SALUD PÚBLICA SUBSECRETARIA NACIONAL DE GOBERNANZA DE LA SALUD PÚBLICA DIRECCIÓN NACIONAL DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS LISTA DE DISPOSITIVOS MÉDICOS ESENCIALE PARA EVENTOS SÍSMICOS
MINISTERIO DE SALUD PÚBLICA SUBSECRETARIA NACIONAL DE GOBERNANZA DE LA SALUD PÚBLICA DIRECCIÓN NACIONAL DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS LISTA DE DISPOSITIVOS MÉDICOS ESENCIALE PARA EVENTOS SÍSMICOS
MANEJO DE SOLUCIONES DESINFECTANTES
 PAGINA: 1 de 8 REVISADO: ELABORADO: COORDINADOR DE CALIDAD 1. DEFINICION ENFERMERO JEFE COORDINADOR CIRUGIA Las soluciones desinfectantes son sustancias que actúan sobre los microorganismos inactivándolos
PAGINA: 1 de 8 REVISADO: ELABORADO: COORDINADOR DE CALIDAD 1. DEFINICION ENFERMERO JEFE COORDINADOR CIRUGIA Las soluciones desinfectantes son sustancias que actúan sobre los microorganismos inactivándolos
Figura 1. Las partes de su sonda de Foley
 Esta información le ayudará a cuidar de su sonda vesical (Foley ) mientras se encuentra en casa. Se le colocó una sonda de Foley (un tubo delgado y flexible) en su vejiga para drenar la orina. Esta se
Esta información le ayudará a cuidar de su sonda vesical (Foley ) mientras se encuentra en casa. Se le colocó una sonda de Foley (un tubo delgado y flexible) en su vejiga para drenar la orina. Esta se
Contribuir en el Dx médico, teniendo muestras adecuadas y oportunas. Obtener muestras utilizando técnicas y procedimientos según normas.
 DEPARTAMENTO DE ENFERMERÍA 1 DE 13 TOMA DE MUESTRA Dentro de las múltiples actividades de enfermería, se encuentra la recolección de muestras; de sangre, orina, es todos, hace 11 decisiones de las heridas
DEPARTAMENTO DE ENFERMERÍA 1 DE 13 TOMA DE MUESTRA Dentro de las múltiples actividades de enfermería, se encuentra la recolección de muestras; de sangre, orina, es todos, hace 11 decisiones de las heridas
SONDAS Y CATÉTERES FIJACIÓN DE SONDAS Y CATÉTERES EN NEONATOLOGÍA
 SONDAS Y CATÉTERES FIJACIÓN DE SONDAS Y CATÉTERES EN NEONATOLOGÍA SONDAS Y CATÉTERES CONSIDERACIONES ESPECÍFICAS Permitir la visualización de las sondas Evitar que se obstruya la salida de las sondas y
SONDAS Y CATÉTERES FIJACIÓN DE SONDAS Y CATÉTERES EN NEONATOLOGÍA SONDAS Y CATÉTERES CONSIDERACIONES ESPECÍFICAS Permitir la visualización de las sondas Evitar que se obstruya la salida de las sondas y
OBTENCIÓN DE MUESTRAS. MEDIDAS GENERALES:
 OBTENCIÓN DE MUESTRAS. MEDIDAS GENERALES: Verificar y entender cuál es la prueba que se pide, por qué y qué debo hacer. Conocer el procedimiento. Preparar el equipo necesario. Preparar al paciente, tanto
OBTENCIÓN DE MUESTRAS. MEDIDAS GENERALES: Verificar y entender cuál es la prueba que se pide, por qué y qué debo hacer. Conocer el procedimiento. Preparar el equipo necesario. Preparar al paciente, tanto
INFORMACION GENERAL EN QUE CONSISTE LA ADENOMECTOMIA O PROSTATECTOMÍA ABIERTA
 INFORMACION GENERAL El adenoma de la próstata, es un crecimiento benigno de la glándula prostática, que obstruye la salida de la orina a nivel del cuello de la vejiga. Este crecimiento suele síntomas urinarios
INFORMACION GENERAL El adenoma de la próstata, es un crecimiento benigno de la glándula prostática, que obstruye la salida de la orina a nivel del cuello de la vejiga. Este crecimiento suele síntomas urinarios
Guía del Curso Especialista en Protocolos y Técnicas de Enfermería en el Paciente Crítico
 Guía del Curso Especialista en Protocolos y Técnicas de Enfermería en el Paciente Crítico Modalidad de realización del curso: Titulación: A distancia y Online Diploma acreditativo con las horas del curso
Guía del Curso Especialista en Protocolos y Técnicas de Enfermería en el Paciente Crítico Modalidad de realización del curso: Titulación: A distancia y Online Diploma acreditativo con las horas del curso
NUTRICIÓN ENTERAL EN FORMA DE BOLUS CON JERINGA
 NUTRICIÓN ENTERAL EN FORMA DE BOLUS CON JERINGA AUTORES Ultima actualización: Begoña Alvarez Coto DUE Sº Nutrición y dietética Fecha Mayo 2011 REVISORES Comisión Cuidados Enfermería Enfermeria de Nutrición
NUTRICIÓN ENTERAL EN FORMA DE BOLUS CON JERINGA AUTORES Ultima actualización: Begoña Alvarez Coto DUE Sº Nutrición y dietética Fecha Mayo 2011 REVISORES Comisión Cuidados Enfermería Enfermeria de Nutrición
MINISTERIO DE SALUD PÚBLICA Y BIENESTAR SOCIAL INSTITUTO DE MEDICINA TROPICAL
 MANUAL DE RECOLECCIÓN, TRANSPORTE Y CONSERVACIÓN DE MUESTRAS PARA EXÁMENES BACTERIOLÓGICOS MAYO 2.009 2 DOCUMENTO ELABORADO POR: Dr. Juan D. Irala Ledezma REVISADO POR: Dra. Edelira Ayala de Paredes APROBADO
MANUAL DE RECOLECCIÓN, TRANSPORTE Y CONSERVACIÓN DE MUESTRAS PARA EXÁMENES BACTERIOLÓGICOS MAYO 2.009 2 DOCUMENTO ELABORADO POR: Dr. Juan D. Irala Ledezma REVISADO POR: Dra. Edelira Ayala de Paredes APROBADO
BIOSEGURIDAD LIC. LAURA ROA CAMPOS
 BIOSEGURIDAD LIC. LAURA ROA CAMPOS BIOSEGURIDAD CONOCIMIENTOS, ACTITUDES Y PRÁCTICAS QUE PROMUEVEN LA PREVENCIÓN DE ACCIDENTES LABORALES QUE COMPROMETE A TODAS LAS PERSONAS DEL AMBIENTE ASISTENCIAL CON
BIOSEGURIDAD LIC. LAURA ROA CAMPOS BIOSEGURIDAD CONOCIMIENTOS, ACTITUDES Y PRÁCTICAS QUE PROMUEVEN LA PREVENCIÓN DE ACCIDENTES LABORALES QUE COMPROMETE A TODAS LAS PERSONAS DEL AMBIENTE ASISTENCIAL CON
