Departamento de Ingeniería Metalúrgica Universidad de Santiago de Chile
|
|
|
- Vicente Hernández Toledo
- hace 6 años
- Vistas:
Transcripción
1 CAPÍTULO 20: DIAGRAMAS DE EQUILIBRIO TÉRMINOS Y DEFINICIONES Fase: Una fase se define como un cuerpo de materia microscópicamente homogénea. Tiene la misma estructura en cualquier punto y está separada de otra fase por una superficie llamada interfase. Los tres estados de la materia (sólido, líquido y gaseoso) son fases separadas y distintas. Un sólido puede ser monofásico y estar formado, sin embargo, por un agregado de cristales de diferentes orientaciones. Los cristales individuales se llaman granos y las separaciones entre ellos, límites de grano. La mayoría de los metales sólidos presentan dos o más fases que complican la estructura pero, que a su vez, le dan muchas propiedades útiles e interesantes. El hierro, el acero y el fierro fundido son ejemplos típicos de sólidos polifásicos o alotrópicos. Soluciones sólidas: Cuando se combinan metales puros para formar aleaciones, pueden resultar estructuras cristalinas con ciertas composiciones y estables a ciertas temperaturas, que forman fases diferentes. Finalmente, debe indicarse que una solución sólida (un cristal que contiene dos o más tipos de átomos en la misma red) satisface la definición de fase. Las soluciones sólidas pueden ser: sustitucionales o intersticiales. Las soluciones sólidas sustitucionales se forman cuando los átomos del solvente y del soluto tienen tamaños y estructura electrónica similares. Como ejemplo tenemos al latón que es una aleación de Cu y Zn. Así cuando el Zn es añadido al Cu los átomos de Zn remplazan a los de Cu dentro de la red de caras centradas hasta llegar a un máximo cercano al 40% de los átomos de Cu. Soluciones sólidas intersticiales se forman cuando átomos pequeños pueden ser ubicados en los intersticios que quedan entre los átomos grandes. Un ejemplo es el Carbono en el Fe. En el hierro cúbico de caras centradas, estructura estable a temperaturas superiores a 910ºC, existen huecos relativamente grandes en el centro de la celdilla unitaria. El carbono por ser un átomo pequeño puede moverse hasta ese hueco para producir una solución sólida de carbono en hierro. Cuando el hierro tiene una estructura cúbica de cuerpo centrado, a bajas temperaturas, los intersticios entre los átomos de Fe llegan a ser muy pequeños y, la solubilidad del carbono en el hierro de cuerpo centrado es relativamente pequeña. Compuestos intermetálicos: Cuando se sobrepasa la solubilidad de un elemento disuelto (intersticiales), se produce una fase intermedia. Estos compuestos tales como el Fe 3 C tienen dureza y punto de fusión elevados y su utilidad se manifiesta en los aceros cementados. Capítulo 20: Diagramas de Equilibrio 249
2 20.2. TRANSFORMACIONES EN ESTADO SÓLIDO DIAGRAMAS DE EQUILIBRIO DE FASES Los diagramas de equilibrio son gráficos que muestran las fases que están presentes en un material en equilibrio con su medio ambiente o alrededores. Un diagrama de equilibrio interpretado en forma correcta nos indica: el número de fases que están presentes, sus composiciones y la cantidad relativa de cada una, como funciones de la temperatura, presión y composición promedio del material. Aunque muchos materiales de uso en ingeniería existen en estado metaestable o fuera de equilibrio, cualquier cambio espontáneo los llevará hacia el equilibrio y muchas informaciones útiles acerca de los cambios de fases en dichos materiales pueden ser deducidas desde diagramas de equilibrio adecuados. Los diagramas de equilibrio están clasificados como: unitarios, binarios y de orden superior (ternarios, cuaternarios, etc.), dependiendo del número de componentes puros envueltos. De éstos los diagramas binarios son los más usados. En términos de microestructura, las fases en un material han sido definidas como regiones que difieren una de otra tanto en composición o en estructura o en ambas (composición y estructura). Por ejemplo, el estado de agregación (sólido, líquido, gaseoso) no es suficiente en algunos casos para dar una descripción estructural del material. Un elemento sólido, compuesto o aleación, puede existir en una o varias fases con diferente estructura cristalina. También un material de dos componentes en su estado fundido puede consistir de dos fases líquidas con composiciones diferentes REGLA DE LAS FASES O DE GIBBS Consideraciones termodinámicas condujeron a Gibbs a establecer una relación entre el número de fases (P) que pueden coexistir en equilibrio en un sistema dado, el número mínimo de componentes (C) que pueden ser usados para formar el sistema, y el grado de libertad (F) del sistema. Esta relación puede ser escrita en forma de ecuación como: P + F = C + 2 y se conoce como Regla de las Fases de Gibbs. En esta ecuación el grado de libertad es definido como "el número de cambios de variables (temperatura, presión, composición) realizados independientemente sin que haya cambio en el número de fases en equilibrio" DIAGRAMAS UNITARIOS Las variables que determinan que fases existen en un material en equilibrio son: Temperatura, Presión y Composición Promedio. En el caso de un sistema unitario o de un Capítulo 20: Diagramas de Equilibrio 250
3 componente, sólo la temperatura y la presión podrán ser variadas. Las coordenadas de un diagrama de equilibrio unitario serán por lo tanto, temperatura y presión (Figura 1). Por convención la temperatura se acostumbra escoger como abscisa pero como en los diagramas binarios, la temperatura es escogida como ordenada, aquí la consideramos como tal. Temperatura ºC Vapor-líquido Líquido Líquido-sólido Vapor-sólido Punto triple (sólido-líquido-vapor) Sólido Presión Figura 1: Diagrama unitario La forma general de un diagrama unitario puede ser deducida a partir de la regla de las fases: consideremos los puntos que representan el equilibrio entre dos fases. Como el número de componentes es 1 y el número de fases es dos existirá un grado de libertad. F = C + 2 P F = = 1 F = 1 Esto significa que nosotros podemos realizar pequeños cambios arbitrarios en temperatura o presión, pero no en ambos a la vez, sin que cambie el número de fases en equilibrio, en este caso 2. Si escogemos la temperatura, habría una sola presión a la cual dos fases estarán en equilibrio. Así dos fases en equilibrio están representadas por líneas o curvas sobre un diagrama unitario. Supongamos ahora que deseamos encontrar las condiciones bajo las cuales el sólido, líquido y vapor coexisten en equilibrio. El número de componentes es todavía 1; el número de fases es tres, por lo tanto no existe grado de libertad: F = C + 2 P = = 0 No podemos designar los valores arbitrariamente de las variables y las tres fases sólo pueden existir en equilibrio a una temperatura y presión específica. Estos valores de Capítulo 20: Diagramas de Equilibrio 251
4 temperatura y presión definen un punto sobre el diagrama y este punto recibe el nombre de punto triple DIAGRAMA PRESIÓN-TEMPERATURA PARA EL FE El hierro puro presenta 3 estructuras cristalinas (fases) diferentes en el estado sólido. El diagrama contiene 5 regiones de una fase: α, γ, δ. L y V; 7 curvas de coexistencia de 2 fases: α - V, α - γ, γ - V, γ - δ, δ - V, δ - L, L - V y 3 puntos triples: α - γ - V, γ - δ - V y δ - L V y un punto crítico. La figura 2 presenta el diagrama presión-temperatura para el Fe. Figura 2: Diagrama P-T para el Fe ANÁLISIS TÉRMICO Los datos necesarios para la construcción de los diagramas de equilibrio, se determinan experimentalmente por medio de distintos procedimientos y el más simple es el análisis térmico. En este método si representamos gráficamente las temperaturas en función del tiempo, a composición constante, obtenemos curvas de enfriamiento, cuya pendiente cambia al presentarse un cambio de fase, debido al calor liberado por esa transformación. Esta curva se obtiene por el estudio del enfriamiento de una cantidad de Fe en estado líquido, utilizando termocuplas para medir la variación de la temperatura en función del tiempo (Figura 3). Capítulo 20: Diagramas de Equilibrio 252
5 Figura 3: Curva de enfriamiento del Fe DIAGRAMAS BINARIOS Un par de elementos puros o compuestos puros pueden ser mezclados en un número infinito de proporciones diferentes. Para cada una de estas composiciones, el estado de equilibrio (número de fases coexistentes, P, sus composiciones, cantidad relativa de c/u) es una función de la temperatura y de la presión. Muchas de las operaciones usadas en los procesos de materiales son hechas a presión atmosférica o muy cercana a ella. Por lo tanto, la presión no es una variable muy significativa y en los diagramas que consideramos, la presión está especificada a una atmósfera. Como un grado de libertad, F, fue especificado, la regla de fases tendrá la forma: P + F = C+ 1 (+1 si se considera la presión) F = C + 1 P Como en los diagramas binarios el número de componentes "C" es dos, la fórmula se simplifica y para este caso queda en la forma: F = 3 P En los diagramas binarios la temperatura es graficada como ordenada y la composición como abscisa. Una fase en equilibrio tendrá dos grados de libertad -la temperatura y la composición de la fase- y en el diagrama estará representada por un área o campo de fase. Dos fases en equilibrio tienen un grado de libertad, si la temperatura es especificada, Capítulo 20: Diagramas de Equilibrio 253
6 entonces las composiciones de ambas fases en equilibrio quedan completamente determinadas. Son representadas por dos líneas llamadas las curvas temperatura concentración de las fases en equilibrio. Tres fases en equilibrio están representadas por un punto y decimos que se trata de un sistema invariante o que tiene 0 grado de libertad. Un diagrama esquemático de solución sólida entre dos componentes A y B, los cuales son completamente solubles el uno en el otro es representado por la figura 4. a) Se determinan experimentalmente las curvas de enfriamiento de las dos aleaciones que se indican con composición c 0 y c 1, y la de los elementos puros A y B. b) Las temperaturas de fusión y las temperaturas "líquidus y sólidus" son graficadas como funciones de la composición para formar el diagrama de fases. El diagrama está compuesto de una región de fase sólida simple, una región de fase líquida simple y una región de dos fases sólidas más líquida. Las curvas temperatura composición para cada fase en la región de dos fases en equilibrio, son las dos curvas que separan las fases simples de la región de dos fases. El "líquidus" es la curva Temperatura v/s Composición para la fase líquida que está en equilibrio con el sólido; "el sólidus" es la curva Temperatura v/s Composición para la fase sólida que está en equilibrio con el líquido. Como el "sólidus" y el "líquidus" son curvas Temperatura v/s. Composición, la intersección de una línea horizontal dibujada entre las dos curvas representará la composición de las dos fases a la temperatura indicada por la línea horizontal. Consideremos una aleación de composición C 0, como la mostrada en la figura 4. Si la aleación está en equilibrio a la temperatura correspondiente al punto "a" entonces es una fase líquida de composición C 0, si ella es luego enfriada lentamente hasta el punto "b" el sólido inicial a formar tendrá la composición C si. Con enfriamientos mayores (suficientemente lentos para mantener el equilibrio) la composición promedio del sólido sigue la línea sólidus y la composición promedio del líquido sigue la línea del líquidus, hasta que la temperatura correspondiente al punto "c" es alcanzada, a la cual el material consiste de un sólido de composición C s en equilibrio con un líquido de composición "C L ". Con mayor enfriamiento se llega al punto "d" y el líquido remanente final tiene la composición C f y la composición del sólido coincide con la composición de la aleación inicial. A cualquier temperatura por debajo de "d" el material está completamente sólido y su composición es C 0. Capítulo 20: Diagramas de Equilibrio 254
7 Figura 4. Diagrama de fases de A B, elementos con solubilidad total CANTIDADES RELATIVAS DE FASES Los diagramas de equilibrio fuera de especificar el número de fases presentes a una temperatura dada y sus composiciones permiten calcular la cantidad relativa de cada fase presente a dicha temperatura. Consideremos la aleación de composición " C 0 "; en el punto c, en este, hay dos fases en equilibrio de composiciones C L y C S. El número de átomos B en la composición inicial es claramente la suma de los átomos B en la fase sólida y en la fase líquida. Aplicando un balance de masas nos lleva a las siguientes ecuaciones para ƒ S = fracción del material en fase sólida y ƒ L = fracción del material en fase líquida: ƒ S C = C 0 S C L C L ƒ L C = C S S C 0 C L Estas relaciones, las cuales son aplicables en cualquier región de dos fases en los diagramas binarios, son conocidas como la regla de la palanca. Su nombre proviene de que la línea horizontal que une dos puntos de las curvas temperatura - composición en una región de dos fases, puede ser considerada como una palanca con su punto de apoyo en C 0. La fracción de una fase que tiene una composición indicada por un extremo de la palanca es igual a la razón de la longitud del brazo de palanca al otro lado del punto de apoyo partido por la longitud total de la palanca. Capítulo 20: Diagramas de Equilibrio 255
8 DIAGRAMA EUTÉCTICO BINARIO La figura 5 muestra un sistema eutéctico que tiene soluciones sólidas terminales α y β. La reacción eutéctica L α + β ocurre a la temperatura eutéctica T eut. Figura 5: (a) Sistema eutéctico con soluciones sólidas terminales y (b) curvas de enfriamiento de varias aleaciones binarias. Uno de los tipos de diagramas de equilibrio que resultan, cuando hay una solubilidad limitada en el estado sólido, es el diagrama eutéctico Estaño Bismuto de la figura 6. Figura 6: Diagrama binario Sn-Bi Capítulo 20: Diagramas de Equilibrio 256
9 Consideremos la aleación C 0, la cual existe como una sola fase líquida en el punto a y cuando es enfriada hasta el punto b la composición del primer sólido a formar está dada por C α1. Con mayor enfriamiento en el punto c están en equilibrio dos fases, una fase sólida de composición C α y una líquida de composición C L. La cantidad relativa de ambas fases en equilibrio en el punto c son: CL C0 ƒα= CL Cα y C0 Cα ƒl = CL Cα Si la aleación es enfriada por debajo del punto c se formará mayor cantidad de sólido y la composición del líquido sigue la línea líquidus hasta alcanzar el punto e llamado punto eutéctico. Con mayor extracción de calor, el líquido de composición C solidifica isotérmicamente a la temperatura eutéctica T. Esta transformación de fase es llamada reacción eutéctica (en la cual una fase líquida se transforma es dos fases sólidas). Es un invariante del sistema ya que tres fases están en equilibrio durante la solidificación del líquido eutéctico; no existe grado de libertad. La temperatura, la composición de la fase líquida y la composición de ambas fases sólidas están fijadas. Una vez que el líquido eutéctico ha solidificado completamente, la temperatura comienza nuevamente a decrecer. Se puede ver en el diagrama que a medida que la temperatura desciende de T, la solubilidad de B en A y de A en B decrece con la temperatura, el exceso de B precipita en el enfriamiento y la composición de la fase sigue la línea solvus o línea de máxima solubilidad. Los átomos de B en exceso que ya no son solubles en α a baja temperatura no son rechazados como B puro sino como una solución sólida β, ya que A es soluble en una cierta extensión en B. La microestructura en el estado sólido de un material que tenga la composición C e será una mezcla íntima de dos fases. Las fases α y β en un material eutéctico pueden estar en la forma de delgadas placas (del orden de los micrones), o bastoncitos o partículas pequeñísimas. Una aleación cuya composición esté entre C α e y C e se llama hipoetéctica y, en general, tendrá una microestructura compuesta por α primaria (α formada por encima de la Te) embebida en una matriz eutéctica. Una aleación cuya composición esté entre C e y C β e es llamada hipereutéctica y, en general, tendrá una microestructura que contiene β primaria en una matriz eutéctica. Ejemplos de fases de metales que siguen el diagrama binario eutéctico: Pb-Sn; Fe-C; Pb- Sb EL DIAGRAMA FE-C El sistema Fe-C es el sistema binario hierro-grafito pero aún cuando las velocidades de enfriamiento fueran muy lentas, todavía son demasiado rápidas para que se forme grafito y, en lugar de él, se forma un carburo de hierro metaestable. Este compuesto intermetálico tiene por fórmula Fe 3 C y se llama cementita. Contiene 6,67% de carbono en peso. Capítulo 20: Diagramas de Equilibrio 257
10 En la figura 7 se muestra el diagrama metaestable o Fe-Fe 3 C con línea llena y el diagrama estable Fe-grafito con línea punteada. Nuestra atención se centrará en el diagrama Fe-Fe 3 C. Figura 7: Diagrama Fe-C Capítulo 20: Diagramas de Equilibrio 258
11 ESTUDIO DEL DIAGRAMA FE-FE 3 C El diagrama consta de 3 horizontales en las cuales deben verificarse 3 reacciones polimórficas. 1º a 1492ºC δ (0,08% C) + Líquido (0,55% C) γ (0,18% C) 2º a 1130ºC Líquido (4,3% C) (2,11% C) + Fe 3 C (6,7% C) 3º a 723ºC γ (0,8% C) (0,025% C) + Fe 3 C (6,7% C) El proceso de solidificación al atravesar las líneas peritéctica, eutéctica y eutectoide, se realiza en igual forma que para cualquier otro sistema, como ya lo hemos visto anteriormente en el capítulo de las aleaciones binarias. Como ejemplo citaremos un acero de 1,5% de carbono. Después que este acero ha sobrepasado en el enfriamiento, la línea sólidus JE, se llega al dominio de estabilidad de la fase γ llamada austenita, que es una solución intersticial de carbono en fierro γ (fcc). Prosiguiendo el enfriamiento a 1050ºC más o menos, interceptaremos la línea solvus SE. Si seguimos descendiendo la temperatura, la composición de la austenita deberá variar según esta línea SE. Comenzará la precipitación de cementita primaria. Este proceso durará hasta que hayamos llegado a la temperatura de 723ºC. La cementita primaria depositada según la línea SE, también llamada A cm precipitará preferentemente en los límites de granos, pero cuando la cantidad es demasiado grande, la precipitación también se efectúa al interior de los granos, formando las estructuras Widmamntätten. Cuando la temperatura ha llegado a 723ºC y la austenita a un 0,8$ de carbono, se produce la reacción 3º anteriormente indicada, toda la austenita se descompondrá isotérmicamente en fase α y cementita secundaria o eutectoide. Prosiguiendo el enfriamiento más debajo de 723ºC, se produce una nueva reacción en fase sólida, debido a la curvatura que posee la línea solvus de la fase α. Este último debe disminuir su composición en carbono al bajar la temperatura, lo cual se realiza precipitando cementita terciaria. Debido a que ya estamos en una región de temperatura bastante baja, los fenómenos de difusión que permiten hacer crecer los cristales de cementita en ciertos puntos de los granos del acero son muy lentos. Este fenómeno es difícil de percibirse y, por lo general, esta precipitación es muy fina y se realiza al interior de los granos, produciendo distorsiones de la red cristalina. Este fenómeno de la precipitación de cementita terciaria puede seguir verificándose a temperatura ambiente con velocidades sumamente bajas. El resultado de esta precipitación es un aumento de durezas y de las propiedades magnéticas del acero, como también un aumento de la fragilidad. Este fenómeno recibe el nombre de envejecimiento y es más notorio en otras aleaciones que en el fierro. Las líneas más importantes del diagrama fierro-cementita de la Figura 7 son las siguientes: Capítulo 20: Diagramas de Equilibrio 259
12 Las 3 horizontales anteriormente expuestas, la peritéctica, eutéctica y la eutectoide. Las líneas inclinadas GOS o también denominadas A 3, la línea SE denominada A cm. La horizontal eutectoide recibe también la denominación A 1. Las líneas A 1 y A 3 así definidas muestran una desviación con la velocidad de enfriamiento o de calentamiento CLASIFICACIÓN DE LAS ALEACIONES FÉRRICAS Aceros hipoeutectoides: Un acero hipoeutectoide es una aleación que contiene menos de 0,8% de carbono. La microestructura contiene ferrita y cementita de acuerdo con el diagrama de fases, pero la ferrita está presente tanto como ferrita proeutectoide o primaria y como parte del microconstituyente eutectoide (perlita). Consideremos una aleación hipoeutectoide típica, por ejemplo una cero 1040 (0,40% de C). A temperaturas mayores a 800ºC este acero es austenítico y la microestructura consiste solamente de granos de austenita. Cuando se enfría lentamente y se alcanzan los 800ºC se forma ferrita primaria, principalmente en los bordes de los granos austeníticos. A temperaturas ligeramente por debajo de la temperatura eutectoide, la austenita de composición eutectoide se transforma isotérmicamente a perlita y la estructura final contendrá un 52% de ferrita primaria y 48% de perlita. La figura 8 ilustra el proceso de enfriamiento descrito y la microestructura que se obtiene a temperatura ambiente se observa en la figura 9. Figura 8: (a) Microestructura austenítica, (b) ferrita proeutectoide en una matriz austenítica y (c) la austenita restante se transforma en perlita. Capítulo 20: Diagramas de Equilibrio 260
13 Figura 9: Microestructura de un acero hipoeutectoide Aceros hipereutectoides: Son aquellos que contienen composiciones mayores de 0,8% de C. El proceso de enfriamiento es análogo al escrito anteriormente sólo que se forma una red de cementita en los bordes del grano austenítico en lugar de la ferrita. El desarrollo del enfriamiento se muestra en la figura 10 y la microestructura típica en un acero con 1,4% de C enfriado lentamente en la figura 11. Figura 10: (a) Microestructura austenítica, (b) red de cementita en bordes de granos austeníticos y (c) microestructura formada por perlita y red de cementita. Capítulo 20: Diagramas de Equilibrio 261
14 Figura 11: Microestructura de un acero hipereutectoide. Aceros eutectoides: Contiene 0,8% C. A temperaturas mayores a 723ºC una muestra de este acero es austenítica (fcc). A la temperatura de 723ºC toda la aleación se transforma, isotérmicamente, en el microconstituyente eutectoide llamado perlita, de acuerdo a la reacción: γ α + Fe 3 C = Perlita El eutectoide está formado por láminas alternadas de ferrita (bcc) y Fe 3 C llamado cementita y se puede apreciar en la figura 12. Figura 12: Microestructura de un acero eutectoide Se pueden calcular las fracciones de ferrita y cementita en el eutectoide aplicando la regla de la palanca a la temperatura eutectoide: Capítulo 20: Diagramas de Equilibrio 262
15 ( 6,67 0,80) ( 0,80 0,025) ferrita = = 0,88 = 88% cementita = = 0,12 = 12% 6,67 0,025 6,67 0,025 El eutectoide contiene, entonces, aproximadamente siete veces más ferrita que cementita y, además, las láminas de ferrita son más gruesas que las de cementita. Capítulo 20: Diagramas de Equilibrio 263
5b. DIAGRAMA HIERRO-CARBONO
 5b. DIAGRAMA HIERRO-CARBONO MATERIALES 13/14 ÍNDICE ACERO DIAGRAMA Fe-C FASES EN EL DIAGRAMA PROPIEDADES MECANICAS DE LAS FASES 2 1. ACERO Constituyentes de las aleaciones Fe-C (fases) Ferrita : Solución
5b. DIAGRAMA HIERRO-CARBONO MATERIALES 13/14 ÍNDICE ACERO DIAGRAMA Fe-C FASES EN EL DIAGRAMA PROPIEDADES MECANICAS DE LAS FASES 2 1. ACERO Constituyentes de las aleaciones Fe-C (fases) Ferrita : Solución
MATERIALES METALICOS 2do Ingeniería Mecánica. Diagramas de Equilibrio de Fases
 MATERIALES METALICOS 2do Ingeniería Mecánica Diagramas de Equilibrio de Fases Ing. Víctor Gómez Universidad Tecnológica Nacional Facultad Regional Tucumán Aleaciones Ø Aleación: Sustancia que tiene propiedades
MATERIALES METALICOS 2do Ingeniería Mecánica Diagramas de Equilibrio de Fases Ing. Víctor Gómez Universidad Tecnológica Nacional Facultad Regional Tucumán Aleaciones Ø Aleación: Sustancia que tiene propiedades
Hoja de problemas Tema 7
 Hoja 7 FUNDAMENTOS DE CIENCIA DE MATERIALES 1 Hoja de problemas Tema 7 1. Sea el diagrama de fases esquemático de la figura para el sistema A-B. (a) Indique la posición de las líneas de liquidus, solidus
Hoja 7 FUNDAMENTOS DE CIENCIA DE MATERIALES 1 Hoja de problemas Tema 7 1. Sea el diagrama de fases esquemático de la figura para el sistema A-B. (a) Indique la posición de las líneas de liquidus, solidus
PROBLEMAS TEMA 2 TECNOLOGÍA INDUSTRIAL II
 1. Dibujar un diagrama de equilibrio entre dos componentes cualesquiera A y B, solubles completamente en estado sólido que solidifican en su estado puro a 1000 y 1300 ºC, respectivamente. Situar en la
1. Dibujar un diagrama de equilibrio entre dos componentes cualesquiera A y B, solubles completamente en estado sólido que solidifican en su estado puro a 1000 y 1300 ºC, respectivamente. Situar en la
5.- Describir la solubilidad del Carbono en el Hierro en función de la temperatura y de sus distintos estados alotrópicos.
 DIAGRAMA HIERRO-CARBONO: 1.- Haciendo uso del diagrama Fe-C, verificar el enfriamiento lento ( en condiciones próximas al equilibrio) de las siguientes aleaciones: a) Acero de 0.17% de C b) Acero de 0.30%
DIAGRAMA HIERRO-CARBONO: 1.- Haciendo uso del diagrama Fe-C, verificar el enfriamiento lento ( en condiciones próximas al equilibrio) de las siguientes aleaciones: a) Acero de 0.17% de C b) Acero de 0.30%
Importancia del hierro en la metalurgia
 DIAGRAMA Fe - C Importancia del hierro en la metalurgia Afinidad química Capacidad de solubilidad de otros elementos Propiedad alotrópica en estado sólido Capacidad para variar sustancialmente la estructura
DIAGRAMA Fe - C Importancia del hierro en la metalurgia Afinidad química Capacidad de solubilidad de otros elementos Propiedad alotrópica en estado sólido Capacidad para variar sustancialmente la estructura
TEMA IV.- ALEACIONES DE HIERRO Y CARBONO
 TEMA IV.- ALEACIONES DE HIERRO Y CARBONO El hierro puro apenas tiene aplicaciones industriales, pero formando aleaciones con el carbono (además de otros elementos), es el metal más utilizado en la industria
TEMA IV.- ALEACIONES DE HIERRO Y CARBONO El hierro puro apenas tiene aplicaciones industriales, pero formando aleaciones con el carbono (además de otros elementos), es el metal más utilizado en la industria
TRANSFORMACIONES EN ESTADO SOLIDO
 TRANSFORMACIONES EN ESTADO SOLIDO Después de solidificada una aleación puede sufrir transformaciones posteriores. Se presenta en metales que tienen al menos un componente que sufre transformaciones alotrópicas
TRANSFORMACIONES EN ESTADO SOLIDO Después de solidificada una aleación puede sufrir transformaciones posteriores. Se presenta en metales que tienen al menos un componente que sufre transformaciones alotrópicas
Departamento de Tecnologías 1 IES Valle del Sol. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013
 1 IES Valle del Sol No hay ejercicios de este tema No hay ejercicios de este tema. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013 1. Dos metales A y B solidifican a 1000 ºC y 500 ºC respectivamente
1 IES Valle del Sol No hay ejercicios de este tema No hay ejercicios de este tema. Selectividad 2015 SELECTIVIDAD 2014 SELECTIVIDAD 2013 1. Dos metales A y B solidifican a 1000 ºC y 500 ºC respectivamente
CONSTRUCCIÓN DEL DIAGRAMA Fe- C. FASES DEL FE PURO
 CONSTRUCCIÓN DEL DIAGRAMA Fe- C. FASES DEL FE PURO T Fe Líquido. Amorfo A 1536 C es la T de fusión del Fe. A 1536 C se forma Fe delta-fe - sólido si estoy disminuyendo T. Presenta estructura BCC Fe delta
CONSTRUCCIÓN DEL DIAGRAMA Fe- C. FASES DEL FE PURO T Fe Líquido. Amorfo A 1536 C es la T de fusión del Fe. A 1536 C se forma Fe delta-fe - sólido si estoy disminuyendo T. Presenta estructura BCC Fe delta
los Aceros El porqué? Tratamientos térmicos Microestructura) Propiedades d Mecánicas FCEIA-UNR C Materiales FCEIA-UNR C-3.20.
 11. Tratamientos t Térmicos de los Aceros El porqué? Tratamientos térmicos (Temperatura y tiempo) Microestructura) Propiedades d Mecánicas 1 El factor TIEMPO La mayoría de las transformaciones en estado
11. Tratamientos t Térmicos de los Aceros El porqué? Tratamientos térmicos (Temperatura y tiempo) Microestructura) Propiedades d Mecánicas 1 El factor TIEMPO La mayoría de las transformaciones en estado
GUÍA DE DISCUSIÓN DE CONCEPTOS Y PROBLEMAS. " DIAGRAMA Fe - Fe 3 C "
 UNIVERSIDAD DON BOSCO FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA MECÁNICA Asignatura: CIENCIA DE LOS MATERIALES CUESTIONARIO GUÍA DE DISCUSIÓN DE CONCEPTOS Y PROBLEMAS " DIAGRAMA Fe - Fe 3 C " 1.- Describir
UNIVERSIDAD DON BOSCO FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA MECÁNICA Asignatura: CIENCIA DE LOS MATERIALES CUESTIONARIO GUÍA DE DISCUSIÓN DE CONCEPTOS Y PROBLEMAS " DIAGRAMA Fe - Fe 3 C " 1.- Describir
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN. 2.- Formas de encontrar el carbono en las aleaciones férreas
 TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de, el hierro puede presentar diferentes estados, con mayor o menor capacidad para disolver
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de, el hierro puede presentar diferentes estados, con mayor o menor capacidad para disolver
TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C
 TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C Los Diagramas de Fase representan estados y transformaciones en condiciones de equilibrio, pero no aportan información sobre
TEMA 9. TRANSFORMACIONES DE FASE Y TRATAMIENTOS TÉRMICOS EN ALEACIONES Fe-C Los Diagramas de Fase representan estados y transformaciones en condiciones de equilibrio, pero no aportan información sobre
UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN. Elaborado por: Ing. Roger Chirinos.
 UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN Elaborado por: Ing. Roger Chirinos. MSc Cabimas, Noviembre de 2013 SOLIDIFICACIÓN Fundamentos básicos
UNE RAFAEL MARÍA BARALT PROGRAMA DE INGENIERÍA Y TECNOLOGÍA INGENIERÍA EN MTTO MECÁNICO SOLIDIFICACIÓN Elaborado por: Ing. Roger Chirinos. MSc Cabimas, Noviembre de 2013 SOLIDIFICACIÓN Fundamentos básicos
TEMA 2: DIAGRAMAS DE FASES
 TEMA 2: DIAGRAMAS DE FASES 1.- LAS ALEACIONES 2.- FUSIÓN Y SOLIDIFICACIÓN 3.- DIAGRAMAS DE EQUILIBRIO O DE FASES 4.- TIPOS DE DIAGRAMAS 5.- REPASO - 1 - 1.- ALEACIONES Una aleación es una sustancia compuesta
TEMA 2: DIAGRAMAS DE FASES 1.- LAS ALEACIONES 2.- FUSIÓN Y SOLIDIFICACIÓN 3.- DIAGRAMAS DE EQUILIBRIO O DE FASES 4.- TIPOS DE DIAGRAMAS 5.- REPASO - 1 - 1.- ALEACIONES Una aleación es una sustancia compuesta
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN. 2.- Formas de encontrar el carbono en las aleaciones férreas
 TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de temperatura, el hierro puede presentar diferentes estados, con mayor o menor capacidad
TEMA 3: ALEACIONES Fe-C, PROPIEDADES Y CLASIFICACIÓN 1.- Estados alotrópicos del Hierro (Fe) Según las condiciones de temperatura, el hierro puede presentar diferentes estados, con mayor o menor capacidad
TEMA 3: DIAGRAMAS DE EQUILIBRIO
 TEMA 3: DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones Características Los metales puros tienen poca aplicación en la industria. La mayoría de ellos se combinan con otros metales o no metales para mejorar sus
TEMA 3: DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones Características Los metales puros tienen poca aplicación en la industria. La mayoría de ellos se combinan con otros metales o no metales para mejorar sus
b) Aplicar la regla de las fases a cada una de las regiones, líneas y puntos significativos y determina el número de grados de libertad existentes.
 1.- El platino y el oro son totalmente solubles en estado sólido y en estado líquido. El punto de fusión del platino son 1774 C y el del oro 1063 C. Una aleación formada por un 40% de oro comienza a solidificar
1.- El platino y el oro son totalmente solubles en estado sólido y en estado líquido. El punto de fusión del platino son 1774 C y el del oro 1063 C. Una aleación formada por un 40% de oro comienza a solidificar
TEMAS Noviembre Belén Molina Sánchez UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I
 TEMAS 16-21 Noviembre 2005 Belén Molina Sánchez 1 Sistema: porción del universo que ha sido aislada de tal modo que sus propiedades pueden ser estudiadas. Microconstituyente: aquello que es observable
TEMAS 16-21 Noviembre 2005 Belén Molina Sánchez 1 Sistema: porción del universo que ha sido aislada de tal modo que sus propiedades pueden ser estudiadas. Microconstituyente: aquello que es observable
Equilibrio sólido- líquido en sistemas de dos componentes
 Equilibrio sólido- líquido en sistemas de dos componentes Miscibilidad en fase líquida e inmiscibilidad en fase sólida: sean C y B dos sustancias miscibles en todas las proporciones en la fase líquida
Equilibrio sólido- líquido en sistemas de dos componentes Miscibilidad en fase líquida e inmiscibilidad en fase sólida: sean C y B dos sustancias miscibles en todas las proporciones en la fase líquida
3.- Con el diagrama de equilibrio Cu-Ni, haga el análisis de fases para una aleación del 50% de Cu a: 1400ºC, 1300ºC, 1200ºC 1100ºC.
 1.- Con el diagrama de equilibrio Cu-Ni que se adjunta, describir el enfriamiento lento de una aleación del 3% de Ni y determinar su composición a 12ºC. 2.- Una aleación compuesta de 2 Kg de Cu y 2 Kg
1.- Con el diagrama de equilibrio Cu-Ni que se adjunta, describir el enfriamiento lento de una aleación del 3% de Ni y determinar su composición a 12ºC. 2.- Una aleación compuesta de 2 Kg de Cu y 2 Kg
Tema 3: Diagramas de fases. Problemas resueltos
 Tema 3: Diagramas de fases Problemas resueltos Problema 1. Dos metales y tienen puntos de fusión a 1400 y 1300 respectivamente. El metal presenta dos cambios alotrópicos a los 900,, y a los 700,, de forma
Tema 3: Diagramas de fases Problemas resueltos Problema 1. Dos metales y tienen puntos de fusión a 1400 y 1300 respectivamente. El metal presenta dos cambios alotrópicos a los 900,, y a los 700,, de forma
Tema 5. Aleaciones metálicas. El sistema Fe-C.
 Tema 5. Aleaciones metálicas. El sistema Fe-C. Problemas sobre aleaciones Fe-C, y cinética de las transformaciones (W.D. Callister Ed. Reverté - Cap 9 y 10). 9.47. Cuál es el porcentaje de carbono de un
Tema 5. Aleaciones metálicas. El sistema Fe-C. Problemas sobre aleaciones Fe-C, y cinética de las transformaciones (W.D. Callister Ed. Reverté - Cap 9 y 10). 9.47. Cuál es el porcentaje de carbono de un
TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO.
 TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO. Objetivos Este tema tiene por objeto conocer el interés e importancia de las aleaciones y las posibilidades de transformaciones y cambios
TEMA 2. FASES Y TRANSFORMACIONES DE FASES. DIAGRAMAS DE EQUILIBRIO. Objetivos Este tema tiene por objeto conocer el interés e importancia de las aleaciones y las posibilidades de transformaciones y cambios
Tema 5.- Diagramas de Equilibrio de Fases
 BLOQUE II.- ESTRUCTURA Tema 5.- Diagramas de Equilibrio de Fases * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción
BLOQUE II.- ESTRUCTURA Tema 5.- Diagramas de Equilibrio de Fases * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción
BLOQUE IV.- Materiales metálicos
 BLOQUE IV.- Materiales metálicos. Aceros * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de
BLOQUE IV.- Materiales metálicos. Aceros * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de
Los constituyentes metálicos que se pueden presentar en los aceros al carbono son:
 DE LOS ACEROS Los constituyentes metálicos que se pueden presentar en los aceros al carbono son: Ferrita Cementita Perlita Sorbita Troostita Martensita Bainita Austenita El análisis de las microestructuras
DE LOS ACEROS Los constituyentes metálicos que se pueden presentar en los aceros al carbono son: Ferrita Cementita Perlita Sorbita Troostita Martensita Bainita Austenita El análisis de las microestructuras
Diagrama de fases Sn-Pb
 Práctica 4 Diagrama de fases Sn-Pb Objetivo Determinación del diagrama de fases Temperatura vs. Composición, a presión atmosférica, de la aleación Estaño - Plomo. Fundamento teórico Casi todos los metales
Práctica 4 Diagrama de fases Sn-Pb Objetivo Determinación del diagrama de fases Temperatura vs. Composición, a presión atmosférica, de la aleación Estaño - Plomo. Fundamento teórico Casi todos los metales
DIAGRAMA HIERRO-CARBONO
 DIAGRAMA HIERRO-CARBONO 1. Con el diagrama hierro-carbono simplificado de la figura, determina: a) Temperatura de solidificación del hierro puro b) Temperatura de solidificación de la ledeburita (el eutéctico)
DIAGRAMA HIERRO-CARBONO 1. Con el diagrama hierro-carbono simplificado de la figura, determina: a) Temperatura de solidificación del hierro puro b) Temperatura de solidificación de la ledeburita (el eutéctico)
PREGUNTAS PRUEBAS PAU MATERIALES
 PREGUNTAS PRUEBAS PAU MATERIALES JUNIO 2010 FE Opción A Defina brevemente las siguientes propiedades que presentan los compuestos metálicos: a) Elasticidad (0,5 puntos) b) Tenacidad (0,5 puntos) c) Maleabilidad
PREGUNTAS PRUEBAS PAU MATERIALES JUNIO 2010 FE Opción A Defina brevemente las siguientes propiedades que presentan los compuestos metálicos: a) Elasticidad (0,5 puntos) b) Tenacidad (0,5 puntos) c) Maleabilidad
CIDEAD. 2º BACHILLERATO.TECNOLOGÍA INDUSTRIAL II. Tema 5.- Los tratamientos térmicos de los aceros.
 Desarrollo del tema: 1. Estados alotrópicos del hierro. 2. Aleaciones hierro carbono. Su composición 3. Constitución de las aleaciones hierro carbono. 4. Estructura de las aleaciones Fe C 5. Diagrama de
Desarrollo del tema: 1. Estados alotrópicos del hierro. 2. Aleaciones hierro carbono. Su composición 3. Constitución de las aleaciones hierro carbono. 4. Estructura de las aleaciones Fe C 5. Diagrama de
PROBLEMAS TEMA 2. FASES y TRANSFORMACIONES DE FASE. DIAGRAMAS DE EQUILIBRIO
 PROBLEMAS TEMA 2. FASES y TRANSFORMACIONES DE FASE. DIAGRAMAS DE EQUILIBRIO 1. Se adjunta el peso atómico y el radio atómico de tres hipotéticos metales. Determinar para cada una de ellas si su estructura
PROBLEMAS TEMA 2. FASES y TRANSFORMACIONES DE FASE. DIAGRAMAS DE EQUILIBRIO 1. Se adjunta el peso atómico y el radio atómico de tres hipotéticos metales. Determinar para cada una de ellas si su estructura
Diagramas de fase en aleaciones metálicas
 Diagramas de fase en aleaciones metálicas Sólidos Inorgánicos Diagramas de fase de sustancias puras 8000 Hielo VI 6000 Presión/atm Hielo V 0 2000 2 Hielo II Hielo III íquido Temperatura/ C 2000 1500 500
Diagramas de fase en aleaciones metálicas Sólidos Inorgánicos Diagramas de fase de sustancias puras 8000 Hielo VI 6000 Presión/atm Hielo V 0 2000 2 Hielo II Hielo III íquido Temperatura/ C 2000 1500 500
Unidad6 ENDURECIMIENTO POR ALEACION. ALEACIONES CON SOLUBILIDAD PARCIAL EN ESTADO SOLIDO
 Unidad6 ENDURECIMIENTO POR ALEACION. ALEACIONES CON SOLUBILIDAD PARCIAL EN ESTADO SOLIDO 1 PRESENTACION En esta Unidad se analiza la casuística que aparece cuando en el estado sólido existen componentes
Unidad6 ENDURECIMIENTO POR ALEACION. ALEACIONES CON SOLUBILIDAD PARCIAL EN ESTADO SOLIDO 1 PRESENTACION En esta Unidad se analiza la casuística que aparece cuando en el estado sólido existen componentes
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN ÍNDICE
 CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
La reacción de formación de perlita en aleaciones Fe-C
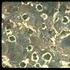 La Transformación Eutectoide ( Tomado de Porter D. A et al Phase Transformations in metals and alloys. Reed Hill R. Principios de Metalurgia Física, Hume Rothery The Structures of alloys of iron ) La reacción
La Transformación Eutectoide ( Tomado de Porter D. A et al Phase Transformations in metals and alloys. Reed Hill R. Principios de Metalurgia Física, Hume Rothery The Structures of alloys of iron ) La reacción
Aleaciones Hierro-carbono
 TEMA 8 : ALEACIONES DE BASE HIERRO Introducción. Aleaciones de base hierro y sus tratamientos. Diagrama hierro carbono. Fundiciones. Tratamientos térmicos: recocido, temple, normalizado. Aleaciones Hierro-carbono
TEMA 8 : ALEACIONES DE BASE HIERRO Introducción. Aleaciones de base hierro y sus tratamientos. Diagrama hierro carbono. Fundiciones. Tratamientos térmicos: recocido, temple, normalizado. Aleaciones Hierro-carbono
Tema 2. Diagramas de Equilibrio y TTT
 Tema 2. Diagramas de Equilibrio y TTT 2.1. Regla de las fases. 2.2. Diagramas en sistemas binarios. Eutéctico y peritéctico. 2.3. Curvas temperatura-tiempo-transformación. 2.4. Ciencia de Materiales en
Tema 2. Diagramas de Equilibrio y TTT 2.1. Regla de las fases. 2.2. Diagramas en sistemas binarios. Eutéctico y peritéctico. 2.3. Curvas temperatura-tiempo-transformación. 2.4. Ciencia de Materiales en
Solidificación e Imperfecciones. en Sólidos
 Preguntas definitivas Capítulo 2 Solidificación e Imperfecciones en Sólidos Ciencia de Materiales 28 PREGUNTA 2.1 Cuándo suele presentar interés el uso de un metal en estado puro?. Justifícalo. Pon un
Preguntas definitivas Capítulo 2 Solidificación e Imperfecciones en Sólidos Ciencia de Materiales 28 PREGUNTA 2.1 Cuándo suele presentar interés el uso de un metal en estado puro?. Justifícalo. Pon un
6. Diagramas de fases en aleaciones metálicas
 6. Diagramas de fases en aleaciones metálicas 6.1. Conceptos fundamentales 6.2. Ejemplos de diagramas de fases 6.2.1. Sistemas isomórficos binarios 6.2.2. Endurecimiento por dispersión. Reacciones de tres
6. Diagramas de fases en aleaciones metálicas 6.1. Conceptos fundamentales 6.2. Ejemplos de diagramas de fases 6.2.1. Sistemas isomórficos binarios 6.2.2. Endurecimiento por dispersión. Reacciones de tres
ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS M.V.M.G ALEACIONES 1
 ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS 2007-08 ALEACIONES 1 INTRODUCCIÓN Una aleación es la combinación de dos o más metales,
ALEACIONES 1. INTRODUCCION 2. CLASIFICACION 3. SOLUCIONES SÓLIDAS 4. FASES INTERMEDIAS 5. SOLUCIONES SÓLIDAS ORDENADAS 2007-08 ALEACIONES 1 INTRODUCCIÓN Una aleación es la combinación de dos o más metales,
ALEACIONES BINARIAS. Julio Alberto Aguilar Schafer
 ALEACIONES BINARIAS Julio Alberto Aguilar Schafer ALEACIONES BINARIAS Homogeneas: Solución sólida (SS): ej. Latones α Compuesto químico definido (CQD): ej. Cementita (Fe3C) Heterogeneas: SS + SS: el. Latones
ALEACIONES BINARIAS Julio Alberto Aguilar Schafer ALEACIONES BINARIAS Homogeneas: Solución sólida (SS): ej. Latones α Compuesto químico definido (CQD): ej. Cementita (Fe3C) Heterogeneas: SS + SS: el. Latones
TEMA 4. IMPERFECIONES EN SÓLIDOS
 TEMA 4. IMPERFECIONES EN SÓLIDOS En el Tema 3 se ha descrito el SÓLIDO CRISTALINO mediante la aproximación del CRISTAL IDEAL, que tomamos como modelo de perfección cristalina Los sólidos cristalinos reales
TEMA 4. IMPERFECIONES EN SÓLIDOS En el Tema 3 se ha descrito el SÓLIDO CRISTALINO mediante la aproximación del CRISTAL IDEAL, que tomamos como modelo de perfección cristalina Los sólidos cristalinos reales
Capítulo 7 Diagramas de fase y transformaciones de fase
 Capítulo 7 Diagramas de fase y transformaciones de fase 1 Tema 7: Diagramas de fase y transformaciones de fase 1. Definiciones 2. Diagramas de fase 3. Cinética: nucleación y crecimiento 4. Tratamientos
Capítulo 7 Diagramas de fase y transformaciones de fase 1 Tema 7: Diagramas de fase y transformaciones de fase 1. Definiciones 2. Diagramas de fase 3. Cinética: nucleación y crecimiento 4. Tratamientos
Diagrama de fases de una sustancia pura: el agua
 Diagrama de fases de una sustancia pura: el agua Apellidos, nombre Departamento Centro Lorena Atarés Huerta (loathue@tal.upv.es) Tecnología de Alimentos Escuela Técnica Superior de Ingeniería Agronómica
Diagrama de fases de una sustancia pura: el agua Apellidos, nombre Departamento Centro Lorena Atarés Huerta (loathue@tal.upv.es) Tecnología de Alimentos Escuela Técnica Superior de Ingeniería Agronómica
BLOQUE IV.- Materiales metálicos. Tema 10.- Fundiciones
 BLOQUE IV.- Materiales metálicos * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de Materiales
BLOQUE IV.- Materiales metálicos * William F. Smith Fundamentos de la Ciencia e Ingeniería de Materiales. Tercera Edición. Ed. Mc-Graw Hill * James F. Shackerlford Introducción a la Ciencia de Materiales
Equilibrio físico. Prof. Jesús Hernández Trujillo. Facultad de Química, UNAM. Equilibrio físico/j. Hdez. T p.
 Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo jesus.hernandezt@gmail.com Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo jesus.hernandezt@gmail.com Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
UNIDAD 6 Endurecimiento por aleación. Aleaciones con solubilidad parcial en estado sólido
 UNIDAD 6 Endurecimiento por aleación. Aleaciones con solubilidad parcial en estado sólido 6.1 CUESTIONES DE AUTOEVALUACIÓN 1 - En los aceros hipereutectoides la cementita aparece en: a) Bordes de grano
UNIDAD 6 Endurecimiento por aleación. Aleaciones con solubilidad parcial en estado sólido 6.1 CUESTIONES DE AUTOEVALUACIÓN 1 - En los aceros hipereutectoides la cementita aparece en: a) Bordes de grano
FUNDICIONES. Las fundiciones son aleaciones de hierro, también manganeso, fosforo y azufre. Las
 FUNDICIONES Las fundiciones son aleaciones de hierro, carbono y silicio que generalmente contienen también manganeso, fosforo y azufre. Las fundiciones, que son las más utilizadas en la práctica, aparecen
FUNDICIONES Las fundiciones son aleaciones de hierro, carbono y silicio que generalmente contienen también manganeso, fosforo y azufre. Las fundiciones, que son las más utilizadas en la práctica, aparecen
PRINCIPALES ELEMENTOS CONSTITUYENTES DE LA FUNDICIÓN ESFEROIDAL
 PRINCIPALES ELEMENTOS CONSTITUYENTES DE LA FUNDICIÓN ESFEROIDAL Dentro de los factores más importantes a tener en cuenta en una eficiente nodulización podemos considerar como el más importante la composición
PRINCIPALES ELEMENTOS CONSTITUYENTES DE LA FUNDICIÓN ESFEROIDAL Dentro de los factores más importantes a tener en cuenta en una eficiente nodulización podemos considerar como el más importante la composición
FISICOQUÍMICA APLICADA
 UNIVERSIDAD NACIONAL DE TUCUMAN FACULTAD DE BIOQUIMICA QUIMICA Y FARMACIA INSTITUTO DE QUIMICA FISICA San Miguel de Tucumán República Argentina FISICOQUÍMICA APLICADA Cambio de fase. Superficies. Coloides
UNIVERSIDAD NACIONAL DE TUCUMAN FACULTAD DE BIOQUIMICA QUIMICA Y FARMACIA INSTITUTO DE QUIMICA FISICA San Miguel de Tucumán República Argentina FISICOQUÍMICA APLICADA Cambio de fase. Superficies. Coloides
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Materiales. Examen Final (28/06/2011) PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta.
 Nombre: Materiales. Examen Final (28/06/2011) Grupo/profesor: PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta. 1) Un material ferromagnético puede presentar
Nombre: Materiales. Examen Final (28/06/2011) Grupo/profesor: PARTE I: Seleccione la respuesta correcta. 0.2 p c/u. Una respuesta incorrecta elimina una correcta. 1) Un material ferromagnético puede presentar
Equilibrio Químico. CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A.
 Equilibrio Químico CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A. Introducción Las reacciones químicas que se ha considerado hasta este punto se denominan irreversibles debido a que ellas proceden
Equilibrio Químico CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A. Introducción Las reacciones químicas que se ha considerado hasta este punto se denominan irreversibles debido a que ellas proceden
GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS
 A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
convección (4.1) 4.1. fundamentos de la convección Planteamiento de un problema de convección
 convección El modo de transferencia de calor por convección se compone de dos mecanismos de transporte, que son, la transferencia de energía debido al movimiento aleatorio de las moléculas (difusión térmica)
convección El modo de transferencia de calor por convección se compone de dos mecanismos de transporte, que son, la transferencia de energía debido al movimiento aleatorio de las moléculas (difusión térmica)
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
FÍSICA 4. P = RT V a V 2. U(T,V) = U 0 +C V T a V? α α T = C 1 = C 2. v = 1.003cm 3 /g. α = 1 v
 FÍSICA 4 SEGUNDO CUARIMESRE DE 2009 GUÍA 3: OENCIALES ERMODINÁMICOS, CAMBIOS DE FASE 1. Sean x,, z cantidades que satisfacen una relación funcional f(x,, z) = 0. Sea w una función de cualquier par de variables
FÍSICA 4 SEGUNDO CUARIMESRE DE 2009 GUÍA 3: OENCIALES ERMODINÁMICOS, CAMBIOS DE FASE 1. Sean x,, z cantidades que satisfacen una relación funcional f(x,, z) = 0. Sea w una función de cualquier par de variables
TRATAMIENTOS TÉRMICOS DE LOS ACEROS CONTENIDOS
 TRATAMIENTOS TÉRMICOS DE LOS ACEROS CONTENIDOS Diagrama Fe-C Tratamiento de los metales para mejorar sus propiedades Tratamientos térmicos Tratamientos termoquímicos Tratamientos mecánicos Tratamientos
TRATAMIENTOS TÉRMICOS DE LOS ACEROS CONTENIDOS Diagrama Fe-C Tratamiento de los metales para mejorar sus propiedades Tratamientos térmicos Tratamientos termoquímicos Tratamientos mecánicos Tratamientos
EJERCICIOS DIAGRAMA DE FASES
 EJERCICIOS DIAGRAMA DE FASES 1. Con el diagrama de equilibrio Cu - Ni. Determinar para una aleación con el 40 % de Ni: a) Curva de enfriamiento, intervalo de solidificación, fases presentes en cada una
EJERCICIOS DIAGRAMA DE FASES 1. Con el diagrama de equilibrio Cu - Ni. Determinar para una aleación con el 40 % de Ni: a) Curva de enfriamiento, intervalo de solidificación, fases presentes en cada una
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
T9 LOS METALES FERROSOS
 T9 LOS METALES FERROSOS Índice 1. Generalidades acerca de los metales 1.1 Estructuras cristalinas 1.2 Aleaciones. Soluciones sólidas. 2. Los metales ferrosos 2.1 Productos férreos industriales 3. El proceso
T9 LOS METALES FERROSOS Índice 1. Generalidades acerca de los metales 1.1 Estructuras cristalinas 1.2 Aleaciones. Soluciones sólidas. 2. Los metales ferrosos 2.1 Productos férreos industriales 3. El proceso
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID. PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Curso
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Curso 007-008 MATERIA: TECNOLOGÍA INDUSTRIAL II MODELO INSTRUCCIONES GENERALES Y VALORACIÓN Estructura
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Curso 007-008 MATERIA: TECNOLOGÍA INDUSTRIAL II MODELO INSTRUCCIONES GENERALES Y VALORACIÓN Estructura
IMPERFECCIONES EN SÓLIDOSS
 IMPERFECCIONES EN SÓLIDOSS UN ORDENAMIENTO PERFECTO DE LOS ÁTOMOS EN LOS MATERIALES CRISTALINOS SOLAMENTE PUEDE OCURRIR A UNA TEMPERATURA DE 0 K. TAL SÓLIDO IDEAL NO EXISTE: TODOS TIENEN GRAN NÚMERO DE
IMPERFECCIONES EN SÓLIDOSS UN ORDENAMIENTO PERFECTO DE LOS ÁTOMOS EN LOS MATERIALES CRISTALINOS SOLAMENTE PUEDE OCURRIR A UNA TEMPERATURA DE 0 K. TAL SÓLIDO IDEAL NO EXISTE: TODOS TIENEN GRAN NÚMERO DE
DIAGRAMAS DE FASE. La base de todo el trabajo sobre los diagramas de equilibrio es la regla de fases de Willard Gibbs.
 DIAGRAMAS DE FASE 1. DEFINICIONES Los diagramas de fase son representaciones gráficas de cuales fases están presentes en un sistema material en función de la temperatura, la presión y la composición. Son
DIAGRAMAS DE FASE 1. DEFINICIONES Los diagramas de fase son representaciones gráficas de cuales fases están presentes en un sistema material en función de la temperatura, la presión y la composición. Son
1.7.2. Diagrama de fases hierro - carbono
 Capítulo 7 Aleaciones Ferrosas 1.7. Acero al carbono y fundiciones 1.7.1. Clasificación de las aleaciones ferrosas El AISI (American Iron and Steel Institute) y el SAE (Society of Automotive Engineers)
Capítulo 7 Aleaciones Ferrosas 1.7. Acero al carbono y fundiciones 1.7.1. Clasificación de las aleaciones ferrosas El AISI (American Iron and Steel Institute) y el SAE (Society of Automotive Engineers)
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
Informe 3: Ensayo de dureza en Acero con distintos tratamientos termicos. Ciencias de los Materiales CM3201
 Universidad de Chile Facultad de Ciencias Físicas y Matemáticas Departamento de Ciencia de los Materiales Informe 3: Ensayo de dureza en Acero con distintos tratamientos termicos Ciencias de los Materiales
Universidad de Chile Facultad de Ciencias Físicas y Matemáticas Departamento de Ciencia de los Materiales Informe 3: Ensayo de dureza en Acero con distintos tratamientos termicos Ciencias de los Materiales
7.7 EL DIAGRAMA EQUILIBRIO DE FASES
 7.7 EL DIAGRAMA EQUILIBRIO DE FASES 7.7.1 CÓMO CONSTRUIR UN DIAGRAMA DE FASES Un diagrama de fases es una representación gráfica de las variables del sistema. Diagrama de fases binario: 2 componentes (r=2).
7.7 EL DIAGRAMA EQUILIBRIO DE FASES 7.7.1 CÓMO CONSTRUIR UN DIAGRAMA DE FASES Un diagrama de fases es una representación gráfica de las variables del sistema. Diagrama de fases binario: 2 componentes (r=2).
Volumen de Sólidos de Revolución
 60 CAPÍTULO 4 Volumen de Sólidos de Revolución 6 Volumen de sólidos de revolución Cuando una región del plano de coordenadas gira alrededor de una recta l, se genera un cuerpo geométrico denominado sólido
60 CAPÍTULO 4 Volumen de Sólidos de Revolución 6 Volumen de sólidos de revolución Cuando una región del plano de coordenadas gira alrededor de una recta l, se genera un cuerpo geométrico denominado sólido
ESTRUCTURA DE LOS MATERIALES 2. 25/02/2012 Elaboró Ing. Efrén Giraldo T. 1
 ESTRUCTURA DE LOS MATERIALES 2 25/02/2012 Elaboró Ing. Efrén Giraldo T. 1 FACTOR DE EMPAQUETAMIENTO FEA = (No de átomos por celda. Vol de un átomo) / V (celda) 25/02/2012 Elaboró Ing. Efrén Giraldo T.
ESTRUCTURA DE LOS MATERIALES 2 25/02/2012 Elaboró Ing. Efrén Giraldo T. 1 FACTOR DE EMPAQUETAMIENTO FEA = (No de átomos por celda. Vol de un átomo) / V (celda) 25/02/2012 Elaboró Ing. Efrén Giraldo T.
Unidad 2. La materia
 Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
3 Materiales poliméricos
 3 Materiales poliméricos 41 3 Materiales poliméricos 3.1 Cuál es la masa molecular media en número ( Mn) y en peso ( Mw) de una mezcla que pesa 2 g y está formada por 1 g de la parafina C 95 H 192 y 1
3 Materiales poliméricos 41 3 Materiales poliméricos 3.1 Cuál es la masa molecular media en número ( Mn) y en peso ( Mw) de una mezcla que pesa 2 g y está formada por 1 g de la parafina C 95 H 192 y 1
TEMAS Diciembre Belén Molina Sánchez UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I
 TEMAS 22-23 Diciembre 2005 Belén Molina Sánchez 1 CURVAS TEMPERATURA-TIEMPO-TRANSFORMACIÓN El tiempo: la tercera dimensión. En los diagramas de fases se exigía que los cambios de temperatura tuviesen lugar
TEMAS 22-23 Diciembre 2005 Belén Molina Sánchez 1 CURVAS TEMPERATURA-TIEMPO-TRANSFORMACIÓN El tiempo: la tercera dimensión. En los diagramas de fases se exigía que los cambios de temperatura tuviesen lugar
Práctica 10 RECONOCIMIENTO DE LOS MICROCONSTITUYENTES DE LAS FUNDICIONES DE HIERRO
 Práctica 10 RECONOCIMIENTO DE LOS MICROCONSTITUYENTES DE LAS FUNDICIONES DE HIERRO OBJETIVO El alumno identificará los constituyentes principales de los diferentes tipos de hierro fundido. INTRODUCCIÓN
Práctica 10 RECONOCIMIENTO DE LOS MICROCONSTITUYENTES DE LAS FUNDICIONES DE HIERRO OBJETIVO El alumno identificará los constituyentes principales de los diferentes tipos de hierro fundido. INTRODUCCIÓN
Laboratorio 8. Diagrama de fase sólido-liquido para un sistema binario
 Laboratorio 8. Diagrama de fase sólido-liquido para un sistema binario Objetivo Construir el diagrama de fase sólido líquido para un sistema binario a partir de las curvas de enfriamiento. Se determinará
Laboratorio 8. Diagrama de fase sólido-liquido para un sistema binario Objetivo Construir el diagrama de fase sólido líquido para un sistema binario a partir de las curvas de enfriamiento. Se determinará
Materia. Mezclas Son aquellas que están formados por 2 o más sustancias.
 Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
Ciencia de Materiales, 4º curso, 2004/2005
 Tema 4. Aleaciones Hierro-Carbono. Aceros y Fundiciones. 4.1. Diagrama Fe-C. 4.2. Aceros y fundiciones. 4.3. Aceros inoxidables. 4.4. Curvas TTT de aceros. El sistema de aleaciones binario más importante
Tema 4. Aleaciones Hierro-Carbono. Aceros y Fundiciones. 4.1. Diagrama Fe-C. 4.2. Aceros y fundiciones. 4.3. Aceros inoxidables. 4.4. Curvas TTT de aceros. El sistema de aleaciones binario más importante
Práctica No 12. Determinación experimental de la Presión de vapor de un líquido puro
 Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
Disoluciones. Química General II 2011
 Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Disoluciones Química General II 2011 Disolución Es una mezcla homogénea de dos o mas sustancias. Componentes: Soluto: Sustancia (s) presente (s) en menor cantidad en una disolución, son las sustancias
Capítulo 7 Diagramas de fase y transformaciones de fase
 Capítulo 7 Diagramas de fase y transformaciones de fase 1 Índice general 1. Definiciones: microestructura, fases, componentes, solubilidad y límite de solubilidad. 2. Diagramas de equilibrio de fase 2.1
Capítulo 7 Diagramas de fase y transformaciones de fase 1 Índice general 1. Definiciones: microestructura, fases, componentes, solubilidad y límite de solubilidad. 2. Diagramas de equilibrio de fase 2.1
Capítulo II TRATAMIENTOS TÉRMICOS Y SELECCIÓN DEL MATERIAL PARA LA FABRICACIÓN DE LEVAS
 Capítulo II TRATAMIENTOS TÉRMICOS Y SELECCIÓN DEL MATERIAL PARA LA FABRICACIÓN DE LEVAS 2.1) Introducción. Como se dijo en el capítulo anterior, para que un mecanismo leva-seguidor sea vida útil de la
Capítulo II TRATAMIENTOS TÉRMICOS Y SELECCIÓN DEL MATERIAL PARA LA FABRICACIÓN DE LEVAS 2.1) Introducción. Como se dijo en el capítulo anterior, para que un mecanismo leva-seguidor sea vida útil de la
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
TRANSFERENCIA DE CALOR
 Conducción Convección Radiación TRANSFERENCIA DE CALOR Ing. Rubén Marcano Temperatura es una propiedad que depende del nivel de interacción molecular. Específicamente la temperatura es un reflejo del nivel
Conducción Convección Radiación TRANSFERENCIA DE CALOR Ing. Rubén Marcano Temperatura es una propiedad que depende del nivel de interacción molecular. Específicamente la temperatura es un reflejo del nivel
c. Su factor de empaquetamiento atómico 15. El Fe a temperatura ambiente tiene estructura Cúbica Centrada en el Cuerpo: a. Cuántos átomos rodean a
 1. Qué energía debe desprender un átomo para dar lugar a un fotón de longitud de onda 630 nm? h=6,624x10-34 J s c=3x10 8 m/s 2. Indique cuales son los n os cuánticos y qué representan. Enuncie el principio
1. Qué energía debe desprender un átomo para dar lugar a un fotón de longitud de onda 630 nm? h=6,624x10-34 J s c=3x10 8 m/s 2. Indique cuales son los n os cuánticos y qué representan. Enuncie el principio
FENÓMENOS DE TRANSPORTE
 FENÓMENOS DE TRANSPORTE UNIDAD I CONTENIDO LEY CERO DE LA TERMODINÁMICA LEY CERO DE LA TERMODINÁMICA Cuando tocamos un objeto, el sentido del tacto nos proporciona la sensación que calificamos como caliente
FENÓMENOS DE TRANSPORTE UNIDAD I CONTENIDO LEY CERO DE LA TERMODINÁMICA LEY CERO DE LA TERMODINÁMICA Cuando tocamos un objeto, el sentido del tacto nos proporciona la sensación que calificamos como caliente
Tema 6 Diagramas de fase.
 Tema 6 Diagramas de fase. Los materiales en estado sólido pueden estar formados por varias fases. La combinación de estas fases define muchas de las propiedades que tendrá el material. Por esa razón, se
Tema 6 Diagramas de fase. Los materiales en estado sólido pueden estar formados por varias fases. La combinación de estas fases define muchas de las propiedades que tendrá el material. Por esa razón, se
5. DIAGRAMAS DE FASES Y TRANSFORMACIONES DE LOS MATERIALES REGLA DE LAS FASES DE GIBS DIAGRAMA DE UNA SUSTANCIA PURA
 5. DIAGRAMAS DE FASES Y TRANSFORMACIONES DE LOS MATERIALES 66 5.1 REGLA DE LAS FASES DE GIBS... 66 5.2 DIAGRAMA DE UNA SUSTANCIA PURA... 67 5.3 DIAGRAMAS BINARIOS... 69 5.3.1 Diagrama de solubilidad total...
5. DIAGRAMAS DE FASES Y TRANSFORMACIONES DE LOS MATERIALES 66 5.1 REGLA DE LAS FASES DE GIBS... 66 5.2 DIAGRAMA DE UNA SUSTANCIA PURA... 67 5.3 DIAGRAMAS BINARIOS... 69 5.3.1 Diagrama de solubilidad total...
Qué son los diagramas Ternarios?
 Diagramas Ternarios Qué son los diagramas Ternarios? Diagramas que representan el equilibrio entre las distintas fases que se forman mediante tres componentes, como una función de la temperatura. Normalmente,
Diagramas Ternarios Qué son los diagramas Ternarios? Diagramas que representan el equilibrio entre las distintas fases que se forman mediante tres componentes, como una función de la temperatura. Normalmente,
GUÍA DE DISCUSIÓN DE PROBLEMAS 4 TEMA DIFUSIÓN EN MATERIALES DE INGENIERÍA
 UNIVERSIDAD DON BOSCO FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA MECÁNICA Asignatura: "Ciencia de los Materiales" I- SECCION DE PREGUNTAS: GUÍA DE DISCUSIÓN DE PROBLEMAS 4 TEMA DIFUSIÓN EN MATERIALES
UNIVERSIDAD DON BOSCO FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA MECÁNICA Asignatura: "Ciencia de los Materiales" I- SECCION DE PREGUNTAS: GUÍA DE DISCUSIÓN DE PROBLEMAS 4 TEMA DIFUSIÓN EN MATERIALES
CRISTALOGRAFIA. Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones.
 CRISTALOGRAFIA CRISTAL SÓLIDO MONOCRISTALINO SÓLIDO POLICRISTALINO Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones. Región donde el
CRISTALOGRAFIA CRISTAL SÓLIDO MONOCRISTALINO SÓLIDO POLICRISTALINO Es un sólido compuesto de átomos, iones o moléculas ordenados de una cierta forma y que se repite en tres dimensiones. Región donde el
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Fundiciones grises aleadas de alta resistencia
 Fundiciones grises aleadas de alta resistencia Ing. Manuel Vega Utrera Docente de Ciencia e Ingeniería de Materiales y Metalurgia Universidad de Montevideo, Facultad de Ingeniería La fabricación de piezas
Fundiciones grises aleadas de alta resistencia Ing. Manuel Vega Utrera Docente de Ciencia e Ingeniería de Materiales y Metalurgia Universidad de Montevideo, Facultad de Ingeniería La fabricación de piezas
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
So S l o u l c u i c o i n o e n s e
 Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Soluciones SOLUCIONES mezclas homogéneas de dos sustancias: SOLUTO SOLVENTE SEGÚN EL ESTADO FISICO DEL SOLVENTE SOLIDA LIQUIDA GASEOSA Cuando un sólido se disuelve en un líquido las partículas que lo
Equilibrio de fases en sistemas multicomponentes. Dr. Abel Moreno Cárcamo Instituto de Química, UNAM /
 Equilibrio de fases en sistemas multicomponentes Dr. Abel Moreno Cárcamo Instituto de Química, UNAM carcamo@unam.mx / abel.moreno@mac.com DIAGRAMAS DE FASE DE SISTEMAS DE DOS COMPONENTES Un sistema de
Equilibrio de fases en sistemas multicomponentes Dr. Abel Moreno Cárcamo Instituto de Química, UNAM carcamo@unam.mx / abel.moreno@mac.com DIAGRAMAS DE FASE DE SISTEMAS DE DOS COMPONENTES Un sistema de
