Anexo II. Conclusiones científicas
|
|
|
- Ana Ojeda Rey
- hace 6 años
- Vistas:
Transcripción
1 Anexo II Conclusiones científicas 200
2 Conclusiones científicas Consiguientemente a la evaluación de un informe periódico de seguridad (IPS) sobre los medicamentos que contienen ambroxol, elaborado conforme al reparto del trabajo e iniciado en enero de 2012, y a las presentaciones de seguimiento, así como de las actividades de detección de señales, la autoridad nacional competente de Bélgica (FAMHP) constató un incremento de las notificaciones de reacciones de hipersensibilidad durante el periodo , informes de reacciones adversas cutáneas graves (RACG) y una evaluación de los beneficios y riesgos en niños menores de 6 años de la que se concluía que, pese a no existir indicaciones de un perfil de seguridad diferente, no se disponía de pruebas suficientes de su eficacia en el tratamiento secretolítico para este grupo de edad, lo que se traducía en una relación beneficio-riesgo negativa. Como el ambroxol es un metabolito de la bromhexina y las reacciones de hipersensibilidad no dependen de la dosis de la sustancia alergénica absorbida, la FAMHP consideró que cualquier riesgo de dichas reacciones confirmado para el ambroxol podía también asociarse a los medicamentos que contienen bromhexina. En este sentido, el 4 de abril de 2014 la FAMHP informó a la Agencia Europea de Medicamentos de su decisión de notificar un procedimiento de arbitraje para solicitar la recomendación del PRAC conforme al artículo 31 de la Directiva 2001/83/CE, sobre si la relación riesgo-beneficio de estos productos sigue siendo positiva en las indicaciones aprobadas y sobre si las autorizaciones de comercialización de los medicamentos que contienen ambroxol y los medicamentos que contienen bromhexina se deberían mantener, modificar, suspender o retirar. El 25 de febrero de 2015 el CMDh, después de considerar la recomendación del PRAC de fecha 9 de enero de 2015, dictaminó por mayoría que las autorizaciones de comercialización de los medicamentos afectados se deberían modificar. El dictamen del CMDh se remitió a la Comisión Europea. Durante el proceso de toma de decisiones, en una reunión del Comité Permanente de Medicamentos de Uso Humano, algunos Estados miembros plantearon nuevas cuestiones de naturaleza técnica, que consideraban que no se habían abordado suficientemente en la recomendación del PRAC y en el dictamen del CMDh. A la vista de esto, la recomendación del PRAC y el dictamen del CMDh se remitieron de vuelta a la Agencia para una mayor consideración. Los medicamentos que contienen ambroxol y los medicamentos que contienen bromhexina se registraron por primera vez en un Estado miembro (EM) de la Unión Europea (UE) en 1978 y 1963, respectivamente, y ahora están autorizados en todos los EM de la UE (así como en Noruega e Islandia) a excepción del Reino Unido. Las indicaciones autorizadas para el ambroxol, tal como se indica en la ficha de información básica de la empresa para la especialidad farmacéutica original, son el tratamiento secretolítico, la profilaxis y el tratamiento del síndrome de dificultad respiratoria infantil (SDRI), la profilaxis y el tratamiento de las complicaciones broncopulmonares postoperatorias (CBP) y el alivio del dolor en la faringitis aguda. Las indicaciones autorizadas para la bromhexina, tal como se indica en la ficha de información básica de la empresa, son el tratamiento secretolítico, las alteraciones en la producción y eliminación del moco (sinusitis aguda y crónica) y el síndrome de Sjögren. No todas las indicaciones están autorizadas en todos los EM de la UE. Además, el ambroxol y la bromhexina se han aprobado en algunos EM de la UE para tratar enfermedades de las vías respiratorias, en combinaciones de dosis fijas con diversos principios activos. Estos productos están contraindicados en distintos subgrupos de la población pediátrica en los EM de la UE. El ambroxol y la bromhexina se comercializan, en diversas formulaciones y con distintas denominaciones de fantasía, para administración oral, nasal, bucofaríngea, intravenosa y rectal. Los medicamentos que contienen ambroxol o bromhexina están disponibles tanto en presentaciones de venta sin receta como en presentaciones sujetas a prescripción. 201
3 1 Resumen general de la evaluación científica del PRAC Aspectos relacionados con la seguridad RACG La información sobre seguridad presentada por los titulares de las autorizaciones de comercialización (TAC), procedente de Eudravigilance y extraída de las publicaciones científicas abarca unos 300 informes de casos de RACG, muchos de los cuales contienen posibles factores de confusión. Cuatro casos de RACG procedentes de Eudravigilance y otros tres casos más recogidos en las publicaciones científicas se han considerado relacionados con el ambroxol. El PRAC consideró que existía una posibilidad razonable de que el ambroxol y la bromhexina estuvieran relacionados con reacciones de hipersensibilidad retardada asociadas a RACG. Las reacciones de hipersensibilidad son independientes de la dosis y de la formulación, por lo que el riesgo de desarrollarlas, incluyendo RACG, es inherente a todos los medicamentos que contengan ambroxol o bromhexina. El PRAC observó que la exposición estimada, únicamente para las especialidades farmacéuticas originales, es de alrededor de 50 millones de pacientes-año, y en la UE durante la última década, de unos 6,8 millones de pacientes-año. El PRAC consideró que las pruebas de un riesgo de RACG relacionadas con el ambroxol y la bromhexina son poco sólidas. Muchos pacientes que desarrollan RACG reciben tratamiento con varios agentes mucolíticos o secretolíticos en el periodo pertinente antes de la aparición de estos efectos adversos. Con mucha frecuencia, tales pacientes reciben un cierto número de fármacos concomitantes y resulta difícil evaluar la causalidad. Como las RACG comienzan a veces con síntomas de tipo gripal, algunos pacientes podrían también empezar a tomar ambroxol o bromhexina para aliviar dichos síntomas, mientras que las reacciones cutáneas típicas aparecerían posteriormente, con lo que el ambroxol o la bromhexina podrían llegar a considerarse fármacos sospechosos de provocarlas. Cabe destacar que es improbable que el fármaco sea el responsable si el inicio de su administración fue menos de 4 días o más de 8 semanas antes de que apareciera la reacción. Muchas reacciones medicamentosas no pueden distinguirse de erupciones que se producen de forma natural o que están inducidas por infecciones y, por tanto, es habitual el diagnóstico erróneo. Sin embargo, el rápido reconocimiento de las reacciones graves y la inmediata retirada de los agentes causantes es el factor más importante para minimizar la morbimortalidad. Reacciones de hipersensibilidad El análisis de la información sobre seguridad presentada por los TAC, procedente de Eudravigilance y extraída de la bibliografía, demuestra que las formulaciones de ambroxol y de bromhexina, en sus distintas indicaciones, se han relacionado con informes de reacciones de hipersensibilidad inmediata graves. Además, las formulaciones de ambroxol en las indicaciones de tratamiento secretolítico y profilaxis o tratamiento del SDRI y las CBP se han relacionado con reacciones de hipersensibilidad retardada sin daños cutáneos graves. Sin embargo, estas reacciones adversas ya se indican en la información sobre el producto (IP) de la mayoría de los medicamentos que contienen ambroxol o bromhexina, y el análisis de los efectos adversos notificados con más frecuencia, seleccionados mediante las SMQ de hipersensibilidad (en sentido amplio), no identifica ningún problema de seguridad nuevo. Basándose en estos datos, se consideró que la susceptibilidad de todos los grupos de edad (niños, adultos y ancianos) respecto a posibles reacciones adversas del ambroxol o la bromhexina relacionadas con la hipersensibilidad es probablemente similar. Se observó un aumento de la frecuencia de notificaciones de reacciones anafilácticas en el periodo relacionadas con el ambroxol. Sin embargo, cuando se analizaron las fechas de las notificaciones, se observó que 40 informes de los 119 comunicados en total para la especialidad farmacéutica original desde su primera autorización de comercialización fueron enviados en dos grupos 202
4 por parte de las autoridades sanitarias chinas al TAC de la especialidad farmacéutica original. Este aumento de las notificaciones siguió a la entrada en vigor de un nuevo reglamento de farmacovigilancia en China, que podría haber influido en la comunicación de reacciones adversas, y no reflejaría un problema de seguridad nuevo. Cuestiones relativas a la eficacia Los estudios clínicos llevados a cabo durante el desarrollo de los productos que contienen bromhexina y ambroxol entre las décadas de 1950 y 1980 estaban claramente menos regulados de lo que hoy en día es obligatorio y podrían no cumplir completamente los requisitos actuales respecto a criterios de valoración homologados, confirmación estadística o buenas prácticas clínicas (BPC). Estos estudios representan la mayor parte de las pruebas disponibles, en concreto para las indicaciones que se autorizaron en primer lugar (p. ej. la indicación secretolítica). Además, el PRAC también ha considerado todos los estudios realizados recientemente que han presentado los titulares de la autorización de comercialización. A menudo se observa un importante efecto placebo en estudios que investigan trastornos respiratorios, en especial si se trata de enfermedades que no son graves, de resolución espontánea. Además, la definición de los criterios de valoración de relevancia clínica y la medición de los síntomas en esas enfermedades son problemáticas (Rubin, 2007). El PRAC tuvo en cuenta todos estos elementos en su revisión de los datos disponibles sobre la eficacia de los productos que contienen ambroxol o bromhexina. Se reconoció que la mayor parte de las indicaciones están respaldadas por estudios antiguos que presentan limitaciones y deficiencias. Algunos ensayos no pudieron demostrar diferencias significativas entre el ambroxol o la bromhexina y el placebo, mientras que otros solo pusieron de manifiesto diferencias significativas en algunos de los criterios de valoración estudiados. No obstante, se comunicaron resultados positivos, aunque modestos, para el ambroxol y la bromhexina. Se reconoció que las pruebas clínicas obtenidas en los estudios con niños son poco sólidas, debido tanto al bajo número de niños reclutados como a su heterogeneidad. Se reconoce también que las limitaciones y las incertidumbres propias de este conjunto de datos limitan la posibilidad de extraer conclusiones sólidas sobre la eficacia. Por estos motivos, los estudios realizados después de la autorización de comercialización inicial no proporcionan nuevos datos científicos significativos sobre la eficacia de estos productos. Evaluación de riesgos y beneficios Cuando se analizaron los datos utilizados para respaldar la seguridad, el PRAC consideró que los productos que contienen ambroxol o bromhexina se relacionaban con informes de casos de hipersensibilidad inmediata y retardada, como reacciones de hipersensibilidad, reacciones anafilácticas (incluyendo choque anafiláctico), angioedema, prurito, erupción cutánea y urticaria. Sin embargo, el PRAC señaló que el aumento de las notificaciones de reacciones anafilácticas observado con los productos que contienen ambroxol era probablemente un artefacto resultante de la entrada en vigor de un nuevo reglamento de farmacovigilancia en China y no reflejaría un problema de seguridad nuevo. Respecto a las reacciones de hipersensibilidad retardada asociadas a RACG, solo unos pocos casos se ha considerado que guardan relación sin lugar a dudas con el ambroxol. Basándose en la evaluación de los informes de casos individuales y teniendo en cuenta la naturaleza de esos episodios, el PRAC opinó que existe una posibilidad razonable de que todos los productos que contienen ambroxol o bromhexina, incluyendo los productos de combinación, se relacionen con un mayor riesgo de RACG. No obstante, la tasa global de notificaciones es muy baja cuando se tiene en cuenta la exposición estimada y estos casos contienen muchos factores de confusión, por lo que las pruebas que respaldan este riesgo son poco sólidas. El PRAC consideró que el posible riesgo de RACG puede abordarse adecuadamente con las modificaciones en la IP propuestas para informar a los cuidadores y pacientes del riesgo y permitir una identificación rápida de los signos de RACG y la inmediata interrupción del tratamiento. Además, el 203
5 PRAC recomendó armonizar los términos relacionados con las reacciones de hipersensibilidad en la IP. También los casos de RACG deben analizarse con detalle en futuros IPS. Y por lo tanto, el espacio entre los IPS se debería acortar a ciclos de 3 años, a fin de revisar periódicamente estos análisis. En relación con las pruebas de la eficacia de los productos que contienen ambroxol o bromhexina, el PRAC concluyó que, a pesar de que se comunicaron unos resultados positivos modestos, las pruebas de la eficacia de ambroxol y bromhexina presentan un cierto número de limitaciones y deficiencias. Esto entra dentro de lo previsible teniendo en cuenta los problemas metodológicos inherentes a esta área terapéutica y los requisitos y normativas existentes en el momento en que se desarrollaron estos productos. Teniendo en cuenta estas limitaciones y dado que las pruebas de problemas de seguridad obtenidas de los datos de farmacovigilancia son poco sólidas, el PRAC no pudo llegar a la conclusión a partir de las pruebas disponibles de que los riesgos sobrepasen a los beneficios en las distintas indicaciones. El PRAC también tuvo en cuenta los datos disponibles para la población pediátrica. El nivel de las pruebas no permitió una mayor estratificación por grupos de edad. Por tanto, el PRAC llegó a la conclusión de que las pruebas disponibles no justificaban la introducción de más restricciones para edades concretas en la información sobre el producto. Además, el PRAC comentó la necesidad de llevar a cabo estudios posteriores a la autorización y concluyó que estos estudios probablemente no generarían nuevos datos sólidos que permitan unas conclusiones más definitivas. Sin embargo, el espacio entre los IPS se debería acortar para seguir revisando periódicamente los datos que aparezcan sobre la relación riesgo-beneficio de los productos. El PRAC tuvo en cuenta el informe del comité de pediatría (PDCO) que señalaba que el uso de ambroxol y bromhexina varía significativamente en la práctica clínica pediátrica en la UE. Basándose en su experiencia clínica, el PDCO consideraba que no era necesario el uso de estos productos para esta indicación en niños menores de 2 años. El PDCO opinaba también que estos productos no debían seguir siendo la opción de tratamiento preferente en el SDRI. Teniendo en cuenta todo lo anterior, el PRAC llegó a la conclusión de que los datos revisados respaldaban la modificación de la IP para reflejar el riesgo de RACG y que, a tenor de los datos disponibles, no se justificaban otras restricciones por edad para reflejar los problemas sobre la relación beneficio-riesgo de los productos que contienen ambroxol o bromhexina. Conclusiones generales y motivos para la recomendación revisada del PRAC Considerando que: El PRAC ha seguido el procedimiento establecido en el artículo 31 de la Directiva 2001/83/CE como resultado de los datos de farmacovigilancia para los medicamentos que contienen ambroxol o bromhexina. El PRAC ha estudiado todos los datos presentados para respaldar la seguridad y eficacia de los medicamentos que contienen ambroxol o bromhexina, incluidas las solicitudes de los TAC y las recomendaciones de los expertos. El PRAC cree que existe la posibilidad razonable de un riesgo de RACG relacionado con el ambroxol y la bromhexina. El PRAC piensa que el ambroxol y la bromhexina están relacionados con un aumento del riesgo de reacciones de hipersensibilidad. 204
6 El PRAC opina que el riesgo de RACG debe abordarse mediante su inclusión en la IP acompañada de una advertencia para que los pacientes y cuidadores reconozcan las señales de alerta de una RACG e interrumpan el tratamiento inmediatamente en caso de observar tales signos. El PRAC juzga los datos disponibles insuficientes para justificar nuevas restricciones por edad. Por consiguiente, el PRAC recomienda la modificación de los términos de las autorizaciones de comercialización de los medicamentos que contienen ambroxol o bromhexina a los que se hace referencia en el anexo I, cuyas secciones relevantes del resumen de las características del producto y del prospecto se incluyen en el anexo III de la recomendación revisada del PRAC. El PRAC, en consecuencia, ha concluido que la relación beneficio-riesgo de los medicamentos que contienen ambroxol o bromhexina continúa siendo favorable, sujeta a las modificaciones en la información sobre el producto arriba detalladas. 2 Dictamen revisado del CMDh Todos los datos disponibles presentados, en relación con la seguridad y la eficacia de estos medicamentos, fueron revisados por el PRAC con el fin de evaluar el posible impacto de estos nuevos problemas de seguridad que se han identificado sobre la relación riesgo-beneficio probada de los medicamentos autorizados. El CMDh, tras tener en cuenta la recomendación revisada del PRAC, coincidió con las conclusiones científicas globales del PRAC y dictaminó que las autorizaciones de comercialización de los medicamentos que contienen ambroxol o bromhexina deben modificarse. El CMDh consideró la recomendación del PRAC en el sentido de que las pruebas disponibles no proporcionan motivo suficiente para demostrar un cambio en la relación riesgo-beneficio probada, siempre y cuando se apliquen las enmiendas recomendadas en las secciones 4.4 y 4.8 de la información sobre el producto, que se enumeran en el anexo III. Solo estas enmiendas, adoptadas e incluidas en el dictamen del CMDh, son jurídicamente vinculantes y se deben aplicar en los Estados miembros. 205
Anexo I. Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de la(s) autorización(es) de comercialización 1 Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe
Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Maria Teresa Herdeiro Adolfo Figueiras
 Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Adolfo Figueiras Reacción Adversa a Medicamento cualquier respuesta a un medicamento que sea nociva y no intencionada
Notificación Espontánea de Reacciones Adversas a Medicamentos (RAM) María Elena López González Adolfo Figueiras Reacción Adversa a Medicamento cualquier respuesta a un medicamento que sea nociva y no intencionada
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Equivalentes terapéuticos
 Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
NORMA INTERNACIONAL DE AUDITORÍA 720 RESPONSABILIDADES DEL AUDITOR RELACIONADAS CON OTRA INFORMACIÓN EN DOCUMENTOS QUE CONTIENEN ESTADOS
 NORMA INTERNACIONAL DE AUDITORÍA 720 RESPONSABILIDADES DEL AUDITOR RELACIONADAS CON OTRA INFORMACIÓN EN DOCUMENTOS QUE CONTIENEN ESTADOS FINANCIEROS AUDITADOS (Entra en vigor para las auditorías de estados
NORMA INTERNACIONAL DE AUDITORÍA 720 RESPONSABILIDADES DEL AUDITOR RELACIONADAS CON OTRA INFORMACIÓN EN DOCUMENTOS QUE CONTIENEN ESTADOS FINANCIEROS AUDITADOS (Entra en vigor para las auditorías de estados
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
PROGRAMA FIDES-AUDIT
 PROGRAMA FIDES-AUDIT INFORME FINAL DE EVALUACIÓN DEL DISEÑO DEL SISTEMA DE GARANTÍA INTERNA DE CALIDAD FACULTAD DE CIENCIAS ECONÓMICAS Y EMPRESARIALES UNIVERSIDADE DE VIGO INFORME FINAL DE EVALUACIÓN DEL
PROGRAMA FIDES-AUDIT INFORME FINAL DE EVALUACIÓN DEL DISEÑO DEL SISTEMA DE GARANTÍA INTERNA DE CALIDAD FACULTAD DE CIENCIAS ECONÓMICAS Y EMPRESARIALES UNIVERSIDADE DE VIGO INFORME FINAL DE EVALUACIÓN DEL
Restricciones de uso de los medicamentos que contienen domperidona
 1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
Pautas para la vigilancia y el control de Coqueluche en situaciones de brote
 2012 0 Pautas para la vigilancia y el control de Coqueluche en situaciones de brote Introducción Coqueluche, tos convulsa o pertussis es una enfermedad respiratoria aguda que puede manifestarse en forma
2012 0 Pautas para la vigilancia y el control de Coqueluche en situaciones de brote Introducción Coqueluche, tos convulsa o pertussis es una enfermedad respiratoria aguda que puede manifestarse en forma
Consejo de la Unión Europea Bruselas, 24 de enero de 2017 (OR. en) A: D. Jeppe TRANHOLM-MIKKELSEN, secretario general del Consejo de la Unión Europea
 Consejo de la Unión Europea Bruselas, 24 de enero de 2017 (OR. en) Expediente interinstitucional: 2017/0010 (NLE) 5569/17 ENV 50 COMPET 37 PROPUESTA De: Fecha de recepción: 19 de enero de 2017 secretario
Consejo de la Unión Europea Bruselas, 24 de enero de 2017 (OR. en) Expediente interinstitucional: 2017/0010 (NLE) 5569/17 ENV 50 COMPET 37 PROPUESTA De: Fecha de recepción: 19 de enero de 2017 secretario
Texto adaptado Lee atentamente el siguiente texto y después contesta a las preguntas.
 LECTURA Título Las cosas claras, por favor Miguel de Ros El Diario. Sábado, 14 de enero de 2006 Texto adaptado Lee atentamente el siguiente texto y después contesta a las preguntas. Los pacientes reclaman
LECTURA Título Las cosas claras, por favor Miguel de Ros El Diario. Sábado, 14 de enero de 2006 Texto adaptado Lee atentamente el siguiente texto y después contesta a las preguntas. Los pacientes reclaman
INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS
 INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS Qué es un medicamento? Una sustancia que pueden consumir las personas con distintos fines 1) Prevenir o tratar enfermedades 2) Aliviar síntomas 3) Realizar un diagnóstico
INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS Qué es un medicamento? Una sustancia que pueden consumir las personas con distintos fines 1) Prevenir o tratar enfermedades 2) Aliviar síntomas 3) Realizar un diagnóstico
Anexo IV. Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
(Texto pertinente a efectos del EEE)
 2.10.2015 ES L 257/19 REGLAMENTO DE EJECUCIÓN (UE) 2015/1759 DE LA COMISIÓN de 28 de septiembre de 2015 por el que se aprueba el uso del glutaraldehído como sustancia activa en biocidas de los tipos de
2.10.2015 ES L 257/19 REGLAMENTO DE EJECUCIÓN (UE) 2015/1759 DE LA COMISIÓN de 28 de septiembre de 2015 por el que se aprueba el uso del glutaraldehído como sustancia activa en biocidas de los tipos de
MEDICAMENTOS GENERICOS
 MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias A.N.M.A.T.
 BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Prospecto: información para el usuario
 Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
ENSAYOS CLINICOS REQUISITOS QUE DEBE CUMPLIR UN PROGRAMA DE ENSAYOS CLINICOS
 ENSAYOS CLINICOS La aplicación para el seguimiento y control de Ensayos Clínicos y estudios de investigación con medicamentos, se contempla como una opción en conexión integral con el resto de los programas
ENSAYOS CLINICOS La aplicación para el seguimiento y control de Ensayos Clínicos y estudios de investigación con medicamentos, se contempla como una opción en conexión integral con el resto de los programas
INN Nombre inventado Concentración Forma farmacéutica. Caustinerf Arsenical
 Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
Estado Miembro (en EEA) Autorización de Comercialización Titular INN Nombre inventado Concentración Forma farmacéutica Vía de administración Lituania Septodont 58, rue du Pont de Creteil clorhidrato de
PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE. Bromhexina hidrocloruro
 PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE Bromhexina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE Bromhexina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Libre circulación de pacientes y receta electrónica en la UE 2
 CONTENIDO: 1 Libre circulación de pacientes y receta electrónica en la UE 2 1 Se prohíbe la reproducción total o parcial del contenido de este "Boletín Europa al Día" sin citar la fuente o sin haber obtenido
CONTENIDO: 1 Libre circulación de pacientes y receta electrónica en la UE 2 1 Se prohíbe la reproducción total o parcial del contenido de este "Boletín Europa al Día" sin citar la fuente o sin haber obtenido
INSTITUTO NACIONAL DE SALUD MENTAL HONORIO DELGADO HIDEYO NOGUCHI REGLAMENTO DEL COMITÉ FARMACOTERAPEUTICO
 INSTITUTO NACIONAL DE SALUD MENTAL HONORIO DELGADO HIDEYO NOGUCHI REGLAMENTO DEL COMITÉ FARMACOTERAPEUTICO 2014 REGLAMENTO DEL COMITÉ FARMACOTERAPEUTICO DEL INSTITUTO NACIONAL DE SALUD MENTAL HONORIO DELGADO
INSTITUTO NACIONAL DE SALUD MENTAL HONORIO DELGADO HIDEYO NOGUCHI REGLAMENTO DEL COMITÉ FARMACOTERAPEUTICO 2014 REGLAMENTO DEL COMITÉ FARMACOTERAPEUTICO DEL INSTITUTO NACIONAL DE SALUD MENTAL HONORIO DELGADO
RESUMEN GENERAL DE LA EVALUACIÓN CIENTÍFICA DE LOS MEDICAMENTOS A BASE DE ÁCIDO VALPROICO/VALPROATO (véase el anexo I)
 ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 108 CONCLUSIONES CIENTÍFICAS
ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 108 CONCLUSIONES CIENTÍFICAS
Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz
 Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz Necesidad de establecer equivalentes terapéuticos Los sistemas sanitarios deben buscar la máxima calidad
Ainhoa Quintana Servicio de Farmacia. Hospital Universitario de Álava Txagorritxu. Vitoria Gasteiz Necesidad de establecer equivalentes terapéuticos Los sistemas sanitarios deben buscar la máxima calidad
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. INTRODUCCION A LAS CIENCIAS FARMACIA OBJETIVO: Que el alumno conozca la historia, conceptos y evolución de la Farmacia.
 1. INTRODUCCION A LAS CIENCIAS FARMACIA OBJETIVO: Que el alumno conozca la historia, conceptos y evolución de la Farmacia. 1.1. Antecedentes históricos 1.2. Ciencia y arte de la Farmacia 1.3. Definiciones
1. INTRODUCCION A LAS CIENCIAS FARMACIA OBJETIVO: Que el alumno conozca la historia, conceptos y evolución de la Farmacia. 1.1. Antecedentes históricos 1.2. Ciencia y arte de la Farmacia 1.3. Definiciones
DOCUMENTO DE AYUDA PARA ELABORACIÓN DE RESÚMENES
 DOCUMENTO DE AYUDA PARA ELABORACIÓN DE RESÚMENES Los trabajos se podrán presentar bajo seis modalidades: 1. PROYECTOS DE INVESTIGACIÓN (cualitativa o cuantitativa) 2. REVISIONES BIBLIOGRAFICAS, DOCUMENTALES
DOCUMENTO DE AYUDA PARA ELABORACIÓN DE RESÚMENES Los trabajos se podrán presentar bajo seis modalidades: 1. PROYECTOS DE INVESTIGACIÓN (cualitativa o cuantitativa) 2. REVISIONES BIBLIOGRAFICAS, DOCUMENTALES
PRM, RNM, Seguimiento Farmacoterapéutico y sus características
 PRM, RNM, Seguimiento Farmacoterapéutico y sus características Daniel Sabater Hernández Grupo de Investigación en Atención Farmacéutica. Universidad de Granada. Resultados Negativos asociados a la Medicación
PRM, RNM, Seguimiento Farmacoterapéutico y sus características Daniel Sabater Hernández Grupo de Investigación en Atención Farmacéutica. Universidad de Granada. Resultados Negativos asociados a la Medicación
CER-MX-PROD-04 Suspensión, Retiro y Cancelación
 CER-MX-PROD-0 25 Jun 201 1 de 6 Elaboró: Coordinación de Calidad Deyanira Neri Revisó: Gerente Técnico Carlos Piña Aprobó: Gerente de Certificación Rodrigo Bustamante Registro de Cambios: Fecha de la Número
CER-MX-PROD-0 25 Jun 201 1 de 6 Elaboró: Coordinación de Calidad Deyanira Neri Revisó: Gerente Técnico Carlos Piña Aprobó: Gerente de Certificación Rodrigo Bustamante Registro de Cambios: Fecha de la Número
NORMA INTERNACIONAL DE AUDITORÍA 620
 NORMA INTERNACIONAL DE AUDITORÍA 620 USO DEL TRABAJO DE UN EXPERTO (Entra en vigor para auditorias de estados financieros por periodos que comiencen en o después del 15 de junio de 2005) CONTENIDO Párrafos
NORMA INTERNACIONAL DE AUDITORÍA 620 USO DEL TRABAJO DE UN EXPERTO (Entra en vigor para auditorias de estados financieros por periodos que comiencen en o después del 15 de junio de 2005) CONTENIDO Párrafos
MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS
 MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS COORDINADOR DEL CURSO Dr. Juan Ruiz-Canela. Médico especialista en Pediatría. Centro de Salud Virgen de África. Sevilla.
MANEJO DE LA ENFERMEDAD MENINGOCÓCICA INVASIVA (EMI) PARA FARMACÉUTICOS COMUNITARIOS COORDINADOR DEL CURSO Dr. Juan Ruiz-Canela. Médico especialista en Pediatría. Centro de Salud Virgen de África. Sevilla.
Prospecto: información para el usuario. LIZIPADOL 20 mg pastillas para chupar Ambroxol hidrocloruro
 Prospecto: información para el usuario LIZIPADOL 20 mg pastillas para chupar Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario LIZIPADOL 20 mg pastillas para chupar Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE
 TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), julio 2015 Índice
TASIGNA (NILOTINIB) INFORMACIÓN DE SEGURIDAD PARA EL PACIENTE Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), julio 2015 Índice
DIRECTIVA 2012/2/UE DE LA COMISIÓN
 ES L 37/60 Diario Oficial de la Unión Europea 10.2.2012 DIRECTIVAS DIRECTIVA 2012/2/UE DE LA COMISIÓN de 9 de febrero de 2012 por la que se modifica la Directiva 98/8/CE del Parlamento Europeo y del Consejo
ES L 37/60 Diario Oficial de la Unión Europea 10.2.2012 DIRECTIVAS DIRECTIVA 2012/2/UE DE LA COMISIÓN de 9 de febrero de 2012 por la que se modifica la Directiva 98/8/CE del Parlamento Europeo y del Consejo
PARLAMENTO EUROPEO. Comisión de Medio Ambiente, Salud Pública y Política del Consumidor
 PARLAMENTO EUROPEO 1999 2004 Comisión de Medio Ambiente, Salud Pública y Política del Consumidor 7 de mayo de 2003 PE 328.783/12-25 ENMIENDAS 12-25 Proyecto de opinión (PE 328.783) Bart Staes sobre la
PARLAMENTO EUROPEO 1999 2004 Comisión de Medio Ambiente, Salud Pública y Política del Consumidor 7 de mayo de 2003 PE 328.783/12-25 ENMIENDAS 12-25 Proyecto de opinión (PE 328.783) Bart Staes sobre la
CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE
 CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE Introducción La administración de medicamento es uno de los procedimientos que exige
CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE Introducción La administración de medicamento es uno de los procedimientos que exige
COQUELUCHE, TOS CONVULSA O PERTUSSIS. Definiciones de caso:
 COQUELUCHE, TOS CONVULSA O PERTUSSIS Definiciones de caso: Caso sospechoso Menores de 6 meses: Toda infección respiratoria aguda, con al menos uno de los siguientes síntomas: Apnea, cianosis, estridor
COQUELUCHE, TOS CONVULSA O PERTUSSIS Definiciones de caso: Caso sospechoso Menores de 6 meses: Toda infección respiratoria aguda, con al menos uno de los siguientes síntomas: Apnea, cianosis, estridor
Antecedentes y Toma de Conocimiento de las nuevas obligaciones de Información. Etapas del Proyecto. Análisis de impactos en procesos y sistemas
 PROYECTO DE IMPLEMENTACION NORMAS INTERNACIONALES DE INFORMACIÓN FINANCIERA (NIIF) Abril 2010 Contenido Antecedentes y Toma de Conocimiento de las nuevas obligaciones de Información Coordinador Responsable
PROYECTO DE IMPLEMENTACION NORMAS INTERNACIONALES DE INFORMACIÓN FINANCIERA (NIIF) Abril 2010 Contenido Antecedentes y Toma de Conocimiento de las nuevas obligaciones de Información Coordinador Responsable
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
 INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1. NOMBRE DEL MEDICAMENTO Disolgas 257,5 mg cápsulas blandas 2. PRINCIPIO(S) ACTIVO(S) 3. LISTA DE EXCIPIENTES Amarillo anaranjado S (E 110), azorrubina
SUBDIRECCIÓN DE REGISTRO SANITARIO GRUPO DE MEDICAMENTOS IN IMA
 SUBDIRECCIÓN DE GRUPO DE MEDICAMENTOS IN IMA Bogotá, Junio 2008 DECRETO 677 DE 1995 ARTICULO 27 COMISION REVISORA De la evaluación farmacológica Comprende el procedimiento mediante el cual la autoridad
SUBDIRECCIÓN DE GRUPO DE MEDICAMENTOS IN IMA Bogotá, Junio 2008 DECRETO 677 DE 1995 ARTICULO 27 COMISION REVISORA De la evaluación farmacológica Comprende el procedimiento mediante el cual la autoridad
Intervención enfermera en el Uso adecuado del Medicamento y Productos Sanitarios
 Intervención enfermera en el Uso adecuado del Medicamento y Productos Sanitarios Contenidos Introducción Uso Adecuado del Medicamento Selección e información de medicamentos Farmacovigilancia Módulo de
Intervención enfermera en el Uso adecuado del Medicamento y Productos Sanitarios Contenidos Introducción Uso Adecuado del Medicamento Selección e información de medicamentos Farmacovigilancia Módulo de
ADMINISTRACIÓN DE MEDICAMENTOS POR VÍA ORAL
 Página 1 de 5 ADMINISTRACIÓN DE MEDICAMENTOS POR VÍA ORAL 1.- OBJETIVO Proporcionar los conocimientos necesarios para administrar por vía oral, la medicación prescrita con fines diagnósticos y terapéuticos.
Página 1 de 5 ADMINISTRACIÓN DE MEDICAMENTOS POR VÍA ORAL 1.- OBJETIVO Proporcionar los conocimientos necesarios para administrar por vía oral, la medicación prescrita con fines diagnósticos y terapéuticos.
PROPUESTA DE DICTAMEN TÉCNICO PROPUESTA DE REVISIÓN 1A DEL PLAN DE EMERGENCIA INTERIOR EN PARADA DE CENTRAL NUCLEAR SANTA MARÍA DE GAROÑA
 PROPUESTA DE DICTAMEN TÉCNICO PROPUESTA DE REVISIÓN 1A DEL PLAN DE EMERGENCIA INTERIOR EN PARADA DE CENTRAL NUCLEAR SANTA MARÍA DE GAROÑA 1. IDENTIFICACIÓN 1.1 Solicitante: Nuclenor S.A. 1.2 Asunto: Solicitud
PROPUESTA DE DICTAMEN TÉCNICO PROPUESTA DE REVISIÓN 1A DEL PLAN DE EMERGENCIA INTERIOR EN PARADA DE CENTRAL NUCLEAR SANTA MARÍA DE GAROÑA 1. IDENTIFICACIÓN 1.1 Solicitante: Nuclenor S.A. 1.2 Asunto: Solicitud
Informe final de evaluación del seguimiento de la implantación de títulos oficiales MÁSTER UNIVERSITARIO EN MARKETING. Centro de Posgrado
 Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2015 MÁSTER UNIVERSITARIO EN MARKETING Universidad Carlos III de Madrid INFORMACIÓN PUBLICA Valoración Final Uno de los
Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2015 MÁSTER UNIVERSITARIO EN MARKETING Universidad Carlos III de Madrid INFORMACIÓN PUBLICA Valoración Final Uno de los
Atención Farmacéutica
 Atención Farmacéutica Los farmacéuticos, como parte del Sistema Nacional de Salud, comparten con los pacientes, los médicos, otros profesionales de la salud, y las Autoridades Sanitarias, la misión de
Atención Farmacéutica Los farmacéuticos, como parte del Sistema Nacional de Salud, comparten con los pacientes, los médicos, otros profesionales de la salud, y las Autoridades Sanitarias, la misión de
SEMINARIOS DE INNOVACIÓN EN ATENCIÓN PRIMARIA 2009
 SEMINARIOS DE INNOVACIÓN EN ATENCIÓN PRIMARIA 2009 Innovación en la toma de decisiones diagnósticas en la consulta médica de primaria: desde el punto de vista de la epidemiología Blanca Lumbreras Lacarra
SEMINARIOS DE INNOVACIÓN EN ATENCIÓN PRIMARIA 2009 Innovación en la toma de decisiones diagnósticas en la consulta médica de primaria: desde el punto de vista de la epidemiología Blanca Lumbreras Lacarra
(Texto pertinente a efectos del EEE)
 31.7.2014 L 228/5 REGLAMENTO DE EJECUCIÓN (UE) N o 828/2014 DE LA COMISIÓN de 30 de julio de 2014 relativo a los requisitos para la transmisión de información a los consumidores sobre la ausencia o la
31.7.2014 L 228/5 REGLAMENTO DE EJECUCIÓN (UE) N o 828/2014 DE LA COMISIÓN de 30 de julio de 2014 relativo a los requisitos para la transmisión de información a los consumidores sobre la ausencia o la
Documento nº 186 Informe de la Comisión Europea sobre la definición de «capital admisible»
 SERVICIO DE ASESORAMIENTO SOBRE EL SISTEMA BANCARIO ESPAÑOL (SASBE) Documento nº 186 Informe de la Comisión Europea sobre la definición de «capital admisible» 27 de Enero de 2016 Núm. de páginas: 8 C/
SERVICIO DE ASESORAMIENTO SOBRE EL SISTEMA BANCARIO ESPAÑOL (SASBE) Documento nº 186 Informe de la Comisión Europea sobre la definición de «capital admisible» 27 de Enero de 2016 Núm. de páginas: 8 C/
Tipos impositivos del IVA aplicados a productos y servicios para personas mayores
 Tipos impositivos del IVA aplicados a productos y servicios para personas mayores Directiva IVA - Conceptos Generales El sistema común del IVA está regulado en la actualidad por la Directiva 2006/112/CE,
Tipos impositivos del IVA aplicados a productos y servicios para personas mayores Directiva IVA - Conceptos Generales El sistema común del IVA está regulado en la actualidad por la Directiva 2006/112/CE,
NORMA INTERNACIONAL DE AUDITORÍA 320
 NORMA INTERNACIONAL DE AUDITORÍA 320 IMPORTANCIA RELATIVA DE LA AUDITORÍA (En vigor para auditorías de estados financieros por periodos que comiencen en o después del 15 de diciembre de 2004)* CONTENIDO
NORMA INTERNACIONAL DE AUDITORÍA 320 IMPORTANCIA RELATIVA DE LA AUDITORÍA (En vigor para auditorías de estados financieros por periodos que comiencen en o después del 15 de diciembre de 2004)* CONTENIDO
Los aditivos y conservantes en la UE. CIPA Cámara de Industriales de Productos Alimenticios
 Los aditivos y conservantes en la UE CIPA Cámara de Industriales de Productos Alimenticios c) NORMATIVA EUROPEA SOBRE ADITIVOS 1. Identificación de la normativa europea 1.1.El régimen general 1.2. Colorantes
Los aditivos y conservantes en la UE CIPA Cámara de Industriales de Productos Alimenticios c) NORMATIVA EUROPEA SOBRE ADITIVOS 1. Identificación de la normativa europea 1.1.El régimen general 1.2. Colorantes
Procedimiento Normalizado de Trabajo para la ejecución del Programa de Vacunación Lengua Azul
 Página 1 de 9 Procedimiento Normalizado de Trabajo para la ejecución del Programa de Vacunación Lengua Azul Realizado por: Revisado por: Aprobado por: SECCIÓN DE EPIDEMIOVIGILANCIA LA JEFA DE SERVICIO
Página 1 de 9 Procedimiento Normalizado de Trabajo para la ejecución del Programa de Vacunación Lengua Azul Realizado por: Revisado por: Aprobado por: SECCIÓN DE EPIDEMIOVIGILANCIA LA JEFA DE SERVICIO
PROGRAMA FIDES-AUDIT
 PROGRAMA FIDES-AUDIT INFORME FINAL DE EVALUACIÓN DEL DISEÑO DEL SISTEMA DE GARANTÍA INTERNA DE LA CALIDAD ESCUELA UNIVERSITARIA DE MAGISTERIO SEDES SAPIENTIAE SAN PABLO CEU UNIVERSIDADE DE VIGO 30/04/12
PROGRAMA FIDES-AUDIT INFORME FINAL DE EVALUACIÓN DEL DISEÑO DEL SISTEMA DE GARANTÍA INTERNA DE LA CALIDAD ESCUELA UNIVERSITARIA DE MAGISTERIO SEDES SAPIENTIAE SAN PABLO CEU UNIVERSIDADE DE VIGO 30/04/12
Documento Técnico NIA-ES Modelos de informes de auditoría
 Documento Técnico NIA-ES Modelos de informes de auditoría Febrero 2014/ Actualizado Febrero 2015 MODELOS DE INFORMES DE AUDITORÍA ADAPTADOS A LAS NIA-ES I. Informes de auditoría sobre CCAA/CCAACC con opinión
Documento Técnico NIA-ES Modelos de informes de auditoría Febrero 2014/ Actualizado Febrero 2015 MODELOS DE INFORMES DE AUDITORÍA ADAPTADOS A LAS NIA-ES I. Informes de auditoría sobre CCAA/CCAACC con opinión
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
FARMACOVIGILANCIA CONCEPTOS CONCEPT NORMA
 FARMACOVIGILANCIA CONCEPTOS NORMATIVOS FARMACOVIGILANCIA La Organización Mundial de la Salud define a la Farmacovigilancia como "la notificación, el registro y la evaluación sistemática de las Reacciones
FARMACOVIGILANCIA CONCEPTOS NORMATIVOS FARMACOVIGILANCIA La Organización Mundial de la Salud define a la Farmacovigilancia como "la notificación, el registro y la evaluación sistemática de las Reacciones
NORMAS INTERNACIONALES DE ASEGURAMIENTO DE LA INFORMACIÓN NAI
 NIA 700 Formación de la opinión y emisión del informe de auditoría NIA 701 Modificaciones al dictamen del auditor independiente NIA 705 Opinión modificada en el informe emitido por el auditor independiente
NIA 700 Formación de la opinión y emisión del informe de auditoría NIA 701 Modificaciones al dictamen del auditor independiente NIA 705 Opinión modificada en el informe emitido por el auditor independiente
PROCEDIMIENTO DE CODECISIÓN (REF.: COD).
 PROCEDIMIENTO DE CODECISIÓN (REF.: COD). El procedimiento de codecisión instaurado por el Tratado de la Unión Europea (Maastricht, 1992) aparece recogido en el artículo 251 del Tratado de la Unión Europea
PROCEDIMIENTO DE CODECISIÓN (REF.: COD). El procedimiento de codecisión instaurado por el Tratado de la Unión Europea (Maastricht, 1992) aparece recogido en el artículo 251 del Tratado de la Unión Europea
Anexo II. Conclusiones científicas y motivos para el dictamen positivo presentados por la Agencia Europea de Medicamentos
 Anexo II Conclusiones científicas y motivos para el dictamen positivo presentados por la Agencia Europea de Medicamentos 4 Conclusiones científicas Resumen general de la evaluación científica de Seasonique
Anexo II Conclusiones científicas y motivos para el dictamen positivo presentados por la Agencia Europea de Medicamentos 4 Conclusiones científicas Resumen general de la evaluación científica de Seasonique
CURSO DE AUDITORIA FINANCIERA
 CURSO DE AUDITORIA FINANCIERA Tema : FASE DE INFORME DE AUDITORIA Expositor : MBA C.P.C.C. Oscar Bruno Díaz Valdivieso Concepto NIA s relacionados Clases de Informe Dictamen de Auditoría Tipos de dictamen
CURSO DE AUDITORIA FINANCIERA Tema : FASE DE INFORME DE AUDITORIA Expositor : MBA C.P.C.C. Oscar Bruno Díaz Valdivieso Concepto NIA s relacionados Clases de Informe Dictamen de Auditoría Tipos de dictamen
Centro de Control Estatal de Equipos Médicos
 Ministerio de Salud Pública Centro de Control Estatal de Equipos Médicos C C E E M GUIA G E - 5 1996-12 12-27 GUÍA PARA LA APLICACIÓN DE LAS BUENAS PRÁCTICAS CLÍNICAS EN LA EJECUCIÓN DE LAS INVESTIGACIONES
Ministerio de Salud Pública Centro de Control Estatal de Equipos Médicos C C E E M GUIA G E - 5 1996-12 12-27 GUÍA PARA LA APLICACIÓN DE LAS BUENAS PRÁCTICAS CLÍNICAS EN LA EJECUCIÓN DE LAS INVESTIGACIONES
Política de incentivos. Esfera Capital Agencia de Valores, S.A.
 Política de incentivos. Esfera Capital Agencia de Valores, S.A. Aprobado por el Consejo de Administración de ESFERA CAPITAL AGENCIA DE VALORES, S.A. En su reunión del día XX de XXXXXXXX de XXXX. POLÍTICA
Política de incentivos. Esfera Capital Agencia de Valores, S.A. Aprobado por el Consejo de Administración de ESFERA CAPITAL AGENCIA DE VALORES, S.A. En su reunión del día XX de XXXXXXXX de XXXX. POLÍTICA
Adjunto se remite a las Delegaciones el documento de la Comisión D027686/02.
 CONSEJO DE LA UNIÓN EUROPEA Bruselas, 23 de julio de 2013 (OR. en) 12706/13 DENLEG 91 SAN 291 NOTA DE TRANSMISIÓN Emisor: Comisión Europea Fecha de recepción: 22 de julio de 2013 Destinatario: Secretaría
CONSEJO DE LA UNIÓN EUROPEA Bruselas, 23 de julio de 2013 (OR. en) 12706/13 DENLEG 91 SAN 291 NOTA DE TRANSMISIÓN Emisor: Comisión Europea Fecha de recepción: 22 de julio de 2013 Destinatario: Secretaría
PBS 8 Gestión de Riesgos y Controles Internos
 PBS 8 Gestión de Riesgos y Controles Internos Seminario de Capacitación en Seguros ASSAL - IAIS San José, Costa Rica 29 de Noviembre de 2016 M. Fernanda Plaza Superintendencia de Valores y Seguros - Chile
PBS 8 Gestión de Riesgos y Controles Internos Seminario de Capacitación en Seguros ASSAL - IAIS San José, Costa Rica 29 de Noviembre de 2016 M. Fernanda Plaza Superintendencia de Valores y Seguros - Chile
COMISIÓN DE LAS COMUNIDADES EUROPEAS. Propuesta de REGLAMENTO (UE) Nº /2011 DE LA COMISIÓN
 ES ES ES COMISIÓN DE LAS COMUNIDADES EUROPEAS Propuesta de Bruselas, XXX C REGLAMENTO (UE) Nº /2011 DE LA COMISIÓN de [ ] por el que se modifica el Reglamento (CE) nº 1702/2003 por el que se establecen
ES ES ES COMISIÓN DE LAS COMUNIDADES EUROPEAS Propuesta de Bruselas, XXX C REGLAMENTO (UE) Nº /2011 DE LA COMISIÓN de [ ] por el que se modifica el Reglamento (CE) nº 1702/2003 por el que se establecen
PERFIL DE INGRESO. CAPTACIÓN, SELECCIÓN Y ADMISIÓN DE ESTUDIANTES
 INDICE 1. OBJETO 2. ÁMBITO DE APLICACIÓN 3. DEFINICIONES 4. PARTICIPANTES Y RESPONSABILIDADES 5. DESARROLLO 5.1 Perfiles de ingreso y captación de alumnos 5.2 Selección y Admisión 6. MEDIDAS, ANÁLISIS
INDICE 1. OBJETO 2. ÁMBITO DE APLICACIÓN 3. DEFINICIONES 4. PARTICIPANTES Y RESPONSABILIDADES 5. DESARROLLO 5.1 Perfiles de ingreso y captación de alumnos 5.2 Selección y Admisión 6. MEDIDAS, ANÁLISIS
Informe final de evaluación del seguimiento de la implantación de títulos oficiales GRADO EN INGENIERÍA DE EDIFICACIÓN. Escuela Politécnica Superior
 Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2013 GRADO EN INGENIERÍA DE EDIFICACIÓN CEU INFORMACIÓN PUBLICA Valoración Final El título no aparece ofertado en la
Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2013 GRADO EN INGENIERÍA DE EDIFICACIÓN CEU INFORMACIÓN PUBLICA Valoración Final El título no aparece ofertado en la
Proceso de constitución de una alianza Herramienta 3. Elaboración de un mapa de recursos
 Elaboración de un mapa de recursos El presente documento incluye un modelo para elaborar un mapa de los recursos disponibles entre los asociados potenciales, así como una ficha sinóptica para el análisis
Elaboración de un mapa de recursos El presente documento incluye un modelo para elaborar un mapa de los recursos disponibles entre los asociados potenciales, así como una ficha sinóptica para el análisis
Formatos Oficiales para la notificación de sospechas de RAM
 Formatos Oficiales para la notificación de sospechas de RAM QFB Norma Ofelia Martínez Guerrero FORO DE FARMACOVIGILANCIA PARA PERSONAL DE FARMACIAS PUBLICAS Y PRIVADAS NOM-220 4.5. Los profesionales de
Formatos Oficiales para la notificación de sospechas de RAM QFB Norma Ofelia Martínez Guerrero FORO DE FARMACOVIGILANCIA PARA PERSONAL DE FARMACIAS PUBLICAS Y PRIVADAS NOM-220 4.5. Los profesionales de
GESTIÓN DE RECLAMACIONES Y SUGERENCIAS DEL TÍTULO SISTEMA DE GARANTÍA INTERNA DE CALIDAD
 Página 1 de 12 GESTIÓN DE RECLAMACIONES Y SUGERENCIAS DEL TÍTULO SISTEMA DE GARANTÍA INTERNA DE CALIDAD ÍNDICE 1. OBJETO... 2 2. ALCANCE... 2 3. NORMATIVA Y/O DOCUMENTOS DE REFERENCIA... 2 4. DEFINICIONES...
Página 1 de 12 GESTIÓN DE RECLAMACIONES Y SUGERENCIAS DEL TÍTULO SISTEMA DE GARANTÍA INTERNA DE CALIDAD ÍNDICE 1. OBJETO... 2 2. ALCANCE... 2 3. NORMATIVA Y/O DOCUMENTOS DE REFERENCIA... 2 4. DEFINICIONES...
PREVENCIÓN DE RIESGOS LABORALES vs PROTECCION DE DATOS DE CARÁCTER PERSONAL
 PREVENCIÓN DE RIESGOS LABORALES vs PROTECCION DE DATOS DE CARÁCTER PERSONAL NORMATIVA REGULADORA EN MATERIA DE PROTECCION DE DATOS DE CARÁCTER PERSONAL Ley Orgánica 15/1999, de 13 de diciembre. Transposición
PREVENCIÓN DE RIESGOS LABORALES vs PROTECCION DE DATOS DE CARÁCTER PERSONAL NORMATIVA REGULADORA EN MATERIA DE PROTECCION DE DATOS DE CARÁCTER PERSONAL Ley Orgánica 15/1999, de 13 de diciembre. Transposición
PROCEDIMIENTO GENERAL DE CALIDAD
 REVISION 5 Pág. 1 de 7 INDICE 1. OBJETO. 2. ALCANCE. 3. REFERENCIAS. 4. RESPONSABILIDADES. 5. DESCRIPCION. 6. ARCHIVO DE DOCUMENTACIÓN. Copia: CONTROLADA NO CONTROLADA Código de la Empresa ASIGNADA A:
REVISION 5 Pág. 1 de 7 INDICE 1. OBJETO. 2. ALCANCE. 3. REFERENCIAS. 4. RESPONSABILIDADES. 5. DESCRIPCION. 6. ARCHIVO DE DOCUMENTACIÓN. Copia: CONTROLADA NO CONTROLADA Código de la Empresa ASIGNADA A:
Modelos de informe sobre estados financieros intermedios de las entidades cotizadas
 Anexo Modelos de informe sobre estados financieros intermedios de las entidades cotizadas Índice Informes de revisión limitada estados financieros intermedios consolidados: - Informe de revisión limitada
Anexo Modelos de informe sobre estados financieros intermedios de las entidades cotizadas Índice Informes de revisión limitada estados financieros intermedios consolidados: - Informe de revisión limitada
SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS
 Publicaciones de la OPS/OMS sobre Control y Prevención del Cáncer Las publicaciones están disponibles en la página web de la OPS: www.paho.org/cancer SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS Cáncer en las
Publicaciones de la OPS/OMS sobre Control y Prevención del Cáncer Las publicaciones están disponibles en la página web de la OPS: www.paho.org/cancer SITUACIÓN DEL CÁNCER EN LAS AMÉRICAS Cáncer en las
SERVICIOS FARMACEUTICOS PROCEDIMIENTO DISPENSACION DE MEDICAMENTOS Y DISPOSITIVOS MEDICOS
 Página 1 de 6 1. OBJETIVO Describir la metodología a seguir para la dispensación de medicamentos, con el fin de lograr un correcto despacho de los medicamentos, acompañado de unas indicaciones indispensables
Página 1 de 6 1. OBJETIVO Describir la metodología a seguir para la dispensación de medicamentos, con el fin de lograr un correcto despacho de los medicamentos, acompañado de unas indicaciones indispensables
LA COOPERACIÓN ENTRE LA PROFESIÓN MÉDICA Y LA INDUSTRIA FARMACÉUTICA
 Declaración Conjunta 3 del CPME y de la EFPIA sobre LA COOPERACIÓN ENTRE LA PROFESIÓN MÉDICA Y LA INDUSTRIA FARMACÉUTICA Introducción 1. La profesión médica, representada por el Comité Permanente de Médicos
Declaración Conjunta 3 del CPME y de la EFPIA sobre LA COOPERACIÓN ENTRE LA PROFESIÓN MÉDICA Y LA INDUSTRIA FARMACÉUTICA Introducción 1. La profesión médica, representada por el Comité Permanente de Médicos
(Texto pertinente a efectos del EEE)
 L 179/26 REGLAMENTO DELEGADO (UE) N o 666/2014 DE LA COMISIÓN de 12 de marzo de 2014 que establece los requisitos sustantivos para el sistema de inventario de la Unión y toma en consideración las modificaciones
L 179/26 REGLAMENTO DELEGADO (UE) N o 666/2014 DE LA COMISIÓN de 12 de marzo de 2014 que establece los requisitos sustantivos para el sistema de inventario de la Unión y toma en consideración las modificaciones
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
LA ASOCIACIÓN INTERNACIONAL DE MARCAS COMENTARIOS AL MANUAL DE EXAMEN DE MARCAS DE LA SUPERINTEDENCIA DE COMERCIO
 655 Third Avenue, 10th Floor New York, NY 10017-5646, USA t: +1-212-642-1700 f: +1-212-768-7796 inta.org LA ASOCIACIÓN INTERNACIONAL DE MARCAS COMENTARIOS AL MANUAL DE EXAMEN DE MARCAS DE LA SUPERINTEDENCIA
655 Third Avenue, 10th Floor New York, NY 10017-5646, USA t: +1-212-642-1700 f: +1-212-768-7796 inta.org LA ASOCIACIÓN INTERNACIONAL DE MARCAS COMENTARIOS AL MANUAL DE EXAMEN DE MARCAS DE LA SUPERINTEDENCIA
Toctino (alitretinoína)
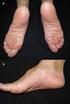 1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Informe final de evaluación del seguimiento de la implantación de títulos oficiales GRADO EN EDUCACIÓN PRIMARIA. Facultad de Ciencias Sociales UEM
 Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2014 GRADO EN EDUCACIÓN PRIMARIA Facultad de Ciencias Sociales UEM INFORMACIÓN PUBLICA Valoración Final La adaptación
Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2014 GRADO EN EDUCACIÓN PRIMARIA Facultad de Ciencias Sociales UEM INFORMACIÓN PUBLICA Valoración Final La adaptación
Política de facturación y cobros del centro médico Mercy
 Política de facturación y cobros del centro médico Mercy Objetivo de la política El centro médico Mercy, de acuerdo con su misión, visión y valores, se compromete a brindar atención médica de calidad y
Política de facturación y cobros del centro médico Mercy Objetivo de la política El centro médico Mercy, de acuerdo con su misión, visión y valores, se compromete a brindar atención médica de calidad y
PROYECTO DE INVESTIGACIÓN
 FACULTAD DE MEDICINA CLINICA ALEMANA UNIVERSIDAD DEL DESARROLLO CENTRO DE BIOÉTICA COMITÉ DE ÉTICA DE LA INVESTIGACIÓN Recepción: / / Código: (Uso Interno) PROYECTO DE INVESTIGACIÓN Título de Proyecto:.
FACULTAD DE MEDICINA CLINICA ALEMANA UNIVERSIDAD DEL DESARROLLO CENTRO DE BIOÉTICA COMITÉ DE ÉTICA DE LA INVESTIGACIÓN Recepción: / / Código: (Uso Interno) PROYECTO DE INVESTIGACIÓN Título de Proyecto:.
Escuela de Enfermería Fundación Jiménez Díaz Grado en Enfermería 9. Sistema de Garantía Interna de Calidad
 Escuela de Enfermería Fundación Jiménez Díaz 9. Sistema de Garantía Interna de Calidad 9.2. Procedimientos de evaluación y mejora de la calidad de la enseñanza y el profesorado 49 Escuela de Enfermería
Escuela de Enfermería Fundación Jiménez Díaz 9. Sistema de Garantía Interna de Calidad 9.2. Procedimientos de evaluación y mejora de la calidad de la enseñanza y el profesorado 49 Escuela de Enfermería
NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP)
 SUBDIRECCIÓN GENERAL DE PRODUCTOS SANITARIOS NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP) Ref.: 005/Marzo 2010 31 de marzo de 2010 Posible aumento de casos de rotura e inflamaciones locales
SUBDIRECCIÓN GENERAL DE PRODUCTOS SANITARIOS NOTA DE SEGURIDAD SOBRE PRÓTESIS MAMARIAS POLY IMPLANT (PIP) Ref.: 005/Marzo 2010 31 de marzo de 2010 Posible aumento de casos de rotura e inflamaciones locales
ISO 9001 Auditing Practices Group Guidance on:
 International Organization for Standardization International Accreditation Forum ISO 9001 Auditing Practices Group Guidance on: Auditando el proceso de Diseño y Desarrollo 1. Introducción El objetivo de
International Organization for Standardization International Accreditation Forum ISO 9001 Auditing Practices Group Guidance on: Auditando el proceso de Diseño y Desarrollo 1. Introducción El objetivo de
Informes Técnicos Sustentatorios
 Informes Técnicos Sustentatorios (ITS) de proyectos eléctricos SERVICIO NACIONAL DE CERTIFICACIÓN AMBIENTAL PARA LAS INVERSIONES SOSTENIBLES 2 1. Qué norma regula los Informes Técnicos Sustentatorios (ITS)
Informes Técnicos Sustentatorios (ITS) de proyectos eléctricos SERVICIO NACIONAL DE CERTIFICACIÓN AMBIENTAL PARA LAS INVERSIONES SOSTENIBLES 2 1. Qué norma regula los Informes Técnicos Sustentatorios (ITS)
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Informe final de evaluación del seguimiento de la implantación de títulos oficiales GRADO EN ARQUITECTURA. Escuela Politécnica Superior UFV
 Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2013 GRADO EN ARQUITECTURA UFV INFORMACIÓN PUBLICA Valoración Final Uno de los compromisos esenciales que las universidades
Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2013 GRADO EN ARQUITECTURA UFV INFORMACIÓN PUBLICA Valoración Final Uno de los compromisos esenciales que las universidades
La Empresa. PSST Control Operacional de la SST Norma OHSAS 18001:2007
 5.3.7 PSST 4.4.6 01 Control Operacional de la SST La Empresa PSST 4.4.6 01 Control Operacional de la SST Norma OHSAS 18001:2007 REGISTRO DE REVISIONES DE ESTE PROCEDIMIENTO Fecha Revisión Descripción de
5.3.7 PSST 4.4.6 01 Control Operacional de la SST La Empresa PSST 4.4.6 01 Control Operacional de la SST Norma OHSAS 18001:2007 REGISTRO DE REVISIONES DE ESTE PROCEDIMIENTO Fecha Revisión Descripción de
Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1)
 Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1) Colaboración Cochrane Antecedentes Las exacerbaciones agudas del asma son frecuentes y responsables de
Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1) Colaboración Cochrane Antecedentes Las exacerbaciones agudas del asma son frecuentes y responsables de
NORMA INTERNACIONAL DE AUDITORÍA 600. USO DEL TRABAJO DE OTRO AUDITOR (Esta declaración está en vigor) CONTENIDO. Párrafos Introducción...
 NORMA INTERNACIONAL DE AUDITORÍA 600 USO DEL TRABAJO DE OTRO AUDITOR (Esta declaración está en vigor) CONTENIDO Párrafos Introducción... 1-5 Aceptación corno auditor principal... 6 Los procedimientos del
NORMA INTERNACIONAL DE AUDITORÍA 600 USO DEL TRABAJO DE OTRO AUDITOR (Esta declaración está en vigor) CONTENIDO Párrafos Introducción... 1-5 Aceptación corno auditor principal... 6 Los procedimientos del
Situación del sarampión en Europa, España y C. Valenciana Años 2010 y 2011 (hasta la actualidad)
 Situación del sarampión en Europa, España y C. Valenciana Años y (hasta la actualidad) Situación del sarampión en Europa, años y primer trimestre de.- La incidencia de sarampión ha sufrido un incremento
Situación del sarampión en Europa, España y C. Valenciana Años y (hasta la actualidad) Situación del sarampión en Europa, años y primer trimestre de.- La incidencia de sarampión ha sufrido un incremento
PROGRAMA DE LA ASIGNATURA "Intervención Psicológica en Niños y Adolescentes" Máster Universitario en Psicología General Sanitaria
 PROGRAMA DE LA ASIGNATURA "Intervención Psicológica en Niños y Adolescentes" Máster Universitario en Psicología General Sanitaria Departamento de Personalidad,Evaluación y Tratam.Psicol. Facultad de Psicología
PROGRAMA DE LA ASIGNATURA "Intervención Psicológica en Niños y Adolescentes" Máster Universitario en Psicología General Sanitaria Departamento de Personalidad,Evaluación y Tratam.Psicol. Facultad de Psicología
Anexo II. Conclusiones científicas y motivos de la suspensión de la comercialización y el uso de los medicamentos presentados por la EMA
 Anexo II Conclusiones científicas y motivos de la suspensión de la comercialización y el uso de los medicamentos presentados por la EMA 14 Conclusiones científicas Resumen general de la evaluación científica
Anexo II Conclusiones científicas y motivos de la suspensión de la comercialización y el uso de los medicamentos presentados por la EMA 14 Conclusiones científicas Resumen general de la evaluación científica
VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA. Sandra Flores Moreno. AETSA 21 de Diciembre de 2006
 VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA Sandra Flores Moreno. AETSA 21 de Diciembre de 2006 VARIANTES EN EL DISEÑO DE ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA *INTRODUCCIÓN
VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA Sandra Flores Moreno. AETSA 21 de Diciembre de 2006 VARIANTES EN EL DISEÑO DE ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA *INTRODUCCIÓN
Informe final de evaluación del seguimiento de la implantación de títulos oficiales GRADO EN DERECHO
 Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2012 GRADO EN DERECHO Facultad de Ciencias Sociales, Jurídicas y Humanidades VALORACIÓN GLOBAL Información pública ofrecida
Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2012 GRADO EN DERECHO Facultad de Ciencias Sociales, Jurídicas y Humanidades VALORACIÓN GLOBAL Información pública ofrecida
