2.A) DETERMINACIÓN DEL COEFICIENTE ADIABATICO DEL AIRE. (Método de Clement-Desormes)
|
|
|
- Julia González Benítez
- hace 6 años
- Vistas:
Transcripción
1 - PRÁCTICA Nº2 TERMODINÁMICA - 2.A) DETERMINACIÓN DEL COEFICIENTE ADIABATICO DEL AIRE. (Método de Clement-Desormes) 2.B) DETERMINACIÓN DEL COEFICIENTE ADIABÁTICO DE GASES. (Oscilador de Flammersfeld) GRUPO Y MESA: V 17 S1 M2 Alumno: Nº Matrícula: Gr.Clase MATEO PRIETO; DIEGO M 201 RUAN; JUNCHAO M 201 RUIZ RUIZ; SERGIO M /10/ er Semestre - Curso:
2 INDICE: A. DET. EL COEFICIENTE ADIABÁTICO DEL AIRE Método de Clement Desormes A.1. Objetivo Pág. 1 A.2. Resumen Pág. 1 A.3. Materiales Pág. 1 A.4. Fundamento teórico Pág. 2, 3 y4 A.5. Procedimiento experimental Pág. 4 y 5 A.6. Cálculos y Gráficos Pág. 6 y 7 A.7. Cálculo de errores Pág. 7 y 8 A.8. Conclusiones Pág. 8 A.9. Bibliografía Pág. 8 B. DET. EL COEFICIENTE ADIABÁTICO DE GASES Oscilador de Flammersfeld B.1. Objetivo Pág. 9 B.2. Resumen Pág. 9 B.3. Materiales Pág. 9 B.4. Fundamento teórico Pág. 10 y 11 B.5. Procedimiento experimental Pág. 11 y 12 B.6. Cálculos Pág. 12 y 13 B.7. Cálculo de errores Pág. 13 B.8. Conclusiones Pág. 14 B.9. Bibliografía Pág. 14 0
3 A.1. OBJETIVO: El objetivo de esta práctica es observar el efecto térmico de la expansión adiabática de los gases. Determinar o medir la relación de los calores específicos del aire a presión constante y volumen constante (ϒ) de acuerdo con el método de Clement Desormes. A.2. RESUMEN: Determinaremos la relación (ϒ) entre los calores específicos de un gas, produciendo una compresión o expansión del gas a baja presión y temperatura ambiente contenido en un recipiente (botellón grande de cristal), pudiéndose entonces suponerse una compresión o expansión adiabática. A3. MATERIALES: a) Botellón de vidrio. b) Compresor de aire. c) Manómetro diferencial de agua. d) Tubo de goma. e) Llave de corte y material auxiliar. f) Cronómetro 1
4 A4. FUNDAMENTO TEÓRICO: (Obtenido del guion de la Práctica) El método de Clement Desormes se basa en el enfriamiento que se produce en un gas cuando se expande según un proceso adiabático. En esta práctica se realizarán expansiones bruscas que pueden considerarse adiabáticas pues, al ser rápidas, no hay tiempo para que el sistema reciba el calor equivalente al trabajo que realiza en la expansión. Según el Primer Principio de la Termodinámica, todo gas que se expande rápidamente contra la oposición de una fuerza exterior realiza trabajo a costa de su energía interna y se enfría. Como la expansión se considera adiabática:, : 0, : Lo contrario ocurre cuando el gas se comprime de forma adiabática que aumenta su energía interna y por tanto su temperatura aumenta. En el diagrama de la. 1 se representan dos isotermas, entre las que se producen los procesos: 1 2 enfriamiento del gas por expansión adiabática reversible, seguido de 2 3 que es un calentamiento a volumen constante, hasta la temperatura inicial. Cualquier estado definido por la terna de variables (p, V, T) se puede relacionar con otro mediante la ecuación de estado del gas ideal: 1. 1 Transformación isoterma La ley de Boyle es la ecuación que relaciona dos estados mediante una transformación isoterma: 2
5 La pendiente de una isoterma en un estado dado por las coordenadas (p, V, T) se obtiene derivando ambos miembros, es decir: p V 2 Transformación adiabática Según el Primer Principio se deduce para dos estados que se unen mediante una transformación adiabática:,, 2 Siendo el exponente la relación de los calores específicos molares a presión y volumen constante del gas, llamado también índice adiabático. La pendiente de la adiabática en dichas coordenadas, se obtiene derivando ambos miembros de la ecuación (2): 0 p V γ p V 3 Por lo tanto, la línea de un proceso adiabático tiene mayor pendiente 1 que otro proceso isotermo que arranque desde el mismo punto. En la figura 1 se ve gráficamente que un gas se enfría cuando se expande de forma adiabática y que el enfriamiento es mas grande cuanto mayor sea el valor de. Método de Clement y Desormes: El método consiste en medir la pendiente de una adiabática y de una isoterma porque de (2) y (3) se deduce que: p V p V 4 Para ello se parte de un punto, (1) de la Fig. 2, y se toman medidas de la presión del aire contenido en el botellón (Fig. 3), que se encuentra en los estados (1), (2) y (3) de la Fig. 2. En efecto, tenemos que: 3
6 o o La pendiente media en (1) de la transformación adiabática es:. La pendiente media en (1) de la isoterma es:. Por lo tanto, llevando estos resultados a (4), se obtiene que: A.5. PROCEDIMIENTO EXPERIMENTAL: La práctica del experimento de Clement Desormes consistió en Medir la relación de los calores específicos del aire a presión constante y volumen constante, es decir el coeficiente adiabático. o Para empezar con la práctica primero se realiza el montaje del material, que en nuestro caso ya estaba hecho, como se refleja en la siguiente figura. Se conectan la bomba y el manómetro al botellón de cristal,. 4
7 o Para iniciar la práctica, y con el recipiente a la presión atmosférica, introducimos aire con la bomba hasta obtener una presión, que mediremos con el manómetro. Para medir esta presión, deberemos dejar esperar unos dos minutos hasta que el aire dentro del botellón llegue a la temperatura ambiente y este equilibrado; anotando la diferencia de alturas existentes en el manómetro de agua. En este estado inicial tendremos: ó o A continuación dejamos salir el aire del botellón abriendo la llave de entrada de aire y cerrándola muy rápidamente, con lo que se conseguirá un proceso adiabático. En este estado tendremos P ó é. á ó o Seguidamente, se deja alcanzar de nuevo el equilibrio dentro del recipiente, hasta que la temperatura se iguale con la temperatura ambiente, (aproximadamente dos minutos, y se vuelve a anotar la diferencia de alturas existentes en el manómetro de agua. En este estado final tendríamos que P ó o o Repetiremos este procedimiento hasta 5 veces a fin de obtener la mayor cantidad de datos posible para obtener un buen resultado final. Por último, a partir de la demostración entre ecuaciones de las transformaciones adiabáticas e isotermas o isocoras, se obtiene que el coeficiente adiabático: Fórmula con la cual calcularemos los coeficientes adiabáticos en los 5 casos que realizaremos la práctica. 5
8 A.6. CÁLCULOS Y GRÁFICOS: (Clement Desormes): ** TABLA DE DATOS OBTENIDOS EN LA REALIZACIÓN DE LA PRÁCTICA Cálculo de γ:..... ** TABLA RESUMEN DE DATOS: ** GRÁFICO DE DISPERSIÓN Y RECTA DE REGRESIÓN: () () 6
9 ** CÁLCULO DEL COEFICIENTE ADIABÁTICO γ : De la recta de regresión, sabemos que su ecuación, al igual que la de cualquier otra recta genérica, es: Si cambiamos las ordenadas y las abscisas por nuestros valores, tenemos que la ecuación de la recta nos queda: De esta recta, nos interesa saber su pendiente, que corresponderá con el valor del coeficiente adiabático γ que estamos buscando. El valor de la ordenada en el origen, en este caso no nos interesa, asique lo podremos tomar como cero. Para calcular : A.7. ERRORES: Método 1 mínimos cuadrados : Cálculo del error referido a la ecuación de la recta, utilizando el método de los mínimos cuadrados, con las ordenadas y las abscisas de cada punto y el coeficiente adiabático calculado
10 5.... % Método 2: Cálculo del error suponiendo que los 5 coeficientes adiabáticos calculados al principio fueran medidas tomadas directamente de la práctica % El error asociado correcto sería el calculado por el Método 1, con lo cual finalmente tendríamos como resultado que: COEFICIENTE ADIABÁTICO γ: Clement Desormes.. A.8. CONCLUSIONES: Teniendo en cuenta el fundamento teórico de la práctica, sabiendo que el valor del coeficiente adiabático es un valor real en torno a 1.40, y que en nuestra práctica según nos indico el profesor, nos debería salir un valor de coeficiente adiabático entre: Podemos deducir, que midiendo las alturas manométricas, se puede estimar con aproximación el valor del coeficiente adiabático. A.9. BIBLIOGRAFÍA: Guiones de la práctica: mo_guion.pdf _resumen.pdf Hoja resumen: _outline.pdf 8
11 B.1. OBJETIVO: El objetivo de esta práctica es obtener el coeficiente adiabático del aire, utilizando el oscilador de Flammersfeld. B.2. RESUMEN: Utilizando el método de Rüchardt, esta práctica se basa en que una masa oscila sobre un volumen de gas en un tubo de vidrio de precisión. La oscilación se mantiene porque parte del gas escapa por una ranura y la masa baja, pero vuelve a ser empujada hacia arriba al ganar presión de nuevo el gas, proporcionada por la bomba. Se puede determinar el coeficiente adiabático de diferentes gases midiendo la oscilación periódica. B.3. MATERIALES: a) Bomba de aire. b) Pinza universal. c) Doble nuez d) Varilla cuadrada L=400 (mm) e) Trípode f) Cronometro g) Tapón de goma 26/32 (mm) h) Tapón de toma 17/22 (mm) i) Manguera de conexión j) Tubo de vidrio en angulo recto k) Tornillo micrométrico l) Botella decantadora 100 (ml) m) Regulador de aire n) Oscilador de gas Flammersfeld o) Cilindro graduado 100 (ml) p) Barometro de habitación q) Balanza de Precisión 9
12 B.4. FUNDAMENTO TEÓRICO: (Obtenido del guion de la Práctica) Con el fin de mantener una oscilación estable, no amortiguada, el gas tiene que escapar al exterior por medio de un agujero entre el tubo de vidrio y el oscilador. El oscilador inicialmente se puede situar por debajo de la apertura. El gas fluye ahora de nuevo en el sistema debido a que se acumula un ligero exceso de presión y esto obliga a que el oscilador suba. Tan pronto como el oscilador ha permitido el escape al exterior del aire por la abertura se pierde el exceso de presión y el oscilador baja y el proceso se repite indefinidamente. Si el cuerpo sufre oscilaciones respecto a la posición de equilibrio para una pequeña distancia, entonces cambia el Δ y la expresión para las fuerzas que se producen es: Δ Δ 1 ó ó ó é Dado que el proceso oscilatorio se lleva a cabo con relativa rapidez, se puede considerar como adiabático y utilizar la ecuación de un proceso adiabático. Diferenciando la anterior ecuación se obtiene: Dividiendo la expresión por : 0 0 Δ Δ 2 La sustitución de (2) en (1), con, nos permite obtener la frecuencia angular : 3 Teniendo en cuenta que podemos calcular el periodo de las oscilaciones meduante:.. 10
13 º Podemos calcular el factor como: Por último, sustituyendo la ecuación (4) en (3), se obtiene como resultado final que: 4 Despejando el coeficiente adiabático de la anterior ecuación: ó. á El Volumen se determina por pesada en vacío del oscilador y lleno de agua hasta la ranura que defina la posición de equilibrio: B.5. PROCEDIMIENTO EXPERIMENTAL: o Lo primero a realizar es el montaje de los instrumentos de la práctica según se indica en los esquemas del experimento del oscilador de Flammersfeld, pero en nuestro caso este montaje ya estaba resuelto. o Seguidamente, antes de poner en marcha la bomba de aire, tomamos las medidas de la masa y el diámetro del oscilador, que nos harán falta posteriormente para realizar los cálculos necesarios. En este paso hay que destacar el cuidado con el que se debe de tratar el oscilador, ya que es una pieza de precisión y mínimos daños en su superficie lo podrían inutilizar. o Posteriormente se pone en marcha la bomba de aire y se abre ligeramente la válvula para que exista un flujo de aire en el oscilador. o Con la válvula de aire abierta, se introduce el oscilador en su posición, con cuidado de que el aire no sea excesivo y el oscilador salga disparado hacia arriba. o Una vez este el oscilador en el interior del tubo, se gradúa la entrada de aire con la válvula hasta que se alcance una amplitud constante de las oscilaciones. 11
14 o Por último, estando el oscilador con amplitud constante, se toman los tiempos con el cronómetro de las oscilaciones que queremos medir. En nuestro caso tomamos 4 tiempos correspondientes a 20, 30, 40 y 50 oscilaciones. o NOTA: durante el proceso de toma de tiempos, no se debe de variar la entrada de aire por la válvula ni tocar ningún dispositivo de la práctica, ya que si por alguna razón se varía la amplitud de la oscilación en el transcurso de la práctica, el resultado será erróneo. o Por último, con los datos tomados en la práctica, se proceden a realizar los cálculos del coeficiente adiabático y su error mediante el método de medidas directas tomadas varias veces. B.6. CÁLCULOS (Oscilador de Flammersfeld): ** DATOS PREVIOS: á 1.17 ; ó é ó ** TABLA DE DATOS OBTENIDOS Nº de Oscilaciones Tiempo Periodo (T) ** CÁLCULO DE PRESIÓN INTERNA: Paso de la presión atmosférica de a
15 ó : ** CÁLCULO DEL COEFICIENTE ADIABÁTICO PARA CADA CASO γ: B.7. ERRORES: ** CÁLCULO DEL ERROR: % COEFICIENTE ADIABÁTICO γ: Oscilador de Flammersfeld.. 13
16 B.8. CONCLUSIONES: Al igual que en el caso de la práctica A, se sabe que el valor del coeficiente adiabático es un valor real en torno a 1.40, y que en nuestra práctica según nos indico el profesor, nos debería salir un valor de coeficiente adiabático entre: En nuestra práctica, existe una gran variación entre el coeficiente adiabático del aire calculado por el método de Clement Deformes y el calculado por el Oscilador de Flammersfeld. B.9. BIBLIOGRAFÍA: Guiones de la práctica: mo_guion.pdf _resumen.pdf Hoja resumen: _outline.pdf Adiabatic coefficient of gases Flammersfeld oscillator ja&ved=0ccqqfjaa&url=http%3a%2f%2fwww.nikhef.nl%2f~h73%2fkn1c%2fpraktikum%2fp hywe%2flep%2fexperim%2f3_2_05.pdf&ei=ahwguj7gjcudhqfbuidqdg&usg=afqjcnfpg2o faoevccapyp 4IxG t1gc2a 14
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Determinación de entalpías de vaporización
 Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo.
 ! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
Determinación de la relación Cp/Cv en gases
 Determinación de la relación p/v en gases Objetivo. En esta práctica se determinará la relación entre p/vγ o coeficiente isentrópico de un gas combinando un sencillo proceso de expansión en condiciones
Determinación de la relación p/v en gases Objetivo. En esta práctica se determinará la relación entre p/vγ o coeficiente isentrópico de un gas combinando un sencillo proceso de expansión en condiciones
DEPARTAMENTO DE INGENIERÍA QUÍMICA. Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESTADO NO ESTACIONARIO
 DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
DEPARAMENO DE INGENIERÍA QUÍMICA Laboratorio de Ingeniería Química BALANCE DE ENERGÍA EN ESADO NO ESACIONARIO 1. INRODUCCIÓN El sistema al que se va a plantear el balance de energía calorífica consiste
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
PRÁCTICA 2: CONDUCTIVIDAD TÉRMICA DE LOS METALES
 PRÁCTICA 2: CONDUCTIVIDAD TÉRMICA DE LOS METALES 1. OBJETIVO En esta práctica se determina la conductividad térmica del cobre y del aluminio midiendo el flujo de calor que atraviesa una barra de cada uno
PRÁCTICA 2: CONDUCTIVIDAD TÉRMICA DE LOS METALES 1. OBJETIVO En esta práctica se determina la conductividad térmica del cobre y del aluminio midiendo el flujo de calor que atraviesa una barra de cada uno
( Práctica nº 6 de 3º de la ESO curso )
 LEY DE GAY LUSSAC ( Práctica nº 6 de 3º de la ESO curso 2015 2016 ) Objetivos: A).- Significado del coeficiente de dilatación volumica (o cúbica ), B).- Comprobar la 1ª ley de Gay Lussac (se basa en la
LEY DE GAY LUSSAC ( Práctica nº 6 de 3º de la ESO curso 2015 2016 ) Objetivos: A).- Significado del coeficiente de dilatación volumica (o cúbica ), B).- Comprobar la 1ª ley de Gay Lussac (se basa en la
COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI
 Laboratorio de Física de Procesos Biológicos COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI Fecha: 13/1/006 1. Obetivo de la práctica Comprobación experimental de la ecuación de Bernoulli de la dinámica de fluidos
Laboratorio de Física de Procesos Biológicos COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI Fecha: 13/1/006 1. Obetivo de la práctica Comprobación experimental de la ecuación de Bernoulli de la dinámica de fluidos
PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]
![PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica] PROBLEMARIO No. 2. Veinte problemas con respuesta sobre los Temas 3 y 4 [Trabajo y Calor. Primera Ley de la Termodinámica]](/thumbs/50/26203302.jpg) Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
Universidad Simón olívar Departamento de Termodinámica y Fenómenos de Transferencia -Junio-007 TF - Termodinámica I Prof. Carlos Castillo PROLEMARIO No. Veinte problemas con respuesta sobre los Temas y
PRACTICA No. 3 EL ESTADO GASEOSO
 PRACTICA No. 3 EL ESTADO GASEOSO INTRODUCCION: Las sustancias en Estado Gaseoso tienen propiedades físicas y químicas que las hacen diferentes de otras que se encuentran en un estado físico distinto. A
PRACTICA No. 3 EL ESTADO GASEOSO INTRODUCCION: Las sustancias en Estado Gaseoso tienen propiedades físicas y químicas que las hacen diferentes de otras que se encuentran en un estado físico distinto. A
COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI
 Laboratorio de Física General (Fluidos) COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI Fecha: 0/10/013 1. Obetivo de la práctica Comprobación experimental de la ecuación de Bernoulli de la dinámica de fluidos
Laboratorio de Física General (Fluidos) COMPROBACIÓN DE LA ECUACIÓN DE BERNOULLI Fecha: 0/10/013 1. Obetivo de la práctica Comprobación experimental de la ecuación de Bernoulli de la dinámica de fluidos
Electricidad y calor
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor. Webpage: Departamento de Física Universidad de Sonora
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
DENSIDAD Y PESO ESPECÍFICO
 DENSIDAD Y PESO ESPECÍFICO Adaptación del Experimento Nº 2 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 43-47. Autorizado por el Autor. Materiales: Cilindros graduados
DENSIDAD Y PESO ESPECÍFICO Adaptación del Experimento Nº 2 de la Guía de Ensayos y Teoría del Error del profesor Ricardo Nitsche, página 43-47. Autorizado por el Autor. Materiales: Cilindros graduados
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
ANEXO 1. CALIBRADO DE LOS SENSORES.
 ANEXO 1. CALIBRADO DE LOS SENSORES. Las resistencias dependientes de la luz (LDR) varían su resistencia en función de la luz que reciben. Un incremento de la luz que reciben produce una disminución de
ANEXO 1. CALIBRADO DE LOS SENSORES. Las resistencias dependientes de la luz (LDR) varían su resistencia en función de la luz que reciben. Un incremento de la luz que reciben produce una disminución de
MEDIDA DE LA DENSIDAD DE UN CUERPO. DETERMINACIÓN DE π
 1 Objetivos Departamento de Física Curso cero MEDIDA DE LA DENSIDAD DE UN CUERPO. DETERMINACIÓN DE π Utilización de un calibre en la determinación de las dimensiones de un objeto y de una balanza digital
1 Objetivos Departamento de Física Curso cero MEDIDA DE LA DENSIDAD DE UN CUERPO. DETERMINACIÓN DE π Utilización de un calibre en la determinación de las dimensiones de un objeto y de una balanza digital
FUERZAS CONCURRENTES. Lorena Vera Ramírez 1, Iván Darío Díaz Roa 2. RESUMEN
 FUERZAS CONCURRENTES Lorena Vera Ramírez 1, Iván Darío Díaz Roa 2. RESUMEN En este laboratorio lo que se hizo inicialmente fue tomar diferentes masas y ponerlas en la mesa de fuerzas de esa manera precisar
FUERZAS CONCURRENTES Lorena Vera Ramírez 1, Iván Darío Díaz Roa 2. RESUMEN En este laboratorio lo que se hizo inicialmente fue tomar diferentes masas y ponerlas en la mesa de fuerzas de esa manera precisar
En la notación C(3) se indica el valor de la cuenta para 3 kilowatts-hora: C(3) = 60 (3) = 1.253
 Eje temático: Álgebra y funciones Contenidos: Operatoria con expresiones algebraicas Nivel: 2 Medio Funciones 1. Funciones En la vida diaria encontramos situaciones en las que aparecen valores que varían
Eje temático: Álgebra y funciones Contenidos: Operatoria con expresiones algebraicas Nivel: 2 Medio Funciones 1. Funciones En la vida diaria encontramos situaciones en las que aparecen valores que varían
PRÁCTICA: BANCO DE ENSAYO DE BOMBAS
 PRÁCTICA: BANCO DE ENSAYO DE BOMBAS htttp://www.uco.es/moodle Descripción del equipo y esquema de la instalación La instalación en la que se lleva a cabo esta práctica es un banco de ensayos preparado
PRÁCTICA: BANCO DE ENSAYO DE BOMBAS htttp://www.uco.es/moodle Descripción del equipo y esquema de la instalación La instalación en la que se lleva a cabo esta práctica es un banco de ensayos preparado
8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO
 8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO OBJETIVO El objetivo de la practica es determinar la densidad de un sólido. Para ello vamos a utilizar dos métodos: Método 1 : Cálculo de la densidad de un
8. DETERMINACIÓN DE LA DENSIDAD DE UN SÓLIDO OBJETIVO El objetivo de la practica es determinar la densidad de un sólido. Para ello vamos a utilizar dos métodos: Método 1 : Cálculo de la densidad de un
HIDRAULICA DE POTENCIA. Unidad 1. Bases físicas de la hidráulica
 HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
y 2 Considere que el viento no sopla en la dirección AB sino que lo hace de forma que v r
 P1. Anemometría sónica. Hoy en día, los Centros Meteorológicos disponen de aparatos muy sofisticados para medir la velocidad del viento que, además y simultáneamente, miden la temperatura del aire. El
P1. Anemometría sónica. Hoy en día, los Centros Meteorológicos disponen de aparatos muy sofisticados para medir la velocidad del viento que, además y simultáneamente, miden la temperatura del aire. El
Determinación de la constante de los gases ideales
 Prácticas de Química. Determinación de la constante de los gases ideales I. Introducción teórica y objetivos........................................ 2 II. Material................................................................
Prácticas de Química. Determinación de la constante de los gases ideales I. Introducción teórica y objetivos........................................ 2 II. Material................................................................
EFECTO JOULE-THOMSON
 PRACTICA nº 4 EFECTO JOULE-THOMSON Fundamentos teóricos El proceso de Joule-Thomson consiste en el paso de un gas desde un contenedor a presión constante a otro a presión también constante y menor (Pf
PRACTICA nº 4 EFECTO JOULE-THOMSON Fundamentos teóricos El proceso de Joule-Thomson consiste en el paso de un gas desde un contenedor a presión constante a otro a presión también constante y menor (Pf
ÓPTICA GEOMÉTRICA: REFLEXIÓN Y REFRACCIÓN DE LA LUZ
 1 ÓPTICA GEOMÉTRICA: REFLEXIÓN Y REFRACCIÓN DE LA LUZ INTRODUCCIÓN TEÓRICA: La característica fundamental de una onda propagándose por un medio es su velocidad (v), y naturalmente, cuando la onda cambia
1 ÓPTICA GEOMÉTRICA: REFLEXIÓN Y REFRACCIÓN DE LA LUZ INTRODUCCIÓN TEÓRICA: La característica fundamental de una onda propagándose por un medio es su velocidad (v), y naturalmente, cuando la onda cambia
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Prácticas de Laboratorio de Hidráulica
 Universidad Politécnica de Madrid E.T.S. Ingenieros de Caminos, Canales y Puertos Prácticas de Laboratorio de Hidráulica Jaime García Palacios Francisco V. Laguna Peñuelas 2010 Índice general 3. Venturi
Universidad Politécnica de Madrid E.T.S. Ingenieros de Caminos, Canales y Puertos Prácticas de Laboratorio de Hidráulica Jaime García Palacios Francisco V. Laguna Peñuelas 2010 Índice general 3. Venturi
Distancia focal de una lente convergente (método del desplazamiento) Fundamento
 Distancia focal de una lente convergente (método del desplazamiento) Fundamento En una lente convergente delgada se considera el eje principal como la recta perpendicular a la lente y que pasa por su centro.
Distancia focal de una lente convergente (método del desplazamiento) Fundamento En una lente convergente delgada se considera el eje principal como la recta perpendicular a la lente y que pasa por su centro.
Momento de Torsión Magnética
 Universidad Nacional Autónoma de Honduras Facultad de Ciencias Escuela de Física Momento de Torsión Magnética Elaborado por: Ing. Francisco Solórzano I. Objetivo. Determinar de forma experimental el momento
Universidad Nacional Autónoma de Honduras Facultad de Ciencias Escuela de Física Momento de Torsión Magnética Elaborado por: Ing. Francisco Solórzano I. Objetivo. Determinar de forma experimental el momento
Ejercicios relacionados con líquidos y sólidos
 Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Carlos Martínez B. Ley de Boyle. Carlos Javier Bernal Avila. Viernes, 29 de enero de 2010
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
Formatos para prácticas de laboratorio
 CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF-04 LABORATORIO DE NOMBRE DE LA PRÁCTICA MECÁNICA
CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF-04 LABORATORIO DE NOMBRE DE LA PRÁCTICA MECÁNICA
CAPITULO V TERMODINAMICA - 115 -
 CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
CAPIULO V ERMODINAMICA - 5 - 5. EL GAS IDEAL Es el conjunto de un gran número de partículas diminutas o puntuales, de simetría esférica, del mismo tamaño y de igual volumen, todas del mismo material. Por
V B. g (1) V B ) g, (2) +ρ B. =( m H. m H (3) ρ 1. ρ B. Aplicando al aire la ecuación de estado de los gases perfectos, en la forma.
 Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
Un globo de aire caliente de volumen =, m 3 está abierto por su parte inferior. La masa de la envoltura es =,87 kg y el volumen de la misma se considera despreciable. La temperatura inicial del aire es
- Determinar experimentalmente la relación entre la presión y el volumen. - Comprender la Ley de Boyle.
 LEY DE BOYLE Objetivos: - Determinar experimentalmente la relación entre la presión y el volumen. - Comprender la Ley de Boyle. Equipo y materiales: - Aparato de la Ley de Gases (pasco TD 8572) - Sensor
LEY DE BOYLE Objetivos: - Determinar experimentalmente la relación entre la presión y el volumen. - Comprender la Ley de Boyle. Equipo y materiales: - Aparato de la Ley de Gases (pasco TD 8572) - Sensor
LABORATORIO DE MECANICA SEDE VILLA DEL ROSARIO
 No 4 LABORATORIO DE MECANICA SEDE VILLA DEL ROSARIO MOVIMIENTO PARABOLICO DEPARTAMENTO DE FISICA Y GEOLOGIA UNIVERSIDAD DE PAMPLONA FACULTAD DE CIENCIAS BASICAS Objetivos Encontrar la velocidad inicial
No 4 LABORATORIO DE MECANICA SEDE VILLA DEL ROSARIO MOVIMIENTO PARABOLICO DEPARTAMENTO DE FISICA Y GEOLOGIA UNIVERSIDAD DE PAMPLONA FACULTAD DE CIENCIAS BASICAS Objetivos Encontrar la velocidad inicial
Termodinámica y Máquinas Térmicas
 Termodinámica y Máquinas Térmicas Tema 04. Funciones de Estado Inmaculada Fernández Diego Severiano F. Pérez Remesal Carlos J. Renedo Estébanez DPTO. DE INGENIERÍA ELÉCTRICA Y ENERGÉTICA Este tema se publica
Termodinámica y Máquinas Térmicas Tema 04. Funciones de Estado Inmaculada Fernández Diego Severiano F. Pérez Remesal Carlos J. Renedo Estébanez DPTO. DE INGENIERÍA ELÉCTRICA Y ENERGÉTICA Este tema se publica
INSTITUTO POLITÉCNICO NACIONAL
 INSTITUTO POLITÉCNICO NACIONAL Centro De Estudios Científicos Y Tecnológicos Wilfrido Massieu LABORATORIO DE FÍSICA II ALUMNO GRUPO EQUIPO PROFESOR FECHA CALIF. PRACTICA No. 7 I. NOMBRE: PRESION ATMOSFERICA.
INSTITUTO POLITÉCNICO NACIONAL Centro De Estudios Científicos Y Tecnológicos Wilfrido Massieu LABORATORIO DE FÍSICA II ALUMNO GRUPO EQUIPO PROFESOR FECHA CALIF. PRACTICA No. 7 I. NOMBRE: PRESION ATMOSFERICA.
LABORATORIO 6. TITULO : Propiedades de los Gases
 37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
Universidad Nacional de Córdoba. Facultad de Ciencias Exactas Físicas y Naturales. Cátedra de Mecánica de los Fluidos. Carrea de Ingeniería Civil
 Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón. Trabajo Práctico: Leyes de los gases
 Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
TRABAJO PRÁCTICO. Estudio de la compresión y expansión de gases ideales, en procesos adiabáticos e isotérmicos
 FACULTAD DE CIENCIAS EXACTAS, INGENIERÍA Y AGRIMENSURA ESCUELA DE CIENCIAS BÁSICAS DEPARTAMENTO DE FÍSICA Y QUÍMICA FÍSICA II - Termodinámica TRABAJO PRÁCTICO Estudio de la compresión y expansión de gases
FACULTAD DE CIENCIAS EXACTAS, INGENIERÍA Y AGRIMENSURA ESCUELA DE CIENCIAS BÁSICAS DEPARTAMENTO DE FÍSICA Y QUÍMICA FÍSICA II - Termodinámica TRABAJO PRÁCTICO Estudio de la compresión y expansión de gases
Cuando se enumeran todos los elementos que componen el conjunto. A = { 1, 2, 3, 4, 5 }
 LOS NÚMEROS REALES TEMA 1 IDEAS SOBRE CONJUNTOS Partiremos de la idea natural de conjunto y del conocimiento de si un elemento pertenece (* ) o no pertenece (* ) a un conjunto. Los conjuntos se pueden
LOS NÚMEROS REALES TEMA 1 IDEAS SOBRE CONJUNTOS Partiremos de la idea natural de conjunto y del conocimiento de si un elemento pertenece (* ) o no pertenece (* ) a un conjunto. Los conjuntos se pueden
Ley de Boyle. A temperatura constante, el volumen de una muestra dada de gas es inversamente proporcional a su presión
 LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
Introducción. Flujo Eléctrico.
 Introducción La descripción cualitativa del campo eléctrico mediante las líneas de fuerza, está relacionada con una ecuación matemática llamada Ley de Gauss, que relaciona el campo eléctrico sobre una
Introducción La descripción cualitativa del campo eléctrico mediante las líneas de fuerza, está relacionada con una ecuación matemática llamada Ley de Gauss, que relaciona el campo eléctrico sobre una
Capítulo 17. Temperatura. t(h) = 100 h h 0
 Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
Capítulo 17 Temperatura t(h) = 100 h h 0 h 1 00 h 0 rincipio cero de la termodinámica. Temperatura empírica. La temperatura empírica de un sistema en equilibrio termodinámico se puede asignar mediante
Péndulo en Plano Inclinado
 Péndulo en Plano nclinado Variación del Período en función de g Alejandra Barnfather: banfa@sion.com - Matías Benitez: matiasbenitez@fibertel.com.ar y Victoria Crawley: v_crawley@hotmail.com Resumen El
Péndulo en Plano nclinado Variación del Período en función de g Alejandra Barnfather: banfa@sion.com - Matías Benitez: matiasbenitez@fibertel.com.ar y Victoria Crawley: v_crawley@hotmail.com Resumen El
Representaciones gráficas: Método del Paralelogramo
 Representaciones gráficas: Método del Paralelogramo La relación funcional más simple entre dos variables es la línea recta. Sea entonces la variable independiente x y la variable dependiente y que se relacionan
Representaciones gráficas: Método del Paralelogramo La relación funcional más simple entre dos variables es la línea recta. Sea entonces la variable independiente x y la variable dependiente y que se relacionan
PRÁCTICA NÚMERO 13 DETERMINACIÓN DE CALOR ESPECÍFICO
 PRÁCTICA NÚMERO 13 DETERMINACIÓN DE CALOR ESPECÍFICO I. Objetivo Determinar el calor especíico de algunos materiales sólidos, usando el calorímetro y agua como sustancia cuyo valor de calor especíico es
PRÁCTICA NÚMERO 13 DETERMINACIÓN DE CALOR ESPECÍFICO I. Objetivo Determinar el calor especíico de algunos materiales sólidos, usando el calorímetro y agua como sustancia cuyo valor de calor especíico es
Formatos para prácticas de laboratorio
 CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF -01 1. INTRODUCCIÓN LABORATORIO DE NOMBRE DE LA
CARRERA PLAN DE ESTUDIO CLAVE DE UNIDAD DE APRENDIZAJE NOMBRE DE LA UNIDAD DE APRENDIZAJE ING. MECÁNICO 2009-2 12198 MECÁNICA DE FLUIDOS PRÁCTICA No. MF -01 1. INTRODUCCIÓN LABORATORIO DE NOMBRE DE LA
Laboratorio de Física para Ingeniería
 Laboratorio de para Ingeniería 1. Al medir la longitud de un cilindro se obtuvieron las siguientes medidas: x [cm] 8,45 8,10 8,40 8,55 8,45 8,30 Al expresar la medida en la forma x = x + x resulta: (a)
Laboratorio de para Ingeniería 1. Al medir la longitud de un cilindro se obtuvieron las siguientes medidas: x [cm] 8,45 8,10 8,40 8,55 8,45 8,30 Al expresar la medida en la forma x = x + x resulta: (a)
Refracción en lámina de caras planas y paralelas
 Refracción en lámina de caras planas y paralelas Fundamento Un medio material que esté formado por dos caras planas y paralelas, siendo su espesor e, forma lo que se llama una lámina de caras planas y
Refracción en lámina de caras planas y paralelas Fundamento Un medio material que esté formado por dos caras planas y paralelas, siendo su espesor e, forma lo que se llama una lámina de caras planas y
Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua.
 CAMBIOS DE FASE. OBJETIVO: Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua. INTRODUCCION. Los procesos
CAMBIOS DE FASE. OBJETIVO: Estudiar el fenómeno de trasferencia de calor en los procesos de fundido y evaporación del agua. Calcular el calor latente de vaporización del agua. INTRODUCCION. Los procesos
Práctica No 2. Determinación experimental del factor de compresibilidad
 Práctica No 2 Determinación experimental del factor de compresibilidad 1. Objetivo general: Determinación del comportamiento de un gas a diferentes presiones, mediante el cálculo experimental del factor
Práctica No 2 Determinación experimental del factor de compresibilidad 1. Objetivo general: Determinación del comportamiento de un gas a diferentes presiones, mediante el cálculo experimental del factor
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
1. FLUIDOS (1 punto) Enuncie la ecuación de Bernoulli y describa cada uno de los términos.
 Física Forestales. Examen A. 7-0-0 Instrucciones. La parte de teoría se contestará en primer lugar utilizando la hoja de color, sin consultar libros ni apuntes, durante el tiempo que el estudiante considere
Física Forestales. Examen A. 7-0-0 Instrucciones. La parte de teoría se contestará en primer lugar utilizando la hoja de color, sin consultar libros ni apuntes, durante el tiempo que el estudiante considere
SESIÓN 11 DERIVACIÓN DE FUNCIONES TRIGONOMETRICAS INVERSAS
 SESIÓN 11 DERIVACIÓN DE FUNCIONES TRIGONOMETRICAS INVERSAS I. CONTENIDOS: 1. Función inversa, conceptos y definiciones 2. Derivación de funciones trigonométricas inversas 3. Ejercicios resueltos 4. Estrategias
SESIÓN 11 DERIVACIÓN DE FUNCIONES TRIGONOMETRICAS INVERSAS I. CONTENIDOS: 1. Función inversa, conceptos y definiciones 2. Derivación de funciones trigonométricas inversas 3. Ejercicios resueltos 4. Estrategias
Capítulo 10. Efectos de superficie. Sistema respiratorio
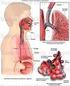 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
1. Caso no lineal: ajuste de una función potencial
 1. Caso no lineal: ajuste de una función potencial La presión (P) y el volumen (V ) en un tipo de gas están ligados por una ecuación del tipo PV b = a, siendo a y b dos parámetros desconocidos. A partir
1. Caso no lineal: ajuste de una función potencial La presión (P) y el volumen (V ) en un tipo de gas están ligados por una ecuación del tipo PV b = a, siendo a y b dos parámetros desconocidos. A partir
LABORATORIO Nº 1 MOVIMIENTO EN CAÍDA LIBRE
 LABORATORIO Nº 1 MOVIMIENTO EN CAÍDA LIBRE I. LOGROS Determinar experimentalmente el valor de la aceleración de la gravedad. Analizar el movimiento de un cuerpo mediante el Software Logger Pro. Identificar
LABORATORIO Nº 1 MOVIMIENTO EN CAÍDA LIBRE I. LOGROS Determinar experimentalmente el valor de la aceleración de la gravedad. Analizar el movimiento de un cuerpo mediante el Software Logger Pro. Identificar
, (1) = 344 (3) (2) sonido
 !"" # # " $% " %& % % ' %& (% ) $ *!+& ' 1. INTRODUCCIÓN: En esta práctica estudiaremos la propagación de ondas sonoras (ondas armónicas producidas por un diapasón*) en el interior de un tubo semiabierto,
!"" # # " $% " %& % % ' %& (% ) $ *!+& ' 1. INTRODUCCIÓN: En esta práctica estudiaremos la propagación de ondas sonoras (ondas armónicas producidas por un diapasón*) en el interior de un tubo semiabierto,
PROBLEMAS ONDAS ESTACIONARIAS. Autor: José Antonio Diego Vives
 PROBLEMAS DE ONDAS ESACIONARIAS Autor: José Antonio Diego Vives Problema 1 Una cuerda de violín de L = 31,6 cm de longitud y = 0,065 g/m de densidad lineal, se coloca próxima a un altavoz alimentado por
PROBLEMAS DE ONDAS ESACIONARIAS Autor: José Antonio Diego Vives Problema 1 Una cuerda de violín de L = 31,6 cm de longitud y = 0,065 g/m de densidad lineal, se coloca próxima a un altavoz alimentado por
TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1
 TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1 CARACTERÍSTICAS DE LAS REACCIONES HOMOGÉNEAS Todas las sustancias reaccionantes se encuentran en una sola fase Velocidad de reacción: Objetivo principal
TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1 CARACTERÍSTICAS DE LAS REACCIONES HOMOGÉNEAS Todas las sustancias reaccionantes se encuentran en una sola fase Velocidad de reacción: Objetivo principal
PRÁCTICA 4 ESTUDIO DEL RESORTE
 INGENIERÍA QUÍICA 1 er curso FUNDAENTOS FÍSICOS DE LA INGENIERÍA PRÁCTICA 4 ESTUDIO DEL RESORTE Departamento de Física Aplicada Escuela Politécnica Superior de la Rábida. 1 IV. Estudio del resorte 1. Objetivos
INGENIERÍA QUÍICA 1 er curso FUNDAENTOS FÍSICOS DE LA INGENIERÍA PRÁCTICA 4 ESTUDIO DEL RESORTE Departamento de Física Aplicada Escuela Politécnica Superior de la Rábida. 1 IV. Estudio del resorte 1. Objetivos
GEOMETRIA ANALITICA- GUIA DE EJERCICIOS DE LA RECTA Y CIRCUNFERENCIA PROF. ANNA LUQUE
 Ejercicios resueltos de la Recta 1. Hallar la ecuación de la recta que pasa por el punto (4. - 1) y tiene un ángulo de inclinación de 135º. SOLUCION: Graficamos La ecuación de la recta se busca por medio
Ejercicios resueltos de la Recta 1. Hallar la ecuación de la recta que pasa por el punto (4. - 1) y tiene un ángulo de inclinación de 135º. SOLUCION: Graficamos La ecuación de la recta se busca por medio
Slide 1 / 71. Movimiento Armónico Simple
 Slide 1 / 71 Movimiento Armónico Simple Slide 2 / 71 MAS y Movimiento Circular Hay una profunda conexión entre el Movimiento armónico simple (MAS) y el Movimiento Circular Uniforme (MCU). Movimiento armónico
Slide 1 / 71 Movimiento Armónico Simple Slide 2 / 71 MAS y Movimiento Circular Hay una profunda conexión entre el Movimiento armónico simple (MAS) y el Movimiento Circular Uniforme (MCU). Movimiento armónico
Práctica 5: El telemicroscopio
 LABORATORIO DE ÓPTICA (ÓPTICA INSTRUMENTAL) CURSO 009/10 Práctica 5: El telemicroscopio 5.1 Objetivo de la práctica El objetivo de esta práctica es el estudio y comprensión de los fundamentos ópticos del
LABORATORIO DE ÓPTICA (ÓPTICA INSTRUMENTAL) CURSO 009/10 Práctica 5: El telemicroscopio 5.1 Objetivo de la práctica El objetivo de esta práctica es el estudio y comprensión de los fundamentos ópticos del
PRÁCTICA Nº.- LENTES.
 PRÁCTICA Nº.- LENTES. Objetivo: Estudiar la ormación de imágenes de lentes delgadas y determinar la distancia ocal y la potencia de una lente convergente y de una lente divergente. undamento teórico: La
PRÁCTICA Nº.- LENTES. Objetivo: Estudiar la ormación de imágenes de lentes delgadas y determinar la distancia ocal y la potencia de una lente convergente y de una lente divergente. undamento teórico: La
DINÁMICA DE ROTACIÓN DE UN SÓLIDO
 Laboratorio de Física General Primer Curso (Mecánica) DINÁMICA DE ROTACIÓN DE UN SÓLIDO Fecha: 07/02/05 1. Objetivo de la práctica Estudio de la ley de la dinámica de rotación de un sólido rígido alrededor
Laboratorio de Física General Primer Curso (Mecánica) DINÁMICA DE ROTACIÓN DE UN SÓLIDO Fecha: 07/02/05 1. Objetivo de la práctica Estudio de la ley de la dinámica de rotación de un sólido rígido alrededor
MEDIDA DE POTENCIA EN TRIFÁSICA MÉTODO DE LOS DOS VATÍMETROS
 Práctica Nº 6 MEDID DE POTENI EN TRIFÁSI MÉTODO DE OS DOS VTÍMETROS 1. Objetivos a) Medida de la potencia activa, reactiva y el factor de potencia, en una red trifásica a tres hilos (sin neutro), utilizando
Práctica Nº 6 MEDID DE POTENI EN TRIFÁSI MÉTODO DE OS DOS VTÍMETROS 1. Objetivos a) Medida de la potencia activa, reactiva y el factor de potencia, en una red trifásica a tres hilos (sin neutro), utilizando
3. VÁLVULAS DE SERVICIO, VACÍO Y CARGA DE REFRIGERANTE
 Guía de Instalación 3. VÁLVULAS DE SERVICIO, VACÍO Y CARGA DE REFRIGERANTE 3.1. VALVULAS DE SERVICIO Válvula de 2 vías (líquido) Válvula de 3 vías (gas) Operación Posición de la llave Posición de la llave
Guía de Instalación 3. VÁLVULAS DE SERVICIO, VACÍO Y CARGA DE REFRIGERANTE 3.1. VALVULAS DE SERVICIO Válvula de 2 vías (líquido) Válvula de 3 vías (gas) Operación Posición de la llave Posición de la llave
Volumen de Sólidos de Revolución
 60 CAPÍTULO 4 Volumen de Sólidos de Revolución 6 Volumen de sólidos de revolución Cuando una región del plano de coordenadas gira alrededor de una recta l, se genera un cuerpo geométrico denominado sólido
60 CAPÍTULO 4 Volumen de Sólidos de Revolución 6 Volumen de sólidos de revolución Cuando una región del plano de coordenadas gira alrededor de una recta l, se genera un cuerpo geométrico denominado sólido
REGRESIÓN LINEAL SIMPLE, COEFICIENTE DE DETERMINACIÓN Y CORRELACIONES (EJERCICIOS RESUELTOS)
 1 REGRESIÓN LINEAL SIMPLE, COEFICIENTE DE DETERMINACIÓN Y CORRELACIONES (EJERCICIOS RESUELTOS) 1. EN LA REGIÓN DE DRAKUL DE LA REPÚBLICA DE NECROLANDIA, LAS AUTORIDADES ECONÓMICAS HAN REALIZADO UNA REVISIÓN
1 REGRESIÓN LINEAL SIMPLE, COEFICIENTE DE DETERMINACIÓN Y CORRELACIONES (EJERCICIOS RESUELTOS) 1. EN LA REGIÓN DE DRAKUL DE LA REPÚBLICA DE NECROLANDIA, LAS AUTORIDADES ECONÓMICAS HAN REALIZADO UNA REVISIÓN
Campo Magnético en un alambre recto.
 Campo Magnético en un alambre recto. A.M. Velasco (133384) J.P. Soler (133380) O.A. Botina (133268) Departamento de física, facultad de ciencias, Universidad Nacional de Colombia Resumen. Se hizo pasar
Campo Magnético en un alambre recto. A.M. Velasco (133384) J.P. Soler (133380) O.A. Botina (133268) Departamento de física, facultad de ciencias, Universidad Nacional de Colombia Resumen. Se hizo pasar
UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS LABORATORIO DE FÍSICA ASIGNATURA: ELECTRICIDAD Y MAGNETISMO
 UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS LABORATORIO DE FÍSICA ASIGNATURA: ELECTRICIDAD Y MAGNETISMO I. OBJETIVOS LABORATORIO 2: CAMPO Y POTENCIAL ELÉCTRICO Determinar la relación entre la
UNIVERSIDAD DON BOSCO DEPARTAMENTO DE CIENCIAS BÁSICAS LABORATORIO DE FÍSICA ASIGNATURA: ELECTRICIDAD Y MAGNETISMO I. OBJETIVOS LABORATORIO 2: CAMPO Y POTENCIAL ELÉCTRICO Determinar la relación entre la
Determinación de oxidantes totales en aire
 Práctica 5 Determinación de oxidantes totales en aire 1. Introducción Los oxidantes atmosféricos son contaminantes secundarios producidos fotoquímicamente en la fase gaseosa y en aerosoles a partir de
Práctica 5 Determinación de oxidantes totales en aire 1. Introducción Los oxidantes atmosféricos son contaminantes secundarios producidos fotoquímicamente en la fase gaseosa y en aerosoles a partir de
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES. Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile
 Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
La energía interna. Nombre Curso Fecha
 Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
APARATO DE VENTURI. Esta relación es conocida como la ecuación de continuidad, y es expresada como: (1) ν ν
 APARATO DE VENTURI Objetivo Estudiar cualitativamente y cuantitativamente para verificar la ecuación de continuidad, el principio de Bernoulli y el efecto Venturi. Introducción En el aparato de Venturi,
APARATO DE VENTURI Objetivo Estudiar cualitativamente y cuantitativamente para verificar la ecuación de continuidad, el principio de Bernoulli y el efecto Venturi. Introducción En el aparato de Venturi,
GUIAS ÚNICAS DE LABORATORIO DE FÍSICA I TRABAJO Y ENERGIA COEFICIENTE DE FRICCIÒN
 GUIAS ÚNICAS DE LABORATORIO DE FÍSICA I TRABAJO Y ENERGIA COEFICIENTE DE FRICCIÒN SANTIAGO DE CALI UNIVERSIDAD SANTIAGO DE CALI DEPARTAMENTO DE LABORATORIOS COEFICIENTE DE FRICCIÓN 1. OBJETIVO Estudio
GUIAS ÚNICAS DE LABORATORIO DE FÍSICA I TRABAJO Y ENERGIA COEFICIENTE DE FRICCIÒN SANTIAGO DE CALI UNIVERSIDAD SANTIAGO DE CALI DEPARTAMENTO DE LABORATORIOS COEFICIENTE DE FRICCIÓN 1. OBJETIVO Estudio
Termodinámica del aire: experimento de expansión adiabática de un gas y medida de γ = C p / C v con el método de Clément y Desormes (*)
 Termodinámica del aire: experimento de expansión adiabática de un gas y medida de γ = C p / C v con el método de Clément y Desormes (*) 1. Introducción El cociente de calores específicos a presión constante
Termodinámica del aire: experimento de expansión adiabática de un gas y medida de γ = C p / C v con el método de Clément y Desormes (*) 1. Introducción El cociente de calores específicos a presión constante
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA
 TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
TRABAJO PRÁCTICO N 0 3 TERMOQUÍMICA OBJETIVOS Determinación de la variación de entalpía asociada a procesos químicos. Aplicación de conceptos termodinámicos: temperatura, calor, entalpía. Verificación
5 9 9t F -15t F =-480; t F =80ºF, como se indica en b.
 Termodinámica 3. Temperatura. Escalas termométricas (continuación) 41. Una temperatura en la escala Fahrenheit se expresa por un número, que es el triple del correspondiente en la escala Celsius. Dicha
Termodinámica 3. Temperatura. Escalas termométricas (continuación) 41. Una temperatura en la escala Fahrenheit se expresa por un número, que es el triple del correspondiente en la escala Celsius. Dicha
Tema 2. Descripción Conjunta de Varias Variables
 Tema 2. Descripción Conjunta de Varias Variables Cuestiones de Verdadero/Falso 1. La covarianza mide la relación lineal entre dos variables, pero depende de las unidades de medida utilizadas. 2. El análisis
Tema 2. Descripción Conjunta de Varias Variables Cuestiones de Verdadero/Falso 1. La covarianza mide la relación lineal entre dos variables, pero depende de las unidades de medida utilizadas. 2. El análisis
GEOMETRÍA ANALÍTICA LA CIRCUNFERENCIA
 LA CIRCUNFERENCIA CONTENIDO. Ecuación común de la circunferencia Ejemplos. Ecuación general de la circunferencia. Análisis de la ecuación. Ejercicios Estudiaremos cuatro curvas que por su importancia aplicaciones
LA CIRCUNFERENCIA CONTENIDO. Ecuación común de la circunferencia Ejemplos. Ecuación general de la circunferencia. Análisis de la ecuación. Ejercicios Estudiaremos cuatro curvas que por su importancia aplicaciones
VII Congreso Nacional de Ciencias Exploraciones fuera y dentro del aula 26 y 27 de agosto, 2005 INBioparque, Santo Domingo de Heredia, Costa Rica
 VII Congreso Nacional de Ciencias Exploraciones fuera y dentro del aula 26 y 27 de agosto, 2005 INBioparque, Santo Domingo de Heredia, Costa Rica EXPERIMENTOS EN CIENCIAS: ESTÁTICA DE FLUIDOS Ing. Carlos
VII Congreso Nacional de Ciencias Exploraciones fuera y dentro del aula 26 y 27 de agosto, 2005 INBioparque, Santo Domingo de Heredia, Costa Rica EXPERIMENTOS EN CIENCIAS: ESTÁTICA DE FLUIDOS Ing. Carlos
La bombilla consume una potencia de 60 W y sabemos que la potencia viene dada por la ecuación:
 Problema resuelto Nº 1 (Fuente Enunciado: IES VICTORIA KENT.ACL. : A. Zaragoza López) 1. Una bombilla lleva la inscripción 60 W, 220 V. Calcula: a) La intensidad de la corriente que circula por ella; la
Problema resuelto Nº 1 (Fuente Enunciado: IES VICTORIA KENT.ACL. : A. Zaragoza López) 1. Una bombilla lleva la inscripción 60 W, 220 V. Calcula: a) La intensidad de la corriente que circula por ella; la
Red de difracción (medida de λ del láser) Fundamento
 Red de difracción (medida de λ del láser) Fundamento Si sobre una superficie transparente marcamos en un gran número de rayas paralelas y equidistantes tendremos una red de difracción. El número de rayas
Red de difracción (medida de λ del láser) Fundamento Si sobre una superficie transparente marcamos en un gran número de rayas paralelas y equidistantes tendremos una red de difracción. El número de rayas
ANEXO 3. GUÍA DE ACTIVIDADES DE UNA ASIGNATURA DE EXPERIMENTACIÓN EN INGENIERÍA QUÍMICA
 ANEXO 3. GUÍA DE DE UNA ASIGNATURA DE EXPERIMENTACIÓN EN INGENIERÍA QUÍMICA Semana 1: guía de las actividades Durante esta semana, tienes que hacer las actividades siguientes: 1. Sesión presencial (2 horas)
ANEXO 3. GUÍA DE DE UNA ASIGNATURA DE EXPERIMENTACIÓN EN INGENIERÍA QUÍMICA Semana 1: guía de las actividades Durante esta semana, tienes que hacer las actividades siguientes: 1. Sesión presencial (2 horas)
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN ÍNDICE
 CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
Deducir la ley de Hooke a partir de la experimentación. Identificar los pasos del método científico en el desarrollo de este experimento.
 LABORATORIO DE FISICA I LEY DE HOOKE UNIVERSIDAD TECNOLÓGICA DE PEREIRA PEREIRA RISARALDA OBJETIVOS Verificar la existencia de fuerzas recuperadas. Identificar las características de estas fuerzas. Deducir
LABORATORIO DE FISICA I LEY DE HOOKE UNIVERSIDAD TECNOLÓGICA DE PEREIRA PEREIRA RISARALDA OBJETIVOS Verificar la existencia de fuerzas recuperadas. Identificar las características de estas fuerzas. Deducir
SESIÓN 6 INTERPRETACION GEOMETRICA DE LA DERIVADA, REGLA GENERAL PARA DERIVACIÓN, REGLAS PARA DERIVAR FUNCIONES ALGEBRAICAS.
 SESIÓN 6 INTERPRETACION GEOMETRICA DE LA DERIVADA, REGLA GENERAL PARA DERIVACIÓN, REGLAS PARA DERIVAR FUNCIONES ALGEBRAICAS. I. CONTENIDOS: 1. Interpretación geométrica de la derivada 2. Regla general
SESIÓN 6 INTERPRETACION GEOMETRICA DE LA DERIVADA, REGLA GENERAL PARA DERIVACIÓN, REGLAS PARA DERIVAR FUNCIONES ALGEBRAICAS. I. CONTENIDOS: 1. Interpretación geométrica de la derivada 2. Regla general
MEDICIÓN DEL VOLUMEN
 MEDICIÓN DEL VOLUMEN CONCEPTOS BÁSICOS Volumen: porción de espacio que ocupa un cuerpo ya sea sólido, líquido o gaseoso. Capacidad: es el volumen de un fluido que puede contener o suministrar un instrumento
MEDICIÓN DEL VOLUMEN CONCEPTOS BÁSICOS Volumen: porción de espacio que ocupa un cuerpo ya sea sólido, líquido o gaseoso. Capacidad: es el volumen de un fluido que puede contener o suministrar un instrumento
La representación gráfica de una función cuadrática es una parábola.
 Función Cuadrática A la función polinómica de segundo grado +bx+c, siendo a, b, c números reales y, se la denomina función cuadrática. Los términos de la función reciben los siguientes nombres: La representación
Función Cuadrática A la función polinómica de segundo grado +bx+c, siendo a, b, c números reales y, se la denomina función cuadrática. Los términos de la función reciben los siguientes nombres: La representación
SESIÓN 10 DERIVACIÓN DE FUNCIONES TRIGONOMÉTRICAS DIRECTAS
 SESIÓN 0 DERIVACIÓN DE FUNCIONES TRIGONOMÉTRICAS DIRECTAS I. CONTENIDOS:. Derivadas de funciones trigonométricas directas. Ejercicios resueltos. Estrategias Centradas en el Aprendizaje: Ejercicios propuestos
SESIÓN 0 DERIVACIÓN DE FUNCIONES TRIGONOMÉTRICAS DIRECTAS I. CONTENIDOS:. Derivadas de funciones trigonométricas directas. Ejercicios resueltos. Estrategias Centradas en el Aprendizaje: Ejercicios propuestos
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA
 PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
PRÁCTICA 10. TORRE DE REFRIGERACIÓN POR AGUA OBJETIVO GENERAL: Familiarizar al alumno con los sistemas de torres de refrigeración para evacuar el calor excedente del agua. OBJETIVOS ESPECÍFICOS: Investigar
Electrotecnia General Tema 26 TEMA 26 CÁLCULO DE REDES DE DISTRIBUCIÓN II
 TEMA 26 CÁLCULO DE REDES DE DISTRIBUCIÓN II 26.1. DISTRIBUCIONES PERFECTAMENTE CERRADAS CON TENSIÓN CONSTANTE Y SECCIÓN UNIFORME. Las distribuciones perfectamente cerradas son aquellas en las que el distribuidor
TEMA 26 CÁLCULO DE REDES DE DISTRIBUCIÓN II 26.1. DISTRIBUCIONES PERFECTAMENTE CERRADAS CON TENSIÓN CONSTANTE Y SECCIÓN UNIFORME. Las distribuciones perfectamente cerradas son aquellas en las que el distribuidor
DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
