QUÍMICA ORGÁNICA SE DEFINE ACTUALMENTE COMO LA QUÍMICA DE LOS COMPUESTOS DEL CARBONO.
|
|
|
- Carla Olivares Ruiz
- hace 6 años
- Vistas:
Transcripción
1 QUÍMICA ORGÁNICA SE DEFINE ACTUALMENTE COMO LA QUÍMICA DE LOS COMPUESTOS DEL CARBONO. LA PALABRA ORGÁNICA SIGNIFICA LITERALMENTE DERIVADO DE ORGANISMOS VIVOS. ORIGINALMENTE SE DEDICABA AL ESTUDIO DE COMPUESTOS EXTRAIDOS DE ORGANISMOS VIVOS Y PRODUCTOS NATURALES, POR EJEMPLO: AZUCAR, ALMIDÓN, CERAS Y ACEITES VEGETALES. ESTOS PRODUCTOS O COMPUESTOS SE CONSIDERAN ORGÁNICOS Y SE CREIA QUE TALES PRODUCTOS NATURALES NECESITABAN DE UNA FUERZA VITAL PARA CREARLOS. QUÍMICA ORGÁNICA INICIALMENTE SE DEDICABA AL ESTUDIO DE COMPUESTOS CON FUERZA VITAL. QUÍMICA INORGÁNICA: ESTUDIO DE GASES, ROCAS, MINERALES Y LOS COMPUESTOS QUE PODÍAN DERIVARSE A PARTIR DE ELLOS. EN EL SIGLO XIX, SE VIO EN LA NECESIDAD DE REVISAR EL SIGNIFICADO DE QUÍMICA ORGÁNICA. SE SINTETIZARON COMPUESTOS ORGÁNICOS A PARTIR DE INORGÁNICOS. UNO DE LOS EXPERIMENTOS EN ESTE SENTIDO FUE LA CONVERSIÓN DE CIANATO DE AMONIO EN ÚREA: NH OCN NH 2 CONH 2 CIANATO DE AMONIO (INORGÁNICO) UREA (ORGÁNICO)
2 LA ÚREA SE HABÍA OBTENIDO SIEMPRE DE ORGANÍSMOS VIVOS Y SE SUPONÍA QUE CONTENÍA LA FUERZA VITAL. SIN EMBARGO EL CIANATO DE AMONIO ES INORGÁNICO Y POR LO TANTO CARECÍA DE DICHA FUERZA. POSTERIORMENTE SE SINTETIZARON MUCHOS COMPUESTOS ORGÁNICOS APARTIR DE INORGÁNICOS. LA PRINCIPAL CARACTERÍSTICA DE LOS COMPUESTOS ORGÁNICOS ES QUE TODOS CONTIENEN UNO O MÁS ÁTOMOS DE CARBONO. SIN EMBARGO, NO TODOS LOS COMPUESTOS DE CARBONO SON SUSTANCIAS ORGÁNICAS, PUES EL DIAMANTE, EL GRAFITO, DIÓXIDO DE CARBONO, CIANATO DE AMONIO Y CARBONATO DE SODIO SE DERIVAN DE MINERALES Y TIENEN PROPIEDADES INORGÁNICAS CARACTERISTICAS. SE CONSIDERA QUE LA MAYOR PARTE DE LOS MILLONES DE COMPUESTOS DEL CARBONO CONOCIDOS SON ORGÁNICOS. QUÉ TIENE DE ESPECIAL EL CARBONO QUE SE LE DEDICA TODA UNA RAMA DE LA QUÍMICA A ESTUDIAR SUS COMPUESTOS? o EL CARBONO PUEDE FORMAR ENLACES FUERTES CON OTROS ÁTOMOS DE CARBONO Y CON VARIEDAD DE OTROS ELEMENTOS. o SE PUEDE CONSTRUIR UNA INFINITA VARIEDAD MOLECULAS. o ESTA DIVERSIDAD DE COMPUESTOS DEL CARBONO ES LO QUE CONSTITUYE LA BASE DE LA VIDA EN LA TIERRA.
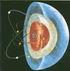
3 o LAS CRIATURAS VIVAS SE COMPONEN PRINCIPALMENTE DE COMPUESTOS DEL CARBONO QUE REALIZAN FUNCIONES ESTRUCTURALES, QUÍMICAS Y GENÉTICAS. o LOS QUÍMICOS HAN APRENDIDO A SINTETIZAR O SIMULAR MUCHAS DE ESAS MOLÉCULAS COMPLEJAS. o LOS PRODUCTOS SINTÉTICOS TIENEN APLICACIONES COMO DROGAS, MEDICINAS, PLÁSTICOS, PESTICIDAS, PINTURAS Y FIBRAS. o MUCHOS DE LOS ADELANTOS IMPORTANTES EN MEDICINAS EN REALIDAD SON AVANCES/ CONTRIBUCIONES DE LA QUÍMICA ORGÁNICA. ESTRUCTURA DEL ÁTOMO Los átomos están formados por protones, neutrones y electrones. Los protones están cargados positivamente y se encuentran, juntos con los neutrones (sin carga), en el núcleo. Los electrones tienen carga negativa de misma magnitud que la carga positiva de los protones y se encuentran el espacio que rodea al núcleo. nube de electrones núcleo (Protones y neutrones)
4 Los protones y neutrones tienen masa parecida, aproximadamente unas 1800 veces la masa de un electrón. A pesar de que prácticamente toda la masa del átomo está concentrada en el núcleo, son los electrones los que participan en los enlaces químicos y en las reacciones. Cada elemento se caracteriza por el número de protones que tiene el núcleo (número atómico). El número de neutrones normalmente es parecido al número de protones, este número puede variar aun en un mismo elemento. Isótopos: átomos con igual número de protones pero diferente número de neutrones. El carbono más común en la naturaleza tiene 6 protones y 6 neutrones en núcleo, su número másico (protones+neutrones) es 12, 12 C. Aproximadamente 1% de los átomos de carbono tienen 7 neutrones, 13 C. Una fracción muy pequeña de átomos de carbono tiene 8 neutrones, 14 C. Este isótopo es radioactivo. ENLACE QUÍMICO CUALQUIER ANÁLISIS SOBRE LA ESTRUCTURA DE MOLECULAS DEBE COMENZAR CON UNA DISCUSIÓN SOBRE EL ENLACE QUÍMICO, LAS FUERZAS QUE MANTIENE UNIDO ÁTOMOS EN UNA MOLÉCULA. CONVIENE PARA UN MEJOR ENTENDINIENTO DEL CONCEPTO DE ENLACE QUÍMICO DISCUTIR PRIMERO COMO SE ENTENDIA ANTES
5 DE 1926 Y POSTERIORMENTE CONSIDERALO DESDE PUNTO DE VISTA DE LA MECANICA CUANTICA. EN 1916 DOS TIPOS DE ENLACES SE DESCRIBIERON: EL ENLACE IONICO POR WALTER KOSSEL (ALEMANIA). EL ENLACE COVALENTE POR G.N.LEWIS (UNIVERSIDAD DE CALIFORNIA) ENLACE IONICO: o UN NUCLEO CARGADO POSITIVAMENTE ESTA RODEADO POR ELECTRONES ORDENADOS EN CAPA CONCENTRICAS O NIVELES DE ENERGÍA. o EXISTE UN MÁXIMO NÚMERO DE ELECTRONES QUE PUEDE ACOMODARSE EN CADA CAPA: 2 EN LA PRIMERA CAPA, 8 EN LA 2DA, 8 Ó 18 EN LA 3ERA, Y ASI SUCESIVAMENTE. o LA MAYOR ESTABILIDAD SE ALCANZA CUANDO LA CAPA MÁS EXTERNA ESTA LLENA COMO EL CASO DE LOS GASES NOBLES. o TANTO EL ENLACE IONICO COMO COVALENTE SE ORIGINAN DE LA TENDENCIA DE LOS ÁTOMOS A OBTENER LA CONFIGURACIÓN DE ELECTRONES MAS ESTABLE.
6 o EL ENLACE IONICO SE ORIGINA DE LA TRANSFERENCIA DE ELECTRONES, COMO SUCEDE EN LA FORMACIÓN DE FLUORURO DE LITIO. PIERDE UN e- Li 2 1 Li 2 + Li Li + + e - o UN ÁTOMO DE LITIO TIENE DOS ELECTRONES EN SU CAPA INTERNA Y UN ELECTRÓN EN SU CAPA MÁS EXTERNA O CAPA DE VALENCIA, LA PERDIDA DE UN ELECTRÓN CONDUCE AL LITIO A LOGRAR UNA CAPA EXTERNA DE DOS ELECTRONES SEMEJANTE AL GAS NOBLE QUE LO PRECEDE (He). o UN ATOMO DE FLUOR TIENE DOS ELECTRONES EN SU CAPA INTERNA Y SIETE ELECTRONES EN SU CAPA DE VALENCIA, LA GANACIA DE UN ELECTRÓN LE DARÍA AL ÁTOMO DE FLUOR UNA CAPA EXTERNA DE 8 ELECTRONES, SEMEJANTE AL GAS NOBLE MÁS CERCANO (Ne). - F 2 7 GANA UN e- F 2 8 F + e- F - o EL FLUORURO DE LITIO SE FORMA POR LA TRANSFERENCIA DE UN ELECTRÓN DEL LITIO AL FLUOR, ENTONCES EL LITIO TERMINA CON UNA CARGA POSITIVA Y EL FLUOR CON UNA NEGATIVA.
7 o LA ATRACCIÓN ELECTROSTÁTICA ENTRE LAS CARGAS DE DIFERENTE SIGNO SE DENOMINA ENLACE IONICO. o ESTOS ENLACES IONICOS SON TÍPICOS EN SALES FORMADAS POR COMBINACIÓN DE UN ELEMENTO METÁLICO (ELEMENTO ELECTROPOSITIVO) PERTENECIENTE AL LADO IZQUIERDO DE LA TABLA PERIODICA CON UN ELEMENTO NO-METALICO (ELEMENTO ELECTRONEGATIVO) PERTENECIENTE AL LADO DERECHO DE LA TABLA PERIODICA. ENLACE COVALENTE: o ES EL RESULTADO DE COMPARTIR ELECTRONES EN LA FORMACIÓN DE MOLÉCULAS COMO LA DE H 2. o CADA HIDRÓGENO TIENE UN ELECTRÓN PARA COMPARTIR EN LA MOLÉCULA. AMBOS HIDRÓGENOS PUEDE ASÍ COMPLETAR SU CAPA EXTERNA CON DOS ELECTRONES. H. + H. H:H o DOS ÁTOMOS DE FLUOR, CADA UN CON 7 ELECTRONES EN SU CAPA DE VALENCIA, PUEDE COMPLETAR SU OCTETO POR COMPARTIR UN PAR DE ELECTRONES. o DE IGUAL FORMA SE PUEDE VISUALIZAR LA FORMACIÓN DE HF, H 2 O, NH 3, CH 4, Y CF 4
8 2H. +. O H: O: H.. o DE NUEVO LA FUERZA DE ENLACE ES ORIGINADA POR ATRACCIÓN ELECTROSTÁTICA, ENTRE CADA ELECTRÓN Y AMBOS NUCLEOS. o EL ENLACE COVALENTE ES TIPICO DE LOS COMPUESTO DEL CARBONO, ES EL ENLACE DE MAYOR IMPORTANCIA EN QUÍMICA ORGÁNICA. MECANICA CUANTICA EN 1926 SE POSTULO LA TEORIA CONOCIDA COMO MECÁNICA CUANTICA, DESARROLLADA EN FORMA MÁS ÚTIL PARA LOS QUÍMICOS POR ERWIN SCHRÖDINGER (UNIVERSIDAD DE ZURICH). EL TRABAJO EN LAS EXPRESIONES MATEMATICAS PARA DESCRIBIR EL MOVIMIENTO DE UN ELECTRÓN EN TÉRMINOS DE SU ENERGÍA. ESTAS EXPRESIONES MATEMÁTICAS SE CONOCEN COMO ECUACIONES DE ONDA, YA QUE SE BASAN EN EL CONCEPTO QUE EL ELECTRÓN TIENE PROPIEDADES NO SÓLO DE PARTÍCULA SINO TAMBIÉN DE ONDA. UNA ECUACIÓN DE ONDA TIENE UNA SERIE DE SOLUCIONES LLAMADAS FUNCIONES DE ONDA, CADA UNA CORRESPONDE A UN NIVEL DE ENERGÍA DIFERENTE PARA EL ELECTRÓN. ORBITALES ATÓMICOS UNA ECUACIÓN DE ONDA NO NOS PUEDE DECIR EXACTAMENTE DONDE ESTA UN ELECTRÓN EN UN MOMENTO PARTICULAR O QUE TAN RÁPIDO ES SU MOVIMIENTO (Principio de incertidumbre de Heisenberg).
9 NO PERMITE GRAFICAR UNA ORBITA EXACTA ALREDEDOR DEL NÚCLEO. ALTERNATIVAMENTE NOS DICE LA PROBABILIDAD DE ENCONTRAR AL ELECTRÓN EN UN LUGAR PARTICULAR. LA REGIÓN DEL ESPACIO DONDE PROBABLEMENTE SE ENCUENTRE EL ELECTRÓN SE DENOMINA ORBITAL. EXISTEN DIFERENTES TIPOS DE ORBITALES, CON DIFERENTES TAMAÑOS Y FORMAS. ESTOS ESTAN ALREDEDOR DEL NÚCLEO. EL ORBITAL PARTICULAR QUE OCUPA UN ELECTRÓN DEPENDE DE SU ENERGÍA. LA FORMA DE ESTOS ORBITALES Y SU DISPOSICIÓN CON RESPECTO A OTROS INTERESA EN QUÍMICA ORGÁNICA YA QUE PERMITE DETERMINAR EL ARREGLO DE LOS ÁTOMOS EN LA MOLÉCULA Y AYUDAN A PREDECIR/ ENTENDER SU COMPORTAMIENTO QUÍMICO. LOS ORBITALES DE MAS BAJO NIVEL DE ENERGÍA ES LLAMADO ORBITAL 1S. SON ESFÉRICOS CON SU CENTRO EN EL NÚCLEO DEL ÁTOMO. Orbital atómico: orbital s. Núcleo en el centro. LA DENSIDAD ELECTRÓNICA ES MÁXIMA EN EL NÚCLEO Y CAE EXPONENCIALMENTE AL AUMENTAR LA DISTANCIA DESDE EL NUCLEO HACIA CUALQUIER DIRECCIÓN. EL ORBITAL 2S ES DE IGUAL SIMETRIA QUE EL 1S PERO DE MAYOR ENERGÍA Y TAMAÑO.
10 LOS SIGUIENTES ORBITALES SON 2P, TRES ORBITALES 2P DE LA MISMA ENERGÍA. CONSISTE EN DOS LOBULOS CON EL NÚCLEO ENTRE ELLOS. EL EJE DE CADA ORBITAL 2P ES PERPENDICULAR A LOS OTROS DOS. SU FORMA ES LA DE DOS ELIPSOIDES DEFORMADOS. SE DIFERENCIAN COMO 2Px, 2Py Y 2Pz DONDE x,y,z SE REFIEREN AL EJE CORRESPONDIENTE. CONFIGURACIÓN ELECTRONICA. PRINCIPIO DE EXCLUSION DE PAULI. EXISTEN UN NÚMERO DE REGLAS QUE DETERMINAN LA VÍA EN LA CUAL LOS ELECTRONES DE UN ÁTOMO PUEDE DISTRIBUIRSE, ESTO ES LO QUE DETERMINA LA CONFIGURACIÓN ELECTRONICA DE UN ÁTOMO. LO MÁS FUNDAMENTAL DE ESTA REGLA ES EL PRINCIPIO DE EXCLUSION DE PAULI: SÓLO DOS ELECTRONES PUEDE OCUPAR EL MISMO ORBITAL ATÓMICO Y ESTOS DEBEN TENER SPIN OPUESTOS ESTOS ELECTRONES DE SPIN OPUESTO SE DICE QUE ESTAN APAREADOS. LOS PRIMEROS 10 ELEMENTOS DE LA TABLA PERIODICA TIENE LA CONFIGURACIÓN ELECTRONICA SEÑALADA EN LA SIGUIENTE TABLA
11 ELECTRONES DE VALENCIA CONFIGURACIÓN 1S 1 1S 2 1S 2 2S 1 1S 2 2S 2 1S 2 2S 2 2Px 1 1S 2 2S 2 2Px 1 2Py 1 1S 2 2S 2 2Px 1 2Py 1 2Pz 1 1S 2 2S 2 2Px 2 2Py 1 2Pz 1 1S 2 2S 2 2Px 2 2Py 2 2Pz 1 1S 2 2S 2 2Px 2 2Py 2 2Pz 2 ORBITALES MOLECULARES EN LA MOLECULA SIMILARMENTE A COMO SUCEDE EN LOS ATOMOS Y DE ACUERDO A REGLAS LOS ELECTRONES OCUPAN ORBITALES MOLECULARES. LOS ORBITALES MOLECULARES SON CONSIDERADOS CENTRADOS ALREDEDOR DE VARIOS NUCLEOS. LA DISTRIBUCION DE LOS ELECTRONES ALREDEDOR DE LOS NUCLEOS ES SIMPLEMENTE LA QUE ORIGINE LA MOLECULA MÁS ESTABLE. DOS SIMPLICACIONES COMUNES SON: o CADA PAR DE ELECTRONES ES ESENCIALMENTE LOCALIZADO CERCA DE DOS NUCLEOS. o LA IDEA DE ORBITALES MOLECULARES LOCALIZADOS ( ORBITALES DE ENLACE ). CONSIDEREMOS EL CASO MÁS SIMPLE: DOS ÁTOMOS DE HIDRÓGENOS QUE SE APROXIMAN DESDE EL INFINITO. CADA ÁTOMO DE HIDRÓGENO TIENE UN ELECTRÓN, LOS CUALES OCUPAN ORBITALES 1S. LOS DOS NUCLEOS DEBEN ACERCARSE PARA QUE LOS ELECTRONES SE SOBRELAPEN AL MÁXIMO. PARA LA MOLECULA DE HIDROGENO, EL SISTEMA ES ESTABLE CUANDO LA DISTANCIA ENTRE LOS DOS NUCLEOS ES DE 0,74Å, ESTA DISTANCIA SE CONOCE COMO LONGITUD DE ENLACE.
12 ORBITALES S ORBITALES S SOBRELAPADOS/ FORMACIÓN DEL ENLACE (SIGMA) A ESTA DISTANCIA EL EFECTO ESTABILIZANTE DEL SOBRELAPAMIENTO ES EXACTAMENTE BALANCEDO POR LA REPULSIÓN DE LAS CARGAS DE LOS NUCLEOS. LA MOLECULA DE HIDRÓGENO RESULTANTE CONTIENE 104 KCAL/ MOL MENOS QUE LOS ÁTOMOS DE HIDRÓGENOS DE LOS CUALES SE HIZO. MATEMATICAMENTE ORBITALES MOLECULARES (MO) PUEDEN OBTENERSE POR UNA APROXIMACIÓN LLAMADA COMBINACIÓN LINEAL DE ORBITALES ATÓMICOS (LCAO). 0,74Å EN CASO DE LA MOLÉCULA DE HIDRÓGENO. ESTA COMBINACIÓN PRODUCE TANTOS ORBITALES MOLECULARES () COMO EL NÚMERO DE ORBITALES ATÓMICOS () ORIGINALES. b = N 1 ( A + B ) ORBITAL DE MENOR ENERGÍA, ORBITAL ENLAZANTE a = N 1 ( A - B ) ORBITAL DE MAYOR ENERGÍA, ORBITAL ANTIENLAZANTE
13 LOS ENLACES SIMPLES DEL H 2 Y DEL F 2 SE DENOMINAN LIGADURAS O ENLACES SIGMA, (LETRA GRIEGA ANÁLOGA A LA LETRA S) TIENEN FORMA DE SALCHICHAS CON AMBOS NÚCLEOS EN LA PARTE INTERIOR, CADA UNO CERCANO AL EXTREMO. + + OTRA POSIBILIDAD LA CONSTITUYE LA LIGADURA O ENLACE FORMADO POR ORBITALES ATOMICOS P. HIBRIDIZACIÓN EN CASI LA TOTALIDAD DE LOS COMPUESTOS COVALENTES EL CARBONO FORMA CUATRO ENLACES. SIN EMBARGO EL ÁTOMO DEL CARBONO EN SU ESTADO NATURAL TIENE SOLAMENTE DOS ELECTRONES NO APAREADOS. 1S 2S 2P C MEDIANTE UN MEZCLADO Y REORDENAMIENTO DE LOS ELECTRONES DE VALENCIA DEL ÁTOMO DE CARBONO SE LOGRA LA FORMACIÓN DE CUATRO NUEVOS ORBITALES CUYAS DIRECCIONES NO CORRESPONDEN A LA DIRECCIONES ORIGINALES. SE DICE QUE EL TRATAMIENTO MECANICO-CUANTICO HIBRIDIZA ESTOS ELECTRONES. LOS NUEVOS CUATRO ORBITALES ATÓMICOS HIBRIDOS RESULTANTES PARA EL CARBONO SE DENOMINAN sp 3. ESTRUCTURAS LEWIS EL MODO MÁS SENCILLO DE REPRESENTAR EL ENLACE COVALENTE ES MEDIANTE LA FORMULAS DE LEWIS, TAL COMO SE HIZO ANTERIORMENTE. PARA LA MOLÉCULA DE HIDRÓGENO H:H
14 EN UNA ESTRUTURA DE LEWIS CADA ELECTRÓN DE VALENCIA SE INDICA CON UN PUNTO O UN PAR DE ELECTRONES SE REPRESENTA POR UN GUIÓN ( ). SE TRATARA DE ACOMODAR TODOS LOS ÁTOMOS PARA TENGA SUS CONFIGURACIONES ADECUADAS DE GAS NOBLE, DOS ELECTRONES PARA EL HIDRÓGENO Y OCTETOS PARA LOS ELEMENTOS DE LA SEGUNDA FILA DE LA TABLA PERIODICA. POR EJEMPLO EL METANO, CH 4, H.. H :C:.. H H H H -C- H H EL CARBONO CONTRIBUYE CON CUATRO ELECTRONES DE VALENCIA Y CADA HIDRÓGENO CON UNO PARA DAR UN TOTAL DE 8 ELECTRONES. LOS 8 ELECTRONES RODEAN AL CARBONO PARA FORMAR EL OCTETO Y CADA HIDROGENO COMPARTE DOS DE LOS ELECTRONES.
15 ver:
Los compuestos del Carbono
 Los compuestos del Carbono Segunda fila de la Tabla Periódica El átomo de carbono está en el medio de la fila y en realidad no cede ni acepta electrones. Comparte sus electrones con otros carbonos al igual
Los compuestos del Carbono Segunda fila de la Tabla Periódica El átomo de carbono está en el medio de la fila y en realidad no cede ni acepta electrones. Comparte sus electrones con otros carbonos al igual
Tema 2: Enlace y propiedades de los materiales
 En la mayoría de moléculas, los enlaces entre los átomos que las constituyen no es mediante la interacción coulombiana que hemos analizado en el caso del enlace iónico. Se necesita tener en cuenta el llamado
En la mayoría de moléculas, los enlaces entre los átomos que las constituyen no es mediante la interacción coulombiana que hemos analizado en el caso del enlace iónico. Se necesita tener en cuenta el llamado
BIOLOGIA. Unidad 0.- Conceptos básicos de química para biología. - Los átomos constituyen la unidad más pequeña de la materia ( aprox cm).
 .- Conceptos básicos de química para biología. 1. Los átomos. - Los átomos constituyen la unidad más pequeña de la materia ( aprox. 10-8 cm). - Los átomos están formados por partículas sub-atómicas denominadas
.- Conceptos básicos de química para biología. 1. Los átomos. - Los átomos constituyen la unidad más pequeña de la materia ( aprox. 10-8 cm). - Los átomos están formados por partículas sub-atómicas denominadas
Enlace químico. Enlace químico. El enlace iónico. El enlace covalente. Fuerza de interacción que mantiene ligados a los átomos en las moléculas.
 Energía Química General e Inorgánica 9 y 11 de mayo de 2016 Prof. Dr. Pablo Evelson Enlace químico Enlace químico Fuerza de interacción que mantiene ligados a los átomos en las moléculas. Tipos de enlace
Energía Química General e Inorgánica 9 y 11 de mayo de 2016 Prof. Dr. Pablo Evelson Enlace químico Enlace químico Fuerza de interacción que mantiene ligados a los átomos en las moléculas. Tipos de enlace
Química Orgánica. 1S2 2S2 2px1 2py1 2pz0
 Química Orgánica Como sabemos la complejidad y la variabilidad de las moléculas de los compuestos orgánicos se basa en la capacidad del átomo de carbono para combinarse consigo mismo para formar cadenas
Química Orgánica Como sabemos la complejidad y la variabilidad de las moléculas de los compuestos orgánicos se basa en la capacidad del átomo de carbono para combinarse consigo mismo para formar cadenas
ENLACE QUÍMICO UNIDADES ESTRUCTURALES DE LAS SUSTANCIAS IONES ÁTOMOS MOLÉCULAS ENLACE IÓNICO ENLACE METÁLICO ENLACE COVALENTE ENLACE COVALENTE
 ENLACE QUÍMICO Y TIPOS ENLACE QUÍMICO Enlace químico es la fuerza responsable de la unión entre las unidades estructurales ( iones, átomos o moléculas) que forman la materia. UNIDADES ESTRUCTURALES DE
ENLACE QUÍMICO Y TIPOS ENLACE QUÍMICO Enlace químico es la fuerza responsable de la unión entre las unidades estructurales ( iones, átomos o moléculas) que forman la materia. UNIDADES ESTRUCTURALES DE
QUÍMICA I. TEMA 2: Estructura atómica. Tecnólogo Minero. E s q u e m a d e l a C l a s e
 QUÍMICA I TEMA 2: Estructura atómica Tecnólogo Minero E s q u e m a d e l a C l a s e Tema 2: Estructura atómica El átomo. Partículas atómicas. Número atómico, número másico. Isótopos. Estructura electrónica.
QUÍMICA I TEMA 2: Estructura atómica Tecnólogo Minero E s q u e m a d e l a C l a s e Tema 2: Estructura atómica El átomo. Partículas atómicas. Número atómico, número másico. Isótopos. Estructura electrónica.
El enlace químico. Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM
 Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple.
Alejandro Solano-Peralta Facultad de Estudios Superiores Cuautitlán, UNAM El enlace químico Las átomos pueden formar enlaces por compartición de electrones Dos electrones compartidos forman un enlace simple.
elementos reaccionan compuestos
 Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Fundamentos Actualmente, existen 118 elementos en la tabla periódica, pero las sustancias químicas que existen como por ejemplo la sal, el azúcar, los jabones, los perfumes, o los existentes en la propia
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Moléculas: partícula neutra más pequeña de una sustancia dada que posee sus propiedades químicas y puede existir independientemente
 Especies químicas de interés formadas por átomos: Moléculas: partícula neutra más pequeña de una sustancia dada que posee sus propiedades químicas y puede existir independientemente Iones: Especies cargada
Especies químicas de interés formadas por átomos: Moléculas: partícula neutra más pequeña de una sustancia dada que posee sus propiedades químicas y puede existir independientemente Iones: Especies cargada
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
3.1. Estructura atómica
 3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
QUÍMICA. Tema 3. Enlace Químico
 Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
Tema 3. Enlace Químico Índice - Tipos de enlace - Enlace iónico - Enlace covalente - Enlace metálico bjetivos específicos - Que el alumno conozca los principales tipos de enlaces químicos - Que el alumno
Teoría cuántica del enlace
 IES La Magdalena. Avilés. Asturias La teoría cuántica (en su versión ondulatoria) describe al electrón mediante una función de onda, pero no podemos considerarlo como una partícula con una localización
IES La Magdalena. Avilés. Asturias La teoría cuántica (en su versión ondulatoria) describe al electrón mediante una función de onda, pero no podemos considerarlo como una partícula con una localización
Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales.
 ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
ENLACES Los enlaces químicos son fuerzas que mantienen unidos a los átomos para formar compuestos moleculares o cristales Enlaces Iónicos electrovalentes o polares Enlaces covalentes o no polar Enlace
COLEGIO DANIEL JORDÁN ÁREA QUÍMICA GRADO 11 PERIODO
 COLEGIO DANIEL JORDÁN ÁREA QUÍMICA GRADO 11 PERIODO OBJETIVO. Identificar la estructura y propiedades del carbono CONCEPTUALIZACIÓN ESTRUCTURA DEL ÁTOMO DE CARBONO El carbono puede unirse consigo mismo
COLEGIO DANIEL JORDÁN ÁREA QUÍMICA GRADO 11 PERIODO OBJETIVO. Identificar la estructura y propiedades del carbono CONCEPTUALIZACIÓN ESTRUCTURA DEL ÁTOMO DE CARBONO El carbono puede unirse consigo mismo
Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables.
 TEMA 3. ENLACE QUÍMICO Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables. Para explicar el enlace químico,
TEMA 3. ENLACE QUÍMICO Las especies químicas (átomos, moléculas, iones..) se unen para formar otras especies químicas con menor contenido energético, es decir más estables. Para explicar el enlace químico,
TEORÍA DE ENLACE DE VALENCIA (TEV) Heitler y London 1927 Pauling
 TEORÍA DE ENLACE DE VALENCIA (TEV) Heitler y London 1927 Pauling BASES: Los electrones de enlace están localizados en la región de solapamiento de los orbitales atómicos. Para que se produzca el enlace
TEORÍA DE ENLACE DE VALENCIA (TEV) Heitler y London 1927 Pauling BASES: Los electrones de enlace están localizados en la región de solapamiento de los orbitales atómicos. Para que se produzca el enlace
IES LEOPOLDO QUEIPO. DEPARTAMENTO FÍSICA Y QUÍMICA 4ºESO. Tema 2 : El átomo y sus uniones
 Tema 2 : El átomo y sus uniones Esquema de trabajo: 1.- El átomo. A. Partículas subatómicas. B. Número atómico y número másico C. Estructura interna del átomo: clásica y actual. 2.- Organización de los
Tema 2 : El átomo y sus uniones Esquema de trabajo: 1.- El átomo. A. Partículas subatómicas. B. Número atómico y número másico C. Estructura interna del átomo: clásica y actual. 2.- Organización de los
Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica
 Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica Lic. Walter de la Roca 1 Formas de los orbitales: Forma en el espacio
Unidad 1 (Parte III 1.1.2) Objetivo de la presentación: Repasar conceptos de Química General que son fundamentales para Química Orgánica Lic. Walter de la Roca 1 Formas de los orbitales: Forma en el espacio
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
Curso 0 de Química PROGRAMA UNIDAD ESTRUCTURA DE LA MATERIA 1.2. ENLACE QUÍMICO
 Curso 0 de Química PROGRAMA UNIDAD 1. 1.1. ESTRUCTURA DE LA MATERIA 1.2. ENLACE QUÍMICO UNIDAD 2. 3.1. CONCEPTOS BÁSICOS 3.2. MEZCLAS Y DISOLUCIONES 3.3. REACCIONES QUÍMICAS UNIDAD 3. 4.1. TERMOQUÍMICA
Curso 0 de Química PROGRAMA UNIDAD 1. 1.1. ESTRUCTURA DE LA MATERIA 1.2. ENLACE QUÍMICO UNIDAD 2. 3.1. CONCEPTOS BÁSICOS 3.2. MEZCLAS Y DISOLUCIONES 3.3. REACCIONES QUÍMICAS UNIDAD 3. 4.1. TERMOQUÍMICA
Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares
 Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares Enlace químico Cómo se unen los átomos? Cualquier teoría que de contestación a esta pregunta ha de explicar: Los diferentes tipos de enlace
Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares Enlace químico Cómo se unen los átomos? Cualquier teoría que de contestación a esta pregunta ha de explicar: Los diferentes tipos de enlace
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS DE LA ESPECTROSCOPIA
 Integrantes: Ipiales Gabriela Química de Alimentos Olmos Wendy Química Farmacéutica Día: Miércoles 9-11 Fecha: 05/07/2011 DEFINICIÓN DE ORBITALES ATÓMICOS Un orbital atómico representa una región del espacio
Integrantes: Ipiales Gabriela Química de Alimentos Olmos Wendy Química Farmacéutica Día: Miércoles 9-11 Fecha: 05/07/2011 DEFINICIÓN DE ORBITALES ATÓMICOS Un orbital atómico representa una región del espacio
TEMA 3 EL ENLACE COVALENTE
 TEMA 3 EL ENLACE COVALENTE 1. Orbitales atómicos. 2. Teoría de orbitales moleculares (OM). 3. El enlace en la molécula de metano. 4. La molécula de etano. 5. La molécula de etileno. 6. La molécula de acetileno.
TEMA 3 EL ENLACE COVALENTE 1. Orbitales atómicos. 2. Teoría de orbitales moleculares (OM). 3. El enlace en la molécula de metano. 4. La molécula de etano. 5. La molécula de etileno. 6. La molécula de acetileno.
ENLACE QUIMICO. Teoría de enlace de valencia Hibridación de orbitales y enlaces múltiples
 ENLACE QUIMICO Teoría de enlace de valencia Hibridación de orbitales y enlaces múltiples Teoría de Enlace de Valencia Teoría de Lewis: El enlace covalente se forma cuando dos átomos comparten pares de
ENLACE QUIMICO Teoría de enlace de valencia Hibridación de orbitales y enlaces múltiples Teoría de Enlace de Valencia Teoría de Lewis: El enlace covalente se forma cuando dos átomos comparten pares de
2. APARICIÓN DE NUEVOS HECHOS: ESPECTROS ATÓMICOS E HIPÓTESIS DE PLANCK 6. CONFIGURACIONES ELECTRÓNICAS: PRINCIPIO DE AUFBAU
 ÍNDICE 1. MODELO ATÓMICO DE RUTHERFORD 2. APARICIÓN DE NUEVOS HECHOS: ESPECTROS ATÓMICOS E HIPÓTESIS DE PLANCK 3. MODELO ATÓMICO DE BORH 4. CONCEPTO DE ORBITAL ATÓMICO 5. NÚMERO CUÁNTICOS Y SU SIGNIFICADO
ÍNDICE 1. MODELO ATÓMICO DE RUTHERFORD 2. APARICIÓN DE NUEVOS HECHOS: ESPECTROS ATÓMICOS E HIPÓTESIS DE PLANCK 3. MODELO ATÓMICO DE BORH 4. CONCEPTO DE ORBITAL ATÓMICO 5. NÚMERO CUÁNTICOS Y SU SIGNIFICADO
Bloque I Origen y evolución de los componentes del Universo
 Bloque I Origen y evolución de los componentes del Universo CRITERIOS DE EVALUACIÓN 1. Analizar cronológicamente los modelos atómicos hasta llegar al modelo actual discutiendo sus limitaciones y la necesitad
Bloque I Origen y evolución de los componentes del Universo CRITERIOS DE EVALUACIÓN 1. Analizar cronológicamente los modelos atómicos hasta llegar al modelo actual discutiendo sus limitaciones y la necesitad
Electrón: LAS PARTÍCULAS SUBATÓMICAS. Electrón: e - Carga eléctrica: 1,602x10-19 C Masa: 9,109x10-31 C
 ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partí
 Capítulo 2: Estructura atómica Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partículas subatómicas: Protones
Capítulo 2: Estructura atómica Los átomos constituyen la unidad básica de todos los materiales de ingeniería. La estructura de los átomos Están constituidos por las siguientes partículas subatómicas: Protones
Uniones Químicas. Iónicas Covalentes Metálicas
 Uniones Químicas Iónicas Covalentes Metálicas Unión iónica Propiedades de los Compuestos iónicos - Puntos de fusión y ebullición elevados - Sólidos duros y quebradizos - Baja conductividad eléctrica y
Uniones Químicas Iónicas Covalentes Metálicas Unión iónica Propiedades de los Compuestos iónicos - Puntos de fusión y ebullición elevados - Sólidos duros y quebradizos - Baja conductividad eléctrica y
Enlace Químico Orbitales moleculares
 QUIMICA INORGÁNICA Enlace Químico Orbitales moleculares Bibliografía Materiales: Tabla periódica Modelo de orbitales atómicos Paramagnetismo del oxígeno: Termos, grande y chicos, manguera, imán fuerte,
QUIMICA INORGÁNICA Enlace Químico Orbitales moleculares Bibliografía Materiales: Tabla periódica Modelo de orbitales atómicos Paramagnetismo del oxígeno: Termos, grande y chicos, manguera, imán fuerte,
Unidad 1: Estructura atómica de la materia
 ACTIVIDADES Unidad 1: Estructura atómica de la materia Para a realización de ditas actividades recoméndase seguir a seguinte páxina de internet do Ministerio de Educación e ciencia na cal se explica de
ACTIVIDADES Unidad 1: Estructura atómica de la materia Para a realización de ditas actividades recoméndase seguir a seguinte páxina de internet do Ministerio de Educación e ciencia na cal se explica de
Química General. Clase 3 FECHA: 19/05
 Química General Clase 3 FECHA: 19/05 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura de los compuestos iónicos.
Química General Clase 3 FECHA: 19/05 Unidad 3 Enlaces químicos Uniones iónicas, uniones covalentes Enlace iónico. Concepto. Condiciones. Formación de compuestos iónicos. Estructura de los compuestos iónicos.
ESTRUCTURA DE LA MATERIA
 Química P.A.U. ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA CUESTIONES NÚMEROS CUÁNTICOS. a) Indique el significado de los números cuánticos que caracterizan a un electrón. b) Escriba los cuatro números
Química P.A.U. ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA CUESTIONES NÚMEROS CUÁNTICOS. a) Indique el significado de los números cuánticos que caracterizan a un electrón. b) Escriba los cuatro números
TEMA 4: EL ENLACE QUÍMICO
 TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
CLASE Nº 4 ENLACE QUÍMICO
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
Química Orgánica I. Clase 2.
 Química Orgánica I Clase 2. Enlace Quimico. Teoria de Enlace de Valencia F 2 Enlace Covalente Polar: Enlace donde la densidad electronica esta polarizada hacia uno de los dos atomos. Electronegatividad
Química Orgánica I Clase 2. Enlace Quimico. Teoria de Enlace de Valencia F 2 Enlace Covalente Polar: Enlace donde la densidad electronica esta polarizada hacia uno de los dos atomos. Electronegatividad
Unidad 1 (Parte IV, (cont.) )
 Unidad 1 (Parte IV, 1.1.2 (cont.) ) Objetivos de la presentación: 1. Describa los procesos de excitación-hibridación para el átomo de carbono, que dan lugar a la formación de orbitales sp, sp 2 y sp 3.
Unidad 1 (Parte IV, 1.1.2 (cont.) ) Objetivos de la presentación: 1. Describa los procesos de excitación-hibridación para el átomo de carbono, que dan lugar a la formación de orbitales sp, sp 2 y sp 3.
Teoría atómica I: Modelos atómicos, estructura atómica y tipos de átomos. Teoría atómica II: Números cuánticos y configuración electrónica
 TEORÍA ATÓMICA Teoría atómica I: Modelos atómicos, estructura atómica y tipos de átomos Teoría atómica II: Números cuánticos y configuración electrónica Aprendizajes esperados Diferenciar los distintos
TEORÍA ATÓMICA Teoría atómica I: Modelos atómicos, estructura atómica y tipos de átomos Teoría atómica II: Números cuánticos y configuración electrónica Aprendizajes esperados Diferenciar los distintos
Modelo de enlace iónico: Modelo electrostático simple
 Modelos de Enlace Enlace iónico Modelo de enlace iónico: Modelo electrostático simple Estructuras de Lewis: Modelo de enlace por pares de electrones Teoría de Repulsión de pares electrónicos de la capa
Modelos de Enlace Enlace iónico Modelo de enlace iónico: Modelo electrostático simple Estructuras de Lewis: Modelo de enlace por pares de electrones Teoría de Repulsión de pares electrónicos de la capa
Metales Alcalinos. Propiedades periódicas. Propiedades periódicas
 Tabla periódica: es un rearreglo tabular de los elementos químicos. Ley periódica: las propiedades físicas como químicas de los elementos varían en forma periódica conforme aumenta la masa atómica. 1 Radios
Tabla periódica: es un rearreglo tabular de los elementos químicos. Ley periódica: las propiedades físicas como químicas de los elementos varían en forma periódica conforme aumenta la masa atómica. 1 Radios
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I 2012
 El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I 2012 Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I 2012 Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
Enlace Químico Orbitales moleculares
 QUIMICA INORGÁNICA Enlace Químico Orbitales moleculares Materiales: 1ra clase: Tabla periódica Modelo de orbitales atómicos 2da clase: Paramagnetismo del oxígeno: Termos, grande y chicos, manguera, imán
QUIMICA INORGÁNICA Enlace Químico Orbitales moleculares Materiales: 1ra clase: Tabla periódica Modelo de orbitales atómicos 2da clase: Paramagnetismo del oxígeno: Termos, grande y chicos, manguera, imán
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
INSTITUTO POLITECNICO NACIONAL CENTRO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS No. 3 ESTANISLAO RAMIREZ RUIZ
 Enlace Quimico y la Regla del Octeto Las primeras especulaciones respecto a la naturaleza del enlace químico son tan tempranas como en el siglo XII, se suponía que ciertos tipos de especies químicas estaban
Enlace Quimico y la Regla del Octeto Las primeras especulaciones respecto a la naturaleza del enlace químico son tan tempranas como en el siglo XII, se suponía que ciertos tipos de especies químicas estaban
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
Tema 1 Átomos y Tabla Periódica
 Tema Átomos y Tabla Periódica Tres partículas subatómicas: el protón (carga +), el neutrón (carga = ) y el electrón (carga -) : son las partículas principales que afectan el comportamiento químico de los
Tema Átomos y Tabla Periódica Tres partículas subatómicas: el protón (carga +), el neutrón (carga = ) y el electrón (carga -) : son las partículas principales que afectan el comportamiento químico de los
CÁTEDRA DE QUÍMICA GENERAL E INORGÁNICA GUIA DE ESTUDIO Nº 3 ENLACE QUÍMICO
 GUIA DE ESTUDIO Nº 3 1. Define enlace químico. ENLACE QUÍMICO 2. Qué son los electrones de valencia? Cuántos electrones de valencia posee un átomo de nitrógeno? 3. Analiza la siguiente configuración electrónica
GUIA DE ESTUDIO Nº 3 1. Define enlace químico. ENLACE QUÍMICO 2. Qué son los electrones de valencia? Cuántos electrones de valencia posee un átomo de nitrógeno? 3. Analiza la siguiente configuración electrónica
EL INTERIOR DE LA MATERIA
 EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
Orbital: región espacio disponible encuentra e-. Isótopos: át = #p+ y #n Principio incertidumbre Heisenberg: localización e-. Orbitales degenerados:
 Orbital: región espacio disponible encuentra e-. Isótopos: át = #p+ y #n Principio incertidumbre Heisenberg: localización e-. Orbitales degenerados: = E px py pz. Principio Exclusión Pauli: c/orbital 2
Orbital: región espacio disponible encuentra e-. Isótopos: át = #p+ y #n Principio incertidumbre Heisenberg: localización e-. Orbitales degenerados: = E px py pz. Principio Exclusión Pauli: c/orbital 2
PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016
 PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016 I. ESTRUCTURA ATÓMICA 1.1 PARTÍCULAS SUBATÓMICAS Partícula subatómica Símbolo Carga fundamental (Q) Carga relativa
PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016 I. ESTRUCTURA ATÓMICA 1.1 PARTÍCULAS SUBATÓMICAS Partícula subatómica Símbolo Carga fundamental (Q) Carga relativa
ENLACE QUÍMICO. Hidrógeno. Carbono. Agua. Etileno. Acetileno
 ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno
ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno
TEMA 2. EL ENLACE QUÍMICO. NOCIONES SOBRE EL ENLACE CONVALENTE Y LAS MOLÉCULAS COVALENTES QUÍMICA 2º BACHILLERATO.
 El enlace covalente se produce cuando se unen átomos no metálicos entre sí o con el hidrógeno, átomos con electronegatividades semejantes y altas en general. Se forma básicamente por compartición de electrones
El enlace covalente se produce cuando se unen átomos no metálicos entre sí o con el hidrógeno, átomos con electronegatividades semejantes y altas en general. Se forma básicamente por compartición de electrones
Enlaces entre átomos:
 Enlaces entre átomos: 1. Enlace químico 2. Formación de enlaces moleculares 3. Orbitales híbridos 4. Fórmula de las moléculas 5. Forma de las moléculas 1 En la naturaleza, los átomos no se encuentran aislados
Enlaces entre átomos: 1. Enlace químico 2. Formación de enlaces moleculares 3. Orbitales híbridos 4. Fórmula de las moléculas 5. Forma de las moléculas 1 En la naturaleza, los átomos no se encuentran aislados
APLICA LO APRENDIDO. 1. Relaciona la columna de la izquierda con la derecha:
 APLICA LO APRENDIDO 1. Relaciona la columna de la izquierda con la derecha: a) Agrupo los elementos en triadas ( ) Lavoisier b) Clasificó los elementos en metales ( ) Dumas y no metales. c) Enunció la
APLICA LO APRENDIDO 1. Relaciona la columna de la izquierda con la derecha: a) Agrupo los elementos en triadas ( ) Lavoisier b) Clasificó los elementos en metales ( ) Dumas y no metales. c) Enunció la
CORPORACION EDUCACIONAL JUAN XXIII COLEGIO "CARDENAL RAÚL SILVA HENRÍQUEZ" DEPARTAMENTO DE CIENCIAS QUÍMICA. Teoría de Enlace
 CORPORACION EDUCACIONAL JUAN XXIII COLEGIO "CARDENAL RAÚL SILVA HENRÍQUEZ" DEPARTAMENTO DE CIENCIAS QUÍMICA Teoría de Enlace Objetivo: Establecer que la capacidad de interacción entre átomos se explica
CORPORACION EDUCACIONAL JUAN XXIII COLEGIO "CARDENAL RAÚL SILVA HENRÍQUEZ" DEPARTAMENTO DE CIENCIAS QUÍMICA Teoría de Enlace Objetivo: Establecer que la capacidad de interacción entre átomos se explica
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I
 El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
El electrón. Naturaleza. Distribución de los electrones en el átomo. Química General I Atención Leer del libro Química de Chang 10ma edición. Capítulo 7, págs 288 a 294. Ojo, la lectura es para ubicarse
GUIA EJERCICIOS PSU TEORIA ATOMICA, NUMEROS CUANTICOS Y CONFIGURACION EDITORIAL SM
 GUIA EJERCICIOS PSU TEORIA ATOMICA, NUMEROS CUANTICOS Y CONFIGURACION EDITORIAL SM 1. Según el modelo mecanocuántico, dónde se pueden encontrar los electrones? A. En una posición definida en un momento
GUIA EJERCICIOS PSU TEORIA ATOMICA, NUMEROS CUANTICOS Y CONFIGURACION EDITORIAL SM 1. Según el modelo mecanocuántico, dónde se pueden encontrar los electrones? A. En una posición definida en un momento
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS ESPECTROSCOPÍA ORBITALES ATÓMICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS ESPECTROSCOPÍA NOMBRES: Carpio Diana (clínicos) Gallegos Mayra (clínicos) PARALELO: jueves de 10 a 12 DEFINICIÓN DE ORBITAL ATÓMICO ORBITALES
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS ESPECTROSCOPÍA NOMBRES: Carpio Diana (clínicos) Gallegos Mayra (clínicos) PARALELO: jueves de 10 a 12 DEFINICIÓN DE ORBITAL ATÓMICO ORBITALES
Evaluación unidad 3 Enlace covalente
 CRITERIOS DE EVALUACIÓN 1. Utilizar el modelo de enlace correspondiente para explicar la formación de moléculas, de cristales y estructuras macroscópicas, y deducir sus propiedades. 2. Describir las características
CRITERIOS DE EVALUACIÓN 1. Utilizar el modelo de enlace correspondiente para explicar la formación de moléculas, de cristales y estructuras macroscópicas, y deducir sus propiedades. 2. Describir las características
ENLACES QUÍMICOS. Prof.: Grettel Azofeifa Lizano
 ENLACES QUÍMICOS Prof.: Grettel Azofeifa Lizano Estructura de Lewis Es una representación de símbolos y puntos, propuesta pro Gilbert Lewis. Según las configuraciones electrónicas, se tiene el tronco electrónico
ENLACES QUÍMICOS Prof.: Grettel Azofeifa Lizano Estructura de Lewis Es una representación de símbolos y puntos, propuesta pro Gilbert Lewis. Según las configuraciones electrónicas, se tiene el tronco electrónico
El Modelo Moderno y resultados de nuestro interés
 CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
Teoría de Orbitales Moleculares (OM)
 Teoría de Orbitales Moleculares (OM) La combinación de orbitales atómicos sobre átomos diferentes forman los llamados orbitales moleculares; dentro de este modelo se señala que los electrones que pertenecen
Teoría de Orbitales Moleculares (OM) La combinación de orbitales atómicos sobre átomos diferentes forman los llamados orbitales moleculares; dentro de este modelo se señala que los electrones que pertenecen
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
TEMA 1 CONCEPTOS FUNDAMENTALES EN QUIMICA ORGANICA
 TEMA 1 NEPTS FUNDAMENTALES EN QUIMIA RGANIA 1. oncepto y origen de la Química rgánica. 2. La Industria Química rgánica. 3. Representación de Lewis de las moléculas orgánicas. 4. Electronegatividad y polarización
TEMA 1 NEPTS FUNDAMENTALES EN QUIMIA RGANIA 1. oncepto y origen de la Química rgánica. 2. La Industria Química rgánica. 3. Representación de Lewis de las moléculas orgánicas. 4. Electronegatividad y polarización
n = = 1; 1234; 4; l l= = 0; 1; m m = = 0; 0 ; + 0; s 12; 2; = s s s = ½ ½
 ENLACE QUÍMICO 2012 6p 5d Energía 6s 4 f 5p 4d 5s 4s 4p 3d 3p 3s 2s 1s 2p nn == 4; 1; 2; 3; 0; 2; + 0; 2; ss = s= += +½ 1; ll == 1; 2; 3; 4; 0; m 2; 1; m == + 1; 0; 2; 1; s= +½ +½ ½ Enlaces según
ENLACE QUÍMICO 2012 6p 5d Energía 6s 4 f 5p 4d 5s 4s 4p 3d 3p 3s 2s 1s 2p nn == 4; 1; 2; 3; 0; 2; + 0; 2; ss = s= += +½ 1; ll == 1; 2; 3; 4; 0; m 2; 1; m == + 1; 0; 2; 1; s= +½ +½ ½ Enlaces según
GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN. Subsector: QUÍMICA Docente: Liduvina Campos A. Nombre alumno: Curso: Fecha:
 Liceo Polivalente Juan Antonio Ríos Quinta Normal GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN Unidad temática: Ejercicios de contenidos Guías 0 a 6 Objetivo General: Repaso de contenidos guías 0 a 6 Contenidos:
Liceo Polivalente Juan Antonio Ríos Quinta Normal GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN Unidad temática: Ejercicios de contenidos Guías 0 a 6 Objetivo General: Repaso de contenidos guías 0 a 6 Contenidos:
Estructuras de Lewis y la regla del octeto
 Estructuras de Lewis y la regla del octeto En 1916 el químico estadounidense Gilbert Newton Lewis y el físico alemán Walter Kossel, de forma independiente, idearon un modelo sencillo para representar a
Estructuras de Lewis y la regla del octeto En 1916 el químico estadounidense Gilbert Newton Lewis y el físico alemán Walter Kossel, de forma independiente, idearon un modelo sencillo para representar a
ESTRUCTURA BÁSICA DEL ÁTOMO Y SUS INTERACCIONES
 ESTRUCTURA BÁSICA DEL ÁTOMO Y SUS INTERACCIONES Estructura del átomo NÚCLEO: PROTONES Y NEUTRONES CORTEZA: ELECTRONES Hoy sabemos que el átomo es divisible, puesto que está formado por partículas más pequeñas,
ESTRUCTURA BÁSICA DEL ÁTOMO Y SUS INTERACCIONES Estructura del átomo NÚCLEO: PROTONES Y NEUTRONES CORTEZA: ELECTRONES Hoy sabemos que el átomo es divisible, puesto que está formado por partículas más pequeñas,
TEMA 1: Estructura Atómica
 TEMA 1: Estructura Atómica 1. Configuraciones electrónicas. 2. Propiedades periódicas: Energía de activación Afinidad electrónica Electronegatividad Descripción mecánico- cuántica del átomo: Orbitales
TEMA 1: Estructura Atómica 1. Configuraciones electrónicas. 2. Propiedades periódicas: Energía de activación Afinidad electrónica Electronegatividad Descripción mecánico- cuántica del átomo: Orbitales
Guía de Estudio para 1er Parcial Temas Selectos de Química
 Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: El átomo y sus enlaces
 1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
Teoría del Enlace de Orbitales Moleculares (TOM)
 Teoría del Enlace de Orbitales Moleculares (TOM) Conceptos Fundamentales: Combinación Lineal de Orbitales Atómicos: CLOA Moléculas diatómicas sencillas homonucleares: OM enlazantes y antienlazantes. OM
Teoría del Enlace de Orbitales Moleculares (TOM) Conceptos Fundamentales: Combinación Lineal de Orbitales Atómicos: CLOA Moléculas diatómicas sencillas homonucleares: OM enlazantes y antienlazantes. OM
Enlace iónico. Propiedades de los compuestos iónicos
 Enlace iónico Un ión no es más que un átomo o molécula que ha perdido su neutralidad eléctrica, debido a que ha perdido o ganado electrones de su capa externa El enlace iónico está presente en todos los
Enlace iónico Un ión no es más que un átomo o molécula que ha perdido su neutralidad eléctrica, debido a que ha perdido o ganado electrones de su capa externa El enlace iónico está presente en todos los
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Indique razonadamente si son ciertas o falsas cada una de las siguientes afirmaciones:
 Considere las configuraciones electrónicas en el estado fundamental: 1ª) 1s 2 2s 2 2p 7 ; 2ª ) 1s 2 2s 3 ; 3ª ) 1s 2 2s 2 2p 5 ; 4ª ) 1s 2 2s 2 2p 6 3s 1 a) Razone cuáles cumplen el principio de exclusión
Considere las configuraciones electrónicas en el estado fundamental: 1ª) 1s 2 2s 2 2p 7 ; 2ª ) 1s 2 2s 3 ; 3ª ) 1s 2 2s 2 2p 5 ; 4ª ) 1s 2 2s 2 2p 6 3s 1 a) Razone cuáles cumplen el principio de exclusión
Tema 2. La agrupación de los átomos en la materia.
 Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
TABLA PERIÓDICA Y CONFIGURACIONES ELECTRÓNICAS. Facultad de Química, UNAM. Curso: Química General 1 Mtra. Norma M. López 1
 TABLA PERIÓDICA Y CONFIGURACIONES ELECTRÓNICAS Facultad de Química, UNAM. Curso: Química General 1 Mtra. Norma M. López 1 ÁTOMO Partícula muy pequeña (1 a 5 Å) Conformada por protones, neutrones y electrones.
TABLA PERIÓDICA Y CONFIGURACIONES ELECTRÓNICAS Facultad de Química, UNAM. Curso: Química General 1 Mtra. Norma M. López 1 ÁTOMO Partícula muy pequeña (1 a 5 Å) Conformada por protones, neutrones y electrones.
CATEDRA DE QUIMICA GENERAL TSIA
 ECUACIÓN DE SCHRÖDINGER Fue Erwin Schrodinger, EN 1926quien ideó el modelo atómico actual, llamado "Ecuación de Onda", una fórmula matemática que considera los aspectos anteriores. La solución de esta
ECUACIÓN DE SCHRÖDINGER Fue Erwin Schrodinger, EN 1926quien ideó el modelo atómico actual, llamado "Ecuación de Onda", una fórmula matemática que considera los aspectos anteriores. La solución de esta
ENLACE QUÍMICO. La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia
 ENLACE QUÍMICO La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia Concepto importante para la química: Diversidad de sustancias Características y propiedades
ENLACE QUÍMICO La fuerza responsable de la unión estable entre los iones, átomos o moléculas que forman una sustancia Concepto importante para la química: Diversidad de sustancias Características y propiedades
Los átomos y sus enlaces
 Los átomos y sus enlaces Unidad 11 El modelo nuclear de átomo Demócrito Dalton Thompson Rutherford 1 El modelo nuclear de átomo Núcleo central / carga positiva / protones. Corteza / carga negativa / electrones.
Los átomos y sus enlaces Unidad 11 El modelo nuclear de átomo Demócrito Dalton Thompson Rutherford 1 El modelo nuclear de átomo Núcleo central / carga positiva / protones. Corteza / carga negativa / electrones.
ENLACE QUIMICO. Química General 2009
 ENLACE QUIMICO 1.- Prediga la estructura de Lewis de los siguientes compuestos: a.- BF 3 b.- CH 4 Para poder predecir la estructura de Lewis utilizamos la siguiente fórmula: E = I - R Donde: E representa
ENLACE QUIMICO 1.- Prediga la estructura de Lewis de los siguientes compuestos: a.- BF 3 b.- CH 4 Para poder predecir la estructura de Lewis utilizamos la siguiente fórmula: E = I - R Donde: E representa
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS
 I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
Química General UNIDAD N 2. Centro de Especialización en Asuntos Económicos Regionales. Asignatura:
 Centro de Especialización en Asuntos Económicos Regionales Asignatura: Química General Carrera: Tecnicatura en Saneamiento y Control Ambiental Guía de Trabajos Prácticos UNIDAD N 2 Página 1 de 6 1) Completar
Centro de Especialización en Asuntos Económicos Regionales Asignatura: Química General Carrera: Tecnicatura en Saneamiento y Control Ambiental Guía de Trabajos Prácticos UNIDAD N 2 Página 1 de 6 1) Completar
LA ESTRUCTURA ATÓMICA
 LA ESTRUCTURA ATÓMICA M en C Alicia Cea Bonilla 1 Teoría Atómica En 1808, John Dalton estableció las hipótesis sobre las que fundó su teoría atómica: a) Los elementos están formados por partículas pequeñas
LA ESTRUCTURA ATÓMICA M en C Alicia Cea Bonilla 1 Teoría Atómica En 1808, John Dalton estableció las hipótesis sobre las que fundó su teoría atómica: a) Los elementos están formados por partículas pequeñas
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
Química Orgánica y Biológica Apunte
 FUERZAS INTERMOLECULARES El enlace covalente es la unión que explica el mantenimiento de la unidad estructural de un compuesto orgánico. Además de este enlace intramolecular se pueden dar interacciones
FUERZAS INTERMOLECULARES El enlace covalente es la unión que explica el mantenimiento de la unidad estructural de un compuesto orgánico. Además de este enlace intramolecular se pueden dar interacciones
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES
 ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
ENLACE QUÍMICO Y UNIONES INTRAMOLECULARES OBJETIVOS Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. Comprender las características de los distintos
ESTRUCTURA DEL NÚCLEO
 ESTRUCTURA DEL NÚCLEO 1. Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes átomos: 7 75 10 12 a) 3Li b) 33As c) 5B d) 6C 2. Calcula
ESTRUCTURA DEL NÚCLEO 1. Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes átomos: 7 75 10 12 a) 3Li b) 33As c) 5B d) 6C 2. Calcula
ENLACE QUÍMICO COVALENTE IÓNICO METÁLICO
 ENLACE QUÍMICO IÓNICO COVALENTE METÁLICO 1- DEFINICIÓN DE ENLACE Enlace químico: fuerza que hace que los átomos se unan para formar un sistema químico más estable Situación antienlazante: predominan las
ENLACE QUÍMICO IÓNICO COVALENTE METÁLICO 1- DEFINICIÓN DE ENLACE Enlace químico: fuerza que hace que los átomos se unan para formar un sistema químico más estable Situación antienlazante: predominan las
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS.
 PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO
 TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO. Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3
TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO. Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3
SOLUCIONES FICHA 2: CONFIGURACIÓN ELECTRÓNICA Y PROPIEDADES PERIÓDICAS
 1.- Cuántos electrones pueden existir en los orbitales: 3d, 2p, 4f y 5s? 3d: El número 3 indica que estos orbitales están en el nivel 3. La letra d indica el tipo de orbital en el que están los electrones.
1.- Cuántos electrones pueden existir en los orbitales: 3d, 2p, 4f y 5s? 3d: El número 3 indica que estos orbitales están en el nivel 3. La letra d indica el tipo de orbital en el que están los electrones.
Clase N 1. Modelo Atómico I
 Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico I ICAL ATACAMA Módulo Plan Común Modelos Atómicos Teoría Atómica De Dalton Los elementos están formados por partículas extremadamente
Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico I ICAL ATACAMA Módulo Plan Común Modelos Atómicos Teoría Atómica De Dalton Los elementos están formados por partículas extremadamente
Regla del octeto Gilbert Newton Lewis
 Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
Resolución de ejercicios PRÁCTICO 12
 Resolución de ejercicios PRÁCTIC 12 1) a) bservando la estructura de Lewis de la molécula BeH 2 podemos decir que el átomo de Be se une a dos átomos de H mediante dos enlaces simples. Una hibridación de
Resolución de ejercicios PRÁCTIC 12 1) a) bservando la estructura de Lewis de la molécula BeH 2 podemos decir que el átomo de Be se une a dos átomos de H mediante dos enlaces simples. Una hibridación de
ENLACE QUÍMICO. Hidrógeno. Carbono. Agua. Etileno. Acetileno
 ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno
ENLACE QUÍMICO Símbolos y estructuras de Lewis: Modelo más simple para describir el enlace químico (sólo en moléculas constituidas por átomos de elementos representativos). Hidrógeno Carbono Agua Etileno
