Ficha del Medicamento ENBREL Polvo y disolvente para sol. iny. 25 mg 2006
|
|
|
- Yolanda Fernández Montoya
- hace 8 años
- Vistas:
Transcripción
1 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Ficha del Medicamento ENBREL Polvo y disolvente para sol. iny. 25 mg 2006 Cada vial contiene: 25 mg de etanercept. Etanercept es una proteína humana compuesta por el receptor p75 del factor de necrosis tumoral y la porción Fc de la IgG1 humana, producida por tecnología del ADN recombinante en un sistema de células de ovario de hámster chino (CHO). Etanercept es una proteína dimérica construída genéticamente por fusión del dominio extracelular soluble del receptor-2 del factor de necrosis tumoral humano (RTNF2/p75), unido al dominio Fc de la IgG1 humana. Este componente Fc contiene la región bisagra, las regiones CH 2 y CH 3, pero no la región CH 1 de la IgG1. Etanercept contiene 934 aminoácidos y tiene un peso molecular aparente de aproximadamente 150 kilodaltons. La potencia se determina midiendo la capacidad de etanercept para neutralizar la inhibición del crecimiento de las células A375 mediado por el TNFα La actividad específica de etanercept es 1,7 x 10 6 unidades/mg. Excipientes, véase Lista de excipientes. FORMA FARMACÉUTICA Polvo y disolvente para solución inyectable. El polvo blanco se suministra en un vial de vidrio transparente con tapón de goma, cápsula de aluminio y tapa de plástico de color rosa. (véase Naturaleza y contenido del recipiente). El disolvente es un líquido incoloro y transparente que se suministra en una jeringa de vidrio precargada (véase Naturaleza y contenido del recipiente). DATOS CLÍNICOS / INDICACIONES TERAPÉUTICAS Artritis reumatoide: Enbrel en combinación con metotrexato está indicado en el tratamiento de la artritis reumatoide activa de moderada a grave en adultos cuando la respuesta a fármacos antirreumáticos que modifican la enfermedad, incluido metotrexato (a no ser que esté contraindicado), ha sido insuficiente. Enbrel puede administrarse como monoterapia en caso de intolerancia a metotrexato o cuando el tratamiento continuo con metotrexato no sea apropiado. Enbrel también está indicado para el tratamiento de la artritis reumatoide progresiva, activa y grave en adultos que no han sido tratados previamente con metotrexato. Enbrel, solo o en combinación con metotrexato, ha demostrado reducir la tasa de progresión del daño de las articulaciones, medido a través de rayos X, así como mejorar la función física. Artritis idiopática juvenil poliarticular: Tratamiento de la artritis idiopática juvenil poliarticular activa en niños de 4 a 17 años que han tenido una respuesta insuficiente, o que tienen una intolerancia probada, al metotrexato. Enbrel no ha sido estudiado en niños menores de 4 años. Artritis psoriásica: Tratamiento de la artritis psoriásica activa y progresiva en adultos cuando la respuesta a una terapia previa con fármacos antirreumáticos modificadores de la enfermedad, ha sido insuficiente. Espondilitis anquilosante: Tratamiento de la espondilitis anquilosante activa grave en adultos que no han tenido una respuesta adecuada a la terapia convencional. Psoriasis en placa: Tratamiento de adultos con psoriasis en placa de moderada a grave que no han respondido o que tienen contraindicada, o no toleran otra terapia sistémica incluyendo ciclosporina, metotrexato o PUVA (véase Propiedades farmacodinámicas) DATOS CLÍNICOS / POSOLOGÍA El tratamiento con Enbrel debe ser iniciado y supervisado por un médico especialista experimentado en el diagnóstico y tratamiento de la artritis reumatoide, artritis psoriásica, espondilitis anquilosante o psoriasis. Enbrel se encuentra disponible en dosis de 25 mg y de 50 mg. Cada vial de Enbrel debe ser reconstituido con 1 ml de agua para inyección antes de ser utilizado y administrado por inyección subcutánea. Adultos (18-64 años). Artritis reumatoide: 25 mg de Enbrel administrados dos veces a la semana es la dosis recomendada. Alternativamente, una dosis de 50 mg administrada una vez a la semana ha demostrado ser segura y efectiva (véase Propiedades farmacodinámicas). Artritis psoriásica y espondilitis anquilosante: La dosis recomendada de Enbrel es de 25 mg administrados dos veces a la semana o de 50 mg administrados una vez a la semana. Psoriasis en placas: La dosis recomendada de Enbrel es de 25 mg administrados dos veces a la semana. Alternativamente, pueden ser administrados 50 mg dos veces a la semana durante 12 semanas, seguidos, si es necesario, de una dosis de 25 mg dos veces a la semana. El tratamiento con Enbrel debe continuar hasta conseguir la remisión, hasta 24 semanas. El tratamiento debe ser discontinuado en pacientes en los que no se observe respuesta después de 12 semanas. Si una repetición del tratamiento con Enbrel está indicada, deben seguirse las pautas sobre la duración del mismo anteriormente indicadas. La dosis debe ser 25 mg dos veces a la semana. Pacientes ancianos (>65 años). No se requiere ajuste de la dosis. La posología y administración es la misma que la de adultos de años de edad. Niños y adolescentes (>4 a <18 años). Después de la reconstitución de 25 mg de Enbrel con 1 ml de agua para inyección administrar como inyección subcutánea, 0,4 mg/kg (hasta un máximo de 25 mg por dosis) dos veces a la semana con un intervalo entre dosis de 3-4 días. Insuficiencia renal y hepática. No se requiere ajuste de la dosis. DATOS CLÍNICOS / CONTRAINDICACIONES
2 Hipersensibilidad al principio activo o a alguno de los excipientes. Sepsis o riesgo de sepsis. En pacientes con infecciones activas, incluyendo infecciones crónicas o localizadas, no debe iniciarse el tratamiento con Enbrel. DATOS CLÍNICOS / ADVERTENCIAS Y PRECAUCIONES Infecciones: Se ha informado de sepsis e infecciones graves (con muerte, peligro de muerte o que requieren hospitalización o antibióticos intravenosos), con el uso de Enbrel (Reacciones adversas). Muchos de estos acontecimientos graves han ocurrido en pacientes con enfermedades subyacentes, que además de su artritis reumatoide, pudieran predisponerles a infecciones. Debería realizarse un seguimiento estrecho de aquellos pacientes que desarrollen una nueva infección mientras se están sometiendo al tratamiento con Enbrel. Debería suspenderse la administración de Enbrel si un paciente desarrolla una infección grave. Los médicos deberán extremar las precauciones cuando consideren el uso de Enbrel en pacientes con historial de infecciones crónicas o recurrentes o con trastornos subyacentes que pudieran predisponer a los pacientes a infecciones, tales como diabetes avanzada o mal controlada. Tratamiento concomitante de Enbrel y anakinra: La administración concomitante de Enbrel y anakinra se ha asociado con un riesgo incrementado de infecciones graves y neutropenia en comparación con la administración sola de Enbrel. Esta combinación no ha demostrado incremento del beneficio clínico. Por tanto, no se recomienda el uso combinado de Enbrel y anakinra (véase Interacción con otros medicamentos y otras formas de interacción y Reacciones adversas). Reacciones alérgicas: Se han observado con frecuencia reacciones alérgicas asociadas a la administración de Enbrel. Las reacciones alérgicas han incluido angioedema y urticaria:se han producido reacciones graves. Si se produce cualquier reacción alérgica o anafiláctica grave, la terapia con Enbrel debería interrumpirse inmediatamente y comenzar una terapia apropiada. Inmunosupresión: Existe la posibilidad de que las terapias anti-tnf, incluyendo Enbrel, afecten a las defensas del hospedador frente a infecciones y enfermedades malignas, ya que el TNF es un mediador de la inflamación y modula la respuesta inmune celular. En el periodo de post-comercialización, se han recibido informes sobre enfermedades malignas (incluyendo linfoma, cáncer de mama y pulmón), (véase Reacciones adversas). En un estudio con 49 pacientes con artritis reumatoide tratados con Enbrel, no hubo evidencia de depresión de hipersensibilidad de tipo retardado, disminución de los niveles de inmunoglobulinas o cambio en el número de poblaciones de células efectoras. En las partes controladas de los ensayos clínicos de los antagonistas del TNF, se han observado más casos de linfomas entre los pacientes que recibieron un antagonista del TNF en comparación con el grupo control. Sin embargo, la incidencia fue rara, y el periodo de seguimiento de los pacientes con placebo fue más corto que el de los pacientes que recibían el tratamiento con el antagonista del TNF. Además, existe un mayor riesgo basal de linfomas en pacientes con artritis reumatoide con enfermedad inflamatoria, de larga evolución y de alta actividad, que complica la estimación del riesgo. Con el conocimiento actual, no se puede excluir un posible riesgo de desarrollo de linfomas u otras enfermedades malignas en pacientes tratados con antagonistas del TNF. Dos pacientes con artritis idiopática juvenil desarrollaron infección por varicela y signos y síntomas de meningitis aséptica que se resolvieron sin secuelas. Los pacientes con una exposición significativa al virus de la varicela deben interrumpir temporalmente el tratamiento con Enbrel y debe considerarse el tratamiento profiláctico con inmunoglobulina de varicela Zoster. La seguridad y eficacia de Enbrel en pacientes con inmunosupresión o infecciones crónicas no han sido evaluadas. Vacunas: No deben administrarse vacunas vivas simultáneamente con Enbrel. No se dispone de datos sobre la transmisión secundaria de la infección por vacunas vivas en pacientes que reciben Enbrel. Se recomienda que los pacientes con artritis idiopática juvenil, si es posible, sean vacunados de acuerdo con los calendarios de vacunación previstos, antes de comenzar la terapia con Enbrel. En un ensayo clínico doble ciego, aleatorizado, controlado con placebo 184 pacientes con artritis psoriásica también recibieron una vacuna polisacárida neumocócica multivalente en la semana 4. En este estudio la mayoría de los pacientes con artritis psoriásica que recibieron Enbrel fueron capaces de generar una respuesta inmune efectiva de células B a la vacuna polisacárida neumocócica, pero los títulos en conjunto fueron moderadamente inferiores y pocos pacientes duplicaron los títulos en comparación con pacientes que no recibieron Enbrel, de lo cual se desconoce el significado clínico. Formación de anticuerpos: El tratamiento con Enbrel puede producir la formación de anticuerpos autoinmunes (véase Reacciones adversas). Reacciones hematológicas: En pacientes tratados con Enbrel se han notificado raramente casos de pancitopenia y muy raramente casos de anemia aplásica, algunos con resultado mortal. Se debe tener precaución en pacientes tratados con Enbrel los cuales tengan un historial de discrasias sanguíneas. Todos los pacientes deben ser advertidos de que si aparecen síntomas que sugieren la existencia de discrasias sanguíneas o infecciones (como p. ej., fiebre persistente, odinofagia, hematomas, sangrado, palidez) mientras están tratándose con Enbrel deben informarlo inmediatamente a su médico. Estos pacientes deberán ser estudiados urgentemente incluyendo un recuento de células sanguíneas completo. Si se confirma una discrasia sanguínea, se deberá interrumpir el tratamiento con Enbrel. Trastornos del SNC: Ha habido, muy ocasionalmente, informes de trastornos desmielinizantes del SNC en pacientes tratados con Enbrel (véase Reacciones adversas). Aunque no se han desarrollado ensayos clínicos para evaluar el tratamiento con Enbrel en pacientes con esclerosis múltiple, los ensayos clínicos de otros antagonistas del TNF en pacientes con esclerosis múltiple han mostrado un incremento en la actividad de la enfermedad. Cuando se prescriba Enbrel a pacientes con enfermedad del SNC desmielinzante preexistente o de reciente comienzo, o a aquellos que se considere que tienen un riesgo incrementado de desarrollar enfermedad desmielinizante, se recomienda una cuidadosa evaluación del riesgo beneficio, incluyendo una evaluación neurológica. Terapia combinada: En un ensayo clínico controlado dos años de duración en pacientes con artritis reumatoide, la combinación de Enbrel y metotrexato, no evidenció hallazgos inesperados sobre la seguridad, y el perfil de seguridad de Enbrel cuando se administra con metotrexato fue similar a los perfiles notificados en los estudios de Enbrel y metotrexato solos. Están en marcha estudios a largo plazo para evaluar la seguridad de la combinación. La seguridad a largo plazo cuando Enbrel se administra en combinación con otros fármacos antirreumáticos modificadores de la enfermedad, no ha sido establecida. No se ha estudiado el uso de Enbrel en combinación con otras terapias sistémicas o fototerapia para el tratamiento de la psoriasis. Insuficiencia renal y hepática: Basado en datos farmacocinéticos (véase Propiedades farmacocinéticas), en pacientes con insuficiencia renal o hepática, no se requiere ajuste de dosis; la experiencia clínica en este tipo de pacientes es limitada. Insuficiencia cardíaca congestiva: Los médicos deben tener precaución cuando se use Enbrel en pacientes que tienen insuficiencia cardíaca congestiva (ICC). Ha habido informes post comercialización sobre empeoramiento de la ICC, con y sin factores de precipitación identificables, en pacientes que están tomando Enbrel. Dos grandes ensayos clínicos en los que se estaba evaluando el uso de Enbrel en el tratamiento de la ICC terminaron antes de tiempo debido a la falta de eficacia. Aunque no es concluyente, los datos de unos de estos ensayos sugieren una posible tendencia al empeoramiento de la ICC en aquellos pacientes asignados al tratamiento con Enbrel. Granulomatosis de Wegener: En un ensayo controlado con placebo, en el que 89 pacientes fueron tratados con Enbrel en adición a la terapia estándar (incluyendo ciclofosfamida o metrotrexato y glucocorticoides) para una duración media de 25 meses, no se ha demostrado que Enbrel sea un tratamiento eficaz para la granulomatosis de Wegener. La incidencia de enfermedades malignas no cutáneas de diferentes tipos fue significativamente más elevada en pacientes tratrados con Enbrel que en pacientes del grupo de control. No se recomienda Enbrel para el tratamiento de la granulomatosis. DATOS CLÍNICOS / INTERACCIONES
3 En ensayos clínicos, no se han observado interacciones cuando Enbrel se administró con glucocorticoides, salicilatos (excepto sulfasalazina), antiinflamatorios no esteroideos (AINEs), analgésicos o metotrexato. Para recomendaciones de vacunación, véase Advertencias y precauciones de empleo. En un ensayo clínico con pacientes que recibieron dosis establecidas de sulfasalazina, a las que se les añadió Enbrel, los pacientes que recibieron la combinación experimentaron una disminución estadísticamente significativa en el recuento medio de glóbulos blancos en comparación con los grupos tratados con sólo Enbrel o sulfasalazina. Se desconoce el significado clínico de esta interacción. Tratamiento concomitante de Enbrel y anakinra: Se ha observado que los pacientes tratados con Enbrel y anakinra tienen una tasa superior de infecciones graves en comparación con los pacientes tratados sólo con Enbrel o sólo con anakinra (datos históricos). Además, en un ensayo doble ciego controlado con placebo realizado en pacientes que estaban siendo tratados con metotrexato, se ha observado que los pacientes tratados con Enbrel y anakinra la tasa de infecciones graves (7%) y neutropenia fue superior a la de los pacientes tratados con Enbrel (véase Advertencias y precauciones de empleo y Reacciones adversas). La combinación Enbrel y anakinra no ha demostrado un mayor beneficio clínico y por tanto no se recomienda su uso. DATOS CLÍNICOS / EMBARAZO Y LACTANCIA No hay estudios de Enbrel en mujeres embarazadas. Durante el desarrollo, se han llevado a cabo estudios de toxicidad en ratas y conejos en los que no se observó evidencia de daño fetal o en la rata neonatal debido a Etanercept. No se dispone de datos preclínicos sobre toxicidad peri- y postnatal de etanercept y de los efectos del etanercept en la fertilidad y desarrollo general de la reproducción. Por tanto, no se recomienda el uso de Enbrel en mujeres embarazadas, y las mujeres en edad fértil deben ser advertidas de no quedarse embarazadas durante la terapia con Enbrel. Uso durante la lactancia: No se conoce si etanercept se excreta en la leche humana. Debido a que las inmunoglobulinas, como muchos otros fármacos, pueden ser excretadas en la leche humana, debería decidirse si dejar la lactancia o suspender el tratamiento con Enbrel durante la misma. DATOS CLÍNICOS / EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR No se han realizado estudios sobre los efectos sobre la capacidad para conducir y utilizar máquinas. DATOS CLÍNICOS / REACCIONES ADVERSAS Enbrel se ha estudiado en pacientes con artritis reumatoide en ensayos clínicos abiertos y a doble ciego. Estos ensayos incluyen 2 estudios con placebo controlados (349 pacientes que recibieron Enbrel y 152 pacientes que recibieron placebo), y 2 ensayos controlados, un ensayo activo controlado en el que se comparan Enbrel y metotrexato (415 pacientes que recibieron Enbrel y 217 pacientes que recibieron metotrexato) y otro ensayo controlado comparando Enbrel (223 pacientes), metotrexato (228 pacientes) y Enbrel en combinación con metotrexato (231 pacientes). La proporción de pacientes que abandonaron el tratamiento debido a acontecimientos adversos fue la misma en los dos grupos de tratamiento, Enbrel y placebo ; en el primer ensayo activo controlado con metotrexato, la tasa de abandonos fue significativamente más alta para metotrexato (10%) que para Enbrel (5%). En el segundo ensayo controlado, la proporción de discontinuación por acontecimientos adversos, después de 2 años de tratamiento, fue similar entre los tres grupos de tratamiento, Enbrel (16%), metotrexato (21%) y Enbrel en combinación con metotrexato (17%). Adicionalmente, Enbrel se ha estudiado en 131 pacientes con artritis psoriásica que participaron en dos estudios placebo controlados y a doble ciego y en un estudio de extensión abierto. Quinientos ocho (508) pacientes con espondilitis anquilosante fueron tratados con Enbrel en 4 estudios doble-ciego controlados con placebo. Enbrel también ha sido estudiado en pacientes con psoriasis en placa hasta 6 meses en 3 estudios doble ciego controlados con placebo. En ensayos clínicos doble ciego, en los que se comparaba Enbrel frente a placebo, las reacciones en el lugar de inyección fueron los acontecimientos adversos más frecuentes entre los pacientes tratados con Enbrel. Entre los pacientes con artritis reumatoide tratados en ensayos con placebo controlados, la frecuencia de los acontecimientos adversos graves producidos fue del 4% en 349 pacientes tratados con Enbrel en comparación con el 5% en 152 pacientes tratados con placebo. En el ensayo activo controlado con metotrexato, la frecuencia de los acontecimientos adversos graves producidos fue del 6% en 415 pacientes tratados con Enbrel en comparación con el 8% en 217 pacientes tratados con metotrexato. En el segundo ensayo controlado la tasa de acontecimientos adversos graves, después de 2 años de tratamiento, fue similar entre los tres grupos de tratamiento (Enbrel 16%, metotrexato 15% y Enbrel en combinación con metotrexato 17%). Entre los pacientes con psoriasis en placa tratados en los ensayos controlados con placebo, la frecuencia de efectos adversos graves fué de aproximadamente un 1% de 933 pacientes tratados con Enbrel en comparación con un 1% de 414 pacientes tratados con placebo. El siguiente listado de reacciones adversas se basa en la experiencia de los ensayos clínicos en adultos y en la experiencia post-comercialización. En la clasificación por órganos, las reacciones adversas están enumeradas por orden de frecuencia (número de pacientes que se espera experimenten la reacción), utilizando las siguientes categorías: muy frecuentes (>1/10); frecuentes (>1/100, <1/10); poco frecuentes (>1/1.000, <1/100); raras (>1/10.000, <1/1.000); muy raras (<1/10.000). Infecciones e infestaciones: Muy frecuentes: infecciones (incluyendo infecciones de las vías respiratorias superiores, bronquitis, cistitis, infecciones en la piel)*. Poco frecuentes: infecciones graves (incluyendo neumonía, celulitis, artritis séptica, sepsis)*. Raras: tuberculosis. Alteraciones hematológicas o linfáticas: Poco frecuentes: trombocitopenia. Raras: anemia, leucopenia, neutropenia, pancitopenia*. Muy raras: anemia aplásica*. Trastornos del sistema inmune: Frecuentes: reacciones alérgicas (véase Trastornos del tejido subcutáneo y de la piel), formación de autoanticuerpos*. Raros: reacciones anafilácticas/alérgicas graves (incluyendo angioedema, broncoespasmo). Trastornos del sistema nervioso: Raros: convulsiones. Cuadros desmielinizantes del SNC sugestivos de esclerosis múltiple o afectación desmielinizante localizada como neuritis óptica y mielitis transversa (véase Advertencias y precauciones de empleo). Trastornos hepatobiliares: Raros: Elevación de los niveles de enzimas hepáticas. Trastornos de la piel y tejido subcutáneo: Frecuentes: prurito. Poco frecuentes: angioedema, urticaria, erupción. Raros: vasculitis cutánea (incluyendo vasculitis leucocitoclástica). Trastornos musculoesqueléticos, del tejido conectivo y óseos: Raros: lupus eritematoso cutáneo subagudo, lupus eritematoso discoide, síndrome lupuslike.
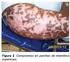
4 Trastornos generales y en el lugar de inyección: Muy frecuentes: reacciones en el lugar de inyección (incluyendo hemorragia, hematoma superficial, eritema, picor, dolor, edema)* Frecuentes: fiebre. Trastornos cardíacos: Ha habido informes relativos a empeoramiento de insuficiencia cardíaca congestiva (véase Advertencias y precauciones de empleo). Información adicional. Acontecimientos adversos graves informados en los ensayos clínicos: Entre los pacientes con artritis reumatoide, artritis psoriásica, espondilitis anquilosante y psoriasis en placa en los ensayos controlados con placebo, activos controlados y de carácter abierto de Enbrel, los acontecimientos adversos graves incluyeron enfermedades malignas (véase más adelante), asma, infecciones (véase más adelante), cardiopatía, infarto de miocardio, isquemia miocárdica, dolor torácico, síncope, isquemia cerebral, hipertensión, hipotensión, colecistitis, pancreatitis, hemorragia gastrointestinal, bursitis, confusión, depresión, disnea, cicatrización anormal, insuficiencia renal, cálculos renales, trombosis venosa profunda, embolismo pulmonar, glomerulonefropatía membranosa, polimiositis, tromboflebitis, daño hepático, leucopenia, paresia, parestesia, vértigo, alveolitis alérgica, angioedema, escleritis, fracturas óseas, linfadenopatía, colitis ulcerosa, obstrucción intestinal, eosinofilia, hematuria y sarcoidosis. Enfermedades malignas: Se observaron ciento veintinueve enfermedades malignas de nueva aparicion y de distintos tipos en pacientes con artritis reumatoide tratados con Enbrel en ensayos clínicos de hasta 6 años aproximadamente, incluyendo 231 pacientes tratados con Enbrel en combinación con metotrexato en el estudio controlado de 2 años. Los porcentajes e incidencias en estos ensayos clínicos fueron similares a los esperados para la población estudiada. Se notificaron un total de dos casos de enfermedades malignas en los estudios clínicos de aproximadamente 2 años de duración que se llevaron a cabo implicando a 240 pacientes con artritis psoriásica, tratados con Enbrel. En los estudios clínicos llevados a cabo durante más de dos años con 351 pacientes con espondilitis anquilosante, se notificaron 6 casos de enfermedades malignas en pacientes tratados con Enbrel. Se registraron 23 enfermedades malignas en los pacientes con psoriasis en placa tratados con Enbrel en los estudios de 15 meses de duración doble ciego y abiertos en los que se incluyeron pacientes tratados con Enbrel. Hubo un total de 15 casos de linfomas notificados en pacientes tratados con Enbrel en ensayos clínicos de artritis reumatoide, artritis psoriásica, espondilitis anquilosante y psoriasis. En el periodo post-comercialización, se han recibido informes sobre enfermedades malignas (incluyendo linfoma, cancer de mama y pulmon) (véase Advertencias y precauciones de empleo). Reacciones en el sitio de inyección: Los pacientes con enfermedades reumáticas tratados con Enbrel, en comparación con el placebo, tuvieron una incidencia de reacciones en el sitio de inyección significativamente mayor (36% versus 9%). Las reacciones en el sitio de inyección ocurrieron normalmente en el primer mes. La duración media fue aproximadamente de 3 a 5 días. No se administró tratamiento alguno para la mayoría de las reacciones en el sitio de inyección en los grupos de tratamiento con Enbrel y la mayoría de los pacientes a los que se les administró el tratamiento recibieron preparaciones tópicas, tales como corticosteroides, o antihistamínicos orales. Adicionalmente, algunos pacientes desarrollaron reacciones en el sitio de inyección de recuerdo caracterizadas por una reacción en la piel en el sitio de inyección más reciente junto con la aparición simultánea de reacciones en sitios de inyección previos. Estas reacciones fueron, por lo general, transitorias y no recurrieron con el tratamiento. En los ensayos controlados de pacientes con psoriasis en placa, aproximadamente el 14% de los pacientes tratados con Enbrel desarrollaron reacciones en el sitio de inyección comparados con el 6% de los pacientes tratados con placebo durante las primeras 12 semanas de tratamiento. Infecciones: En ensayos clínicos en procesos reumáticos, las infecciones más frecuentemente notificadas en pacientes que recibieron Enbrel o placebo fueron infecciones de las vías respiratorias altas (resfriados) y sinusitis. En ensayos controlados con placebo, la incidencia de infecciones del tracto respiratorio superior fue del 17% en el grupo placebo y del 22% en el grupo tratado con Enbrel. En los pacientes con artritis reumatoide que participaron en los ensayos placebo controlados, hubo 0,68 acontecimientos por paciente y año en el grupo placebo y 0,82 acontecimientos por paciente y por año en el grupo tratado con Enbrel. En ensayos controlados con placebo que evaluaban Enbrel, no se observó aumento alguno en la incidencia de infecciones graves (muerte, peligro de muerte o que requieren hospitalización o antibióticos intravenosos). Entre los pacientes con artritis reumatoide tratados con Enbrel durante un período de tiempo de hasta 48 meses, incluyendo 231 pacientes tratados con Enbrel en combinación con metotrexato en el estudio controlado de 2 años, se observaron 186 infecciones graves. Estas infecciones graves incluyeron abscesos (en diferentes lugares), bacteriemia, bronquitis, bursitis, celulitis, colecistitis, diarrea, diverticulitis, endocarditis (sospecha), gastroenteritis, hepatitis B, herpes zoster, úlcera en piernas, infección bucal, osteomielitis, otitis, peritonitis, pneumonía, pielonefritis, sepsis, artritis séptica, sinusitis, infección cutánea, úlcera cutánea, infección del tracto urinario, vasculitis e infección de heridas. En el estudio controlado de 2 años, donde los pacientes eran tratados con Enbrel en monoterapia, con metotrexato en monoterapia o con Enbrel combinado con metotrexato, las tasas de infecciones graves fueron similares entre los grupos de tratamiento. Sin embargo, no se puede excluir que la combinación de Enbrel con metotrexato pudiera estar asociada con un incremento de la tasa de infecciones. En los ensayos placebo controlados de artritis psoriásica y en los ensayos de psoriasis en placa, no hubo diferencias en las tasas de infección entre pacientes tratados con Enbrel y pacientes tratados con placebo.en los ensayos de artritis psoriásica, no hubo infecciones graves en pacientes tratados con Enbrel. En los ensayos doble ciego y abiertos de psoriasis en placa de 15 meses de duración, se experimentaron infecciones graves en los pacientes tratados con Enbrel incluyendo celulitis, gastroenteritis, neumonía, colecistitis, osteomielitis y abcesos. Se han comunicado infecciones graves y mortales; los patogenos identificados incluyen bacterias, micobacterias (incluyendo tuberculosis), virus y hongos. Algunas se produjeron a las pocas semanas después de iniciar el tratamiento con Enbrel en pacientes que, además de su artritis reumatoide, presentaban trastornos subyacentes (p. ej., diabetes, insuficiencia cardíaca congestiva, historial de infecciones activas o crónicas). (véase Advertencias y precauciones de empleo). Los datos procedentes de un ensayo clínico en sepsis, en pacientes no específicamente con artritis reumatoide, sugieren que el tratamiento con Enbrel puede incrementar la mortalidad en pacientes con sepsis demostrada. Autoanticuerpos: En pacientes, se analizaron muestras de suero en distintos puntos de los ensayos para la determinación de autoanticuerpos. De los pacientes con artritis reumatoide evaluados en cuanto a anticuerpos antinucleares (ANA), el porcentaje de pacientes que desarrollaron nuevos ANA positivos (>1:40) fue superior en los tratados con Enbrel (11%) que en los tratados con placebo (5%). El porcentaje de pacientes que desarrolló nuevos anticuerpos positivos anti ADN de doble filamento fue también superior por radioinmunoensayo (15% de los pacientes tratados con Enbrel en comparación con el 4% de los pacientes tratados con placebo) y con el ensayo Crithidia luciliae (3% de los pacientes tratados con Enbrel en comparación con ninguno de los pacientes tratados con placebo). La proporción de pacientes tratados con Enbrel que desarrollaron anticuerpos anticardiolipina aumentó de forma similar en comparación con los pacientes tratados con placebo. No se conoce el impacto del tratamiento a largo plazo con Enbrel sobre el desarrollo de enfermedades autoinmunes. Ha habido raros informes de pacientes con factor reumatoide positivo, que han desarrollado otros anticuerpos junto a un síndrome lupus-like o a erupciones compatibles, clinicamente y tras la realizacion de biopsia, con lupus cutáneo subagudo o lupus discoide. Pancitopenia y anemia aplásica: Ha habido informes postcomercialización de pancitopenia y anemia aplásica, algunos de los cuales tuvieron consecuencias fatales (véase Advertencias y precauciones de empleo). Evaluaciones de laboratorio: En base a los resultados de los estudios clínicos, normalmente no fueron necessarias evaluaciones de laboratorio especiales adicionales al cuidadoso control médico y supervisión de los pacientes. Tratamiento concomitante de Enbrel y anakinra: En los estudios clínicos, se observó que los pacientes que recibieron un tratamiento concomitante con Enbrel y anakinra presentaron una tasa superior de infecciones graves en comparación con los que recibieron sólo Enbrel y un 2% de los pacientes (3/139) desarrollaron neutropenia (recuento de neutrófilos totales <1.000 mm 3 ). Durante la fase neutropénica, un paciente desarrolló celulitis que se resolvió tras su hospitalización (véase Advertencias y precauciones de empleo e Interacción con otros medicamentos y otras formas de interacción). Reacciones adversas en pacientes pediátricos con artritis idiopática juvenil: En general, los acontecimientos adversos en pacientes pediátricos fueron similares en frecuencia y tipo a los observados en pacientes adultos. En los siguientes párrafos se comentan las diferencias entre adultos y otras consideraciones especiales. Los acontecimientos adversos informados en el ensayo clínico realizado con 69 pacientes entre 4 y 17 años, con artritis idiopática juvenil incluyen varicela con signos y síntomas de meningitis aséptica que se resolvió sin secuelas (véase Advertencias y precauciones de empleo), gastroenteritis, alteraciones de la personalidad/depresión, úlcera cutánea, gastritis/esofagitis, shock séptico por estreptococos del grupo A, diabetes mellitus tipo I, e infección en tejidos blandos y en heridas post-operatorias. Cuarenta y tres de 69 (62%) niños con artritis idiopática juvenil experimentaron una infección mientras recibían Enbrel durante 3 meses de estudio (abierto Parte I), y la frecuencia y severidad de las infecciones fue similar en los 58 pacientes que completaron el tratamiento de carácter abierto durante los 12 meses de duración. Los tipos de infecciones en pacientes con artritis idiopática juvenil fueron generalmente moderadas y consistentes con las comúnmente observadas en la población pediátrica.
5 Los tipos y proporción de acontecimientos adversos en pacientes con artritis idiopática juvenil fueron similares a las observadas en ensayos con Enbrel en pacientes adultos con artritis reumatoide y, la mayoría fueron moderadas. Varios acontecimientos adversos se comunicaron más frecuentemente en 69 pacientes con artritis idiopática juvenil que recibieron Enbrel durante 3 meses comparado con los 349 pacientes adultos con artritis reumatoide. Estos acontecimientos incluyen cefalea (19%, 1,7 acontecimientos por paciente año), náuseas (9%, 1,0 acontecimientos por paciente año), dolor abdominal (19%, 0,74 acontecimientos por paciente año) y vómitos (13%, 0,74 acontecimientos por paciente año). DATOS CLÍNICOS / SOBREDOSIFICACIÓN En los ensayos clínicos en pacientes con artritis reumatoide, no se observó toxicidad limitante de la dosis. La dosis más alta evaluada ha sido una dosis de carga inicial intravenosa de 32 mg/m 2 seguida de dosis subcutánea de 16 mg/m 2 administradas dos veces a la semana. Un paciente con artritis reumatoide se autoadministró por error 62 mg de Enbrel subcutáneo dos veces a la semana durante 3 semanas sin experimentar efectos adversos. No se conoce ningún antídoto para Enbrel. PROPIEDADES FARMACOLÓGICAS / PROPIEDADES FARMACODINÁMICAS Grupo farmacoterapéutico: agentes inmunosupresores selectivos. Código ATC: L04AA11. El factor de necrosis tumoral (TNF) es una citoquina dominante en el proceso inflamatorio de la artritis reumatoide. También se han encontrado niveles elevados de TNF en la membrana sinovial y placas psoriásicas de pacientes con artritis psoriásica y en el suero y el tejido sinovial de pacientes anquilosante. En psoriasis en placa, la infiltración por células inflamatorias incluyendo las células T conduce al incremento de los niveles de TNF en lesiones psoriásicas comparadas con los niveles en la piel no involucrada. Etanercept es un inhibidor competitivo de la unión del TNF a sus receptores de superficie celular, y, por ello, inhibe la actividad biológica del TNF. El TNF y la linfotoxina son citoquinas proinflamatorias que se unen a dos receptores de superficie diferentes: los receptores del factor de necrosis tumoral (RTNF) 55-kilodalton (p55) y 75-kilodalton (p75). Ambos RTNF existen de forma natural unidos a la membrana y en forma soluble. Se cree que los RTNF solubles regulan la actividad biológica del TNF. El TNF y la linfotoxina existen predominantemente como homotrímeros, dependiendo su actividad biológica del entrecruzamiento de los RTNF de la superficie celular. Los receptores solubles diméricos, tales como etanercept poseen mayor afinidad por el TNF que los receptores monoméricos y son inhibidores competitivos considerablemente más potentes de la unión del TNF a sus receptores celulares. Además, la utilización de una región Fc de inmunoglobulina como elemento de fusión en la construcción de un receptor dimérico la dota de una vida media sérica más larga. Mecanismo de acción: Gran parte de la patología articular en la artritis reumatoide y espondilitis anquilosante y de la patología cutánea en psoriasis en placa, está mediada por moléculas proinflamatorias ligadas a una red controlada por el TNF. Se piensa que el mecanismo de acción del etanercept es la inhibición competitiva de la unión del TNF al RTNF de la superficie celular impidiendo la respuesta celular mediada por el TNF provocando que el TNF sea biológicamente inactivo. El etanercept también puede modular la respuesta biológica controlada por moléculas adicionales que regulan a la baja (p. ej., citoquinas, moléculas de adhesión o proteinasas) que se inducen o regulan por el TNF. Ensayos clínicos: Esta sección presenta datos de cuatro ensayos controlados aleatorizados en artritis reumatoide, 1 estudio en artritis idiopática juvenil poliarticular, 1 estudio en artritis psoriásica, 1 estudio en espondilitis anquilosante y 3 estudios en psoriasis en placa. Artritis reumatoide: La eficacia de Enbrel fue evaluada en un estudio randomizado, doble ciego, controlado con placebo. El estudio evaluó 234 pacientes adultos con Artritis Reumatoide (AR) activa, que habían fracasado al tratamiento previo con, al menos, uno pero no más de cuatro, fármacos antirreumáticos modificadores de la enfermedad (DMARD). Se administraron dosis subcutáneas de 10 mg o 25 mg de Enbrel o placebo, dos veces a la semana durante 6 meses consecutivos. Los resultados de este ensayo controlado se expresaron en forma de porcentaje de mejoría de la AR utilizando los criterios de respuesta del Colegio Americano de Reumatología (ACR). La respuesta ACR20 y 50 a los 3 y 6 meses, fue mayor en los pacientes tratados con Enbrel que en los pacientes tratados con placebo (ACR20: Enbrel 62% y 59%, placebo 23% y 11% a los 3 y 6 meses respectivametne: ACR50: Enbrel 41% y 40%, placebo 8% y 5% a los 3 y 6 meses respectivametne; p <0,01 Enbrel vs placebo en todos los puntos de tiempo para las respuestas ACR20 y ACR20. Aproximadamente el 15% de los pacientes que recibieron Enbrel alcanzaron una respuesta ACR 70 en el mes 3 y 6, en comparación con menos del 5% de los pacientes en el grupo placebo. Entre los pacientes que recibieron Enbrel, las respuestas clínicas aparecieron, generalmente, entre la primera y segunda semana desde el inicio del tratamiento y prácticamente siempre ocurrieron en tres meses. Se observó una relación dosis respuesta; los resultados con 10 mg fueron intermedios entre el placebo y la dosis de 25 mg. Enbrel fue significativamente mejor que el placebo en todos los componentes de los criterios de la ACR, así como en otras medidas de actividad de la enfermedad en la AR, no incluidas en los criterios de respuesta de la ACR, como la rigidez matinal. Durante el ensayo, cada 3 meses se administró un Cuestionario de Evaluación de la Salud (HAQ) que incluye parámetros de discapacidad, vitalidad, salud mental, estado general de salud y subdominios del estado de salud asociado a la artritis. Todos los subdominios del cuestionario HAQ mejoraron en los pacientes tratados con Enbrel a los 3 y 6 meses en comparación con los pacientes control. Después de la interrupción de Enbrel, los síntomas de la artritis generalmente reaparecieron en un mes. La reintroducción del tratamiento con Enbrel después de interrupciones de hasta 24 meses resultó en la misma magnitud de respuesta que los pacientes que recibieron Enbrel sin interrupción del tratamiento en base a los resultados de los estudios abiertos. Se han observado respuestas duraderas continuadas de hasta 48 meses en los ensayos abiertos de extensión del tratamiento cuando los pacientes recibieron Enbrel sin interrupción. No se dispone de experiencia a largo plazo. La eficacia de Enbrel se comparó con el metotrexato en un ensayo, randomizado, activo y controlado, con evaluaciones radiográficas ciegas como objetivo primario en 632 pacientes adultos con artritis reumatoide activa (de duración menor de 3 años), que no habían recibido tratamiento previo con metotrexato. Se administraron subcutáneamente dos veces por semana durante 24 meses dosis de 10 ó 25 mg de Enbrel. Las dosis de metotrexato se escalonaron desde 7,5 mg/semana hasta un máximo de 20 mg/semana durante las primeras 8 semanas del ensayo, continuándose hasta los 24 meses. La mejoría clínica incluyendo un comienzo de acción de 2 semanas conseguida con 25 mg de Enbrel fue similar a la observada en los ensayos previos, y se mantuvo hasta 24 meses. En la línea base, los pacientes presentaron un grado moderado de discapacidad, con puntuaciones medias de HAQ de 1,4 a 1,5. El tratamiento con Enbrel 25 mg produjo una mejora sustancial a los 12 meses, con un 44% aproximadamente de pacientes que alcanzaron una puntuación normal de HAQ (menores de 0,5). Este beneficio se mantuvo en el segundo año del estudio. En este estudio, se evaluó radiográficamente el daño estructural en las articulaciones, expresándose como cambio en la prueba de puntuación total de Sharp (TSS) y en sus componentes, la puntuación de la erosión y la puntuación del estrechamiento del espacio articular (JSN). Las radiografías de manos/muñecas y pies se leyeron a un nivel base de 6, 12 y 24 meses. La dosis de Enbrel de 10 mg presentó de forma consistente un efecto menor que la de 25 mg sobre el daño estructural. Enbrel 25 mg fue significativamente superior a metotrexato en términos de erosión tanto a los 12 como a los 24 meses. Las diferencias en TSS y JSN no fueron estadísticamente significativas entre MTX y Enbrel 25 mg. En otro estudio controlado doble-ciego, aleatorizado, en pacientes con AR tratados con Enbrel solo (25 mg dos veces por semana), metotrexato solo (7,5 a 20 mg semanalmente, dosis media 20 mg), o la combinación de Enbrel y metotrexato iniciada concomitantemente, se compararon la eficacia clínica, la seguridad y la progresión radiográfica en 682 pacientes adultos con artritis reumatoide activa de 6 meses a 20 años de duración (mediana 5 años) que tuvieron una respuesta no satisfactoria a al menos 1 fármaco modificador de la enfermedad (DMARD) distinto del metotrexato. Los pacientes en el grupo de Enbrel en combinación con metotrexato tuvieron respuestas ACR20, ACR50 y ACR70 significativamente mayores y mejora de las escalas DAS y HAQ a las 24 y a las 52 semanas que los pacientes de cualquiera de los grupos de terapia individual (los resultados se muestran en la tabla a continuación). Después de 24 meses de tratamiento, se observaron también ventajas significativas con la administración de Enbrel en combinación con metotrexato, al compararla con la administración de ambos, Enbrel y metotrexato, como monoterapia. Resultados de eficacia clínica a los 12 meses: comparación de Enbrel frente a metotrexato frente a Enbrel en combinación con metotrexato en pacientes con AR de 6 meses a 20 años de duración Variable Metotrexato Enbrel Enbrel + Metotrexato Reapuestas ACR a ACR 20 58,8% 65,5% ACR 50 36,4% 43,0% ACR 70 16,7% 22,0% DAS (n=228) (n=223) (n=231) Marcador basal b 5,5 5,7 5,5 Marcador semana 52 b 3,0 3,0 Remisión c 14% 18% HAQ Basal 1,7 1,7 1,8 Semana 52 1,1 1,0 74,5%,ø 63,2%,ø 39,8%,ø 2,3,ø 37%,ø
6 0,8,ø a : los pacientes que no completaron los 12 meses en el estudio fueron considerados como pacientes que no respondían al tratamiento. b : los valores para DAS (escala de actividad de la enfermedad) son medias. c : la remisión se define como DAS <1,6. Valores p de comparación de pares: =p<0,05 para comparaciones de Enbrel+metotrexato vs metotrexato y ø : p<0,05 para comparaciones de Enbrel+metotrexato vs Enbrel. La progresión radiográfica a los 12 meses fue significativamente menor en el grupo de Enbrel que en el grupo de metotrexato, mientras que la combinación fue significativamente mejor que en cualquier grupo de monoterapia en el enlentecimiento de la progresión radiográfica. Después de 24 meses de tratamiento, se observaron también ventajas significativas con la administración de Enbrel en combinación con metotrexato, al compararla con la administración de ambos fármacos, Enbrel y metotrexato, como monoterapia. De forma similar, también se observaron, después de 24 meses de tratamiento, ventajas significativas del tratamiento de Enbrel como monoterapia, con respecto a la administración de metotrexato como monoterapia. En un análisis, en el que se consideró que todos los pacientes que habían abandonado el estudio por cualquier motivo habían progresado, el porcentaje de pacientes sin progresión (cambio TSS <0,5) a los 24 meses era mayor en los grupos de Enbrel en combinación con metotrexato, comparados con los grupos de Enbrel solo y de metotrexato solo (62%, 50% y 36%, respectivamente; p< 0,05). La diferencia entre los grupos de Enbrel solo y de metotrexato solo también fue significativa (p<0,05). Las tasas de ausencia de progresión, entre los pacientes del estudio que completaron el periodo total de 24 meses de tratamiento, fueron de un 78%, 70% y 61%, respectivamente. Se evaluó la seguridad y efectividad de 50 mg de Enbrel (dos inyecciones subcutáneas de 25 mg) administradas una vez a la semana en un estudio doble ciego controlado con placebo con 420 pacientes con artritis reumatoide activa. En este estudio, 53 pacientes recibieron placebo, 214 pacientes recibieron 50 mg de Enbrel una vez a la semana y 153 pacientes recibieron 25 mg de Enbrel dos veces a la semana. Los perfiles de seguridad y efectividad de los dos regímenes de tratamiento de Enbrel fueron comparables en la semana 8 en lo que se refiere a signos y síntomas de artritis reumatoide; los datos a 16 semanas no mostraron comparabilidad (ni inferioridad) entre los dos regímenes. Artritis idiopática juvenil poliarticular: La eficacia y seguridad de Enbrel en artritis idiopática juvenil poliarticular han sido evaluadas en un estudio con dos partes en 69 niños con una variedad de formas de inicio de artritis idiopática juvenil. Se incluyeron pacientes entre 4 y 17 años de edad con artritis idiopática juvenil poliarticular moderada o grave refractaria o intolerante al metotrexato; los pacientes permanecieron con una dosis única estable de un único fármaco antiinflamatorio no esteroideo y/o prednisona (máximo < 0,2 mg/kg/día ó 10 mg). En la parte 1, todos los pacientes 0,4 mg/kg (máximo 25 mg por dosis) de Enbrel subcutáneamente dos veces a la semana. En la parte 2, los pacientes con respuesta clínica el día 90 fueron randomizados para continuar recibiendo Enbrel o recibir placebo durante cuatro meses y para evaluar el brote de enfermedad. Las respuestas se midieron utilizando la definición de mejoría (DOI) de ARJC, definida como >30 % de mejoría en al menos 3 de los 6 criterios y empeoramiento >30 % en no más de uno de los 6 criterios de respuesta en la ARCJ, incluyendo el recuento de articulaciones activas, limitación de la movilidad, evaluación global por un médico y el paciente/padre, evaluación funcional y VSG. El brote de la enfermedad se definió como un empeoramiento >30 % en 3 de los 6 criterios de la ARCJ y mejoría >30 % en no más de uno de los 6 criterios y un mínimo de 2 articulaciones activas. En la parte 1 del estudio, 51 de 69 pacientes (74%) demostraron respuesta clínica y entraron en la parte 2. En la parte 2, 6 de 25 pacientes (24%) de los que continuaron con Enbrel experimentaron un brote inflamación de la enfermedad comparado con 20 de 26 pacientes (77%) de los que recibieron placebo (p= 0,007). Desde el inicio de la parte 2, el tiempo medio hasta el brote de la enfermedad fue > a 116 días para los pacientes que recibieron Enbrel y de 28 días para los pacientes que recibieron placebo. De los pacientes que demostraron respuesta clínica a los 90 días y entraron en la parte 2 del estudio algunos de los que continuaron con Enbrel continuaron mejorando desde el mes 3 hasta el 7, mientras que los que recibieron placebo no mejoraron. En pacientes con artritis idiopática juvenil poliarticular, no se han realizado estudios para evaluar los efectos de la continuación de la terapia con Enbrel en aquellos que no respondieron después de 3 meses de tratamiento o para evaluar la combinación de Enbrel con metotrexato. Adultos con artritis psoriásica: Se evaluó la eficacia de Enbrel en un estudio placebo controlado, doble ciego, randomizado con 205 pacientes con artritis psoriásica. Los pacientes tenían entre 18 y 70 años de edad y tenían artritis psoriásica activa (3 o más articulaciones hinchadas y 3 o más articulaciones sensibles) en al menos una de las siguientes formas: (1) afectación interfalángica distal (DIP), (2) artritis poliarticular (ausencia de nódulos reumatoides y presencia de psoriasis); (3) artritis mutilante; (4) artritis psoriásica asimétrica; o (5) espondilitis como anquilosis. Los pacientes también tenían placas psoriásicas con una lesión cualificada > a 2 cm de diámetro. Los pacientes habían sido tratados previamente con AINES (86%), DMARDS (80%) y corticosteroides (24%). Los pacientes actualmente tratados con metotrexato (estables durante 2 o más meses) pudieron continuar a una dosis estable igual o inferior a 25 mg/semana de metotrexato. Se administraron 2 veces a la semana dosis SC de 25 mg de Enbrel (en base a los resultados de estudios en pacientes con artritis reumatoide) o placebo durante 6 meses. Los resultados se expresaron como porcentajes de pacientes que consiguieron la respuesta ACR 20, 50 y 70 y porcentajes con mejora en el criterio de respuesta de artritis psoriásica (PsARC). La tabla siguiente resume los resultados. Respuesta artritis psoriásica Respuestas de pacientes con artritis psoriásica en ensayo placebo controlado (n=104) ACR 20 Mes 3 15 Mes 6 13 ACR 50 Mes 3 4 Mes 6 4 ACR 70 Mes 3 0 Mes 6 1 PsARC Mes 3 31 Mes 6 23 Porcentaje de pacientes Placebo Enbrel a (n=101) 59 b 50 b 38 b 37 b 11 b 9 c 72 b 70 b a : 25 mg Enbrel SC dos veces a la semana. b : p< 0,001, Enbrel vs placebo. c : p< 0,01, Enbrel vs placebo Las respuestas clínicas entre pacientes con artritis psoriásica que recibieron Enbrel fueron visibles en la primera visita (4 semanas) y se mantuvieron a lo largo de 6 meses de terapia. Enbrel resultó significativamente mejor que placebo en todas las determinaciones de actividad de la enfermedad (p <0,001), y las respuestas fueron similares con y sin terapia concomitante de metotrexato. Se evaluó la calidad de vida de los pacientes con artritis psoriásica en cada momento utilizando el índice de discapacidad del HAQ. El resultado del índice de discapacidad resultó significativamente mejorado en todo momento en los pacientes con artritis psoriásica tratados con Enbrel en relación con los tratados con placebo (p<0,001). No hay suficientes evidencias de la eficacia de Enbrel en pacientes con espondilitis anquilosante como artropatía psoriásica debido al pequeño número de pacientes estudiados. No se ha realizado ningún estudio en pacientes con artritis psoriásica, utilizando el régimen de dosificación de 50 mg una vez a la semana. La evidencia sobre la eficacia del régimen de dosificación de una vez a la semana en esta población de pacientes se ha basado en los datos procedentes del estudio llevado a cabo en pacientes con espondilitis anquilosante. Adultos con espondilitis anquilosante: Se evaluó la eficacia de Enbrel en la espondilitis anquilosante en 3 estudios doble ciego, aleatorizados, en los que se comparó la administración de 25 mg de Enbrel dos veces a la semana con la administración de placebo. Un total de 401 pacientes fueron incluidos en el estudio, de los cuales 203 fueron tratados con Enbrel. El mayor de estos estudios (n=277) incluyó a pacientes de edades
7 comprendidas entre 18 y 70 años y que tenían espondilitis anquilosante activa definida según los marcadores de la escala analógica visual (EAV) de > 30 para un promedio de duración e intensidad de rigidez matutina y marcadores de la escala analógica visual >30 para al menos 2 de los siguientes 3 parámetros: evaluación global del paciente; la media de la escala analógica visual para dolor de espalda nocturno y dolor de espalda total; media de 10 preguntas sobre el índice funcional de espondilitis anquilosante (BASFI). Los pacientes que recibieron DMARDs, AINES o corticosteroides pudieron continuar con ellos a dosis estables. No se incluyeron en el estudio pacientes con anquilosis completa de la columna. Se administraron subcutáneamente dosis de 25 mg de Enbrel (en base a los hallazgos de los estudios realizados en pacientes con artritis reumatoide) o placebo dos veces por semana durante 6 meses en 138 pacientes. La determinación primaria de eficacia (ASAS 20) supuso una mejora >20% en al menos 3 de los 4 parámetros (evaluaciones globales del paciente, dolor de espalda, BASFI e inflamación) en la evaluación de espondilitis anquilosante (ASAS) y en ausencia de deterioro del parámetro restante. Las respuestas ASAS 50 y ASAS 70 utilizaron los mismos criterios con mejoras del 50% y del 70%, respectivamente. Comparado con placebo, el tratamiento con Enbrel resultó en mejoras significativas en la respuesta ASAS 20, ASAS 50 y ASAS 70, a las dos semanas de iniciar la terapia. Respuestas de pacientes con espondilitis anquilosante en un ensayo controlado con placebo Porcentaje de pacientes Respuesta espondilitis anquilosante Placebo Enbrel N=139 N=138 ASAS 20 2 semanas a 3 meses a 6 meses a ASAS 50 2 semanas 7 24 a 3 meses a 6 meses a ASAS 70 2 semanas 2 12 b 3 meses 7 29 b 6 meses 5 28 b a : p< 0,001, Enbrel vs, placebo. b : p= 0,002. Enbrel vs, placebo. Entre los pacientes con espondilitis anquilosante que recibieron Enbrel, las respuestas clínicas fueron evidentes en el momento de la primera visita (2 semanas) y se mantuvieron a lo largo de 6 meses de tratamiento. Las respuestas fueron similares en pacientes que estaban recibiendo o no terapias concomitantes al comienzo. En los dos ensayos más pequeños de espondilitis anquilosante se obtuvieron resultados similares. En un cuarto estudio, fueron evaluadas la seguridad y la eficacia de Enbrel 50 mg (dos inyecciones subcutáneas de 25 mg), administrado una vez a la semana frente a Enbrel 25 mg administrado dos veces a la semana, en un estudio doble ciego, controlado con placebo de 356 pacientes que padecían espondilitis anquilosante activa. Los perfiles de seguridad y de eficacia de los regímenes de 50 mg una vez a la semana y de 25 mg dos veces a la semana fueron similares. Adultos con psoriasis en placas: Se recomienda el uso de Enbrel para pacientes tal como se ha definido en la sección Indicaciones terapéuticas. Pacientes que presentan fracaso a la respuesta a en la población diana viene definido por una respuesta insuficiente (PASI <50 o PGA menos que bueno), o un empeoramiento de la enfermedad durante el tratamiento, y para aquellos que han recibido una dosis adecuada durante un periodo de tiempo lo suficientemente largo como para evaluar la respuesta con al menos cada una de las 3 terapias sistémicas principales disponibles. No se ha evaluado la eficacia de Enbrel frente a otras terapias sistémicas en pacientes con psoriasis de moderada a grave (que responden a otras terapias sistémicas) en estudios que comparen directamente Enbrel con otras terapias sistémicas. En cambio, se evaluó la eficacia y seguridad de Enbrel en 3 estudios randomizados, doble ciego y controlados con placebo. El criterio de valoración de eficacia primaria en los 3 estudios fue la proporción de pacientes en cada grupo de tratamiento que consiguieron un PASI 75 (esto es, al menos un 75% de mejoría en el área de psoriasis y un marcador del índice de gravedad desde la visita basal) a las 12 semanas. El estudio 1 fue un estudio Fase 2 en pacientes con psoriasis en placa estable activa pero clínicamente controlada en los que la superficie corporal afectada era igual o superior al 10% con 18 o más años de edad. Se randomizaron ciento doce pacientes (112) que recibieron una dosis de 25 mg de Enbrel (n=57) o placebo (n=55) dos veces a la semana durante 24 semanas. El estudio 2 evaluó 652 pacientes con psoriasis en placa crónica utilizando los mismos criterios de inclusión que el estudio 1 con la adición de un área de psoriasis mínima y un índice de gravedad (PASI) de 10 en la visita de reclutamiento. Se administró Enbrel a dosis de 25 mg una vez a la semana, 25 mg dos veces a la semana o 50 mg dos veces a la semana durante 6 meses consecutivos. Durante las primeras 12 semanas del periodo de tratamiento doble ciego, los pacientes recibieron placebo o una de las tres dosis de Enbrel antes mencionadas. Después de 12 semanas de tratamiento, los pacientes del grupo placebo comenzaron el tratamiento ciego con Enbrel (25 mg dos veces a la semana); los pacientes de los grupos de tratamiento activos continuaron hasta la semana 24 con la dosis con la que inicialmente fueron randomizados. El estudio 3 evaluó 583 pacientes y tuvo los mismos criterios de inclusión que el estudio 2. Los pacientes en este estudio recibieron una dosis de 25 mg o 50 mg de Enbrel, o placebo dos veces a la semana durante 12 semanas y después todos los pacientes del estudio abierto recibieron 25 mg de Enbrel dos veces a la semana durante 24 semanas adicionales. En el estudio 1, el grupo tratado con Enbrel tuvo una proporción de pacientes con una respuesta PASI 75 significativamente mayor en la semana 12 (30%) en comparación con el grupo tratado con placebo (2%) (p<0.0001). A las 24 semanas, el 56% de los pacientes del grupo tratado con Enbrel habían alcanzado el PASI 75 en comparación con el 5% de los pacientes tratados con placebo. A continuación se muestran los resultados de los estudios 2 y 3. Ver Tabla 1. Tabla 1 Respuestas de pacientes con psoriasis en los estudios 2 y 3 Estudio 2 Estudio 3 Enbrel Placebo 25 mg bisemanales 50 mg bisemanales Placebo 25 mg bisemanales 50 mg bisemanales n=166 n=162 n=162 n=164 n=164 n=193 n=196 n=196 Respuesta Sem 12 Sem 12 Sem 24 a Sem 12 Sem 24 a Sem 12 Sem 12 Sem 12 PASI 50 (%) 14 58* 78 74* * 77* PASI 75 (%) 4 34* 44 49* * 49* DSGA b, aclaramieto o casi aclaramiento (%) 5 34* 39 49* * 57* *p 0,0001 comparado con placebo. a. No se realizaron comparaciones estadísticas con placebo en la semana 24 del estudio 2 porque el grupo placebo original comenzó recibiendo 25 mg de Enbrel bisemanales desde la semana 13 a la semana 24. b. Evaluación Global Estática Dermatológica. Aclaramiento o casi aclaramiento definido como 0 ó 1 sobre una escala de 0 a 5. Entre los pacientes con psoriasis en placa que recibieron Enbrel, se obtuvieron claras respuestas significativas relativas al placebo en el momento de la primera visita (2 semanas) y se mantuvieron a lo largo de las 24 semanas de terapia. El estudio 2 tuvo también un periodo de retirada del fármaco durante el cual a los pacientes que alcanzaron una mejoría de PASI de al menos un 50% en la semana 24 se les suspendió el tratamiento.
8 Se observaron los pacientes fuera de tratamiento en cuanto a la posibilidad de recurrencia (PASI > 150% desde la visita basal) y en cuanto al tiempo de recaída (definido como una pérdida de al menos la mitad de la mejoría alcanzada entre la visita basal y la semana 24). Durante el periodo de retirada volvieron gradualmente los síntomas de psoriasis con una media de recurrencia de la enfermedad de 3 meses. No se observó ningún efecto adverso grave relativo a la psoriasis ni ningún signo de recurrencia de la enfermedad. Hubo alguna evidencia que permite avalar un beneficio de la repetición del tratamiento con Enbrel en pacientes que inicialmente respondían al tratamiento. En el estudio 3, la mayoría de los pacientes (77%) que fueron randomizados inicialmente con 50 mg dos veces por semana y tuvieron reducida su dosis de Enbrel en la semana 12 a 25 mg dos veces a la semana mantuvieron su respuesta PASI 75 a lo largo de la semana 36. Para pacientes que recibieron 25 mg de Enbrel dos veces a la semana a lo largo del estudio, la respuesta PASI 75 continuó mejorando entre las semanas 12 a 36. Anticuerpos frente a Enbrel : En 4 de 96 pacientes con artritis reumatoide que habían recibido dosis de Enbrel de 25 mg dos veces a la semana durante 3 meses en un ensayo controlado frente a placebo, se detectaron anticuerpos frente a Enbrel, todos ellos no neutralizantes. En el ensayo activo y controlado, 11 (2,8%) de los 400 pacientes tratados con etanercept obtuvieron al menos un resultado positivo, pero ninguno de estos pacientes tuvo una prueba positiva de anticuerpos neutralizantes. Los resultados procedentes de pacientes con artritis idiopática juvenil eran similares a los obtenidos para pacientes adultos con artritis reumatoide tratados con Enbrel. De 98 pacientes con artritis psoriásica que fueron evaluados, ninguno desarrolló anticuerpos a Enbrel a las 24 semanas. Entre los 480 pacientes con espondilitis anquilosante tratados con Enbrel, 5 desarrollaron anticuerpos a Enbrel, aunque ninguno de ellos era neutralizante. En los estudios doble ciego de hasta 6 meses de duración en la psoriasis en placa, alrededor del 1% de los pacientes desarrolló anticuerpos a Enbrel, ninguno de ellos neutralizante. Aunque, la experiencia no excluye la posibilidad de que pueda ocurrir un efecto de relevancia clínica, no se observó una correlación aparente entre el desarrollo de anticuerpos y la respuesta clínica o acontecimientos adversos. PROPIEDADES FARMACOLÓGICAS / PROPIEDADES FARMACOCINÉTICAS Los valores séricos de etanercept se determinaron por un método ELISA, este método puede detectar productos de degradación reactivos a ELISA así como el compuesto padre. Etanercept se absorbe lentamente desde el sitio de inyección subcutánea, alcanzando una concentración máxima aproximadamente 48 horas después de una dosis única. La biodisponibilidad absoluta es del 76%. Con dosis administradas dos veces a la semana, se preveé que las concentraciones plato sean aproximadamente dos veces más elevadas que las observadas después de dosis únicas. Después de una dosis subcutánea única de 25 mg de Enbrel, la concentración sérica máxima media observada en voluntarios sanos fue de 1, µg/ml, y el área bajo la curva (ABC) fue de ,6 µgxh/ml. La proporcionalidad de la dosis no se ha evaluado específicamente, pero aparentemente en el rango de dosis, no existe una saturación del aclaramiento. Para describir la curva concentración-tiempo del etanercept, se requiere una curva biexponencial. El volumen central de distribución del etanercept es 7,6 l, mientras que el volumen de distribución en el plató en de 10,4 l. El etanercept se elimina lentamente del organismo. La vida media es larga, aproximadamente 70 horas. El aclaramiento en pacientes con artritis reumatoide es de aproximadamente 0,066 l/h, algo inferior que el valor de 0,11 l/h. observado en voluntarios sanos. De forma adicional, la farmacocinética de Enbrel en pacientes con artritis reumatoide y en pacientes con espondilitis anquilosante y en pacientes con psoriasis en placa es similar. Alcanzado el plató, la media de los perfiles de concentración sérica en los pacientes con artritis reumatoide tratados fueron C máx. de 2,4 mg/l frente a 2,6 mg/l, C mín. de 1,2 mg/l frente a 1,4 mg/l y el area bajo la curva parcial de 297 mgh/l frente a 316 mgh/l para 50 mg de Enbrel una vez a la semana (n=21) frente a 25 mg de Enbrel dos veces a la semana (n=16), respectivamente. En un análisis farmacocinético poblacional realizado en pacientes con espondilitis anquilosante, las AUCs de etanercept en estado de equilibrio fueron 466 µgxh/ml y 474 µgxh/ml, en el caso de Enbrel 50 mg administrado una vez a la semana (N=154) y en el caso de Enbrel 25 mg administrado dos veces a la semana (N=148), respectivamente. Aunque después de la administración de etanercept marcado radiactivamente a pacientes y voluntarios sanos, hay eliminación de radiactividad en orina, en pacientes con insuficiencia renal o hepática aguda, no se observó aumento de las concentraciones de etanercept. La presencia de alteración renal y hepática no requerirá un cambio en la dosificación. Aparentemente, no existe diferencia farmacocinética entre hombres y mujeres. El metotrexato no produce efecto sobre la farmacocinética de etanercept. El efecto de Enbrel sobre la farmacocinética humana del metotrexato, no ha sido investigado. Pacientes ancianos: El impacto de la edad avanzada en la farmacocinética se ha estudiado en un análisis de las concentraciones séricas de etanercept en esta población. El aclaramiento y volumen estimados, en pacientes entre 65 y 87 años, fueron similares a los de los pacientes menores de 65 años de edad. Pacientes con artritis idiopática juvenil poliarticular: En un ensayo con Enbrel en artritis idiopática juvenil poliarticular, a 69 pacientes (edad entre 4 y 17 años) se les administraron 0,4 mg de Enbrel/kg dos veces a la semana durante 3 meses. Los perfiles de concentraciones séricas fueron similares a los encontrados en pacientes adultos con artritis reumatoide. Los niños menores (4 años de edad) presentaron una reducción en el aclaramiento (el aclaramiento aumentó cuando se normalizó por el peso) comparado con los niños mayores (12 años de edad) y adultos. La simulación de dosis sugiere que mientras los niños mayores (10-17 años de edad) tendrán niveles séricos cercanos a los observados en adultos, los niños menores tendrán niveles apreciablemente más bajos. PROPIEDADES FARMACOLÓGICAS / DATOS PRECLÍNICOS DE SEGURIDAD En los estudios toxicológicos con Enbrel, no se observó toxicidad dependiente de la dosis o en el órgano diana. A partir de una batería de estudios in vitro e in vivo se llegó a la conclusión de que Enbrel no era genotóxico. Debido al desarrollo de anticuerpos neutralizante en roedores, no se realizaron estudios de carcinogenicidad ni valoraciones estándar de la fertilidad y toxicidad postnatal con Enbrel. Enbrel no induce letalidad o signos notables de toxicidad en el ratón o en la rata después de una dosis única subcutánea de mg/kg ó después de una dosis única intravenosa de mg/kg. Enbrel no muestra toxicidad dosis limitante u órgano específica en el mono cynomolgus después de administraciones subcutáneas, dos veces en semana durante 4 o 26 semanas consecutivas a una dosis (15 mg/kg) que resulta en un área bajo curva (AUC) basada en concentraciones séricas del fármaco que fueron unas 27 veces mayores que las que se obtienen en humanos a la dosis recomendada de 25 mg. DATOS FARMACÉUTICOS / LISTA DE EXCIPIENTES Polvo: manitol, sacarosa y trometamol. Disolvente: agua para inyección. DATOS FARMACÉUTICOS / INCOMPATIBILIDADES En ausencia de estudios de incompatibilidad, este medicamento no debe mezclarse con otros. DATOS FARMACÉUTICOS / PERÍODO DE VALIDEZ Tres años. Después de la reconstitución, se recomienda el uso inmediato. Se ha demostrado una estabilidad física y química de 48 horas entre 2 o C- 8 o C. Desde un punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se usa de inmediato, será responsabilidad del usuario el tiempo de almacenaje, el cual no debería ser superior a 6 horas entre 2 o C- 8 o C, a menos que la reconstitución haya tenido lugar en condiciones asépticas validadas y controladas. DATOS FARMACÉUTICOS / ALMACENAMIENTO Conservar en nevera (2 o C- 8 o C). No congelar. DATOS FARMACÉUTICOS / CONTENIDO DEL ENVASE Vial de vidrio transparente (4 ml, vidrio tipo I) con tapones de goma, cápsulas de aluminio y cápsulas flip-off de plástico. Enbrel se presenta con jeringas precargadas que contienen agua para inyección. Las jeringas son de vidrio tipo I. Cada envase contiene 4, 8 ó 24 viales de Enbrel con 4, 8 ó 24 jeringas precargadas, 4, 8 ó 24 agujas, 4, 8 ó 24 adaptadores del vial y 8, 16 ó 48 torundas con alcohol. Posible comercialización solamente de algunos tamaños de envases.
9 DATOS FARMACÉUTICOS / INSTRUCCIONES DE USO Enbrel 25 mg se reconstituye con 1 ml de agua para inyección. Enbrel no contiene conservantes antibacterianos y, por tanto, las soluciones preparadas con agua para inyección deberán administrarse lo antes posible y dentro de las 6 horas siguientes a su reconstitución. La solución debería ser clara e incolora, sin grumos, escamas o partículas. Algo de espuma blanca puede permanecer en el vial- esto es normal. No utilizar Enbrel si no se disuelve todo el polvo del vial en 10 minutos. Empezar de nuevo con otro vial. La eliminación de los productos no utilizados o de los envases se establecerá de acuerdo con las exigencias locales. AUTORIZACIÓN DE COMERCIALIZACIÓN / TITULAR DE LA AUTORIZACIÓN Wyeth Europa Ltd. Huntercombe Lane South. Taplow Maidenhead. Berkshire, SL6 0PH. Reino Unido. AUTORIZACIÓN DE COMERCIALIZACIÓN / NÚMERO DE LA AUTORIZACIÓN EU/1/99/126/003 4 viales. EU/1/99/126/004 8 viales. EU/1/99/126/ viales. AUTORIZACIÓN DE COMERCIALIZACIÓN / FECHA DE LA PRIMERA AUTORIZACIÓN Fecha de la primera autorización: 3 de febrero de Fecha de la última revalidación: 3 de febrero de DISPENSACIÓN Y COMERCIALIZACIÓN / PRESENTACIÓN Y PVP Enbrel Polvo y disolvente para solución inyectable, envase con 4 viales y 4 jeringas, 539,25 (IVA). Con receta médica. Uso hospitalario.
FICHA TÉCNICA. El polvo es blanco. El disolvente es un líquido incoloro y transparente.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Enbrel 50 mg polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 50 mg de etanercept. Etanercept es una
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO Enbrel 50 mg polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 50 mg de etanercept. Etanercept es una
QUÉ ES LA PSORIASIS EN PLACAS?
 QUÉ ES LA PSORIASIS EN PLACAS? La psoriasis en placa es la forma más común de la psoriasis. Puede aparecer en cualquier parte del cuerpo, pero se encuentra más comúnmente en los codos, rodillas, cuero
QUÉ ES LA PSORIASIS EN PLACAS? La psoriasis en placa es la forma más común de la psoriasis. Puede aparecer en cualquier parte del cuerpo, pero se encuentra más comúnmente en los codos, rodillas, cuero
Qué es? Los Antimaláricos en Reumatología
 30 Qué es? Los Antimaláricos en Reumatología 30 Qué es? Los Antimaláricos en Reumatología Son un grupo de medicamentos (también llamados antipalúdicos) que se han usado clásicamente para tratar el paludismo
30 Qué es? Los Antimaláricos en Reumatología 30 Qué es? Los Antimaláricos en Reumatología Son un grupo de medicamentos (también llamados antipalúdicos) que se han usado clásicamente para tratar el paludismo
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Enbrel 25 mg polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Enbrel 25 mg polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
riesgos con Xolair. Información sobre Xolair (omalizumab)
 La FDA aprueba cambios en la etiqueta del medicamento para el asma Xolair (omalizumab), los que incluyen la descripción de un riesgo ligeramente mayor de acontecimientos adversos cardíacos y cerebrales
La FDA aprueba cambios en la etiqueta del medicamento para el asma Xolair (omalizumab), los que incluyen la descripción de un riesgo ligeramente mayor de acontecimientos adversos cardíacos y cerebrales
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ENBREL (Etanercept) Solución para Inyección. Cada jeringa prellenada de ENBREL 25 mg contiene: 25 mg de etanercept
 ENBREL (Etanercept) Solución para Inyección 1. NOMBRE DEL PRODUCTO FARMACÉUTICO ENBREL 25 mg Solución para Inyección ENBREL 50 mg Solución para Inyección 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ENBREL (Etanercept) Solución para Inyección 1. NOMBRE DEL PRODUCTO FARMACÉUTICO ENBREL 25 mg Solución para Inyección ENBREL 50 mg Solución para Inyección 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
Anexo III. Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto
 Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Debe utilizarse la dosis eficaz mínima durante el periodo más corto posible a fin de reducir las reacciones adversas.
 ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
FICHA TÉCNICA. STREPSILS pastillas para chupar sabor miel y limón
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA. Pastillas circulares de color rosa con sabor a fresa y el icono de Strepsils grabado en ambos lados.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FOLLETO DE INFORMACION AL PROFESIONAL ENBREL 50 MG SOLUCIÓN INYECTABLE EN AUTOINYECTOR PRELLENADO
 FOLLETO DE INFORMACION AL PROFESIONAL ENBREL 50 MG SOLUCIÓN INYECTABLE EN AUTOINYECTOR PRELLENADO 1.- DESCRIPCION 1.1 Ingredientes activos Etanercept (INN) Etanercept es una proteína de fusión del receptor
FOLLETO DE INFORMACION AL PROFESIONAL ENBREL 50 MG SOLUCIÓN INYECTABLE EN AUTOINYECTOR PRELLENADO 1.- DESCRIPCION 1.1 Ingredientes activos Etanercept (INN) Etanercept es una proteína de fusión del receptor
Introducción. Nuevos anticoagulantes orales
 Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES
 DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES DEFINICIÓN El déficit selectivo de IgA se define como la ausencia total de Inmunoglobulina de tipo IgA en sangre. Existen cinco tipos (clases)
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES DEFINICIÓN El déficit selectivo de IgA se define como la ausencia total de Inmunoglobulina de tipo IgA en sangre. Existen cinco tipos (clases)
Kineret 100 mg, solución inyectable en jeringa precargada. Cada jeringa precargada contiene 100 mg de anakinra en 0,67 ml (150 mg/ml).
 1. DENOMINACIÓN DEL MEDICAMENTO Kineret 100 mg, solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada jeringa precargada contiene 100 mg de anakinra en 0,67 ml (150
1. DENOMINACIÓN DEL MEDICAMENTO Kineret 100 mg, solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada jeringa precargada contiene 100 mg de anakinra en 0,67 ml (150
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA. Excipientes con efecto conocido: 1,38 g de sacarosa y 1,10 g de glucosa.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES
 DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL
 FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria
 TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO
 LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO Xenaro Graña 7 de Julio de 2007 Servicio de Reumatología del Complejo Hospitalario Universitario Juan Canalejo de A Coruña El tratamiento de la Enfermedad
LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO Xenaro Graña 7 de Julio de 2007 Servicio de Reumatología del Complejo Hospitalario Universitario Juan Canalejo de A Coruña El tratamiento de la Enfermedad
Hernán Argote Berdugo MD, Michael Macías Vidal QF, Ricardo Ávila de la Hoz QF, Esp.
 Colegio Nacional de Químicos Farmacéuticos de Colombia Unidad Regional Atlántico Hernán Argote Berdugo MD, Michael Macías Vidal QF, Ricardo Ávila de la Hoz QF, Esp. Barranquilla, Octubre 2011 Reacciones
Colegio Nacional de Químicos Farmacéuticos de Colombia Unidad Regional Atlántico Hernán Argote Berdugo MD, Michael Macías Vidal QF, Ricardo Ávila de la Hoz QF, Esp. Barranquilla, Octubre 2011 Reacciones
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
ENFERMEDAD DE CROHN. Qué es la enfermedad de crohn?
 ENFERMEDAD DE CROHN Qué es la enfermedad de crohn? La enfermedad de Crohn es un proceso inflamatorio que afecta primariamente al tracto intestinal, aunque puede afectar a cualquier parte del aparato digestivo,
ENFERMEDAD DE CROHN Qué es la enfermedad de crohn? La enfermedad de Crohn es un proceso inflamatorio que afecta primariamente al tracto intestinal, aunque puede afectar a cualquier parte del aparato digestivo,
Calcitonina Almirall 100 UI Solución inyectable Calcitonina sintética de salmón
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
CAPÍTULO VIII EL SÍNDROME HIPER IgM LIGADO AL X
 CAPÍTULO VIII EL SÍNDROME HIPER IgM LIGADO AL X Los pacientes con el Síndrome Hiper IgM ligado al x tienen deficiencia de una proteína, Ligando CD40, que se encuentra en la superficie de los linfocitos
CAPÍTULO VIII EL SÍNDROME HIPER IgM LIGADO AL X Los pacientes con el Síndrome Hiper IgM ligado al x tienen deficiencia de una proteína, Ligando CD40, que se encuentra en la superficie de los linfocitos
Qué es la tarjeta amarilla?
 Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
FICHA TÉCNICA. Glucosa
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
REGISTRO ESPAÑOL DE ACONTECIMIENTOS ADVERSOS DE TERAPIAS BIOLÓGICAS EN ENFERMEDADES REUMÁTICAS (Fase II)
 REGISTRO ESPAÑOL DE ACONTECIMIENTOS ADVERSOS DE TERAPIAS BIOLÓGICAS EN ENFERMEDADES REUMÁTICAS (Fase II) INFORME DICIEMBRE 2007 Índice Descripción del registro con todos los tratamientos biológicos...3
REGISTRO ESPAÑOL DE ACONTECIMIENTOS ADVERSOS DE TERAPIAS BIOLÓGICAS EN ENFERMEDADES REUMÁTICAS (Fase II) INFORME DICIEMBRE 2007 Índice Descripción del registro con todos los tratamientos biológicos...3
Informe mensual. Medicamentos. Noviembre. sobre. de Uso Humano y Productos Sanitarios. Medicamentos. Información dirigida a profesionales sanitarios
 Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Información dirigida a profesionales sanitarios ÍNDICE Medicamentos 1. Nuevos medicamentos 2. Cambios de especial interés
Informe mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Información dirigida a profesionales sanitarios ÍNDICE Medicamentos 1. Nuevos medicamentos 2. Cambios de especial interés
Algunas consideraciones sobre el Síndrome Antifosfolípido Primario
 Anexos Anexo 1 Algunas consideraciones sobre el Síndrome Antifosfolípido Primario El síndrome antifosfolípido, descrito inicialmente como lupus eritematoso sistémico, aparece en personas que no reúnen
Anexos Anexo 1 Algunas consideraciones sobre el Síndrome Antifosfolípido Primario El síndrome antifosfolípido, descrito inicialmente como lupus eritematoso sistémico, aparece en personas que no reúnen
HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA.
 HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA. Mª Victoria Rodríguez, Nelida Madrazo, Asunción Aguilera, Eva Mª Aguirre, Concepción Herrero, Mª Eugenia Plagaro,
HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA. Mª Victoria Rodríguez, Nelida Madrazo, Asunción Aguilera, Eva Mª Aguirre, Concepción Herrero, Mª Eugenia Plagaro,
INSTRUCTIVO PARA GESTION DE MEDICACIÓN ESPECIAL:
 Manual para Procedimientos, Dispositivos y Medicación SUR 249 Form. N.1.1.1. Se informa a Ud. que, con el fin de realizar la solicitud de ABATECEPT prescripto para el tratamiento de la patología ARTRITIS
Manual para Procedimientos, Dispositivos y Medicación SUR 249 Form. N.1.1.1. Se informa a Ud. que, con el fin de realizar la solicitud de ABATECEPT prescripto para el tratamiento de la patología ARTRITIS
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 IBUPROFENO 100 mg/5 ml SUSPENSIÓN ANTIPIRÉTICO-ANTIINFLAMATORIO Página 1 IBUPROFENO 100 mg/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 IBUPROFENO 100 mg/5 ml SUSPENSIÓN ANTIPIRÉTICO-ANTIINFLAMATORIO Página 1 IBUPROFENO 100 mg/5 ml Suspensión Principio
FICHA TÉCNICA. Polisacárido capsular Vi purificado de Salmonella typhi (cepa Ty2)...25 microgramos
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
Autor: Dres. Freynhagen R, Serpell M, Latymer M y colaboradores Fuente: SIIC Pain Practice 1-11, Nov 2013. Introducción y objetivos
 Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
Tuberculosis Hospital Event
 Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Que son "inyecciones para la alergia"?
 Que son "inyecciones para la alergia"? Este folleto está diseñado para responder las preguntas básicas de quién, qué, cuándo, dónde, cómo y por qué que pueda tener con respecto a la inmunoterapia alergénica,
Que son "inyecciones para la alergia"? Este folleto está diseñado para responder las preguntas básicas de quién, qué, cuándo, dónde, cómo y por qué que pueda tener con respecto a la inmunoterapia alergénica,
Cada sobre de MOVICOL Pediátrico contiene los siguientes principios activos:
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO MOVICOL Pediátrico 6,9 g sobre, polvo para solución oral. 2. COMPOSICIÓN
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Oxacilina (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La oxacilina corresponde
Oxacilina (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La oxacilina corresponde
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
APRENDIENDO CON NEFRON SUPERHEROE
 APRENDIENDO CON NEFRON SUPERHEROE DIABETES - UN FACTOR DE RIESGO PARA LA ENFERMEDAD RENAL La Diabetes mellitus, generalmente conocida como diabetes, es una enfermedad en la que su cuerpo no produce suficiente
APRENDIENDO CON NEFRON SUPERHEROE DIABETES - UN FACTOR DE RIESGO PARA LA ENFERMEDAD RENAL La Diabetes mellitus, generalmente conocida como diabetes, es una enfermedad en la que su cuerpo no produce suficiente
GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG.
 1. NOMBRE DEL MEDICAMENTO GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada sobre contiene 1.500 mg de glucosamina sulfato como 1.884 mg de glucosamina
1. NOMBRE DEL MEDICAMENTO GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada sobre contiene 1.500 mg de glucosamina sulfato como 1.884 mg de glucosamina
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
Anticoncepción oral sin estrógenos Qué debes saber?
 Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
Preguntas generales sobre la meningitis
 Preguntas generales sobre la meningitis P: Qué es la meningitis? R: La meningitis es una inflamación de las membranas que recubren el cerebro y la médula espinal. Algunas veces se le conoce como meningitis
Preguntas generales sobre la meningitis P: Qué es la meningitis? R: La meningitis es una inflamación de las membranas que recubren el cerebro y la médula espinal. Algunas veces se le conoce como meningitis
FICHA TÉCNICA. Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Coulergin 10 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Coulergin 10 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
SIM EXPRESS Información dirigida a los profesionales de la salud. Ustekinumab
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM EXPRESS Información dirigida a los profesionales de la salud Ustekinumab SIM Sistema
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM EXPRESS Información dirigida a los profesionales de la salud Ustekinumab SIM Sistema
Principios activos Eficacia Seguridad Conveniencia Niveles 1 Ibuprofeno +++ +++ +++ 1-2-3. 2 Prednisolona +++ ++ ++ 1-2-3. 3 Metotrexato +++ ++ ++ 3
 Título: ARTRITIS REUMATOIDE Codificación CIE 10 M05.9 artritis reumatoide con compromiso de otros órganos o sistemas M06.9 artritis reumatoide, no especificada Problema: La artritis reumatoide (AR) es
Título: ARTRITIS REUMATOIDE Codificación CIE 10 M05.9 artritis reumatoide con compromiso de otros órganos o sistemas M06.9 artritis reumatoide, no especificada Problema: La artritis reumatoide (AR) es
Clasificación de problemas relacionados con medicamentos
 Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes
 Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes antes de hidroxiurea después de hidroxiurea Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes 1 Este documento
Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes antes de hidroxiurea después de hidroxiurea Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes 1 Este documento
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
Cada pluma precargada con una dosis única de 0,8 ml contiene 40 mg de adalimumab.
 Ficha Técnica HUMIRA 1. NOMBRE DEL MEDICAMENTO Humira 40 mg solución inyectable en pluma precargada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pluma precargada con una dosis única de 0,8 ml contiene
Ficha Técnica HUMIRA 1. NOMBRE DEL MEDICAMENTO Humira 40 mg solución inyectable en pluma precargada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada pluma precargada con una dosis única de 0,8 ml contiene
SALUD DE LA MUJER. III. Resultados obtenidos
 SALUD DE LA MUJER I. Introducción En este informe se busca abordar la participación de la mujer en la utilización de servicios públicos de salud, particularmente en los centros de atención primaria. En
SALUD DE LA MUJER I. Introducción En este informe se busca abordar la participación de la mujer en la utilización de servicios públicos de salud, particularmente en los centros de atención primaria. En
No lo dude, la vacunación es la prevención más efectiva contra la gripe. Prevenir la gripe es más simple de lo que usted piensa
 No lo dude, la vacunación es la prevención más efectiva contra la gripe Prevenir la gripe es más simple de lo que usted piensa Arriesgarse a contraer la gripe o vacunarse? Qué es la gripe? La gripe es
No lo dude, la vacunación es la prevención más efectiva contra la gripe Prevenir la gripe es más simple de lo que usted piensa Arriesgarse a contraer la gripe o vacunarse? Qué es la gripe? La gripe es
El sobrepeso puede reducir seriamente la calidad de vida de su perro.
 El sobrepeso puede reducir seriamente la calidad de vida de su perro. Un perro con sobrepeso puede no sentirse tan bien como realmente podría. De hecho, si su perro Tiene problemas a la hora de levantarse
El sobrepeso puede reducir seriamente la calidad de vida de su perro. Un perro con sobrepeso puede no sentirse tan bien como realmente podría. De hecho, si su perro Tiene problemas a la hora de levantarse
GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR
 GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR CLÍNICA UNIVERSITARIA universidad de navarra QUÉ SON LOS ANTICOAGULANTES? Son sustancias utilizadas para la prevención y tratamiento de la trombosis,
GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR CLÍNICA UNIVERSITARIA universidad de navarra QUÉ SON LOS ANTICOAGULANTES? Son sustancias utilizadas para la prevención y tratamiento de la trombosis,
Anexo II. Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos
 Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
RESUMEN EJECUTIVO EN ESPAÑOL
 RESUMEN EJECUTIVO EN ESPAÑOL Guía de Práctica Clínica para la prevención, diagnóstico, evaluación y tratamiento de la Hepatitis C en enfermedad renal crónica Page 1 of 8 GUIA 1: DETECCIÓN Y EVALUACIÓN
RESUMEN EJECUTIVO EN ESPAÑOL Guía de Práctica Clínica para la prevención, diagnóstico, evaluación y tratamiento de la Hepatitis C en enfermedad renal crónica Page 1 of 8 GUIA 1: DETECCIÓN Y EVALUACIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Falcol Difucrem 15 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Falcol Difucrem 15 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 15 mg de aceclofenaco. Excipientes con efecto conocido: alcohol
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Falcol Difucrem 15 mg/g crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene 15 mg de aceclofenaco. Excipientes con efecto conocido: alcohol
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Kineret 100 mg, solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Kineret 100 mg, solución inyectable en jeringa precargada. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Marcadores tumorales
 Marcadores tumorales Uno de los retos más importantes de la medicina actual es el tratamiento del cáncer. Muchas veces el diagnóstico precoz va a ser importante para el éxito de dicho tratamiento. No se
Marcadores tumorales Uno de los retos más importantes de la medicina actual es el tratamiento del cáncer. Muchas veces el diagnóstico precoz va a ser importante para el éxito de dicho tratamiento. No se
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
GPC. Guía de Referencia Rápida. Sarcoma de Kaposi en pacientes VIH. Guía de Práctica Clínica. Sarcoma de Kaposi Asociado a VIH
 Guía de Referencia Rápida Sarcoma de Kaposi en pacientes VIH GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-462-11 1 Guía de Referencia Rápida CIE-10: B210 Enfermedad
Guía de Referencia Rápida Sarcoma de Kaposi en pacientes VIH GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-462-11 1 Guía de Referencia Rápida CIE-10: B210 Enfermedad
Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento.
 Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento. ENTENDIENDO SU INFORME DE PATOLOGÍA Usualmente se realiza
Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento. ENTENDIENDO SU INFORME DE PATOLOGÍA Usualmente se realiza
Este artículo describe los pasos para el diagnóstico de un paciente con sospecha de enfermedad autoinmune reumática
 Diagnóstico Artículo: Este artículo describe los pasos para el diagnóstico de un paciente con sospecha de enfermedad autoinmune reumática Una mujer de 23 años asiste a la consulta con su médico general
Diagnóstico Artículo: Este artículo describe los pasos para el diagnóstico de un paciente con sospecha de enfermedad autoinmune reumática Una mujer de 23 años asiste a la consulta con su médico general
Índice de contenidos DESCRIPCIÓN GENERAL. Esteroides Anabólicos (Por via oral)
 Esteroides Anabólicos (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los esteroides anabólicos
Esteroides Anabólicos (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los esteroides anabólicos
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada ml contiene: Sustancia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada ml contiene: Sustancia
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
*6816* CONSENTIMIENTO PARA OPCIONES DE DONACIÓN DE RIÑÓN DE DONANTE FALLECIDO/A
 La escasez de donantes de riñón y la creciente lista de espera ha llevado a la comunidad de trasplante a buscar distintos tipos de donantes de órganos para cubrir las necesidades de nuestros/as pacientes
La escasez de donantes de riñón y la creciente lista de espera ha llevado a la comunidad de trasplante a buscar distintos tipos de donantes de órganos para cubrir las necesidades de nuestros/as pacientes
HUMIRA (adalimumab) Rx solamente
 HUMIRA (adalimumab) Rx solamente 64C-1603104 Spanish MASTER INFORMACIÓN DESTACADA SOBRE LA PRESCRIPCIÓN Esta información destacada no incluye toda la información necesaria para usar HUMIRA (adalimumab)
HUMIRA (adalimumab) Rx solamente 64C-1603104 Spanish MASTER INFORMACIÓN DESTACADA SOBRE LA PRESCRIPCIÓN Esta información destacada no incluye toda la información necesaria para usar HUMIRA (adalimumab)
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Lincomicina (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las lincomicinas corresponden
Lincomicina (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las lincomicinas corresponden
Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina)
 1. DENOMINACIÓN DEL MEDICAMENTO Glucomed 625 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina) Para la lista
1. DENOMINACIÓN DEL MEDICAMENTO Glucomed 625 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina) Para la lista
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS VICTRELIS (BOCEPREVIR): INTERACCIÓN CON LOS INHIBIDORES DE LA PROTEASA DEL VIH ATAZANAVIR, DARUNAVIR Y LOPINAVIR Fecha de
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS VICTRELIS (BOCEPREVIR): INTERACCIÓN CON LOS INHIBIDORES DE LA PROTEASA DEL VIH ATAZANAVIR, DARUNAVIR Y LOPINAVIR Fecha de
Aspectos psiquiátricos y conductuales de la enfermedad cardiovascular.
 Aspectos psiquiátricos y conductuales de la enfermedad cardiovascular. Durante décadas, la enfermedad cardiovascular (ECV) ha sido la principal causa de muerte y discapacidad en los países occidentales,
Aspectos psiquiátricos y conductuales de la enfermedad cardiovascular. Durante décadas, la enfermedad cardiovascular (ECV) ha sido la principal causa de muerte y discapacidad en los países occidentales,
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
RESUMEN GENERAL DE LA EVALUACIÓN CIENTÍFICA DE LOS MEDICAMENTOS A BASE DE ÁCIDO VALPROICO/VALPROATO (véase el anexo I)
 ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 108 CONCLUSIONES CIENTÍFICAS
ANEXO II CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO PRESENTADOS POR LA AGENCIA EUROPEA DE MEDICAMENTOS 108 CONCLUSIONES CIENTÍFICAS
ASPECTOS GENERALES SOBRE VACUNACIÓN
 Qué es la vacunación? La vacunación es el proceso que tiene por objetivo conseguir una respuesta inmunitaria o protección frente a una enfermedad determinada mediante la administración de una vacuna. Es
Qué es la vacunación? La vacunación es el proceso que tiene por objetivo conseguir una respuesta inmunitaria o protección frente a una enfermedad determinada mediante la administración de una vacuna. Es
TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL
 TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL Título del reporte: efectividad y seguridad de lapatinib (terapia anti-her2) en cáncer de mama HER2 positivo Autores: grupo desarrollador
TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL Título del reporte: efectividad y seguridad de lapatinib (terapia anti-her2) en cáncer de mama HER2 positivo Autores: grupo desarrollador
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
Advertencias y precauciones especiales de empleo
 1 - NOMBRE DEL MEDICAMENTO GINKGO MADAUS Extracto de Ginkgo biloba 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Una medida de 1,5 ml contiene: Extracto estandarizado seco de hojas de Ginkgo biloba, obtenido
1 - NOMBRE DEL MEDICAMENTO GINKGO MADAUS Extracto de Ginkgo biloba 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Una medida de 1,5 ml contiene: Extracto estandarizado seco de hojas de Ginkgo biloba, obtenido
La mayoría de exposiciones no ocasionan una infección. Después de una exposición, el riesgo de infección depende de factores como los siguientes:
 Exposición a la sangre Lo que deben saber los trabajadores de la salud Departamento de Salud y Servicios Humanos Centros para el Control y la Prevención de Enfermedades Exposiciones ocupacionales a la
Exposición a la sangre Lo que deben saber los trabajadores de la salud Departamento de Salud y Servicios Humanos Centros para el Control y la Prevención de Enfermedades Exposiciones ocupacionales a la
Estándares de cuidado de la artritis reumatoide
 Estándares de cuidado de la artritis reumatoide Translation into: Completed by: Email: SOC 1 SOC 2 SOC 3 SOC 4 SOC 5 SOC 6 Spanish (Castilian) Loreto Carmona lcarmona.inmusc@gmail.com Las personas con
Estándares de cuidado de la artritis reumatoide Translation into: Completed by: Email: SOC 1 SOC 2 SOC 3 SOC 4 SOC 5 SOC 6 Spanish (Castilian) Loreto Carmona lcarmona.inmusc@gmail.com Las personas con
SIGNOS DE ALARMA DURANTE EL EMBARAZO
 SIGNOS DE ALARMA DURANTE EL EMBARAZO MG. María Tello D., RN. Universidad Católica Santo Toribio de Mogrovejo CHICLAYO-PERÚ SIGNOS DE ALARMA DURANTE EL EMBARAZO Si bien la mayoría a de los embarazos y partos
SIGNOS DE ALARMA DURANTE EL EMBARAZO MG. María Tello D., RN. Universidad Católica Santo Toribio de Mogrovejo CHICLAYO-PERÚ SIGNOS DE ALARMA DURANTE EL EMBARAZO Si bien la mayoría a de los embarazos y partos
