EFECTO SOLVENTE. Los espectros de emisión de algunos fluoróforos son muy sensibles al ambiente circundante, incluyendo al solvente
|
|
|
- Sergio Benítez Alvarado
- hace 6 años
- Vistas:
Transcripción
1 EFECTO SOLVENTE
2 EFECTO SOLVENTE Los espectros de emisión de algunos fluoróforos son muy sensibles al ambiente circundante, incluyendo al solvente A partir de los espectros de emisión de estos fluoróforos unidos a proteínas y membranas se puede inferir la naturaleza del sitio de unión
3 EFECTO SOLVENTE La emisión de un fluoróforo en solución ocurre a λ más largas que la λ de absorción CORRIMIENTO DE STOKES Disipación de energía vibracional Redistribución electrónica en las moléculas de solvente que rodean al fluoróforo en estado excitado Interacciones específicas entre fluoróforo y solvente (enlace de hidrógeno, complejos de transferencia de carga, etc) EG EE
4 EFECTO SOLVENTE Efecto general Se produce por la influencia colectiva del juego entero de moléculas de solvente sobre el fluoróforo. Está relacionado con el índice de refracción (n) y constante dieléctrica (ε) del solvente Efecto específico Interacción específica entre pocas moléculas de solvente y el fluoróforo
5 EFECTOS GENERALES DEL SOLVENTE Diagrama parcial de energía relajación vibracional ( s) S 1 hνα (10-15 s) hνf relajación por solvente (10-11 s) solvente poco polar solvente más polar hν F ( s) S 1 relajado
6 F EFECTOS GENERALES DEL SOLVENTE Los efectos generales del solvente producen corrimientos al rojo a medida que aumenta la polaridad del solvente, pero los espectros son semejantes ÁCIDO 2-ANILINO-6- NAFTALEN SULFÓNICO en: acetonitrilo etilenglicol agua λ
7 EFECTOS GENERALES DEL SOLVENTE Ecuación de Lippert (1960): predice los desplazamientos de Stokes de un fluoróforo en medios de distinta polaridad Se debe verificar: 1) ausencia de efectos específicos 2) que la relajación por solvente sea más rápida que la emisión fluorescente momento dipolar del fluoróforo en estado fundamental y excitado constante dieléctrica ν a ν f = 2 (µ* - µ) 2 ε 1 n 2-1 hc a 3 2ε + 1 2n cte pérdida por relajación vibracional n o de onda de luz absorbida y fluorescente radio de la cavidad donde está el fluoróforo índice de refracción
8 EFECTOS GENERALES DEL SOLVENTE ε 1 n 2-1 2ε + 1 2n f polarizabilidad polarizabilidad electrónica o de alta frecuencia: se relaciona con la redistribución electrónica del solvente al interaccionar con el momento dipolar del fluoróforo en estado excitado (µ*) polarizabilidad molecular o de baja frecuencia: se relaciona con la reorientación entre sí de las moléculas de solvente
9 EFECTOS GENERALES DEL SOLVENTE Interpretación de la ecuación de Lippert Se considera al fluoróforo como un dipolo en un medio continuo de constante dieléctrica homogénea Un dipolo puntual produce un campo eléctrico inducido (R) en el solvente de igual dirección y de sentido contrario al dipolo Este campo eléctrico es distinto en estado fundamental y excitado, y se distingue si debe a factores electrónicos o a la reorientación del solvente.
10 EFECTOS GENERALES DEL SOLVENTE CAMPOS ELÉCTRICOS El campo eléctrico es distinto en estado fundamental (R) y excitado (R*), y se distingue si debe a factores electrónicos (R e y R e* ) o a la reorientación del solvente (R r y R r* ). R = (2 µ/a 3 ) f R e = (2 µ/a 3 ) f(n) R r = (2 µ/a 3 ) f R* = (2 µ /a 3 ) f R* e = (2 µ /a 3 ) f(n) R* r = (2 µ /a 3 ) f
11 EFECTOS GENERALES DEL SOLVENTE Estos campos son fáciles de describir con la siguiente figura: E R* e Redistribución de electrones del fluoróforo, pero no de sus núcleos (Franck Condon) R µ* r µ* R* e hν R* r R e R r µ µ R e R* r El solvente se perturba al cambiar el momento dipolar del analito: primero modificando la posición de sus electrones y después la posición de sus moléculas
12 EFECTOS GENERALES DEL SOLVENTE
13 EFECTOS GENERALES DEL SOLVENTE
14 Las energías implicadas en cada posición del diagrama se calculan de la siguiente manera: Recordar que: E = µr E = hcν Energía en estado vapor (no considera el solvente) Componente de orientación Componente electrónico R* e R r µ* µ* R* e R* r absorción R e R r µ µ emisión R e R* r E abs E abs = E v µr r µr e E* abs = E* v µ R r µ R* e E abs E em = hc (ν a - ν f ) = E em E* em = E* v µ*r* r µ*r* e = hc (ν a(v) - ν f(v) ) (µ*-µ)r r + (µ*-µ)r* r E em = E v µr* r µr e k ν a -ν f = k/hc + (µ*-µ) (R* r -R r )/hc k
15 EFECTOS GENERALES DEL SOLVENTE ν a -ν f = k/hc + (µ*-µ) (R* r -R r )/hc k Expresando los campos de reorientación R r en función de la polarizabilidad Recordar que R r = (2 µ/a 3 ) f ν a -ν b = k + (µ*-µ)/hc (2µ* f/a 3 2µ f/a 3 ) = 2 (µ*-µ) 2 f/hca 3
16 EFECTOS GENERALES DEL SOLVENTE Desplazamiento esperado por efecto general del solvente 2-anilinonaftaleno (2-AN) en hexano y en cloroformo irradiado a 350 nm µ*-µ = 20 D a = 4 A Solvente ε n f ν a -ν f λ em (calcul.) hexano cm nm cloroformo cm nm Sin embargo, la emisión del 2-AN en hexano se detecta a 370 nm Relajación vibracional
17 APLICACIÓN DE LA ECUACIÓN DE LIPPERT Indicadores de polaridad de sitios de unión Se determina la polaridad de un sitio de unión comparando la fluorescencia de una sonda unida a dicho sitio con la fluorescencia de la sonda en solventes de polaridad conocida. (ν a -ν f ) Se prepara una curva de calibración 2/hca 3 (µ*-µ) 2 f A mayor (µ*-µ) de un fluoróforo, mayor pendiente, mayor sensibilidad a cambios de polaridad. Ej: los sulfonatos de N-arilaminonaftaleno son indicadores de polaridad de sitios biológicos
18 EFECTOS GENERALES DEL SOLVENTE Gráficos de Lippert para dos derivados naftilamínicos en mezclas etanol-agua La constante dieléctrica y el índice de refracción del sistema depende de la constante dieléctrica y del índice de refracción de cada solvente y de su respectivo % en la mezcla (promedio ponderado)
19 Desplazamientos de Stokes en distintos solventes (ν a -ν f ) NH 2 solventes apróticos solventes próticos 2-anilinonaftaleno (ν a -ν f ) f - O C OR f + 9-metil antroato
20 Interacción química entre fluoróforo y unas pocas moléculas vecinas de solvente durante el tiempo de vida del estado excitado 2-anilinonaftaleno en ciclohexano, y en ciclohexano con cantidades crecientes de etanol F EFECTOS ESPECÍFICOS DEL SOLVENTE 0 % etanol 0.2 % etanol 0.4 % etanol 1.7 % etanol 100 % etanol λ Efecto general
21 Otro ejemplo: O HO CH 3 C CH3 2-acetilantraceno Fluorescencia de 2-acetilantraceno en hexano-dioxano Al aumentar el % de dioxano (hasta 100 %) el máximo de emisión se corre paulatinamente efecto general Fluorescencia de 2-acetilantraceno en hexano-metanol 1-2 % de metanol (% pequeño para modificar ε y N) producen un corrimiento brusco del máximo de emisión efecto específico Se produce enlace de hidrógeno entre metanol y grupo carbonilo del fluoróforo durante el tiempo de vida del estado excitado (el espectro de absorción no se modifica)
22 Espectros de 2-acetilantraceno en mezclas hexano-metanol Metanol 0.34 M 0.2 M 0.12 M M 0.05 M 0.03 M 0 M
23 DOS: Trans-4- dimetilamino- 4 -(1-oxobutil)- estilbeno Espectros de emisión de DOS en ciclohexano (CH), tolueno (T), acetato de etilo (EA) y butanol (B). La línea punteada muestra el espectro de emisión del DOS en vesículas de DPPC (dipalmitoil fosfatidil colina)
24 Otro ejemplo de efecto solvente DNS: 4-dimetilamino-4 - nitroestilbeno hexano ciclohexano tolueno acetato de etilo butanol
25 EJERCICIOS 1) Calcular el desplazamiento de Stokes de 2-aminonaftaleno (2-AN) en hexano y en cloroformo cuando se irradia a 350 nm. El valor (µ*-µ) para 2-AN es 20 D y el a = 4 Å Recordar 1debye (D) = 3.34x10-30 c x m Constante de Plank (h) = 6.63x10-34 J x s Velocidad de la luz (c) = 3 x 10 8 m x s -1 Factor de la ley de Coulomb (k) = 9x10 9 J x m/c 2
26 2) Usar los siguientes datos de corrimientos de Stokes de PRODAN en distintos solventes para calcular el cambio de su momento dipolar al pasar al estado excitado. Analizar si existen efectos específicos de solvente. Buscar en tabla los valores de índices de refracción y constantes dieléctricas. Considerar: a = 4.2 Å H 3 C H 3 C N O C CH 2 CH 3 PRODAN 6-propionil-2-(dimetilamino)naftaleno Solvente Máx. absorción (nm) Máx. emisión (nm) ciclohexano trietilamina clorobenceno cloroformo acetona ,3-propilen glicol metanol agua
Efectos del solvente y del entorno local sobre la fluorescencia
 Efectos del solvente y del entorno local sobre la fluorescencia C 6 C 7 Temario Efectos generales del solvente Efectos específicos del solvente Efectos de la temperatura Transferencia interna de carga
Efectos del solvente y del entorno local sobre la fluorescencia C 6 C 7 Temario Efectos generales del solvente Efectos específicos del solvente Efectos de la temperatura Transferencia interna de carga
Tema 7.- Principios de fotoquímica
 Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Propiedades físicas y estructura de los compuestos orgánicos
 Propiedades físicas y estructura de los compuestos orgánicos 1 1.-Uniones iónicas 2.-Uniones más débiles que las covalentes: -fuerzas dipolo-dipolo -dispersión de London -unión hidrógeno -interacciones
Propiedades físicas y estructura de los compuestos orgánicos 1 1.-Uniones iónicas 2.-Uniones más débiles que las covalentes: -fuerzas dipolo-dipolo -dispersión de London -unión hidrógeno -interacciones
Conceptos basicos del equilibrio de quimico en medio acuoso
 Conceptos basicos del equilibrio de quimico en medio acuoso Elaborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM QU ÍM IC A A N A LÍTIC A I C LAV E 1402 G rupo 4, s em es tre 2010-2 CONCEPTOS BASICOS
Conceptos basicos del equilibrio de quimico en medio acuoso Elaborado por: Gustavo Gomez Sosa Facultad de Quimica UNAM QU ÍM IC A A N A LÍTIC A I C LAV E 1402 G rupo 4, s em es tre 2010-2 CONCEPTOS BASICOS
(( )) Tema 5: Técnicas espectroscópicas: Espectrofotometría. visible Infrarrojo. Ultravioleta. Espectro de emisión de los cuerpos en equilibrio
 Tema 5: Técnicas espectroscópicas: Espectrofotometría 0 22 Hz Frecuencia 0 4 Hz 0 3 Hz γ X UV IR micro radio Rayos γ (gamma) λ < pm Rayos X pm-0nm Visible 400-800nm Ultravioleta 0-400 nm Longitud de onda
Tema 5: Técnicas espectroscópicas: Espectrofotometría 0 22 Hz Frecuencia 0 4 Hz 0 3 Hz γ X UV IR micro radio Rayos γ (gamma) λ < pm Rayos X pm-0nm Visible 400-800nm Ultravioleta 0-400 nm Longitud de onda
MOLÉCULAS POLAReS Y NO POLAReS
 MOLÉCULAS POLAReS Y NO POLAReS Una molécula polar presenta distribución asimétrica de las cargas eléctricas debido a la diferencia de electronegatividad de los átomos que la forman. Presenta dos zonas
MOLÉCULAS POLAReS Y NO POLAReS Una molécula polar presenta distribución asimétrica de las cargas eléctricas debido a la diferencia de electronegatividad de los átomos que la forman. Presenta dos zonas
Tema 7. Espectroscopia para el estudio de la materia. 1. Introducción. 1. Introducción. 1. Introducción
 1 Tema 7. Espectroscopia para el estudio de la materia 1801: Thomas Young. Naturaleza dual de la radiación y la materia. Interacción Radiación-materia. Ley de Lambert-Beer 3. Espectroscopía InfraRojos
1 Tema 7. Espectroscopia para el estudio de la materia 1801: Thomas Young. Naturaleza dual de la radiación y la materia. Interacción Radiación-materia. Ley de Lambert-Beer 3. Espectroscopía InfraRojos
Propiedades de los enlaces y de las moléculas
 Propiedades de los enlaces y de las moléculas Dr. Enrique Ruiz Trejo Las leyes fundamentales necesarias para el tratamiento matemático de gran parte de la física y para toda la química ya son conocidas
Propiedades de los enlaces y de las moléculas Dr. Enrique Ruiz Trejo Las leyes fundamentales necesarias para el tratamiento matemático de gran parte de la física y para toda la química ya son conocidas
VOLUMENES ATOMICO Y MOLECULAR EN EL PUNTO DE EBULLICION NORMAL
 VOLUMENES ATOMICO Y MOLECULAR EN EL PUNTO DE EBULLICION NORMAL Volumen atómico x 10 3 ( m 3 / kg átomo ) Volumen molecular x 10 3 ( m 3 / kg mol ) Bromo 27,0 Aire 29,9 Carbono 14,8 Br 2 53,2 Cloro 24,6
VOLUMENES ATOMICO Y MOLECULAR EN EL PUNTO DE EBULLICION NORMAL Volumen atómico x 10 3 ( m 3 / kg átomo ) Volumen molecular x 10 3 ( m 3 / kg mol ) Bromo 27,0 Aire 29,9 Carbono 14,8 Br 2 53,2 Cloro 24,6
Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA
 Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA 1. Objetivo Familiarizarse con los fundamentos de la identificación de moléculas a partir de su espectro de absorción infrarrojo.
Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA 1. Objetivo Familiarizarse con los fundamentos de la identificación de moléculas a partir de su espectro de absorción infrarrojo.
Espectroscopía de Absorción Molecular
 Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Regla del octeto Gilbert Newton Lewis
 Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
Regla del octeto En 1916 Gilbert Newton Lewis propuso que el enlace covalente entre átomos se produce al compartir pares de electrones, mecanismo por el que cada uno individualmente podría alcanzar ocho
Tema 7: Espectroscopia Vibracional (IR)
 Tabla 1. El espectro electromagnético Región Longitud de onda Energía de excitación Tipo de excitación Rayos x, rayos cósmicos 286 (Kcal/mol) Ultravioleta Visible Infrarrojo próximo Infrarrojo
Tabla 1. El espectro electromagnético Región Longitud de onda Energía de excitación Tipo de excitación Rayos x, rayos cósmicos 286 (Kcal/mol) Ultravioleta Visible Infrarrojo próximo Infrarrojo
Orbital: región espacio disponible encuentra e-. Isótopos: át = #p+ y #n Principio incertidumbre Heisenberg: localización e-. Orbitales degenerados:
 Orbital: región espacio disponible encuentra e-. Isótopos: át = #p+ y #n Principio incertidumbre Heisenberg: localización e-. Orbitales degenerados: = E px py pz. Principio Exclusión Pauli: c/orbital 2
Orbital: región espacio disponible encuentra e-. Isótopos: át = #p+ y #n Principio incertidumbre Heisenberg: localización e-. Orbitales degenerados: = E px py pz. Principio Exclusión Pauli: c/orbital 2
FUERZAS INTERMOLECULARES. Elementos de Fisicoquímica UNEXPO
 FUERZAS INTERMOLECULARES Elementos de Fisicoquímica UNEXPO Las fuerzas intermoleculares son interacciones entre moléculas. Las propiedades físicas de los sólidos y líquidos moleculares (fases condensadas)
FUERZAS INTERMOLECULARES Elementos de Fisicoquímica UNEXPO Las fuerzas intermoleculares son interacciones entre moléculas. Las propiedades físicas de los sólidos y líquidos moleculares (fases condensadas)
Espectroscopía Clase integradora
 Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS. Partícula Masa (g) Carga (Coulombs) Carga unitaria. Electrón
 MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
Estructura y propiedades físicas
 Estructura y propiedades físicas Fuerzas intermoleculares: Fuerzas de Van der Waals, atracción dipolo-dipolo, puente Hidrógeno. Punto de ebullición. Punto de fusión. Solubilidad. Solvatación de iones y
Estructura y propiedades físicas Fuerzas intermoleculares: Fuerzas de Van der Waals, atracción dipolo-dipolo, puente Hidrógeno. Punto de ebullición. Punto de fusión. Solubilidad. Solvatación de iones y
Medicina Veterinaria. Parte I
 Medicina Veterinaria QUÍMICA ORGÁNICA Parte I Moléculas Polares y No Polares Moléculas No Polares: Los electrones están distribuidos simétricamente en la molécula y el centro de las cargas eléctricas coincide
Medicina Veterinaria QUÍMICA ORGÁNICA Parte I Moléculas Polares y No Polares Moléculas No Polares: Los electrones están distribuidos simétricamente en la molécula y el centro de las cargas eléctricas coincide
Espectro Electromagnético
 1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
PROBLEMARIO DE QUÍMICA ANALÍTICA II. Espectrometría UV-Visible
 UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DEPARTAMENT DE QUIMICA UNIDAD ACADÉMICA DE QUÍMICA ANALÍTICA MATERIA: QUÍMICA ANALÍTICA II PRBLEMARI DE QUÍMICA ANALÍTICA II Espectrometría UV-Visible
UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DEPARTAMENT DE QUIMICA UNIDAD ACADÉMICA DE QUÍMICA ANALÍTICA MATERIA: QUÍMICA ANALÍTICA II PRBLEMARI DE QUÍMICA ANALÍTICA II Espectrometría UV-Visible
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
1.- Introducción. - Identificación de materiales y aditivos. - Análisis cuali y cuantitativo
 1.- Introducción - Identificación de materiales y aditivos - Análisis cuali y cuantitativo - Estudio de estructura molecular (conformación, estereoquímica, cristalinidad y orientación). - Interacciones
1.- Introducción - Identificación de materiales y aditivos - Análisis cuali y cuantitativo - Estudio de estructura molecular (conformación, estereoquímica, cristalinidad y orientación). - Interacciones
Espectroscopía vibracional y rotacional
 Espectroscopía vibracional y rotacional Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 19 de marzo de 2015 Índice 1. Interacción de la radiación con la materia
Espectroscopía vibracional y rotacional Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 19 de marzo de 2015 Índice 1. Interacción de la radiación con la materia
INSTITUCIÒN EDUCATIVA JUAN MARIA CESPEDES. DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
 INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
INSTITUCIÒN EDUCATIVA Código: F-GA-024 EDUCACIÒN CON CALIDAD JUAN MARIA CESPEDES Versión: 02 Fecha: 2011-07-05 DOCENTE: Gissely A. Quintero S. ÁREA: Ciencias Naturales (Química) 10º FUERZAS INTERMOLECULARES
HPLC CROMATOGRAFÍA LÍQUIDA CLÁSICA HPLC. Lentitutd Operación manual
 CROMATOGRAFÍA LÍQUIDA CLÁSICA Lentitutd Operación manual Columnas reutilizables pequeño diámetro. Disminución tamaño partícula f.e. Desarrollo nuevas f.e. Introducción de muestra precisa en pequeñas cantidades.
CROMATOGRAFÍA LÍQUIDA CLÁSICA Lentitutd Operación manual Columnas reutilizables pequeño diámetro. Disminución tamaño partícula f.e. Desarrollo nuevas f.e. Introducción de muestra precisa en pequeñas cantidades.
ESTRUCTURA DEL SEMINARIO:
 ESTRUCTURA DEL SEMINARIO: S1.1. Introducción a la espectrofotometría 1 S1.2. Radiación electromagnética 1 S1.3. Espectroscopía ultravioleta/visible 2 S1.4. Colorimetría 5 S1.1. Introducción a la espectrofotometría
ESTRUCTURA DEL SEMINARIO: S1.1. Introducción a la espectrofotometría 1 S1.2. Radiación electromagnética 1 S1.3. Espectroscopía ultravioleta/visible 2 S1.4. Colorimetría 5 S1.1. Introducción a la espectrofotometría
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA
 MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA y EL VISIBLE La espectroscopia de absorción molecular en el ultravioleta y visible se emplea en el análisis cuantitativo y es
MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA y EL VISIBLE La espectroscopia de absorción molecular en el ultravioleta y visible se emplea en el análisis cuantitativo y es
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
FUERZAS INTERMOLECULARES FUERZAS INTRAMOLECULARES: Fuerzas que se dan en el interior de las moléculas :Enlace Químico. FUERZAS INTERMOLECULARES: Interacciones entre moléculas. Mantienen unidas las moléculas
RADIACIÓN ELECTROMAGNÉTICA
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 1 RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL, 4 ed.; Ed. McGraw-Hill (1994), págs.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 1 RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL, 4 ed.; Ed. McGraw-Hill (1994), págs.
ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR. Introducción Principios teóricos Instrumentación Aplicaciones
 ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR Introducción Principios teóricos Instrumentación Aplicaciones Introducción: Fenómenos luminiscentes moleculares emisión de radiación por parte de determinadas
ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR Introducción Principios teóricos Instrumentación Aplicaciones Introducción: Fenómenos luminiscentes moleculares emisión de radiación por parte de determinadas
PROPIEDADES FÍSICAS Y ÁREA SUPERFICIAL MOLECULAR
 PROPIEDADES FÍSICAS Y ÁREA SUPERFICIAL MOLECULAR David Octavio Rosales Sánchez El punto de fusión es la temperatura a la cual se encuentra el equilibrio de fases sólido - líquido, es decir la materia pasa
PROPIEDADES FÍSICAS Y ÁREA SUPERFICIAL MOLECULAR David Octavio Rosales Sánchez El punto de fusión es la temperatura a la cual se encuentra el equilibrio de fases sólido - líquido, es decir la materia pasa
Polaridad de una molécula
 Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe
Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe
Las Ondas y la Luz. Las Ondas
 Las Ondas Una onda consiste en la propagación de una perturbación física en un medio que puede ser material (aire, agua, tierra, etc) o inmaterial (vacío), según la cual existe transporte de energía, pero
Las Ondas Una onda consiste en la propagación de una perturbación física en un medio que puede ser material (aire, agua, tierra, etc) o inmaterial (vacío), según la cual existe transporte de energía, pero
Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas
 Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas Objetivos: Recordar y actualizar los conocimientos sobre las características de electrones, protones y neutrones Describir la
Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas Objetivos: Recordar y actualizar los conocimientos sobre las características de electrones, protones y neutrones Describir la
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Fluorescencia de proteínas
 Fluorescencia de proteínas Fluorescencia intrínseca (emisión dominada por trp) Marcado con sondas fluorescentes (RET, anisotropía) GFP y derivados (visualización, RET) Fluorescencia de proteínas Herramienta
Fluorescencia de proteínas Fluorescencia intrínseca (emisión dominada por trp) Marcado con sondas fluorescentes (RET, anisotropía) GFP y derivados (visualización, RET) Fluorescencia de proteínas Herramienta
Res. Si n = 3 => l puede valer 0, 1 y 2. Por tanto, existen tres subniveles de energía: los correspondientes a los orbitales atómicos 3s, 3p y 3d.
 Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de calcio b) Hidróxido de cromo (III) c) Hexano-1,1-diol d) Hg 2 O 2 e) CdHPO 4 f) CH 2 =CHCH 2 CH 2 COOH Res. a) CaCrO 4 ; b) Cr(OH)
Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de calcio b) Hidróxido de cromo (III) c) Hexano-1,1-diol d) Hg 2 O 2 e) CdHPO 4 f) CH 2 =CHCH 2 CH 2 COOH Res. a) CaCrO 4 ; b) Cr(OH)
Fundamentos de la microscopía de fluorescencia
 Fundamentos de la microscopía de fluorescencia Andrés Esteban Cantos y Covadonga Alonso Martí Laboratorio de Interacción virus-célula Departamento de Biotecnología del INIA 1) La fluorescencia y sus propiedades
Fundamentos de la microscopía de fluorescencia Andrés Esteban Cantos y Covadonga Alonso Martí Laboratorio de Interacción virus-célula Departamento de Biotecnología del INIA 1) La fluorescencia y sus propiedades
Interacciones moleculares
 Interacciones moleculares Recuerde Gas: Interacciones entre partículas son mínimas. Sólido y líquido: Interacciones entre partículas son suficientes para mantenerlas cerca (aunque los sólidos tienen diferentes
Interacciones moleculares Recuerde Gas: Interacciones entre partículas son mínimas. Sólido y líquido: Interacciones entre partículas son suficientes para mantenerlas cerca (aunque los sólidos tienen diferentes
Espectroscopía electrónica de moléculas diatómicas
 C A P Í T U L O 12 Espectroscopía electrónica de moléculas diatómicas 12.1. ENUNCIADOS Y SOLUCIONES DE LOS PROBLEMAS PROBLEMAS 12.1 Demuestre que el operador reflexión ˆσ v no conmuta con el operador momento
C A P Í T U L O 12 Espectroscopía electrónica de moléculas diatómicas 12.1. ENUNCIADOS Y SOLUCIONES DE LOS PROBLEMAS PROBLEMAS 12.1 Demuestre que el operador reflexión ˆσ v no conmuta con el operador momento
Ecuaciones de Maxwell y Ondas Electromagnéticas
 Capítulo 7: Ecuaciones de Maxwell y Ondas Electromagnéticas Hasta ahora: Ley de Gauss Ley de Faraday-Henry Ley de Gauss para el magnetismo Ley de Ampere Veremos que la Ley de Ampere presenta problemas
Capítulo 7: Ecuaciones de Maxwell y Ondas Electromagnéticas Hasta ahora: Ley de Gauss Ley de Faraday-Henry Ley de Gauss para el magnetismo Ley de Ampere Veremos que la Ley de Ampere presenta problemas
Teoría cuántica y la estructura electrónica de los átomos. Capítulo 7
 Teoría cuántica y la estructura electrónica de los átomos Capítulo 7 Propiedades de las ondas Longitud de onda (λ) es la distancia que existe entre dos puntos idénticos en una serie de ondas. Amplitud:
Teoría cuántica y la estructura electrónica de los átomos Capítulo 7 Propiedades de las ondas Longitud de onda (λ) es la distancia que existe entre dos puntos idénticos en una serie de ondas. Amplitud:
Examen de problemas (SOLUCIONADO)
 1. [3.0 puntos] Aplicaciones de la Química Cuántica 3 de Químicas Convocatoria de Septiembre Curso: 2004-05 Examen de problemas SOLUCIONADO a Determinar las frecuencias rotacionales en Hz de la molécula
1. [3.0 puntos] Aplicaciones de la Química Cuántica 3 de Químicas Convocatoria de Septiembre Curso: 2004-05 Examen de problemas SOLUCIONADO a Determinar las frecuencias rotacionales en Hz de la molécula
UNAM- Facultad de Química Prof. Mario Alfredo García Carrillo
 GUIA DE ESTUDIOS PARA EL PRIMER EXAMEN. 1. El punto de fusión del ácido benzoico puro y del 2-naftol puro son 122.5 C y 123 C respectivamente. Se tiene una muestra que no se sabe si es ácido benzoico o
GUIA DE ESTUDIOS PARA EL PRIMER EXAMEN. 1. El punto de fusión del ácido benzoico puro y del 2-naftol puro son 122.5 C y 123 C respectivamente. Se tiene una muestra que no se sabe si es ácido benzoico o
Espectroscopía de Absorción Molecular
 Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Tema 3.-Espectroscopía de biomoléculas
 Tema 3.-Espectroscopía de biomoléculas Tema 3.-Espectroscopía de biomoléculas 3.1.-El espectro electromagnético 3.2.-Espectros de absorción y de emisión (espontánea y estimulada) 3.2.1.-Momento dipolar
Tema 3.-Espectroscopía de biomoléculas Tema 3.-Espectroscopía de biomoléculas 3.1.-El espectro electromagnético 3.2.-Espectros de absorción y de emisión (espontánea y estimulada) 3.2.1.-Momento dipolar
Fluorescencia. Biología celular 2017 Dra. Melisa Monteleone
 Fluorescencia Biología celular 2017 Dra. Melisa Monteleone Para qué sirve? Visualizar partes de la célula: membrana plasmática, núcleo, vacuolas, retículo endoplásmico, etc. Estudiar procesos celulares:
Fluorescencia Biología celular 2017 Dra. Melisa Monteleone Para qué sirve? Visualizar partes de la célula: membrana plasmática, núcleo, vacuolas, retículo endoplásmico, etc. Estudiar procesos celulares:
Análisis Funcional Orgánico. Cromatografía Líquida de Alta Resolución (HPLC/CLAR)
 Análisis Funcional Orgánico Cromatografía Líquida de Alta Resolución (HPLC/CLAR) PARTE A Introducción Técnicas instrumentales cromatográficas 1. Gaseosa líquida (CGL) o sólida (CGS) 2. Líquida de Alta
Análisis Funcional Orgánico Cromatografía Líquida de Alta Resolución (HPLC/CLAR) PARTE A Introducción Técnicas instrumentales cromatográficas 1. Gaseosa líquida (CGL) o sólida (CGS) 2. Líquida de Alta
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
ANARMONICIDAD Y RESONANCIA EN VIBRACIONES DE MOLÉCULAS. Q. Yokari Godínez Loyola Q. Kristopher M. Hess Frieling Q. Rafael Adrián Delgadillo Ruiz
 ANARMONICIDAD Y RESONANCIA EN VIBRACIONES DE MOLÉCULAS Q. Yokari Godínez Loyola Q. Kristopher M. Hess Frieling Q. Rafael Adrián Delgadillo Ruiz 1 CONTENIDO I. II. III. IV. V. VI. Introducción Anarmonicidad
ANARMONICIDAD Y RESONANCIA EN VIBRACIONES DE MOLÉCULAS Q. Yokari Godínez Loyola Q. Kristopher M. Hess Frieling Q. Rafael Adrián Delgadillo Ruiz 1 CONTENIDO I. II. III. IV. V. VI. Introducción Anarmonicidad
FACULTAD DE INGENIERIA. DIVISION DE CIENCIAS BASICAS UNAM. (27 DE ENERO 2014). Estrategia de Planeación del Modelo Atómico de Bohr
 FACULTAD DE INGENIERIA. DIVISION DE CIENCIAS BASICAS UNAM. (27 DE ENERO 2014). Estrategia de Planeación del Modelo Atómico de Bohr PROFESOR. DR. RAMIRO MARAVILLA GALVAN MODELOS EN LA ENSEÑANZA. EL MODELO
FACULTAD DE INGENIERIA. DIVISION DE CIENCIAS BASICAS UNAM. (27 DE ENERO 2014). Estrategia de Planeación del Modelo Atómico de Bohr PROFESOR. DR. RAMIRO MARAVILLA GALVAN MODELOS EN LA ENSEÑANZA. EL MODELO
RESONANCIA MAGNÉTICA NUCLEAR
 RESONANCIA MAGNÉTICA NUCLEAR SPIN DEL NUCLEO El nucleo de algunos átomos poseen SPIN. Estos núcleos se comportan como si estuvieran girando... no sabemos si realmente giran! Es como la propiedad de un
RESONANCIA MAGNÉTICA NUCLEAR SPIN DEL NUCLEO El nucleo de algunos átomos poseen SPIN. Estos núcleos se comportan como si estuvieran girando... no sabemos si realmente giran! Es como la propiedad de un
Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Segundo Semestre 2016 INTERACCIONES INTERMOLECULARES
 olegio San Esteban Diácono Departamento de iencias Química Iº Medio Segundo Semestre 2016 ITERAIOES ITERMOLEULARES Interacciones Intermoleculares Qué son? Son fuerzas de atracción que se producen entre
olegio San Esteban Diácono Departamento de iencias Química Iº Medio Segundo Semestre 2016 ITERAIOES ITERMOLEULARES Interacciones Intermoleculares Qué son? Son fuerzas de atracción que se producen entre
Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares
 Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares Enlace químico Cómo se unen los átomos? Cualquier teoría que de contestación a esta pregunta ha de explicar: Los diferentes tipos de enlace
Unidad 3 Enlace químico Moléculas y Fuerzas Intermoleculares Enlace químico Cómo se unen los átomos? Cualquier teoría que de contestación a esta pregunta ha de explicar: Los diferentes tipos de enlace
En general, las fuerzas intermoleculares poseen solo un 15% en magnitud que la fuerza de los enlaces iónicos o covalentes.
 Fuerzas intramoleculares La fuerza que mantiene unidos a los átomos de una molécula. Es una fuerza química o intramolecular. Fuerzas intermoleculares La fuerza que une a las moléculas unas con otras. Es
Fuerzas intramoleculares La fuerza que mantiene unidos a los átomos de una molécula. Es una fuerza química o intramolecular. Fuerzas intermoleculares La fuerza que une a las moléculas unas con otras. Es
Tema 3.-Espectroscopía de biomoléculas
 Tema 3.Espectroscopía de biomoléculas Tema 3.Espectroscopía de biomoléculas 3..El espectro electromagnético 3.2.Espectros de absorción y de emisión (espontánea y estimulada) 3.2..Momento dipolar de transición:
Tema 3.Espectroscopía de biomoléculas Tema 3.Espectroscopía de biomoléculas 3..El espectro electromagnético 3.2.Espectros de absorción y de emisión (espontánea y estimulada) 3.2..Momento dipolar de transición:
Influencia de la Constante Dieléctrica del disolvente
 Influencia de la Constante Dieléctrica del disolvente En las reacciones entre iones, las interacciones electrostáticas modifican de manera importante a la energía de activación de Gibbs Δ G =Δ G + * *
Influencia de la Constante Dieléctrica del disolvente En las reacciones entre iones, las interacciones electrostáticas modifican de manera importante a la energía de activación de Gibbs Δ G =Δ G + * *
Moléculas poliatómicas con dobles enlaces conjugados en la aproximación de electrones libres
 aterial didáctico para el curso de Química Cuántica Andrés Cedillo Departamento de Química, UA-I arzo de 1991 oléculas poliatómicas con dobles enlaces conjugados en la aproximación de electrones libres
aterial didáctico para el curso de Química Cuántica Andrés Cedillo Departamento de Química, UA-I arzo de 1991 oléculas poliatómicas con dobles enlaces conjugados en la aproximación de electrones libres
Espectros de emisión y absorción.
 Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos?
 qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos? Academia de Química, ITESM, campus Qro. 1 FUERZAS INTERMOLECULARES Academia de Química, ITESM, campus Qro. 2 FUERZAS INTERMOLECULARES
qué es lo que mantiene unidas a las MOLECULAS en los sólidos o líquidos? Academia de Química, ITESM, campus Qro. 1 FUERZAS INTERMOLECULARES Academia de Química, ITESM, campus Qro. 2 FUERZAS INTERMOLECULARES
Lección 10: HALUROS DE ALQUILO II
 Lección 10: HALUROS DE ALQUILO II 1. Reacciones. 2. Sustitución nucleófila. Mecanismos. 3. Mecanismo S N 2. 4. Reacciones estereoespecíficas y estereoselectivas. 5. Factores que afectan a la facilidad
Lección 10: HALUROS DE ALQUILO II 1. Reacciones. 2. Sustitución nucleófila. Mecanismos. 3. Mecanismo S N 2. 4. Reacciones estereoespecíficas y estereoselectivas. 5. Factores que afectan a la facilidad
Décimo novena sesión. Fuerzas Intermoleculares
 Décimo novena sesión Fuerzas Intermoleculares Introducción Las fuerzas que unen a los átomos en una molécula se deben al enlace químico. La energía requerida para romper este tipo de enlaces se llama energía
Décimo novena sesión Fuerzas Intermoleculares Introducción Las fuerzas que unen a los átomos en una molécula se deben al enlace químico. La energía requerida para romper este tipo de enlaces se llama energía
EL MODELO ATOMICO DE BOHR
 EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
radiación electromagnética
 radiación electromagnética ondas propagándose en el espacio con velocidad c crestas amplitud l valles longitud de onda [ l]=cm, nm, μm, A Frecuencia=n=c/l [ n ]=HZ=1/s l= numero de ondas por unidad de
radiación electromagnética ondas propagándose en el espacio con velocidad c crestas amplitud l valles longitud de onda [ l]=cm, nm, μm, A Frecuencia=n=c/l [ n ]=HZ=1/s l= numero de ondas por unidad de
Espectroscopia ultravioleta-visible (temas complementarios)
 1 Espectroscopia ultravioleta-visible (temas complementarios) Ley de Lambert y Beer Cuando se hace incidir radiación electromagnética en un medio, la energía dependerá de la longitud de onda de la radiación
1 Espectroscopia ultravioleta-visible (temas complementarios) Ley de Lambert y Beer Cuando se hace incidir radiación electromagnética en un medio, la energía dependerá de la longitud de onda de la radiación
CROMATOGRAFIA. Dra. María del Rosario Torviso Química Orgánica I FFyB-UBA
 CROMATOGRAFIA Dra. María del Rosario Torviso Química Orgánica I FFyB-UBA 1 CROMATOGRAFIA Se basa en el principio general de distribución de un compuesto entre dos fases, una fija o estacionaria (FE) y
CROMATOGRAFIA Dra. María del Rosario Torviso Química Orgánica I FFyB-UBA 1 CROMATOGRAFIA Se basa en el principio general de distribución de un compuesto entre dos fases, una fija o estacionaria (FE) y
EXAMEN (fecha: 12/05/2004)
 ESPECTROSCOPÍA EXAMEN (fecha: /05/004) Enunciados, resolución y soluciones: () La serie del espectro del catión He +, que corresponde al conjunto de transiciones en las que el electrón salta desde un nivel
ESPECTROSCOPÍA EXAMEN (fecha: /05/004) Enunciados, resolución y soluciones: () La serie del espectro del catión He +, que corresponde al conjunto de transiciones en las que el electrón salta desde un nivel
EXAMEN DE CAPACIDAD PROGRAMA DE POSGRADO EN QUÍMICA
 EXAMEN DE CAPACIDAD PROGRAMA DE POSGRADO EN QUÍMICA PRIMER SEMESTRE, 2015 NOMBRE COMPLETO INSTRUCCIONES Escriba su nombre de forma legible en el espacio indicado. Queda terminantemente prohibido firmar
EXAMEN DE CAPACIDAD PROGRAMA DE POSGRADO EN QUÍMICA PRIMER SEMESTRE, 2015 NOMBRE COMPLETO INSTRUCCIONES Escriba su nombre de forma legible en el espacio indicado. Queda terminantemente prohibido firmar
Fuerzas intermoleculares y líquidos y sólidos
 Fuerzas intermoleculares y líquidos y sólidos Capítulo 11 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Una fase es la parte homógenea de un sistema en contacto
Fuerzas intermoleculares y líquidos y sólidos Capítulo 11 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Una fase es la parte homógenea de un sistema en contacto
Interacción electrón-electrón: Plasmones, Apantallamiento, función dieléctrica
 Interacción electrón-electrón: Plasmones, Apantallamiento, función dieléctrica Rubén Pérez Departamento de Física Teórica de la Materia Condensada, C-05, 6a planta, despacho 601 Universidad Autónoma de
Interacción electrón-electrón: Plasmones, Apantallamiento, función dieléctrica Rubén Pérez Departamento de Física Teórica de la Materia Condensada, C-05, 6a planta, despacho 601 Universidad Autónoma de
BJ(J + 1) = (2J + 1) exp. máximo d(n J/N 0 ) + (2J + 1) exp. 2 (2J + 1) 2 B kt = 0 (2J + 1)2 = 2kT B J =
 Aplicaciones de la Química Cuántica 3 de Químicas Convocatoria de Febrero Curso: 004-05 Examen de problemas SOLUCIONADO) Versión: 8 de septiembre de 005) 1. [3.0 puntos] a) Deduce la expresión que permite
Aplicaciones de la Química Cuántica 3 de Químicas Convocatoria de Febrero Curso: 004-05 Examen de problemas SOLUCIONADO) Versión: 8 de septiembre de 005) 1. [3.0 puntos] a) Deduce la expresión que permite
LISTA DE FIGURAS. 1 Estructura de los primeros quimiosensores fluorescentes reportados para cationes metálicos... 3
 LISTA DE FIGURAS Fig. Pág. 1 Estructura de los primeros quimiosensores fluorescentes reportados para cationes metálicos... 3 2 Representación esquemática de un quimiosensor fluorescente.. 4 3 Estructura
LISTA DE FIGURAS Fig. Pág. 1 Estructura de los primeros quimiosensores fluorescentes reportados para cationes metálicos... 3 2 Representación esquemática de un quimiosensor fluorescente.. 4 3 Estructura
Caracterización Estructural de Materiales por Difracción de Rayos X
 Grado C. Físicas SÍNTESIS Y DETERMINACIÓN ESTRUCTURAL DE LOS MATERIALES Caracterización Estructural de Materiales por Difracción de Rayos X J. Medina UNIVERSIDAD DE VALLADOLID Departamento de Física de
Grado C. Físicas SÍNTESIS Y DETERMINACIÓN ESTRUCTURAL DE LOS MATERIALES Caracterización Estructural de Materiales por Difracción de Rayos X J. Medina UNIVERSIDAD DE VALLADOLID Departamento de Física de
Radiación. La radiación electromagnética
 Radiación Curso Introducción a las Ciencias de la Tierra y el Espacio II La radiación electromagnética Es el portador de la información de los objetos astronómicos. Es la forma en que la energía electromagnética
Radiación Curso Introducción a las Ciencias de la Tierra y el Espacio II La radiación electromagnética Es el portador de la información de los objetos astronómicos. Es la forma en que la energía electromagnética
Energías de Interacción
 Química General e Inorgánica A Energías de Interacción Tema 7 Fuerzas intermoleculares Fuerzas intermoleculares son fuerzas de atracción entre las moléculas Fuerzas intramoleculares mantienen juntos a
Química General e Inorgánica A Energías de Interacción Tema 7 Fuerzas intermoleculares Fuerzas intermoleculares son fuerzas de atracción entre las moléculas Fuerzas intramoleculares mantienen juntos a
Estructura de la Materia. Quinta Sesión Modelo Atómico de Bohr (2)
 Estructura de la Materia Quinta Sesión Modelo Atómico de Bohr () Postulados del Modelo de Bohr Postulado 1 (o de Rutherford): El átomo consta de una parte central llamada núcleo en la que se encuentra
Estructura de la Materia Quinta Sesión Modelo Atómico de Bohr () Postulados del Modelo de Bohr Postulado 1 (o de Rutherford): El átomo consta de una parte central llamada núcleo en la que se encuentra
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
TEMA 3. Grupos funcionales con enlaces múltiples.
 TEMA 3. Grupos funcionales con enlaces múltiples. Alquenos. Alquinos. Compuestos aromáticos. El grupo carbonilo. Aldehídos. Cetonas. Ácidos carboxílicos. Ésteres. Anhídridos. Amidas Tioésteres, Fosfoésteres,
TEMA 3. Grupos funcionales con enlaces múltiples. Alquenos. Alquinos. Compuestos aromáticos. El grupo carbonilo. Aldehídos. Cetonas. Ácidos carboxílicos. Ésteres. Anhídridos. Amidas Tioésteres, Fosfoésteres,
Bloque I Origen y evolución de los componentes del Universo
 Bloque I Origen y evolución de los componentes del Universo CRITERIOS DE EVALUACIÓN 1. Analizar cronológicamente los modelos atómicos hasta llegar al modelo actual discutiendo sus limitaciones y la necesitad
Bloque I Origen y evolución de los componentes del Universo CRITERIOS DE EVALUACIÓN 1. Analizar cronológicamente los modelos atómicos hasta llegar al modelo actual discutiendo sus limitaciones y la necesitad
INTRODUCCION (2) espectroscopía de absorción Espectroscopía de Emisión RMN Espectrometría de Masas espectrometría de fragmentación
 INTRODUCCION (1) Una de las labores más difíciles dentro de la Química Orgánica es la elucidación estructural. En algunos casos es suficiente con algunos datos mínimos. Utilizando algunas propiedades Fisico-Químicas
INTRODUCCION (1) Una de las labores más difíciles dentro de la Química Orgánica es la elucidación estructural. En algunos casos es suficiente con algunos datos mínimos. Utilizando algunas propiedades Fisico-Químicas
Métodos Espectrofotométricos. Capítulos 24 y 25 de Fundamentos de Química Analítica Skoog-West-Holler-Crouch (octava Ed.)
 Métodos Espectrofotométricos Capítulos 24 y 25 de Fundamentos de Química Analítica Skoog-West-Holler-Crouch (octava Ed.) 1 Radiación electromagnética Longitud de onda : Frecuencia en s -1 Hertz Numero
Métodos Espectrofotométricos Capítulos 24 y 25 de Fundamentos de Química Analítica Skoog-West-Holler-Crouch (octava Ed.) 1 Radiación electromagnética Longitud de onda : Frecuencia en s -1 Hertz Numero
Caracterización Estructural de Minerales por Difracción de Rayos X
 Máster Universitario en Profesor de Enseñanza Secundaria Obligatoria, Bachillerato, Formación Profesional y Enseñanza de Idiomas Caracterización Estructural de Minerales por Difracción de Rayos X J. Medina
Máster Universitario en Profesor de Enseñanza Secundaria Obligatoria, Bachillerato, Formación Profesional y Enseñanza de Idiomas Caracterización Estructural de Minerales por Difracción de Rayos X J. Medina
Agua. Agua. Estructura del agua. Estructura del agua. Estructura del agua. Dra. Edith Ponce A. enlace covalente polar (100 kcal/mol).
 Agua Agua Dra. Edith Ponce A. Es la sustancia más abundante en la biosfera la encontramos en sus tres estados comprende del 65 y el 95% del peso de la mayor parte de las formas vivas Sus propiedades físicas
Agua Agua Dra. Edith Ponce A. Es la sustancia más abundante en la biosfera la encontramos en sus tres estados comprende del 65 y el 95% del peso de la mayor parte de las formas vivas Sus propiedades físicas
Espectroscopía de Fluorescencia. Ana Denicola
 Espectroscopía de Fluorescencia Ana Denicola DIAGRAMA DE JABLONSKI (1898-1980) relajación vibracional S2 conversión interna IC relajación vibracional cruce intersistemas ISC S1 T1 k NR IC hυ A hυ F k NR
Espectroscopía de Fluorescencia Ana Denicola DIAGRAMA DE JABLONSKI (1898-1980) relajación vibracional S2 conversión interna IC relajación vibracional cruce intersistemas ISC S1 T1 k NR IC hυ A hυ F k NR
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Espectrometría de luminiscencia molecular Cap.15
 Espectrometría de luminiscencia molecular Cap.15 Luz cuyo origen no radica exclusivamente en las altas temperaturas Se da en sustancias que pueden absorber energía, excitándose a niveles mayores y emitirla
Espectrometría de luminiscencia molecular Cap.15 Luz cuyo origen no radica exclusivamente en las altas temperaturas Se da en sustancias que pueden absorber energía, excitándose a niveles mayores y emitirla
Interacción materia-radiación
 Interacción materia-radiación 1. Indicar en qué zona del espectro electromagnético aparece cada uno de los tránsitos siguientes: a) 3000 cm -1 ; b) 100 Kcal/mol; c) 3.3 10-1 ergios y d) 6 10 9 sg 1.. ierto
Interacción materia-radiación 1. Indicar en qué zona del espectro electromagnético aparece cada uno de los tránsitos siguientes: a) 3000 cm -1 ; b) 100 Kcal/mol; c) 3.3 10-1 ergios y d) 6 10 9 sg 1.. ierto
Capítulo 24. Emisión y absorción de la luz. Láser
 Capítulo 24 Emisión y absorción de la luz. Láser 1 Absorción y emisión La frecuencia luminosa depende de los niveles atómicos entre los que se produce la transición electrónica a través de: hν = E f E
Capítulo 24 Emisión y absorción de la luz. Láser 1 Absorción y emisión La frecuencia luminosa depende de los niveles atómicos entre los que se produce la transición electrónica a través de: hν = E f E
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica
 Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Curso 2015-2016 Problema 1 La línea principal del espectro
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Curso 2015-2016 Problema 1 La línea principal del espectro
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA.
 CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
EL ESPECTRO ELECTROMAGNÉTICO
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
Desplazamiento Químico. Dr. Jorge A. Palermo
 Desplazamiento Químico δ Dr. Jorge A. Palermo ν 0 = γ B 0 / 2π ECUACIÓN DE LARMOR E aumenta con B 0 Núcleo 1 2.35 Tesla 100 Mz 17.63 Tesla 750 Mz ν 0 aumenta con B 0 2 13 C 31 P 15.35 Mz 25.1 Mz 40.5 Mz
Desplazamiento Químico δ Dr. Jorge A. Palermo ν 0 = γ B 0 / 2π ECUACIÓN DE LARMOR E aumenta con B 0 Núcleo 1 2.35 Tesla 100 Mz 17.63 Tesla 750 Mz ν 0 aumenta con B 0 2 13 C 31 P 15.35 Mz 25.1 Mz 40.5 Mz
Fuerzas de Van der Waals. Fuerzas de dispersión London
 FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
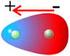 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
TEMA 3 ENLACE QUÍMICO (PARTE 2)
 TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
TEMA 3 ENLACE QUÍMICO (PARTE 2) Teoría de enlace valencia Se basa en la suposición de que los enlaces covalentes se producen por solapamiento (superposición) de los orbitales atómicos de distintos átomos
ANALISIS INSTRUMENTAL II 4. ESPECTROSCOPIA ULTRAVIOLETA 2
 ANALISIS INSTRUMENTAL II 4. ESPECTROSCOPIA ULTRAVIOLETA 2 La región ultravioleta del espectro electromagnético se caracteriza por tener radiaciones con la energía suficiente para afectar la energía electrónica
ANALISIS INSTRUMENTAL II 4. ESPECTROSCOPIA ULTRAVIOLETA 2 La región ultravioleta del espectro electromagnético se caracteriza por tener radiaciones con la energía suficiente para afectar la energía electrónica
Química Orgánica I. Clase 2.
 Química Orgánica I Clase 2. Enlace Quimico. Teoria de Enlace de Valencia F 2 Enlace Covalente Polar: Enlace donde la densidad electronica esta polarizada hacia uno de los dos atomos. Electronegatividad
Química Orgánica I Clase 2. Enlace Quimico. Teoria de Enlace de Valencia F 2 Enlace Covalente Polar: Enlace donde la densidad electronica esta polarizada hacia uno de los dos atomos. Electronegatividad
