Proteínas. Marijose Artolozaga Sustacha, MSc
|
|
|
- Salvador Franco Villanueva
- hace 6 años
- Vistas:
Transcripción
1 Proteínas Marijose Artolozaga Sustacha, MSc
2 Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH
3 Carbono α Extremo amino (N) Extremo carbonilo (C)
4 - Dipéptido: 2 aá unidos por enlace peptídico - Tripéptido: 3 aminoácidos - Oligopéptido: entre 4 y 100 aá - Polipéptido: entre 100 y aá - Proteína > aminoácidos Las cadenas polipeptídicas son flexibles y forman una espiral aleatoria que toma diferentes formas dependiendo de enlaces o fuerzas entre átomos y grupos
5 Fuerzas que estabilizan la estructura de las proteínas: 1. Enlaces covalentes enlace peptídico puente disulfuro (cistina) 2. Fuerzas no covalentes enlaces iónicos (electrostáticos) enlaces o puentes de hidrógeno interacciones hidrofóbicas fuerzas de van der Waals
6 1. Enlaces covalentes Tienen hasta 80 veces más fuerza de enlace que los enlaces no covalentes
7 Puente disulfuro Estabiliza la estructura tridimensional de las proteínas Es un enlace covalente
8 2. Fuerzas no covalentes Interacciones electrostáticas Fuerzas de repulsión cargas del mismo signo atracción cargas opuestas = enlaces iónicos o salinos
9 Los enlaces iónicos Son más fuertes en el interior de las proteínas que entre ellas Los grupos cargados son abundantes en la superficie de las proteínas, donde están estabilizadas por el agua y no interactúan entre sí Asp, Glu, Lis +, Arg +, His +
10 Puentes de Hidrógeno H unido covalentemente a un átomo electronegativo (donador) se comparte con otro átomo electronegativo (aceptor) Entre N-H y O=C de los enlaces peptídicos Entre átomos de grupos laterales Con el agua
11 Interacciones Hidrofóbicas Son las fuerzas no covalentes más importantes que hacen que un polipéptido se pliegue en su estructura funcional Los grupos no polares no se atraen pero, cuando se juntan, el área de superficie en contacto con el agua se reduce, desplazando agua al grueso del disolvente Aumenta la entropía Termodinámicamente favorable
12
13 Fuerzas de van der Waals-London Son las fuerzas no covalentes más débiles Pero muy importantes para la formación de la estructura de las proteínas Depende mucho de la distancia entre los átomos
14 4 niveles de estructura: Estructura primaria: Secuencia de aminoácidos Estructura secundaria: Conformación en láminas o hélices Estructura terciaria: Conformación espacial tridimensional Estructura cuaternaria: Unión de subunidades
15 Estructura primaria, secundaria, terciaria y cuaternaria de la hemoglobina
16
17 Tipos de proteínas según su forma Fibrosas Colágeno Queratina Fibroína - seda E1 - E2 Globulares (=Globulinas) Hemoglobina Mioglobina Inmunoglobulinas Muchas enzimas E1 - E2 - E3 - (E4)
18 Estructura primaria: La secuencia de los aá unidos por enlace peptídico (covalente) Así se sintetizan las proteínas Es lo que se codifica en el ADN Suele incluir los puentes disulfuro Algunas hormonas proteicas sólo tienen Estructura Primaria: Insulina, vasopresina (hormona antidiurética), secretina y otras hormonas digestivas
19 La E1 de una proteína determina Su estructura Su mecanismo de acción Su función Su relación con otras proteínas de función fisiológica similar Ejemplos
20 Ej. E1 de la Insulina La E1 de las insulinas de distintas especies animales es casi idéntica, excepto en 4-5 posiciones de aá: >> La E1 de una prot es esencial para su función
21 Ej. E1 de la Hemoglobina en la Anemia falciforme La E1 de la hemoglobina normal y la de la que produce células falciformes se diferencia sólo en un aá: (<<mutación de una sola base del ADN) Se cambia un Glutamato (polar) por una Valina (apolar) en la molécula de globina β. >> La E1 de una proteína es esencial para su función
22 Estructura secundaria: Es el plegamiento tridimensional local Se debe a los enlaces de H entre los NH y C=O de enlaces peptídicos distantes Las más estables son 2: Hélice α Hoja plegada β Las proteínas fibrosas sólo tienen E1 y E2 (especiales) Generalmente funciones estructurales
23 Hélice α Pte de H entre aá de la misma molécula (cada 3 aá) Ej. Proteínas fibrosas: Miosina, queratina, colágeno
24 Hélice α
25 Ej. Queratina del pelo, uñas, etc
26 ej. Colágeno de tendones y ligamentos Hélice α - tipo cable:
27 ej. Colágeno de tendones y ligamentos Contiene mucha cantidad de: Glicina Prolina o Hidroxiprolina Hidroxilisina Modificaciones: -Hidroxilaciones < vitamina C -Grupos carbonilo perpendiculares crean ptes de H muy fuertes entre cadenas
28
29 Hoja plegada β Ptes de H entre aá de dos cadenas o regiones similares distantes Alineadas en dirección paralela o antiparalela Ej. Proteína fibrosa: Fibroína de la Seda
30
31
32 Ej. Proteína fibrosa: Fibroína de la Seda
33 Estructura terciaria: Describe la posición de cada uno de sus átomos en el espacio, tridimensional Para las proteínas globulares Átomos muy separados entre sí en la estructura primaria aparecen juntos en el espacio Grupos laterales apolares aparecen juntos en el interior de la molécula lejos del agua Grupos ionizados se encuentran en el exterior
34 Las proteínas globulares combinan hélices α, hojas β y giros y bucles para formar su E3
35 Dominios Regiones compactas semiindependientes en que se pliegan frecuentemente las cadenas polipeptídicas largas Entre aá consecutivos Núcleo apolar interno y exterior polar Interconectados por segmentos de cadena sin estructura secundaria regular Pueden tener una tarea o función
36 Dominios Los dominios pueden presentarse globulares y separados por una hendidura Frecuentemente en esta hendidura se encuentra el sitio funcional de la molécula (enzimas) con grupos laterales pertenecientes a varios dominios alejados en la secuencia
37
38 Los dominios pueden moverse unos con respecto a otros Ej. Hexoquinasa cataliza la fosforilación de Glucosa por ATP: Sitio de unión de glucosa: entre dos dominios Cuando se une, los dominios se cierran y la atrapan para su fosforilación
39 Hexoquinasa + Glucosa libre Hexoquinasa con Glucosa unida al centro activo
40
41
42 Cada dominio puede tener diferente tarea dentro de las funciones de la misma proteína Por ejemplo: En las enzimas alostéricas: Los sitios alostéricos y los sitios catalíticos pueden estar en distintos dominios de la misma proteína
43 Estructura cuaternaria: Algunas proteínas poseen subunidades Las subunidades tienen estructura tridimensional (E3) Estas interactúan entre sí formando una estructura funcional cuaternaria (E4) Ej. Interacciones entre las 4 subunidades de la Hemoglobina La hemoglobina transporta el O 2 de los pulmones a las células y el CO 2 de vuelta, con ayuda del grupo Hemo La mioglobina almacena el O 2 en los músculos con ayuda del grupo Hemo; se usa en ejercicio extenuante
44 Mioglobina Sólo E3 Cadena β de la Hemoglobina HbA 1 Parte de su E3 Las estructuras globales son muy parecidas, excepto en los extremos N y C terminales
45
46 Estructura cuaternaria de la Hemoglobina: 4 subunidades: 2 α y 2 β 4 grupos Hemo
47 Interacciones entre subunidades, en proteínas con E4: Ej. Cooperatividad positiva de la Hemoglobina La fijación de un O 2 a la primera subunidad de desoxi-hemoglobina facilita a fijación de O 2 a las otras subunidades Y la disociación de un O 2 de la Hb totalmente oxigenada facilitará la disociación de O 2 de las otras subunidades
48 Interacciones entre subunidades, en proteínas con E4: Ej. Algunas enzimas alostéricas tienen: Subunidades alostéricas Subunidades catalíticas La fijación de un activador alostérico facilita la unión del sustrato en la subunidad catalítica La fijación de un inhibidor alostérico dificulta la unión del sustrato en la subunidad catalítica
49 Conformación nativa Es la conformación tridimensional (secundaria, terciaria y cuaternaria) que adopta espontáneamente cada proteína a partir de su estructura primaria. -en las condiciones de disolución correctas -en presencia de sus grupos prostéticos (*) Las proteínas chaperonas aumentan la velocidad del plegamiento proteico hacia su forma nativa Es la conformación funcional
50 Desnaturalización Pérdida de la E2, E3 y/o E4 nativas No necesariamente se rompe la E1 Implica pérdida de la función de la proteína Causas fisiológicas: cambio de ph cambio de fuerza iónica cambio de temperatura la unión de grupos prostéticos, cofactores y sustratos influye en estabilidad
51 Métodos experimentales de desnaturalización de proteínas: Adición de: Base fuerte Ácido Disolvente orgánico Urea Detergentes Calentamiento (>60ºC) Congelación / descongelación
52 Métodos para el estudio de proteínas Para el estudio de una proteína de interés, primero es importante extraerla y purificarla: ejemplo: Romper las células que la contienen Eliminar otras moléculas: lípidos, ácidos nucleicos Precipitar y eliminar otras proteínas Cromatografías para purificarla Ya pura, se puede a veces cristalizar, para poder ver su estructura tridimensional por difracción de rayos X
53 Métodos para el estudio de proteínas La caracterización de una proteína incluye datos como: Peso Molecular Estructura cuaternaria (subunidades) Estructura tridimensional Secuencia y composición de aá Cofactores que se le unen Función o actividad ph y temperatura óptimos Especificidad de sustrato (enzimas) etc
54 Métodos para el estudio de proteínas Métodos de determinación del Peso Molecular: Ultracentrifugación (Svederg) Centrifugación en gradiente de sacarosa Filtración en gel = cromatografía Microscopio electrónico (las muy grandes) Electroforesis en gel de poliacrilamida, PAGE: Las moléculas cargadas se mueven entre dos electrodos y se separan en un gel con cierta porosidad El gel se tiñe con azul de Commassie o plata Ag + para visualizar las bandas
55 Métodos para el estudio de proteínas Electroforesis en gel de poliacrilamida, PAGE: Las proteínas se desnaturalizan hirviéndolas con SDS y mercaptoetanol: mercaptoetanol se separan las subunidades SDS todas con carga negativa y forma similar Proteínas se separan según su tamaño, no su carga Para determinar el PM de la proteína: Se compara con la separación de proteínas con PM definido
56 etc
57 Ej. Estructura cuaternaria muy compleja Enzima Porfobilinógeno Sintasa de Pseudomonas aeruginosa
58 Ej. Inmunoglobulinas, anticuerpos Son glicoproteínas
59 Ej. Inmunoglobulinas Complejo antígeno-anticuerpo
60 Ej. Caseína Hidrólisis por la renina Aá hidrofóbicos Micelas Fosfato de calcio Hidrolizado más insoluble: precipita o coagula
61 Ej. Ovoalbúmina Estructura terciaria globular Se desnaturaliza por el calor
62 Ej. Gelatina
63 Ej. Lipoproteínas
64 Ej. Actina y miosina
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria.
 Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria. Estructura supersecundaria Motivos Dominios Estructura terciaria Fuerzas que la estabilizan Plegamiento de proteínas
Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria. Estructura supersecundaria Motivos Dominios Estructura terciaria Fuerzas que la estabilizan Plegamiento de proteínas
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares.
 Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
PROTEÍNAS. Las proteínas están constituidas por la unión de numerosas moléculas sencillas (monómeros) denominados aminoácidos.
 PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
Polímero corto Monómero. síntesis. degradación
 Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
Biomoléculas orgánicas: Proteínas y Ácidos nucleicos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
Proteínas fibrosas. α-queratinas
 Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS
 INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS Lic. Claudio Vidos Departamento de investigación de DEMIK Electromedicina Director del INSTITUTO CAV Rehabilitación Departamento de investigación
INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS Lic. Claudio Vidos Departamento de investigación de DEMIK Electromedicina Director del INSTITUTO CAV Rehabilitación Departamento de investigación
Estructura 3D de proteínas
 Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo.
 1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Funciones biológicas de las proteínas. 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica.
 Funciones biológicas de las proteínas 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica. 2.- Proteínas de transporte. Proteínas de transporte en el
Funciones biológicas de las proteínas 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica. 2.- Proteínas de transporte. Proteínas de transporte en el
TEMA 5 PROTEÍNAS. 4. Proteínas Globulares. Mioglobina, Hemoglobina, Inmunoglobulinas
 TEMA 5 PROTEÍNAS 1. Clasificación de las proteínas y niveles estructurales 2. Proteínas Fibrosas. Queratinas 4. Proteínas Globulares. Mioglobina, Hemoglobina, Inmunoglobulinas 1. Clasificación de las proteínas
TEMA 5 PROTEÍNAS 1. Clasificación de las proteínas y niveles estructurales 2. Proteínas Fibrosas. Queratinas 4. Proteínas Globulares. Mioglobina, Hemoglobina, Inmunoglobulinas 1. Clasificación de las proteínas
Tema 1: Los seres vivos: composición y función
 Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
I) Biomoléculas 6) Proteínas I-6 PROTEÍNAS
 I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
H N CH COOH. dipéptido
 CLASE : PROTEINAS Fuerzas que influyen en estructura Proteica Papel de secuencia de aminoácidos en estructura de la proteína Estructura Secundaria de las Proteínas Plegamiento (Folding) de proteínas y
CLASE : PROTEINAS Fuerzas que influyen en estructura Proteica Papel de secuencia de aminoácidos en estructura de la proteína Estructura Secundaria de las Proteínas Plegamiento (Folding) de proteínas y
Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M.
 COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
APRENDIZAJES ESPERADOS:
 APRENDIZAJES ESPERADOS: Identifican la composición y función biológica de los carbohidratos. Identifican la estructura, composición y organización de las proteínas. Comprenden el rol biológico de ciertas
APRENDIZAJES ESPERADOS: Identifican la composición y función biológica de los carbohidratos. Identifican la estructura, composición y organización de las proteínas. Comprenden el rol biológico de ciertas
BIOQUIMICA Y FISIOLOGÍA MICROBIANA. Dra. Yenizey Merit Alvarez Cisneros
 BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
Tema 5: aminoácidos y proteínas
 1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
Proteínas. Tabla 1: Funciones de las proteínas
 Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
Composición química de la materia viva. Componentes orgánicos. Proteínas
 Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
TEORIA CELULAR. En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS
 TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
ESTRUCTURA 4ª. áá ESENCIAL
 PROTEINAS COMPOSICIÓN AMINOÁCIDOS ENLACE PEPTÍDICO ESTRUCTURA CLASIFICACIÓN áá ESENCIAL PROPIEDADES NO POLARES POLARES S/CARGA POLARES C/CARGA OPTICAS ACIDO-BASE (Anfóteras) SOLUBILIDAD PUNTO DE FUSIÓN
PROTEINAS COMPOSICIÓN AMINOÁCIDOS ENLACE PEPTÍDICO ESTRUCTURA CLASIFICACIÓN áá ESENCIAL PROPIEDADES NO POLARES POLARES S/CARGA POLARES C/CARGA OPTICAS ACIDO-BASE (Anfóteras) SOLUBILIDAD PUNTO DE FUSIÓN
QUIMICA BIOLOGICA INTRODUCCION GENERAL
 QUIMICA BIOLOGICA INTRODUCCION GENERAL 1 BIOQUIMICA: La química de los seres vivos. La palabra "Bioquímica" fué utilizada por primera vez por Félix Hoppe-Seyler en 1877, en el prólogo al primer número
QUIMICA BIOLOGICA INTRODUCCION GENERAL 1 BIOQUIMICA: La química de los seres vivos. La palabra "Bioquímica" fué utilizada por primera vez por Félix Hoppe-Seyler en 1877, en el prólogo al primer número
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Figura 1: Esquema de polímero
 Eje temático: Química: Fenómenos nucleares Polímeros Procesos químicos industriales Contenido: Tipos de polímeros y polimerización Nivel: Cuarto medio Polímeros. Polímeros sintéticos y naturales Polímeros
Eje temático: Química: Fenómenos nucleares Polímeros Procesos químicos industriales Contenido: Tipos de polímeros y polimerización Nivel: Cuarto medio Polímeros. Polímeros sintéticos y naturales Polímeros
TEMARIO PARA EL EXAMEN DE BIOQUÍMICA
 TEMARIO PARA EL EXAMEN DE BIOQUÍMICA PARTE I. ESTRUCTURA BIOLÓGICA Y QUÍMICA DE LAS PROTEÍNAS 1. CARACTERÍSTICAS QUÍMICAS DE LA MATERIA VIVA 1. La mayoría de los organismos están compuestos solamente de
TEMARIO PARA EL EXAMEN DE BIOQUÍMICA PARTE I. ESTRUCTURA BIOLÓGICA Y QUÍMICA DE LAS PROTEÍNAS 1. CARACTERÍSTICAS QUÍMICAS DE LA MATERIA VIVA 1. La mayoría de los organismos están compuestos solamente de
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
PROTEÍNAS Y ÁCIDOS NUCLEICOS
 DESAFÍO Nº 10 Profesor Mauricio Hernández Fonseca Biología 1 Medio Nombre del Estudiante : Curso : PROTEÍNAS Y ÁCIDOS NUCLEICOS TIMBRE PROTEÍNAS Las proteínas son macromoléculas de elevada masa molecular.
DESAFÍO Nº 10 Profesor Mauricio Hernández Fonseca Biología 1 Medio Nombre del Estudiante : Curso : PROTEÍNAS Y ÁCIDOS NUCLEICOS TIMBRE PROTEÍNAS Las proteínas son macromoléculas de elevada masa molecular.
La palabra "Bioquímica" fué utilizada por primera vez. número de "Hoppe-Seylers Zeitschrift für Physiologische Chemie" (la primera revista de
 BIOQUIMICA: La química de los seres vivos. La palabra "Bioquímica" fué utilizada por primera vez por Félix Hoppe-Seyler en 1877, en el prólogo al primer número de "Hoppe-Seylers Zeitschrift für Physiologische
BIOQUIMICA: La química de los seres vivos. La palabra "Bioquímica" fué utilizada por primera vez por Félix Hoppe-Seyler en 1877, en el prólogo al primer número de "Hoppe-Seylers Zeitschrift für Physiologische
FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
 BIOMOLÉCULAS. PROTEÍNAS BIOMOLÉCULAS Los bioelementos se unen para formar biomoléculas, también denominadas principios inmediatos. En los seres vivos las moléculas se caracterizan por presentar una gran
BIOMOLÉCULAS. PROTEÍNAS BIOMOLÉCULAS Los bioelementos se unen para formar biomoléculas, también denominadas principios inmediatos. En los seres vivos las moléculas se caracterizan por presentar una gran
Biología General y Metodología de las Ciencias 2016 BIOMOLÉCULAS
 BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
UD 5: LOS ÁCIDOS NUCLEICOS
 UD 5: LOS ÁCIDOS NUCLEICOS ÍNDICE: 1. COMPOSICIÓN QUÍMICA Y CLASIFICACIÓN 2. NUCLEÓTIDOS 3. ADN. COMPOSICIÓN QUÍMICA Y ESTRUCTURA Y PROPIEDADES. 4. ARN 1. ARN MENSAJERO 2. ARN TRANSFERENTE 3. OTROS ARNs
UD 5: LOS ÁCIDOS NUCLEICOS ÍNDICE: 1. COMPOSICIÓN QUÍMICA Y CLASIFICACIÓN 2. NUCLEÓTIDOS 3. ADN. COMPOSICIÓN QUÍMICA Y ESTRUCTURA Y PROPIEDADES. 4. ARN 1. ARN MENSAJERO 2. ARN TRANSFERENTE 3. OTROS ARNs
ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEINAS
 . Estructura secundaria, terciaria y cuaternaria de las proteínas. Fuerzas débiles que estabilizan la estructura tridimensional. Geometría del enlace peptídico. Estructura secundaria: hélices alfa, hojas
. Estructura secundaria, terciaria y cuaternaria de las proteínas. Fuerzas débiles que estabilizan la estructura tridimensional. Geometría del enlace peptídico. Estructura secundaria: hélices alfa, hojas
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
Biomoléculas Orgánicas II
 Biomoléculas Orgánicas II INTRODUCCIÓN Tal como se vio en la clase anterior, los elementos químicos se organizan de tal forma que aumentan su complejidad y desarrollan funciones que son específicas. En
Biomoléculas Orgánicas II INTRODUCCIÓN Tal como se vio en la clase anterior, los elementos químicos se organizan de tal forma que aumentan su complejidad y desarrollan funciones que son específicas. En
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Textos de refuerzo. 2. Formación de ADN y ARN. 1. Principios de bioquímica. Proteínas. 1 Unidad 3
 1. Principios de bioquímica 2. Formación de ADN y ARN 1. Principios de bioquímica La bioquímica estudia los componentes químicos de los seres vivos: proteínas, carbohidratos, lípidos y ácidos nucleicos.
1. Principios de bioquímica 2. Formación de ADN y ARN 1. Principios de bioquímica La bioquímica estudia los componentes químicos de los seres vivos: proteínas, carbohidratos, lípidos y ácidos nucleicos.
Niveles de organización biológica. La composición de los seres vivos
 Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Ambientación Universitaria BIOLOGÍA. Guía de Actividades 2014
 1 Ambientación Universitaria BIOLOGÍA Guía de Actividades 2014 2 I.- INTRODUCCIÓN- CONCEPTO DE CIENCIA Y VIDA 1) Lea el siguiente texto. Mencione ejemplos de lo que considere investigación en ciencias
1 Ambientación Universitaria BIOLOGÍA Guía de Actividades 2014 2 I.- INTRODUCCIÓN- CONCEPTO DE CIENCIA Y VIDA 1) Lea el siguiente texto. Mencione ejemplos de lo que considere investigación en ciencias
AMINOÁCIDOS SE PUEDEN UNIR POR ENLACES PEPTÍDICOS
 Tema 4. Proteínas: funciones biológicas y estructura primaria. Enlace peptídico. Péptidos y proteínas. Diversidad de funciones biológicas. Niveles de organización estructural de las proteínas. Separación
Tema 4. Proteínas: funciones biológicas y estructura primaria. Enlace peptídico. Péptidos y proteínas. Diversidad de funciones biológicas. Niveles de organización estructural de las proteínas. Separación
TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS
 1 TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS I) Péptidos Los aminoácidos pueden condesarse entre sí, uniéndose a través del grupo carboxilo de un aminoácido al grupo amino de otro
1 TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS I) Péptidos Los aminoácidos pueden condesarse entre sí, uniéndose a través del grupo carboxilo de un aminoácido al grupo amino de otro
SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura primaria. Estructura secundaria o modelo de Watson y Crick
 COFERENCIA 5 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. ÁCIDOS NUCLEICOS Autor: Dr. Daniel Sánchez Serrano SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura
COFERENCIA 5 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. ÁCIDOS NUCLEICOS Autor: Dr. Daniel Sánchez Serrano SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura
SESIÓN 3 LA QUÍMICA DE LA VIDA
 Biología SESIÓN 3 LA QUÍMICA DE LA VIDA 1. Las Bases Químicas De La Vida Los organismos vivos y el mundo en el que viven están sometidos a las leyes de la física y de la química. En los organismos vivos
Biología SESIÓN 3 LA QUÍMICA DE LA VIDA 1. Las Bases Químicas De La Vida Los organismos vivos y el mundo en el que viven están sometidos a las leyes de la física y de la química. En los organismos vivos
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas
 Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
Los elementos químicos más abundantes en los seres vivos son: Agua y proteínas. Carbono, oxígeno, hidrógeno, nitrógeno, fósforo y azufre.
 Los elementos químicos más abundantes en los seres vivos son: Agua y proteínas. Carbono, oxígeno, hidrógeno, nitrógeno, fósforo y azufre. Glúcidos, lípidos, proteínas, ácidos nucleicos. Oxígeno, calcio,
Los elementos químicos más abundantes en los seres vivos son: Agua y proteínas. Carbono, oxígeno, hidrógeno, nitrógeno, fósforo y azufre. Glúcidos, lípidos, proteínas, ácidos nucleicos. Oxígeno, calcio,
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo
 Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
4. El esquema adjunto representa la estructura de una molécula denominada lisozima.
 BLOQUE I : La base físico-química de la materia 1. a. Nombre y formule un monosacárido que contenga seis átomos de carbono. b. Indica esquemáticamente una diferencia estructural existente entre el almidón
BLOQUE I : La base físico-química de la materia 1. a. Nombre y formule un monosacárido que contenga seis átomos de carbono. b. Indica esquemáticamente una diferencia estructural existente entre el almidón
Actividades de los lípidos Tema 1
 Actividades de los lípidos Tema 1 parte 3 BLOQUE 1: TEST 1. Qué tipo de lípidos son los más abundantes en la membrana plasmática de la mayoría de las células? a) Fosfolípidos b) Acidos grasos esenciales
Actividades de los lípidos Tema 1 parte 3 BLOQUE 1: TEST 1. Qué tipo de lípidos son los más abundantes en la membrana plasmática de la mayoría de las células? a) Fosfolípidos b) Acidos grasos esenciales
Iniciativa de Ciencia Progresiva
 Slide 1 / 42 New Jersey enter for Teaching and Learning Iniciativa de iencia Progresiva Este material está disponible gratuitamente en www.njctl.org y está pensado para el uso no comercial de estudiantes
Slide 1 / 42 New Jersey enter for Teaching and Learning Iniciativa de iencia Progresiva Este material está disponible gratuitamente en www.njctl.org y está pensado para el uso no comercial de estudiantes
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Proteínas: Métodos para su Estudio
 Proteínas: Métodos para su Estudio Propiedades Espectroscópicas Todos los aminoácidos absorben luz en la región infraroja Sólo Phe, Tyr, & Trp absorben UV Absorbancia a 280 nm es un buen diagnóstico para
Proteínas: Métodos para su Estudio Propiedades Espectroscópicas Todos los aminoácidos absorben luz en la región infraroja Sólo Phe, Tyr, & Trp absorben UV Absorbancia a 280 nm es un buen diagnóstico para
Agua. Agua. Estructura del agua. Estructura del agua. Estructura del agua. Dra. Edith Ponce A. enlace covalente polar (100 kcal/mol).
 Agua Agua Dra. Edith Ponce A. Es la sustancia más abundante en la biosfera la encontramos en sus tres estados comprende del 65 y el 95% del peso de la mayor parte de las formas vivas Sus propiedades físicas
Agua Agua Dra. Edith Ponce A. Es la sustancia más abundante en la biosfera la encontramos en sus tres estados comprende del 65 y el 95% del peso de la mayor parte de las formas vivas Sus propiedades físicas
REPASANDO CONCEPTOS : LAS PROTEÍNAS
 REPASANDO CONCEPTOS : LAS PROTEÍNAS Drqf. Manuel Fontboté A. Consultor en Ciencias Cosméticas CHILE El uso de materias activas de naturaleza proteica en los cosméticos no es un hecho reciente, antes bien,
REPASANDO CONCEPTOS : LAS PROTEÍNAS Drqf. Manuel Fontboté A. Consultor en Ciencias Cosméticas CHILE El uso de materias activas de naturaleza proteica en los cosméticos no es un hecho reciente, antes bien,
Cadena ramificada O CH3 CH2
 UIDAD Libro guía páginas 41 49 1LEIÓ 5 : De qué está hecha la célula? Biomoléculas orgánicas oncepto clave: Las moléculas a base de carbono son fundamentales para la vida. Los átomos de carbono tienen
UIDAD Libro guía páginas 41 49 1LEIÓ 5 : De qué está hecha la célula? Biomoléculas orgánicas oncepto clave: Las moléculas a base de carbono son fundamentales para la vida. Los átomos de carbono tienen
MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN
 MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN Propiedades de una proteína que son útiles para su purificación por cromatografía Peso molecular Carga iónica Hidrofobicidad
MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN Propiedades de una proteína que son útiles para su purificación por cromatografía Peso molecular Carga iónica Hidrofobicidad
Proteínas y enzimas. Biología. Niveles de organización I. Nivel molecular: Composición química de los seres vivos (II) Proteínas y Enzimas.
 Proteínas y enzimas Biología Niveles de organización I. Nivel molecular: Composición química de los seres vivos (II) Proteínas y Enzimas. 1. Proteínas: concepto e importancia biológica Importante Las proteínas
Proteínas y enzimas Biología Niveles de organización I. Nivel molecular: Composición química de los seres vivos (II) Proteínas y Enzimas. 1. Proteínas: concepto e importancia biológica Importante Las proteínas
TEMA 5: LOS ÁCIDOS NUCLEICOS
 TEMA 5: LOS ÁCIDOS NUCLEICOS 1. LOS NUCLEÓTIDOS Los ácidos nucleicos son biomoléculas orgánicas formadas por C, H, O, N y P. Nunca llevan S. Se forman por la polimerización de nucleótidos, que se unen
TEMA 5: LOS ÁCIDOS NUCLEICOS 1. LOS NUCLEÓTIDOS Los ácidos nucleicos son biomoléculas orgánicas formadas por C, H, O, N y P. Nunca llevan S. Se forman por la polimerización de nucleótidos, que se unen
Bioquímica Estructural y Metabólica. Tema 3. Proteínas: composición y estructura
 TEMA 3. Proteínas: composición y estructura. Enlace pep)dico. Pép0dos. Niveles de organización estructural de las proteínas. Estructura primaria. Proteínas homólogas. Estructura secundaria, terciaria y
TEMA 3. Proteínas: composición y estructura. Enlace pep)dico. Pép0dos. Niveles de organización estructural de las proteínas. Estructura primaria. Proteínas homólogas. Estructura secundaria, terciaria y
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
- Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales.
 TEMA 6. PROTEÍNAS - Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales. - Los aa son los elementos estructurales de las proteínas. Las proteínas de plantas y animales
TEMA 6. PROTEÍNAS - Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales. - Los aa son los elementos estructurales de las proteínas. Las proteínas de plantas y animales
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Bioquímica Estructural y Metabólica. TEMA 4. Proteínas estructurales y globulares
 TEMA 4. Proteínas: estructurales y globulares. Clasificación de las proteínas según su estructura. El colágeno como paradigma de las proteínas estructurales. Enfermedades del colágeno. Dos proteínas globulares:
TEMA 4. Proteínas: estructurales y globulares. Clasificación de las proteínas según su estructura. El colágeno como paradigma de las proteínas estructurales. Enfermedades del colágeno. Dos proteínas globulares:
Proteínas. José Seijo Ramil
 P.1. Aminoácidos: P.1.1. Concepto y fórmula general. P.1.2. Estereoisomería y actividad óptica P.1.3. Propiedades de los aminoácidos: Comportamiento anfótero. Punto isoeléctrico P.1.4 Clasificación P.2.
P.1. Aminoácidos: P.1.1. Concepto y fórmula general. P.1.2. Estereoisomería y actividad óptica P.1.3. Propiedades de los aminoácidos: Comportamiento anfótero. Punto isoeléctrico P.1.4 Clasificación P.2.
GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas
 GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas I.- Conceptos básicos: Aminoácidos: Estructura y propiedades ácido base de los aminoácidos. Clasificación según su polaridad. Capacidad buffer. El
GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas I.- Conceptos básicos: Aminoácidos: Estructura y propiedades ácido base de los aminoácidos. Clasificación según su polaridad. Capacidad buffer. El
Pagina casos de estudios:
 Libros para consulta de alumnos en el Área de Biología La Célula. De Coopers Biología Celular y Molecular G. Karp Becker.El mundo de la Célula 6Ed. Editorial Pearson Education. Alberts/Bray/Hopkin/Johnson/Lewis/Raff/Roberts/Walter.
Libros para consulta de alumnos en el Área de Biología La Célula. De Coopers Biología Celular y Molecular G. Karp Becker.El mundo de la Célula 6Ed. Editorial Pearson Education. Alberts/Bray/Hopkin/Johnson/Lewis/Raff/Roberts/Walter.
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Proteínas fibrosas. Alfa Queratinas Beta-Queratinas Fibroína Colágeno Elastina
 Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Electroforesis de proteínas en geles de poliacrilamida
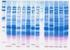 Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
ADN. Estructura primaria del ADN. Cadena lineal de nucleótidos que se unen por enlace fosfodiéster en sentido carbono 5 3 Nucleótidos
 GENÉTICA MOLECULAR ADN ESTRUCTURA ADN Estructura primaria del ADN Cadena lineal de nucleótidos que se unen por enlace fosfodiéster en sentido carbono 5 3 Nucleótidos Azúcar; desoxirribosa Bases nitrogenadas;
GENÉTICA MOLECULAR ADN ESTRUCTURA ADN Estructura primaria del ADN Cadena lineal de nucleótidos que se unen por enlace fosfodiéster en sentido carbono 5 3 Nucleótidos Azúcar; desoxirribosa Bases nitrogenadas;
ANDALUCIA / SEPTIEMBRE 00. LOGSE / BIOLOGIA / OPCION A / EXAMEN COMPLETO
 OPCION A 1. Retículo endoplásmico (3 puntos). a) Describa la estructura y funciones del retículo endoplásmico rugoso. b) En algunas células esta muy desarrollado el retículo endoplásmico liso. Qué consecuencias
OPCION A 1. Retículo endoplásmico (3 puntos). a) Describa la estructura y funciones del retículo endoplásmico rugoso. b) En algunas células esta muy desarrollado el retículo endoplásmico liso. Qué consecuencias
PROGRAMA DE ESTUDIO. 2. CICLO O AREA: División de Ciencias e Ingeniería/Ingeniería Ambiental.
 PROGRAMA DE ESTUDIO 1. NOMBRE DE LA ASIGNATURA: BIOQUÍMICA. 2. CICLO O AREA: División de Ciencias e Ingeniería/Ingeniería Ambiental. 3. CLAVE: 4. SERIACION: Química Orgánica. 5. H.T.S. H.P.S. T.H.S. C.
PROGRAMA DE ESTUDIO 1. NOMBRE DE LA ASIGNATURA: BIOQUÍMICA. 2. CICLO O AREA: División de Ciencias e Ingeniería/Ingeniería Ambiental. 3. CLAVE: 4. SERIACION: Química Orgánica. 5. H.T.S. H.P.S. T.H.S. C.
Clave Genética y Síntesis de Proteínas
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Clave Genética y Síntesis de Proteínas Dr. Mynor A. Leiva Enríquez
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Clave Genética y Síntesis de Proteínas Dr. Mynor A. Leiva Enríquez
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS
 PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Digestión y absorción de PROTEÍNAS. Marijose Artolozaga Sustacha, MSc
 Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
AMINOÁCIDOS, PÉPTIDOS Y PROTEINAS. M.Sc. GABY MÓNICA FELIPE BRAVO
 AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
01. INTRODUCCION. Conceptos previos. Verónica González Núñez Universidad de Salamanca
 01. INTRODUCCION. Conceptos previos Verónica González Núñez Universidad de Salamanca ESQUEMA. Introducción. Conceptos previos I. Principales grupos funcionales en Bioquímica II. Formación de compuestos
01. INTRODUCCION. Conceptos previos Verónica González Núñez Universidad de Salamanca ESQUEMA. Introducción. Conceptos previos I. Principales grupos funcionales en Bioquímica II. Formación de compuestos
Tema 7 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD
 Tema 7 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD 1 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD 1. Concepto y naturaleza química de la biofase 2. Lípidos: acciones inespecíficas 3. Proteínas: enzimas
Tema 7 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD 1 LA BIOFASE: NATURALEZA QUIMICA Y REACTIVIDAD 1. Concepto y naturaleza química de la biofase 2. Lípidos: acciones inespecíficas 3. Proteínas: enzimas
Digestión y absorción de PROTEÍNAS. Marijose Artolozaga Sustacha, MSc
 Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
