ESTRUCTURA DE LA MATERIA
|
|
|
- María Concepción Miranda Domínguez
- hace 6 años
- Vistas:
Transcripción
1 ESTRUCTURA DE LA MATERIA Química 2º Bachillerato 1
2 John Dalton Para él tenía que cumplirse, ante todo, que los átomos de un mismo elemento debían tener la misma masa. Con esta idea, Dalton publicó en 1808 su Teoría Atómica que podemos resumir: La materia está formada por partículas muy pequeñas, llamadas átomos, que son indivisibles e indestructibles. Todos los átomos de un mismo elemento tienen la misma masa atómica. Los átomos se combinan entre si en relaciones sencillas para formar compuestos. Los cuerpos compuestos están formados por átomos diferentes. Las propiedades del compuesto dependen del número y de la clase de átomos que tenga. 2
3 Joseph John Thomson ( ) 1940) Físico Británico estudió las propiedades eléctricas de la materia, especialmente la de los gases. Descubrió que los rayos catódicos estaban formados por partículas cargadas negativamente (hoy en día llamadas electrones), de las que determinó la relación entre su carga y masa. En 1906 le fue concedido el premio Nóbel por sus trabajos. Millikan calculó experimentalmente el valor de la carga eléctrica negativa de un electrón mediante su experimento con gotas de aceite entre placas de un condensador. Dió como valor de dicha carga e = 1,6 * culombios. La medida directa del cociente carga-masa, e/m, de los electrones por J.J.Thomson en 1897 puede considerarse justamente como el principio para la compresión actual de la estructura atómica. 3
4 Thomson define así su modelo de átomo : Considera el átomo como una gran esfera con carga eléctrica positiva, en la cual se distribuyen los electrones como pequeños granitos (de forma similar a las semillas en una sandía) Modelo atómico de Thomson Concebía el átomo como una esfera de carga positiva uniforme en la cual están incrustados los electrones es. 4
5 Ernest Rutherford,,, (1871 (1871,,( ) 1937) 1937) Físico Físico Inglés, Inglés, nació nació en en Nueva Nueva Zelanda, Zelanda, profesor profesor en en Manchester y director director del del laboratorio Cavendish de de la la universidad de de Cambridge.. Premio Premio Nobel Nobel de de Química mica en en Sus Sus brillantes brillantes investigaciones sobre sobre la la estructura atómica mica y sobre sobre la la radioactividad iniciaron iniciaron el el camino camino a los los descubrimientos más más notables notables del del siglo. siglo. Estudió experimentalmente la la naturaleza de de las las radiaciones emitidas emitidas por por los los elementos radiactivos. Tras las investigaciones de Geiger y Mardsen sobre la dispersión de partículas alfa al incidir sobre láminas l metálicas, se hizo necesario la revisión del modelo atómico de Thomson, que realizó Rutherford entre Puesto que las partículas alfa y beta atraviesan el átomo, un estudio riguroso de la naturaleza de la desviación debe proporcionar cierta luz sobre la constitución de átomo, capaz de producir los efectos observados. Las investigaciones se produjeron tras el descubrimiento de la radioactividad r y la identificación n de las partículas emitidas en un proceso radiactivo. 5
6 Experimento para determinar la la constitución n del del átomo Algunos rayos se desviaban, porque pasan muy cerca de centros con carga eléctrica del mismo tipo que los rayos alfa (CARGA POSITIVA). La mayoría a de los rayos alfa atravesaba la lámina l sin desviarse, porque la mayor parte del espacio de un átomo es espacio vacío. Muy pocos rebotan, porque chocan frontalmente contra esos centros de carga positiva. 6
7 El El Modelo Atómico de de Rutherford quedó así: - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones, donde se concentra toda la masa atómica mica. - Existiendo un gran espacio vacío entre el núcleo y la corteza donde se mueven los electrones. NÚMERO ATÓMICO= número n mero de de protones del del núcleo n cleo que que coincide con con el el número n mero de de electrones si si el el átomo tomo es es neutro. 7
8 En 1932 el inglés Chadwik al bombardear átomos con partículas observó que se emitía una nueva partícula sin carga y de masa similar al protón, acababa de descubrir el NEUTRÓN En el núcleo se encuentran los neutrones y los protones. - Puesto que la materia es neutra el núcleo deberá tener un número de cargas positivas protones ( número atómico=z ) igual al de electrones corticales. En el núcleo es donde están también los neutrones - Los electrones giran a grandes distancias del núcleo de modo que su fuerza centrífuga es igual a la atracción electrostática, tica, pero de sentido contrario. Al compensar con la fuerza electrostática tica la atracción del núcleo evita caer contra él l y se mantiene girando alrededor. 8
9 PARTÍCULAS FUNDAMENTALES Partícula Carga Masa PROTÓN p+ NEUTRON n +1 unidad electrostática de carga = 1, C 0 no tiene carga eléctrica, es neutro 1 unidad atómica de masa (u.m.a.) =1, kg 1 unidad atómica de masa (u.m.a.) =1, kg 1 1 p 1 0n NÚCLEO = Zona Zona central central del del átomo átomo donde donde se se encuentran protones y neutrones CORTEZA =Zona =Zona que que envuelve al al núcleo núcleo donde donde se se encuentran moviéndose los los electrones ELECTRÓN e- -1 unidad electrostática de carga =-1, C Muy pequeña y por tanto despreciable comparada con la de p+ y n 1/1840 umas 0 1e Los Los protones y neutrones determinan la la masa de de los los átomos y los los electrones son son los los responsables de de las las propiedades químicas. NÚMERO ATÓMICO (Z) (Z) al al número de de protones que que tiene tiene un un átomo. átomo. Coincide con con el el número número de de electrones si si el el átomo átomo está estáneutro. Todos Todos los los átomos átomos de de un un mismo mismo elemento tienen tienen el el mismo mismo número número de de protones, por por lo lo tanto, tanto, tienen tienen el el mismo mismo número número atómico. 9
10 NÚMERO MÁSICO (A) (A) a la la suma suma de de los los protones y los los neutrones que que tiene tiene un un átomo. átomo. Es Es el el número entero entero más más próximo a la la masa masa del del átomo átomo medida medida en en unidades de de masa masa atómica (la (la masa masa de de la la Tabla Tabla periódica redondeada). ISÓTOPOS a átomos átomos de de un un mismo mismo elemento que que se se diferencian en en el el número número de de neutrones. Tienen Tienen por por tanto tanto el el mismo mismo número atómico(z) pero pero diferente número másico(a). Por ejemplo: Un átomo se representa por: Cl 17Cl Su símbolo = una letra mayúscula o dos letras, la primera mayúscula que derivan de su nombre. Ca, H, Li, S, He... Su número atómico (Z) que se escribe abajo a la izquierda. Su número másico (A) que se escribe arriba a la izquierda. Cuando un elemento está formado por varios isótopos, su masa atómica se establece como una media ponderada de las masas de sus isótopos A Z E IONES IONES a átomos átomos o grupos grupos de de átomos átomos que que poseen poseen carga carga eléctrica porque porque han han ganado ganado o perdido perdido electrones. Pueden Pueden ser: ser: CATIONES si si poseen poseen carga carga positiva positiva y, y, por por tanto, tanto, se se han han perdido perdido electrones. ANIONES si si poseen poseen carga carga negativa y,, por por tanto, tanto, se se han han ganado ganado electrones. 10
11 Crítica del del modelo de de Rutherford: Fue fundamental la demostración de la discontinuidad de la materia y de los grandes vacíos del átomo. Por lo demás, presenta deficiencias y puntos poco claros: - Según la ya probada teoría electromagnética de Maxwell, al ser el electrón una partícula cargada en movimiento debe emitir radiación constante ya que crea un campo magnético y por tanto, perder energía. Esto debe hacer que disminuya el radio de su órbita y el electrón terminaría por caer en el núcleo; el átomo sería inestable. Por lo tanto, no se puede simplificar el problema planteando, para un electrón, que la fuerza electrostática es igual a la centrífuga debe haber algo más. -Era conocida en el momento de diseñar su teoría la hipótesis de Planck que no era tuvo en cuenta. -Tampoco es coherente con los resultados de los espectros atómicos. Los experimentos de Rutherford eran definitivos, pero el planteamiento era incompleto y lógicamente, l también los cálculos. 11
12 LA RADIACIÓN ELECTROMAGNÉTICA. Una onda electromagnética consiste en la oscilación de un campo eléctrico y otro magnético en direcciones perpendiculares, entre sí, y a su vez, perpendiculares ambos a la dirección de propagación. Viene determinada por su frecuencia (ν ) y por su longitud de onda (λ ) relacionadas entre sí por: λ =LONGITUD DE DE ONDA: ONDA: distancia distancia entre entre dos dos puntos puntos consecutivos de de la la onda onda con con igual igual estado estado de de vibración = c ν λ C= C= velocidad velocidad de de propagación de de la la luz luz =3.10 = m/s m/s ν = FRECUENCIA: número n mero de de oscilaciones por por unidad unidad de de tiempo tiempo λ Propagación ondulatoria 12
13 ν λ Espectro continuo de la luz es la descomposición de la luz en todas su longitudes de onda mediante un prisma óptico. ESPECTRO ELECTROMAGNÉTICO:Es el conjunto de todas las radiaciones electro-magnéticas desde muy bajas longitudes de ondas (rayos γ m) hasta kilómetros (ondas de radio) 13
14 Espectro atómico de de absorción Espectro de absorción: se obtiene cuando un haz de luz blanca atraviesa una muestra de un elemento y, posteriormente, la luz emergente se hace pasar por un prisma (que separa la luz en las distintas frecuencias que la componen) Cuando la radiación atraviesa un gas, este absorbe una parte, el resultado es el espectro continuo pero con rayas negras donde falta la radiación absorbida. Espectro de absorción 14
15 ESPECTRO DE EMISIÓN Espectro de emisión: se obtiene cuando una muestra gaseosa de un elemento se calienta hasta altas temperaturas y se hace pasar la luz emitida a través de un prisma Cuando a los elementos en estado gaseoso se les suministra energía (descarga eléctrica, calentamiento...) éstos emiten radiaciones de determinadas longitudes de onda. Espectro de emisión Estas radiaciones dispersadas en un prisma de un espectroscopio se ven como una serie de rayas, y el conjunto de las mismas es lo que se conoce como espectro de emisión. 15
16 El espectro de emisión de un elemento es el negativo del espectro de absorción: a la frecuencia a la que en el espectro de absorción hay una línea negra, en el de emisión hay una línea emitida,de un color, y viceversa Cada Cada elemento tiene tiene un un espectro característico; por por tanto, un un modelo atómico mico debería a ser ser capaz de de justificar el el espectro de de cada cada elemento. 16
17 17
18 TEORÍA A CUÁNTICA DE PLANCK La teoría cuántica se refiere a la energía: Cuando una sustancia absorbe o emite energía, no puede absorberse o emitirse cualquier cantidad de energía, sino que definimos una unidad mínima de energía, llamada cuanto (que será el equivalente en energía a lo que es el átomo para la materia). O sea cualquier cantidad de energía que se emita o se absorba deberá ser un número entero de cuantos. Cuando la energía está en forma de radiación electromagnética (es decir, de una radiación similar a la luz), se denomina energía radiante y su unidad mínima recibe el nombre de fotón. La energía de un fotón viene dada por la ecuación de Planck: E = h ν h: constante de Planck = Joule segundo ν : frecuencia de la radiación La materia y la energía son discontínuas nuas 18
19 Cátodo Ánodo Electrones EL EFECTO FOTOELÉCTRICO Consiste en la emisión de electrones por la superficie de un metal cuando sobre él incide luz de frecuencia suficientemente elevada La luz incide sobre el cátodo (metálico) produciendo la emisión de e que llegan al ánodo y establecen una corriente que es detectada por el amperímetro La física clásica no explica que la energía cinética máxima de los e emitidos dependa de la frecuencia de la radiación incidente, y que por debajo de una frecuencia llamada frecuencia umbral, no exista emisión electrónica Einstein interpretó el fenómeno aplicando el principio de conservación de la energía y la teoría de Planck: h ν = h ν 0 + Ec h ν es la energía luminosa que llega al metal, Ec es la energía cinética máxima del electrón emitido y h ν 0 es la energía mínima, energía umbral (trabajo de extracción) para desalojar al electrón de la superficie metálica 19
20 MODELO ATÓMICO DE BÖHR. B (En qué se se basó) El modelo atómico de Rutherford llevaba a unas conclusiones que se contradecían claramente con los datos experimentales. La teoría de Maxwell echaba por tierra el sencillo planteamiento matemático del modelo de Rutherford. El estudio de las rayas de los espectros atómicos permitió relacionar la emisión de radiaciones de determinada λ (longitud de onda) con cambios energéticos asociados a saltos entre niveles electrónicos. La teoría de Planck le hizo ver que la energía no era algo continuo sino que estaba cuantizada en cantidades hν. 20
21 MODELO ATÓMICO DE BÖHR B Primer postulado: El electrón gira alrededor del núcleo en órbitas circulares sin emitir energía radiante llamadas ÓRBITAS ESTACIONARIAS. Cuando el átomo se encuentra en ésta situación se dice que está en ESTADO ESTACIONARIO y si ocupa el nivel de energía más bajo se dice que está en ESTADO FUNDAMENTAL. Así, el primer postulado nos indica que el electrón no puede estar a cualquier distancia del núcleo, sino que sólo hay unas pocas órbitas posibles, las cuales vienen definidas por los valores permitidos para un parámetro que se denomina número cuántico principal n. Segundo postulado: Sólo son posibles aquellas órbitas en las que el electrón tiene un momento angular que es múltiplo entero de h /(2 π) Momento angular: L= r.m.v r=radio de la órbita, m=masa del electrón y v= velocidad que lleva el electrón 21
22 rmv = n h 2π 2 mv F c = r F e = kq r mv = r kq r 2 2 r n = n h 2πmv n = número cuántico principal r = radio de la órbita h = cte de Planck=6, J.s k = Cte de Coulomb m = masa del e- q = carga del e- V=velocidad del electrón en la órbita En las órbitas ESTACIONARIAS los electrones se mueven sin perder energía Los radios de las órbitas están cuantizados ( su valor depende de n) 22
23 E = R n H 2 R h = cte Rydberg = 2, J n = número cuántico principal,número entero (1,2,3...) Tercer Postulado La energía liberada al caer el electrón desde una órbita a otra de menor energía se emite en forma de fotón, cuya frecuencia viene dada por la ecuación de Planck: E a - a -E = h b b ν Un electrón podrá saltar de una órbita a otra absorbiendo o emitiendo la energía necesaria, que corresponde a la diferencia energética de las órbitas. Así, cuando el átomo absorbe (o emite) una radiación, el electrón pasa a una órbita de mayor (o menor) energía, y la diferencia entre ambas órbitas se corresponderá con una línea del espectro atómico de absorción (o de emisión). 23
24 Niveles permitidos según el el modelo de de Bohr (calculados para parael el átomo átomo de de hidrógeno) n = E = 0 J n = 5 E = 0, J n = 4 E = 1, J Energía n = 3 E = 2, J n = 2 E = 5, J n = 1 E = 21, J 24
25 Si un electrón asciende desde una órbita n i a otra de mayor energía n j debe absorber una cantidad de energía igual a: E = E(n j ) E(n i ) Si un electrón desciende desde una órbita n j a otra de menor energía n i, la diferencia de energía E = E(n j ) E(n i ) se emite en el salto La energía intercambiada por un electrón en un salto puede adoptar la forma de radiación electromagnética, que puede considerarse una onda o un chorro de partículas llamadas fotones cuya energía es proporcional a la frecuencia de radiación (ν): E = hν = h c λ Según el valor de su longitud de onda, las radiaciones electromagnéticas se dividen en: rayos gamma, rayos X, ultravioleta, visible, infrarrojo, microondas, ondas de radio 25
26 Si un electrón asciende desde una órbita n i a otra de mayor energía n j debe absorber una cantidad de energía igual a: E = E(n j ) E(n i ) Si un electrón desciende desde una órbita n j a otra de menor energía n i, la diferencia de energía E = E(n j ) E(n i ) se emite en el salto La energía intercambiada por un electrón en un salto puede adoptar la forma de radiación electromagnética, que puede considerarse una onda o un chorro de partículas llamadas fotones cuya energía es proporcional a la frecuencia de radiación (ν): Los espectros de absorción se originan cuando los electrones absorben la energía de los fotones y ascienden desde un nivel (n i ) hasta otro de mayor energía (n j ) E = hν = h c λ El modelo atómico de Bohr explica satisfactoriamente el espectro del átomo de hidrógeno 26
27 Los espectros de emisión se deben a las radiaciones emitidas cuando un electrón excitado en un nivel alto (n j ) desciende a otro nivel de energía inferior (n i ) La conservación de la energía exige que la energía del fotón absorbido o emitido sea igual a la diferencia de energía de las órbitas entre las que se produce el salto del electrón E = En ( ) En ( ) = hν j Sólo se emiten fotones cuya energía coincide con la diferencia de energía entre dos niveles permitidos: por ello, el espectro consta solo de determinadas frecuencias,ν, que verifican: E( nj ) En ( i) ν = 27 h i
28 De acuerdo con el modelo de Bohr, la energía de las diferentes órbitas viene dada por: R E = n ( n) 2 Por tanto, las frecuencias de las líneas del espectro satisfacen la ecuación: H ν R H 1 1 = 2 h n 2 i nj Que coincide con la fórmula f obtenida experimentalmente por los espectroscopistas para el espectro del hidrógeno Los espectroscopistas habían calculado y estudiado a fondo las rayas del espectro atómico más sencillo, el del átomo de hidrógeno. Cada uno estudió un grupo de rayas del espectro. 28
29 Serie Balmer hasta n=2: aparece en la zona visible del espectro. Serie Lyman hasta n=1: aparece en la zona ultravioleta del espectro. Serie Paschen n=3 Serie Bracket n=4 Serie Pfund n=5 Aparecen en la zona infrarroja del espectro n = 6 5 n = 4 n = 3 n = 2 n = 1 Series espectrales Balmer Lyman Pfund Bracket Paschen E = h ν SERIES: Lyman Balmer Paschen Bracket Pfund Espectro UV Visible Infrarrojo 29
30 MECÁNICA CUÁNTICA. La mecánica cuántica surge ante la imposibilidad de dar una explicación satisfactoria, con el modelo de Bohr, a los espectros de átomos con más de un electrón La dualidad onda corpúsculo De Broglie sugirió que un electrón puede mostrar propiedades de onda. La longitud de onda asociada a una partícula de masa m y velocidad v, viene dada por h λ = mv donde h es la constante de Planck Modelo de Bohr Se fundamenta en dos hipótesis Cada electrón tenía una órbita fijada. La probabilidad de encontrarlo en una órbita de radio r o es del 100% Principio de incertidumbre de Heisenberg Heisenberg propuso la imposibilidad de conocer con precisión, y a la vez, la posición y la velocidad de una partícula. Se trata al electrón como una onda y se intenta determinar la probabilidad de encontrarlo en un punto determinado del espacio Modelo cuántico La probabilidad de encontrar al electrón en una órbita de radio r es máxima cuando r = r o 30
31 ORBITAL Un orbital es una solución de la ecuación de ondas aplicada a un átomo. Determina la región del espacio en el átomo donde hay una probabilidad muy alta de encontrar a los electrones La función de onda no permite saber en qué punto del espacio se encuentra el electrón en cada momento, pero sí la probabilidad de encontrarlo en una región determinada La probabilidad de encontrar al electrón dentro de la región dibujada es del 90% Mientras que en el modelo de Bohr cada nivel corresponde a una única órbita, ahora puede haber varios orbitales correspondientes a un mismo nivel energético En el átomo de hidrógeno hay n 2 orbitales en el nivel de energía n-ésimo. Al valor n se le denomina número cuántico principal 31
32 ORBITALES Y NÚMEROS CUÁNTICOS ORBITALES Y NÚMEROS CUÁNTICOS En átomos polielectrónicos, los n 2 orbitales del nivel n dejan de tener todos la misma energía y se separan en diferentes subniveles El número de subniveles que hay en un nivel depende del valor de n para n=1 (primer nivel de energía principal) un subnivel para n=2 (segundo nivel de energía principal) dos subniveles para n=n (n-ésimo nivel de energía principal) n subniveles Los distintos subniveles se diferencian por medio de un parámetro, denominado número cuántico secundario, l, y se nombran mediante una letra para n = 1 l=0 letra s para n = 2 para n = 3 l=0 letra s l=1 letra p l=0 letra s l=1 letra p l=2 letra d Al pasar de Z=1 a Z>1, el nivel de energía n se separa en n subniveles. El número de orbitales en un subnivel dado es igual a (2L + 1) 32
33 Nomenclatura de los subniveles Valor de l Letras 0 s p d f 33
34 Número cuántico secundario o azimutal (L): corrección n de de Sommerfeld El desdoblamiento de algunas rayas espectrales observado con las mejoras técnicas t de algunos espectroscopios llevó a la necesidad de justificar estas nuevas rayas y por tanto de corregir el modelo de Bohr. En 1916, Sommerfeld modificó el modelo de Böhr considerando que las órbitas del electrón no eran necesariamente circulares, sino que también eran posibles órbitas elípticas pticas; esta modificación exige disponer de dos parámetros para caracterizar al electrón. Una elipse viene definida por dos parámetros, que son los valores de sus semiejes mayor y menor. En el caso de que ambos semiejes sean iguales, la elipse se convierte en una circunferencia. Así, introducimos el número cuántico secundario o azimutal (l), cuyos valores permitidos son: L= 0, 1, 2,..., n 1 Por ejemplo, si n = 3, los valores que puede tomar L serán: 0, 1, 2 34
35 Número cuántico magnético (m). El efecto Zeemann se debe a que cualquier carga eléctrica en movimiento crea un campo magnético; por lo tanto, también el electrón lo crea, así que deberá sufrir la influencia de cualquier campo magnético externo que se le aplique. Aplicando un campo magnético a los espectros atómicos las rayas se desdoblan lo que indica que deben existir diferentes orientaciones posibles. Indica las posibles orientaciones en el espacio que puede adoptar la órbita del electrón cuando éste es sometido a un campo magnético externo (efecto Zeemann). Valores permitidos: - L,..., 0,..., + L Por ejemplo, si el número cuántico secundario vale L= 2, los valores permitidos para m serán: -2, -1, 0, 1, 2 Número cuántico de de espín n (s). Indica el sentido de giro del electrón en torno a su propio eje. Puede tomar sólo dos valores para el electrón: +1/2, -1/2. 35
36 número cuántico secundario o azimutal (l) (l) número cuántico magnético (m) número cuántico de de espín (s) (s) Cada electrón viene determinado por 4 números cuánticos: n, L, m y s (los tres primeros determinan cada orbital, y el cuarto s sirve para diferenciar a cada uno de los dos e que componen el mismo). Los valores de éstos son los siguientes: n = 1, 2, 3, 4,... (nº de capa o nivel) l = 0, 1, 2,... (n 1) (forma del orbital o subnivel) m = l,..., 0,... L (orientación orbital o orbital) s = ½, + ½ (spín rotación del electrón ) 36
37 n l m s 1s ±1/2 2s ±1/2 2p 2 1 1,0,1 ±1/2 3s ±1/2 3p 3 1 1,0,1 ±1/2 3d 3 2 2, 1,0,1,2 ±1/2 4s ±1/2 4p 4 1 1,0,1 ±1/2 4d 4 2 2, 1,0,1,2 ±1/2 4f 4 3 3, 2, 1,0,1,2,3 ±1/2 37
38 MODELO ACTUAL El átomo está formado por un núcleo donde se encuentran los neutrones y los protones y los electrones giran alrededor en diferentes orbitales. ORBITAL: ZONA DEL ESPACIO EN TORNO AL NÚCLEO DONDE LA POSIBILIDAD DE ENCONTRAR AL ELECTRÓN ES MÁXIMA Los electrones se sitúan en orbitales, los cuales tienen capacidad para situar dos de ellos: 1ª capa: 1 orb. s (2 e ) 2ª capa: 1 orb. s (2 e ) + 3 orb. p (6 e ) 3ª capa: 1 orb. s (2 e ) + 3 orb. p (6 e ) 5 orb. d (10 e ) 4ª capa: 1 orb. s (2 e ) + 3 orb. p (6 e ) 5 orb. d (10 e ) + 7 orb. f (14 e ) Y así sucesivamente Primero se indica el nivel que es el número cuántico principal n Los valores del número cuántico L (subnivel ( subnivel) indican la letra del orbital que corresponde: (L=0 es s ; L=1 es p ; L=2 es d ; L=3 es f) Los valores de m indican los diferentes orbitales que caben en cada subnivel. En cada orbital solo caben dos electrones uno girando de un lado y otro del otro+1/2 y 1/2 número de spin ss 2 2 p 6 6 d f 14 f 14 38
39 LA FORMA DE LOS ORBITALES Orbitales s (l=0) - tienen forma esférica - la probabilidad de encontrar al electrón es la misma en todas las direcciones radiales - la distancia media del electrón al núcleo sigue el orden 3s > 2s > 1s Orbitales p (l=1) - tienen forma de elipsoides de revolución y se diferencian sólo en la orientación en el espacio - un electrón que se encuentre en un orbital p x pasa la mayor parte del tiempo en las proximidades del eje X. Análogamente ocurren con p y y p z - los tres orbitales np tienen igual forma y tamaño 39
40 Orbitales d (l=2) - tienen forma de elipsoides de revolución - tienen direcciones y tamaños distintos a los p El valor de n afecta al tamaño del orbital, pero no a su forma. Cuanto mayor sea el valor de n, más grande es el orbital 40
41 LA ENERGÍA DE LOS ORBITALES. La energía de un orbital depende de los valores de los números cuánticos principal y secundario pero no del magnético, por tanto todos los orbitales de un mismo subnivel tienen la misma energía Los orbitales vacíos tienen unos niveles energéticos definidos primeramente por el número cuántico principal y luego por el secundario Conforme se van llenando de electrones, la repulsión entre estos modifica la energía de los orbitales y todos disminuyen su energía (se estabilizan) al aumentar Z, pero unos más que otros, y esto origina que su orden energético no sea constante 41
42 La energía de un orbital perteneciente a un átomo polielectrónico no es única. Sin embargo, en referencia a su sucesivo llenado, el orden de energía a utilizar es el siguiente: Regla de llenado de Hund: la energía de un orbital en orden a su llenado es tanto menor cuanto más pequeña sea la suma (n+l). Cuando hay varios orbitales con igual valor de n+l, tiene mayor energía aquel que tenga menor valor de n 42
43 COLOCACIÓN DE DE LOS LOS ELECTRONES EN EN UN UN DIAGRAMA DE DE ENERGÍA Se siguen los siguientes principios: Principio de mínima energía (aufbau) Principio de máxima multiplicidad (regla de Hund) Una vez colocados se cumple el principio de exclusión de Pauli. Principio de mínima energía (aufbau) Se rellenan primero los niveles con menor energía. No se rellenan niveles superiores hasta que no estén completos los niveles inferiores. Principio de máxima multiplicidad (regla de Hund) Principio de exclusión de Pauli. Cuando un nivel electrónico tenga varios orbitales con la misma energía, los electrones se van colocando lo más desapareados posible en ese nivel electrónico. No se coloca un segundo electrón en uno de dichos orbitales hasta que todos los orbitales de dicho nivel de igual energía están semiocupados (desapareados). No puede haber dos electrones con los cuatro números cuánticos iguales en un mismo átomo 43
44 Elemento H He Li Be B C N O F Ne Na Orbitales 1s 2s 2p x 2p y 2p z 3s Configuración electrónica 1s 1 1s 2 1s 2 2s 1 1s 2 2s 2 1s 2 2s 2 2p 1 1s 2 2s 2 2p 2 1s 2 2s 2 2p 3 1s 2 2s 2 2p 4 1s 2 2s 2 2p 5 1s 2 2s 2 2p 6 1s 2 2s 2 2p 6 3s 1 44
45 Energía 6s 5 s 4 s 6 p 5 d 5 p 4 d 4 p 3 d 4 f ORDEN ORDEN EN EN QUE QUE SE SE RELLENAN RELLENAN LOS LOS ORBITALES ORBITALES 3 s 3 p 2 s 2 p 1 s n = 1; 2; 3; 4; 1; 2; 3; 4; l l = 0; 2; 1; 0; 2; 1; m = 0; + 0; ; 2; 1; 2; 1; s s = + = + ½ ½ 45
46 Se Se llama llama CONFIGURACIÓN ELECTRÓNICA de de un un átomo átomo a la la distribución de de sus sus electrones en en los los diferentes orbitales,, teniendo en en cuenta cuenta que que se se van van llenando en en orden orden creciente de de energía energía y situando 2 electrones como como máximo máximo en en cada orbital. cada orbital. 1s 2s 2p 3s 3p 3d 4s 4d 4p 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p LA TABLA PERIÓDICA SE ORDENA SEGÚN EL NÚMERO ATÓMICO, como es el número de protones pero coincide con el de electrones cuando el átomo es neutro, la tabla periódica queda ordenada según las configuraciones electrónicas de los diferentes elementos. 46
MODELOS ATÓMICOS 2ª PARTE
 MODELOS ATÓMICOS 2ª PARTE Teoría Atómica de Joseph John Thomson Diseño Experimental de Joseph John Thomson (1856-1940) Utiliza Tubos de Rayos Catódicos, en los cuales estudia el comportamiento de los gases
MODELOS ATÓMICOS 2ª PARTE Teoría Atómica de Joseph John Thomson Diseño Experimental de Joseph John Thomson (1856-1940) Utiliza Tubos de Rayos Catódicos, en los cuales estudia el comportamiento de los gases
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico.
 EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
ESQUEMA. De él cabe destacar el experimento que demostró que el modelo de Thompson era falso y los postulados que llevaron a que formulara su modelo:
 TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
Unidad 1 Estructura atómica de la materia. Teoría cuántica
 Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA.
 Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
EL ÁTOMO CONTENIDOS. ANTECEDENTES HISTÓRICOS. ( ) MODELOS ATÓMICOS. RAYOS CATÓDICOS. MODELO DE THOMSON.
 EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
Robert A. MILLIKAN ( )
 Robert A. MILLIKAN (1906 1914) Modelo atómico de Rutherford - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones igual
Robert A. MILLIKAN (1906 1914) Modelo atómico de Rutherford - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones igual
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3.
 El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
Un modelo atómico, por lo tanto consiste en representar de manera grafica, la dimensión atómica de la materia. El objetivo de estos modelos es que el
 Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO
 UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO 1. PRIMERAS TEORÍAS ATÓMICAS Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería
UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO 1. PRIMERAS TEORÍAS ATÓMICAS Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería
ESTRUCTURA DEL ÁTOMO - RESUMEN
 TEMA 1 ESTRUCTURA DEL ÁTOMO - RESUMEN 1. DESCUBRIMIENTO DE LA ESTRUCTURA ATÓMICA (ideas generales) Dalton: consideraba que un átomo no podía romperse en trozos más pequeños. El primer indicio de que el
TEMA 1 ESTRUCTURA DEL ÁTOMO - RESUMEN 1. DESCUBRIMIENTO DE LA ESTRUCTURA ATÓMICA (ideas generales) Dalton: consideraba que un átomo no podía romperse en trozos más pequeños. El primer indicio de que el
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS. Partícula Masa (g) Carga (Coulombs) Carga unitaria. Electrón
 MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA CONTENIDOS. 1.- Radiación electromagnética y espectros atómicos. 1.1. Espectros atómicos. 1.2. Series espectrales. 1.3. Ley de Rygberg ( ). 2.- Orígenes de la teoría cuántica.
ESTRUCTURA DE LA MATERIA CONTENIDOS. 1.- Radiación electromagnética y espectros atómicos. 1.1. Espectros atómicos. 1.2. Series espectrales. 1.3. Ley de Rygberg ( ). 2.- Orígenes de la teoría cuántica.
MODELOS ATOMICOS. Solución Å; Ultravioleta; 1106 m/s
 MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
EL MODELO ATOMICO DE BOHR
 EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
Clase N 1. Modelo Atómico I
 Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico I ICAL ATACAMA Módulo Plan Común Modelos Atómicos Teoría Atómica De Dalton Los elementos están formados por partículas extremadamente
Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico I ICAL ATACAMA Módulo Plan Común Modelos Atómicos Teoría Atómica De Dalton Los elementos están formados por partículas extremadamente
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León.
 Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
EL ÁTOMO. Se supuso que estas partículas deberían estar en todos los átomos. Thomson las llamó electrones.
 ANTECEDENTES HISTÓRICOS. () EL ÁTOMO Leucipo y Demócrito. Proponen la Discontinuidad de la materia. Dalton. Formula la primera Teoría atómica. Volta, Davy, Faraday, Berzelius, descubren la Naturaleza eléctrica
ANTECEDENTES HISTÓRICOS. () EL ÁTOMO Leucipo y Demócrito. Proponen la Discontinuidad de la materia. Dalton. Formula la primera Teoría atómica. Volta, Davy, Faraday, Berzelius, descubren la Naturaleza eléctrica
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
LiceoTolimense Química Séptimo 1 Periodo ESTRUCTURA INTERNA DE LA MATERIA
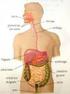 ESTRUCTURA INTERNA DE LA MATERIA Lectura comprensiva Desde la antigüedad los filósofos se preguntaban de qué estaban formadas las cosas que los rodeaban. Primero pensaron que la materia era continua, es
ESTRUCTURA INTERNA DE LA MATERIA Lectura comprensiva Desde la antigüedad los filósofos se preguntaban de qué estaban formadas las cosas que los rodeaban. Primero pensaron que la materia era continua, es
J.J Thomson propone el primer modelo de átomo:
 MODELOS ATÓMICOS. DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1.
MODELOS ATÓMICOS. DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1.
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS. TEMA 7 Pág. 155 libro nuevo
 PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
El átomo: sus partículas elementales
 El átomo: sus partículas elementales Los rayos catódicos estaban constituidos por partículas cargadas negativamente ( a las que se llamo electrones) y que la relación carga/masa de éstas partículas era
El átomo: sus partículas elementales Los rayos catódicos estaban constituidos por partículas cargadas negativamente ( a las que se llamo electrones) y que la relación carga/masa de éstas partículas era
FÍSICA y QUÍMICA. Número cuántico Secundario (SUBNIVEL) l. Número cuántico Magnético (ORBITAL, como si fuera una caja) m.
 TEMA 1: ESTRUCTURA DE LA MATERIA. MODELOS ATÓMICOS 1. Modelo Atómico de RUTHERFORD a. Modelo predecesor de Thomson. b. Modelo atómico de Rutherford. c. Virtudes y defectos del Modelo de Rutherford. 2.
TEMA 1: ESTRUCTURA DE LA MATERIA. MODELOS ATÓMICOS 1. Modelo Atómico de RUTHERFORD a. Modelo predecesor de Thomson. b. Modelo atómico de Rutherford. c. Virtudes y defectos del Modelo de Rutherford. 2.
El ÁTOMO de HIDRÓGENO
 El ÁTOMO de HIDRÓGENO Dr. Andres Ozols Dra. María Rebollo FIUBA 006 Dr. A. Ozols 1 ESPECTROS DE HIDROGENO espectros de emisión espectro de absorción Dr. A. Ozols ESPECTROS DE HIDROGENO Secuencias de las
El ÁTOMO de HIDRÓGENO Dr. Andres Ozols Dra. María Rebollo FIUBA 006 Dr. A. Ozols 1 ESPECTROS DE HIDROGENO espectros de emisión espectro de absorción Dr. A. Ozols ESPECTROS DE HIDROGENO Secuencias de las
2º Bachillerato. Química. Unidad 1 (Estructura atómica de la materia). Fotocopia 1.
 Partículas subatómicas Los átomos están formados por un núcleo (formado por protones y neutrones) rodeado por una nube de electrones, que se encuentran en la corteza. Entre núcleo y corteza hay espacio
Partículas subatómicas Los átomos están formados por un núcleo (formado por protones y neutrones) rodeado por una nube de electrones, que se encuentran en la corteza. Entre núcleo y corteza hay espacio
2.- Los átomos de un mismo elemento son iguales en masa y propiedades. Y los átomos de elementos diferentes son diferentes en masa y propiedades.
 FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV
 M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV Comprender la utilidad de los modelos atómicos y de la teoría atómica para explicar los procesos de transformación físico-química de la materia
M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV Comprender la utilidad de los modelos atómicos y de la teoría atómica para explicar los procesos de transformación físico-química de la materia
Como esta formada la materia?
 Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Espectros de emisión y absorción.
 Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Radiación. Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler. L. Infante 1
 Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
- Marie Curie. - Joseph Thomson. - Ernest Rutherford. - Max Planck. - Albert Einstein. - Niels Bohr. - Louis de Broglie. - Werner Heisenberg
 - Marie Curie - Joseph Thomson - Ernest Rutherford - Max Planck - Albert Einstein - Niels Bohr - Louis de Broglie - Werner Heisenberg - Wolfgang Pauli - Arnorld Sommerfeld Autores (Orden Alfabético): Celia
- Marie Curie - Joseph Thomson - Ernest Rutherford - Max Planck - Albert Einstein - Niels Bohr - Louis de Broglie - Werner Heisenberg - Wolfgang Pauli - Arnorld Sommerfeld Autores (Orden Alfabético): Celia
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia I: estructura atómica, modelos atómicos y tipos de átomos
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia I: estructura atómica, modelos atómicos y tipos de átomos Química Técnico Profesional Intensivo SCUACTC001TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia I: estructura atómica, modelos atómicos y tipos de átomos Química Técnico Profesional Intensivo SCUACTC001TC83-A16V1 Ítem Alternativa
Estructura de la materia y Sistema Periódico
 Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
1.6-Series espectrales Ley de Rydberg. 2.- Orígenes de la teoría cuántica. 3.- Modelo atómico de Bohr. 4.- Principios de la mecánica cuántica.
 Clase 7 Contenidos 2 1.Estructura de la materia 1.1- Rayos catódicos y anódicos. 1.2- Experimento de j. J. Thomson, e/m, experimento de Millikan, carga del electrón. 1.3-Rayos x. Radiactividad. 1.4- modelo
Clase 7 Contenidos 2 1.Estructura de la materia 1.1- Rayos catódicos y anódicos. 1.2- Experimento de j. J. Thomson, e/m, experimento de Millikan, carga del electrón. 1.3-Rayos x. Radiactividad. 1.4- modelo
EL ESPECTRO ELECTROMAGNÉTICO
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
Con posterioridad el físico alemán Sommerfeld introdujo en el modelo la posibilidad de órbitas elípticas. Köningsberg, Munich, 1951
 4. El paso de una órbita a otra supone la absorción o emisión de radiación. El átomo sólo absorberá o emitirá la radiación justa para pasar de una órbita a otra. Las órbitas de los electrones son estables
4. El paso de una órbita a otra supone la absorción o emisión de radiación. El átomo sólo absorberá o emitirá la radiación justa para pasar de una órbita a otra. Las órbitas de los electrones son estables
Modelo atómico de la materia.
 Modelo atómico de la materia. La Teoría Atómica se basa en la suposición (ratificada después por datos experimentales) de que la materia no es continua, sino que está formada por partículas distintas.
Modelo atómico de la materia. La Teoría Atómica se basa en la suposición (ratificada después por datos experimentales) de que la materia no es continua, sino que está formada por partículas distintas.
3.1. Estructura atómica
 3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
MODELOS ATÓMICOS REALIZADO POR: NICOLÁS CASTELLANO SUÁREZ. Nº2, 4ºesoB. Física y Química
 MODELOS ATÓMICOS REALIZADO POR: NICOLÁS CASTELLANO SUÁREZ. Nº2, 4ºesoB Física y Química 2 Índice: Introducción..3 Modelo atómico de Dalton..4 Modelo atómico de Thomson.5 Modelo atómico de Rutherford..6
MODELOS ATÓMICOS REALIZADO POR: NICOLÁS CASTELLANO SUÁREZ. Nº2, 4ºesoB Física y Química 2 Índice: Introducción..3 Modelo atómico de Dalton..4 Modelo atómico de Thomson.5 Modelo atómico de Rutherford..6
ÁTOMO..su historia y su estudio
 ÁTOMO.su historia y su estudio LOS GRIEGOS Y SU APORTE 2000 años antes de Cristo, la civilización griega representada por varios filósofos, ya se preguntaban acerca de qué estaba formado el universo?...
ÁTOMO.su historia y su estudio LOS GRIEGOS Y SU APORTE 2000 años antes de Cristo, la civilización griega representada por varios filósofos, ya se preguntaban acerca de qué estaba formado el universo?...
Tercero: una reacción química incluye sólo la separación combinación o reordenamiento de átomos sin crearlos o destruirlos.
 Coomppoonneennt teess ffuunnddaameennt taalleess ddeell áát toomoo El filósofo griego demócrito en el siglo V a.c. propuso la idea de que la materia estaba formada por partículas muy pequeñas indivisibles
Coomppoonneennt teess ffuunnddaameennt taalleess ddeell áát toomoo El filósofo griego demócrito en el siglo V a.c. propuso la idea de que la materia estaba formada por partículas muy pequeñas indivisibles
Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín. El átomo.
 Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín El átomo 06 de Marzo 2015 Objetivos de la clase Comprender el Modelo corpuscular de
Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín El átomo 06 de Marzo 2015 Objetivos de la clase Comprender el Modelo corpuscular de
Química Los procesos químicos
 Universidad de Cantabria Departamento CITIMAC Química Los procesos químicos Dr. Imanol de Pedro del Valle Estructura de la Materia CONCEPTOS FUNDAMENTALES DE LA CLASE Los Modelos atómicos. Las Partículas
Universidad de Cantabria Departamento CITIMAC Química Los procesos químicos Dr. Imanol de Pedro del Valle Estructura de la Materia CONCEPTOS FUNDAMENTALES DE LA CLASE Los Modelos atómicos. Las Partículas
ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST
 ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST Serie A: PARTICULAS SUBATOMICAS: Serie B- ESPECTROS: Serie C- COMPOSICION DEL ÁTOMO Serie D- ESTRUCTURA ELECTRÓNICA Serie E- ATOMO DE THOMPSON Serie F- DEFECTO DE
ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST Serie A: PARTICULAS SUBATOMICAS: Serie B- ESPECTROS: Serie C- COMPOSICION DEL ÁTOMO Serie D- ESTRUCTURA ELECTRÓNICA Serie E- ATOMO DE THOMPSON Serie F- DEFECTO DE
TEMA 4 La Materia: Propiedades. eléctricas y el átomo
 TEMA 4 La Materia: Propiedades eléctricas y el átomo La mente curiosa de un científico le hace preguntarse incluso por aquellos que no ve? Pero esas preguntas nacen de aquellos fenómenos que apreciamos
TEMA 4 La Materia: Propiedades eléctricas y el átomo La mente curiosa de un científico le hace preguntarse incluso por aquellos que no ve? Pero esas preguntas nacen de aquellos fenómenos que apreciamos
Corteza atómica: Estructura electrónica
 Corteza atómica: Estructura electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes: 1. Existen 7 niveles
Corteza atómica: Estructura electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes: 1. Existen 7 niveles
Teoría Cuántica y la estructura electrónica de los Átomos
 EN EL INTERIOR DEL ATOMO TEMA 3 Química General e Inorgánica A Teoría Cuántica y la estructura electrónica de los Átomos 1 LO QUE SABEMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON
EN EL INTERIOR DEL ATOMO TEMA 3 Química General e Inorgánica A Teoría Cuántica y la estructura electrónica de los Átomos 1 LO QUE SABEMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON
LA TEORIA ATOMICA John Dalton
 LA TEORIA ATOMICA En 1808, un científico inglés, el profesor John Dalton, formuló una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos 1766-1844
LA TEORIA ATOMICA En 1808, un científico inglés, el profesor John Dalton, formuló una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos 1766-1844
Respuestas del Control 1. Curso Noviembre 2008
 NOMBRE y APELLIDOS... NOTA: En los cálculos numéricos tenga en cuenta la precisión de las constantes y de las magnitudes que se dan y dé el resultado con el número de cifras significativas adecuado. La
NOMBRE y APELLIDOS... NOTA: En los cálculos numéricos tenga en cuenta la precisión de las constantes y de las magnitudes que se dan y dé el resultado con el número de cifras significativas adecuado. La
Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C
 Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C La materia es todo aquello que tiene masa, ocupa un lugar en el espacio y es cuantificable (se puede medir).la Química es la ciencia que estudia su naturaleza,
Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C La materia es todo aquello que tiene masa, ocupa un lugar en el espacio y es cuantificable (se puede medir).la Química es la ciencia que estudia su naturaleza,
Modelo atómico de Dalton(1808)
 El átomo Modelos atómicos Como no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
El átomo Modelos atómicos Como no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
QUIMICA GENERAL. Docente : Raquel Villafrades Torres
 Universidad Pontificia Bolivariana QUIMICA GENERAL Docente : Raquel Villafrades Torres TEORIA ATOMICA DE DALTON (1808) BASES Ley de conservación de la masa: La masa total de las sustancias presentes después
Universidad Pontificia Bolivariana QUIMICA GENERAL Docente : Raquel Villafrades Torres TEORIA ATOMICA DE DALTON (1808) BASES Ley de conservación de la masa: La masa total de las sustancias presentes después
Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B
 Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B * Historia del Átomo: -El átomo en la antigüedad (pág. 3) -Leucipo y Demócrito (pág.4)
Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B * Historia del Átomo: -El átomo en la antigüedad (pág. 3) -Leucipo y Demócrito (pág.4)
Estructura extranuclear del átomo MODELOS ATÓMICOS
 Estructura extranuclear del átomo MODELOS ATÓMICOS A MEDIADOS DEL XIX, ESTUDIOS RELACIONADOS CON LA NATURALEZA ELÉCTRICA DE LA MATERIA Y EN CONCRETO, CON LA NATURALEZA DE LA CHISPA QUE SALTA ENTRE DOS
Estructura extranuclear del átomo MODELOS ATÓMICOS A MEDIADOS DEL XIX, ESTUDIOS RELACIONADOS CON LA NATURALEZA ELÉCTRICA DE LA MATERIA Y EN CONCRETO, CON LA NATURALEZA DE LA CHISPA QUE SALTA ENTRE DOS
1. Estructura Atómica
 1. Estructura Atómica 1.1 Modelos atómicos: de Dalton a Rutherford 1.1.1 Modelo atómico de Dalton 1.1.2 Modelo atómico de Thomson 1.1.3 Modelo atómico de Rutherford 1.2 Modelo atómico de Bohr 1.2.1 Espectro
1. Estructura Atómica 1.1 Modelos atómicos: de Dalton a Rutherford 1.1.1 Modelo atómico de Dalton 1.1.2 Modelo atómico de Thomson 1.1.3 Modelo atómico de Rutherford 1.2 Modelo atómico de Bohr 1.2.1 Espectro
- Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson ( )
 REPASO QUÍMICA 01 - Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson (1856-1940) Modelo de Thompson Modelo del budín de pasas - EN 1895 WILHELM RONTGEN Descubre
REPASO QUÍMICA 01 - Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson (1856-1940) Modelo de Thompson Modelo del budín de pasas - EN 1895 WILHELM RONTGEN Descubre
Configuración Electrónica
 Configuración Electrónica La configuración electrónica de un átomo indica la forma como están distribuidos los electrones entre los distintos orbitales atómicos. Según el Principio de Exclusión de Pauli,
Configuración Electrónica La configuración electrónica de un átomo indica la forma como están distribuidos los electrones entre los distintos orbitales atómicos. Según el Principio de Exclusión de Pauli,
Estas partículas son estudiadas por J.J. Thomson que las caracterizó determinando el tipo de carga que poseían y su relación carga/masa.
 página 1/12 Partículas en el átomo Los experimentos de Volta y más tarde otros que pusieron de manifiesto la existencia de partículas cargadas en la materia llevaron a la investigación que obligó a replantearse
página 1/12 Partículas en el átomo Los experimentos de Volta y más tarde otros que pusieron de manifiesto la existencia de partículas cargadas en la materia llevaron a la investigación que obligó a replantearse
Estructura de la materia. Introducción a la Química moderna.
 Estructura de la materia. Introducción a la Química moderna. 6. Estructura atómica y clasificación periódica de los elementos Contenidos Del átomo de Bohr al modelo cuántico. Hipótesis de Planck y Einstein.
Estructura de la materia. Introducción a la Química moderna. 6. Estructura atómica y clasificación periódica de los elementos Contenidos Del átomo de Bohr al modelo cuántico. Hipótesis de Planck y Einstein.
EL ÁTOMO Modelos Atómicos
 EL ÁTOMO Modelos Atómicos Cómo está formada la materia en su interior? Desde los tiempos de la antigua Grecia,los pensadores venían haciéndose esta pregunta, acerca de cómo estaba constituida la materia
EL ÁTOMO Modelos Atómicos Cómo está formada la materia en su interior? Desde los tiempos de la antigua Grecia,los pensadores venían haciéndose esta pregunta, acerca de cómo estaba constituida la materia
b) La zona externa del átomo se llama CORTEZA. y ahí es donde se mueven los ELECTRONES
 PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
ESTRUCTURA DEL ÁTOMO. MODELOS DE RUTHERFORD Y DE BOHR-SOMMERFELD
 ESTRUCTURA DEL ÁTOMO. MODELOS DE RUTHERFORD Y DE BOHR-SOMMERFELD De todas las partículas subatómicas elementales, ay tres que interesan fundamentalmente, pues son necesarias para construir un modelo atómico
ESTRUCTURA DEL ÁTOMO. MODELOS DE RUTHERFORD Y DE BOHR-SOMMERFELD De todas las partículas subatómicas elementales, ay tres que interesan fundamentalmente, pues son necesarias para construir un modelo atómico
radiación electromagnética
 radiación electromagnética ondas propagándose en el espacio con velocidad c crestas amplitud l valles longitud de onda [ l]=cm, nm, μm, A Frecuencia=n=c/l [ n ]=HZ=1/s l= numero de ondas por unidad de
radiación electromagnética ondas propagándose en el espacio con velocidad c crestas amplitud l valles longitud de onda [ l]=cm, nm, μm, A Frecuencia=n=c/l [ n ]=HZ=1/s l= numero de ondas por unidad de
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 Modelos atómicos Los filósofos de la antigüedad especularon sobre cómo estaba formada la materia. Demócrito (460-370 a.c) y otros filósofos anteriores a él, pensaban que el mundo material debería estar
Modelos atómicos Los filósofos de la antigüedad especularon sobre cómo estaba formada la materia. Demócrito (460-370 a.c) y otros filósofos anteriores a él, pensaban que el mundo material debería estar
Núcleo Atómico. El núcleo es una masa muy compacta formada por protones y neutrones.
 Núcleo Atómico Profesor: Robinson Pino H. 1 COMPONENTES DEL NÚCLEO ATÓMICO El núcleo es una masa muy compacta formada por protones y neutrones. PROTÓN PROTÓN(p + ) Es una partícula elemental con carga
Núcleo Atómico Profesor: Robinson Pino H. 1 COMPONENTES DEL NÚCLEO ATÓMICO El núcleo es una masa muy compacta formada por protones y neutrones. PROTÓN PROTÓN(p + ) Es una partícula elemental con carga
Las estructura electrónica de los átomos
 Las estructura electrónica de los átomos Al preguntarnos por las diferencias entre las propiedades químicas y físicas de los elementos, así como, su forma de enlazarse y la forma en la cual emiten o absorben
Las estructura electrónica de los átomos Al preguntarnos por las diferencias entre las propiedades químicas y físicas de los elementos, así como, su forma de enlazarse y la forma en la cual emiten o absorben
U N A M. Facultad de Ingeniería MODELO ATÓMICO DE J. J. THOMSON MODELO ATÓMICO DE ERNEST RUTHERFORD DESCUBRIMIENTO DEL PROTÓN Y DEL NEUTRON
 MODELO ATÓMICO DE J. J. THOMSON MODELO ATÓMICO DE ERNEST RUTHERFORD DESCUBRIMIENTO DEL PROTÓN Y DEL NEUTRON M. C. Q. Alfredo Velásquez Márquez Modelo Atómico de J. J. Thomson Electrones de Carga Negativa
MODELO ATÓMICO DE J. J. THOMSON MODELO ATÓMICO DE ERNEST RUTHERFORD DESCUBRIMIENTO DEL PROTÓN Y DEL NEUTRON M. C. Q. Alfredo Velásquez Márquez Modelo Atómico de J. J. Thomson Electrones de Carga Negativa
PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA
 PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA CURSO 013 014 CONVOCATORIA: PROBLEMAS OPCIÓN A MATERIA: FÍSICA De las dos opciones propuestas, sólo hay que desarrollar
PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA CURSO 013 014 CONVOCATORIA: PROBLEMAS OPCIÓN A MATERIA: FÍSICA De las dos opciones propuestas, sólo hay que desarrollar
1. Qué es un modelo atómico?
 MODELOS ATÒMICOS ÌNDICE. 1. Qué es un modelo atómico? 2. Historia del modelo atómico. 3. Modelos atómicos. 3.1. Modelo Atómico de Dalton. 3.2. Modelo Atómico de Thomson. 3.3. Modelo atómico de Perrin.
MODELOS ATÒMICOS ÌNDICE. 1. Qué es un modelo atómico? 2. Historia del modelo atómico. 3. Modelos atómicos. 3.1. Modelo Atómico de Dalton. 3.2. Modelo Atómico de Thomson. 3.3. Modelo atómico de Perrin.
Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete. Núcleo. (protones y neutrones)
 Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete EL ÁTOMO Núcleo Envoltura (electrones) (protones y neutrones) El átomo, como lo conocemos
Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete EL ÁTOMO Núcleo Envoltura (electrones) (protones y neutrones) El átomo, como lo conocemos
ESTRUCTURA ATOMICA DESARROLLO HISTORICO
 ESTRUCTURA ATOMICA DESARROLLO HISTORICO MODELOS ATOMICOS Átomo: Partícula más pequeña de un elemento que retiene sus propiedades. DEMOCRITO Y LEUCIPO. En el Siglo V A.C. dos Filósofos Griegos Leucipo y
ESTRUCTURA ATOMICA DESARROLLO HISTORICO MODELOS ATOMICOS Átomo: Partícula más pequeña de un elemento que retiene sus propiedades. DEMOCRITO Y LEUCIPO. En el Siglo V A.C. dos Filósofos Griegos Leucipo y
Átomos polielectrónicos Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas
 ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
ESTRUCTURA ELECTRÓNICA Espín y configuraciones electrónicas Número y masa atómicos (isótopos) Tabla periódica y configuraciones electrónicas Átomos con un solo electrón: La energía depende solamente del
Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica. Clasificación de los elementos y propiedades periódicas
 Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica Clasificación de los elementos y propiedades periódicas Modelos atómicos: Átomo de Dalton NOMBRE EN QUÉ CONSISTE QUÉ EXPLICA QUÉ
Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica Clasificación de los elementos y propiedades periódicas Modelos atómicos: Átomo de Dalton NOMBRE EN QUÉ CONSISTE QUÉ EXPLICA QUÉ
Complejo Educacional Joaquín Edwards Bello QUIMICA 2º MEDIO TRABAJO 2 LEA CUIDADOSAMENTE EL SIGUIENTE TEXTO Y CONTESTE LAS PREGUNTAS
 Complejo Educacional Joaquín Edwards Bello QUIMICA 2º MEDIO TRABAJO 2 NOMBRE: CURSO: LEA CUIDADOSAMENTE EL SIGUIENTE TEXTO Y CONTESTE LAS PREGUNTAS..Naturaleza Eléctrica de la Materia La electricidad fue
Complejo Educacional Joaquín Edwards Bello QUIMICA 2º MEDIO TRABAJO 2 NOMBRE: CURSO: LEA CUIDADOSAMENTE EL SIGUIENTE TEXTO Y CONTESTE LAS PREGUNTAS..Naturaleza Eléctrica de la Materia La electricidad fue
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS.
 PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS. 1.3 El sol, horno nuclear
 UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS 1.3 El sol, horno nuclear RADIACTIVIDAD Y DESINTEGRACIÓN NUCLEAR HISTORIA DEL ÁTOMO Hace aproximadamente 2500 años, los filósofos griegos, afirmaron que la
UNIDAD 1 LA ENERGÍA, LA MATERIA Y SUS CAMBIOS 1.3 El sol, horno nuclear RADIACTIVIDAD Y DESINTEGRACIÓN NUCLEAR HISTORIA DEL ÁTOMO Hace aproximadamente 2500 años, los filósofos griegos, afirmaron que la
TEMA 2 ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS
 TEMA 2 ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS MARÍA PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Introducción 2. Modelo de Thomson 3. Modelo de Rutherford 4. La luz y las ondas electromagnéticas 5. Dispersión
TEMA 2 ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS MARÍA PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Introducción 2. Modelo de Thomson 3. Modelo de Rutherford 4. La luz y las ondas electromagnéticas 5. Dispersión
RADIACIÓN ELECTROMAGNÉTICA Y TÉCNICAS DE OBSERVACIÓN. Curso Introducción a la Astronomía 1
 RADIACIÓN ELECTROMAGNÉTICA Y TÉCNICAS DE OBSERVACIÓN Curso 2011-12 Introducción a la Astronomía 1 Brillo Magnitud aparente El ojo detecta la luz de forma logarítmica, es decir, detecta cambios no de manera
RADIACIÓN ELECTROMAGNÉTICA Y TÉCNICAS DE OBSERVACIÓN Curso 2011-12 Introducción a la Astronomía 1 Brillo Magnitud aparente El ojo detecta la luz de forma logarítmica, es decir, detecta cambios no de manera
Solución: a) Falso, porque la carga que se apiña en lo que se denomina núcleo es toda la carga positiva.
 ies menéndez tolosa 1 De las siguientes proposiciones, señala las que considere correctas: a) Todos los isótopos de un elemento tienen el mismo número de electrones. b) Dos isótopos de un elemento pueden
ies menéndez tolosa 1 De las siguientes proposiciones, señala las que considere correctas: a) Todos los isótopos de un elemento tienen el mismo número de electrones. b) Dos isótopos de un elemento pueden
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1.- Escriba la configuración electrónica de los siguientes iones o elementos: 8 O -2, 9 F - y 10 Ne, e indique el período y grupo de los elementos correspondientes.
UNIDAD 9 ESTRUCTURA ATÓMICA Y SISTEMA PERIÓDICO
 UNIDAD 9 ESTRUCTURA ATÓMICA Y SISTEMA PERIÓDICO I Historia de los modelos atómicos Los diferentes modelos atómicos que han sido propuestos a lo largo de la historia son un claro ejemplo de la aplicación
UNIDAD 9 ESTRUCTURA ATÓMICA Y SISTEMA PERIÓDICO I Historia de los modelos atómicos Los diferentes modelos atómicos que han sido propuestos a lo largo de la historia son un claro ejemplo de la aplicación
BLOQUE 4.1 ÓPTICA FÍSICA
 BLOQUE 4.1 ÓPTICA FÍSICA 1. NATURALEZA DE LA LUZ Hasta ahora hemos considerado a la luz como algo que transporta energía de un lugar a otro. Por otra parte, sabemos que existen dos formas básicas de transportar
BLOQUE 4.1 ÓPTICA FÍSICA 1. NATURALEZA DE LA LUZ Hasta ahora hemos considerado a la luz como algo que transporta energía de un lugar a otro. Por otra parte, sabemos que existen dos formas básicas de transportar
Radiaciones Ionizantes: Utilización y Riesgos RIUR. Guía de estudio
 Radiaciones Ionizantes: Utilización y Riesgos RIUR . Estructura y radiaciones atómicas Esta guía describe el conjunto de actividades que forman el tema 2 del módulo 1: " Estructura y radiaciones atómicas"
Radiaciones Ionizantes: Utilización y Riesgos RIUR . Estructura y radiaciones atómicas Esta guía describe el conjunto de actividades que forman el tema 2 del módulo 1: " Estructura y radiaciones atómicas"
Enseñanza - Aprendizaje
 El primer modelo atómico con bases científicas, fue formulado por John Dalton descubrió a los átomos en 1804. Pensaba que eran las partículas más pequeñas de la materia, que no podían ser divididas en
El primer modelo atómico con bases científicas, fue formulado por John Dalton descubrió a los átomos en 1804. Pensaba que eran las partículas más pequeñas de la materia, que no podían ser divididas en
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
Evolución de los modelos atómicos
 Evolución de los modelos atómicos Un paso importante hacia el desarrollo de la química como ciencia fue el desarrollo de la comprensión de la estructura atómica. Por ejemplo, era posible comprender lo
Evolución de los modelos atómicos Un paso importante hacia el desarrollo de la química como ciencia fue el desarrollo de la comprensión de la estructura atómica. Por ejemplo, era posible comprender lo
ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA.
 ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA. INDICE Qué es la materia? Modelos de la materia Fuerzas Fundamentales
ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA. INDICE Qué es la materia? Modelos de la materia Fuerzas Fundamentales
Ejercicios de Física cuántica y nuclear. PAU (PAEG)
 1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
Modelos atómicos. El valor de la energía de estos niveles de energía está en función de un número n, denominado número cuántico principal 18 J.
 MODELO ATÓMICO DE BOHR (1913) El modelo atómico de Rutherfod tuvo poca vigencia, ya que inmediatamente a su publicación, se le puso una objeción que no supo rebatir: según la teoría del electromagnetismo
MODELO ATÓMICO DE BOHR (1913) El modelo atómico de Rutherfod tuvo poca vigencia, ya que inmediatamente a su publicación, se le puso una objeción que no supo rebatir: según la teoría del electromagnetismo
Actividad: Cómo son las configuraciones electrónicas?
 Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B.
 CAPITULO 4 ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B. Aproximadamente 400 a.c. el filosofo griego Democrito sugirió que toda la materia esta formada por partículas minúsculas, discretas e indivisibles,
CAPITULO 4 ESTRUCTURA DE LOS ATOMOS Ing. Alfredo Luis Rojas B. Aproximadamente 400 a.c. el filosofo griego Democrito sugirió que toda la materia esta formada por partículas minúsculas, discretas e indivisibles,
Antecedentes de Química. Autora: Violeta Luz María Bravo Hernández
 Antecedentes de Química Autora: Violeta Luz María Bravo Hernández CONTENIDO 1. Descubrimiento del electrón, protón y neutrón. 2. Modelo atómico de Thomson. 3. Modelo atómico de Rutherford. 4. Modelo atómico
Antecedentes de Química Autora: Violeta Luz María Bravo Hernández CONTENIDO 1. Descubrimiento del electrón, protón y neutrón. 2. Modelo atómico de Thomson. 3. Modelo atómico de Rutherford. 4. Modelo atómico
EL ÁTOMO. Se supuso que estas partículas deberían estar en todos los átomos. Thomson las llamó electrones.
 ANTECEDENTES HISTÓRICOS. () EL ÁTOMO Leucipo y Demócrito. Proponen la Discontinuidad de la materia. Dalton. Formula la primera Teoría atómica. Volta, Davy, Faraday, Berzelius, descubren la Naturaleza eléctrica
ANTECEDENTES HISTÓRICOS. () EL ÁTOMO Leucipo y Demócrito. Proponen la Discontinuidad de la materia. Dalton. Formula la primera Teoría atómica. Volta, Davy, Faraday, Berzelius, descubren la Naturaleza eléctrica
Estructura Atómica. Los inicios años A.C. Demócrito y ÁTOMO. Los inicios.. Tuvieron que pasar casi 2400 años. Sin. División
 Estructura Atómica Los inicios.. 500 años A.C. Demócrito y Leucippus fundan la escuela atomista. Sostienen que la materia era finita, discontinua, indivisible formada por una partícula común a la que llamaron
Estructura Atómica Los inicios.. 500 años A.C. Demócrito y Leucippus fundan la escuela atomista. Sostienen que la materia era finita, discontinua, indivisible formada por una partícula común a la que llamaron
3 - Cómo podemos diferenciar un elemento químico de un compuesto, según la teoría de Dalton?
 TEORÍA ATÓMICA 1- A partir de los siguientes datos, cuántas veces es maor la masa del protón que la del electrón? Masa del protón =1,673 10-27 kg Masa del electrón =9,1 10-31 kg 2 - El modelo del átomo
TEORÍA ATÓMICA 1- A partir de los siguientes datos, cuántas veces es maor la masa del protón que la del electrón? Masa del protón =1,673 10-27 kg Masa del electrón =9,1 10-31 kg 2 - El modelo del átomo
