GARDASIL SUSPENSIÓN INYECTABLE (Vacuna Recombinante Tetravalente Absorbida contra el virus de Papiloma Humano (Tipos 6, 11, 16, 18))
|
|
|
- Ángel Navarrete Aguirre
- hace 6 años
- Vistas:
Transcripción
1 GARDASIL SUSPENSIÓN INYECTABLE (Vacuna Recombinante Tetravalente Absorbida contra el virus de Papiloma Humano (Tipos 6, 11, 16, 18)) GARDASIL SUSPENSIÓN INYECTABLE JERINGA PRELLENADA (Vacuna Recombinante Tetravalente Absorbida contra el virus de Papiloma Humano (Tipos 6, 11, 16, 18)) I. COMPOSICION Gardasil Vacuna Recombinante Tetravalente contra el virus de Papiloma Humano (Tipos 6, 11, 16, 18). II. FORMA FARMACEUTICA Suspensión inyectable. III. COMPOSICIÓN POR UNIDAD DE DOSIFICACION INGREDIENTES ACTIVOS GARDASIL es una preparación estéril de administración intramuscular. Cada dosis de 0.5-mL contiene aproximadamente: Proteína L1 VPH Tipo 6 20 mcg Proteína L1 VPH Tipo mcg Proteína L1 VPH Tipo mcg Proteína L1 VPH Tipo mcg INGREDIENTES INACTIVOS Cada dosis de 0.5-mL contiene aproximadamente: Aluminio (en forma de adyuvante sulfato hidroxifosfato de aluminio amorfo) 225 mcg Cloruro de sodio 9.56 mg L-histidina 0.78 mg Polisorbato mcg Borato de sodio 35 mcg Agua para inyección c.s. El producto no contiene preservativo ni antibiótico. IV. FARMACOLOGIA CLÍNICA Carga de la enfermedad En todo el mundo, cada año se diagnostican más de 490,000 casos de cáncer cervical. La prevención del cáncer cervical se centra en el tamizaje repetido (por ejemplo, frotis de Papanicolaou, pruebas de virus del papiloma humano o ambas) y la intervención temprana. Tal estrategia ha reducido las tasas de cáncer aproximadamente 75% en el mundo desarrollado, pero ha desviado la carga, pasando del manejo del cáncer cervical a la detección y el tratamiento de un gran número de lesiones premalignas. El cáncer cervical es causado por una infección por el virus del papiloma humano (VPH). Es necesaria la infección por VPH para que aparezcan el cáncer cervical de células escamosas (y su lesión precursora, la neoplasia intraepitelial cervical o NIC de grados 1 y 2/3) y el adenocarcinoma cervical (y su lesión precursora, el adenocarcinoma in situ [AIS]). La infección por el VPH es muy común. La mayoría de las infecciones por VPH son sin secuelas, pero algunas progresan a cáncer cervical y/o otras enfermedades relacionadas al VPH. A falta de vacunación, más de 50% de los adultos sexualmente activos se infectarán con el VPH a lo largo de la vida. La infección por el VPH de los tipos 6, 11, 16 y 18 puede ocasionar resultados anormales en la citología de Papanicolaou y lesiones displásicas de grado leve (NIC 1). Las lesiones por el VPH de los tipos 6 y 11 tienen pocas probabilidades de progresar hasta el cáncer, pero son clínicamente indistinguibles de las lesiones premalignas causadas por el VPH de los tipos 16 y 18. La infección por el VPH de los tipos 6 y 11 también causa verrugas genitales (condilomas acuminados), excrecencias que aparecen en la mucosa cervicovaginal y en los genitales externos, que rara vez progresan hasta el cáncer. Se ha calculado que el riesgo de por vida de contraer verrugas genitales es superior al 10%.
2 GARDASIL es una vacuna recombinante con proteínas L1 parecidas a los tipos de VPH 6, 11, 16 y 18. Los tipos 16 y 18 causan aproximadamente: 70% de los casos de cáncer cervical, adenocarcinoma in situ, y NIC 3; 50% de casos NIC 2 Los tipos de VPH 6, 11, 16 y 18 causan aproximadamente: 35 a 50% de todos los casos de NIC 1 Los tipos de VPH 6 y 11 causan aproximadamente: 90% de los casos de verrugas genitales 9 a 12% de los casos de NIC 1 Mecanismo de acción GARDASIL contiene partículas parecidas a virus (PPV) de L1, las cuales son proteínas que semejan los viriones naturales. Dado que las partículas parecidas a virus no contienen ADN, no pueden infectar a las células ni reproducirse. En los estudios preclínicos, la inducción de anticuerpos contra el papilomavirus con las vacunas de PPV de L1 confirió protección contra la infección. La administración del suero de los animales vacunados a animales no vacunados logró transferir la protección contra el VPH a los segundos. Estos datos sugieren que la eficacia de las vacunas de PPV de L1 está mediada por la aparición de una respuesta inmune humoral Estudios clínicos En mujeres, la neoplasia intraepitelial cervical 2/3 y el adenocarcinoma in situ son los precursores inmediatos del carcinoma de células escamosas invasor y del adenocarcinoma cervical invasor, respectivamente. Se ha demostrado que su detección y extirpación previene el cáncer invasor (prevención secundaria); así pues, su prevención primaria mediante la vacunación también prevendrá el cáncer invasor. No puede emplearse el cáncer cervical invasor como un punto final en los estudios de eficacia de las vacunas contra el VPH, debido a la importancia de emplear medidas de prevención secundaria. Así pues, los precursores inmediatos, tales como la NIC 2 (displasia cervical de grado moderado), la NIC 3 (displasia cervical de grado alto, que incluye el carcinoma in situ), y el adenocarcinoma in situ son los puntos finales más apropiados para demostrar la prevención del cáncer cervical mediante las vacunas contra el VPH. La neoplasia intraepitelial cervical 3 y el adenocarcinoma in situ se clasifican como cánceres cervicales de grado 0, según la FIGO (Federación Internacional de Ginecología y Obstetricia). La eficacia de GARDASIL se evaluó en 5 estudios clínicos de Fase II y III, doble ciego, con distribución al azar, controlados con placebo. El primer estudio de Fase II evaluó el componente de VPH 16 de GARDASIL (Protocolo 005, N = 2,391 niñas y mujeres), y el segundo evaluó todos los componentes de GARDASIL (Protocolo 007, N = 551). Los estudios de Fase III, denominados FUTURE (siglas en inglés de Mujeres Unidas para Reducir Unilateralmente las Enfermedades Ecto- y Endocervicales), evaluaron GARDASIL en 5,442 (FUTURE I), 12,157 (FUTURE II), y 3,817 (FUTURE III) participantes. En conjunto, dichos estudios evaluaron a 24,358 mujeres que tenían entre 16 a 45. La mediana de duración del seguimiento fue de 4.0, 3.0, 3.0, 4.0, y 2.3 años para el Protocolo 005, el Protocolo 007, FUTURE I, FUTURE II, y FUTURE III de estudios base, respectivamente. Las participantes recibieron la vacuna o placebo el día de su ingreso y 2 y 6 meses después. Se analizó la eficacia por separado en cada estudio y en todos los estudios combinados. Los estudios no tuvieron una fase de detección. Así pues, en los estudios se incluyó a personas que habían estado expuestas a alguno de los tipos del VPH de la vacuna antes del ingreso. En términos generales, 73% de las participantes de 16 a 26 años de edad y 67% de las participantes de 24 a 45 años de edad nunca habían estado expuestas a ninguno de los 4 tipos de VPH al ingreso. Las participantes que nunca habían estado expuestas continuaron en riesgo de contraer infecciones y enfermedades causadas por los cuatro tipos de VPH presentes en la vacuna. De las participantes de 24 a 45 años de edad, sólo el 0.4% estuvieron expuestas a los 4 tipos de VPH presentes en la vacuna. Eficacia Profiláctica VPH tipos 6, 11, 16 y 18 en niñas y mujeres de 16 a 26 Años de Edad GARDASIL fue sumamente eficaz para reducir la incidencia de cánceres cervical; neoplasia intraepitelial cervical (de cualquier grado); de adenocarcinoma in situ; de cáncer cervical no invasor (NIC 3 y adenocarcinoma in situ); y de lesiones genitales externas, incluidos los condilomas acuminados causadas por el VPH tipos 6, 11, 16 y 18. Con base en un análisis pre especificado de las lesiones evidentes a partir de 30 días después de la primera dosis, se demostró que la vacuna ya era eficaz durante el curso del esquema de vacunación, de tres dosis. Los análisis primarios de eficacia, con relación al VPH tipos 6, 11, 16 y 18, se realizaron en la población de eficacia con por protocolo (PEPP), conformada por participantes que recibieron las 3 dosis de vacuna en el curso de 1 año después del
3 ingreso, no presentaron desviaciones importantes con respecto al protocolo del estudio y no habían estado expuestas (eran inmunológicamente "vírgenes") al tipo o tipos relevantes de VPH antes de la primera dosis y hasta un mes después de la tercera dosis (mes 7). La eficacia se midió a partir de la consulta del 7 mes. La eficacia de GARDASIL en contra de la NIC 2/3 o AIS relacionadas con el VPH 16 ó 18 fue de 98.2% (IC de 95%: 93.5%, 99.8%) al combinar los protocolos. Los análisis de cada uno de los protocolos demostraron los siguientes resultados: 100% (IC de 95%: 65.1%, 100.0%) en el Protocolo 005, 100% (IC de 95%: <0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 89.2%, 100.0%) en el FUTURE I y 96.9% (IC de 95%: 88.2%, 99.6%) en el FUTURE II. Se presentaron dos casos de NIC 3 que ocurrieron en el grupo que recibió GARDASIL. En el primer caso se detectaron el VPH 16 y el VPH 52. Este paciente fue infectado de manera crónica con el VPH 52 (infección en el Día 1, y meses 32.5 y 33.6) en 8 de 11 especímenes, incluyendo tejido que fue extirpado durante una escisión electro quirúrgica con asa (EEA). Se encontró VPH 16 en 1 de 11 especímenes en el Mes El VPH 16 no fue detectado en el tejido que fue extirpado durante la EEA. En el segundo caso, se detectaron VPH 16, VPH 51, y VPH 56. Este paciente fue infectado con VPH 51 (infección detectada por PCR en el día 1) en 2 de 9 especímenes. VPH 56 fue detectado (en tejido extirpado durante una EEA) en 3 de 9 especímenes en el Mes 52. VPH 16 fue detectado en 1 de 9 especímenes por biopsia en el mes 51. Dado que estos casos ocurrieron en el contexto de una infección mixta, con el tipo dominante no presente en la vacuna de VPH, parece ser que el tipo relacionado con la vacuna de VPH no fue la causa del tipo de VPH. Con base a esta evaluación, puede deducirse que la eficacia de la vacuna contra la NIC 2/3 o AIS relacionada con el VPH 16/18 fue de 100%. La eficacia de GARDASIL contra NIC 2/3 o AIS relacionada con el VPH 16 fue de 97.9% (I C de 95%: 92.3%, 99.8%) al combinar los protocolos. La eficacia de GARDASIL contra NIC 2/3 o AIS relacionada con el VPH 18 fue de 100% (IC de 95%: 86.6%, 100%) al combinar los protocolos. La eficacia de GARDASIL contra la NIC (NIC 1, NIC 2/3) o AIS relacionados con el VPH 6, 11, 16 ó 18 fue de 96.0% (IC de 95%: 92.3%, 98.2%) al combinar los protocolos. El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:<0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 95.1%, 100.0%) en el FUTURE I y 93.8% (IC de 95%: 88.0%, 97.2%) en el FUTURE II. La eficacia de GARDASIL contra las lesiones genitales relacionadas con el VPH 6, 11, 16 ó 18 fue de 99.1% (IC de 95%: 96.8%, 99.9%) al combinar los protocolos. El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:<0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 94.9%, 100.0%) en el FUTURE I y 98.7% (IC de 95%: 95.2%, 99.8%) en el FUTURE II. La eficacia de GARDASIL contra las verrugas genitales relacionadas con el VPH 6 y 11 fue de 99.0% (IC de 95%: 96.2%, 99.9%) al combinar los protocolos. En el estudio de extensión a largo plazo FUTURE III, para las mujeres de 16 a 26 años de edad, en la población PEPP vacunadas con GARDASIL en el estudio base y seguidas en la fase de extensión, no se observaron casos de enfermedades por VPH, (NIC relacionada con VPH tipos 6/11/16/18 de cualquier grado o verrugas genitales) hasta aproximadamente 8 años. En este estudio de extensión, las mujeres serán objeto de seguimiento hasta por 14 años. Análisis Complementario de Eficacia para los Puntos Finales del Cáncer en niñas y mujeres de 16 a 26 Años de Edad En un análisis complementario, la eficacia de GARDASIL fue evaluada contra el cáncer cervical (NIC 2/3 y AIS) Etapa 0 de acuerdo con la FIGO relacionado con el VPH 16/18 en la PEPP y en la población modificada por intención de tratar-2 (PMIT-2). La PMIT-2 consistió en pacientes que no habían sido expuestos al tipo o tipos relevantes de VPH (tipos 6, 11, 16 y 18) antes de la dosis 1, que recibieron por lo menos una dosis de la vacuna o placebo, y que tuvieron por lo menos una visita de seguimiento después del Día 30. La población PMIT-2 fue diferente a la PEPP en que la primera incluye individuos con violaciones importantes al protocolo y que se infectaron con un tipo incluido en la vacuna durante el periodo de vacunación. La eficacia se midió comenzando 30 días Postdosis 1 para la población PMIT-2. La eficacia de GARDASIL contra enfermedad relacionada con el VPH 16/18 fue de 96.9% (IC de 95%: 88.4%, 99.6%) y 100% (IC de 95%: 30.6%, 100.0%) para NIC 3 y AIS respectivamente, en la PEPP. La eficacia de GARDASIL en contra de enfermedad relacionada con el VPH 16/18 fue de 96.7% (IC de 95%: 90.2%, 99.3%) y 100% (IC de 95%: 60.0%, 100.0%) para NIC 3 y AIS respectivamente, en la PMIT-2. La eficacia profiláctica en contra de la infección persistente general o enfermedad en una fase de extensión del Protocolo 007, que incluyó datos desde el Mes 60, fue 95.8% (IC de 95%: 83.8%, 99.5%). En el grupo que recibió GARDASIL, no se observaron casos a pesar de la inmunidad decreciente. GARDASIL fue igualmente eficaz contra las enfermedades por el VPH causadas por los tipos de VPH 6, 11, 16 y 18. Eficacia en niñas y mujeres de 16 a 26 Años de Edad con Infección Actual o Previa con el VPH Tipos 6, 11, 16 y 18 Los individuos que ya estaban infectados con uno o más tipos de VPH relacionados con la vacuna antes de la vacunación fueron protegidos de la enfermedad clínica causada por los tipos de VPH remanentes. Los individuos con evidencia de una infección previa que decidieron vacunarse al comienzo de la enfermedad fueron protegidos de una readquisición o recurrencia de la infección que los llevara a enfermedad clínica.
4 Los individuos que recibieron GARDASIL, pero que tenían infección en curso por el VPH al momento de la vacunación, tuvieron un 21.6% (IC de 95%: <0.0%, 42.1%) menos incidencia de NIC (NIC 1 o NIC 2/3) o AIS como resultado de esta infección al compararse con placebo. La infección en curso se definió como una infección de un tipo de VPH contenido en la vacuna al momento de la inclusión, pero sin evidencia de respuesta inmune a la misma. Protección en Contra de la Carga General de Enfermedad Cervical por VPH en niñas y mujeres de 16 a 26 Años de Edad. El impacto de GARDASIL en contra del riesgo general de enfermedad cervical causado por el VPH (p. ej., enfermedad causada por cualquier tipo de VPH) fue evaluado en un análisis pre especificado en 17,599 sujetos incluidos en el FUTURE I y FUTURE II. Se realizaron análisis posteriores de eficacia en 2 poblaciones clínicas relevantes: (1) una población nunca antes expuesta al VPH (con resultado negativo a 14 tipos comunes de VPH y que tuvo una prueba de Papanicolaou con resultado negativo para LICE [lesiones intraepiteliales de células escamosas] en el Día 1), la cual asemejaba una población de adolescentes y mujeres jóvenes adultas sin experiencia sexual previa más mujeres jóvenes adultas poco después de su iniciación sexual; y (2) la población general del estudio de mujeres jóvenes adultas sin importar su estado de VPH inicial, algunas de ellas con enfermedad relacionada con el VPH al comienzo de la vacunación. Entre las mujeres sin exposición previa al VPH y entre la población general del estudio (incluyendo mujeres con infección por VPH al comienzo de la vacunación), GARDASIL redujo la incidencia general de NIC 2/3 o AIS; o NIC (de cualquier grado) o AIS; y de verrugas genitales. Estas reducciones se debieron principalmente a reducciones en las lesiones causadas por el VPH tipos 6, 11, 16 y 18. Entre los pacientes sin exposición previa y la población general del estudio, el beneficio de la vacuna con respecto a la incidencia general de NIC 2/3 o AIS más aparente conforme transcurrió el tiempo. Lo anterior debido a que GARDASIL no tiene un impacto sobre la evolución de las infecciones que estén presentes al comienzo de la vacunación. Dichas mujeres infectadas pueden tener NIC 2/3 o AIS al comienzo de la vacunación y algunas desarrollarán NIC 2/3 o AIS durante el seguimiento. GARDASIL reduce la incidencia de NIC 2/3 o AIS causadas por infecciones por el VPH tipos 6, 11, 16 y 18, que ocurran después del comienzo de la vacunación. GARDASIL no ha demostrado proteger contra enfermedades causadas por cada tipo de VPH, y no tratará la enfermedad preexistente. La eficacia general de GARDASIL variará con la prevalencia inicial de la infección y enfermedad por VPH, la incidencia de la infección en contra de las cuales GARDASIL ha demostrado protección, y en aquellas infecciones en contra de las cuales GARDASIL no ha demostrado proteger. Impacto en las Tasas de Anormalidades de la Prueba de Papanicolaou y en Procedimientos Cervicales en niñas y mujeres de 16 a 26 Años de Edad El impacto de GARDASIL en las tasas de pruebas de Papanicolaou y procedimientos cervicales (biopsia colposcópica, terapia definitiva) independientemente de los tipos de VPH causantes fue evaluada en 18,150 sujetos incluidos en el Protocolo 007, el FUTURE I y FUTURE II. El impacto de GARDASIL en las tasas de procedimientos de extirpación quirúrgica para tratar las lesiones causadas por cualquier tipo de VPH fue evaluado en 5,455 sujetos incluidos en el FUTURE I. Se consideraron dos poblaciones: (1) una población sin exposición previa al VPH (con resultado negativo a 14 tipos comunes de VPH y que tuvieron una prueba de Papanicolaou que fue negativa a LICE [lesión intraepitelial de células escamosas] en el Día 1), la cual asemejaba una población de adolescentes y mujeres jóvenes adultas sin experiencia sexual previa más mujeres jóvenes adultas poco después de su iniciación sexual; y (2) la población general del estudio de mujeres jóvenes adultas sin importar su estado de VPH inicial, algunas de ellas con enfermedad relacionada con el VPH al comienzo de la vacunación. En ambas poblaciones, GARDASIL redujo las proporciones de mujeres que experimentaron una anormalidad en la prueba de Papanicolaou sugerente de NIC, una biopsia colposcópica, un procedimiento de tratamiento cervical definitivo (escisión electro quirúrgica con asa o conización por criocirugía). En resumen, la administración de GARDASIL a la población general de mujeres de 16 a 26 años de edad expuesta a VPH redujo la incidencia de anormalidades en la prueba de papanicolaou (ASCUS positivas, LICE de bajo grado, o peores) relacionadas con el VPH 16 y 18 en 92.4% (IC de 95%: 83.7, 97.0) y 96.9% (IC de 95%: 81.6, 99.9%) en el estudio FUTURE I. Eficacia Profiláctica - VPH tipos 6, 11, 16 y 18 - en niñas y mujeres de 24 a 45 Años de Edad No ha sido definido un nivel mínimo de anticuerpos antivph que proporcione protección contra VPH. Asimismo, las respuestas inmunes a las vacunas en personas mayores de edad son comúnmente más bajas comparadas con las de los jóvenes. Por lo tanto, para confirmar la utilidad de GARDASIL para prevenir cáncer cervical y enfermedades relacionadas causadas por los tipos objetivo de la vacuna en mujeres de hasta 45 años de edad, se realizó un estudio de eficacia (FUTURE III). GARDASIL fue muy eficaz en reducir la incidencia de infección persistente; NIC (cualquier grado); lesiones genitales externas (LGE) causadas por los tipos de VPH 6, 11, 16, y 18. GARDASIL fue también muy eficaz en reducir la incidencia de VPH 16/18 relacionada con el diagnóstico por prueba de Papanicolaou de ASCUS (células escamosas atípicas de significado indeterminado) positivas para alto riesgo de VPH. Los análisis primarios de eficacia, con respecto a los tipos de VPH 6, 11, 16, y 18, fueron conducidos en la PEPP. La eficacia fue medida al inicio después de la visita 7 del Mes.
5 La eficacia de GARDASIL contra VPH 6-, 11-, 16- ó 18- relacionados con infección persistente, NIC (cualquier grado) o LGE fue de 88.7% (IC de 95%: 78.1%, 94.8%). La eficacia de GARDASIL contra VPH 16- ó 18- relacionados con infección persistente, NIC (cualquier grado), o LGE fue de 84.7% (IC de 95%: 67.5%, 93.7%). Hubo 1 caso de NIC 2 (VPH 16 y VPH 51 identificados) en el grupo de PEPP. El caso NIC 2 fue positivo para VPH tipos 16 y 51 mediante biopsia en el Mes 18. Los 9 casos remanentes en el grupo PPE fueron puntos terminales de infección persistente. La eficacia de GARDASIL contra infección persistente relacionada con VPH 6-, u 11-, NIC (cualquier grado) o LGE fue de 94.8% (IC de 95%: 79.9%, 99.4%). La eficacia de GARDASIL contra diagnóstico por papanicolaou de ASCUS positivas relacionadas con VPH 16/18 fue de 96.3% (IC de 95%: 77.7%, 99.9%). Con base en la eficacia de estos hallazgos, puede deducirse la eficacia de GARDASIL con respecto a la prevención de cáncer cervical y enfermedades relacionadas en mujeres de hasta 45 años de edad. En el estudio de extensión a largo plazo FUTURE III, para las mujeres de 24 a 45 años de edad, en la población PEPP vacunadas con GARDASIL en el estudio base y seguidas en la fase de extensión, no se observaron casos de enfermedades por VPH, (NIC relacionada con VPH tipos 6/11/16/18 de cualquier grado o verrugas genitales) hasta aproximadamente 6 años. En este estudio de extensión, las mujeres serán objeto de seguimiento hasta por 10 años. Inmunogenicidad Análisis para medir la Respuesta Inmune Análisis específicos de tipo con estándares específicos de tipo fueron utilizados para evaluar la inmunogenicidad contra cada tipo de VPH de la vacuna. Estos inmunoensayos competitivos multiplexados Luminex (clia) midieron anticuerpos contra epítopos neutralizantes para cada tipo de VPH, en lugar de los anticuerpos totales dirigidos contra las partículas parecidas al virus de la vacuna. Las escalas para los análisis son únicas para cada tipo de VPH; por lo tanto, las comparaciones entre tipos y con otros análisis carecen de significado. Se demostró que los análisis empleados para medir la respuesta inmune a GARDASIL se correlacionaron con la capacidad para neutralizar los viriones vivos de VPH. Debido a la gran eficacia de GARDASIL en los estudios clínicos, no ha sido posible establecer los niveles mínimos de anticuerpos anti-vph 6, anti- VPH 11, anti-vph 16 y anti-vph 18 que protegen contra la enfermedad manifiesta por VPH. La inmunogenicidad de GARDASIL se evaluó en 23,951 de mujeres y niñas de 9 a 45 años de edad (GARDASIL, N = 12,634; placebo, N = 11,317). Los análisis primarios de inmunogenicidad se llevaron a cabo en una población de inmunogenicidad con apego al protocolo (IAP). Esta población consistió en individuos que eran seronegativos y tenían una reacción en cadena de la polimerasa (RCP) negativa para el tipo o tipos relevantes de VPH a su ingreso, que mantuvieron una RCP negativa para el tipo o tipos relevantes de VPH hasta un mes después de la tercera dosis (Mes 7), que recibieron las tres dosis de vacuna y que no se desviaron del protocolo del estudio de alguna manera que pudiera interferir con los efectos de la vacuna. La inmunogenicidad fue medida por (1) el porcentaje de pacientes que fueron seropositivos para anticuerpos contra los tipos relevantes de la vacuna de VPH, y (2) los Títulos Geométricos Promedio (TGP). La Respuesta Inmune a GARDASIL en el Mes 7 en niñas y mujeres de 9 a 45 años de edad (Punto en el Tiempo Aproximado al Pico Máximo de Inmunogenicidad) En la población de inmunogenicidad por protocolo (PIPP) en mujeres de 9 a 45 años de edad, la seropositividad en el Mes 7 fluctuó de 96.4% a 99% a través de los 4 tipos de la vacuna y a través de las poblaciones definidas por rango de edad. Los TGPs de los niveles de anticuerpos antivph para todos los tipos disminuyeron con la edad. La disminución máxima fue observada entre 9- a 17- y 18- a 26- años de edad. Este hallazgo era de esperarse, ya que las respuestas inmunes a las vacunas generalmente disminuyen con la edad de la vacunación. La eficacia de GARDASIL permaneció alta a pesar de la disminución observada en los TGPs antivph relacionados con la edad. Adicionalmente, no hubo casos de avance en la enfermedad relacionada con VPH tipo 18 debido a inmunidad menguante ocurrida en los estudios clínicos. Comparación de la eficacia de GARDASIL en los adultos jóvenes y en los adolescentes Un estudio clínico comparó las respuestas contra el VPH-6, el VPH-11, el VPH-16 y el VPH-18 niñas de 10 a 15 años de edad con las respuestas en mujeres adolescentes y adultas jóvenes de 16 a 23 años de edad. Entre los individuos que recibieron GARDASIL, 99.1% a 100% se volvieron seropositivos contra el VPH-6, el VPH-11, el VPH-16 y el VPH-18, respectivamente, al término de un mes después de la tercera dosis. Las respuestas anti-vph, en niñas de 10 a 15 años de edad, fueron significativamente superiores a las observadas en las mujeres de 16 a 23 años de edad.
6 Se observaron resultados similares en una comparación de las respuestas anti-vph un mes después de la tercera dosis en niñas de 9 a 15 años de edad con las respuestas anti-vph en mujeres adolescentes y adultas jóvenes de 16 a 23 años de edad, en la base de datos combinada de los estudios de inmunogenicidad de GARDASIL. Con base en la comparación de la inmunogenicidad, la eficacia de GARDASIL en niñas de 9-15 años es comparable a la eficacia de GARDASIL observada en mujeres entre los 16 y los 26 años. En el estudio de extensión a largo plazo del Protocolo 018, para niñas de 9 a 15 años de edad vacunados con GARDASIL en el estudio base y seguidos en la fase de extensión, no se observaron casos de enfermedades por VPH (NIC relacionadas con VPH tipos 6/11/16/18 de cualquier grado y/o verrugas genitales) después de una mediana de seguimiento de aproximadamente 6,9 y 6,5 años, respectivamente. En este estudio de extensión, las niñas serán objeto de seguimiento hasta por 10 años. Persistencia de la respuesta inmune a GARDASIL La duración de la inmunidad después de un programa completo de inmunización con GARDASIL no se ha establecido. En el Protocolo 007, las TGP máximas anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 se observaron al Mes 7. Los TGP disminuyeron durante el Mes 24 y después generalmente se estabilizaron hasta al menos el Mes 60 (ver Figura 1). Un subconjunto de sujetos reclutados en los estudios fase III fue seguido por un período prolongado para la seguridad, inmunogenicidad y eficacia. Se usó el Inmunoensayo IgG Total Luminex (IgG LIA) para evaluar la persistencia de la respuesta inmune, adicionalmente a clia. En todas las poblaciones (mujeres 9-45 años), las TGP máximas anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 por clia se observaron al Mes 7. Posteriormente, las TGP disminuyeron durante los Meses y luego generalmente se estabilizaron. Actualmente se está estudiando la duración exacta de la inmunidad después de una serie de 3 dosis. Las niñas vacunadas con GARDASIL a los 9-15 años de edad en el estudio base Protocolo 018 se seguirán para determinar la persistencia de la inmunidad hasta por 10 años en un estudio de extensión. Dependiendo del tipo de VPH, 64-97% y % de los sujetos fueron seropositivos por clia e IgG LIA, respectivamente, 8 años después de la vacunación. Figura 1 Persistencia de las Respuestas Anti-VPH Después de Aplicar un Esquema de 3-dosis de GARDASIL Persistencia de las Respuestas AntiVPH 6 Persistencia de las Respuestas AntiVPH 11
7 Persistencia de las Respuestas AntiVPH 16 Persistencia de las Respuestas AntiVPH 18 Las mujeres vacunadas con GARDASIL a años de edad en el estudio base FUTURE II serán sometidas a seguimiento hasta por 14 años en un estudio de extensión. Nueve años después de la vacunación, 94%, 96%, 99% y 60% eran seropositivas para anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 en el clia, respectivamente, y 98%, 96%, 100% y 91% eran seropositivas para anti-hpv6, anti-vph 11, anti-vph 16 y anti-vph 18 en el IgG LIA, respectivamente. Las mujeres vacunadas con GARDASIL a años de edad en el estudio base FUTURE III serán objeto de seguimiento hasta por 10 años en un estudio de extensión. Seis años después de la vacunación, 89%, 92%, 97% y 45% eran seropositivas para anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 en el clia, respectivamente, y 88%, 84%, 100% y 82% eran seropositivas para anti-hpv6, anti-vph 11, anti-vph 16 y anti-vph 18 en el IgG LIA, respectivamente. En estos estudios de seguimiento a más largo plazo en mujeres de 16 a 45 años, los sujetos que eran seronegativos para anti-vph 6, anti-vph 11, anti-vph 16 y VPH-18 en el clia, al final del estudio, aún estaban protegidos contra la enfermedad clínica después de un seguimiento de 9 años para las mujeres de años de edad, 6 años para las mujeres de años de edad. Evidencia de respuesta anamnésica (memoria inmunológica) Se observó evidencia de una respuesta anamnésica en individuos vacunados que eran seropositivos a los tipos relevantes del VPH antes de la vacunación. En un estudio para evaluar la capacidad de inducir memoria inmunológica, a los individuos que recibieron una serie primaria de 3 dosis de la vacuna se les administró una dosis de refuerzo de GARDASIL 5 años después de la primovacunación. Estos individuos exhibieron una respuesta anamnésica rápida y fuerte que superó las TGP anti-vph observadas 1 mes después de la dosis 3 (Mes 7). Las TGP 1 semana después de la dosis de refuerzo fueron 0,9; 2,2; 1,2 y 1,4 veces más altas que las TGP después de la dosis 3 para los tipos 6, 11, 16 y 18, respectivamente. Las TGP 1 semana después de la dosis de refuerzo fueron 1,3; 4,2; 1,5 y 1,7 veces más altas que las TGP después de la dosis 3 para los tipos 6, 11, 16 y 18, respectivamente. A 1 semana después de la dosis de refuerzo, 87,2%, 94,9%, 86,4% y 95,2% de los individuos tenían GMT anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 superiores a las detectadas en el Mes 60. Además, un subgrupo de individuos que recibieron una serie primaria de 3 dosis de la vacuna se convirtieron nominalmente seronegativos para anti-vph 18 al Mes 60. Aunque estos individuos eran nominalmente seronegativos para anti-vph 18, no se detectaron casos de enfermedades relacionadas con el VPH 18 entre estos individuos. Estos sujetos también exhibieron memoria inmunológica: cuando se les dio una dosis de refuerzo de GARDASIL (el Mes 60), 93% y 97% se hicieron seropositivos para anti-vph 18 a 1 semana y 1 mes después del refuerzo, respectivamente; 73% tenían niveles de VPH 18 a 1 mes después de la estimulación que fueron mayores a su nivel de anti-vph 18 al Mes 7 (1 mes después de la dosis 3). Flexibilidad del esquema Todos los individuos evaluados en las poblaciones PEPP de los estudios de Fase II y III recibieron el esquema de tres dosis de GARDASIL en el transcurso de un año, independientemente del intervalo entre las dosis. Un análisis de los datos sobre la respuesta inmune sugiere que la flexibilidad de ±1 mes para la segunda dosis (es decir, del mes 1 al mes 3 en el esquema de vacunación) y la flexibilidad de ±2 meses para la tercera dosis (es decir, del mes 4 al mes 8 en el esquema de vacunación) no influye sustancialmente en las respuestas inmunes a GARDASIL (véase VI. POSOLOGIA Y ADMINISTRACIÓN). Respuestas inmunes a GARDASIL con un esquema de 2 dosis Un ensayo clínico mostró que, en el mes 7, la respuesta inmunitaria en niñas de 9 a 13 años (n = 259) que recibieron 2 dosis de GARDASIL (a los 0, 6 meses) no fue inferior a la respuesta inmune en mujeres mayores de 16 años - 26 años (n =
8 310) que recibieron 3 dosis de GARDASIL (a los 0, 2, 6 meses). No se ha establecido la duración de la protección de un esquema de 2 dosis de GARDASIL. Estudios con otras vacunas La seguridad y la inmunogenicidad de la administración simultánea de GARDASIL con la vacuna contra la hepatitis B (recombinante) (en la misma fecha, pero inyectada en distintos sitios) se evaluaron en un estudio con distribución al azar de 1,871 mujeres que tenían entre 16 a 24 años al ingreso. La respuesta inmune y el perfil de seguridad, tanto de la vacuna contra la hepatitis B (recombinante) como de GARDASIL, fueron similares cuando se les administró en la misma fecha o en fechas distintas. Vacuna contra hepatitis B (recombinante) La seguridad e inmunogenicidad de la co-administración de GARDASIL con la vacuna contra hepatitis B (recombinante) (en la misma visita, sitios separados de inyección) fueron evaluadas en un estudio randomizado de 1,871 mujeres entre 16 y 24 años de edad en el momento del enrolamiento. La respuesta inmune y el perfil de seguridad para ambas vacunas contra Hepatitis B (recombinante) y GARDASIL fueron similares incluso al ser administradas en la misma visita o en diferentes visitas. Vacuna contra Difteria, Tetanos, Pertussis (componente acelular) y Poliomielitis (Vacuna que contiene antigenos inactivados reducidos adsorbidos) La seguridad e inmunogenicidad de la co-administración de GARDASIL con la vacuna contra difteria, tetanos, pertussis y vacuna de Polio (en la misma visita, sitios separados de inyección) fueron evaluadas en un estudio randomizado de niñas de 11 a 17 años de edad al momento del enrolamiento. La administración concomitante de GARDASIL con la vacuna contra difteria, tetanos, pertussis y vacuna de Polio no interfiere con la respuesta de los anticuerpos a alguno de los componentes de la vacuna. Adicionalmente, el perfil de seguridad fue generalmente similar. Vacuna conjugada Meningococo (Grupos A, C, Y y W-135) y Toxoide de Difteria y Vacuna adsorbida de Toxoide de Tétanos, Toxoide reducido de Difteria y Pertussis acelular La seguridad e inmunogenicidad de la coadministración de GARDASIL con la vacuna conjugada Meningococo, toxoide de difteria y la Vacuna adsorbida de toxoide de tétanos, toxoide reducido de difteria y pertussis acelular (la misma visita, sitios separados de inyección) fueron evaluadas en un estudio randomizado de niñas de 11 a 17 años de edad en el momento del enrolamiento. La administración concomitante de GARDASIL con la vacuna conjugada Meningococo, toxoide de difteria y la Vacuna adsorbida de toxoide de tétanos, toxoide reducido de difteria y pertussis acelular no interfiere con la respuesta de los anticuerpos a alguno de los componentes de estas vacunas. Adicionalmente el perfil de seguridad fue generalmente similar. V. INDICACIONES GARDASIL es una vacuna indicada en niñas y mujeres de 9 a 45 años para la prevención de cáncer cervical y lesiones precancerosas o displásicas, verrugas genitales, e infección causada por los tipos de Virus de Papiloma Humano (VPH) que son el objetivo de la vacuna. GARDASIL está indicada para prevenir las siguientes enfermedades: Cáncer de cuello uterino causado por VPH tipos 16 y 18 Verrugas genitales (condiloma acuminado) causadas por VPH tipos 6 y 11 Además de prevenir las siguientes lesiones precancerosas o displásicas causadas por VPH tipos 6, 11, 16 y 18: GARDASIL está indicada para la prevención de lo siguiente causado por VPH 6, 11, 16 y 18: Neoplasia intraepitelial cervical (NIC) grado 2 y 3 Adenocarcinoma cervical in situ (AIS) Neoplasia Intraepitelial Cervical (NIC) grado 1 VI. POSOLOGIA Y ADMINISTRACIÓN Dosificación GARDASIL se debe administrar intramuscularmente como 3 dosis separadas de 0.5 ml de acuerdo con el siguiente programa: Primera dosis: en la fecha elegida Segunda dosis: 2 meses después de la primera dosis Tercera dosis: 6 meses después de la primera dosis Se anima a que los individuos cumplan un programa de vacunación de 0, 2, y 6 meses. Sin embargo, en estudios clínicos, se ha demostrado la eficacia en individuos que recibieron las 3 dosis en un periodo de 1 año. La segunda dosis se deberá administrar al menos 1 mes después de la primera dosis, y la tercera dosis se deberá administrar al menos 3 meses después de la segunda dosis. Las tres dosis deben ser administradas dentro de un período de 1 año.
9 Alternativamente, en individuos de 9 hasta 13 años de edad, GARDASIL puede ser administrado de acuerdo a un esquema de 2 dosis (0, 6 meses o 0, 12 meses). El uso de GARDASIL debe estar de acuerdo con las recomendaciones oficiales. Se recomienda que los individuos que reciben una primera dosis de GARDASIL completen el curso de la vacunación con GARDASIL. La necesidad de una dosis de refuerzo no ha sido establecida. Método de Administración GARDASIL se deberá administrar intramuscularmente en la región deltoide del brazo o en el área anterolateral superior del muslo. GARDASIL no se debe inyectar intravascularmente. Tampoco han sido objeto de estudio la administración subcutánea ni intradérmica. Estos métodos de administración no son recomendados. La jeringa prellenada es sólo para un único uso y no se deberá usar para más de un individuo. Para viales de uso único se debe usar una jeringa y aguja estéril individual para cada individuo. La vacuna se deberá usar tal cual se suministra; no es necesario dilución ni reconstitución. Se deberá usar la dosis completa recomendada de la vacuna. Agitar bien antes de usar. Es necesario agitar bien inmediatamente antes de la administración para mantener la suspensión de la vacuna. Después de agitar bien, GARDASIL es un líquido blanco, turbio. Los productos parenterales del fármaco deberán ser inspeccionados visualmente antes de su administración, con respecto a materia particulada y decoloración. Desechar el producto si existen materias particuladas o si existe decoloración. Uso de Vial de Dosis Única Retirar la dosis de la vacuna de 0.5 ml del vial de dosis única usando una aguja y jeringa estéril libre de preservantes, antisépticos, y detergentes. Una vez que el vial de dosis única ha sido penetrado, la vacuna extraída se deberá usar inmediatamente, y el vial se deberá desechar. Uso de Jeringa Prellenada Inyectar todo el contenido de la jeringa. VII. CONTRAINDICACIONES Hipersensibilidad a las sustancias activas o a cualquiera de los excipientes de la vacuna. Los individuos que desarrollen síntomas indicativos de hipersensibilidad después de recibir una dosis de GARDASIL no deben recibir más dosis de GARDASIL. VIII. PRECAUCIONES Y ADVERTENCIAS General Como es el caso de cualquier vacuna, la vacunación con GARDASIL puede no producir protección en todos los receptores de la vacuna. GARDASIL está indicado únicamente para uso profiláctico y no tiene efecto sobre las infecciones por VPH activas o sobre la enfermedad clínica ya existente; no ha demostrado tener un efecto terapéutico. Esta vacuna no está destinada para ser usada para el tratamiento de lesiones genitales externas activas, o cáncer de cuello uterino, vulvar, vaginal,; NIC, NIV, NIVa. Tampoco está indicada para prevenir la progresión de otras lesiones relacionadas con el VPH prexistentes. GARDASIL solo protege frente a las enfermedades causadas por los tipos 6, 11, 16 y 18 del VPH y hasta cierto grado frente a las enfermedades causadas por ciertos tipos del VPH relacionados. Por lo tanto, se deben continuar utilizando las precauciones apropiadas frente a las enfermedades de transmisión sexual. La vacunación no es un sustituto del cribado rutinario del cuello uterino. Como ninguna vacuna es efectiva 100% y GARDASIL no proporciona protección frente a todos los tipos del VPH, o frente a infecciones por VPH prexistentes, la importancia del cribado rutinario sigue siendo crucial. Esta vacuna no protegerá contra enfermedades que no son causadas por VPH.
10 Como sucede con todas las vacunas inyectables, siempre deberá estar fácilmente disponible un tratamiento médico apropiado en caso de reacciones anafilácticas raras después de la administración de la vacuna. Sincope (Desmayos) pueden presentarse después de la vacunación, especialmente en adolescentes y adultos jóvenes. El sincope algunas veces asociado con caídas, se ha presentado después de la vacunación con GARDASIL, por lo tanto, se debe realizar observación cuidadosa de los pacientes por 15 minutos después de la aplicación de GARDASIL (Ver Efectos Adversos, Reportes Post-comercialización). La decisión para administrar o retrasar la vacunación debido a una enfermedad febril actual o reciente depende en gran medida de la gravedad de los síntomas y su etiología. La fiebre baja y la infección leve de las vías respiratorias superiores generalmente no son contraindicaciones para la vacunación. Los individuos con respuesta inmunitaria deficiente, ya sea por el uso de terapia inmunosupresora, un defecto genético, infección por el Virus de Inmunodeficiencia Humana (VIH), u otras causas, podrían tener reducida la respuesta de los anticuerpos a la inmunización activa (ver INTERACCIONES). Esta vacuna deberá administrarse con precaución a los individuos con trombocitopenia o algún trastorno de coagulación debido a que puede ocurrir hemorragia después de la administración intramuscular en estos individuos. IX. EFECTOS ADVERSOS Estudios Clínicos En 7 estudios clínicos (6 controlados con placebo), los individuos recibieron GARDASIL o placebo el día del enrolamiento y aproximadamente 2 y 6 meses después. GARDASIL demostró un perfil de seguridad favorable cuando se comparó con placebo (que contiene aluminio o no). Algunos individuos (0.2%) descontinuaron debido a eventos adversos. En todos los estudios clínicos excepto uno, la seguridad se evaluó usando vigilancia asistida por la cartilla de vacunación (VRC, por sus siglas en inglés) durante 14 días después de cada inyección de GARDASIL o placebo. Los individuos que fueron monitoreados usando vigilancia asistida por VRC incluyeron 6996 niñas y mujeres entre 9 y 45 años que recibieron GARDASIL y 7995 individuos que recibieron placebo. Se observaron los siguientes eventos adversos relacionados con la vacuna entre los receptores de GARDASIL a una frecuencia de al menos 1.0% y también a una frecuencia mayor a aquella observada entre los receptores de placebo, se listan de acuerdo a la frecuencia y el sistema de clasificación de órganos. La clasificación por frecuencia es como sigue: Muy común ( 1/10); Común ( 1/100, <1/10); Poco Común ( 1/1,000, <1/100); Raro ( 1/10,000, <1/1,000); Muy Raro (<1/10,000) Experiencias Adversas Clínicas Relacionadas en niñas y mujeres de 9-45 años Desórdenes del sistema nervioso Muy común: dolor de cabeza Común: mareos Desórdenes Gastrointestinales Común: nausea Desórdenes Músculo esqueléticos y del tejido conectivo Común: dolor en extremidad Trastornos generales y condiciones del lugar de administración Muy Común: pirexia, Las siguientes reacciones en el lugar de la inyección ocurrieron con una mayor incidencia en el grupo que recibió GARDASIL comparado con el grupo de placebo que contiene adyuvante aluminio amorfo de sulfato hidroxifosfato o el grupo de placebo de solución salina. Muy común: eritema, dolor, e hinchazón. Comunes: prurito y hematoma. La mayoría de reacciones en el lugar de la inyección fueron leves a moderadas. Asimismo, el broncoespasmo fue muy raramente reportado como un evento adverso serio. Administración concomitante con otras vacunas La seguridad de GARDASIL cuando se administró concomitantemente con otras vacunas fue evaluada en estudios clínicos.
11 La frecuencia de experiencias adversas observadas con la administración concomitante con la vacuna de hepatitis B (recombinante) fue similar a la frecuencia cuando GARDASIL fue administrada sola. Hubo un incremento en dolor de cabeza e inflamación en el sitio de inyección cuando GARDASIL fue administrado concomitantemente con la vacuna (Difteria, Tetanos, Pertussis (componente acelular) y vacuna inactivada de Poliomielitis (contenido reducido de antígeno adsorbido). Hubo un incremento en la inflamación en el sitio de inyección cuando GARDASIL fue administrada concomitantemente con Meningococo (Grupo A, C, Y, y W-135), vacuna conjugada de difteria Toxoide Polisacárida y Toxoide Tetánico, Toxoide Difteria reducido y Vacuna Adsorbida de Pertussis Acelular (Tdap). La mayoría de estas experiencias adversas luego de la administración concomitante con otras vacunas fueron reportadas como de intensidad leve a moderada. Reportes de Post-comercialización Las siguientes experiencias adversas han sido reportadas espontáneamente durante el uso post-aprobación de GARDASIL. Debido a que estas experiencias adversas fueron reportadas voluntariamente de una población de tamaño incierto, no es posible estimar realmente su frecuencia o establecer la relación causal de exposición a la vacuna. Infecciones e infestaciones: Celulitis Desórdenes en el sistema circulatorio y linfático: Trombocitopenia púrpura idiopática, linfoadenopatía. Desórdenes del sistema nervioso: Encefalomielitis diseminada aguda, mareo, síndrome de Guillain-Barré, dolor de cabeza, síncope algunas veces acompañado de movimientos tónico-clónicos. Desórdenes gastrointestinales: náusea, vómito. Desórdenes Músculo esqueléticos y del tejido conectivo: artralgia, mialgia, Desórdenes Generales y del sitio de administración: Astenia, escalofríos, fatiga, debilidad. Desórdenes del sistema inmune: Hipersensibilidad incluyendo reacciones anafilácticas/anafilactoides, broncoespasmo y urticaria. X. EMBARAZO Y LACTANCIA Estudios en Ratas Hembras Estudios en animales no indican efectos dañinos directos o indirectos con respecto al embarazo, desarrollo embrionario/fetal, parto o desarrollo postnatal. GARDASIL indujo una respuesta de anticuerpos específica contra los tipos 6, 11, 16, y 18 de VPH en ratas embarazadas después de una o múltiples inyecciones intramusculares. Los anticuerpos contra los 4 tipos de VPH se transfirieron a la descendencia durante la gestación y posiblemente durante la lactancia. Estudios Clínicos en Humanos Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre son indicativos de la respuesta humana, se debe evitar el embarazo durante el régimen de vacunación para GARDASIL. En estudios clínicos, las mujeres se sometieron a la prueba de embarazo en orina antes de la administración de cada dosis de GARDASIL. Las mujeres que estaban embarazadas antes de terminar el régimen de 3 dosis de GARDASIL recibieron instrucciones de postergar la culminación de sus regímenes de vacunación hasta el término del embarazo. Dichos regímenes no estándares produjeron respuestas anti-vph 6, anti-vph 11, anti-vph 16, y anti-vph 18 después de la dosis 3 que fueron comparables con aquellas observadas en mujeres que recibieron un régimen de vacunación estándar de 0, 2, y 6 meses (ver POSOLOGIA Y ADMINISTRACIÓN). Durante las pruebas clínicas, 3819 mujeres (vacuna N= 1894 vs. placebo N= 1925) presentaron al menos un embarazo. En general, las proporciones de embarazos con un resultado adverso, definidas como el número combinado de abortos espontáneos, muerte fetal tardía y casos de anormalidades congénitas del número total de embarazos con resultados conocidos (y excluyendo terminaciones electivas), fueron 22.6% (446/1973) en individuos que recibieron GARDASIL y 23.1% (460/1994) en individuos que recibieron placebo. Se realizaron sub-análisis adicionales para evaluar los embarazos con inicio estimado dentro de los 30 días o más de 30 días de la administración de una dosis de GARDASIL o placebo. Para los embarazos con inicio estimado dentro de los 30 días de la vacunación, se observaron 5 casos de anomalía congénita en el grupo que recibió GARDASIL comparado con 1 caso de anomalía congénita en el grupo que recibió placebo. Por el contrario, en embarazos con inicio más de 30 días después de la vacunación, se observaron 40 casos de anomalía congénita en el grupo que recibió GARDASIL comparado con 33 casos de anomalía congénita en el grupo que recibió placebo. Los tipos de anomalías observados fueron consistentes (independientemente de cuando ocurrió el embarazo en relación con la vacunación) con aquellos generalmente observados en embarazos de mujeres en edades entre 16 a 45 años.
12 De este modo, no hay evidencia para sugerir que la administración de GARDASIL afecte de manera adversa la fertilidad, el embarazo, o los resultados en los niños. No se sabe si los antígenos o anticuerpos de la vacuna inducidos por la vacuna son excretados en la leche materna. GARDASIL se puede administrar a mujeres que amamantan. GARDASIL o placebo fueron dados a un total de 1133 madres que amamantan durante la relevante Fase III de los estudios clínicos. En estos estudios, los índices de eventos adversos en la madre y el lactante fueron comparables entre los grupos de vacunación. Asimismo, la inmunogenicidad de la vacuna fue comparable entre las madres que amamantan y las mujeres que no amamantan durante la administración de la vacuna. XI. USO PEDIATRICO La seguridad y eficacia de GARDASIL no se ha evaluado en niñas menores de 9 años. XII. PACIENTES EN EDAD AVANZADA La seguridad y eficacia de GARDASIL no se ha evaluado en adultos mayores de 45 años. XIII. OTRAS PROBLACIONES ESPECIALES La seguridad, inmunogenicidad y eficacia de GARDASIL no se ha evaluado por completo en individuos infectados por VIH. XIV. INTERACCIONES Uso con Otras Vacunas: Los resultados de los estudios clínicos indican que GARDASIL se puede administrar de manera concomitante (en un lugar diferente de aplicación de la inyección) con vacuna de Hepatitis B recombinante; Vacuna conjugada Meningococo (Grupos A, C, Y y W-135) y Toxoide de Difteria; Vacuna adsorbida de Toxoide de Tétanos, Toxoide reducido de Difteria y Pertussis acelular; Vacuna contra Difteria, Tetanos, Pertussis (componente acelular) y Vacuna de Poliomielitis inactivada (Vacuna que contiene antígenos inactivados reducidos adsorbidos). Uso con Medicamentos Comunes En estudios clínicos para niñas y mujeres (de 16 a 26 años), 11.9%, 9.5%, 6.9%, y 4.3% de los individuos usaron analgésicos, antinflamatorios, antibióticos, y preparaciones de vitaminas, respectivamente. En un estudio clínico en mujeres (de 24 a 45 años) 30.6%, 20.2%, 11.6%, y 7.5% de los individuos usaron analgésicos, antinflamatorios, antibióticos, y preparaciones de vitaminas, respectivamente. La eficacia, inmunogenicidad y seguridad de la vacuna no sufrieron impacto por el uso de estos medicamentos. Uso con Anticonceptivos Hormonales En estudios clínicos, 50.2% de mujeres (de 16 a 45 años) que recibieron GARDASIL usaron anticonceptivos hormonales. El uso de anticonceptivos hormonales al parecer no afectó las respuestas inmunitarias a GARDASIL. Uso con Esteroides En estudios clínicos de niñas y mujeres (de 16 a 26 años), 1.7% (n = 158), 0.6% (n = 56), y 1.0% (n = 89) de los individuos usaron inmunosupresores inhalados, tópicos y parenterales, respectivamente. En un estudio clínico en mujeres (de 24 a 45 años), 1.4% (n = 27) usaron corticosteroides para uso sistémico. Los corticosteroides fueron administrados cerca del tiempo de la administración de una dosis de GARDASIL. Estos medicamentos al parecer no afectaron las respuestas inmunitarias a GARDASIL. Muy pocos individuos en los estudios clínicos estaban tomando esteroides, y se presume que la cantidad de inmunosupresión fue baja. Uso con Medicamentos Inmunosupresores Sistémicos No existe información sobre el uso concomitante de inmunosupresores potentes con GARDASIL. Los individuos que reciben terapia con agentes inmunosupresores (dosis sistémicas de corticosteroides, antimetabolitos, agentes alquilantes, agentes citotóxicos) pueden no responder de manera óptima a la inmunización activa (ver PRECAUCIONES Y ADVERTENCIAS). XV. SOBREDOSIS Han habido informes de administración de dosis de GARDASIL superiores a las recomendadas. En general, el perfil de eventos adversos reportados con sobredosis fue comparable a las dosis únicas recomendadas de GARDASIL.
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Gardasil suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida).
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Gardasil suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida).
PI-GRD-I-082008-COLOMBIA GARDASIL
 1. NOMBRE DEL PRODUCTO Y DENOMINACIÓN COMÚN INTERNACIONAL DEL PRINCIPIO ACTIVO GARDASIL * [Vacuna Recombinante Tetravalente contra el Virus de Papiloma Humano (Tipos 6, 11, 16, 18)] 2. FORMA FARMACEUTICA
1. NOMBRE DEL PRODUCTO Y DENOMINACIÓN COMÚN INTERNACIONAL DEL PRINCIPIO ACTIVO GARDASIL * [Vacuna Recombinante Tetravalente contra el Virus de Papiloma Humano (Tipos 6, 11, 16, 18)] 2. FORMA FARMACEUTICA
GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE
 FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
PROSPECTO PARA EL PRESCRIPTOR
 PROSPECTO PARA EL PRESCRIPTOR SILGARD VPH VACUNA CUADRIVALENTE RECOMBINANTE CONTRA EL VIRUS DEL PAPILOMA HUMANO, TIPOS 6, 11, 16 Y 18 Suspensión inyectable - Vía intramuscular VENTA BAJO RECETA FÓRMULA
PROSPECTO PARA EL PRESCRIPTOR SILGARD VPH VACUNA CUADRIVALENTE RECOMBINANTE CONTRA EL VIRUS DEL PAPILOMA HUMANO, TIPOS 6, 11, 16 Y 18 Suspensión inyectable - Vía intramuscular VENTA BAJO RECETA FÓRMULA
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
Dra. Nayrin A. Súnico B.
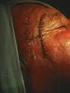 Dra. Nayrin A. Súnico B. Caracas, 14 de marzo de 2012 Introducción Cáncer de cuello uterino: 2da causa de cáncer en la mujer 2da causa de muerte en mujeres entre 14-44 años VPH con carcinoma de cuello
Dra. Nayrin A. Súnico B. Caracas, 14 de marzo de 2012 Introducción Cáncer de cuello uterino: 2da causa de cáncer en la mujer 2da causa de muerte en mujeres entre 14-44 años VPH con carcinoma de cuello
Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP
 Virus del Papiloma Humano Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP VPH: Agente ADN Virus de doble cadena Flia: Papillomaviridae Producen infección en tejidos estratificados de piel y mucosas de
Virus del Papiloma Humano Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP VPH: Agente ADN Virus de doble cadena Flia: Papillomaviridae Producen infección en tejidos estratificados de piel y mucosas de
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Ministerio de Salud y Protección Social República de Colombia
 Los Virus del Papiloma Humano y el Cáncer Cartilla de Preguntas y Respuestas (página Web) Qué es el cáncer de cuello uterino? Es una desorganización de las células que componen el cuello del útero, formando
Los Virus del Papiloma Humano y el Cáncer Cartilla de Preguntas y Respuestas (página Web) Qué es el cáncer de cuello uterino? Es una desorganización de las células que componen el cuello del útero, formando
Prevención del cáncer de cuello de útero
 Prevención del cáncer de cuello de útero Ref. 150/ Febrero 2008 Servicio de Ginecología ( )" " * " " +, % "- Gran Vía Carlos III 71-75 08028 Barcelona Tel. 93 227 47 00 Fax 93 418 78 32 info@dexeus.com
Prevención del cáncer de cuello de útero Ref. 150/ Febrero 2008 Servicio de Ginecología ( )" " * " " +, % "- Gran Vía Carlos III 71-75 08028 Barcelona Tel. 93 227 47 00 Fax 93 418 78 32 info@dexeus.com
VACUNA VPH. Dra Carlota Russ Pro-secretaria del Comité de Infectologia de la Sociedad Argentina de Pediatría
 VACUNA VPH Dra Carlota Russ Pro-secretaria del Comité de Infectologia de la Sociedad Argentina de Pediatría 1. Un matrimonio consulta con su hija de 11 años y pregunta cual vacuna le puede dar para protegerla
VACUNA VPH Dra Carlota Russ Pro-secretaria del Comité de Infectologia de la Sociedad Argentina de Pediatría 1. Un matrimonio consulta con su hija de 11 años y pregunta cual vacuna le puede dar para protegerla
CANCER DE CUELLO UTERINO. Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior
 CANCER DE CUELLO UTERINO Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior IMPORTANCIA Tras el cáncer de mama, el cáncer de cérvix es el cáncer femenino mundial más frecuente tanto en incidencia
CANCER DE CUELLO UTERINO Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior IMPORTANCIA Tras el cáncer de mama, el cáncer de cérvix es el cáncer femenino mundial más frecuente tanto en incidencia
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Gardasil, suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Gardasil, suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Cervarix suspensión inyectable Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Cervarix suspensión inyectable Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
Inmunizaciones. Vacunas Infantiles. Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Objetivo:
 Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
El sistema inmune y las vacunas
 SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad
 El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad No. DE AUTORIZACION: 093300201B1730 SSA El cáncer cérvico uterino P1 Dónde se
El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad No. DE AUTORIZACION: 093300201B1730 SSA El cáncer cérvico uterino P1 Dónde se
Vacuna contra la poliomielitis. (Comentarios a las fichas técnicas)
 Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
TÍTULO: Citología alterada
 Fecha: 13/11/2014 Nombre: Dra. Ana María Castillo Cañadas R4 Tipo de Sesión: Caso clínico TÍTULO: Citología alterada El cáncer de cérvix es la tercera neoplasia más frecuente entre las mujeres a nivel
Fecha: 13/11/2014 Nombre: Dra. Ana María Castillo Cañadas R4 Tipo de Sesión: Caso clínico TÍTULO: Citología alterada El cáncer de cérvix es la tercera neoplasia más frecuente entre las mujeres a nivel
FICHA TÉCNICA VAQTA. 1. Denominación distintiva VAQTA. 2. Denominación genérica Vacuna antihepatitis A inactivada
 1. Denominación distintiva 2. Denominación genérica Vacuna antihepatitis A inactivada 3. Composición cualitativa y cuantitativa Un mililitro de la vacuna contiene aproximadamente: 50 unidades (U) de antígeno
1. Denominación distintiva 2. Denominación genérica Vacuna antihepatitis A inactivada 3. Composición cualitativa y cuantitativa Un mililitro de la vacuna contiene aproximadamente: 50 unidades (U) de antígeno
DONDE SE APLICA. Región supra escapular izquierda. Peso Superior a 2000 gramos. Primeras 12 Horas de Vida.
 ESQUEMA ESQUEMA BASICO DE VACUNACION BCG VACUNA ENFERMEDAD PROTEGE Meningitis Tuberculosa EDAD DOSIS- REFUERZOS DE APLIACION Recién Nacido Dosis única HEPATITIS B Hepatitis B Recién nacido Muslo POLIO
ESQUEMA ESQUEMA BASICO DE VACUNACION BCG VACUNA ENFERMEDAD PROTEGE Meningitis Tuberculosa EDAD DOSIS- REFUERZOS DE APLIACION Recién Nacido Dosis única HEPATITIS B Hepatitis B Recién nacido Muslo POLIO
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Vacuna frente a Haemophilus influenzae tipo b
 Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
LA NUEVA VACUNA PARA LA PREVECIÓN DE LA INFECCIÓN POR VPH. Judit Morraja Nadal R-4 Ginecología-Obstetricia HMI-HIC
 LA NUEVA VACUNA PARA LA PREVECIÓN DE LA INFECCIÓN POR VPH Judit Morraja Nadal R-4 Ginecología-Obstetricia HMI-HIC VACUNA CONTRA VIRUS DE PAPILOMA HUMANO LCR L2 E6 E7 E5 E4 E2 E1 Un nuevo hito contra el
LA NUEVA VACUNA PARA LA PREVECIÓN DE LA INFECCIÓN POR VPH Judit Morraja Nadal R-4 Ginecología-Obstetricia HMI-HIC VACUNA CONTRA VIRUS DE PAPILOMA HUMANO LCR L2 E6 E7 E5 E4 E2 E1 Un nuevo hito contra el
PRIMERA REUNION NACIONAL DE HEPATITIS B y C. Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud
 PRIMERA REUNION NACIONAL DE HEPATITIS B y C Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud Misión: Protección de la población chilena frente a enfermedades inmunoprevenibles
PRIMERA REUNION NACIONAL DE HEPATITIS B y C Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud Misión: Protección de la población chilena frente a enfermedades inmunoprevenibles
VIRUS DEL PAPILOMA HUMANO. VACUNACIÓN
 VIRUS DEL PAPILOMA HUMANO. VACUNACIÓN JESSICA NOGUEIRA GARCÍA, R4 SERVICIO GINECOLOGIA Y OBSTETRICIA Albacete, 7 de Febrero de 204 -Familia Papillomaviridae -Pequeños virus de ADN circular doble cadena
VIRUS DEL PAPILOMA HUMANO. VACUNACIÓN JESSICA NOGUEIRA GARCÍA, R4 SERVICIO GINECOLOGIA Y OBSTETRICIA Albacete, 7 de Febrero de 204 -Familia Papillomaviridae -Pequeños virus de ADN circular doble cadena
Boostrix está indicada para la vacunación de recuerdo frente a difteria, tétanos y tos ferina a partir de 4 años de edad (ver sección 4.2).
 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitosferina (componente acelular) (adsorbida, carga antigénica reducida) 2. COMPOSICIÓN
1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitosferina (componente acelular) (adsorbida, carga antigénica reducida) 2. COMPOSICIÓN
Objetivos de Aprendizaje
 Objetivos de Aprendizaje Discutir los cánceres asociados al VPH debido a los tipos de VPH y el impacto de las vacunas actuales contra el VPH Analizar los beneficios de la vacuna contra el VPH 9 Valente
Objetivos de Aprendizaje Discutir los cánceres asociados al VPH debido a los tipos de VPH y el impacto de las vacunas actuales contra el VPH Analizar los beneficios de la vacuna contra el VPH 9 Valente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
Vacunas Tosferina. Quién debe recibir la vacuna?
 Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana
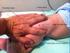 Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
II. ESQUEMA NACIONAL DE VACUNACIÓN Dosis y lugar de aplicación Hepatitis B. No de dosis Intervalo entre dosis
 II. ESQUEMA NACIONAL DE VACUNACIÓN 2009 Vacuna Edad a vacunar No de dosis Intervalo entre dosis Dosis y lugar de aplicación Recién Nacido 12 horas * 1 0.5cc IM, área del (antero lateral) 0.1CC ID, en la
II. ESQUEMA NACIONAL DE VACUNACIÓN 2009 Vacuna Edad a vacunar No de dosis Intervalo entre dosis Dosis y lugar de aplicación Recién Nacido 12 horas * 1 0.5cc IM, área del (antero lateral) 0.1CC ID, en la
EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II
 EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II MBE Cáncer de cuello uterino y VPH CA de cérvix: Segundo tipo de CA en las mujeres. Principal causa de muerte por
EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II MBE Cáncer de cuello uterino y VPH CA de cérvix: Segundo tipo de CA en las mujeres. Principal causa de muerte por
3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A
 1.0. DENOMINACIÓN DISTINTIVA. Virohep A 2.0. DENOMINACIÓN GENÉRICA Vacuna Antihepatitis A 3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A 12 UI 4.0. FORMA FARMACÉUTICA.
1.0. DENOMINACIÓN DISTINTIVA. Virohep A 2.0. DENOMINACIÓN GENÉRICA Vacuna Antihepatitis A 3.0. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Antígeno del virus de la hepatitis A 12 UI 4.0. FORMA FARMACÉUTICA.
MODELO DE FORMATO TEXTO PARA LITERATURA INTERIOR
 PARA LITERATURA INTERIOR Heberpenta Vacuna combinada de Difteria, Tétanos, células enteras de Pertussis, Hepatitis B y Haemophilus influenzae tipo b COMPOSICIÓN Composición de la vacuna, una vez lista
PARA LITERATURA INTERIOR Heberpenta Vacuna combinada de Difteria, Tétanos, células enteras de Pertussis, Hepatitis B y Haemophilus influenzae tipo b COMPOSICIÓN Composición de la vacuna, una vez lista
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Secretaría de Salud Programa Ampliado de Inmunizaciones. Conceptos y principios generales de inmunización
 Secretaría de Salud Programa Ampliado de Inmunizaciones Conceptos y principios generales de inmunización Siguatepeque 27 de junio al 01 de julio de 2011 Contenido Conceptos básicos Principios generales
Secretaría de Salud Programa Ampliado de Inmunizaciones Conceptos y principios generales de inmunización Siguatepeque 27 de junio al 01 de julio de 2011 Contenido Conceptos básicos Principios generales
Vacunas contra los virus del papiloma humano Para destacar:
 Vacunas contra los virus del papiloma humano Para destacar: Los virus del papiloma humano (VPH) son un grupo de más de 100 virus relacionados. Ciertos tipos de VPH son la causa principal de cáncer de cuello
Vacunas contra los virus del papiloma humano Para destacar: Los virus del papiloma humano (VPH) son un grupo de más de 100 virus relacionados. Ciertos tipos de VPH son la causa principal de cáncer de cuello
* producido en levadura Saccharomyces cerevisiae (cepa ) mediante tecnología recombinante de ADN.
 1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
Virus del Papiloma Humano
 Virus del Papiloma Humano Es el término científico correcto, pero muchos, por no decir la mayoría, hablan de papiloma virus. Cualquiera de las dos formas la consideraremos con fines prácticos como correcta
Virus del Papiloma Humano Es el término científico correcto, pero muchos, por no decir la mayoría, hablan de papiloma virus. Cualquiera de las dos formas la consideraremos con fines prácticos como correcta
Cepa derivada de A/California/7/2009 (H1N1)pdm09: (NYMC X-181) 15 microgramos HA** Cepa derivada de A/Victoria/361/2011 (H3N2): (IVR-165)
 1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
1. NOMBRE DEL MEDICAMENTO CHIROFLU, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Antígenos
LO QUE DEBES SABER SOBRE LA VACUNA CONTRA EL VIRUS DEL PAPILOMA HUMANO (VPH)
 LO QUE DEBES SABER SOBRE LA VACUNA CONTRA EL VIRUS DEL PAPILOMA HUMANO (VPH) 2 Qué estudios se han realizado en el mundo para determinar si la vacuna contra el virus del papiloma humano (VPH) es efectiva?
LO QUE DEBES SABER SOBRE LA VACUNA CONTRA EL VIRUS DEL PAPILOMA HUMANO (VPH) 2 Qué estudios se han realizado en el mundo para determinar si la vacuna contra el virus del papiloma humano (VPH) es efectiva?
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV suspensión inyectable para gatos 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSIFEL FeLV suspensión inyectable para gatos 2. COMPOSICIÓN
600 U.I. 480 mg 95% Ig. 67,5 mg 9,0 mg 3 ml. Solución inyectable con inmunoglobulinas, principalmente inmunoglobulina G (IgG).
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
50% Comprobado: Por lo menos un de las personas sexualmente activas contraerán el VPH genital.
 Comprobado: 50% Por lo menos un de las personas sexualmente activas contraerán el VPH genital. La mayoría no sabrá que lo tiene. Infórmese sobre este virus común. Por qué mucha gente no lo conoce? El VPH
Comprobado: 50% Por lo menos un de las personas sexualmente activas contraerán el VPH genital. La mayoría no sabrá que lo tiene. Infórmese sobre este virus común. Por qué mucha gente no lo conoce? El VPH
VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M.
 VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M. INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Formulación para uso pediátrico y en adolescentes Cada
VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M. INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Formulación para uso pediátrico y en adolescentes Cada
VACUNA CONTRA EL HPV(VIRUS PAPILOMA HUMANO)
 VACUNA CONTRA EL HPV(VIRUS PAPILOMA HUMANO) LO QUE USTED DEBE SABER Dra. Claudia Andrea Federiche.- Julio 2011. La infección por Virus Papiloma Humano ( HPV) representa una de las enfermedades de transmisión
VACUNA CONTRA EL HPV(VIRUS PAPILOMA HUMANO) LO QUE USTED DEBE SABER Dra. Claudia Andrea Federiche.- Julio 2011. La infección por Virus Papiloma Humano ( HPV) representa una de las enfermedades de transmisión
FICHA TÉCNICA. no menos de 20 Unidades Internaciones (UI) (5 Lf) 1adsorbidos en hidróxido de aluminio hidratado (Al(OH)3)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
La vacuna no es eficaz para la prevención de la otitis media aguda, sinusitis y otras infecciones comunes del tracto respiratorio superior.
 1. NOMBRE DEL MEDICAMENTO Pneumovax 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna contiene 25 microgramos
1. NOMBRE DEL MEDICAMENTO Pneumovax 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna contiene 25 microgramos
VACUNAS. Generalidades y calendarios. C. S. San Blas, 21 de junio de 2006
 C. S. San Blas, 21 de junio de 2006 VACUNAS Generalidades y calendarios Dr. Manuel Merino Moína Pediatra C. S. El Greco Comité Asesor de Vacunas de Madrid Qué es una vacuna? Sustancia que, administrada
C. S. San Blas, 21 de junio de 2006 VACUNAS Generalidades y calendarios Dr. Manuel Merino Moína Pediatra C. S. El Greco Comité Asesor de Vacunas de Madrid Qué es una vacuna? Sustancia que, administrada
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. TRIAXIS, suspensión inyectable.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
Contraindicaciones de las Vacunas
 Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
G. Orejón de Luna a, C. Ochoa Sangrador b a. Resumen estructurado. Emplazamiento: noventa centros hospitalarios,
 Una vacuna cuatrivalente contra el virus del papiloma humano, previene las lesiones cervicales de alto grado de malignidad asociadas a los serotipos 16 y 18, en mujeres jóvenes sin infección previa G.
Una vacuna cuatrivalente contra el virus del papiloma humano, previene las lesiones cervicales de alto grado de malignidad asociadas a los serotipos 16 y 18, en mujeres jóvenes sin infección previa G.
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616
![GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616 GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616](/thumbs/34/13114587.jpg) USPPI Información para el paciente sobre GARDASIL Nombre genérico: [vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] Lea esta información con atención antes
USPPI Información para el paciente sobre GARDASIL Nombre genérico: [vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] Lea esta información con atención antes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
IMPORTANCIA DE LA PREVENCION DEL CA DE CERVIX
 IMPORTANCIA DE LA PREVENCION DEL CA DE CERVIX FRANCISCA REYES CINTAS D.U.E. QUIROFANO BLOQUE QUIRURGICO HOSPITAL DEL HENARES MADRID Mª ANGELES ALTOZANO YUSTE D.U.E. QUIROFANO. H. PRINCIPE DE ASTURIAS.
IMPORTANCIA DE LA PREVENCION DEL CA DE CERVIX FRANCISCA REYES CINTAS D.U.E. QUIROFANO BLOQUE QUIRURGICO HOSPITAL DEL HENARES MADRID Mª ANGELES ALTOZANO YUSTE D.U.E. QUIROFANO. H. PRINCIPE DE ASTURIAS.
MINISTERIO DE SALUD PANAMA PROGRAMA AMPLIADO DE INMUNIZACION
 MINISTERIO DE SALUD PANAMA PROGRAMA AMPLIADO DE INMUNIZACION La vacunación de la población escolar, adolescentes y adultos jóvenes: análisis de casos en HPV, acp, MMR, Hepatitis B Enf Argelis Espinosa
MINISTERIO DE SALUD PANAMA PROGRAMA AMPLIADO DE INMUNIZACION La vacunación de la población escolar, adolescentes y adultos jóvenes: análisis de casos en HPV, acp, MMR, Hepatitis B Enf Argelis Espinosa
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1.
 1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2014/2015) 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2014/2015) 2. COMPOSICIÓN CUALITATIVA
PATOLOGÍA CERVICAL EN LA PRÁCTICA DIARIA.
 GUÍAS CLÍNICAS MANEJO CLÍNICO Y TERAPÉUTICO DE LA PATOLOGÍA CERVICAL EN LA PRÁCTICA DIARIA. SOCIEDAD DE PATOLOGÍA DEL TRACTO GENITAL INFERIOR, CITOLOGÍA Y COLPOSCOPÍA. Agosto 2005. Montevideo, Uruguay.
GUÍAS CLÍNICAS MANEJO CLÍNICO Y TERAPÉUTICO DE LA PATOLOGÍA CERVICAL EN LA PRÁCTICA DIARIA. SOCIEDAD DE PATOLOGÍA DEL TRACTO GENITAL INFERIOR, CITOLOGÍA Y COLPOSCOPÍA. Agosto 2005. Montevideo, Uruguay.
PENTAVALENTE DESCRIPCIÓN VÍA DE ADMINISTRACIÓN
 DESCRIPCIÓN Es una vacuna combinada que contiene; los toxoides diftérico y tetánico y toxoide Pertússico así como los tres tipos de virus inactivados de la poliomielitis. PRESENTACIÓN Jeringa prellenada
DESCRIPCIÓN Es una vacuna combinada que contiene; los toxoides diftérico y tetánico y toxoide Pertússico así como los tres tipos de virus inactivados de la poliomielitis. PRESENTACIÓN Jeringa prellenada
ARGUMENTARIO DE LA VACUNA DEL VIRUS DEL PAPILOMA HUMANO 2008
 ARGUMENTARIO DE LA VACUNA DEL VIRUS DEL PAPILOMA HUMANO 2008 INDICE: 1- Qué es el Virus del Papiloma Humano y vía de transmisión? 2- Prevención de la enfermedad. 3- Diagnostico de la enfermedad. 4- Indicación
ARGUMENTARIO DE LA VACUNA DEL VIRUS DEL PAPILOMA HUMANO 2008 INDICE: 1- Qué es el Virus del Papiloma Humano y vía de transmisión? 2- Prevención de la enfermedad. 3- Diagnostico de la enfermedad. 4- Indicación
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
CÁNCER DE CÉRVIX Y ANTICONCEPCIÓN: NUEVAS EVIDENCIAS EPIDEMIOLÓGICAS
 CÁNCER DE CÉRVIX Y ANTICONCEPCIÓN: NUEVAS EVIDENCIAS EPIDEMIOLÓGICAS Xavier Castellsagué Institut Català d'oncologia Barcelona Barcelona, Junio 2006 Uno de los descubrimientos más importantes en la investigación
CÁNCER DE CÉRVIX Y ANTICONCEPCIÓN: NUEVAS EVIDENCIAS EPIDEMIOLÓGICAS Xavier Castellsagué Institut Català d'oncologia Barcelona Barcelona, Junio 2006 Uno de los descubrimientos más importantes en la investigación
Guía educativa sobre el Virus del Papiloma Humano (VPH), cáncer cervicouterino y otras enfermedades
 Guía educativa sobre el Virus del Papiloma Humano (VPH), cáncer cervicouterino y otras enfermedades Qué es el Virus del Papiloma Humano (VPH) y cuántos tipos de VPH existen? El VPH (Virus del Papiloma
Guía educativa sobre el Virus del Papiloma Humano (VPH), cáncer cervicouterino y otras enfermedades Qué es el Virus del Papiloma Humano (VPH) y cuántos tipos de VPH existen? El VPH (Virus del Papiloma
La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año.
 La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año. Los síntomas suelen aparecer a las 48 horas de efectuado el contagio y la mayoría
La gripe o influenza es una enfermedad viral respiratoria que se presenta habitualmente en los meses más fríos del año. Los síntomas suelen aparecer a las 48 horas de efectuado el contagio y la mayoría
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
Factores de Riesgo. Virus de papiloma Humano
 Factores de Riesgo Virus de papiloma Humano Las verrugas genitales son causadas por el virus papilloma humano (HPV por sus siglas en inglés). El HPV es una familia de más de 100 virus muy comunes. Muchos
Factores de Riesgo Virus de papiloma Humano Las verrugas genitales son causadas por el virus papilloma humano (HPV por sus siglas en inglés). El HPV es una familia de más de 100 virus muy comunes. Muchos
Dra. Nelly Cruz Viruel. Da click para escuchar el audio
 Dra. Nelly Cruz Viruel LESIÓN ESCAMOSA INTRAEPITELIAL: espectro de anomalías NO INVASORAS del epitelio escamoso cervical causadas por el VPH, que abarcan desde cambios celulares asociados a la infección
Dra. Nelly Cruz Viruel LESIÓN ESCAMOSA INTRAEPITELIAL: espectro de anomalías NO INVASORAS del epitelio escamoso cervical causadas por el VPH, que abarcan desde cambios celulares asociados a la infección
[Referencia 3] Registro de vacunación y cuestionario de selección para vacunación H M
![[Referencia 3] Registro de vacunación y cuestionario de selección para vacunación H M [Referencia 3] Registro de vacunación y cuestionario de selección para vacunación H M](/thumbs/50/26789210.jpg) Cuestionario de selección para vacunación destinado a [ スペイン語版 Formulario 2 ] (edad preescolar / escolar) mbre del niño mbre del padre, madre o tutor Cuestionario para la vacunación Respuesta a leído el
Cuestionario de selección para vacunación destinado a [ スペイン語版 Formulario 2 ] (edad preescolar / escolar) mbre del niño mbre del padre, madre o tutor Cuestionario para la vacunación Respuesta a leído el
FICHA TÉCNICA VACUNA ADSORBIDA ANTIDIFTÉRICA, ANTITETÁNICA Y CONTRA LA TOS FERINA
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
I. Principado de Asturias
 núm. 49 de 29-ii-2016 1/5 I. Principado de Asturias Ot r a s Disposiciones Consejería de Sanidad Resolución de 17 de febrero de 2016, de la Consejería de Sanidad, por la que se aprueba el nuevo calendario
núm. 49 de 29-ii-2016 1/5 I. Principado de Asturias Ot r a s Disposiciones Consejería de Sanidad Resolución de 17 de febrero de 2016, de la Consejería de Sanidad, por la que se aprueba el nuevo calendario
Porque se hace el Papanicolao
 Maria Daheri RN Porque se hace el Papanicolao La prueba de Papanicolaou y el examen pélvico constituyen una parte importante del cuidado médico regular de la mujer, ya que con ellos se pueden detectar
Maria Daheri RN Porque se hace el Papanicolao La prueba de Papanicolaou y el examen pélvico constituyen una parte importante del cuidado médico regular de la mujer, ya que con ellos se pueden detectar
Prevención del cáncer de cuello de útero
 GINECOLOGÍA Prevención del cáncer de cuello de útero Prevención del cáncer de cuello de útero Vacúnate y protégete Salud de la mujer Dexeus ATENCIÓN INTEGRAL EN OBSTETRICIA, GINECOLOGÍA Y MEDICINA DE LA
GINECOLOGÍA Prevención del cáncer de cuello de útero Prevención del cáncer de cuello de útero Vacúnate y protégete Salud de la mujer Dexeus ATENCIÓN INTEGRAL EN OBSTETRICIA, GINECOLOGÍA Y MEDICINA DE LA
K:\Jenner_Public\QSS\VACCINE QUALITY & REGULATION GROUP\Inserts\Spanish\esp_Insert measles rubella Vd2-rev.doc
 MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida)
![Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida) Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida)](/thumbs/25/5103336.jpg) 1. NOMBRE DEL MEDICAMENTO Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida) 2. COMPOSICIÓN CUALITATIVA Y
1. NOMBRE DEL MEDICAMENTO Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida) 2. COMPOSICIÓN CUALITATIVA Y
Pautas para la vigilancia y el control de Coqueluche en situaciones de brote
 2012 0 Pautas para la vigilancia y el control de Coqueluche en situaciones de brote Introducción Coqueluche, tos convulsa o pertussis es una enfermedad respiratoria aguda que puede manifestarse en forma
2012 0 Pautas para la vigilancia y el control de Coqueluche en situaciones de brote Introducción Coqueluche, tos convulsa o pertussis es una enfermedad respiratoria aguda que puede manifestarse en forma
Anexo III. Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos
 Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
NÚMERO DE DOSIS RECOMENDADO DE CADA VACUNA SEGÚN LA EDAD Asociación Española de Pediatría 2015 Comité Asesor de Vacunas.
 1 de enero de 2015 Esta tabla indica el número de necesarias según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se
1 de enero de 2015 Esta tabla indica el número de necesarias según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se
PROSPECTO: INFORMACIÓN PARA EL USUARIO
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Gardasil, suspensión inyectable Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida) Lea todo el prospecto detenidamente antes
PROSPECTO: INFORMACIÓN PARA EL USUARIO Gardasil, suspensión inyectable Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida) Lea todo el prospecto detenidamente antes
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
Dra. Noemí Soto Nieves
 Vacuna es una preparación biológica que se utiliza para establecer o mejorar la inmunidad a una enfermedad en particular. La vacunación se considera como uno de los grandes triunfos de la salud pública.
Vacuna es una preparación biológica que se utiliza para establecer o mejorar la inmunidad a una enfermedad en particular. La vacunación se considera como uno de los grandes triunfos de la salud pública.
AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública
 Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
Fiebre Amarilla AUTOR. Dr. César Velasco Muñoz. Medicina Preventiva y Salud Pública La fiebre amarilla es una infección aguda causada por un Arbovirus del género flavivirus, transmitida por la picadura
EFUDIX LPS FICHA TÉCNICA. verrugas genitales (vulva, zona perianal, pene y meato urinario).
 verrugas genitales (vulva, zona perianal, pene y meato urinario). Efudix LPS es una nueva formulación en crema con liposomas a una concentración de fluorouracilo al 0.5 %. FICHA TÉCNICA EFUDIX LPS Sep
verrugas genitales (vulva, zona perianal, pene y meato urinario). Efudix LPS es una nueva formulación en crema con liposomas a una concentración de fluorouracilo al 0.5 %. FICHA TÉCNICA EFUDIX LPS Sep
Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1.
 1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2012/2013) 2. COMPOSICIÓN CUALITATIVA
