1.- CONCEPTO 2.- FUNCIONES GENERALES 3.- LOS AMINOÁCIDOS INTRODUCCIÓN PROPIEDADES FÍSICAS PROPIEDADES QUÍMICAS 3.4.
|
|
|
- Agustín Soriano Maidana
- hace 6 años
- Vistas:
Transcripción
1 1.- CONCEPTO 2.- FUNCIONES GENERALES 3.- LOS AMINOÁCIDOS INTRODUCCIÓN PROPIEDADES FÍSICAS PROPIEDADES QUÍMICAS CLASIFICACIÓN 4.- PÉTIDOS INTRODUCCIÓN CARACTERÍSTICAS DEL ENLACE PEPTÍDICO PÉTIDOS NATURALES 5.- PROTEÍNAS INTRODUCCIÓN NIVELES ESTRUCTURALES PROPIEDADES CLASIFICACIÓN
2 1.- CONCEPTO Son biomoléculas orgánicas formadas por C, H, O, N. La mayoría presentan S y P e incluso algunas poseen Fe y Cu ( Hemoglobinas y cromoproteínas). Son las macromoléculas más abundantes en nuestras células (50-80%). En cada célula existen miles de moléculas de proteínas diferentes. Presentan elevado peso molecular. Son polímeros formados por unidades de menor masa molecular, los aminoácidos (monómeros), unidos mediante enlaces peptídicos. Son específicas que marcan la individualidad de cada ser vivo. Son además de gran importancia porque a través de ellas se va a expresar la información genética. Según el dogma central de la Biología Molecular ADN ARN Proteína Si el número de aminoácidos es menor de 100 hablamos de péptidos y si es mayor de 100 de proteínas. 2.- FUNCIONES GENERALES Las proteínas están entre las sustancias que realizan las funciones más importantes en los seres vivos. De reserva: en general las proteínas no tienen función de reserva, pero pueden utilizarse con este fin en algunos casos especiales como por ejemplo en el desarrollo embrionario: ovoalbúmina del huevo, caseína de la leche, seroalbúmina en la sangre, ferritina reserva de hierro. Estructural. Las proteínas constituyen muchas estructuras de los seres vivos. Las membranas celulares contienen proteínas. En el organismo, en general, ciertas estructuras -cartílago, huesoestán formadas, entre otras sustancias, por proteínas como el colágeno, abundante en tendones. La queratina en pelo, cuernos, uñas,.. Enzimática. Todas las reacciones que se producen en los organismos son catalizadas por moléculas orgánicas. Las enzimas son las moléculas que realizan esta función en los seres vivos. Todas las reacciones químicas que se producen en los seres vivos necesitan su enzima y todas las enzimas son proteínas. Ejemplo la pepsina, las lipasas, Homeostática. Ciertas proteínas mantienen el equilibrio osmótico del medio celular y extracelular. Transporte, de gases, como es el caso de la hemoglobina que transporta el oxígeno en sangre o la mioglobina que lo transporta en el músculo. Las lipoproteínas que transportan lípidos, la transferrina transporta hierro. Las permeasas, moléculas que realizan los intercambios entre la célula y el exterior, son también proteínas Movimiento. Actúan como elementos esenciales en el movimiento. Así, la actina y la miosina, proteínas de las células musculares, son las responsables de la contracción de la fibra muscular. Hormonal. Las hormonas son sustancias químicas que regulan procesos vitales. Algunas proteínas actúan como hormonas, por ejemplo: la insulina, que regula la concentración de la glucosa en la sangre. Inmunológica. Los anticuerpos, sustancias que intervienen en los procesos de defensa frente a de los agentes patógenos, son proteínas del tipo de las δ globulinas 1
3 Transferrina Lipoproteinas Liquido sinovial Insulina:disminuye glucosa en sangre Glucagon: aumenta glucosa Globulinas Caseina Elastina 2
4 3.- LOS AMINOÁCIDOS 3.1 INTRODUCCIÓN Son compuestos orgánicos que se caracterizan por poseer un grupo amino (-NH 2 ) y un grupo carboxilo (-COOH). Son los monómeros de las proteínas y todos, salvo la prolina, corresponden a la siguiente fórmula general. La mayoría son α - aminoácidos. Existen un total de 100 aminoácidos, pero sólo 20 forman parte de las proteínas. La mayoría se pueden sintetizar a partir de otros aminoácidos, pero existen otros aminoácidos esenciales que no pueden ser sintetizados y deben obtenerse en la dieta habitual. Estos aminoácidos son diferentes para cada especie, así por ejemplo para la especie humana estos aminoácidos son: Thr, Lys, Arg, His, Val, Leu, Ileu, Met, Phe y Trp PROPIEDADES FÍSICAS - Son sólidos, blancos y cristalinos. - Son solubles en agua - Presentan actividad óptica y estereoisomería, excepto la glicocola, como consecuencia del carbono α que es asimétrico, De manera que existen dos configuraciones la D y la L. Normalmente en los seres vivos sólo encontramos uno de los dos isómeros. Por convenio se ha establecido que los aminoácidos que tienen el grupo amino NH 2 a la derecha son formas D y los que lo tienen a la izquierda, son formas L PROPIEDADES QUÍMICAS (Ácido-Básicas) 3
5 En disolución acuosa los grupos funcionales ( amino y ácido ) se encuentra en forma iónica, esto hace que los aminoácidos en agua formen iones dipolares (tienen el mismo número de cargas positivas que de cargas negativas). Esto hace que dependiendo del ph de la disolución se pueden comportar como ácidos o bases, es decir tienen carácter anfótero, por lo que van a actuar como sistemas amortiguadores del ph del medio. Al ph en el que un determinado aminoácido forma el ión dipolar ( carga neutra) se le llama punto isoeléctrico (pi). Si hay un exceso de protones, H + (ph ácido) se comporta como una base y queda cargado positivamente, pues el grupo ácido COO - capta los iones hidrógeno, H +. El aminoácido entonces se comporta como un catión. Por el contrario, si hay menos protones, H + (ph básico), se comporta como un + ácido. El grupo amino NH 3 libera H + y pierde su carga positiva. El aminoácido se comporta como un anión CLASIFICACIÓN Los aminoácidos se diferencian según su comportamiento en agua, algunos son polares y otros hidrófobos o apolares. En disolución acuosa los hay que se cargan positivamente (+) y otros negativamente (-). La siguiente clasificación se basa en la polaridad de los radicales: Grupo I: Aminoácidos apolares. Aminoácidos cuyo resto R no es polar. Esto es, no posee cargas eléctricas en R al tener en él largas cadenas hidrocarbonadas. Estos aminoácidos, si están en gran abundancia en una proteína, la hacen insoluble en agua Grupo II: Aminoácidos polares no ionizables. Poseen restos con cortas cadenas hidrocarbonadas en las que hay funciones polares (alcohol, tiol o amida). Contrariamente al grupo anterior si una proteína los tiene en abundancia será soluble en agua Grupo III: Aminoácidos polares ácidos. Pertenecen a este grupo aquellos aminoácidos que tienen más de un grupo carboxilo. En las proteínas, si el ph es básico o neutro, estos grupos se encuentran cargados negativamente. Proporcionan cargas negativas a las proteínas. Grupo IV: Aminoácidos polares básicos. Son aquellos aminoácidos que tienen otro u otros grupos aminos. En las proteínas, estos grupos amino, si el ph es ácido o neutro, están cargados positivamente. Proporcionan cargas positivas a las proteínas. 4
6 5
7 4.- PÉPTIDOS INTRODUCCIÓN Los péptidos son biomoléculas orgánicas formadas por la unión de menos de 100 aminoácidos. La unión se produce mediante el enlace peptídico, este es un enlace covalente que se establece entre el grupo carboxilo de un aminoácido y el grupo amino del siguiente aminoácido, liberándose una molécula de agua. Si se unen dos aminoácidos se forma un dipéptido, si son tres, un tripéptido,, unos pocos un oligopéptido y muchos aminoácidos un polipéptido. Las cadenas peptídicas siempre tienen en el extremo izquierdo el grupo amino libre (N-terminal) y en el extremo derecho el grupo carboxilo (C-terminal). En los péptidos en disolución, sólo se ionizan estos grupos funcionales terminales. Para conocer la estructura de un péptido, es necesario saber, el número de aminoácidos que lo componen, la proporción de los mismos, la secuencia, es decir el orden en el que se encuentran; esto último se ha utilizado para interpretar el grado de parentesco de las diferentes especies CARACTERÍSTICAS DEL ENLACE PEPTÍDICO - Es un enlace covalente - Es hidrolizable - Mediantes estudios de rayos X se ha observado que se comporta, en cierto modo como un doble enlace, lo que le proporciona cierta rigidez, de manera que no puede girar libremente. Esto hace que una cadena peptídica adopte en el espacio un número limitado de configuraciones. 6
8 - Los átomos implicados en el enlace: C, H, O y N, se sitúan en un mismo plano, llamado plano de la amida. Dos planos de la amida contiguos pueden girar, aunque el giro no es completamente libre, pues las cadenas laterales unidas al carbono α dificultan la rotación. Debido a esto las cadenas peptídicas adquieren unas estructuras de planos sucesivos que pueden formar diversos ángulos entre sí y de los que salen lateralmente los radicales. - Los enlaces peptídicos están a unas distancias y ángulos característicos PÉPTIDOS NATURALES Hormonas: o Vasopresina: favorece la retención renal del agua. Controla la presión de las sales minerales. o Oxitocina: responsable de las contracciones del útero durante el parto. o Insulina y Glucagón: regulan la concentración de glucosa en sangre. La primera disminuye la glucosa en sangre y la segunda tiene una acción antagónica.la insulina incrementa el anabolismo proteico y moviliza los depósitos de grasa. Antibióticos Sustancias producidas de forma natural por hongos y micoorganismos. Ejemplo la penicilina, la gramicidina, Encefalinas Sustancias producidas por las células nerviosas que inhiben el dolor 7
9 5.- PROTEÍNAS INTRODUCCIÓN Son macromoléculas de elevado peso molecular (p.m), constituidas por largas cadenas polipeptídicas, que poseen una estructura tridimensional y una función que le son propias de cada una. La estructura de una proteína está determinada por los aminoácidos que la forman, la secuencia de los mismos y su disposición espacial. Se distinguen así varios niveles estructurales o de organización dentro de una misma proteína. Podemos decir que las proteínas no son moléculas inmutables, sino que se hinchan, palpitan, 5.2.-NIVELES ESTRUCTURALES DE LAS PROTEÍNAS Estructura primaria: Esta estructura viene determinada por la secuencia lineal (orden) de los aminoácidos y el número de aa que forman la cadena peptídica. Como existen 20 a diferentes, el número de estructuras posibles vienen dado por las variaciones con repetición de 20 elementos tomados de n en n, siendo n el número de aa que componen la proteína. Los enlaces que participan en la estructura primaria de la proteína son covalentes : son los enlaces peptídicos. El enlace peptídico es un enlace amida que se forma entre el grupo carboxilo de un aa y el grupo amino de otro aa, desprendiéndose una molécula de agua. En toda cadena polipeptídica siempre hay un extremo amino terminal y uno carboxilo terminal que permanecen intactos. Por convenio, la secuencia de una proteína se lee siempre a partir de su extremo amino: H 2 N-leu-val-his-..COOH. La unión de los aa mediante enlace peptídico forma una cadena principal o esqueleto a partir de la cual emergen las cadenas laterales de los aa.en realidad es una sucesión de planos (plano de la amida). Como la estructura primaria es la que determina los siguientes niveles superiores de organización, el conocimiento de la secuencia de aa es de gran interés para el estudio de la estructura y función de una proteína. 8
10 Estructura secundaria: (proteínas fibrilares) Enrollamiento de la cadena polipeptídica en el espacio como consecuencia de la rotación del carbono α, estableciéndose entre los diferentes aminoácidos unas interacciones en forma de puentes de hidrógeno. El enrollamiento puede ser α- helicoidal o β lámina plegada. v α- helicoidal: estructura en espiral, disponiéndose los aminoácidos como alrededor del eje de un cilindro. Cada vuelta esta formada por 3,6 aminoácidos, disponiéndose los radicales hacia fuera. La estabilidad se mantiene mediante puentes de hidrógeno intracatenarios que se establecen entre el grupo HN y el grupo COOH cada 3 o 4 aminoácidos. No todas las secuencias adoptan esta conformación, hay aminoácidos que desestabilizan esta estructura porque poseen grupo R muy voluminosos o porque presentan cargas eléctricas del mismo signo (están próximas y se repelen) o porque ciertos aminoácidos se acomodan mal y tienden a romperla.. v β lámina plegada: semejante a un acordeón. Estructura formada por dos o más cadenas que se disponen paralelamente entre sí; en este caso los puentes de hidrógeno son intercatenarios, pues se establecen entre los grupos COOH y HN de aminoácidos contiguos. Normalmente, una α-hélice aislada no es estable por sí sola en medio acuoso. El carácter hidrofóbico de las hélices α favorece que puedan interaccionar entre sí enrollándose unas sobre otras formándose una superhélice, como ocurre en la proteína queratina. 9
11 Un caso especial es el de la molécula de colágeno, la proteína típica de los tejidos conectivos, formada por tres cadenas polipeptídicas, muy empaquetadas formando una triple hélice, con aspecto de cable. Generalmente, en una misma cadena polipeptídica hay regiones de α-hélice, de β- lámina u hoja plegada y de enrollamiento al azar. (zonas irregulares). Estructura terciaria: En las proteínas fibrilares (colágeno, queratina,..) la estructura terciaria es muy simple, ya que las cadenas laterales R apenas influyen, pues tienen pocos grupos polares, suelen ser proteínas alargadas, muy resistentes e insolubles en agua, por lo que desempeñan funciones mecánicas, de manera que constituyen: - Elementos estructurales: triple hélice de colágeno, que se localiza en forma pura en la córnea, proporcionando gran resistencia en forma de fibras paralelas en los tendones y proporcionando elasticidad a la piel en forma de fibras entrecruzadas. - Elementos protectores: queratina, la configuración α se localiza en la piel, pelo, lana, cuernos, y la configuración β en picos, garras, tela de araña, hilo de seda, En las proteínas globulares, la estructura secundaria se repliega sobre sí misma, en la búsqueda posiblemente de una estabilidad. Como la mayoría se encuentran en medio acuoso, el plegamiento se produce de tal manera que los aminoácidos que poseen restos hidrófobos se disponen hacia dentro, mientras que los aminoácidos con restos polares o con carga se disponen hacia el exterior (puentes de H con el agua). Esto se conoce como efecto hidrófobo. Esta estructura se mantiene por las interacciones que se establecen entre las cadenas laterales de la molécula. Esos enlaces pueden ser covalentes y no covalentes. - Enlaces no covalentes: Puentes de hidrógeno, se establecen entre cadenas laterales polares (que presentan algún grupo dador o aceptor de electrones) por ejemplo, el OH de la serina o threonina. Interacciones electrostáticas, que se establecen entre grupos con carga opuesta. Ejemplo los + grupos NH 3 y -COO - de diferentes cadenas laterales, o aquellos que poseen una carga parcial positiva o negativa como los grupo amida de la asparragina y glutamina. 10
12 Interacciones de Van der Waals, son enlaces débiles entre grupos no cargados. Interacciones hidrofóbicas, se establecen entre grupos apolares que tienden a interaccionar entre sí ocultándoses del agua que envuelve a la molécula, por lo que se disponen hacia dentro. - Enlace covalentes (fuerte): Puentes de disulfuro, por ejemplo entre dos cisteínas. Las proteínas globulares presentan un interior compacto de marcado carácter hidrófobo, sin embargo el exterior es polar, lo que hace que sean solubles en agua. Debido a esto tienen funciones con un marcado carácter dinámico y no estático como el caso de las proteínas fibrilares (funciones estructurales). Un dominio proteico es una parte de la cadena polipeptídica que puede plegarse independientemente del resto, dando lugar a una estructura espacial característica. Muchas proteínas grandes constan de varios dominios unidos por segmentos desestructurados de cadena polipeptídica (bisagra). Cada dominio suele estar asociado a una función de la proteína. Muchas proteínas pueden agruparse en familias proteicas que comparten dominios estructurales asociados a una función determinada. Estructura cuaternaria: En las proteínas fibrilares se asocian varias cadenas peptídicas con estructura secundaria. - Colágeno: tres cadenas polipeptídicas muy empaquetadas, formando una triple hélice con aspecto de cable. Proporciona resistencia a tendones,.. - Queratina: forma estructuras como piel, cuernos, pelo, uñas, En las proteínas globulares, varias cadenas polipeptídicas (estructura terciaria) se asocian y se mantienen unidas mediante enlaces tanto covalentes como no covalentes, formando proteínas oligoméricas, cada 11
13 cadena polipeptídica se llama protómero y el conjunto oligómero. Es el caso de la hemoglobina (tetrámero) o los anticuerpos ( γ globulinas) La estructura cuaternaria es responsable de su actividad biológica, ésta depende de la estructura terciaria, que a su vez depende de la secundaria y ésta de la primaria (secuencia de aminoácidos). Podemos deducir por lo tanto que las proteínas no son estructuras inmutables, se encogen, se estiran, modifican su estructura en respuesta a la función que desempeñan. 5.3 PROPIEDADES Solubilidad: Esta propiedad es la que hace posible la hidratación de los tejidos de los seres vivos. Las proteínas en realidad forman dispersiones coloidales, ya que son macromoléculas. La solubilidad de una proteína se debe a los radicales (-R) libres de los aminoácidos que, al ionizarse, establecen enlaces débiles (puentes de H) con las moléculas de agua. Cuando una proteína se solubiliza queda recubierta de una capa de moléculas de agua (capa de solvatación) que impide que se pueda unir a otras proteínas, lo cual provocaría su precipitación (pérdida de solubilidad) El grado de solubilidad de una proteína depende de: ü Su composición en aminoácidos (una proteína rica en aminoácidos polares es en general más soluble que una rica en aminoácidos hidrofóbicos) ü Su estructura tridimensional (las proteínas fibrosas son en general insolubles mientras que las globulares son solubles. ü El entorno de la propia proteína Los factores ambientales que influyen en la solubilidad son: la temperatura. la constante dieléctrica del medio. el ph del mismo. La fuerza iónica - La mayoría de las proteínas fibrilares son insolubles, la mayoría de las globulares son solubles y las de elevado peso molecular forman disoluciones coloidales. 12
14 Propiedades electrolíticas: Las proteínas son sustancias anfóteras, es decir se pueden comportar como ácidos o como bases, esta propiedad viene definida por los grupos N-terminal y C- terminas. Esto hace que sean amortiguadores del ph En un medio básico (poca concentración de protones) actúan como aniones (-), pues el grupo carboxilo está ionizado COO - y en un campo eléctrico emigrarán hacia el ánodo (+). En un medio ácido (mucha concentración de protones) actúan como cationes (+), pues el grupo amino se encuentra ionizado NH 3 + y en un campo eléctrico emigrarán hacia el cátodo (-). En un medio neutro los dos grupos funcionales se encuentran ionizados,se dice que la proteína ha alcanzado el punto isoeléctrico (pi). La carga eléctrica de las proteínas y su diferente peso molecular, se aprovecha para separar proteínas mediante electroforesis. Especificidad: Esta propiedad es una consecuencia del elevado número de posibilidades de combinación de los 20 aminoácidos, haciendo posible tal variedad de proteínas que cada individuo posee las suyas. Esa especificidad se debe al diferente orden en el que se disponen los aminoácidos. Una consecuencia de esta especificidad es la existencia de los anticuerpos, que son proteínas del sistema inmunitario que se generan ante la entrada de un cuerpo extraño (antígeno); otra consecuencia es la propiedad antigénica, de manera que cuando se introduce una proteína de un individuo en otro se desencadena la respuesta inmunitaria y los anticuerpos van a reaccionar frente a esa proteína extraña. También esta propiedad es responsable de la especificidad de las enzimas, que catalizan reacciones determinadas. Esta propiedad es interesante en los estudios evolutivos, ya que cuanto más cercanas estén dos especies en la escala evolutiva, sus proteínas serán más parecidas. Acción osmótica: Las proteínas ejercen un efecto osmótico cuando existen barreras que limitan su libre difusión, (membrana semipermeable), porque permiten el paso del agua, pero no de los solutos. 13
15 Si tenemos dos compartimentos acuosos separados por una membrana semipermeable y uno de ellos contiene proteínas, éstas tienden a captar agua del compartimento vecino.este efecto osmótico es proporcional al número de partículas dispersas. Desnaturalización: Cualquier factor que modifique la interacción de la proteína con el disolvente disminuirá su estabilidad en disolución y provocará la precipitación. Así, la desaparición total o parcial de la envoltura acuosa, la neutralización de las cargas eléctricas de tipo repulsivo o la ruptura de los puentes de hidrógeno facilitará la agregación intermolecular y provocará la precipitación. La estructura nativa de la proteína y la desnaturalizada, tienen en común solamente la estructura primaria, es decir, la secuencia de los aa - Los efectos que provoca la desnaturalización en las proteínas, son los siguientes: Una drástica disminución de su solubilidad, ya que los residuos hidrofóbicos del interior aparecen en la superficie. Cambios en las propiedades hidrodinámicas de la proteína: aumenta la viscosidad y disminuye el coeficiente de difusión. Pérdida de las propiedades biológicas. Entre los agentes que pueden desnaturalizar proteínas están los físicos, como el calor y los químicos como el ph, los disolventes, los detergentes y la fuerza iónica. Ejemplos de desnaturalización son: Un aumento de temperatura provoca que la albúmina de la clara de huevo al freírla se desnaturaliza y precipite. Un cambio extremo de ph, provoca que la caseína (proteína soluble) de la leche precipite, por ejemplo cuando las bacterias de la leche fermentan la lactosa a ácido láctico acidificando el medio, esto se aprovecha en la industria para la obtención de yogures. La presencia de ciertas sustancias como la urea, que son semejantes a ciertos aminoácidos, también provoca la desnaturalización de ciertas proteínas. La desnaturalización puede ser reversible ya que es, la estructura primaria la que contiene la información necesaria y suficiente para adoptar niveles superiores de estructuración. Esto ocurre cuando el cambio en las condiciones del medio es gradual y controlado y la proteína recupera su estructura nativa, se dice que se ha renaturalizado. Gracias a esta capacidad de renaturalización, es posible precipitar proteínas de manera selectiva mediante cambios en: 14
16 ü la polaridad del disolvente ü La fuerza iónica ü -El ph ü La temperatura Esta propiedad permite el aislamiento y purificación de proteínas CLASIFICACIÓN DE LAS PROTEÍNAS HOLOPROTEÍNAS: mediante hidrólisis dan solamente aminoácidos v PROTEÍNAS GLOBULARES: Su configuración es más o menos esférica. La mayoría son solubles en agua. - Albúminas (p.m= D): constituyen la fracción principal de las proteínas plasmáticas. Regulan la presión osmótica de la sangre y constituyen la reserva principal de proteínas en el organismo. Transportan hormonas, ac.grasos, cationes, Ej: seroalbúmina en el suero sanguíneo, lactoalbúmina en la leche, ovoalbúmina en la clara de huevo. - Globulinas: Elevado peso molecular ( D). Algunas sólo son solubles en soluciones salinas diluidas. En la sangre humana encontramos: Las α-globulinas, asociadas a la hemoglobina. Las β-globulinas, son transportadoras como la transferrina que transporta hierro en la sangre, la ceruloplasmina que transporta cobre. Las γ- Globulinas, que son los anticuerpos. - Protaminas e Histonas: son proteínas básicas asociadas a ácidos nucleicos. Las histonas forman complejos esféricos proteicos alrededor de los cuales se enrolla la doble hélice de ADN formando los cromosomas. v PROTEÍNAS FIBRILARES O ESCLEROPROTEÍNAS: Forma alargada, estructura tipo α. La mayoría son insolubles en agua. Resisten la acción de las enzimas proteolíticas. - Colágeno: Formado por tres cadenas polipeptídicas diferentes que constituyen una triple hélice. Forma parte de los tejidos conjuntivo, cartilaginoso y óseo constituyendo la piel, los tendones, - Elastinas: Formadas por varias cadenas polipeptídicas que se unen mediante enlaces covalentes formando una matriz elástica. Se localizan en los pulmones, arterias y dermis a los que permite su deformación y su posterior recuperación sin deteriorarse. - Queratinas: Constituyente proteico más abundante de las estructuras epidérmicas como pelo, uñas, plumas, lana, HETEROPROTEÍNAS: Presentan un grupo proteico y un grupo prostético (la parte no proteica). Atendiendo a este último se clasifican en: 15
17 * GLUCOPROTEÍNAS: El grupo prostético es un glúcido (oligosacárido). Muchas son componentes de las membranas celulares y tienen función antigénica, otras tienen funciones específicas. - Hormonas anterohipofisarias: FSH: controla la actividad de los folículos. LH: controla la actividad del cuerpo amarillo. TSH: controla la actividad del tiroides. ICSH: regula la secreción de testosterona. - Mucoproteínas o mucinas: protegen las mucosas del aparato digestivo, respiratorio, y al que deben su aspecto las flemas bronquiales. - Inmunoglobulinas: son cuatro cadenas polipeptídicas unidas a dos moléculas de azúcares. - Los péptidoglicanos que forman parte de la pared de las bacterias. * FOSFOPROTEÍNAS: el grupo prostético es el ácido ortofosfórico. Ej: la caseína que se encuentra en la leche y la vitelina, en la yema de huevo. * NUCLEOPROTEÍNAS: Tienen como grupo prostético un ácido nucleico. LIPOPROTEÍNAS: el grupo prostético es un lípido polar o neutro unido a la proteína mediante un enlace no covalente. Algunas son constituyentes de membrana y otras transportan lípidos. - Quilomicrones: Transportan la grasa desde la mucosa intestinal hasta el tejido adiposo y el hígado, donde se almacena. - VLDL (Lipoporteínas de muy baja densidad) Transportan los triglicéridos formados en el hígado a partir de azúcares, al tejido adiposo y otros órganos. - LDL (Lipoproteínas de densidad baja): Transportan el colesterol y los fosfolípidos a las células de los tejidos, para la síntesis de membranas. Su presencia en cantidades excesivas en las arterias produce arterioesclerosis. - HDL (Lipoproteínas de densidad alta): Se forman en el intestino y van a la sangre. En su superficie se esterifica el colesterol y se transporta al hígado para su degradación y posterior excreción. Es decir retiran y separan ésteres de colesterol de las paredes vasculares. Un aumento de HDL, diminuye el riesgo de arterioesclerosis. * CROMOPROTEÍNAS: Tienen como grupo prostético una sustancia coloreada. - Porfirinas: tienen como grupo prostético la metalporfirina, formada por un anillo tetrapirrólico o porfirina en cuyo interior hay un catión metálico. 16
18 Si es el hierro (Fe 2+ ) se forma el grupo hemo, es el caso de la hemoglobina y la mioglobina, ambas transportan el oxígeno, la primera en la sangre y la segunda en el músculo. La hemoglobina presenta cuatro subunidades, 2α y 2β. Cada una de estas cadenas posee un grupo hemo, y a cada uno de estos grupos se le une una molécula de oxigeno. Por lo tanto una molécula de hemoglobina transporta 4 moléculas de oxígeno. La fijación del oxígeno es cooperativa, es decir, cuando se une una molécula esta aumenta la afinidad para que se una segunda molécula de oxígeno y así sucesivamente. Esta unión es reversible. Cuando la presión parcial de oxígeno es alta se favorece la unión de éste (alvéolos pulmonares). Cuando es baja se favorece la liberación de oxígeno (tejidos). E l monóxido de carbono se une a la hemoglobina con una afinidad 320 veces mayor que el oxígeno, por lo que el envenenamiento por este compuesto (gases de motores, humo de cigarrillos, )se produce por inhibición del transporte de oxígeno. Hay tres tipos de hemoglobina: la A (adulto), la F (fetal) y la A 2. Los citocromos: Son pigmentos de hierro intracelulares. Transportan electrones en la cadena respiratoria de las células. Las cloroplastinas: Como grupo prostético tienen la clorofila, que es una magnesio porfirina. Interviene en la fotosíntesis. - No porfirínicas: Hemocianina: De color azul. Contiene cobre y es el pigmento respiratorio de la sangre de crustáceos y moluscos. Flavoproteínas: El grupo prostético es un derivado de la vitamina B 2 (cadena respiratoria). Carotenoproteínas: como la rodopsina, pigmento fotosensible de los bastones de la retina. Como proteína tiene la opsina y como grupo prostético el retineno (carotenoide) 17
19 18
20 19
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLaM 2016
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 LOGO Composición: C, H, O, N, S (P, Fe, Cu, I, ). LAS PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS El C α es el del amino y el C 1 es el del carboxilo. GRUPO
LOGO Composición: C, H, O, N, S (P, Fe, Cu, I, ). LAS PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS El C α es el del amino y el C 1 es el del carboxilo. GRUPO
Moléculas orgánicas. Proteínas y Lípidos
 Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
PROTEINAS AMINOÁCIDOS FUNCIONES DE LOS AMINOÁCIDOS
 PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
PROTEÍNAS. Las proteínas están constituidas por la unión de numerosas moléculas sencillas (monómeros) denominados aminoácidos.
 PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
Tema 4. Proteínas. Contenidos: Criterios de evaluación mínimos: CONCEPTOS ACORDADOS PARA LA PAEG EN LA UCLM. Proteínas:
 Tema 4. Proteínas Contenidos: 1. Características químicas y clasificación general. 2. Aminoácidos. 1. Clasificación. 2. Propiedades. 3. Enlace peptídico. 3. Péptidos y proteínas. 1. Estructura de las proteínas.
Tema 4. Proteínas Contenidos: 1. Características químicas y clasificación general. 2. Aminoácidos. 1. Clasificación. 2. Propiedades. 3. Enlace peptídico. 3. Péptidos y proteínas. 1. Estructura de las proteínas.
LAS PROTEÍNAS. Fórmula general
 LAS PROTEÍNAS Las proteínas: Los aminoácidos introducción. Propiedades. Actividad óptica y Comportamiento químico. Carácter anfótero. Clasificación de los aminoácidos proteicos. El enlace peptídico. Estructura
LAS PROTEÍNAS Las proteínas: Los aminoácidos introducción. Propiedades. Actividad óptica y Comportamiento químico. Carácter anfótero. Clasificación de los aminoácidos proteicos. El enlace peptídico. Estructura
Composición química de la materia viva. Componentes orgánicos. Proteínas
 Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
PROTEÍNAS. Profa. María Moreno Biología 1º bach.
 PROTEÍNAS Profa. María Moreno Biología 1º bach. DEFINICIÓN Polímeros (macromoléculas) formados por la unión de varios aminoácidos por enlace peptídico. Biomoléculas más abundantes en los s.v., después
PROTEÍNAS Profa. María Moreno Biología 1º bach. DEFINICIÓN Polímeros (macromoléculas) formados por la unión de varios aminoácidos por enlace peptídico. Biomoléculas más abundantes en los s.v., después
Soluciones del EXAMEN 2º BCHTO TEMAS LÍPIDOS Y PROTEÍNAS
 Soluciones del EXAMEN 2º BCHTO TEMAS LÍPIDOS Y PROTEÍNAS 1.- Los lípidos: a) Qué significa que los ácidos grasos son moléculas anfipáticas? Cómo se comportan estas moléculas en agua? Los ácidos grasos
Soluciones del EXAMEN 2º BCHTO TEMAS LÍPIDOS Y PROTEÍNAS 1.- Los lípidos: a) Qué significa que los ácidos grasos son moléculas anfipáticas? Cómo se comportan estas moléculas en agua? Los ácidos grasos
Tema I: Biomoléculas
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
Colegio El Valle Departamento de Biología 2º Bachillerato TEMA 5: AMINOÁCIDOS Y PROTEÍNAS
 TEMA 5: AMINOÁCIDOS Y PROTEÍNAS Los aminoácidos. - Compuestos orgánicos sencillos, de bajo peso molecular. Se unen entre sí formando proteínas. - Químicamente están formados por C, H, O y N. - Presentan
TEMA 5: AMINOÁCIDOS Y PROTEÍNAS Los aminoácidos. - Compuestos orgánicos sencillos, de bajo peso molecular. Se unen entre sí formando proteínas. - Químicamente están formados por C, H, O y N. - Presentan
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
TEMA 4 LAS PROTEÍNAS
 TEMA 4 LAS PROTEÍNAS 1. CARACTERISTICAS GENERALES 2. AMINOACIDOS 2.1. ESTRUCTURA 2.2. PROPIEDADES 2.3. CLASIFICACION 3. ENLACE PEPTIDICO 4. PEPTIDOS Y PROTEINAS 5. ESTRUCTURA DE LAS PROTEINAS 5.1. ESTRUCTURA
TEMA 4 LAS PROTEÍNAS 1. CARACTERISTICAS GENERALES 2. AMINOACIDOS 2.1. ESTRUCTURA 2.2. PROPIEDADES 2.3. CLASIFICACION 3. ENLACE PEPTIDICO 4. PEPTIDOS Y PROTEINAS 5. ESTRUCTURA DE LAS PROTEINAS 5.1. ESTRUCTURA
jueves, 18 de septiembre de 14
 BIOELEMENTOS Y BIOMOLÉCULAS BIOELEMENTO Elemento químico que constituye las moléculas de los seres vivos. Se dividen en : PRIMARIOS: C,H,O,N,P y S. Son los más abundantes (96,2%) SECUNDARIOS: Na+, K+,
BIOELEMENTOS Y BIOMOLÉCULAS BIOELEMENTO Elemento químico que constituye las moléculas de los seres vivos. Se dividen en : PRIMARIOS: C,H,O,N,P y S. Son los más abundantes (96,2%) SECUNDARIOS: Na+, K+,
Tema 5: aminoácidos y proteínas
 1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Biología y Geología. La naturaleza básica. de la vida. 1º Bachillerato. Manuel López Naval 1. Características. de la vida. Biomoléculas.
 Características de la vida La naturaleza básica de la vida Complejidad molecular Niveles de organización Automantenimiento Reproducción Ciclo vital Sensibilidad Manuel López Naval Tabla periódica Bioelementos
Características de la vida La naturaleza básica de la vida Complejidad molecular Niveles de organización Automantenimiento Reproducción Ciclo vital Sensibilidad Manuel López Naval Tabla periódica Bioelementos
I) Biomoléculas 5) Proteínas I-5 PROTEÍNAS
 I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
TEORIA CELULAR. En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS
 TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS. Nombre:... Curso:.. Fecha:...
 Liceo La Florida Prof: M. Ibáñez H. GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS Nombre:... Curso:.. Fecha:... Introducción: Nuestro organismo produce proteínas, sin embargo si a las células les falta 1 ingrediente,
Liceo La Florida Prof: M. Ibáñez H. GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS Nombre:... Curso:.. Fecha:... Introducción: Nuestro organismo produce proteínas, sin embargo si a las células les falta 1 ingrediente,
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
Agua, carbohidratos y Lípidos
 Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Niveles de organización biológica. La composición de los seres vivos
 Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
IES La Gándara PREGUNTAS PAU CyL Dpto. Biología y Geología. EJERCICIOS PAU (Castilla y León)
 Tema 5. PRTEÍNAS y ENZIMAS EJERCICIS PAU (Castilla y León) Fuente: http://www.usal.es/node/28881 1. a) Dibuje la fórmula estructural del hexapéptido Gly-Ser-Gly-Ala-Gly-Ala y señale con claridad los enlaces
Tema 5. PRTEÍNAS y ENZIMAS EJERCICIS PAU (Castilla y León) Fuente: http://www.usal.es/node/28881 1. a) Dibuje la fórmula estructural del hexapéptido Gly-Ser-Gly-Ala-Gly-Ala y señale con claridad los enlaces
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
Estructura tridimensional de las proteínas
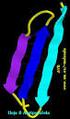 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
Biomoléculas orgánicas: Proteínas y Ácidos nucleicos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Características generales y funciones.
 1.6.-Proteínas 1.6.1.- Características generales y funciones. Todas las proteínas contienen C, H, O y N, además la mayoría contienen S y algunas P, Fe, Zn y Cu. Las proteínas constituyen el grupo de moléculas
1.6.-Proteínas 1.6.1.- Características generales y funciones. Todas las proteínas contienen C, H, O y N, además la mayoría contienen S y algunas P, Fe, Zn y Cu. Las proteínas constituyen el grupo de moléculas
CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia.
 CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia. PROTEINAS Las proteínas son las moléculas orgánicas más abundantes; en la mayoría de los
CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia. PROTEINAS Las proteínas son las moléculas orgánicas más abundantes; en la mayoría de los
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Bloque I: Proteínas y enzimas
 Bloque I: Proteínas y enzimas 1. BASE FÍSICO-QUÍMICA DE LA VIDA PROTEÍNAS Y ENZIMAS CONTENIDOS 1.5. PROTEÍNAS 1.5.1. Concepto e importancia biológica. 1.5.2. Aminoácidos. Enlace peptídico. 1.5.3. Estructura
Bloque I: Proteínas y enzimas 1. BASE FÍSICO-QUÍMICA DE LA VIDA PROTEÍNAS Y ENZIMAS CONTENIDOS 1.5. PROTEÍNAS 1.5.1. Concepto e importancia biológica. 1.5.2. Aminoácidos. Enlace peptídico. 1.5.3. Estructura
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
Tema 5 Estructura cuaternaria de proteínas
 Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Tema 1: Los seres vivos: composición y función
 Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
PROTEINAS. Licda. Lilian Judith Guzmán Melgar
 CONJUGADAS SIMPLES PROTEINAS Licda. Lilian Judith Guzmán Melgar 2016 30 Las proteínas son macromoléculas biológicas, formadas de polímeros lineales de aminoácidos, de dimensión variable. Además de Carbono,
CONJUGADAS SIMPLES PROTEINAS Licda. Lilian Judith Guzmán Melgar 2016 30 Las proteínas son macromoléculas biológicas, formadas de polímeros lineales de aminoácidos, de dimensión variable. Además de Carbono,
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas.
 Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
Biología General y Metodología de las Ciencias 2016 BIOMOLÉCULAS
 BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
inactivación de materiales tóxicos o peligrosos, etc.).
 Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS
 AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos al mismo
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos al mismo
Estructura secundaria de las proteínas
 Estructura secundaria de las proteínas Niveles de estructuración en las proteínas Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena
Estructura secundaria de las proteínas Niveles de estructuración en las proteínas Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena
Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M.
 COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Base molecular de la vida. TEMA 6 LIBRO (Pág. 131)
 Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos Bioelementos
Base molecular de la vida TEMA 6 LIBRO (Pág. 131) GUIÓN TEMA Bioelementos Biomoléculas inorgánicas Agua Sales minerales Ósmosis Biomoléculas orgánicas Glúcidos Lípidos Proteínas Ácidos nucleicos Bioelementos
Polímero corto Monómero. síntesis. degradación
 Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo.
 1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
EJERCICIOS TEMA 1 BIOLOGÍA ORIENTACIONES
 EJERCICIOS TEMA 1 BIOLOGÍA ORIENTACIONES 1.- Definir qué es un bioelemento. Conocer su clasificación en primarios, secundarios y oligoelementos (esenciales en todos los organismos y no esenciales en todos
EJERCICIOS TEMA 1 BIOLOGÍA ORIENTACIONES 1.- Definir qué es un bioelemento. Conocer su clasificación en primarios, secundarios y oligoelementos (esenciales en todos los organismos y no esenciales en todos
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares.
 Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
BIOELEMENTOS AGUA Y SALES MINERALES
 BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
BIOELEMENTOS AGUA Y SALES MINERALES BIOELEMENTOS PROPIEDADES Capas electrónicas externas incompletas ENLACES COVALENTES Nº atómico bajo ENLACES ESTABLES Oxígeno y Nitrógeno electronegativos BIOMOLÉCULAS
BLOQUE 1: ÁTOMOS Y MOLÉCULAS
 BLOQUE 1: ÁTOMOS Y MOLÉCULAS 1 CAPÍTULO 1: INTRODUCCIÓN A LA QUÍMICA Cuestionario de autoevaluación 1. Cuáles son las partículas subatómicas y qué características tienen? 2. Por qué el átomo es eléctricamente
BLOQUE 1: ÁTOMOS Y MOLÉCULAS 1 CAPÍTULO 1: INTRODUCCIÓN A LA QUÍMICA Cuestionario de autoevaluación 1. Cuáles son las partículas subatómicas y qué características tienen? 2. Por qué el átomo es eléctricamente
QUÍMICA PARA COMPRENDER LA VIDA
 CIENCIAS BIOLÓGICAS 2 - UNIDAD 1 Prof. María Paula García 1 QUÍMICA PARA COMPRENDER LA VIDA Todo lo que nos rodea está constituido por materia. La materia es todo lo que existe, ocupa un lugar en el espacio,
CIENCIAS BIOLÓGICAS 2 - UNIDAD 1 Prof. María Paula García 1 QUÍMICA PARA COMPRENDER LA VIDA Todo lo que nos rodea está constituido por materia. La materia es todo lo que existe, ocupa un lugar en el espacio,
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
PAGS LIBRO PROTEÍNAS
 PAGS. 140 142 LIBRO PROTEÍNAS Las proteínas son las moléculas orgánicas más abundantes en las células Son polímeros formados por la unión de subunidades monoméricas; los aminoácidos El orden en el que
PAGS. 140 142 LIBRO PROTEÍNAS Las proteínas son las moléculas orgánicas más abundantes en las células Son polímeros formados por la unión de subunidades monoméricas; los aminoácidos El orden en el que
COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA
 COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA ELEMENTOS QUÍMICOS: 110 BIOELEMENTOS ( Elementos biogénicos): 25-30 Forman parte de la materia viva, aunque no son exclusivos de ella No son los más abundantes, pero
COMPOSICIÓN QUÍMICA DE LA MATERIA VIVA ELEMENTOS QUÍMICOS: 110 BIOELEMENTOS ( Elementos biogénicos): 25-30 Forman parte de la materia viva, aunque no son exclusivos de ella No son los más abundantes, pero
De qué está compuesta la materia viva?
 De qué está compuesta la materia viva? Bioelementos. Son los elementos químicos que constituyen las moléculas de los seres vivos. De acuerdo a su abundancia, se clasifican en: Primarios (96%): C, H, O,
De qué está compuesta la materia viva? Bioelementos. Son los elementos químicos que constituyen las moléculas de los seres vivos. De acuerdo a su abundancia, se clasifican en: Primarios (96%): C, H, O,
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
1.- CONCEPTO Y CLASIFICACIÓN
 U. D. 3 LOS LIPIDOS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 3 LOS LIPIDOS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
Universidad Nacional de la Patagonia San Juan Bosco Facultad de Ciencias Naturales Química Biológica Introducción
 Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO
 COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade
 +UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
+UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
BIOQUIMICA Y FISIOLOGÍA MICROBIANA. Dra. Yenizey Merit Alvarez Cisneros
 BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS
 Las proteínas AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos
Las proteínas AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
Análisis de proteínas
 Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
SOLUCIONARIO GUÍAS ESTÁNDAR ANUAL. Biomoléculas orgánicas: proteínas y ácidos nucleicos SGUICES003CB31-A16V1
 SOLUCIONARIO GUÍAS ESTÁNDAR ANUAL Biomoléculas orgánicas: proteínas y ácidos nucleicos SGUICES003CB31-A16V1 SOLUCIONARIO GUÍA Biomoléculas orgánicas: proteínas y ácidos nucleicos Ítem Alternativa Habilidad
SOLUCIONARIO GUÍAS ESTÁNDAR ANUAL Biomoléculas orgánicas: proteínas y ácidos nucleicos SGUICES003CB31-A16V1 SOLUCIONARIO GUÍA Biomoléculas orgánicas: proteínas y ácidos nucleicos Ítem Alternativa Habilidad
