FICHA TÉCNICA. 1 ml de concentrado para solución para perfusión contiene 10 mg de docetaxel.
|
|
|
- Ramón Calderón Soler
- hace 6 años
- Vistas:
Transcripción
1 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Docetaxel Hospira 10 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de concentrado para solución para perfusión contiene 10 mg de docetaxel. Vial de 20mg/2 ml: Un vial de 2 ml contiene 20 mg de docetaxel. Vial de 80mg/8 ml: Un vial de 8 ml contiene 80 mg de docetaxel Vial de 120mg/16 ml: Un vial de 16 ml contiene 160 mg de docetaxel Excipiente(s) con efecto conocido Vial de 20mg/2 ml: Cada vial de 2 ml contiene 0.46 ml de etanol anhídrido (363 mg). Vial de 80mg/8 ml: Cada vial de 8 ml contiene 1,84 ml de etanol anhídrido (1452 mg). Vial de 120mg/16 ml: Cada vial de 16 ml contiene 3,68 ml de etanol anhídrido (2904 mg). Para consultar la lista completa de excipientes, ver sección Descripción general 2.2 Composición cualitativa y cuantitativa Excipiente(s) con efecto conocido 3. FORMA FARMACÉUTICA Concentrado para solución para perfusión Solución transparente de incolora a amarillo claro. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Cáncer de mama 1 de 42
2 Docetaxel Hospira en combinación con doxorubicina y ciclofosfamida está indicado para el tratamiento adyuvante de pacientes con: - cáncer de mama operable con afectación ganglionar - cáncer de mama operable sin afectación ganglionar Para los pacientes con cáncer de mama operable sin afectación ganglionar, el tratamiento adyuvante debería restringirse a los pacientes elegibles para recibir quimioterapia de acuerdo con los criterios establecidos internacionalmente para el tratamiento primario de cáncer de mama precoz (ver sección 5.1). Docetaxel Hospira en combinación con doxorubicina está indicado para el tratamiento de pacientes con cáncer de mama localmente avanzado o metastásico, que no hayan recibido previamente terapia citotóxica para esta condición. La monoterapia con Docetaxel Hospira está indicada para el tratamiento de pacientes cáncer de mama localmente avanzado o metastásico tras el fracaso de la terapia citotóxica. La quimioterapia previa debe de haber incluido una antraciclina o un agente alquilante. Docetaxel Hospira en combinación con trastuzumab está indicado para el tratamiento de pacientes con cáncer de mama metastásico cuyos tumores sobreexpresan HER2 y que no hayan recibido previamente quimioterapia para enfermedad metastásica. Docetaxel Hospira en combinación con capecitabina está indicado para el tratamiento de pacientes cáncer de mama localmente avanzado o metastásico tras el fracaso de la quimioterapia citotóxica. La terapia previa debe de haber incluido una antraciclina. Cáncer de pulmón de célula no pequeña Docetaxel Hospira está indicado para el tratamiento de pacientes con cáncer de pulmón de célula no pequeña localmente avanzado o metastásico tras el fracaso de la quimioterapia previa. Docetaxel Hospira en combinación con cisplatino está indicado para el tratamiento de pacientes con cáncer de pulmón de célula no pequeña localmente avanzado o metastásico no extirpable, cuando los pacientes no hayan recibido previamente quimioterapia para esta condición. Cáncer de próstata Docetaxel Hospira en combinación con prednisona o prednisolona está indicado para el tratamiento de pacientes con cáncer de próstata hormona-refractario metastásico. Adenocarcinoma gástrico Docetaxel Hospira en combinación con cisplatino y 5-fluorouracilo está indicado para el tratamiento de pacientes con adenocarcinoma gástrico metastásico, incluyendo adenocarcinoma de la unión gastroesofágica, que no hayan recibido quimioterapia previa para la enfermedad metastásica. Cáncer de cabeza y cuello Docetaxel Hospira en combinación con cisplatino y 5-fluorouracilo está indicado para el tratamiento de pacientes con carcinoma de célula escamosa localmente avanzado de la cabeza y el cuello. 4.2 Posología y forma de administración Docetaxel Hospira es sólo para uso intravenoso. El uso de docetaxel debe limitarse a unidades especializadas en la administración de quimioterapia citotóxica, y debe administrarse bajo la supervisión de un médico cualificado en el uso de quimioterapia anticancerosa (ver sección 6.6). 2 de 42
3 Dosis recomendada Para el cáncer de mama, de pulmón de célula no pequeña, gástrico y de cabeza y cuello, puede emplearse premedicación consistente en un corticoesteroide oral tal como dexametasona 16 mg al día (por ejemplo, 8 mg dos veces al día) durante 3 días comenzando a partir de 1 antes de la administración de docetaxel, a menos que esté contraindicado (ver sección 4.4). Puede utilizarse G-CSF profiláctico para mitigar el riesgo de toxicidades hematológicas. Para el cáncer de próstata, dado el uso concurrente de prednisona o prednisolona, el régimen de premedicación recomendado es dexametasona oral 8 mg 12 horas, 3 horas y 1 hora antes de la perfusión de docetaxel (ver sección 4.4). Docetaxel se administra como una perfusión de una hora, cada tres semanas. Cáncer de mama En el tratamiento adyuvante de cáncer de mama operable con y sin afectación ganglionar, la dosis recomendada de docetaxel es de 75 mg/m 2 administrada 1 hora después de doxorubicina 50 mg/m 2 y ciclofosfamida 500 mg/m 2 cada 3 semanas durante 6 ciclos (tratamiento TAC) (ver también ajuste de dosis durante el tratamiento ). Para el tratamiento de pacientes con cáncer de mama localmente avanzado o metastásico, la dosis recomendada de docetaxel es de 100 mg/m 2 en la monoterapia. En el tratamiento de primera línea, docetaxel 75 mg/m 2 se administra en terapia combinada con doxorubicina (50 mg/m 2 ). En combinación con trastuzumab la dosis recomendada de docetaxel es de 100 mg/m 2 cada tres semanas, mientras que el trastuzumab se administra semanalmente. En un ensayo pivotal, la perfusión inicial de docetaxel comenzó el día después de la primera dosis de trastuzumab. Las dosis subsiguientes de docetaxel se administraron inmediatamente después de completarse la perfusión de trastuzumab, si la dosis precedente de trastuzumab había sido bien tolerada. Para la dosis y administración de trastuzumab, consultar el resumen de características de producto de trastuzumab. En combinación con capecitabina, la dosis recomendada de docetaxel es de 75 mg/m 2 cada tres semanas, en combinación con capecitabina 1250 mg/m 2 dos veces al día (dentro de los 30 minutos posteriores a una comida) durante 2 semanas, seguido de un período de descanso de 1 semana. Para calcular la dosis de capecitabina según la superficie corporal, consultar el resumen de las características de producto de capecitabina. Cáncer de pulmón de célula no pequeña En pacientes que nunca antes hayan recibido quimioterapia tratados para cáncer de pulmón de célula no pequeña, el régimen de dosis recomendado de docetaxel es de 75 mg/m 2 seguido inmediatamente por cisplatino 75 mg/m 2 durante un período de minutos. Para el tratamiento tras el fracaso de una quimioterapia anterior a base de platino, la dosis recomendada es de 75 mg/m 2 como agente único. Cáncer de próstata La dosis recomendada de docetaxel es de 75 mg/m 2. También se administra continuamente prednisona o prednisolona 5 mg por vía oral dos veces al día (ver sección 5.1). Adenocarcinoma gástrico La dosis recomendada de docetaxel es de 75 mg/m 2 como una perfusión de 1 hora, seguida de cisplatino 75 mg/m 2, como una perfusión de 1 a 3 horas (ambas sólo en el día 1), seguida de 5-fluorouracilo 750 mg/m 2 3 de 42
4 por día administrado como una perfusión continua las 24 horas durante 5 días, comenzando al finalizar la perfusión de cisplatino. El tratamiento se repite cada tres semanas. Los pacientes deben premedicarse con antieméticos, y recibir hidratación apropiada para la administración de cisplatino. Debe usarse G-CSF profiláctico para mitigar el riesgo de toxicidades hematológicas (ver también ajuste de dosis durante el tratamiento ). Cáncer de cabeza y cuello Los pacientes deben premedicarse con antieméticos y recibir hidratación apropiada (antes y después de la administración de cisplatino). Puede usarse G-CSF profiláctico para mitigar el riesgo de toxicidades hematológicas. Todos los pacientes en el grupo tratado con docetaxel de los estudios TAX 323 y TAX 324 recibieron antibióticos profilácticos. Quimioterapia de inducción seguida de radioterapia (TAX 323) Para el tratamiento de inducción de pacientes con carcinoma no operable de célula escamosa localmente avanzado de cabeza y cuello (SCCHN), la dosis recomendada de docetaxel es de 75 mg/m 2 como una perfusión de 1 hora seguida de cisplatino 75 mg/m 2 durante 1 hora, en el día uno, seguida de 5-fluorouracilo como perfusión continua, 750 mg/m 2 por día durante cinco días. Este régimen se administra cada 3 semanas durante 4 ciclos. Después de la quimioterapia los pacientes deben recibir radioterapia. Quimioterapia de inducción seguida de quimiorradioterapia (TAX 324) Para el tratamiento de inducción de pacientes con carcinoma de célula escamosa de cabeza y cuello (SCCHN) localmente avanzado (técnicamente inextirpable, con baja probabilidad de cura quirúrgica, y dirigido a la conservación de órganos), la dosis recomendada de docetaxel es de 75 mg/m 2 como perfusión intravenosa de 1 hora en el día 1, seguida de cisplatino 100 mg/m2 administrado como una perfusión de 30 minutos a 3 horas, seguida de 5-fluorouracilo 1000 mg/m 2 /día como perfusión continua desde el día 1 al día 4. Este régimen se administra cada 3 semanas durante 3 ciclos. Después de la quimioterapia los pacientes deben recibir quimiorradioterapia. Para modificaciones en las dosis de cisplatino y 5-fluorouracilo, consultar los correspondientes resúmenes de características del producto. Ajuste de dosis durante el tratamiento General Docetaxel debe administrarse cuando el recuento de neutrófilos es células/mm 3. En pacientes que presentaron neutropenia febril, neutrófilos <500 células/mm 3 durante más de una semana, reacciones cutáneas graves o acumulativas, o neuropatía periférica grave, la dosis de docetaxel debe reducirse de 100 mg/m 2 a 75 mg/m 2 y/o 75 mg/m 2 a 60 mg/m 2. Si el paciente sigue experimentando estas reacciones con 60 mg/m 2, el tratamiento debe interrumpirse. Terapia adyuvante para el cáncer de mama En un ensayo pivotal en pacientes que recibieron terapia adyuvante para cáncer de mama, y que experimentaron neutropenia complicada (incluyendo neutropenia prolongada, neutropenia febril o infección), se recomendó el uso de G-CSF para aportar cobertura profiláctica (por ejemplo, día 4 a 11) en todos los ciclos subsiguientes. En los pacientes que siguieron experimentando esta reacción debió continuarse G-CSF y reducirse la dosis de docetaxel a 60 mg/m 2. No obstante, en la práctica clínica la neutropenia puede producirse antes. Por lo tanto, el uso de G-CSF debe considerarse en función del riesgo de neutropenia de los pacientes y las recomendaciones actuales. En los pacientes que experimentaron estomatitis de Grado 3 ó 4 la dosis debe reducirse a 60 mg/m 2. En combinación con cisplatino 4 de 42
5 Para los pacientes que inicialmente reciben una dosis de docetaxel 75 mg/m 2 en combinación con cisplatino y cuyo peor recuento de plaquetas durante el curso de terapia previo es < células/mm 3, o en pacientes que experimentan neutropenia febril, o en pacientes con toxicidades no hematológicas de seriedad, la dosis de docetaxel en los ciclos subsiguientes debe reducirse a 65 mg/m 2. Para el ajuste de dosis de cisplatino, consultar el resumen de las características de producto del fabricante. En combinación con capecitabina Para modificaciones en la dosis de capecitabina, consultar el resumen de las características del producto de la capecitabina. Para pacientes que desarrollan el primer episodio de una toxicidad de Grado 2, que persiste al momento del siguiente tratamiento con docetaxel / capecitabina, debe retrasarse el tratamiento hasta que el episodio disminuya a Grado 0-1, y luego reanudar la dosis original al 100%. Para pacientes que desarrollan un segundo episodio de toxicidad de Grado 2, o el primer episodio de toxicidad de Grado 3 en cualquier momento durante el ciclo de tratamiento, retrasar el tratamiento hasta que el episodio disminuya a Grado 0-1, y luego reanudar el tratamiento con docetaxel 55 mg/m². Para cualquier episodio de toxicidad subsiguiente, o para toxicidades de Grado 4, interrumpir la dosis de docetaxel. Para modificaciones en la dosis de trastuzumab, consultar el resumen de las características del producto de trastuzumab. En combinación con cisplatino y 5-fluorouracilo: Si se produce un episodio de neutropenia febril, neutropenia prolongada o infección neutropénica a pesar del uso de G-CSF, la dosis de docetaxel debe reducirse de 75 a 60 mg/m 2. Si se producen episodios subsiguientes de neutropenia complicada, la dosis de docetaxel debe reducirse de 60 a 45 mg/m 2. En el caso de trombocitopenia de Grado 4, la dosis de docetaxel debe reducirse de 75 a 60 mg/m 2. Los pacientes no deberán recibir ciclos subsiguientes de docetaxel hasta que los neutrófilos hayan vuelto a alcanzar un nivel > células/mm3 y las plaquetas un nivel > células/mm3. Debe interrumpirse el tratamiento si estas toxicidades persisten. (Ver sección 4.4). Modificaciones de dosis recomendadas para toxicidades gastrointestinales en pacientes tratados con docetaxel en combinación con cisplatino y 5-fluorouracilo (5-FU): Toxicidad Ajuste de dosis Diarrea grado 3 Primer episodio: reducir la dosis de 5-FU en un 20%. Segundo episodio: luego reducir la dosis de docetaxel en un 20%. Diarrea grado 4 Primer episodio: reducir la dosis de docetaxel y 5-FU en un 20%. Estomatitis/mucositis grado 3 Estomatitis/mucositis grado 4 Segundo episodio: interrumpir el tratamiento. Primer episodio: reducir la dosis de 5-FU en un 20%. Segundo episodio: sólo interrumpir 5-FU en todos los ciclos subsiguientes. Tercer episodio: reducir la dosis de docetaxel en un 20%. Primer episodio: sólo interrumpir 5-FU en todos los ciclos subsiguientes Segundo episodio: reducir la dosis de docetaxel en un 20%. 5 de 42
6 Para los ajustes de dosis de cisplatino y 5-fluorouracilo consultar el resumen de las características del producto del fabricante. En el ensayo de importancia clave con pacientes que recibieron un tratamiento de inducción con docetaxel para carcinoma de célula escamosa de la cabeza y el cuello localmente avanzado e inoperable, y que experimentaron neutropenia complicada (incluyendo neutropenia prolongada, neutropenia febril, o infección), se recomendó el uso de G-CSF para aportar cobertura profiláctica (por ejemplo, día 6-15) en todos los ciclos subsiguientes. Poblaciones especiales: Pacientes con alteración hepática: Sobre la base de los datos farmacocinéticos condocetaxel 100 mg/m² como agente único, los pacientes con elevación de ambas transaminasas (ALT y/o AST) superior a 1,5 veces el límite superior del valor normal (LSGN) y fosfatasa alcalina superior a 2,5 veces el LSGN, la dosis recomendada de docetaxel es 75 mg/m2 (ver secciones 4.4 y 5.2). Para los pacientes con bilirrubina sérica >al LSGN y/o ALT y AST >3,5 veces el LSGN asociado con fosfatasa alcalina >6 veces el LSGN, no se recomienda una reducción de dosis, y no debe usarse docetaxel a menos que esté estrictamente indicado. En combinación con cisplatino y 5-fluorouracilo para el tratamiento de pacientes con adenocarcinoma gástrico, el ensayo clínico de importancia clave excluyó los pacientes con ALT y/o AST > 1,5 LSGN asociado con fosfatasa alcalina > 2,5 LSGN, y bilirrubina > 1 x LSGN. Para estos pacientes no pueden recomendarse reducciones de dosis, y no debe usarse docetaxel a menos que esté estrictamente indicado. No se dispone de datos en pacientes con alteración hepática tratados con docetaxel en combinación en otras indicaciones. Niños y adolescentes: La experiencia en niños y adolescentes es limitada. Pacientes de edad avanzada: En base al análisis farmacocinético de esta población, no existen instrucciones especiales para el uso en pacientes de edad avanzada. En combinación con capecitabina, para pacientes de o mayores de 60 años de edad, se recomienda una reducción de la dosis inicial de capecitabina a 75% (consultar el resumen de las características de producto de la capecitabina). 4.3 Contraindicaciones Docetaxel está contraindicado en pacientes que; Sufren de hipersensibilidad conocida a docetaxel o a cualquiera de sus excipientes. Presentan un recuento de neutrófilos <1.500 células/mm3 a la línea basal. Presentan una grave alteración hepática, dado que no existen datos disponibles (ver secciones 4.2 y 4.4). Se deben tener en cuenta las contraindicaciones de los otros medicamentos que se usan en combinación con docetaxel. 4.4 Advertencias y precauciones especiales de empleo Para cáncer de mama y de pulmón de célula no pequeña, la premedicación con un corticoesteroide oral, tal como dexametasona 16 mg por día (por ejemplo, 8 mg, dos veces al día) durante 3 días a partir del día anterior a la administración de docetaxel, a menos que esté contraindicado, puede reducir la incidencia y severidad de la retención de líquido, y también la severidad de las reacciones de hipersensibilidad. Para el 6 de 42
7 cáncer de próstata, la premedicación es dexametasona oral 8 mg, 12 horas, 3 horas y 1 hora antes de la perfusión de docetaxel (ver sección 4.2). Hematología La neutropenia es el efecto adverso más frecuente de docetaxel. Los peores recuentos (nadir) de neutrófilos se produjeron a la mediana de 7 días, pero este intervalo puede ser inferior en pacientes muy pretratados. La frecuente monitorización de recuentos de sangre completos debe efectuarse en todos los pacientes tratados con docetaxel. Los pacientes deben volver a tratarse con docetaxel cuando los neutrófilos vuelvan a alcanzar un nivel células/mm3 (ver sección 4.2). En el caso de neutropenia grave (<500 células/mm 3 durante 7 días o más) durante un curso de terapia con docetaxel, se recomienda una reducción en la dosis para los cursos de terapia subsiguientes, o el uso de medidas sintomáticas apropiadas (ver sección 4.2). En pacientes tratados con docetaxel en combinación con cisplatino y 5-fluorouracilo (TCF) y docetaxel en combinación con doxorubicina y ciclofosfamida (TAC), se produjo un menor índice de neutropenia febril e infección neutropénica cuando los pacientes recibieron G-CSF profiláctico. Los pacientes tratados con TCF y TAC (para cáncer de mama) deben recibir G-CSF profiláctico para mitigar el riesgo de neutropenia complicada (neutropenia febril, neutropenia prolongada o infección neutropénica). Los pacientes que reciben TCF y TAC deben monitorizarse con atención (ver sección 4.2 y 4.8). Reacciones de hipersensibilidad Deben vigilarse atentamente a los pacientes para detectar toda posible reacción de hipersensibilidad, en especial durante la primera y segunda perfusión. Las reacciones de hipersensibilidad pueden producirse a los pocos minutos de iniciarse la perfusión de docetaxel, y por lo tanto, debe contarse con elementos para el tratamiento de hipotensión y broncoespasmo. Si se producen reacciones de hipersensibilidad, síntomas menores tales como enrojecimiento o reacciones cutáneas localizadas no precisan la interrupción de la terapia. No obstante, reacciones graves, tales como hipotensión, broncoespasmo o erupción o eritema generalizados graves requieren la inmediata discontinuación de docetaxel y la aplicación de la terapia apropiada. No debe volver a instaurar la terapia con docetaxel en los pacientes que hayan desarrollado reacciones de hipersensibilidad graves. Reacciones cutáneas Se ha observado eritema cutáneo localizado en las extremidades (palmas de las manos y plantas de los pies) con edema seguido de descamación. Se han informado síntomas tales como erupciones seguidas de descamación que provocaron la interrupción o discontinuación del tratamiento con docetaxel (ver sección 4.2). Retención de líquido Los pacientes con grave retención de líquido, tal como efusión pleural, efusión pericardial y ascitis deben monitorizarse atentamente. Trastornos respiratorios Se han notificado síndrome de dificultad respiratoria agudo, neumonía intersticial/neumonitis, enfermedad pulmonar intersticial, fibrosis pulmonar e insuficiencia respiratoria que pueden estar asociados con desenlaces mortales. Se han notificado casos de neumonitis por radiación en pacientes que recibieron radioterapia concomitante. Si empeoran o se desarrollan nuevos síntomas pulmonares, los pacientes deben ser estrechamente monitorizados, diagnosticados rápidamente y tratados adecuadamente. Se recomienda la interrupción del tratamiento con docetaxel hasta que el diagnóstico está disponible. El uso precoz de medidas de apoyo puede ayudar a mejorar la condición. Se debe evaluar cuidadosamente el beneficio de reanudar el tratamiento con docetaxel Pacientes con alteración hepática 7 de 42
8 En pacientes tratados con docetaxel 100 mg/m 2 como agente único, que presentan niveles de transaminasas séricas (ALT y/o AST) superiores a 1,5 veces el LSGN concurrente con niveles de fosfatasa alcalina en el suero superiores a 2,5 veces el LSGN, existe mayor riesgo de desarrollar reacciones adversas graves tales como muerte tóxica, incluyendo sepsis y hemorragia gastrointestinal que pueden ser fatales, neutropenia febril, infecciones, trombocitopenia, estomatitis y astenia. En consecuencia, la dosis recomendada de docetaxel en estos pacientes con resultados elevados en los análisis de función hepática (LFT) es 75mg/m2 y deben medirse los LFT a la línea basal, y antes de cada ciclo (ver sección 4.2). Para pacientes con niveles de bilirrubina sérica >el LSGN y/o ALT y AST >3,5 x el LSGN concurrente con niveles de fosfatasa alcalina en el suero >6 veces el LSGN, no puede recomendarse una reducción de dosis, y no debe usarse docetaxel a menos que esté estrictamente indicado. En combinación con cisplatino y 5- fluorouracilo para el tratamiento de pacientes con adenocarcinoma gástrico, un ensayo clínico de importancia clave excluyó los pacientes con ALT y/o AST >1,5 veces el LSGN asociado con fosfatasa alcalina >2,5 veces el LSGN y bilirrubina >1 x LSGN; para estos pacientes no puede recomendarse una reducción de dosis, y no debe usarse docetaxel a menos que esté estrictamente indicado. No hay datos disponibles en pacientes con alteración de la función hepática tratados con docetaxel en combinación, en otras indicaciones. Pacientes con alteración de la función renal No hay datos disponibles en pacientes con disfunción renal grave tratados con docetaxel. Docetaxel Hospira 10 mg/ml solución para perfusión contiene PEG300, que puede incrementar el riesgo de nefrotoxicidad en pacientes con disfunción renal. Sistema nervioso El desarrollo de neurotoxicidad periférica grave hace necesaria la reducción de la dosis (ver sección 4.2). Dado que docetaxel contiene etanol (182 mg/ml), debe considerarse la posibilidad de efectos al sistema nervioso central y otros efectos. La cantidad de alcohol en este medicamento puede alterar los efectos de otros medicamentos. Toxicidad cardiaca Se ha observado fallo cardíaco en pacientes tratados con docetaxel en combinación con trastuzumab, en particular, después de quimioterapia con una antraciclina (doxorubicina o epirubicina). Tal puede ser de moderada a grave, y ha estado relacionada con muerte (ver sección 4.8). Los pacientes que son candidatos para el tratamiento con docetaxel en combinación con trastuzumab deben pasar por una evaluación cardíaca de línea basal. La función cardíaca debe monitorizarse adicionalmente durante el tratamiento (por ejemplo, cada tres meses) para ayudar a identificar los pacientes que puedan desarrollar disfunción cardíaca. Para mayores detalles, consultar el Resumen de las Características del Productos de trastuzumab. Trastornos oculares Se ha notificado edema macular cistoide (EMC) en pacientes tratados con docetaxel. Los pacientes con deterioro de la visión deben someterse de forma inmediata a un examen oftalmológico completo. En caso de que se diagnostique EMC, el tratamiento con docetaxel debe interrumpirse, e iniciar un tratamiento adecuado (ver sección 4.8). Otros Tantos hombres como mujeres deben tomar medidas anticonceptivas (ver sección 4.6). Se debe evitar el uso concomitante de docetaxel con inhibidores potentes del CYP3A4 (por ejemplo ketoconazol, itraconazol, claritromicina, indinavir, ritonavir, saquinavir, telitromicina y voriconazol) (ver sección 4.5). Precauciones adicionales para el uso en el tratamiento adyuvante de cáncer de mama 8 de 42
9 Neutropenia complicada Para pacientes que experimentan neutropenia complicada (neutropenia prolongada, neutropenia febril o infección), debe considerarse el uso de G-CSF y la reducción de la dosis (ver sección 4.2). Reacciones gastrointestinales Síntomas tempranos tales como dolor e inflamación abdominal, fiebre, diarrea, con o sin neutropenia, pueden ser manifestaciones tempranas de toxicidad gastrointestinal, y deben evaluarse y tratarse de inmediato. Insuficiencia cardíaca congestiva Deben monitorizarse en los pacientes la aparición de síntomas de insuficiencia cardíaca congestiva durante la terapia y durante el período de seguimiento. En los pacientes tratados con el régimen TAC para el cáncer de mama de nódulos positivos, se ha demostrado que el riesgo de CHF es más alto durante el primer año después del tratamiento (ver secciones 4.8 y 5.1). Leucemia En los pacientes tratados con docetaxel, doxorubicina y ciclofosfamida (TAC) el riesgo de desarrollar mielodisplasia o leucemia mieloide tardía hace necesario el seguimiento hematológico. Pacientes con 4+ nódulos Como el beneficio observado en pacientes 4+ nódulos no fue estadísticamente significativo en la supervivencia sin enfermedad y en la supervivencia general, la relación riesgo/beneficio de TAC en pacientes con 4+ nódulos no se demostrópor completo en el análisis final (ver sección 5.1). Pacientes de edad avanzada Existen datos limitados disponibles en pacientes >70 años de edad respecto del uso de docetaxel en combinación con doxorubicina y ciclofosfamida.. De los 333 pacientes tratados con docetaxel cada tres semanas en un estudio de cáncer de próstata, 209 pacientes tenían 65 años o más y 68 pacientes eran mayores de 75 años. En pacientes tratados con docetaxel cada tres semanas, la incidencia de cambios en las uñas relacionados se produjo con un índice 10% en pacientes de 65 años o más en comparación con pacientes más jóvenes. La incidencia de fiebre, diarrea, anorexia y edema periférica relacionados se produjo en índices de 10% en pacientes de 75 años o más en comparación con los menores de 65 años. Ente los 300 pacientes (221 pacientes en la fase III del estudio y 79 pacientes en la fase II) tratados con docetaxel en combinación con cisplatino y 5-fluorouracilo en el estudio de cáncer gástrico, 74 tenían 65 años de edad o más, y 4 tenían 75 años o más. La incidencia de acontecimientos adversos serios fue mayor en los pacientes de edad avanzadaque en los pacientes más jóvenes. La incidencia de letargo, estomatitis, e infección neutropénica (todos los grados) se produjo a índices 10% en pacientes de 65 años de edad o más en comparación con los pacientes más jóvenes. Los pacientes de edad avanzadatratados con TCF deben monitorizarse atentamente. Población pediátrica: No se ha establecido la seguridad y eficacia de docetaxel en niños menores de 18 años de edad. Excipientes: Vial de 20mg/2 ml: Este medicamento contiene 23 vol % etanol anhídrido (alcohol), por ejemplo hasta 363 mg de etanol anhídrido por vial, equivalente a 9 ml de cerveza o a 4 ml de vino por dosis. Vial de 80mg/8 ml: Este medicamento contiene 23 vol % etanol anhídrido (alcohol), por ejemplo hasta 1452 mg de etanol anhídrido por vial, equivalente a 37 ml de cerveza o a 15 ml de vino por dosis Vial de 120mg/16 ml: 9 de 42
10 Este medicamento contiene 23 vol % etanol anhídrido (alcohol), por ejemplo hasta 2904 mg de etanol anhídrido por vial, equivalente a 74 ml de cerveza o a 31 ml de vino por dosis Perjudicial en pacientes que sufran de alcoholismo. Debe ser tenido en cuenta en mujeres embarazadas o en periodo de lactancia, niños o grupos de alto riesgo tales como pacientes con enfermedad hepática o epilepsia. La cantidad de alcohol presente en este medicamento puede alterar el efecto de otros medicamentos. Deben tenerse en cuenta los posibles efectos sobre el sistema nervioso central. La cantidad de alcohol en este medicamento puede afectar la capacidad del paciente para conducir o utilizar máquinas (ver sección 4.7). 4.5 Interacción con otros medicamentos y otras formas de interacción Los estudios in vitro han demostrado que el metabolismo de docetaxel puede modificarse a través de la administración concomitante de compuestos que inducen, inhiben o son metabolizados por (y por tanto pueden inhibir competitivamente la enzima) el citocromo P450-3A, tales como ciclosporina, ketoconazol y eritromicina. En consecuencia, debe obrarse con extrema cautela al tratar pacientes con estos fármacos como terapia concomitante, ya que existe el potencial de una significativa interacción. En caso de combinación con inhibidores del CYP3A4, puede aumentar la aparición de reacciones adversas de docetaxel, como resultado de la reducción de la metabolización. Si no se puede evitar el uso concomitante de un inhibidor potente del CYP3A4 (por ejemplo, ketoconazol, itraconazol, claritromicina, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, telitromicina y voriconazol), se debe llevar a cabo una estrecha monitorización clínica y puede ser adecuado un ajuste de la dosis de docetaxel durante el tratamiento con el inhibidor potente del CYP3A4 (ver sección 4.4). En un estudio farmacocinético con 7 pacientes, la co-administración de docetaxel con inhibidor potente de CYP3A4, ketoconazol, produce una disminución significativa en el aclaramiento de docetaxel en un 49 %. Se estudió la farmacocinética de docetaxel en presencia de prednisona en pacientes con cáncer de próstata metastásico Docetaxel se metaboliza por el CYP3A4 y se sabe que prednisona induce el CYP3A4. No se observó ningún efecto estadísticamente significativo de prednisona sobre la farmacocinética de docetaxel. Docetaxel se une en alto grado a las proteínas (>95%). Si bien no se ha investigado formalmente la posible interacción in vivo de docetaxel con la administración de medicación concomitante, las interacciones in vitro con fármacos estrechamente ligados a proteínas tales como eritromicina, difenhidramina, propanolol, propafenone, fenitoína, salicilato, sulfametoxazola y valproateo sódico no afectaron la unión de docetaxel a las proteínas.asimismo, la dexametasona no afectó la unión de docetaxel a las proteínas. Docetaxel no afectó la unión de digitoxina. La farmacocinética de docetaxel, doxorubicina y ciclofosfamida no se ve afectada por su administración conjunta. Datos escasos procedentes de un estudio no controlado sugieren una interacción entre docetaxel y carboplatino. Cuando está en combinación con docetaxel, el aclaramiento de carboplatino es un 50% mayor que el valor obtenido con carboplatino en monoterapia. 4.6 Fertilidad, embarazo y lactancia Embarazo No existe información sobre el uso de docetaxel en mujeres embarazadas. Los estudios in vivo han demostrado que docetaxel es tanto embrio como fetotóxico en conejos y ratas y reduce de la fertilidad en 10 de 42
11 ratas (ver sección 5.3). Al igual que con otros fármacos citotóxicos, docetaxel puede ocasionar daños fetales cuando se lo administra a mujeres embarazadas. En consecuencia, docetaxel no debe usarse durante el embarazo, a menos que esté claramente indicado. Mujeres con potencial de concebir/métodos anticonceptivos: Deberá aconsejarse a las mujeres en edad fértil tratadas con docetaxel evitar quedarse embarazadas, y que informen a su médico de inmediato en caso de ocurrir un embarazo. Deberá usarse un método anticonceptivo eficaz durante el tratamiento y hasta 3 meses después del mismo Lactancia Docetaxel es una sustancia lipofílica, pero no se sabe si se excreta en la leche humana. En consecuencia, debido al potencial de reacciones adversas en los infantes lactantes, no debería amamantarse durante el transcurso de la terapia con docetaxel Fertilidad Los efectos adversos en los testículos observados en los estudios de toxicidad con roedores sugieren que docetaxel puede perjudicar la fertilidad en hombres. Docetaxel puede tener efectos genotóxicos. Por lo tanto, se aconseja a los hombres tratados con docetaxel no procrear durante el tratamiento ni hasta 6 meses después del mismo, y procurar asesoramiento sobre conservación del esperma antes del tratamiento debido a la posibilidad de infertilidad irreversible a causa de la terapia con docetaxel. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. La cantidad de etanol presente en Docetaxel Hospira puede alterar la capacidad para conducir o manejar máquinas (ver sección 4.4). 4.8 Reacciones adversas Resumen del perfil de seguridad para todas las inidicaciones Los efectos adversos considerados posible o probablemente relacionados con la administración de docetaxel se obtuvieron de: 1312 y 121 pacientes tratados con 100 mg/m 2 y 75 mg/m 2 de docetaxel como agente único, respectivamente. 258 pacientes tratados con docetaxel en combinación con doxorubicina. 406 pacientes tratados con docetaxel en combinación con cisplatino. 92 pacientes tratados con docetaxel en combinación con trastuzumab. 255 pacientes tratados con docetaxel en combinación con capecitabina. 332 pacientes tratados con docetaxel en combinación con prednisona o prednisolona (se presentan los acontecimientos adversos clínicamente importantes relacionados con el tratamiento) pacientes (744 y 532 en TAX 316 y GEICAM 9805 respectivamente) pacientes tratados con docetaxel en combinación con doxorubicina y ciclofosfamida (se presentan los acontecimientos adversos clínicamente importantes relacionados con el tratamiento). 300 pacientes de adenocarcinoma gástrico (221 pacientes de la fase III del estudio y 79 pacientes de la fase II) tratados con docetaxel en combinación con cisplatino y 5- fluorouracilo (se presentan los acontecimientos adversos clínicamente importantes relacionados con el tratamiento). 11 de 42
12 174 y 251 pacientes de cáncer de cabeza y cuello tratados con docetaxel en combinación con cisplatino y 5-fluorouracilo (se presentan los acontecimientos adversos clínicamente importantes relacionados con el tratamiento). Estos efectos se describieron utilizando los Criterios de Toxicidad Común del National Cancer Institute (NCI) (grado 3 = G3; grado 3-4 = G3/4; grado 4 = G4) y los términos de COSTART y MedDRA. Las frecuencias se definen como muy frecuente ( 1/10), frecuente ( 1/100 a <1/10); poco frecuente ( 1/1.000 a <1/100); rara ( 1/ a <1/1.000); muy rara (<1/10.000); desconocida (no puede estimarse a partir de los datos disponibles). Dentro de cada grupo de frecuencia, los efectos adversos se presentan en orden decreciente de gravedad. Los efectos adversos más frecuentemente informados de docetaxel como agente único son: neutropenia (que es reversible y no acumulativa, la peor mediana de días fueron 7 días y la duración mediana de neutropenia grave (<500 células/mm3) es 7 días), anemia, alopecia, náuseas, vómitos, estomatitis, diarrea y astenia. La severidad de los efectos adversos de docetaxel puede aumentar cuando docetaxel se administra en combinación con otros agentes quimioterapéuticos. Para la combinación con trastuzumab, se detallan los efectos adversos (todos los grados) informados en 10%. Se observó una mayor incidencia de EAS (efectos adversos severos) (40% vs 31%) y EA (efectos adversos) de Grado 4 (34% vs. 23%) en el grupo tratado con la combinación con trastuzumab en comparación con la monoterapia con docetaxel. Para la combinación con capecitabina, se presentan los efectos adversos más frecuentes relacionados con el tratamiento ( 5%) informados en un ensayo de fase III en pacientes de cáncer de mama cuyo tratamiento con antraciclina había fracasado (ver el Resumen de las características de Producto para capecitabina). Los siguientes efectos adversos se observan frecuentemente con docetaxel: Trastornos del sistema inmune: Por lo general, las reacciones de hipersensibilidad se produjeron a los pocos minutos de iniciarse la perfusión de docetaxel y fueron de leves a moderadas. Los síntomas más frecuentemente informados fueron enrojecimiento, sarpullido con o sin prurito, pecho cerrado, dolor de espalda, disnea, y fiebre o escalofríos ocasionados por el fármaco. Las reacciones graves se caracterizaron por hipotensión y/o broncoespasmo o sarpullido/eritema generalizados (ver sección 4.4). Trastornos del sistema nervioso: El desarrollo de neurotoxicidad periférica grave hace necesaria una reducción de la dosis (ver secciones 4.2 y 4.4). Los signos neurosensoriales de leves a moderados están caracterizados por parestesia, disestesia o dolor, incluso ardor. Los acontecimientos neuromotores están principalmente caracterizados por debilidad. Trastornos cutáneos y subcutáneos: Se observaron reacciones cutáneas reversibles, generalmente consideradas de leves a moderadas. Las reacciones se caracterizaron por un sarpullido, incluyendo erupciones localizadas, principalmente en las manos y los pies (incluso síndrome de manos y pies grave), pero también en los brazos, la cara o el tórax, y frecuentemente asociado con prurito. Por lo general, las erupciones se produjeron dentro de una semana después de la perfusión de docetaxel. Con menor frecuencia se informaron síntomas tales como erupciones seguidas de descamación que rara vez provocaron la interrupción o la discontinuación del tratamiento con docetaxel (ver secciones 4.2 y 4.4). Los trastornos graves de las uñas se caracterizan por hipo e hiperpigmentación, y algunas veces, dolor y onicólisis. Trastornos generales y condiciones del lugar de administración: Las reacciones en el lugar de perfusión por lo general fueron leves y consistieron en hiperpigmentación, inflamación, enrojecimiento o sequedad de la piel, flebitis o extravasación, e hinchazón en la vena. La retención de líquido incluyó acontecimientos tales como edema periférico, y con menor frecuencia, efusión pleural, efusión pericadial, ascitis y aumento de peso. El edema periférico generalmente comienza 12 de 42
13 en las extremidades inferiores, y puede convertirse en generalizado, con aumento de peso de 3 kg o más. La retención de líquido es acumulativa en incidencia y severidad (ver sección 4.4). Docetaxel 100mg/m² como agente único en cáncer de mama: Clasificación de órganos del sistema MedDRA Infecciones e infestaciones Trastornos de la sangre y del sistema linfático Trastornos del sistema inmunológico Trastornos del metabolismo y de la nutrición Trastornos del sistema nervioso Reacciones adversas muy frecuentes Infecciones (G3/4: 5,7%; incluyendo sepsis y neumonía, mortal en el 1,7%) Neutropenia (G4: 76,4%); Anemia (G3/4: 8,9%); Neutropenia febril Hipersensibilidad (G3/4: 5,3%) Anorexia Reacciones adversas frecuentes Infección asociada a neutropenia G4 (G3/4: 4,6%) Trombocitopenia (G4: 0,2%) Reacciones adversas poco frecuentes Neuropatía sensorial periférica (G3: 4,1%); Neuropatía motora periférica (G3/4: 4%); Disgeusia (grave: 0,07%) Trastornos cardiacos Arritmia (G3/4: 0,7%) Fallo cardiaco Trastornos vasculares Trastornos respiratorios, torácicos y mediastínicos Disnea (grave: 2,7%) Hipotensión; Hipertensión; Hemorragia Trastornos Estomatitis (G3/4: Estreñimiento (grave: Esofagitis (grave: 0,4%) gastrointestinales 5,3%); 0,2%); Diarrea (G3/4: 4%); Dolor abdominal Náuseas (G3/4: 4%); (grave: 1%); Vómitos (G3/4: 3%) Hemorragia gastrointestinal (grave: 0,3%) Trastornos de la piel y del tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Trastornos generales y alteraciones en el lugar de administración Alopecia; Reacciones cutáneas (G3/4: 5,9%); Alteraciones de las uñas (grave: 2,6%) Mialgia (grave: 1,4%) Retención de líquidos (grave: 6,5%); Astenia (grave: 11,2%); Dolor Artralgia Reacción en la zona de perfusión; Dolor torácico no cardiaco (grave: 0,4%) 13 de 42
14 Exploraciones complementarias Aumento de bilirrubina en sangre G3/4 (< 5%); Aumento de fosfatasa alcalina en sangre G3/4 (< 4%); Aumento de AST G3/4 (< 3%); Aumento de ALT G3/4 (< 2%) Descripción de las reacciones adversas seleccionadas en cáncer de mama para Docetaxel 100 mg/m 2 como agente único Trastornos de la sangre y del sistema linfático: Raros: episodios de hemorragia asociados con trombocitopenia grado 3/4 Frecuencia no conocida: leucopenia Trastornos del sistema nervioso: Se dispone de datos de reversibilidad de un 35,3% de los pacientes que desarrollaron neurotoxicidad tras el tratamiento con docetaxel 100 mg/m² como agente único. Los efectos fueron espontáneamente reversibles dentro de un período de 3 meses. Trastornos cutáneos y de los tejidos subcutáneos: Muy raros: un caso de alopecia irreversible al finalizar el estudio. Un 73% de las reacciones cutáneas fueron reversibles dentro de un período de 21 días. Trastornos generales y condiciones del lugar de administración: La mediana de dosis acumulativa hasta la discontinuación del tratamiento fue superior a mg/m 2 y la mediana de tiempo hasta la reversibilidad de la retención de líquido fue de 16,4 semanas (intervalo de 0 a 42 semanas). El inicio de retención moderada y grave se retrasa (mediana de dosis acumulativa: 818,9 mg/m 2 ) en pacientes con premedicación en comparación con pacientes sin premedicación (mediana de dosis acumulativa: mg/m 2 ). No obstante, fue informada en algunos pacientes durante los primeros cursos de la terapia. Docetaxel 75mg/m² como agente único en cáncer de mama: Clasificación de órganos del Reacciones adversas muy frecuentes Reacciones adversas frecuentes sistema MedDRA Infecciones e infestaciones Infecciones (G3/4: 5%) Trastornos de la sangre y del sistema linfático Trastornos del sistema inmunológico Neutropenia (G4: 54,2%); Anemia (G3/4: 10,8%); Trombocitopenia (G4: 1,7%) Trastornos del metabolismo y de Anorexia la nutrición Trastornos del sistema nervioso Neuropatía sensorial periférica (G3/4: 0,8%) Neutropenia febril Hipersensibilidad (no grave) Neuropatía motora periférica (G3/4: 2,5%) 14 de 42
15 Trastornos cardiacos Trastornos vasculares Trastornos gastrointestinales Náuseas (G3/4: 3,3%); Estomatitis (G3/4: 1,7%); Vómitos (G3/4: 0,8%); Diarrea (G3/4: 1,7%) Trastornos de la piel y del tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Trastornos generales y alteraciones en el lugar de administración Exploraciones complementarias Alopecia; Reacciones cutáneas (G3/4: 0,8%) Astenia (grave: 12,4%); Retención de líquidos (grave: 0,8%); Dolor Arritmia (no grave) Hipotensión Estreñimiento Alteraciones de las uñas (grave 0,8%) Mialgia Aumento de bilirrubina en sangre G3/4 (< 2%) Docetaxel 75mg/m² en combinación con doxorubicina en cáncer de mama: Clasificación de órganos del Reacciones adversas sistema MedDRA muy frecuentes Infecciones e infestaciones Infección (G3/4: 7,8%) Reacciones adversas frecuentes Reacciones adversas poco frecuentes Trastornos de la sangre y del sistema linfático Trastornos del sistema inmunológico Neutropenia (G4: 91,7%); Anemia (G3/4: 9,4%); Neutropenia febril; Trombocitopenia (G4: 0,8%) Hipersensibilidad (G3/4: 1,2%) Trastornos del metabolismo y de la nutrición Trastornos del sistema nervioso Neuropatía sensorial periférica (G3: 0,4%) Trastornos cardiacos Trastornos vasculares Trastornos gastrointestinales Náuseas (G3/4: 5%); Estomatitis (G3/4: 7,8%); Diarrea (G3/4: 6,2%); Vómitos (G3/4: 5%); Estreñimiento Anorexia Neuropatía motora periférica (G3/4: 0,4%) Fallo cardiaco; Arritmia (no grave) Hipotensión 15 de 42
16 Trastornos de la piel y del tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Alopecia; Alteraciones de las uñas (grave: 0,4%); Reacciones cutáneas (no grave) Mialgia Trastornos generales y alteraciones en el lugar de administración Astenia (grave 8,1%); Retención de líquidos (grave 1,2%); Dolor Reacción en la zona de perfusión Exploraciones complementarias Aumento de bilirrubina en sangre G3/4 (< 2,5%); Aumento de fosfatasa alcalina en sangre G3/4 (< 2,5%) Aumento de AST G3/4 (< 1%); Aumento de ALT G3/4 (< 1%) Docetaxel 75mg/m² en combinación con cisplatino en cáncer de mama Clasificación de órganos del sistema MedDRA Infecciones e Reacciones adversas muy frecuentes Infección (G3/4: 5,7%) Reacciones adversas frecuentes infestaciones Trastornos de la sangre Neutropenia (G4: Neutropenia febril y del sistema linfático 51,5%); Anemia (G3/4: 6,9%); Trombocitopenia (G4: 0,5%) Trastornos del sistema inmunológico Trastornos del metabolismo y de la nutrición Hipersensibilidad (G3/4: 2,5%) Anorexia Reacciones adversas poco frecuentes Trastornos del sistema nervioso Neuropatía sensorial periférica (G3: 3,7%); Neuropatía motora periférica (G3/4: 2%) Trastornos cardiacos Arritmia (G3/4: 0,7%) Fallo cardiaco Trastornos vasculares Hipotensión (G3/4: 0,7%) Trastornos Náuseas (G3/4: 9,6%); Estreñimiento gastrointestinales Vómitos (G3/4: 7,6%); Diarrea (G3/4: 6,4%); Estomatitis (G3/4: 2%) 16 de 42
17 Trastornos de la piel y del tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Trastornos generales y alteraciones en el lugar de administración Exploraciones complementarias Alopecia; Alteraciones de las uñas (grave 0,7%); Reacciones cutáneas (G3/4: 0,2%) Mialgia (grave: 0,5%) Astenia (grave: 9,9%); Retención de líquidos (grave: 0,7%); Fiebre (G3/4: 1,2%) Reacción en la zona de perfusión; Dolor Aumento de bilirrubina en sangre G3/4 (2,1%); Aumento de ALT G3/4 (1,3%) Aumento de AST G3/4 (0,5%); Aumento de fosfatasa alcalina en sangre G3/4 (0,3%) Docetaxel 100mg/m² en combinación con trastuzumab en cáncer de mama: Clasificación de órganos del sistema MedDRA Trastornos de la sangre y del sistema linfático Trastornos del metabolismo y de la nutrición Trastornos psiquiátricos Trastornos del sistema nervioso Trastornos oculares Trastornos cardiacos Trastornos vasculares Trastornos respiratorios, torácicos y mediastínicos Trastornos gastrointestinales Reacciones adversas muy frecuentes Neutropenia (G3/4: 32%); Neutropenia febril (incluida neutropenia asociada a fiebre y uso de antibióticos) o sepsis neutropénica Anorexia Insomnio Parestesia; Cefalea; Disgeusia; Hipoestesia Aumento del lagrimeo; conjuntivitis Linfedema Epistaxis; Dolor faringolaríngeo; Nasofaringitis; Disnea; Tos; Rinorrea Náuseas; Diarrea; Vómitos; Estreñimiento; Estomatitis; Dispepsia; Dolor abdominal Reacciones adversas frecuentes Fallo cardiaco 17 de 42
18 Trastornos de la piel y del tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Trastornos generales y alteraciones en el lugar de administración Exploraciones complementarias Alopecia; Eritema; Rash; Alteraciones de las uñas Mialgia; Artralgia; Dolor en extremidades; Dolor óseo; Dolor de espalda Astenia; Edema periférico; Pirexia; Fatiga; Inflamación de las mucosas; Dolor; Síntomas catarrales; Dolor torácico; Escalofríos Aumento de peso Letargo Descripción de las reacciones adversas seleccionadas en cáncer de mama para Docetaxel 100 mg/m 2 en combinación con trastuzumab Trastornos de la sangre y del sistema linfático: Muy frecuente: La toxicidad hematológica aumentó en pacientes tratados con trastuzumab y docetaxel, en comparación con docetaxel solo (32% neutropenia grado 3/4 versus 22%, utilizando los criterios NCI- CTC). Cabe destacar que probablemente ésta sea una subestimación, dado que se sabe que docetaxel solo en dosis de 100mg/m2 produce neutropenia en 97% de los pacientes, 76% de grado 4, sobre la base de los recuentos sanguíneos más bajos. La incidencia de neutropenia febril/sepsis neutropénica también aumentó en los pacientes tratados con trastuzumab más docetaxel (23% versus 17% para los pacientes tratados con docetaxel solo) Trastornos cardíacos: Se informó de fallo cardíaco sintomático en 2,2% de los pacientes tratados con docetaxel más trastuzumab en comparación con 0% de los pacientes tratados con docetaxel solo. En el grupo con docetaxel más trastuzumab, 64% habían recibido previamente una antraciclina como terapia adyuvante en comparación con 55% en el grupo con docetaxel solo. Docetaxel 75mg/m² en combinación con capecitabina en cáncer de mama: Clasificación de órganos del sistema MedDRA Reacciones adversas muy frecuentes Reacciones adversas frecuentes Infecciones e infestaciones Candidiasis oral (G3/4: < 1%) Trastornos de la sangre y del Neutropenia (G3/4: 63%); Trombocitopenia (G3/4: 3%) sistema linfático Anemia (G3/4: 10%) Trastornos del metabolismo y de Anorexia (G3/4: 1%); Deshidratación (G3/4: 2%); la nutrición Disminución del apetito Trastornos del sistema nervioso Disgeusia (G3/4: < 1%); Parestesia (G3/4: < 1%) Mareos; Cefalea (G3/4: < 1%); Neuropatía periférica 18 de 42
19 Trastornos oculares Trastornos respiratorios, torácicos y mediastínicos Aumento del lagrimeo Dolor faringolaríngeo (G3/4: 2%) Trastornos gastrointestinales Estomatitis (G3/4: 18%); Diarrea (G3/4: 14%); Náuseas (G3/4: 6%); Vómitos (G3/4: 4%); Estreñimiento (G3/4: 1%); Dolor abdominal (G3/4: 2%); Dispepsia Disnea (G3/4: 1%); Tos (G3/4: < 1%); Epistaxis (G3/4: < 1%) Dolor abdominal superior; Sequedad de boca Trastornos de la piel y del tejido Síndrome mano-pie (G3/4: Dermatitis; subcutáneo 24%); Rash eritematoso (G3/4: < 1%); Alopecia (G3/4: 6%); Decoloración de las uñas; Alteraciones de las uñas (G3/4: Onicolisis (G3/4: 1%) 2%) Trastornos musculoesqueléticos y del tejido conjuntivo Mialgia (G3/4: 2%); Artralgia (G3/4: 1%) Dolor en extremidades (G3/4: < 1%); Trastornos generales y alteraciones en el lugar de administración Exploraciones complementarias Astenia (G3/4: 3%); Pirexia (G3/4: 1%); Fatiga/debilidad (G3/4: 5%); Edema periférico (G3/4: 1%); Dolor de espalda (G3/4: 1%) Letargo; Dolor Reducción de peso; Aumento de bilirrubina en sangre G3/4 (9%) Docetaxel 75mg/m² en combinación con prednisona o prednisolona en cáncer de mama: Clasificación de órganos del sistema MedDRA Reacciones adversas muy frecuentes Reacciones adversas frecuentes Infecciones e infestaciones Infección (G3/4: 3,3%) Trastornos de la sangre y del sistema linfático Trastornos del sistema inmunológico Trastornos del metabolismo y de la nutrición Trastornos del sistema nervioso Trastornos oculares Trastornos cardiacos Trastornos respiratorios, torácicos y mediastínicos Neutropenia (G3/4: 32%); Anemia (G3/4: 4,9%) Anorexia (G3/4: 0,6%) Neuropatía sensorial periférica (G3/4: 1,2%); Disgeusia (G3/4: 0%) Trombocitopenia; (G3/4: 0,6%); Neutropenia febril Hipersensibilidad (G3/4: 0,6%) Neuropatía motora periférica (G3/4: 0%) Aumento del lagrimeo (G3/4: 0,6%) Reducción de la función cardiaca del ventrículo izquierdo (G3/4: 0,3%) Epistaxis (G3/4: 0%); Disnea (G3/4: 0,6%); Tos (G3/4: 0%) 19 de 42
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Docetaxel Winthrop20 mg/1 ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Docetaxel Winthrop20 mg/1 ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Docetaxel Teva 20 mg /0,72 ml concentrado y disolvente para solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Docetaxel Teva 20 mg /0,72 ml concentrado y disolvente para solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Docetaxel Actavis 20 mg/ml concentrado para solución para perfusión
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Docetaxel Actavis 20 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Docetaxel Actavis 20 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Caelyx 2 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml de
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Caelyx 2 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml de
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
FICHA DE INFORMACIÓN AL PACIENTE: Ranitidina
 FICHA DE INFORMACIÓN AL PACIENTE: Ranitidina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antiúlcera péptica, antisecretor gástrico, antagonista de los receptores H2 de la histamina. 1.2 Cómo actúa este
FICHA DE INFORMACIÓN AL PACIENTE: Ranitidina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antiúlcera péptica, antisecretor gástrico, antagonista de los receptores H2 de la histamina. 1.2 Cómo actúa este
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
CARBOPLATINO PHARMACIA 10 mg/ml concentrado para solución para perfusión EFG
 CARBOPLATINO PHARMACIA 10 mg/ml concentrado para solución para perfusión EFG COMPOSICIÓN Por ml: Principio activo: Carboplatino (D.C.I.) 10 mg Excipientes: Agua para inyección c.s. FORMA FARMACÉUTICA Y
CARBOPLATINO PHARMACIA 10 mg/ml concentrado para solución para perfusión EFG COMPOSICIÓN Por ml: Principio activo: Carboplatino (D.C.I.) 10 mg Excipientes: Agua para inyección c.s. FORMA FARMACÉUTICA Y
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg
 PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
Lea todo el Prospecto Información para el paciente detenidamente antes de recibir este medicamento. Estos datos pueden ser importantes para usted.
 PROSPECTO INFORMACIÓN PARA EL PACIENTE Herceptin 150 mg y 440 mg Polvo para concentrado para solución para infusión intravenosa Trastuzumab (Adaptado a la Disposición ANMAT N 5904/96) Lea todo el Prospecto
PROSPECTO INFORMACIÓN PARA EL PACIENTE Herceptin 150 mg y 440 mg Polvo para concentrado para solución para infusión intravenosa Trastuzumab (Adaptado a la Disposición ANMAT N 5904/96) Lea todo el Prospecto
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
Reacciones Adversas de los Fármacos
 Reacciones Adversas de los Fármacos -Talidomida se administró a embarazadas, con el fin de disminuir los efectos propios del embarazo(náuseas, vómitos). Primero se probó en animales y cuando se usó en
Reacciones Adversas de los Fármacos -Talidomida se administró a embarazadas, con el fin de disminuir los efectos propios del embarazo(náuseas, vómitos). Primero se probó en animales y cuando se usó en
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FOLLETO DE INFORMACIÓN AL PACIENTE
 FOLLETO DE INFORMACIÓN AL PACIENTE NIMESULIDA Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
FOLLETO DE INFORMACIÓN AL PACIENTE NIMESULIDA Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
INFORMACION PARA PRESCRIBIR AMPLIA
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: ASODOC 2. Nombre Genérico: DOCETAXEL 3. Forma Farmacéutica y Formulación: Solución Inyectable. Cada frasco ámpula contiene: Docetaxel Vehiculo c.b.p.
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: ASODOC 2. Nombre Genérico: DOCETAXEL 3. Forma Farmacéutica y Formulación: Solución Inyectable. Cada frasco ámpula contiene: Docetaxel Vehiculo c.b.p.
Documento Local del Producto
 1 Documento Local del Producto Título del Documento de Producto: Alprazolam Fecha de CDS que reemplaza: 14 de octubre de 2013 Fecha Efectiva: 12 de diciembre de 2013 Versión CDS: 8.0 1. NOMBRE DEL MEDICAMENTO
1 Documento Local del Producto Título del Documento de Producto: Alprazolam Fecha de CDS que reemplaza: 14 de octubre de 2013 Fecha Efectiva: 12 de diciembre de 2013 Versión CDS: 8.0 1. NOMBRE DEL MEDICAMENTO
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
Excipientes con efecto conocido: propilenglicol 200 mg/g
 FELDENE* 0.5% (Piroxicam) Gel 1. NOMBRE DEL PRODUCTO FARMACÉUTICO FELDENE* 0.5% Gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 gramos de FELDENE 0.5% Gel contiene: Piroxicam 0.5 g Excipientes con
FELDENE* 0.5% (Piroxicam) Gel 1. NOMBRE DEL PRODUCTO FARMACÉUTICO FELDENE* 0.5% Gel 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 gramos de FELDENE 0.5% Gel contiene: Piroxicam 0.5 g Excipientes con
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de Lacovin 20 mg/ml solución cutánea contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Lacovin 20 mg/ml solución cutánea. Lacovin 50 mg/ml solución cutánea. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de Lacovin 20 mg/ml solución cutánea contiene
1. Qué es Actithiol Mucolítico adultos y para qué se utiliza
 Introducción PROSPECTO: INFORMACIÓN PARA EL USUARIO Actithiol Mucolítico adultos 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente porque contiene información importante para usted.
Introducción PROSPECTO: INFORMACIÓN PARA EL USUARIO Actithiol Mucolítico adultos 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente porque contiene información importante para usted.
Enfermedad de Kawasaki
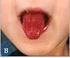 www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
www.printo.it/pediatric-rheumatology/ar/intro Enfermedad de Kawasaki Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de la enfermedad de Kawasaki se realiza en base
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
1. NOMBRE DEL MEDICAMENTO. VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
INTOXICACIÓN POR SULFONAMIDAS
 INTOXII ICACIÓN POR SULFONAMIIDAS Las sulfas fueron las primeras drogas usadas efectivamente para combatir las infecciones. La morbimortalidad por infecciones disminuyó en forma considerable desde que
INTOXII ICACIÓN POR SULFONAMIIDAS Las sulfas fueron las primeras drogas usadas efectivamente para combatir las infecciones. La morbimortalidad por infecciones disminuyó en forma considerable desde que
Desórdenes renales. Profa. Noemí Díaz Ruberté, MSN
 Desórdenes renales Profa. Noemí Díaz Ruberté, MSN 1 Glomerulonefritis posestreptococcica aguda Reacción inmunológica (antígeno-anticuerpo) a una infección del organismo que suele ser provocada por una
Desórdenes renales Profa. Noemí Díaz Ruberté, MSN 1 Glomerulonefritis posestreptococcica aguda Reacción inmunológica (antígeno-anticuerpo) a una infección del organismo que suele ser provocada por una
FLUCONAZOL. Solución para infusión IV. 200 mg. ALFARMA S.A., PANAMÁ, REPÚBLICA DE PANAMÁ. Fabricante, país:
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
OPCIONES ESTANDAR DE TRATAMIENTO carcinoma basocelular y escamocelular:
 TUMOR MALIGNO DE LA PIEL Codificación CIE10 D04 carcinoma in situ de la piel Problema: El carcinoma basocelular es la forma más común de cáncer de la piel (65%) y el carcinoma escamocelular (21%) es el
TUMOR MALIGNO DE LA PIEL Codificación CIE10 D04 carcinoma in situ de la piel Problema: El carcinoma basocelular es la forma más común de cáncer de la piel (65%) y el carcinoma escamocelular (21%) es el
Lea todo el Prospecto Información para el paciente detenidamente antes de recibir este medicamento. Estos datos pueden ser importantes para usted.
 PROSPECTO INFORMACIÓN PARA EL PACIENTE Herceptin s.c. 600 mg/5 ml Solución para inyección subcutánea Trastuzumab (Adaptado a la Disposición ANMAT N 5904/96) Lea todo el Prospecto Información para el paciente
PROSPECTO INFORMACIÓN PARA EL PACIENTE Herceptin s.c. 600 mg/5 ml Solución para inyección subcutánea Trastuzumab (Adaptado a la Disposición ANMAT N 5904/96) Lea todo el Prospecto Información para el paciente
NOMBRE DEL MEDICAMENTO YONDELIS Trabectedina para inyección (1 mg)
 NOMBRE DEL MEDICAMENTO YONDELIS Trabectedina para inyección (1 mg) COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 1 mg de trabectedina. 1 ml de solución reconstituida contiene 0,05 mg de trabectedina
NOMBRE DEL MEDICAMENTO YONDELIS Trabectedina para inyección (1 mg) COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 1 mg de trabectedina. 1 ml de solución reconstituida contiene 0,05 mg de trabectedina
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zavedos 10 mg polvo para solución inyectable (Idarubicina)
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zavedos 10 mg polvo para solución inyectable (Idarubicina) Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zavedos 10 mg polvo para solución inyectable (Idarubicina) Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
El paciente debe estar en una dieta adecuada baja en lípidos y debe continuar en esta dieta durante el tratamiento con ZETIA.
 ZETIA 10 mg TABLETAS (Ezetimiba) I. CLASE TERAPEUTICA ZETIA (ezetimiba) está en una nueva clase de compuestos hipolipemiantes que inhiben selectivamente la absorción intestinal de colesterol y esteroles
ZETIA 10 mg TABLETAS (Ezetimiba) I. CLASE TERAPEUTICA ZETIA (ezetimiba) está en una nueva clase de compuestos hipolipemiantes que inhiben selectivamente la absorción intestinal de colesterol y esteroles
Tevagrastim solución inyectable 300 µg
 Tevagrastim solución inyectable 300 µg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda
Tevagrastim solución inyectable 300 µg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda
MINOXIDIL AL 2%, SOLUCIÓN DE. Excipientes: Propilenglicol Agua purificada Etanol 96 %
 FN/2006/PO/039 1. NOMBRE: Solución de minoxidil 2. SINÓNIMOS Minoxidil en solución hidroalcohólica MINOXIDIL AL 2%, SOLUCIÓN DE 3. COMPOSICIÓN 3.1. FÓRMULA PATRÓN ( 2 % ) Minoxidil Excipientes: Propilenglicol
FN/2006/PO/039 1. NOMBRE: Solución de minoxidil 2. SINÓNIMOS Minoxidil en solución hidroalcohólica MINOXIDIL AL 2%, SOLUCIÓN DE 3. COMPOSICIÓN 3.1. FÓRMULA PATRÓN ( 2 % ) Minoxidil Excipientes: Propilenglicol
MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6. Mieloma múltiple resistente o refractario al tratamiento estándar. La Sociedad
 MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6 1. DENOMINACIÓN DEL ESQUEMA (1) : TACIDEX o THACYDEX (Talidomida + Ciclofosfamida + Dexametasona). 2. INDICACIÓN. Mieloma múltiple resistente o refractario al tratamiento
MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6 1. DENOMINACIÓN DEL ESQUEMA (1) : TACIDEX o THACYDEX (Talidomida + Ciclofosfamida + Dexametasona). 2. INDICACIÓN. Mieloma múltiple resistente o refractario al tratamiento
FICHA TÉCNICA. 3. FORMA FARMACÉUTICA Comprimidos recubiertos. Biconvexos, ovales, de color blanco o blanquecino grisáceo jaspeado.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FUCIDINE 250 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de fusidato de sodio. Excipiente: 72 mg de lactosa por comprimido.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FUCIDINE 250 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de fusidato de sodio. Excipiente: 72 mg de lactosa por comprimido.
ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO
 ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO 1 ENMIENDA A INCLUIR EN LAS SECCIONES RELEVANTES DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL
ANEXO III ENMIENDA DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y PROSPECTO 1 ENMIENDA A INCLUIR EN LAS SECCIONES RELEVANTES DE LA FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Se recomiendan las siguientes modificaciones en caso de disfunción renal.
 1. NOMBRE DEL MEDICAMENTO ACICLOVIR TEDEC 25 mg/ml solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene: Aciclovir (D.O.E.) 250 mg Para excipientes, ver 6.1. 3. FORMA
1. NOMBRE DEL MEDICAMENTO ACICLOVIR TEDEC 25 mg/ml solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene: Aciclovir (D.O.E.) 250 mg Para excipientes, ver 6.1. 3. FORMA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA. Virus de la gripe fraccionados*, inactivados, que contienen antígenos equivalentes a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VACUNA ANTIGRIPAL POLIVALENTE LETI VIRUS FRACCIONADOS SUSPENSIÓN INYECTABLE EN JERINGA PRECARGADA. Vacuna antigripal de virus fraccionados inactivados. 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Abraxane 5 mg/ml polvo para suspensión para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Abraxane 5 mg/ml polvo para suspensión para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial
YONDELIS TRABECTEDINA
 PROSPECTO YONDELIS TRABECTEDINA Polvo liofilizado para inyectables Industria Alemana Venta Bajo Receta Archivada Para infusión intravenosa COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene: Trabectedina
PROSPECTO YONDELIS TRABECTEDINA Polvo liofilizado para inyectables Industria Alemana Venta Bajo Receta Archivada Para infusión intravenosa COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene: Trabectedina
NOMBRE DEL MEDICAMENTO COMPOSICIÓN CUALITATIVA Y CUANTITATIVA FORMA FARMACÉUTICA DATOS CLÍNICOS. Edad Peso corporal (aprox.) Posología (cada 6 horas)
 NOMBRE DEL MEDICAMENTO APIRETAL 100 mg/ml solución oral COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Fórmula por ml: Paracetamol... 100 mg Azorrubina (E-122)... 50 μg También contiene AGUA FORMA FARMACÉUTICA
NOMBRE DEL MEDICAMENTO APIRETAL 100 mg/ml solución oral COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Fórmula por ml: Paracetamol... 100 mg Azorrubina (E-122)... 50 μg También contiene AGUA FORMA FARMACÉUTICA
Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película. Ebastina
 Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película Ebastina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el paciente Ebastel Forte 20 mg Comprimidos recubiertos con película Ebastina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
Eni* Tabletas e Inyectable. Ciprofloxacino
 Tabletas e Inyectable Ciprofloxacino Descripción Es ciprofloxacino, la fluoroquinolona bactericida potente, con amplio espectro antibacteriano que incluye grampositivos y gramnegativos. Tiene alta eficacia
Tabletas e Inyectable Ciprofloxacino Descripción Es ciprofloxacino, la fluoroquinolona bactericida potente, con amplio espectro antibacteriano que incluye grampositivos y gramnegativos. Tiene alta eficacia
MEGAPLEX 160mg. Nombre Comercial. Megaplex 160mg. Nombre Genérico. Acetato de Megestrol 160mg. Concentración. 160mg. Denominación Común Internacional
 MEGAPLE 160mg 1. Identificación del Medicamento Nombre Comercial Megaplex 160mg Nombre Genérico Acetato de Megestrol 160mg Concentración 160mg Denominación Común Internacional Acetato de Megestrol N Registro
MEGAPLE 160mg 1. Identificación del Medicamento Nombre Comercial Megaplex 160mg Nombre Genérico Acetato de Megestrol 160mg Concentración 160mg Denominación Común Internacional Acetato de Megestrol N Registro
PROSPECTO: INFORMACIÓN PARA EL USUARIO. CITICOLINA Normon 1000 mg solución inyectable EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO FARMIBLASTINA 10 mg polvo y disolvente para solución inyectable
 PROSPECTO: INFORMACIÓN PARA EL USUARIO FARMIBLASTINA 10 mg polvo y disolvente para solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO FARMIBLASTINA 10 mg polvo y disolvente para solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
TRATAMIENTO ORAL EN EL CÁNCER
 En los últimos años se han producido una serie de cambios en el tratamiento médico estándar del cáncer con administración oral de: citostáticos, profármacos orales de compuestos activos y sobre todo con
En los últimos años se han producido una serie de cambios en el tratamiento médico estándar del cáncer con administración oral de: citostáticos, profármacos orales de compuestos activos y sobre todo con
SERPIENTES Definición:
 SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
SIMVASTATINA KORHISPANA 10 mg comprimidos recubiertos con película EFG
 PROSPECTO: INFORMACIÓN PARA EL USARIO SIMVASTATINA KORHISPANA 10 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
PROSPECTO: INFORMACIÓN PARA EL USARIO SIMVASTATINA KORHISPANA 10 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el usuario
 Prospecto: información para el usuario Grafalon 20 mg/ml concentrado para solución para perfusión Inmunoglobulina anti-linfocitos T humanos de conejo Lea todo el prospecto detenidamente Conserve este prospecto.
Prospecto: información para el usuario Grafalon 20 mg/ml concentrado para solución para perfusión Inmunoglobulina anti-linfocitos T humanos de conejo Lea todo el prospecto detenidamente Conserve este prospecto.
Prospecto: información para el usuario
 Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Mucosan 6 mg/ml jarabe Ambroxol hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
La citarabina, ARA-C o arabinósido de citocina es un antimetabolito específico de la fase S del ciclo celular; impide la síntesis de ADN.
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: MEDSARA 2. Nombre Genérico: CITARABINA 3. Forma Farmacéutica y Formulación: SOLUCIÓN INYECTABLE Cada frasco ámpula contiene: Citarabina.. 500 mg
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: MEDSARA 2. Nombre Genérico: CITARABINA 3. Forma Farmacéutica y Formulación: SOLUCIÓN INYECTABLE Cada frasco ámpula contiene: Citarabina.. 500 mg
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: Bortezomib
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: Bortezomib
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
La osmolaridad calculada de la solución es de 154 mosm/l y el ph de 4,5-7,0. El contenido teórico en sodio y en cloruro es de 77 mmol/l.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de Sodio Grifols 0,45% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio, 0,45 g La osmolaridad
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de Sodio Grifols 0,45% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio, 0,45 g La osmolaridad
Pacientes de edad avanzada: debe considerarse la conveniencia de ampliar el intervalo de dosificación (Ver Propiedades Famacocinéticas).
 FT290191-B+2 1. NOMBRE DEL MEDICAMENTO DARVON 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextropropoxifeno (D.C.I.) napsilato 100 mg. 3. FORMA FARMACÉUTICA Cápsulas para administración por vía oral. 4.
FT290191-B+2 1. NOMBRE DEL MEDICAMENTO DARVON 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextropropoxifeno (D.C.I.) napsilato 100 mg. 3. FORMA FARMACÉUTICA Cápsulas para administración por vía oral. 4.
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P.
 CIRCULAR DEL PRODUCTO Cápsulas EMEND (aprepitant) I. CLASE TERAPÉUTICA * EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P. II. INDICACIONES EMEND en combinación
CIRCULAR DEL PRODUCTO Cápsulas EMEND (aprepitant) I. CLASE TERAPÉUTICA * EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P. II. INDICACIONES EMEND en combinación
AMLODIPINO (BESILATO) comprimidos 5-10 mg
 AMLODIPINO (BESILATO) comprimidos 5-10 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda
AMLODIPINO (BESILATO) comprimidos 5-10 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda
Dr. Juan Carlos Valia Vera, Dr. Guido Mazzinari
 Dr. Juan Carlos Valia Vera, Dr. Guido Mazzinari Servicio de Anestesia Reanimación n y Tratamiento del Dolor Consorcio Hospital General Universitario Valencia Caso Clinico Varón de 34 años VIH estadio C3,
Dr. Juan Carlos Valia Vera, Dr. Guido Mazzinari Servicio de Anestesia Reanimación n y Tratamiento del Dolor Consorcio Hospital General Universitario Valencia Caso Clinico Varón de 34 años VIH estadio C3,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de polvo para suspensión oral contienen 99,75 g de poliestireno sulfonato
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RESINCALCIO polvo para suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 g de polvo para suspensión oral contienen 99,75 g de poliestireno sulfonato
Lea todo el Prospecto Información para el paciente detenidamente antes de recibir este medicamento. Estos datos pueden ser importantes para usted.
 PROSPECTO INFORMACIÓN PARA EL PACIENTE Kadcyla 100 mg y 160 mg Polvo liofilizado para concentrado para solución para infusión Trastuzumab emtansina (Adaptado a la Disposición ANMAT N 5904/96) Lea todo
PROSPECTO INFORMACIÓN PARA EL PACIENTE Kadcyla 100 mg y 160 mg Polvo liofilizado para concentrado para solución para infusión Trastuzumab emtansina (Adaptado a la Disposición ANMAT N 5904/96) Lea todo
PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE. Bromhexina hidrocloruro
 PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE Bromhexina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
PROSPECTO: INFORMACIÓN PARA EL PACIENTE BISOLVON MUCOLÍTICO INFANTIL 0,8 MG/ML JARABE Bromhexina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
FICHA TÉCNICA. Vispring 500 microgramos/ml colirio en solución en envases unidosis
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Vispring 500 microgramos/ml colirio en solución en envases unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de colirio en solución contiene: Tetrizolina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR COMBIX 800 mg Comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de 800 mg contiene: Aciclovir (DCI) 800 mg. 3. FORMA FARMACÉUTICA
Simvastatina Davur 10 mg comprimidos EFG
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
TEST DE INTOLERANCIA ALIMENTARIA
 TEST DE INTOLERANCIA ALIMENTARIA PUNTOS CLAVE Permite determinar la presencia y niveles de anticuerpos del tipo IgG frente a más de 200 alimentos diferentes. Se realiza el análisis de cada alimento por
TEST DE INTOLERANCIA ALIMENTARIA PUNTOS CLAVE Permite determinar la presencia y niveles de anticuerpos del tipo IgG frente a más de 200 alimentos diferentes. Se realiza el análisis de cada alimento por
Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG. Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
 1. NOMBRE DEL MEDICAMENTO Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
1. NOMBRE DEL MEDICAMENTO Cetirizina NORMON 10 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido recubierto con película contiene 10 mg de cetirizina dihidrocloruro.
