Tema 2: Fuerzas intermoleculares
|
|
|
- Guillermo Suárez Barbero
- hace 6 años
- Vistas:
Transcripción
1 Tema 2: Fuerzas intermoleculares Fuerzas intermoleculares: ion dipolo, dipolo dipolo, dispersión de London y puentes de hidrógeno. Gases ideales y reales. Propiedades de los ĺıquidos. Presión de vapor. Propiedades de los sólidos. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
2 Fuerzas intermoleculares:... Entre partículas cargadas (cristales iónicos): dominan las fuerzas culombianas ion dipolo. Ejemplo: disolución de una sal en agua. Entre moléculas neutras con dipolos permanentes (polares): interacciones dipolo dipolo. Entre moléculas neutras apolares: fuerzas de dispersión o de London. Las fuerzas de dispersión aumentan con el tamaño de las moléculas. Genéricamente se denominan fuerzas de van der Waals. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
3 Fuerzas intermoleculares:... Enlace de hidrógeno Se produce entre moléculas con enlaces NH, OH, FH. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
4 Fuerzas intermoleculares:... Enlace de hidrógeno intramolecular Se produce dentro de una misma molécula: enlace de hidrógeno intramolecular. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
5 Fuerzas intermoleculares:... Diagrama de fases de una sustancia pura H 2 O (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
6 Fuerzas intermoleculares:... Diagrama de fases de una sustancia pura CO 2 Azufre (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
7 Fuerzas intermoleculares:... Diagrama de fases de una sustancia pura H 2 O Carbono (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
8 Gases ideales y reales En los gases las interacciones entre las moléculas aparte de sus colisiones, son muy pequeñas. En el ĺımite en que sólo hay colisiones elásticas hablamos de gases ideales. Los gases ideales siguen la ecuación: P V = n R T R es una constante universal que recibe el nombre de constante de los gases. R = atm L mol 1 K 1 = J mol 1 K 1 Una mezcla de gases ideales sigue la ley de Dalton de las presiones parciales: p T = i p i = R T V i n i (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
9 Gases ideales y reales Los gases reales En los gases reales las interacciones entre las moléculas no son despreciables. La existencia de esas interacciones se hace más apreciable a presiones altas y temperaturas bajas. No existe una ecuación simple para todos los gases reales. La ecuación de van der Waals recoge dos características importantes de las moléculas que forman los gases reales: su tamaño finito y la atracción que expermientan a distancias medias y grandes. P = R T (V m b) a Vm 2 La existencia de esas fuerzas se manifiesta por los cambios de fase que se producen a temperaturas bajas y presiones altas: licuación y solidificación. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
10 Gases ideales y reales Ejemplos de gases reales (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
11 Propiedades de los ĺıquidos En los ĺıquidos las distancias intermoleculares son mucho menores que en los gases. Las fuerzas de interacción entre las moléculas son más importantes. La existencia de esas fuerzas se aprecia en la tensión superficial y la viscosidad La tensión superficial es la energía necesaria para aumentar la superficie de un ĺıquido en una unidad (unidades: J m 2 ). Fuerzas cohesivas: las que se dan entre moléculas del mismo tipo. Fuerzas adhesivas: las que se dan entre moléculas de distinto tipo. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
12 Propiedades de los ĺıquidos Meniscos Consecuencia de la existencia de esas fuerzas son la existencia de meniscos y los fenómenos de capilaridad. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
13 Propiedades de los ĺıquidos Viscosidad Es la resistencia que opone un ĺıquido a fluir. Cuanto mayores son las fuerzas intermoleculares, mayor es la viscosidad. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
14 Presión de vapor Las moléculas en la superficie de un ĺıquido sufren fuerzas de atracción por el resto que tienden a mantenerlas unidas a él. Algunas moléculas pueden obtener energía (térmica) suficiente para escapar de la superficie. El equilibrio (dinámico) se alcanza cuando el número de moléculas que abandonan la superficie por unidad de tiempo iguala al de las que se depositan sobre la superficie. La consecuencia es que si se deposita un ĺıquido en un recipiente cerrado sin ocuparlo completamente, parte de él se evapora hasta que la presión alcanza un cierto valor de equilibrio: su presión de vapor. La presión de vapor aumenta con la temperatura. Los ĺıquidos con presiones de vapor relativamente altas a temperaturas ordinarias se denominan volátiles. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
15 Presión de vapor (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
16 Presión de vapor Puntos de ebullición y crítico El punto de ebullición de un ĺıquido es la temperatura a la que su presión de vapor iguala la presión externa. Si la presión externa es la presión normal (antes 1 atm, actualmente 1 bar), se denomina punto de ebullición normal. El punto crítico es aquél a partir del cual no se distinguen el ĺıquido y el vapor. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
17 Propiedades de los sólidos En los sólidos, las moléculas o iones que los forman tienen la movilidad muy reducida: sus movimientos se reducen a vibraciones en la red. Punto de fusión: es la temperatura a que se produce el paso de sólido a ĺıquido. Punto de congelación: es la temperatura a que se produce el paso de ĺıquido a sólido. Sublimación: es el paso de sólido a gas o de gas a sólido. Para una sustancia, pueden existir varias fases sólidas distintas. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
18 Propiedades de los sólidos Tipos de sólidos cristalinos Sólidos de red covalente: los átomos que forman la red están unidos entre sí por enlaces covalentes (ej. diamante, grafito). Sólidos iónicos: la red está formada por cationes y aniones. Sólidos moleculares: la red está formada por moléculas neutras. (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
19 Propiedades de los sólidos Sólidos de red covalente Diamante Grafito (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
20 Propiedades de los sólidos Sólidos moleculares I 2 H 2 O (hielo) (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
21 Propiedades de los sólidos Sólidos iónicos NaCl CaTiO 3 (Perovskita) (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
22 Propiedades de los sólidos Sólidos metálicos Empaquetamiento hexagonal compacto: Mg, Zn, Cd Empaquetamiento cúbico compacto: Na, K, Fe, Cr (Fundamentos de Química, Grado en Física) Fuerzas intermoleculares Enero Mayo, / 22
Líquidos Tensión superficial, viscosidad, presión de vapor. Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
 Fuerzas intermoleculares Estados de agregación de la materia Gases Gases ideales y reales Líquidos Tensión superficial, viscosidad, presión de vapor Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
Fuerzas intermoleculares Estados de agregación de la materia Gases Gases ideales y reales Líquidos Tensión superficial, viscosidad, presión de vapor Sólidos Sólidos covalentes, iónicos, moleculares y metálicos
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS
 A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
Tema 4. Fuerzas intermoleculares
 Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Tema 4: Fuerzas intermoleculares Química para biólogos Slide 1 of 35 Contenidos 4-1 Electronegatividad 4-2 Polaridad de enlace y molécula: momento dipolar 4-3 Fuerzas intermoleclares 4-4 Puentes de hidrógeno
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
El H solo necesita 2 electrones en su capa de valencia como el He.
 Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Longitud y energía de enlace
 Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Longitud y energía de enlace ENLACES QUIMICOS Los enlaces interatómicos se clasifican en: Enlaces iónicos Enlaces covalentes Enlaces metálicos ENLACE IÓNICO: Transferencia de electrones Li F El litio le
Interacciones químicas de no enlace. Fuerzas de van der Waals
 Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Química Orgánica General
 Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato
 Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Departamento de Física y Química. Ies Dr. Rodríguez Delgado. Ronda Nivel 1º Bachillerato Planteamiento del problema 1. La mina de un lápiz se compone de grafito y arcilla. El grafito es una sustancia simple
Líquido. Sólido. Gas Plasma. educacionsanitariaymas.blogspot.com.
 Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
III. ESTADOS DE LA MATERIA
 III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Química 2º de Bachillerato
 Química 2º de Bachillerato Tema 3 Enlace químico Contenidos Tipos de sustancias y de enlace Enlace iónico Enlace metálico Enlace covalente Estructuras de Lewis Geometría molecular: RPECV Enlace de valencia:
Química 2º de Bachillerato Tema 3 Enlace químico Contenidos Tipos de sustancias y de enlace Enlace iónico Enlace metálico Enlace covalente Estructuras de Lewis Geometría molecular: RPECV Enlace de valencia:
SOLUCIONES EJERCICIOS DE ENLACE QUÍMICO. 1º BCT
 SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
HISTORIA DE SU DESCUBRIMIENTO
 1 HISTORIA DE SU DESCUBRIMIENTO La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar
1 HISTORIA DE SU DESCUBRIMIENTO La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar
TEMA 5 ESTADOS DE LA MATERIA Y FUERZAS INTERMOLECULARES Mª PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ
 TEMA 5 ESTADOS DE LA MATERIA Y FUERZAS INTERMOLECULARES Mª PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Introducción 2. Estados de agregación de la materia y Teoría cinético-molecular 3. Fuerzas intermoleculares:
TEMA 5 ESTADOS DE LA MATERIA Y FUERZAS INTERMOLECULARES Mª PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Introducción 2. Estados de agregación de la materia y Teoría cinético-molecular 3. Fuerzas intermoleculares:
Equilibrio físico. Prof. Jesús Hernández Trujillo. Facultad de Química, UNAM. Equilibrio físico/j. Hdez. T p.
 Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo jesus.hernandezt@gmail.com Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
Equilibrio físico/j. Hdez. T p. 1/34 Equilibrio físico Prof. Jesús Hernández Trujillo jesus.hernandezt@gmail.com Facultad de Química, UNAM Equilibrio físico/j. Hdez. T p. 2/34 Interacciones intermoleculares
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Las propiedades de las sustancias puras se deben a: Elementos de las que están constituidas Tipo de
A continuación se detallan cada una de las propiedades coligativas:
 PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
Capítulo 9. Estados de agregación de la materia
 Capítulo 9. Estados de agregación de la materia Objetivos: Establecer las características químico-físicas de gases, líquidos y sólidos. Establecer la ecuación de estado de los gases ideales y describir
Capítulo 9. Estados de agregación de la materia Objetivos: Establecer las características químico-físicas de gases, líquidos y sólidos. Establecer la ecuación de estado de los gases ideales y describir
2/17/2013. La fuerza que mantiene unidos a los átomos de unamolécula. Es una fuerza química o intramolecular.
 FUERZAS INTERMOLECULARES Comparación molecular de gases, líquidos y sólidos Viscosidad y tensión superficial Cambios de fase Volatilidad, presión de vapor y punto de ebullición Fuerzas intramoleculares
FUERZAS INTERMOLECULARES Comparación molecular de gases, líquidos y sólidos Viscosidad y tensión superficial Cambios de fase Volatilidad, presión de vapor y punto de ebullición Fuerzas intramoleculares
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES
 PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
PERIODO Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 1: ESTRUCTURA INTERNA DE LOS MATERIALES El átomo: Toda la materia está compuesta por átomos y éstos por partículas
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
ENLACE QUÍMICO. TEMA 3 Pág. 271 libro (Unidad 13)
 ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
ENLACE QUÍMICO TEMA 3 Pág. 271 libro (Unidad 13) CONCEPTO DE ENLACE QUÍMICO Concepto de enlace químico Propiedades de sustancias puras se deben a: Elementos de las que están constituidas Tipo de enlace
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.2 Composición de la materia. Sustancias y mezclas. Mezclas homogéneas, heterogéneas y coloides. Introducción a las disoluciones: no saturadas, saturadas y sobresaturadas.
UNIDAD 1 La materia y sus cambios Tema 1.2 Composición de la materia. Sustancias y mezclas. Mezclas homogéneas, heterogéneas y coloides. Introducción a las disoluciones: no saturadas, saturadas y sobresaturadas.
Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES
 Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES Todo gas, si se enfría y comprime suficientemente, se transforma en un líquido. La causa son las fuerzas intermoleculares, fuerzas de atracción
Tema 4. Estados de Agregación y FUERZAS INTERMOLECULARES Todo gas, si se enfría y comprime suficientemente, se transforma en un líquido. La causa son las fuerzas intermoleculares, fuerzas de atracción
CONOCIMIENTO DEL MEDIO EN EDUCACIÓN INFANTIL
 CONOCIMIENTO DEL MEDIO EN EDUCACIÓN INFANTIL Francisco Javier Navas Pineda javier.navas@uca.es Tema 5. Estados de agregación de la materia 1 ÍNDICE 1. Los Estados de la Materia 2. Estado Sólido. Tipos
CONOCIMIENTO DEL MEDIO EN EDUCACIÓN INFANTIL Francisco Javier Navas Pineda javier.navas@uca.es Tema 5. Estados de agregación de la materia 1 ÍNDICE 1. Los Estados de la Materia 2. Estado Sólido. Tipos
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
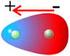 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
SÓLIDOS I. Tipos de sólidos. Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada.
 SÓLIDOS I Tipos de sólidos Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada. Sólidos amorfos: no presentan estructuras ordenadas. 1 Sólidos cristalinos Hay posiciones
SÓLIDOS I Tipos de sólidos Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada. Sólidos amorfos: no presentan estructuras ordenadas. 1 Sólidos cristalinos Hay posiciones
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace.
 EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
Práctica 6. Propiedades físicas y enlace químico
 Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos
 3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
Introducción: La importancia del enlace. químicos. Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen
 Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
Introducción: La importancia del enlace químicos Nos interesa conocer las propiedades físico-químicas de las diferentes sustancias que existen De qué dependen esas propiedades? La clave está en el interior
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN.
 MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
Propiedades de la materia. Características de sólidos, líquidos y gases
 Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
3. DESARROLLO 3.1 ENLACE IONICO
 3. DESARROLLO Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. 3.1 ENLACE IONICO El enlace iónico
3. DESARROLLO Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. 3.1 ENLACE IONICO El enlace iónico
Preguntas Propuestas
 Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
Preguntas Propuestas 2 ... Propiedades periódicas de los elementos 1. En qué orden varía el tamaño (volumen atómico) de los elementos alcalinos? A) K > Cs > Rb > Na > Li B) Na > Rb > K > Cs > Li C) Li
TRABAJO PRÁCTICO: MODELOS EXTREMOS DE SUSTANCIA
 1 Complemento TRABAJO PRÁCTICO: S EXTREMOS DE SUSTANCIA FUNDAMENTOS TEÓRICOS BÁSICOS Todas las sustancias pueden considerarse formadas por un conjunto de unidades estructurales o fundamentales. La clase
1 Complemento TRABAJO PRÁCTICO: S EXTREMOS DE SUSTANCIA FUNDAMENTOS TEÓRICOS BÁSICOS Todas las sustancias pueden considerarse formadas por un conjunto de unidades estructurales o fundamentales. La clase
ENLACE QUÍMICO II. 5.- De los compuestos iónicos KBr y NaBr, cuál será el más duro y cuál el de mayor temperatura de fusión?. Por qué?.
 ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
ENLACE QUÍMICO II 1.- Representa las estructuras de Lewis indicando geometría molecular y momento dipolar de las siguientes moléculas: CO 2, H 2 S y O 2. 2.- De las siguientes moléculas: F 2, CS 2, C 2
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS. Cuestiones de evaluación inicial. 2.- Cuántos protones y cuantos neutrones tiene el Carbono?
 UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
ESTADO LÍQUIDO 26/05/2011. Características. Dependen de la naturaleza y fuerza de las partículas que los constituyen
 ESTADO LÍQUIDO Dependen de la naturaleza y fuerza de las partículas que los constituyen Características Tienen densidades mayores que los gases Volumen definido sin forma propia Son poco compresibles Fluyen
ESTADO LÍQUIDO Dependen de la naturaleza y fuerza de las partículas que los constituyen Características Tienen densidades mayores que los gases Volumen definido sin forma propia Son poco compresibles Fluyen
Capitulo 8 Fuerzas intermoleculares.
 Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua
 Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua Técnico Professor: Verónica en masoterapia Pantoja. Lic. MSP. Objetivos Reconocer los bioelementos en los seres vivos Reconocer el agua como biomolécula
Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua Técnico Professor: Verónica en masoterapia Pantoja. Lic. MSP. Objetivos Reconocer los bioelementos en los seres vivos Reconocer el agua como biomolécula
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
Enlace químico. 5. Dadas las siguientes sustancias: CS 2 (lineal), HCN (lineal), NH 3 (piramidal) y H 2 O (angular):
 Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
Enlace químico Cuestiones y problemas 1. Explique: a) Si las estructuras de Lewis justifican la forma geométrica de las moléculas o si ésta se debe determinar experimentalmente para poder proponer la representación
EFECTO DEL CALOR SOBRE LA MATERIA
 EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO
 ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
ACTIVIDADES DA UNIDADE 14: O ENLACE QUÍMICO 1 Puede formarse un enlace iónico entre átomos de un mismo elemento químico? Por qué? No. El enlace químico se produce entre átomos con valores muy diferentes
CIENCIAS II CON ENFASIS EN QUIMICA
 CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
2003, Ernesto de Jesús Alcañiz
 2003, Ernesto de Jesús Alcañiz 5 Gases y líquidos 5.1 La teoría cinético-molecular de los gases 5.2 Predicciones de la teoría cinético-molecular 5.3 Los gases reales: ecuación de Van der Waals 5.4 Propiedades
2003, Ernesto de Jesús Alcañiz 5 Gases y líquidos 5.1 La teoría cinético-molecular de los gases 5.2 Predicciones de la teoría cinético-molecular 5.3 Los gases reales: ecuación de Van der Waals 5.4 Propiedades
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
CANTIDAD DE SUSTANCIA. EL MOL. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 CANTIDAD DE SUSTANCIA. EL MOL Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Es fácil contar los garbanzos que hay en un puñado de esta legumbre. Hay que tener más paciencia para contar
CANTIDAD DE SUSTANCIA. EL MOL Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Es fácil contar los garbanzos que hay en un puñado de esta legumbre. Hay que tener más paciencia para contar
Tema 1.3 Estados de agregación de la materia. Tema 1.4 Composición de la materia
 Tema 1.3 Estados de agregación de la materia Tema 1.4 Composición de la materia 1 MATERIA Todo aquello que ocupa un lugar en el espacio, tiene una energía medible y está sujeto a cambios en el tiempo y
Tema 1.3 Estados de agregación de la materia Tema 1.4 Composición de la materia 1 MATERIA Todo aquello que ocupa un lugar en el espacio, tiene una energía medible y está sujeto a cambios en el tiempo y
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Capítulo 2: Enlace químico
 Capítulo 2: Enlace químico ACTIVIDADES DE RECAPITULACIÓN 1. Cuál será la electrovalencia de los siguientes elementos: Al, K, Br, Ne? Teniendo en cuenta la configuración electrónica del nivel de valencia,
Capítulo 2: Enlace químico ACTIVIDADES DE RECAPITULACIÓN 1. Cuál será la electrovalencia de los siguientes elementos: Al, K, Br, Ne? Teniendo en cuenta la configuración electrónica del nivel de valencia,
CLASE Nº 4 ENLACE QUÍMICO
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 4 ENLACE QUÍMICO 2012 1 Moléculas y compuestos
Fundamentos de Química. Horario de Tutorías
 Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
DISOLUCIONES UNIDAD IV. Licda. Miriam Marroquín Leiva
 DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
C/ Fernando Poo 5 Madrid (Metro Delicias o Embajadores).
 Problema 1: Junio 2013-2014 OPCION A Z=3 = = Periodo 2, Grupo 1 =Litio=Li Z=18 = =Periodo 3, Grupo 18 =Argón=Ar Potencial de ionización: energía necesaria para arrancar un electrón de un átomo. El potencial
Problema 1: Junio 2013-2014 OPCION A Z=3 = = Periodo 2, Grupo 1 =Litio=Li Z=18 = =Periodo 3, Grupo 18 =Argón=Ar Potencial de ionización: energía necesaria para arrancar un electrón de un átomo. El potencial
-aproximadamente 60% del organismo humano. -componente mas abundante en la mayoría de los alimentos
 EL AGUA -aproximadamente 60% del organismo humano -componente mas abundante en la mayoría de los alimentos -responsable del carácter apetecible de muchos alimentos y también de la aptitud al deterioro
EL AGUA -aproximadamente 60% del organismo humano -componente mas abundante en la mayoría de los alimentos -responsable del carácter apetecible de muchos alimentos y también de la aptitud al deterioro
4 Estructuras de los sólidos
 4 Estructuras de los sólidos 4.1 Comparación entre las propiedades de sólidos, líquidos y gases 4.2 Fuerzas entre moléculas y iones 4.3 Estructuras de los cristales 4.4 Sólidos metálicos 4.5 Sólidos iónicos
4 Estructuras de los sólidos 4.1 Comparación entre las propiedades de sólidos, líquidos y gases 4.2 Fuerzas entre moléculas y iones 4.3 Estructuras de los cristales 4.4 Sólidos metálicos 4.5 Sólidos iónicos
Estado Sólido. Estado Sólido. Estado Sólido. Estado Sólido - + Sólidos cristalinos y sólidos amorfos
 Sólidos cristalinos y sólidos amorfos Sólidos cristalinos: presentan un ordenamiento regular en el espacio Sólidos amorfos: no presentan el ordenamiento típico de los cristalinos Región cristalina Región
Sólidos cristalinos y sólidos amorfos Sólidos cristalinos: presentan un ordenamiento regular en el espacio Sólidos amorfos: no presentan el ordenamiento típico de los cristalinos Región cristalina Región
ESTADO SOLIDO. Propiedades 03/07/2012. Fuerte interacción entre partículas
 ESTADO SOLIDO Propiedades Fuerte interacción entre partículas Ocupan posiciones relativamente fijas las partículas vibran Tienen forma propia y definida Son prácticamente incompresibles No difunden entre
ESTADO SOLIDO Propiedades Fuerte interacción entre partículas Ocupan posiciones relativamente fijas las partículas vibran Tienen forma propia y definida Son prácticamente incompresibles No difunden entre
LA MATERIA. Características de los átomos
 LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
2.1.- ESTRUCTURA DEL ÁTOMO
 2.1.- ESTRUCTURA DEL ÁTOMO El átomo está formado por un núcleo, que contiene nuetrones y protones, el que a su vez esta rodeado por electrones. La carga eléctrica de un átomo es nula. Número atómico es
2.1.- ESTRUCTURA DEL ÁTOMO El átomo está formado por un núcleo, que contiene nuetrones y protones, el que a su vez esta rodeado por electrones. La carga eléctrica de un átomo es nula. Número atómico es
TEMA 1 1.CONSIDERACIONES SOBRE LA QUIMICA 1.1 QUE ES LA QUIMICA? 1.2 CLASIFICACIÓN DE LA QUÍMICA 1.3 PROCESOS QUIMICOS: SINTESIS Y ANÁLISIS
 TEMA 1 1.CONSIDERACIONES SOBRE LA QUIMICA 1.1 QUE ES LA QUIMICA? 1.2 CLASIFICACIÓN DE LA QUÍMICA 1.3 PROCESOS QUIMICOS: SINTESIS Y ANÁLISIS 2.CONCEPTOS BASICOS 1.1 ELEMENTOS, ISOTOPOS, U.M.A. Y PESOS ATOMICOS
TEMA 1 1.CONSIDERACIONES SOBRE LA QUIMICA 1.1 QUE ES LA QUIMICA? 1.2 CLASIFICACIÓN DE LA QUÍMICA 1.3 PROCESOS QUIMICOS: SINTESIS Y ANÁLISIS 2.CONCEPTOS BASICOS 1.1 ELEMENTOS, ISOTOPOS, U.M.A. Y PESOS ATOMICOS
Valor 3 puntos. 42. a. Diferenciación. b. Mutaciones. c. Recombinación. d. Herencia.
 Valor 3 puntos Las alteraciones que se producen en el material cromosómico ó genético de las células y que son capaces de transmitirse a la descendencia se denominan: 42. a. Diferenciación. b. Mutaciones.
Valor 3 puntos Las alteraciones que se producen en el material cromosómico ó genético de las células y que son capaces de transmitirse a la descendencia se denominan: 42. a. Diferenciación. b. Mutaciones.
JUNIO FASE ESPECÍFICA. QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres).
 Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
Dato experimental: Solamente los gases nobles y los metales en estado vapor existen en la naturaleza como átomo aislados (átomos libres). En condiciones estándar sólo los gases nobles. Por qué se unen
