SEGURIDAD, EFECTIVIDAD, COSTE-EFECTIVIDAD E IMPACTO PRESUPUESTARIO DE PANITUMUMAB (VECTIBIX ) PARA EL CÁNCER COLORRECTAL METASTÁTICO
|
|
|
- Luis Miguel Correa Miranda
- hace 6 años
- Vistas:
Transcripción
1 Seguridad, efectividad, coste-efectividad e impacto presupuestario de Panitumumab SEGURIDAD, EFECTIVIDAD, COSTE-EFECTIVIDAD E IMPACTO PRESUPUESTARIO DE PANITUMUMAB (VECTIBIX ) PARA EL CÁNCER COLORRECTAL METASTÁTICO Informe de evaluación de tecnologías sanitarias elaborado por el Servicio de Evaluación y Planificación a petición de la Dirección General de Farmacia del Servicio Canario de la Salud y de la Dirección Médica del Hospital Universitario Insular de Gran Canaria. Fecha de informe: 22 de marzo de 2010 Persona responsable: Pedro Serrano Aguilar (Jefe de Servicio) Investigadoras: Lidia García Pérez, Renata Linertová Resumen: Tecnología evaluada: Vectibix 20 mg/ml concentrado para solución para perfusión. Indicación: Vectibix está indicado en monoterapia para el tratamiento de pacientes con carcinoma colorrectal metastásico (CCRm) que exprese EGFR con KRAS no mutado (wildtype), tras el fracaso de regímenes de quimioterapia que contengan fluoropirimidina, oxaliplatino e irinotecán. Efectividad clínica y seguridad: La efectividad de panitumumab está avalada por un solo ensayo clínico que presenta algunas limitaciones. Según los resultados de este ensayo, se observó una pequeña mejora en la supervivencia libre de progresión en pacientes con gen KRAS no mutado y ninguna diferencia significativa en supervivencia global. La autorización de la EMEA es condicional hasta la aportación de resultados de nuevos estudios prospectivos. Coste e impacto presupuestario: El coste del tratamiento con Vectibix de paciente durante 8 semanas es de 96 por kg de peso corporal. El tratamiento de un paciente de 70 kg sería de aproximadamente Este coste es ligeramente inferior al coste de cetuximab (tratamiento actual del CCRm), por lo que el impacto presupuestario sería mínimo ya que un tratamiento es sustitutivo del otro. No existen estudios sobre la relación costeefectividad de panitumumab. Recomendación: Financiar el tratamiento con panitumumab (Vectibix ) en pacientes con cáncer colorrectal metastático con gen KRAS no mutado tras el fracaso de regímenes de quimioterapia con fluoropirimidina, oxaliplatino y irinotecán, cuando esté contraindicado cetuximab.
2 INTRODUCCIÓN El tratamiento del cáncer colorrectal metastático (CCRm) ha ido cambiando en los últimos años debido a la aparición de nuevos fármacos biotecnológicos, que actúan a través del factor de crecimiento endotelial (VEGF), o bloquean el receptor del factor de crecimiento epidérmico (EGFR). Actualmente, se dispone de dos anticuerpos monoclonales indicados en el tratamiento del cáncer colorrectal metastático que actúan inhibiendo la expresión del EGFR: cetuximab (Erbitux ) y panitumumab (Vectibix ). Panitumumab es el primer anticuerpo monoclonal 100% humano. La Agencia Española de Medicamentos y Productos Sanitarios y la Agencia Europea de Medicamentos (EMEA) han autorizado Vectibix, de forma condicional, como monoterapia para el tratamiento de pacientes con CCRm que exprese EGFR con KRAS no mutado (wild-type), tras el fracaso de regímenes de quimioterapia que contengan fluoropirimidina, oxaliplatino e irinotecán. Hasta el momento este tratamiento ha sido ofrecido puntualmente en un muy reducido número de pacientes. OBJETIVOS DEL INFORME 1. Identificar, evaluar y sintetizar el conocimiento científico disponible sobre la seguridad, la efectividad clínica y el coste-efectividad de panitumumab para el tratamiento del cáncer colorrectal metastático. 2. Estimar el coste del tratamiento por persona y año y su impacto presupuestario sobre el Servicio Canario de la Salud. Cuadro 1. Descripción de la tecnología Nombre comercial: Vectibix 20 mg/ml concentrado para solución para perfusión. Indicación: Vectibix está indicado en monoterapia para el tratamiento de pacientes con carcinoma colorrectal metastásico que exprese EGFR con KRAS no mutado (wild-type), tras el fracaso de regímenes de quimioterapia que contengan fluoropirimidina, oxaliplatino e irinotecán. Laboratorio: Amgen Europe B.V. Fecha de autorización por la EMEA: 3 de diciembre de 2007 (autorización condicional) Fecha de autorización en España: 18 de diciembre de 2007 Dispensación: Uso hospitalario, debe administrarse bajo la supervisión de un médico con experiencia en el empleo de medicamentos anticancerosos. La detección de la expresión de KRAS no mutado se debe realizar en un laboratorio experimentado y utilizando un método analítico validado. Composición: Panitumumab (anticuerpo monoclonal IgG2 humano producido en una línea celular de mamíferos (ovario de hámster chino) mediante tecnología del ADN recombinante) Presentación: Cada vial contiene 100 mg de panitumumab en 5 ml, 200 mg en 10 ml ó 400 mg en 20 ml
3 Administración y dosis: La dosis recomendada es de 6 mg/kg de peso corporal, administrada una vez cada dos semanas. Se debe administrar en infusión intravenosa mediante una bomba de infusión a través de una vía periférica o de un catéter permanente y utilizando un filtro de baja fijación a proteínas de 0,2 ó 0,22 micrómetros dispuesto en línea. El tiempo de infusión recomendado es de aproximadamente 60 minutos. Las dosis superiores a 1000 mg se deben infundir durante aproximadamente 90 minutos. Fuente: Ficha técnica del medicamento. EFECTIVIDAD CLÍNICA Y SEGURIDAD Metodología Se realizó una revisión sistemática rápida de la literatura y de otra documentación relevante (páginas web de la Agencia Europea del Medicamento y de la Agencia Española de Medicamentos y Productos Sanitarios). Se realizaron búsquedas de referencias bibliográficas en las siguientes bases de datos electrónicas y meta-buscadores: MEDLINE, MEDLINE in process, Cochrane, NHS CRD y ClinicalTrial.gov. La estrategia de búsqueda no se limitó por fechas ni idiomas y consistió en la combinación de los términos panitumumab y vectibix. Los resúmenes de las referencias y los artículos seleccionados fueron revisados teniendo en cuenta los criterios de inclusión especificados de acuerdo al objetivo del estudio. La calidad metodológica de los estudios fue evaluada. También fueron revisadas las listas de referencias bibliográficas de los artículos incluidos con el fin de localizar referencias relevantes. Se realizó una síntesis narrativa de los artículos incluidos. Criterios de inclusión: pacientes con cáncer colorrectal metastático tratados con panitumumab en monoterapia en el contexto de un estudio experimental, longitudinal y comparativo en el que se evalúe la efectividad clínica y/o seguridad del tratamiento. También se buscaron revisiones sistemáticas y estudios de costeefectividad. RESULTADOS Efectividad La estrategia de búsqueda dio como resultado 154 referencias bibliográficas una vez eliminados duplicados, la mayoría de las cuales no fueron seleccionadas. No se localizó ninguna revisión sistemática que respondiera al objetivo planteado aunque si se identificaron manualmente algunos informes que permitieron la identificación de estudios primarios (EMEA). Puesto que las agencias europea y española del medicamento sólo han autorizado la combinación de panitumumab en monoterapia con restricciones y de forma condicional 1 a la aportación de resultados clínicos 1 Cuando los datos, aunque no completos, indican que los beneficios de un medicamento superan los riesgos, la EMEA puede dar una autorización condicional al medicamento. La autorización condicional es renovada cada año hasta que la compañía farmacéutica cumple con las obligaciones que la EMEA le ha impuesto. Una vez ocurre esto la autorización pasa a ser normal. Las obligaciones que la EMEA ha impuesto a la compañía farmacéutica son, entre otras: presentar el informe del ensayo clínico que confirme la hipótesis sobre KRAS no mutado - 3 -
4 adicionales, aquellos estudios identificados que evaluaban panitumumab en combinación con otros medicamentos han sido excluidos del presente informe. Ensayo clínico en fase III (ensayo de referencia) Van Cutsem et al (Van Cutsem 2007) publicaron en 2007 el único ensayo clínico en fase III en el que se valora panitumumab en combinación con la mejor terapia de soporte (MTS) frente a la MTS (incluye tratamiento antibiótico, analgésico, radioterapia paliativa limitada a las metástasis óseas, corticoides, transfusiones, psicoterapia, factores de crecimiento, cirugía paliativa o cualquier tratamiento sintomático; se excluyen fármacos en investigación y antineoplásicos). El ensayo fue abierto, multicéntrico (81 centros), aleatorizado (1:1) y no doble ciego, debido a la toxicidad cutánea con panitumumab. Un total de 463 pacientes con diagnóstico de adenocarcinoma colorrectal metastático fueron aleatoriamente asignados a panitumumab 6 mg/kg cada 2 semanas + MTS (N=231) o a MTS sólo (N=232). En el grupo de MTS 176 pacientes recibieron panitumumab tras la progresión de la enfermedad y fueron incluidos en un estudio de extensión (Van Cutsem 2008). Se evaluó la supervivencia libre de progresión (SLP) como medida principal, respuesta tumoral objetiva, supervivencia global y seguridad. La mediana del seguimiento fue de 72 semanas (rango de 52 a 113). Tabla 1: Características del ensayo de referencia (Van Cutsem 2007) Diseño Ensayo clínico en fase III, abierto, multicéntrico, de asignación aleatoria 1:1, con seguimiento de 2 años Panitumumab + mejor terapia de soporte: 6 mg/kg cada 2 semanas, hasta progresión Intervenciones Pacientes Mejor terapia de soporte (MTS) Los pacientes de este grupo en los que la enfermedad progresó podían recibir panitumumab como parte de un estudio de extensión (Van Cutsem 2008). Pacientes con cáncer colorrectal metastático, con progreso confirmado por radiología que hubieran recibido en los últimos 6 meses fluoropirimidinas, irinotecan y oxaliplatino; con 2 ó 3 líneas previas de quimioterapia para el tratamiento del CCRm; estado funcional ECOG: 0 2; tinción positiva del EGFR, en las membranas en las células tumorales, 1%, por inmunohistoquímica. Criterios de exclusión: metástasis cerebrales sintomáticas, neumonitis intersticial o fibrosis pulmonar, radioterapia o quimioterapia sistémica en los últimos 30 días, tratamiento previo con fármacos anti-egfr, tratamiento previo con anticuerpos comercializados o en desarrollo con vida media elevada (bevacizumab) en los últimos 3 meses, tratamiento previo antitumoral experimental o moléculas pequeñas o con vida media sérica corta en los últimos 30 días, quimioterapia distinta de los regímenes especificados como biomarcador, proporcionar datos sobre calidad de vida, presentar resultados de los otros ensayos clínicos en marcha, realizar un ensayo confirmatorio investigando panitumumab en monoterapia en la indicación autorizada, etc
5 para fluoropirimidinas, irinotecan y oxaliplatino para CCR. Medidas de resultados -Grupo de terapia: Panitumumab + mejor terapia de soporte (N=231) -Grupo mejor terapia de soporte (N=232) PRIMARIA: -Supervivencia libre de progresión: tiempo desde la aleatorización hasta la fecha de progresión radiológica de la enfermedad o muerte. SECUNDARIAS: -Respuesta tumoral objetiva, mediante criterios RECIST modificados -Supervivencia global: se determina cada 3 meses hasta los 2 años. Se midió como tiempo desde la aleatorización hasta la muerte. -Seguridad La SLP fue más prolongada en el grupo de panitumumab frente al grupo MTS (p<0,0001; hazard ratio = 0,54 (IC 95% 0,44-0,66)). La mediana de SLP fue de 8 semanas (IC 95% 7,9-8,4) en el grupo del panitumumab frente a 7,3 (IC 95% 7,1-7,7) en el grupo de MTS. A las 8 semanas (primera visita programada) la SLP fue de 49% para el grupo de panitumumab y de 30% para el MTS; las diferencias de SLP entre grupos fueron favorables para el grupo de panitumumab en todas las evaluaciones desde la semana 8 a la 32 (tabla 2). La respuesta objetiva a los 12 meses como mínimo fue de 10% en el grupo de panitumumab y 0% en el grupo de MTS (p<0,0001). La mediana del tiempo hasta respuesta fue de 7,9 semanas (rango 6,7 15,6) y la mediana de la duración de la respuesta fue de 17 semanas (rango 7,9 76,7). No se observaron diferencias en la supervivencia global (SG), probablemente por el diseño cruzado del estudio para el grupo de MTS. Los efectos adversos tóxicos más frecuentemente observados fueron toxicidad dermatológica, hipomagnesemia y diarrea. Ningún paciente tuvo reacciones graves a la infusión (grado 3/4). Evaluación de la calidad: El ensayo de referencia no fue diseñado adecuadamente para mostrar diferencias en SG, ya que los pacientes del grupo de MTS fueron admitidos al tratamiento con panitumumab al progresar la enfermedad y eso impide la comparación de SG entre grupos. La primera valoración de la progresión se realizó a las 8 semanas, cuando una gran parte de los pacientes habían ya progresado. La falta de visitas planificadas más tempranas en ambos grupos puede llevar a sesgos y la diferencia en la SLP está probablemente sobreestimada. Aún así, se observó una muy pequeña mejora en SLP, ninguna diferencia en SG y una respuesta objetiva baja. La diferencia de medianas de SLP es muy reducida (5 días) y, aunque estadísticamente significativa, la SLP es una variable intermedia y la efectividad se debería valorar en función de variables finales como SG, en la que no se ha demostrado mejora en el estudio de referencia. Por estos motivos la EMEA consideró en un primer momento que el balance beneficioriesgo resultaba desfavorable
6 Extensión del ensayo de referencia En 2008 el mismo grupo de autores publicó un estudio de extensión del ensayo de referencia de un solo brazo (Van Cutsem 2008), en el que fueron tratados con panitumumab 176 pacientes que estaban en el grupo control del ensayo de referencia, y en los que hubo progresión de la enfermedad en la primera revisión a los 8 semanas. El tratamiento fue igual que el del grupo de intervención del ensayo anterior. La mediana del seguimiento fue de 61 semanas (18-103) y la mediana de infusiones por paciente fue 5 (1-29). La principal medida de resultado evaluada fue la seguridad (véase el apartado de seguridad). Como variables secundarias se evaluó la SLP, SG y respuesta objetiva. El 11% tuvo respuesta objetiva parcial con panitumumab y sólo el 0,6% respuesta completa. Adicionalmente el 33% de los pacientes tuvieron una respuesta estable. La SLP mediana fue de 9,4 semanas (8,0-13,4) y la SG mediana fue de 6,3 meses (5,1-6,8) (tabla 2). Tabla 2. Resultados del ensayo de referencia (Van Cutsem 2007) y su extensión de un solo brazo (Van Cutsem 2008) Medida de resultado Supervivencia libre de progresión (mediana, en semanas) Supervivencia libre de progresión (media, en semanas) Supervivencia global (mediana, meses) Respuesta objetiva (parcial) (%) Tiempo hasta la respuesta (mediana, semanas) Duración de la respuesta (mediana, semanas) Enfermedad estable (%) Panitumumab + MTS N=231 8 (7,9-8,4) MTS N=232 7,3 (7,1-7,7) HR (IC 95%) HR: 0,54 (0,44-0,66) Análisis ajustado*: HR: 0,60 (0,49-0,74) p-value Panitumumab + MTS Extensión N=176 <0,0001 9,4 (8,0-13,4) 13,8 8, ,3 (3,4-10,3) 6,0 (3,1-10,6) HR: 1,0 (0,82-1,22) NS 6,3 (5,1-6,8) 10 0 Dif.: 10 <0, ,9 (6,7-15,6) (7-25) 17,0 (7,9-76,7) (8-35) Dif.: * Análisis ajustado por los posibles sesgos introducidos por las evaluaciones no planificadas. MTS: Mejor terapia de soporte; HR: Hazard ratio; IC: Intervalo de confianza; NS: No significativo; Dif.: diferencia. Reanálisis del ensayo de referencia Posteriormente se ha publicado un análisis retrospectivo de los resultados en función del estado de la mutación del gen KRAS (Amado 2008). Se analizaron datos de pacientes del ECA de referencia con muestras disponibles para el análisis de - 6 -
7 mutaciones del gen KRAS (92%). Un 40% de los pacientes en el grupo activo y un 46% de los pacientes en el grupo control presentaron KRAS mutado. Este análisis demostró que el beneficio de panitumumab solo se obtenía en ausencia de mutaciones del KRAS: el hazard ratio de la SLP fue de 0,45 (IC 95% 0,34-0,59) a favor de panitumumab, con una diferencia en la mediana de la SLP de 5 semanas. Tabla 3. Resultados del reanálisis por tipo de KRAS (Amado 2008) Medida de resultado Panitumumab + MTS KRAS no mutado (N=124) MTS (N=119) HR (IC 95%) p-value Supervivencia libre de progresión (mediana, semanas) 12,3 7,3 0,45 (0,34-0,59) <0,0001 Supervivencia global No No disponible (mediana, meses) disponible 0,99 (0,75-1,29) NS Respuesta objetiva (%) 17 (11-25) Tiempo hasta la respuesta (mediana, semanas) 7,9 (7,0-15,6) Duración de la respuesta (mediana, semanas) 19,7 (7,9-88,7) Enfermedad estable (%) RAR: 22 - * Análisis ajustado por los posibles sesgos introducidos por las evaluaciones no planificadas. MTS: Mejor terapia de soporte; HR: Hazard ratio; IC: Intervalo de confianza; NS: No significativo; RAR: reducción absoluta de riesgo. Otros ensayos Existen otros 4 ensayos en fase II, multicéntricos, abiertos y de un solo brazo en los que se evalúa seguridad y eficacia de panitumumab en monoterapia en pacientes con CCRm que han fracasado al tratamiento estándar (Hecht 2007, , , Muro 2009). Tres de ellos fueron evaluados por la EMEA; el ensayo de Muro et al (2009) no fue evaluado por su fecha reciente de publicación. Los resultados de eficacia de estos ensayos, que incluyeron una población de pacientes similar, confirmaron los resultados de eficacia del ensayo de referencia (Van Cutsem 2007). Sin embargo, es difícil comparar estos estudios con el ensayo de referencia, ya que existen diferencias en criterios de inclusión, métodos de evaluación de la respuesta tumoral (RECIST modificado vs. criterios de OMS), tiempos de evaluación del tumor, medidas principales y los procesos de fabricación de panitumumab. En general se puede asegurar, que existe una eficacia anti-tumoral, aunque el nivel de respuesta es bajo (se observó sólo respuesta parcial). Seguridad Con el objeto de informar sobre la seguridad de panitumumab se tomó en consideración, además del ensayo clínico publicado por Van Cutsem et al y su extensión, la discusión científica redactada por la EMEA en En el ensayo de Van Cutsem et al (2008) ocurrieron reacciones adversas de grado 3 en el 16% de los casos y de grado 4 en el 2%. El 4% de los pacientes interrumpieron el tratamiento por reacciones cutáneas adversas relacionadas con panitumumab. La mediana de tiempo hasta la aparición de la 1ª toxicidad cutánea fue de 14 días (
8 72). Los efectos adversos más comunes fueron hipomagnesemia (29%), hipocalcemia (14%) y toxicidad ocular (15%). La EMEA analizó 10 estudios que suman 789 pacientes con CCRm refractarios a quimioterapia estándar tratados con panitumumab en monoterapia. La mayoría de los pacientes (77%) recibió la dosis indicada (6 mg/kg cada 2 semanas), con la mediana de seguimiento de 17 semanas (rango 1-111). Todos los pacientes experimentaron al menos un efecto adverso. Los efectos adversos más comunes de panitumumab en monoterapia en pacientes con CCRm eran efectos adversos cutáneos seguidos por los efectos adversos gastrointestinales (tabla 4). La mayoría de los síntomas de las reacciones potencialmente relacionadas con la infusión fueron de intensidad leve, se resolvieron sin tratamiento, fueron casos aislados y no fue necesario alterar o interrumpir el tratamiento. Tabla 4: Efectos adversos más comunes en pacientes con monoterapia de panitumumab. Evento Cualquier grado (N=789) Grado 3 o más (N=789) Al menos un evento 100% 54% Dermatitis acneiforme 52% 5% Prurito 49% 2% Eritema 49% 4% Rash cutáneo 38% 3% Fatiga 33% 5% Náuseas 29% 2% Diarrea 26% 2% Los efectos adversos fatales o severos fueron directamente atribuidos a la progresión del cáncer. Dos pacientes presentaron efectos adversos mortales (posiblemente relacionados con el tratamiento): uno por embolia pulmonar y otro por infarto de miocardio. Otros ocho pacientes (1%) tuvieron eventos adversos potencialmente mortales que se consideraron relacionados con panitumumab. La incidencia global de formación de anticuerpos anti-panitumumab es baja (1-2%). Comparado con pacientes que no desarrollaron anticuerpos, no se observó ninguna relación entre la presencia de anticuerpos anti-panitumumab y la farmacocinética, la eficacia y la seguridad. Estudios en fase de ejecución De acuerdo con la base da datos clinicaltrial.gov (consultada el 19 de enero de 2010) existen 34 estudios actualmente en activo con y sin reclutamiento de pacientes, en los que se incluye panitumumab en monoterapia o combinado con otro medicamento en uno de los brazos. Quince de ellos son patrocinados por Amgen. Únicamente uno de ellos comparará panitumumab con cetuximab para el tratamiento del CCRm en un ensayo fase III a realizarse de enero de 2010 a agosto de
9 COSTE DEL TRATAMIENTO Metodología Al igual que para la efectividad, se realizó una búsqueda sistemática en la base de datos de estudios económicos NHS EDD y en MEDLINE. Se realizó una estimación bruta del coste directo del tratamiento con panitumumab por paciente y año. La cantidad de recursos consumidos (dosis) del tratamiento farmacológico se ha estimado a partir de la ficha técnica del laboratorio. Los datos de costes unitarios (PVL sin impuestos) han sido obtenidos en vademecum.es: 1 vial de 20 ml tiene un coste de Los costes se expresan en euros de Posteriormente se realizó un análisis del impacto presupuestario que supondría para el Servicio Canario de la Salud la indicación de panitumumab para el tratamiento del cáncer colorrectal metastático en todos sus centros hospitalarios, mediante la comparación de varios escenarios. Para ello se consultó con expertos en oncología de Canarias que nos facilitaron información sobre el número de pacientes susceptibles de recibir este tratamiento atendiendo a criterios clínicos. Resultados No se encontró ninguna evaluación económica que valorara panitumumab. Únicamente se identificó un estudio de análisis de costes en el que se comparan los costes de panitumumab y cetuximab, sin entrar en comparaciones de efectividad (Arocho et al, 2009). Según este estudio el tratamiento con panitumumab del CCRm puede generar ahorros para los hospitales del Sistema Nacional de Salud en comparación con cetuximab ya que el coste del primero es inferior al segundo: frente a ( de 2008). A continuación se muestran los resultados de la estimación bruta del coste del tratamiento e impacto presupuestario en el SCS. El coste unitario de un vial de 20 ml de Vectibix es de (PVL, 2010). Considerando una dosis de 6 mg/kg cada 2 semanas el coste de 8 semanas de tratamiento es de 96 por kg de peso; (suponemos 8 semanas de tratamiento puesto que este es el tiempo que transcurre hasta que el tumor progresa en el ensayo clínico de referencia). La tabla 5 muestra las estimaciones del coste del tratamiento con Vectibix y su alternativa Erbitux de 8 semanas por persona para distintos pesos corporales. Estos resultados muestran que el coste de Vectibix es menor que el coste de Erbitux. Tabla 5. Estimación del coste por persona del tratamiento de 8 semanas con Vectibix y con Erbitux (euros 2010) Panitumumab (Vectibix ) 20 ml (20 mg) Cetuximab (Erbitux ) 20 ml (5 mg/ml) PVL de un vial de 20 ml ,3 Posología 6 mg/kg cada 2 semanas 400 mg/m² la primera semana y 250 mg/m² cada semana sucesiva Coste de 8 semanas de tratamiento ,01 Notas Estimaciones basadas en el supuesto de que cada paciente recibe 8 semanas de tratamiento (en el estudio de Van Cutsen et al transcurren 8 semanas hasta que el tumor progresa). Suponemos paciente de 70 kg de peso, 1 75 m de altura y superficie corporal de 1,8 m
10 El número de pacientes con CCRm y KRAS mutado en Canarias se ha estimado, a partir de la consulta con especialistas, entre 5 y 10 casos al año. La tabla 6 muestra diversos escenarios de impacto presupuestario anual para el Servicio Canario de la Salud para distintas prevalencias de la enfermedad, en el caso de que cada paciente recibiera 8 semanas de tratamiento. Estas estimaciones sólo incluyen el coste directo del medicamento; no incluye coste de la administración, visitas a médicos, estancias, otras medicaciones, etc. Tabla 6. Análisis del impacto presupuestario anual en el Servicio Canario de la Salud de la introducción de Vectibix (euros 2010) Panitumumab (Vectibix ) Nº de personas 20 ml (20 mg) 60 kg de peso 70 kg de peso 80 kg de peso Notas Estimaciones basadas en el supuesto de que cada paciente recibe 8 semanas de tratamiento (en el estudio de Van Cutsen et al transcurren 8 semanas hasta que el tumor progresa). El coste promedio del tratamiento con panitumumab de un paciente con CCRm se estima en aproximadamente (8 semanas de tratamiento). Suponiendo un escenario de 10 pacientes susceptibles de recibir el tratamiento al año en Canarias, el impacto presupuestario para el Servicio Canario de la Salud sería de aproximadamente euros. Esta cifra podría ser más reducida si panitumumab se prescribiera únicamente a pacientes que tuvieran contraindicado cetuximab. En cualquier caso, puesto que los dos tratamientos, panitumumab y cetuximab, tienen similar coste, el impacto presupuestario sería mínimo ya que un tratamiento es alternativo al otro. CONCLUSIONES 1. Un solo ensayo clínico en fase III comparó panitumumab + mejor terapia de soporte (MTS) con MTS en pacientes con CCRm tras el fracaso de regímenes de quimioterapia con fluoropirimidina, irinotecán y oxaliplatino. Se observó una pequeña mejora en la supervivencia libre de progresión (5 días), ninguna diferencia significativa en supervivencia global (probablemente por el diseño cruzado del estudio para el grupo de MTS) y una respuesta objetiva baja (10%). 2. El reanálisis de los datos demostró un efecto estadísticamente significativo de la SLP en pacientes con gen KRAS no mutado comparado con los pacientes con KRAS mutado (5 semanas). 3. No existen estudios disponibles que comparen panitumumab con la alternativa actualmente disponible, cetuximab. 4. Se están esperando los resultados de dos ensayos clínicos en curso (fecha prevista de terminación en marzo y julio de 2010). A la luz de los nuevos
11 resultados será necesario reevaluar este medicamento ya que su autorización por la EMEA es condicional a la aportación de nuevos estudios prospectivos. 5. Como en otros inhibidores del EGFR, los efectos adversos más comunes están relacionados con el efecto farmacológico en forma de toxicidad cutánea, el cual se considera clínicamente manejable. 6. El coste directo de la medicación con panitumumab es ligeramente inferior al coste de cetuximab. No existen evaluaciones económicas completas en las que se evalúe el coste-efectividad de panitumumab. RECOMENDACIONES A partir del estado actual del conocimiento científico (muy pequeña mejora de la supervivencia libre de progresión, no mejora en la supervivencia global y respuesta objetiva baja, más favorable para un subgrupo de pacientes), y teniendo en cuenta que se trata de un medicamento con aprobación condicional del que se esperan nuevos estudios y cuya coste-efectividad no ha sido demostrada, Se recomienda: No financiar panitumumab (Vectibix ), salvo en aquellas circunstancias en las que esté contraindicado cetuximab y exclusivamente en pacientes con cáncer colorrectal metastático con gen KRAS no mutado tras el fracaso de regímenes de quimioterapia con fluoropirimidina, oxaliplatino y irinotecán. EXPERTOS CONSULTADOS Dr. José Norberto Batista López. Jefe del Servicio de Oncología Médica del Hospital Universitario de Canarias Dr. Adolfo Murias Rosales. Jefe del Servicio de Oncología del Hospital Universitario Insular de Gran Canaria Dr. José Aguiar Morales. Jefe del Servicio de Oncología Médica del Hospital Universitario de Gran Canaria Dr. Negrín Doña Marina Bullejos Molina. Jefa del Servicio de Farmacia del Hospital Universitario de Canarias Doña Alicia Díez del Pino. Jefa del Servicio de Farmacia del Hospital Universitario Insular de Gran Canaria Don Rafael Molero Gómez. Jefe del Servicio de Farmacia del Hospital Universitario de Gran Canaria Dr. Negrín Don Francisco Javier Merino Alonso. Jefe del Servicio de Farmacia del Hospital Universitario Nuestra Señora de la Candelaria Dra. Marta Llanos Muñoz. Servicio de Oncología Médica del Hospital Universitario de Canarias
12 Dr. Delvys Rodríguez Abreu. Servicio de Oncología del Hospital Universitario Insular de Gran Canaria EXPERTOS CONSULTADOS Y REVISORES EXTERNOS DEL INFORME Dr. Javier Dorta. Jefe del Servicio de Oncología del Hospital Universitario Nuestra Señora de la Candelaria AGRADECIMIENTOS A la Dirección General de Farmacia, a los Servicios de Oncología de los hospitales citados, a Don Francisco Javier García García y a Don José Antonio Martín Conde. REFERENCIAS Amado RG, Wolf M, Peeters M, Van Cutsem E, Siena S, Freeman DJ et al. Wildtype KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. Journal of Clinical Oncology. 2008;26(10): Arocho R, García de Paredes M, Maurel J, Lema M, Hart WM, Rubio-Terrés C. Análisis del coste de la terapia biológica del cáncer colorrectal metastático con panitumumab y cetuximab. PharmacoEconomics Span Res Art. 2009;6(2): Hecht JR, Patnaik A, Berlin J, Venook A, Malik I, Tchekmedyian S et al. Panitumumab monotherapy in patients with previously treated metastatic colorectal cancer. Cancer. 2007;110(5): Muro K, Yoshino T, Doi T, Shirao K, Takiuchi H, Hamamoto Y et al. A phase 2 clinical trial of panitumumab monotherapy in Japanese patients with metastatic colorectal cancer. Japanese Journal of Clinical Oncology. 2009;39(5): Van Cutsem E, Peeters M, Siena S, Humblet Y, Hendlisz A, Neyns B et al. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. Journal of Clinical Oncology. 2007;25(13): Van Cutsem E, Siena S, Humblet Y, Canon JL, Maurel J, Bajetta E et al. An open-label, single-arm study assessing safety and efficacy of panitumumab in patients with metastatic colorectal cancer refractory to standard chemotherapy. Annals of Oncology. 2008;1: Páginas web consultadas: Agencia Española de Medicamentos y Productos Sanitarios:
13 European Medicines Agency: Vademecum:
PANITUMUMAB EN CANCER DE COLON METASTÁSICO:
 PANITUMUMAB EN CANCER DE COLON METASTÁSICO: Romero Soria L 1, Jaraquemada Peláez T 2, Martin Clavo S 1, Rivero Cava MS 1, Braga Fuentes JL, Rangel Mayoral JF 1. 1 Servicio de Farmacia Hospitalaria 2 Servicio
PANITUMUMAB EN CANCER DE COLON METASTÁSICO: Romero Soria L 1, Jaraquemada Peláez T 2, Martin Clavo S 1, Rivero Cava MS 1, Braga Fuentes JL, Rangel Mayoral JF 1. 1 Servicio de Farmacia Hospitalaria 2 Servicio
Hospital Universitario Dr. Peset Valencia, 20 de octubre de 2011.
 EFICIENCIA DE BEVACIZUMAB IRINOTECÁN FLUOROURACILO VERSUS IRINOTECÁN FLUOROURACILO EN PRIMERA LÍNEA DE CARCINOMA COLORRECTAL METASTÁSICO Ruiz Millo O. 1, Sendra García A. 1, Albert Marí A. 1, González
EFICIENCIA DE BEVACIZUMAB IRINOTECÁN FLUOROURACILO VERSUS IRINOTECÁN FLUOROURACILO EN PRIMERA LÍNEA DE CARCINOMA COLORRECTAL METASTÁSICO Ruiz Millo O. 1, Sendra García A. 1, Albert Marí A. 1, González
COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE USO HOSPITALARIO. L01XC08: Agentes antineoplásicos, anticuerpos monoclonales. acético glacial.
 COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE USO HOSPITALARIO INFORME DE EVALUACIÓN Principio activo: Nombre comercial y presentaciones: Condiciones de dispensación: Procedimiento de autorización: Fecha
COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE USO HOSPITALARIO INFORME DE EVALUACIÓN Principio activo: Nombre comercial y presentaciones: Condiciones de dispensación: Procedimiento de autorización: Fecha
PANITUMUMAB Carcinoma colorrectal metastásico
 PANITUMUMAB Carcinoma colorrectal metastásico Informe para la Comisión de Farmacia y Terapéutica del Hospital Morales Meseguer Fecha 16/06/09 1. IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco:
PANITUMUMAB Carcinoma colorrectal metastásico Informe para la Comisión de Farmacia y Terapéutica del Hospital Morales Meseguer Fecha 16/06/09 1. IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco:
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
2.1 EFICACIA. Cetuximab en combinación con quimioterapia
 EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal
 El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal Proporción vivos Supervivencia con Ipilumumab en acceso expandido 1.0 0.9 0.8 Mediana de supervivencia meses
El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal Proporción vivos Supervivencia con Ipilumumab en acceso expandido 1.0 0.9 0.8 Mediana de supervivencia meses
Cetuximab en Cáncer de Colon
 1 Cetuximab ONCOLOGÍA en Cáncer de Colon 2013 Cetuximab en Cáncer de Colon Recomendaciones para su Uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Patricio Servienti, Dr. Ventura Simonovich Evaluación
1 Cetuximab ONCOLOGÍA en Cáncer de Colon 2013 Cetuximab en Cáncer de Colon Recomendaciones para su Uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Patricio Servienti, Dr. Ventura Simonovich Evaluación
GESTION INTEGRAL DEL BANCO DROGAS ONCOLOGICAS
 GESTION INTEGRAL DEL BANCO DROGAS ONCOLOGICAS DR MAURICIO LIRUSSI DIRECTOR BANCO DE DROGAS ANTINEOPLASICAS PROVINCIA DE SAN JUAN BANCO DROGAS ANTINEOPLASICOS PROVINCIA DE SAN JUAN 144 PACIENTES TRATADOS
GESTION INTEGRAL DEL BANCO DROGAS ONCOLOGICAS DR MAURICIO LIRUSSI DIRECTOR BANCO DE DROGAS ANTINEOPLASICAS PROVINCIA DE SAN JUAN BANCO DROGAS ANTINEOPLASICOS PROVINCIA DE SAN JUAN 144 PACIENTES TRATADOS
SEGURIDAD, EFECTIVIDAD, COSTE-EFECTIVIDAD E IMPACTO PRESUPUESTARIO DE BEVACIZUMAB (AVASTIN ) PARA EL CÁNCER DE MAMA METASTÁTICO
 Seguridad, efectividad, coste- efectividad e impacto presupuestario de bevacizumab SEGURIDAD, EFECTIVIDAD, COSTE-EFECTIVIDAD E IMPACTO PRESUPUESTARIO DE BEVACIZUMAB (AVASTIN ) PARA EL CÁNCER DE MAMA METASTÁTICO
Seguridad, efectividad, coste- efectividad e impacto presupuestario de bevacizumab SEGURIDAD, EFECTIVIDAD, COSTE-EFECTIVIDAD E IMPACTO PRESUPUESTARIO DE BEVACIZUMAB (AVASTIN ) PARA EL CÁNCER DE MAMA METASTÁTICO
Bevacizumab en Cáncer de Colon
 1 Bevacizumab ONCOLOGÍA en Cáncer de Colon 2013 Bevacizumab en Cáncer de Colon Recomendaciones para su Uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Patricio Servienti, Dr. Ventura Simonovich Evaluación
1 Bevacizumab ONCOLOGÍA en Cáncer de Colon 2013 Bevacizumab en Cáncer de Colon Recomendaciones para su Uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Patricio Servienti, Dr. Ventura Simonovich Evaluación
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Vectibix 20 mg/ml concentrado para solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Vectibix 20 mg/ml concentrado para solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
PERTUZUMAB AUMENTA LA SUPERVIVENCIA GLOBAL EN CÁNCER DE MAMA METASTÁSICO HER2 POSITIVO
 Los especialistas españoles coinciden en que es el avance más relevante en una década y que permitirá afrontar una necesidad médica urgente PERTUZUMAB AUMENTA LA SUPERVIVENCIA GLOBAL EN CÁNCER DE MAMA
Los especialistas españoles coinciden en que es el avance más relevante en una década y que permitirá afrontar una necesidad médica urgente PERTUZUMAB AUMENTA LA SUPERVIVENCIA GLOBAL EN CÁNCER DE MAMA
ANEXO Plantillas de trabajo para la formulación de recomendaciones
 ANEXO 12.3. Plantillas de trabajo para la formulación de recomendaciones 1. PREGUNTA CLÍNICA ESTRUCTURADA (FORMATO PICO) En los pacientes adultos Se recomienda el uso de fármacos libres de conservantes
ANEXO 12.3. Plantillas de trabajo para la formulación de recomendaciones 1. PREGUNTA CLÍNICA ESTRUCTURADA (FORMATO PICO) En los pacientes adultos Se recomienda el uso de fármacos libres de conservantes
Comissió de Millora de l'adequació de la Pràctica Assistencial i Clínica (MAPAC) Resumen de la evaluación 2011/01
 Comissió de Millora de l'adequació de la Pràctica Assistencial i Clínica (MAPAC) Resumen de la evaluación 2011/01 PREGUNTAS PRESTACIONES EVALUADAS Está recomendado en términos de supervivencia y calidad
Comissió de Millora de l'adequació de la Pràctica Assistencial i Clínica (MAPAC) Resumen de la evaluación 2011/01 PREGUNTAS PRESTACIONES EVALUADAS Está recomendado en términos de supervivencia y calidad
Coste por unidad PVL con IVA Vial 100 mg/ 50 ml 1 vial 745026 246,69 204,60
 Servei de Farmàcia Informe CFT: 1/6 Cetuximab Tratamiento de cáncer de células escamosas de cabeza y cuello localmente avanzado, en combinación con radioterapia Informe para la Comisión Farmacoterapéutica
Servei de Farmàcia Informe CFT: 1/6 Cetuximab Tratamiento de cáncer de células escamosas de cabeza y cuello localmente avanzado, en combinación con radioterapia Informe para la Comisión Farmacoterapéutica
Cáncer de mama avanzado
 Cáncer de mama avanzado Santander 1 de Julio 2016 Tàrsila Ferro Directora de Cuidados Instituto Catalán de Oncología Profesora Universidad de Barcelona Definiciones Cáncer de mama recurrente o recurrencia:
Cáncer de mama avanzado Santander 1 de Julio 2016 Tàrsila Ferro Directora de Cuidados Instituto Catalán de Oncología Profesora Universidad de Barcelona Definiciones Cáncer de mama recurrente o recurrencia:
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Vectibix 20 mg/ml concentrado para solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Vectibix 20 mg/ml concentrado para solución para perfusión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
EL EQUIPO MULTIDISCIPLINAR XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO BIOMARCADORES PREDICTIVOS
 XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO ACTUALIZACION EN BIOMARCADORES Y GUIA DE RECOMENDACIONES EN TUMORES DEL APARATO DIGESTIVO # DIAGNOSTICO # APORTACION
XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO ACTUALIZACION EN BIOMARCADORES Y GUIA DE RECOMENDACIONES EN TUMORES DEL APARATO DIGESTIVO # DIAGNOSTICO # APORTACION
INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) INSULINAS
 Centro de Información de Medicamentos. Servicio de Farmacia. INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) Datos del solicitante INSULINAS Dr. Pedro José Pines Corrales, FEA del servicio
Centro de Información de Medicamentos. Servicio de Farmacia. INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) Datos del solicitante INSULINAS Dr. Pedro José Pines Corrales, FEA del servicio
Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1)
 Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1) Colaboración Cochrane Antecedentes Las exacerbaciones agudas del asma son frecuentes y responsables de
Cámara de inhalación versus nebulizadores para el tratamiento con β agonista en el asma agudo (1) Colaboración Cochrane Antecedentes Las exacerbaciones agudas del asma son frecuentes y responsables de
POLÍTICA DE PRECIOS Y FINANCIACIÓN DE MEDICAMENTOS. Piedad Ferré DG Cartera Básica de Servicios del SNS y Farmacia 27-oct-2016
 POLÍTICA DE PRECIOS Y FINANCIACIÓN DE MEDICAMENTOS Piedad Ferré DG Cartera Básica de Servicios del SNS y Farmacia 27-oct-2016 Bases legales Real Decreto legislativo I/2015 por el que se aprueba el texto
POLÍTICA DE PRECIOS Y FINANCIACIÓN DE MEDICAMENTOS Piedad Ferré DG Cartera Básica de Servicios del SNS y Farmacia 27-oct-2016 Bases legales Real Decreto legislativo I/2015 por el que se aprueba el texto
Formación Médica Continuada y Curso de Doctorado de la ULPGC. Metodología de la Investigación en Medicina
 Formación Médica Continuada y Curso de Doctorado de la ULPGC Metodología de la Investigación en Medicina 1 Formación Médica Continuada y Curso de Doctorado de la ULPGC Metodología de la Investigación en
Formación Médica Continuada y Curso de Doctorado de la ULPGC Metodología de la Investigación en Medicina 1 Formación Médica Continuada y Curso de Doctorado de la ULPGC Metodología de la Investigación en
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
Costo efectividad de la ingesta de sangre de pollo en el tratamiento de la anemia ferropénica en estudiantes de la EAP de Obstetricia de la UNMSM
 REV ACAD PERU SALUD 14(1), 2007 97 TESIS DE MAESTRÍA Costo efectividad de la ingesta de sangre de pollo en el tratamiento de la anemia ferropénica en estudiantes de la EAP de Obstetricia de la UNMSM Zaida
REV ACAD PERU SALUD 14(1), 2007 97 TESIS DE MAESTRÍA Costo efectividad de la ingesta de sangre de pollo en el tratamiento de la anemia ferropénica en estudiantes de la EAP de Obstetricia de la UNMSM Zaida
Equivalentes terapéuticos
 Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
ENSAYOS CLINICOS REQUISITOS QUE DEBE CUMPLIR UN PROGRAMA DE ENSAYOS CLINICOS
 ENSAYOS CLINICOS La aplicación para el seguimiento y control de Ensayos Clínicos y estudios de investigación con medicamentos, se contempla como una opción en conexión integral con el resto de los programas
ENSAYOS CLINICOS La aplicación para el seguimiento y control de Ensayos Clínicos y estudios de investigación con medicamentos, se contempla como una opción en conexión integral con el resto de los programas
Le ayudamos a comprender la importancia de los Biomarcadores predictivos RAS en el tratamiento del cáncer colorrectal
 Le ayudamos a comprender la importancia de los Biomarcadores predictivos RAS en el tratamiento del cáncer colorrectal... porque la vida importa Objetivos de este folleto Este folleto ha sido elaborado
Le ayudamos a comprender la importancia de los Biomarcadores predictivos RAS en el tratamiento del cáncer colorrectal... porque la vida importa Objetivos de este folleto Este folleto ha sido elaborado
Conocimientos Aporta los atributos cognitivos que se describen en los contenidos básicos.
 Unidad de Aprendizaje TC.4 EN SALUD INVESTIGACIÓN E INFORMACIÓN CIENTÍFICA Descripción general Es una introducción a la investigación y a la información científica actual. El estudiante, aunque no se formará
Unidad de Aprendizaje TC.4 EN SALUD INVESTIGACIÓN E INFORMACIÓN CIENTÍFICA Descripción general Es una introducción a la investigación y a la información científica actual. El estudiante, aunque no se formará
AFLIBERCEPT. ZALTRAP (Sanofi Aventis) CÁNCER DE COLON
 AFLIBERCEPT ZALTRAP (Sanofi Aventis) CÁNCER DE COLON Según la International Agency for Research on Cancer, en 2008 había más de 450.000 personas con cáncer colorrectal en Europa, con una tasa estandarizada
AFLIBERCEPT ZALTRAP (Sanofi Aventis) CÁNCER DE COLON Según la International Agency for Research on Cancer, en 2008 había más de 450.000 personas con cáncer colorrectal en Europa, con una tasa estandarizada
: Cáncer renal avanzado o metastásico
 EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
De qué sistemas se dispone para evaluar el riesgo vascular? A qué población y con qué frecuencia se le debe evaluar el riesgo vascular?
 4. Riesgo vascular Preguntas para responder: De qué sistemas se dispone para evaluar el riesgo vascular? A qué población y con qué frecuencia se le debe evaluar el riesgo vascular? 4.1. Importancia del
4. Riesgo vascular Preguntas para responder: De qué sistemas se dispone para evaluar el riesgo vascular? A qué población y con qué frecuencia se le debe evaluar el riesgo vascular? 4.1. Importancia del
TECNOLOGÍA EN SALUD DE INTERÉS. Oxcarbazepina, lacosamida, vigabatrina, topiramato o levetiracetam. 1. RESUMEN
 TECNOLOGÍA EN SALUD DE INTERÉS Oxcarbazepina, lacosamida, vigabatrina, topiramato y levetiracetam 1. RESUMEN Título del reporte: Efectividad y seguridad de oxcarbazepina, lacosamida, vigabatrina, topiramato
TECNOLOGÍA EN SALUD DE INTERÉS Oxcarbazepina, lacosamida, vigabatrina, topiramato y levetiracetam 1. RESUMEN Título del reporte: Efectividad y seguridad de oxcarbazepina, lacosamida, vigabatrina, topiramato
TRATAMIENTO FARMACOLÓGICO DE LA FPI. Julio Ancochea
 TRATAMIENTO FARMACOLÓGICO DE LA FPI Julio Ancochea GUÍAS 2000 Era de la inmunosupresión y opiniones de expertos 2011 Era de los ensayos clínicos aleatorizados y de la metodología perfeccionada: ningún
TRATAMIENTO FARMACOLÓGICO DE LA FPI Julio Ancochea GUÍAS 2000 Era de la inmunosupresión y opiniones de expertos 2011 Era de los ensayos clínicos aleatorizados y de la metodología perfeccionada: ningún
CEFUROXIMA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO CEFUROXIMA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Cefuroxima STADA EFG se ha realizado siguiendo las Directrices que la Unión Europea recomienda para
OBJETIVO CEFUROXIMA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Cefuroxima STADA EFG se ha realizado siguiendo las Directrices que la Unión Europea recomienda para
TRATAMIENTO DE LA ARTRITIS REUMATOIDE. CUAL ES EL DEBATE?
 TRATAMIENTO DE LA ARTRITIS REUMATOIDE. CUAL ES EL DEBATE? LUIS ALBERTO RAMÍREZ GÓMEZ INTERNISTA REUMATÓLOGO REUMATOLOGYA S.A. CLÍNICA LAS VEGAS MEDELLÍN ENTREMOS EN MATERIA!!! Evolución dramática del tratamiento
TRATAMIENTO DE LA ARTRITIS REUMATOIDE. CUAL ES EL DEBATE? LUIS ALBERTO RAMÍREZ GÓMEZ INTERNISTA REUMATÓLOGO REUMATOLOGYA S.A. CLÍNICA LAS VEGAS MEDELLÍN ENTREMOS EN MATERIA!!! Evolución dramática del tratamiento
Documento de Consenso sobre el Uso de Nuevos Fármacos en el Tratamiento del Cáncer. Colorrectal Metastásico.
 Documento de Consenso sobre el Uso de Nuevos Fármacos en el Tratamiento del Cáncer Colorrectal Metastásico. Grupo de Trabajo de Medicamentos Oncológicos Comisión Regional de Farmacia y Terapéutica Consejería
Documento de Consenso sobre el Uso de Nuevos Fármacos en el Tratamiento del Cáncer Colorrectal Metastásico. Grupo de Trabajo de Medicamentos Oncológicos Comisión Regional de Farmacia y Terapéutica Consejería
Análisis del coste de la terapia biológica del cáncer colorrectal metastásico con panitumumab y cetuximab
 ARTÍCULO DE INVESTIGACIÓN ORIGINAL PharmacoEconomics - Spanish Research Articles 6 (2): 55-65, 2009 2009 Adis Data Information BV. All rights reserved. Análisis del coste de la terapia biológica del cáncer
ARTÍCULO DE INVESTIGACIÓN ORIGINAL PharmacoEconomics - Spanish Research Articles 6 (2): 55-65, 2009 2009 Adis Data Information BV. All rights reserved. Análisis del coste de la terapia biológica del cáncer
Lourdes Betegon 1 ; Cristina Canal 1 ; Marina De Salas-Cansado 2
 Análisis de Costes No Farmacológicos y Eventos Evitados en el Tratamiento de la Fibrilación Auricular en España: Apixaban Frente a Otros Fármacos Anticoagulantes Lourdes Betegon 1 ; Cristina Canal 1 ;
Análisis de Costes No Farmacológicos y Eventos Evitados en el Tratamiento de la Fibrilación Auricular en España: Apixaban Frente a Otros Fármacos Anticoagulantes Lourdes Betegon 1 ; Cristina Canal 1 ;
SARCOMA DE EWING Y TUMOR NEUROECTODERMICO PRIMITIVO.
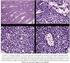 SARCOMA DE EWING Y TUMOR NEUROECTODERMICO PRIMITIVO. Una vez que el paciente ha sido diagnosticado por biopsia como Tumor Neuroectodermico Primitivo o Sarcoma de Ewing, se realizarán los siguientes estudios:
SARCOMA DE EWING Y TUMOR NEUROECTODERMICO PRIMITIVO. Una vez que el paciente ha sido diagnosticado por biopsia como Tumor Neuroectodermico Primitivo o Sarcoma de Ewing, se realizarán los siguientes estudios:
Tratamiento inmunoterápico de las metástasis cerebrales. Alfonso Berrocal Hospital General de Valencia
 Tratamiento inmunoterápico de las metástasis cerebrales Alfonso Berrocal Hospital General de Valencia Inmunidad y metástasis cerebrales Cancer 2013;119:2737-46. Ipilimumab y metástasis SNC Ipilimumab bloquea
Tratamiento inmunoterápico de las metástasis cerebrales Alfonso Berrocal Hospital General de Valencia Inmunidad y metástasis cerebrales Cancer 2013;119:2737-46. Ipilimumab y metástasis SNC Ipilimumab bloquea
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Erbitux 5 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución para
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Erbitux 5 mg/ml solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución para
INSTRUCTIVO REGISTRO PARA LAS ATENCIONES DE QUIMIOTERAPIA
 1. OBJETIVO: Establecer una orientación clara y precisa que permita oficializar el sistema de registro de los tratamientos de quimioterapia en adultos del Hospital Regional de Arica Dr. Juan Noé Crevani,
1. OBJETIVO: Establecer una orientación clara y precisa que permita oficializar el sistema de registro de los tratamientos de quimioterapia en adultos del Hospital Regional de Arica Dr. Juan Noé Crevani,
Los datos de Roche mostraban que los pacientes con cáncer colorrectal metastásico vivían más tiempo si continuaban con Avastin y quimioterapia
 Comunicado de prensa Basilea, 3 de junio de 2012 Los datos de Roche mostraban que los pacientes con cáncer colorrectal metastásico vivían más tiempo si continuaban con Avastin y quimioterapia Primer estudio
Comunicado de prensa Basilea, 3 de junio de 2012 Los datos de Roche mostraban que los pacientes con cáncer colorrectal metastásico vivían más tiempo si continuaban con Avastin y quimioterapia Primer estudio
Avastin se utiliza para el tratamiento de adultos con los siguientes tipos de cáncer en combinación con otros medicamentos contra el cáncer:
 EMA/175824/2015 EMEA/H/C/000582 Resumen del EPAR para el público general bevacizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de
EMA/175824/2015 EMEA/H/C/000582 Resumen del EPAR para el público general bevacizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de
ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN
 Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA. Sandra Flores Moreno. AETSA 21 de Diciembre de 2006
 VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA Sandra Flores Moreno. AETSA 21 de Diciembre de 2006 VARIANTES EN EL DISEÑO DE ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA *INTRODUCCIÓN
VARIANTES EN EL DISEÑO DE LOS ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA Sandra Flores Moreno. AETSA 21 de Diciembre de 2006 VARIANTES EN EL DISEÑO DE ENSAYOS CLÍNICOS CON ASIGNACIÓN ALEATORIA *INTRODUCCIÓN
ANALISIS COMPARATIVO DE ERRORES DE MEDICACION CON PRESCRIPCION ELECTRONICA Y MANUAL EN HEMATOLOGIA
 ANALISIS COMPARATIVO DE ERRORES DE MEDICACION CON PRESCRIPCION ELECTRONICA Y MANUAL EN HEMATOLOGIA Servicio de Farmacia OBJETIVOS Implantación del sistema de prescripción electrónica de la quimioterapia
ANALISIS COMPARATIVO DE ERRORES DE MEDICACION CON PRESCRIPCION ELECTRONICA Y MANUAL EN HEMATOLOGIA Servicio de Farmacia OBJETIVOS Implantación del sistema de prescripción electrónica de la quimioterapia
LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ
 LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ 13.12.2013 VARÓN, 62 AÑOS. Fumador 30 cigarrillos/día desde hace 40 años Asintomático PRUEBA DE
LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ 13.12.2013 VARÓN, 62 AÑOS. Fumador 30 cigarrillos/día desde hace 40 años Asintomático PRUEBA DE
de ensayos clínicos , Cabello Ibacache R RESUMEN
 de ensayos clínicos, Cabello Ibacache R RESUMEN caries. Las inconsistencias encontradas podrían deberse a la presencia de sesgos o a la heterogeneidad de los estudios disponibles en la literatura. Rev.
de ensayos clínicos, Cabello Ibacache R RESUMEN caries. Las inconsistencias encontradas podrían deberse a la presencia de sesgos o a la heterogeneidad de los estudios disponibles en la literatura. Rev.
Protocolo de Prevención de Error de Medicación en HRR
 Protocolo de Prevención de Error Elaborado por: Revisado por: Aprobado por: E.U. Teresa Carrasco Forné E.U. Verónica Torres Colivoro E.U. C. Gloria Díaz Zúñiga EU. Magdalena Moreno Subdirección de Enfermería
Protocolo de Prevención de Error Elaborado por: Revisado por: Aprobado por: E.U. Teresa Carrasco Forné E.U. Verónica Torres Colivoro E.U. C. Gloria Díaz Zúñiga EU. Magdalena Moreno Subdirección de Enfermería
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Resultados relevantes obtenidos con Escozul para Cáncer Maxilar
 Documento elaborado por: Grupo Resultados relevantes obtenidos con Escozul para Cáncer Maxilar Paciente: Maria del Carmen Diagnóstico: CA Maxilar con metástasis Está Está prohibida la la reproducción de
Documento elaborado por: Grupo Resultados relevantes obtenidos con Escozul para Cáncer Maxilar Paciente: Maria del Carmen Diagnóstico: CA Maxilar con metástasis Está Está prohibida la la reproducción de
PROSPECTO INFORMACIÓN PARA PROFESIONALES (Adaptado a la Disposición ANMAT N 5904/96)
 PROSPECTO INFORMACIÓN PARA PROFESIONALES (Adaptado a la Disposición ANMAT N 5904/96) Avastin Bevacizumab Roche Concentrado para solución para infusión Industria Suiza Expendio bajo receta archivada Composición
PROSPECTO INFORMACIÓN PARA PROFESIONALES (Adaptado a la Disposición ANMAT N 5904/96) Avastin Bevacizumab Roche Concentrado para solución para infusión Industria Suiza Expendio bajo receta archivada Composición
TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL
 TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL Título del reporte: efectividad y seguridad de lapatinib (terapia anti-her2) en cáncer de mama HER2 positivo Autores: grupo desarrollador
TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL Título del reporte: efectividad y seguridad de lapatinib (terapia anti-her2) en cáncer de mama HER2 positivo Autores: grupo desarrollador
RESULTADOS PRELIMINARES
 ESTUDIO DE LA EFICACIA DE LICOTRIZ COMO CREMA REGENERATIVA Y REGENERADORA EN EL TRATAMIENTO DE CICATRICES POSTQUIRÚRGICAS EN PACIENTES SOMETIDAS A RADIOTERAPIA POR CÁNCERES GINECOLÓGICOS. INTRODUCCIÓN
ESTUDIO DE LA EFICACIA DE LICOTRIZ COMO CREMA REGENERATIVA Y REGENERADORA EN EL TRATAMIENTO DE CICATRICES POSTQUIRÚRGICAS EN PACIENTES SOMETIDAS A RADIOTERAPIA POR CÁNCERES GINECOLÓGICOS. INTRODUCCIÓN
EVALUACIÓN DEL TIEMPO DE MUESTREO DE LAS CONCENTRACIONES PLASMÁTICAS DE 2 FARMACOS ANTICONVULSIVANTES EN PACIENTES DE UN HOSPITAL PEDIATRICO.
 EVALUACIÓN DEL TIEMPO DE MUESTREO DE LAS CONCENTRACIONES PLASMÁTICAS DE 2 FARMACOS ANTICONVULSIVANTES EN PACIENTES DE UN HOSPITAL PEDIATRICO. Márquez Cruz Maribel 1, Robles Piedras Ana Luisa 1, Ruiz Anaya
EVALUACIÓN DEL TIEMPO DE MUESTREO DE LAS CONCENTRACIONES PLASMÁTICAS DE 2 FARMACOS ANTICONVULSIVANTES EN PACIENTES DE UN HOSPITAL PEDIATRICO. Márquez Cruz Maribel 1, Robles Piedras Ana Luisa 1, Ruiz Anaya
Dr Alejandro Acevedo Gaete Oncólogo Médico Hospital Carlos Van Buren
 Dr Alejandro Acevedo Gaete Oncólogo Médico Hospital Carlos Van Buren Introduccion Perspectiva histórica Principios de Biologia molecular del cáncer colorectal Conceptos de biomarcadores Evidencia clínica
Dr Alejandro Acevedo Gaete Oncólogo Médico Hospital Carlos Van Buren Introduccion Perspectiva histórica Principios de Biologia molecular del cáncer colorectal Conceptos de biomarcadores Evidencia clínica
Control del sangrado. Artículo: Hemorragia por Warfarina (Cortesía de IntraMed.com)
 Control del sangrado En este gran estudio de cohorte de pacientes mayores con fibrilación auricular se halló que las tasas de hemorragia por tratamiento con warfarina son más elevadas durante los primeros
Control del sangrado En este gran estudio de cohorte de pacientes mayores con fibrilación auricular se halló que las tasas de hemorragia por tratamiento con warfarina son más elevadas durante los primeros
Biomarcadores. Oncología. CCR. k-ras, Biomarcador decisivo, imprescindible y disponible.
 30 Biomarcadores. Oncología. CCR. k-ras, Biomarcador decisivo, imprescindible y disponible. 10 min. De esta forma el biomarcador K-ras Step 3: ARMS: Selectively amplifies target es un marcador decisivo
30 Biomarcadores. Oncología. CCR. k-ras, Biomarcador decisivo, imprescindible y disponible. 10 min. De esta forma el biomarcador K-ras Step 3: ARMS: Selectively amplifies target es un marcador decisivo
ESTATINAS EN PERSONAS MAYORES
 ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
DOCUMENTO DE AYUDA PARA ELABORACIÓN DE RESÚMENES
 DOCUMENTO DE AYUDA PARA ELABORACIÓN DE RESÚMENES Los trabajos se podrán presentar bajo seis modalidades: 1. PROYECTOS DE INVESTIGACIÓN (cualitativa o cuantitativa) 2. REVISIONES BIBLIOGRAFICAS, DOCUMENTALES
DOCUMENTO DE AYUDA PARA ELABORACIÓN DE RESÚMENES Los trabajos se podrán presentar bajo seis modalidades: 1. PROYECTOS DE INVESTIGACIÓN (cualitativa o cuantitativa) 2. REVISIONES BIBLIOGRAFICAS, DOCUMENTALES
Proyecto CENIT. III Conferencia Anual de las Plataformas Tecnológicas de Investigación Biomédica
 Proyecto CENIT III Conferencia Anual de las Plataformas Tecnológicas de Investigación Biomédica Miguel Aracil (Coordinador científico del Consorcio ONCOLOGICA) Barcelona, 23-24 Febrero 2010 Consorcio ONCOLOGICA
Proyecto CENIT III Conferencia Anual de las Plataformas Tecnológicas de Investigación Biomédica Miguel Aracil (Coordinador científico del Consorcio ONCOLOGICA) Barcelona, 23-24 Febrero 2010 Consorcio ONCOLOGICA
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Informe de Posicionamiento Terapéutico de regorafenib (Stivarga ) en cáncer colorrectal
 INFORME DE POSICIONAMIENTO TERAPÉUTICO PT/V1/04032015 Informe de Posicionamiento Terapéutico de regorafenib (Stivarga ) en cáncer colorrectal Fecha de publicación: 4 de marzo de 2015 El cáncer colorrectal
INFORME DE POSICIONAMIENTO TERAPÉUTICO PT/V1/04032015 Informe de Posicionamiento Terapéutico de regorafenib (Stivarga ) en cáncer colorrectal Fecha de publicación: 4 de marzo de 2015 El cáncer colorrectal
LA EVALUACIÓN DEL PSA EN EL DIAGNÓSTICO DEL CÁNCER DE PRÓSTATA
 LA EVALUACIÓN DEL PSA EN EL DIAGNÓSTICO DEL CÁNCER DE PRÓSTATA Diana Predescu Isabel Martínez Sáez Centro de Salud de Onda I Unitad Docente MFYC Castellon INTRODUCCIÒN El CaP en España y Europa es el tercer
LA EVALUACIÓN DEL PSA EN EL DIAGNÓSTICO DEL CÁNCER DE PRÓSTATA Diana Predescu Isabel Martínez Sáez Centro de Salud de Onda I Unitad Docente MFYC Castellon INTRODUCCIÒN El CaP en España y Europa es el tercer
S OCIEDAD VERSIÓN PARA IMPRIMIR
 Médicos de Barcelona descubren una mutación que fortalece e... http://www.eldia.es/2012-01-23/sociedad/sociedad2prn.htm S OCIEDAD VERSIÓN PARA IMPRIMIR LUNES, 23 DE ENERO DE 2012 Médicos de Barcelona descubren
Médicos de Barcelona descubren una mutación que fortalece e... http://www.eldia.es/2012-01-23/sociedad/sociedad2prn.htm S OCIEDAD VERSIÓN PARA IMPRIMIR LUNES, 23 DE ENERO DE 2012 Médicos de Barcelona descubren
Preguntas para responder
 Preguntas para responder TRATAMIENTO DE LA EPOC EN FASE ESTABLE 1. Existe evidencia para aconsejar un tipo concreto de broncodilatador de acción mantenida en monoterapia cuando se inicia el tratamiento
Preguntas para responder TRATAMIENTO DE LA EPOC EN FASE ESTABLE 1. Existe evidencia para aconsejar un tipo concreto de broncodilatador de acción mantenida en monoterapia cuando se inicia el tratamiento
ARTÍCULO DE REVISIÓN. supplementation in developmental neurological disorders. Antonio Calderón-Moore RESUMEN ABSTRACT. Introducción. Métodos.
 ARTÍCULO DE REVISIÓN supplementation in developmental neurological disorders Antonio Calderón-Moore RESUMEN Introducción. Métodos. Resultados. Conclusiones. Palabras clave: ABSTRACT Background. for the
ARTÍCULO DE REVISIÓN supplementation in developmental neurological disorders Antonio Calderón-Moore RESUMEN Introducción. Métodos. Resultados. Conclusiones. Palabras clave: ABSTRACT Background. for the
EFECTIVIDAD Y EFICACIA DEL TRASPLANTE DE PROGENITORES HEMATOPOYÉTICOS NO EMPARENTADO PARA EL TRATAMIENTO DE ANEMIA DE FANCONI.
 INSTITUTO NACIONAL DE SALUD EFECTIVIDAD Y EFICACIA DEL TRASPLANTE DE PROGENITORES HEMATOPOYÉTICOS NO EMPARENTADO PARA EL TRATAMIENTO DE ANEMIA DE FANCONI. NOTA TÉCNICA N 16 Unidad de Análisis y Generación
INSTITUTO NACIONAL DE SALUD EFECTIVIDAD Y EFICACIA DEL TRASPLANTE DE PROGENITORES HEMATOPOYÉTICOS NO EMPARENTADO PARA EL TRATAMIENTO DE ANEMIA DE FANCONI. NOTA TÉCNICA N 16 Unidad de Análisis y Generación
Ensayos con células de la sangre del cordón umbilical (SCU) autólogas en Duke
 Ensayos con células de la sangre del cordón umbilical (SCU) autólogas en Duke Seguridad SCU críopreservada, 184 pacientes Sun y otros, Transfusión, 2010. Estudio EHI Babybac Fresco, VR, RR, SCU Cotten
Ensayos con células de la sangre del cordón umbilical (SCU) autólogas en Duke Seguridad SCU críopreservada, 184 pacientes Sun y otros, Transfusión, 2010. Estudio EHI Babybac Fresco, VR, RR, SCU Cotten
Tratamiento del cáncer de cérvix Amalia Gómez Bernal Complejo Asistencial Universitario de Salamanca
 Tratamiento del cáncer de cérvix 2016 Amalia Gómez Bernal Complejo Asistencial Universitario de Salamanca Datos estadísticos INCIDENCIA Es el 3º tumor más frecuente en las mujeres en el mundo y el 7º del
Tratamiento del cáncer de cérvix 2016 Amalia Gómez Bernal Complejo Asistencial Universitario de Salamanca Datos estadísticos INCIDENCIA Es el 3º tumor más frecuente en las mujeres en el mundo y el 7º del
GUÍA FORMATIVA de RESIDENTES Servicio de Farmacología Clínica Hospital Universitario La Princesa
 GUÍA FORMATIVA de RESIDENTES Servicio de Farmacología Clínica Hospital Universitario La Princesa 1. BOE con el programa oficial de la especialidad: BOE con el vigente Programa Oficial de la Especialidad
GUÍA FORMATIVA de RESIDENTES Servicio de Farmacología Clínica Hospital Universitario La Princesa 1. BOE con el programa oficial de la especialidad: BOE con el vigente Programa Oficial de la Especialidad
REUNION BIBLIOGRAFICA CLINICA UNIVERSITARIA REINA FABIOLA
 REUNION BIBLIOGRAFICA CLINICA UNIVERSITARIA REINA FABIOLA INTRODUCCION La respuesta al tratamiento sistémico en el cáncer de mama temprano puede ser controlada si el tratamiento se administra previo a
REUNION BIBLIOGRAFICA CLINICA UNIVERSITARIA REINA FABIOLA INTRODUCCION La respuesta al tratamiento sistémico en el cáncer de mama temprano puede ser controlada si el tratamiento se administra previo a
personalizado del cáncer de pulmón y la importancia de las determinaciones moleculares para oncovida
 Tratamiento personalizado del cáncer de pulmón y la importancia de las determinaciones moleculares para optimizar el tratamiento 22 oncovida C o l e c c i ó n 1 Qué es el cáncer de pulmón y cuales son
Tratamiento personalizado del cáncer de pulmón y la importancia de las determinaciones moleculares para optimizar el tratamiento 22 oncovida C o l e c c i ó n 1 Qué es el cáncer de pulmón y cuales son
EXTRAVASACIÓN, ASPECTOS ASOCIADOS Y PREVENCIÓN
 Introducción: La extravasación de la medicación intravenosa es un hecho que por sí mismo está ligado a lo catastrófico en el ámbito de la administración de quimioterapia; el hecho de la misma extravasación
Introducción: La extravasación de la medicación intravenosa es un hecho que por sí mismo está ligado a lo catastrófico en el ámbito de la administración de quimioterapia; el hecho de la misma extravasación
Impacto de los nuevos tratamientos. Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena
 Impacto de los nuevos tratamientos Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena Indicaciones. Ipilimumab (Yervoy): EMA: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos
Impacto de los nuevos tratamientos Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena Indicaciones. Ipilimumab (Yervoy): EMA: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos
LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008
 LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco:
LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco:
Los Ensayos Clínicos (EC) son estudios epidemiológicos caracterizados por ser:
 (678',26(3,'(0,2/Ï*,&26(;3(5,0(17$/(6 Contenido: 1. Ensayos Clínicos Características Diseño de estudio de cohortes y ensayos clínicos Selección de la muestra de estudio Grupos de estudio. Aleatorización.
(678',26(3,'(0,2/Ï*,&26(;3(5,0(17$/(6 Contenido: 1. Ensayos Clínicos Características Diseño de estudio de cohortes y ensayos clínicos Selección de la muestra de estudio Grupos de estudio. Aleatorización.
* NOTA: Real Decreto desarrollado por la Orden de 6 de abril de (BOE núm. 43, de 19 febrero de 1993)
 Real Decreto 83/1993, de 22 de enero, por el que se regula la selección de los medicamentos a efectos de su financiación por el Sistema Nacional de Salud. * NOTA: Real Decreto desarrollado por la Orden
Real Decreto 83/1993, de 22 de enero, por el que se regula la selección de los medicamentos a efectos de su financiación por el Sistema Nacional de Salud. * NOTA: Real Decreto desarrollado por la Orden
Grupo de estudio internacional del cáncer de mama (IBCSG) 23-01
 Grupo de estudio internacional del cáncer de mama (IBCSG) 23-01 Disección axilar vs. no disección axilar en cáncer de mama con axila clínicamente negativa y micrometástasis en ganglio centinela Viviana
Grupo de estudio internacional del cáncer de mama (IBCSG) 23-01 Disección axilar vs. no disección axilar en cáncer de mama con axila clínicamente negativa y micrometástasis en ganglio centinela Viviana
SEMINARIOS DE INNOVACIÓN EN ATENCIÓN PRIMARIA 2009
 SEMINARIOS DE INNOVACIÓN EN ATENCIÓN PRIMARIA 2009 Innovación en la toma de decisiones diagnósticas en la consulta médica de primaria: desde el punto de vista de la epidemiología Blanca Lumbreras Lacarra
SEMINARIOS DE INNOVACIÓN EN ATENCIÓN PRIMARIA 2009 Innovación en la toma de decisiones diagnósticas en la consulta médica de primaria: desde el punto de vista de la epidemiología Blanca Lumbreras Lacarra
Descripción CLASES MAGISTRALES, TALLERES PRÁCTICOS DE CITOLOGÍA Y PRESENTACIÓN DE CASOS CLÍNICOS
 CURSO DE POSGRADO EN ONCOLOGÍA VETERINARIA De lo molecular a lo clínico Facultad de Ciencias Agropecuarias Universidad Católica de Córdoba Cupo MÍNIMO 10, MÁXIMO 30 ALUMNOS Descripción CLASES MAGISTRALES,
CURSO DE POSGRADO EN ONCOLOGÍA VETERINARIA De lo molecular a lo clínico Facultad de Ciencias Agropecuarias Universidad Católica de Córdoba Cupo MÍNIMO 10, MÁXIMO 30 ALUMNOS Descripción CLASES MAGISTRALES,
Anexo IV. Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
Anexo IV Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización 267 Conclusiones científicas El CHMP estudió la siguiente recomendación del
Erbitux prolonga significativamente la supervivencia como tratamiento en primera línea del cáncer no microcítico de pulmón avanzado
 Nota de prensa Contacto Pilar Caro Telf. +34 917454429; 647 533 909 pilar.caro@merck.es Erbitux prolonga significativamente la supervivencia como tratamiento en primera línea del cáncer no microcítico
Nota de prensa Contacto Pilar Caro Telf. +34 917454429; 647 533 909 pilar.caro@merck.es Erbitux prolonga significativamente la supervivencia como tratamiento en primera línea del cáncer no microcítico
Revisión sistemática sobre la eficacia de los diferentes tratamientos preventivos de migraña
 Revisión sistemática sobre la eficacia de los diferentes tratamientos preventivos de migraña Benito León J, Morales González JM, Collar JM. Tratamiento farmacológico preventivo de la migraña Med Clin (Barc)
Revisión sistemática sobre la eficacia de los diferentes tratamientos preventivos de migraña Benito León J, Morales González JM, Collar JM. Tratamiento farmacológico preventivo de la migraña Med Clin (Barc)
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS
 INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
5. Cáncer de próstata en progresión bioquímica
 5. Cáncer de próstata en progresión bioquímica 5.1. efinición de progresión bioquímica Pregunta para responder: En pacientes con cáncer de próstata sometidos a prostatectomía o radioterapia con intención
5. Cáncer de próstata en progresión bioquímica 5.1. efinición de progresión bioquímica Pregunta para responder: En pacientes con cáncer de próstata sometidos a prostatectomía o radioterapia con intención
Fitoestrógenos, nuevos datos, ofreciendo soluciones. Dra. Marisa Andrea David, Febrero 2013
 Fitoestrógenos, nuevos datos, ofreciendo soluciones Dra. Marisa Andrea David, Febrero 2013 Índice Síntomas de la menopausia y su tratamiento Evidencias científicas de las isoflavonas de soja Eficacia Seguridad
Fitoestrógenos, nuevos datos, ofreciendo soluciones Dra. Marisa Andrea David, Febrero 2013 Índice Síntomas de la menopausia y su tratamiento Evidencias científicas de las isoflavonas de soja Eficacia Seguridad
Cáncer colorrectal metastático cómo decidir la mejor secuencia de tratamiento? Cristina Grávalos Hospital Universitario Marqués de Valdecilla
 Cáncer colorrectal metastático cómo decidir la mejor secuencia de tratamiento? Cristina Grávalos Hospital Universitario Marqués de Valdecilla Introducción - Cáncer colorrectal en España en el año 2012
Cáncer colorrectal metastático cómo decidir la mejor secuencia de tratamiento? Cristina Grávalos Hospital Universitario Marqués de Valdecilla Introducción - Cáncer colorrectal en España en el año 2012
Incidencia episodios severos de hipoglucemia en pacientes con diabetes tipo 2 en el País Vasco: impacto en el coste sanitario
 Incidencia episodios severos de hipoglucemia en pacientes con diabetes tipo 2 en el País Vasco: impacto en el coste sanitario Edurne Alonso-Morán. Juan F. Orueta y Roberto Nuño-Solinis Introducción En
Incidencia episodios severos de hipoglucemia en pacientes con diabetes tipo 2 en el País Vasco: impacto en el coste sanitario Edurne Alonso-Morán. Juan F. Orueta y Roberto Nuño-Solinis Introducción En
Melasma. Andrea Albuja, Nicolás Almeida, Danilo Noboa UIDE
 Melasma Andrea Albuja, Nicolás Almeida, Danilo Noboa UIDE Es la terapia triple la mejor opción de tratamiento en pacientes con melasma? Primer articulo 2003 Criterios Inclusion: muestra de 641 pacientes
Melasma Andrea Albuja, Nicolás Almeida, Danilo Noboa UIDE Es la terapia triple la mejor opción de tratamiento en pacientes con melasma? Primer articulo 2003 Criterios Inclusion: muestra de 641 pacientes
R E S P Y N Revista Salud Pública y Nutrición
 R E S P Y N Revista Salud Pública y Nutrición Información para Autores Contenido La Revista Salud Pública y Nutrición, aborda las áreas de salud pública, nutrición, alimentos, así como, formación de recursos
R E S P Y N Revista Salud Pública y Nutrición Información para Autores Contenido La Revista Salud Pública y Nutrición, aborda las áreas de salud pública, nutrición, alimentos, así como, formación de recursos
CETUXIMAB PARA EL TRATAMIENTO DEL CÁNCER COLORRECTAL METASTÁSICO IP-11-012-004
 CETUXIMAB PARA EL TRATAMIENTO DEL CÁNCER COLORRECTAL METASTÁSICO IP-11-012-004 FEBRERO 2012 La siguiente evaluación se elaboró a solicitud de la Dirección General de la Salud, con el fin de decidir la
CETUXIMAB PARA EL TRATAMIENTO DEL CÁNCER COLORRECTAL METASTÁSICO IP-11-012-004 FEBRERO 2012 La siguiente evaluación se elaboró a solicitud de la Dirección General de la Salud, con el fin de decidir la
GOBIERNO de CANTABRIA
 CRITERIOS DE ACTUACIÓN PARA LA PREVENCIÓN, DIAGNÓSTICO Y TRATAMIENTO DE LA PATOLOGÍA MAMARIA. PETICIÓN DE MAMOGRAFÍAS EN MUJERES ASINTOMÁTICAS 1. Mujeres sin factores riesgo Mujeres comprendidas entre
CRITERIOS DE ACTUACIÓN PARA LA PREVENCIÓN, DIAGNÓSTICO Y TRATAMIENTO DE LA PATOLOGÍA MAMARIA. PETICIÓN DE MAMOGRAFÍAS EN MUJERES ASINTOMÁTICAS 1. Mujeres sin factores riesgo Mujeres comprendidas entre
Preguntas y respuestas sobre las vacunas contra el dengue: eficacia y seguridad a largo plazo de la vacuna CYD-TDV
 Preguntas y respuestas sobre las vacunas contra el dengue: eficacia y seguridad a largo plazo de la vacuna CYD-TDV Julio de 2015 Cuál es la situación actual respecto del desarrollo de vacunas contra el
Preguntas y respuestas sobre las vacunas contra el dengue: eficacia y seguridad a largo plazo de la vacuna CYD-TDV Julio de 2015 Cuál es la situación actual respecto del desarrollo de vacunas contra el
Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar?
 Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar? Salvador Blanch Tormo Servicio de Oncología Médica FUNDACIÓN INSTITUTO VALENCIANO DE ONCOLOGIA 11 de Junio de 2015 Sabes
Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar? Salvador Blanch Tormo Servicio de Oncología Médica FUNDACIÓN INSTITUTO VALENCIANO DE ONCOLOGIA 11 de Junio de 2015 Sabes
CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE
 CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE Introducción La administración de medicamento es uno de los procedimientos que exige
CUIDADOS DE ENFERMERIA EN LA ADMINISTRACIÓN DE MEDICAMENTOS LIC. ELIZABETH VALERIO SOLARI CLINICA MAISON DE SANTE ESTE Introducción La administración de medicamento es uno de los procedimientos que exige
