SU CUERPO FUE HECHO PARA COSAS MEJORES QUE LA AR.
|
|
|
- Miguel Navarro Velázquez
- hace 6 años
- Vistas:
Transcripción
1 XELJANZ se utiliza para tratar adultos con artritis reumatoide activa de moderada a severa, para los cuales el metotrexato no funcionó bien. SU CUERPO FUE HECHO PARA COSAS MEJORES QUE LA AR. Se le exhorta a informar los efectos secundarios negativos de los medicamentos con receta a la FDA. Visite o llame al FDA Necesita ayuda para pagar por su medicamento? XELSOURCE SM pudiera ayudar, sin importar su condición de seguro. Conozca cómo en La información de salud incluida aquí es provista para propósitos educativos solamente y su propósito no es reemplazar una conversación con un profesional del cuidado de la salud. Todas las decisiones relacionadas con el cuidado del paciente tienen que ser tomadas con un profesional del cuidado de la salud, tomando en consideración las características singulares del paciente. Los productos que se discuten aquí pueden tener una rotulación distinta en los diferentes países. Copyright 2013 Pfizer Inc. Derechos reservados. Pfizer, PO Box 2938, Mission, KS TRA Impreso en EE.UU./Octubre 2013 INFORMACIÓN IMPORTANTE DE SEGURIDAD XELJANZ puede reducir la capacidad de su sistema inmunológico para combatir infecciones. Algunas personas tienen infecciones graves mientras toman XELJANZ, incluida la tuberculosis (TB) e infecciones causadas por bacterias, hongos o virus, que pueden extenderse por todo el cuerpo. Algunas personas han fallecido por causa de dichas infecciones. XELJANZ puede aumentar el riesgo de ciertos tipos de cáncer. Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás.
2 XELJANZ (tofacitinib) es un medicamento con receta llamado inhibidor de cinasa de Janus (JAK, por sus siglas en inglés). XELJANZ se utiliza para tratar adultos con artritis reumatoide activa de moderada a severa, para los cuales el metotrexato no funcionó bien. Se desconoce si XELJANZ es seguro y eficaz en personas con hepatitis B o C. XELJANZ no es para personas con problemas hepáticos severos. Se desconoce si XELJANZ es seguro y eficaz en niños. PREGUNTE SOBRE XELJANZ. UN TRATAMIENTO ORAL PARA LA AR. Las manos fueron hechas para tomarlas. Los brazos se hicieron para abrazar. Su cuerpo fue hecho para cosas mejores que los dolorosos síntomas de la artritis reumatoide (AR). Si le interesa otra forma de tratar la AR, de moderada a severa, conozca más sobre XELJANZ. El primero en una nueva clase de tratamientos para la AR. XELJANZ (se pronuncia sel-yans) es el primero en una nueva clase de tratamientos para la AR de moderada a severa. Llamado un inhibidor asociado a la cinasa de Janus (JAK), XELJANZ trabaja profundo dentro de las células. XELJANZ puede reducir los síntomas comunes de la AR como el dolor, la hinchazón y la rigidez de las articulaciones. INFORMACIÓN IMPORTANTE DE SEGURIDAD Infecciones graves. XELJANZ puede disminuir la capacidad de su sistema inmunológico para combatir infecciones. Algunas personas tienen infecciones graves mientras toman XELJANZ, incluida la tuberculosis (TB) e infecciones causadas por bacterias, hongos o virus que pueden extenderse por todo el cuerpo. Algunas personas han fallecido por causa de dichas infecciones. Su profesional del cuidado de la salud debe hacerle una prueba de TB antes de comenzar a tomar XELJANZ y monitorearlo para ver si existen indicios y síntomas de una infección de TB durante el tratamiento. Una pequeña píldora. Dos veces al día. XELJANZ, un medicamento oral disponible con receta, es una pequeña píldora para tomar dos veces al día. Cáncer y problemas del sistema inmunológico. XELJANZ puede aumentar el riesgo de ciertos tipos de cáncer, cambiando la forma en que funciona su sistema inmunológico. Pueden producirse linfomas y otros tipos de cáncer en pacientes que toman XELJANZ. Informe a su profesional del cuidado de la salud si ha tenido algún tipo de cáncer. Algunas personas que han tomado XELJANZ con otros medicamentos específicos para prevenir el rechazo del trasplante de riñón, han tenido problemas con ciertos glóbulos blancos que se descontrolaban (trastorno linfoproliferativo asociado con el virus de Epstein Barr). Conozca más en info.xeljanz.com 2 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 3
3 DATOS RÁPIDOS SOBRE XELJANZ. XELJANZ es el primero en una nueva clase de tratamientos para la AR, de moderada a severa, llamados inhibidores asociados a la cinasa de Janus (JAK). Trabajan profundo dentro de las células para interrumpir la inflamación asociada con la AR. Disponible con receta, XELJANZ es una pequeña píldora que se toma por vía oral dos veces al día. En estudios clínicos, algunos pacientes que tomaron XELJANZ experimentaron reducción en el dolor y la hinchazón de las articulaciones en un periodo de 2 semanas. Para otros, tomó tanto como 3-6 meses. Todas las personas son diferentes, así que sus resultados pueden variar. XELJANZ puede tomarse sin metotrexato. A la tapa fácil de abrir del frasco de XELJANZ se le otorgó el Ease-of-Use Commendation* de la Arthritis Foundation. LA AR Y XELJANZ *El Ease-of-Use Commendation de la Arthritis Foundation reconoce productos, como la tapa del frasco de XELJANZ, que se han comprobado facilitan la vida a las personas con artritis y otras limitaciones físicas. CIENCIA DE LA AR Y XELJANZ RESULTADOS DE XELJANZ OPCIONES DE TRATAMIENTO INFORMACIÓN IMPORTANTE DE SEGURIDAD Algunas personas que toman XELJANZ presentan desgarres en el estómago o intestino. Esto ocurre con mayor frecuencia en personas que también toman medicamentos antiinflamatorios no esteroides (NSAID, por sus siglas en inglés), corticosteroides o metotrexato. Hable cuanto antes con su profesional del cuidado de la salud si tiene fiebre y dolor en la zona del estómago que no desaparece y algún cambio en los hábitos de movimientos intestinales. 4 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 5
4 LA AR Y LA INFLAMACIÓN. La AR es una enfermedad autoinmune en la que los mecanismos naturales de defensa del cuerpo para combatir dolencias y enfermedades por error atacan los propios tejidos del cuerpo, en específico la membrana sinovial, una membrana delgada que recubre las articulaciones. Como resultado, ocurre inflamación. La inflamación de la AR puede desempeñar una función principal en crear problemas de las articulaciones. Puede producir sensibilidad e hinchazón de las articulaciones, al igual que rigidez y dolor significativo. Aunque la AR puede afectar cualquier articulación, afecta con mayor frecuencia las articulaciones pequeñas en las manos y los pies. Los síntomas comunes de la AR incluyen: rigidez en la mañana y dolor de las articulaciones hinchazón y limitación de movimiento de muchas articulaciones sensación general de estar enfermo Vivir con los síntomas de AR puede ser un reto, porque los dolorosos síntomas pueden interferir con sus actividades cotidianas. LA CIENCIA DETRÁS DE XELJANZ. La investigación clínica ha descubierto redes de citosina y ciertas vías de señalización, llamadas vías asociadas con las cinasas de Janus (JAK), que se cree desempeñan una función en la inflamación de la AR. Las citocinas son pequeñas proteínas de señalización producidas por el cuerpo que ayudan a regular la actividad de nuestro sistema inmunológico. Las vías de JAK son vías de señalización dentro de nuestras células que son usadas por algunas citocinas para ayudar a controlar las respuestas inmunitarias e inflamatorias. XELJANZ es el primero en una nueva clase de tratamientos para la AR llamado inhibidores de JAK. XELJANZ trabaja profundo dentro de la célula dirigido a las vías de JAK para interrumpir la señalización y la producción de citocinas relacionadas con la inflamación de la AR. Vea un vídeo sobre la ciencia detrás de XELJANZ en view.xeljanz.com INFORMACIÓN IMPORTANTE DE SEGURIDAD Su profesional del cuidado de la salud debe realizar análisis de sangre antes de que comience a recibir XELJANZ, y mientras tome XELJANZ, para ver si se producen los siguientes efectos secundarios: cambios en recuentos de linfocitos. Los linfocitos son glóbulos blancos que ayudan al cuerpo a combatir infecciones. recuentos bajos de neutrófilos. Los neutrófilos son glóbulos blancos que ayudan al cuerpo a combatir infecciones. recuentos bajos de glóbulos rojos. Esto puede indicar que tiene anemia, lo cual puede hacerle sentir débil y cansado. Citocinas Vías de JAK activadas XELJANZ 6 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 7
5 RESULTADOS DE XELJANZ. XELJANZ se utiliza para tratar adultos con artritis reumatoide activa de moderada a severa, para los cuales el metotrexato no funcionó bien. XELJANZ ha sido estudiado en un amplio grupo de pacientes adultos con AR activa de moderada a severa. Se llevaron a cabo cinco estudios que incluyeron más de 3,000 pacientes. Estos estudios evaluaron la eficacia de XELJANZ tomado solo o con un medicamento antirreumático modificador de la enfermedad (DMARD, por sus siglas en inglés) no biológico, con mayor frecuencia metotrexato. Incluso cuando se toma sin metotrexato, se ha comprobado clínicamente que XELJANZ reduce el dolor y la hinchazón de las articulaciones causados por la AR. Se demostró que XELJANZ reduce la actividad de la enfermedad a lo largo de un periodo de 6 meses. Puntuación DAS28* Datos en archivo. Pfizer Inc., New York, NY. Reducción en la puntuación de actividad de la enfermedad (DAS)* a los 6 meses Estudio ORAL Sync XELJANZ/placebo con un DMARD no biológico Inicial Mes 6 MAYOR ACTIVIDAD DE LA ENFERMEDAD MENOR Reducción de los síntomas de AR* a los 3 meses (2 estudios separados) XELJANZ 5 mg dos veces al día 310 pacientes Placebo 158 pacientes XELJANZ 5 mg dos veces al día 242 pacientes Placebo 62 pacientes % de pacientes con reducción de síntomas Estudio ORAL Solo XELJANZ/placebo solo XELJANZ 5 mg dos veces al día 243 pacientes Placebo 122 pacientes Estudio ORAL Sync XELJANZ/placebo con un DMARD no biológico XELJANZ 5 mg dos veces al día 311 pacientes Placebo 157 pacientes * Reducción de 20% en los recuentos de articulaciones dolorosas e hinchadas y 3 de estos 5 indicadores: prueba de sangre que mide la inflamación, evaluación del paciente, evaluación del médico, escala de dolor y cuestionario de discapacidad/función. Medicamentos antirreumáticos modificadores de la enfermedad, incluido metotrexato Datos en archivo. Pfizer Inc., New York, NY. * DAS28 es una medida de actividad de la enfermedad a base de contar cuántas de 28 articulaciones están hinchadas y dolorosas. Las puntuaciones mayores de 5.1 indican un nivel alto de actividad de la enfermedad y las puntuaciones de 3.2 o menos indican un nivel bajo de actividad de la enfermedad. A los 6 meses, el 9% (24 pacientes) que tomaron XELJANZ con DMARD y el 3% (4 pacientes) que tomaron placebo con DMARD alcanzaron una puntuación DAS28 de menos de 2.6. Los pacientes con una puntuación menor de 2.6 aún pueden tener algunas articulaciones hinchadas y con dolor. Medicamentos antirreumáticos modificadores de la enfermedad, incluido metotrexato Datos en archivo. Pfizer Inc., New York, NY. Cuán rápido observaron los pacientes una reducción en los Algunos pacientes que tomaron XELJANZ experimentaron reducción en el dolor y la hinchazón de las articulaciones en un periodo de 2 semanas. Para otros, tomó tanto como 3-6 meses. Todas las personas son diferentes, así que los resultados pueden variar. INFORMACIÓN IMPORTANTE DE SEGURIDAD Su profesional del cuidado de la salud debe realizar rutinariamente ciertas pruebas de hígado. No debe recibir XELJANZ si su recuento de linfocitos, neutrófilos o glóbulos rojos es demasiado bajo, o si sus pruebas de hígado son demasiado altas. Su profesional del cuidado de la salud puede parar su tratamiento con XELJANZ por un período de tiempo, si es necesario, debido a cambios en los resultados de estas pruebas de sangre. Su profesional del cuidado de la salud debe realizar pruebas de sangre para verificar sus niveles de colesterol de 4-8 semanas después de que haya comenzado a tomar XELJANZ, y según sea necesario después de este tiempo. Cuán rápido observaron los pacientes una reducción en los síntomas de AR* % de pacientes con reducción de síntomas XELJANZ 5 mg dos veces al día 240 pacientes A las 2 semanas Estudio ORAL Solo XELJANZ/placebo solo Placebo 120 pacientes A los 3 meses XELJANZ 5 mg dos veces al día 241 pacientes Placebo 120 pacientes * Reducción de 20% en los recuentos de articulaciones dolorosas e hinchadas y 3 de estos 5 indicadores: prueba de sangre que mide la inflamación, evaluación del paciente, evaluación del médico, escala de dolor y cuestionario de discapacidad/función. Datos en archivo. Pfizer Inc., New York, NY. 8 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 9
6 Si piensa que su tratamiento actual para la AR no lo está ayudando lo suficiente, pregúntele a su reumatólogo sobre XELJANZ. Considere las siguientes preguntas: ES XELJANZ INDICADO PARA MÍ? Es usted un adulto que ha sido diagnosticado con AR de moderada a severa? Toma en la actualidad, o ha tomado, metotrexato para su AR de moderada a severa? Siente que su plan de tratamiento actual no reduce eficazmente sus síntomas de AR, como el dolor, la hinchazón y la rigidez mañanera? Aún experimenta síntomas de AR de moderada a severa con frecuencia? Tiene dificultad para llevar a cabo sus actividades cotidianas como acostarse/levantarse de la cama, vestirse o abrir un frasco sin ayuda? Le interesa explorar opciones adicionales de tratamiento? Si contestó sí a estas preguntas, pregunte a su reumatólogo sobre XELJANZ. Usted encontrará herramientas en XELJANZ.com que pueden ayudarlo a entender mejor sus síntomas y a hablar con su médico de forma más efectiva. Juntos, pueden determinar si XELJANZ puede ser adecuado para usted. INFORMACIÓN IMPORTANTE DE SEGURIDAD XELJANZ puede causar efectos secundarios graves incluyendo infección por activación de la hepatitis B o C en personas que portan el virus en la sangre. Si usted porta el virus de la hepatitis B o C en la sangre (virus que afectan el hígado), estos pueden activarse mientras usa XELJANZ. Hable con su profesional del cuidado de la salud si tiene los siguientes síntomas de una posible infección de hepatitis B o C: se siente muy cansado, tiene la piel o los ojos amarillentos, tiene poco o ningún apetito, vómitos, movimientos intestinales de color arcilla, fiebre, escalofríos, molestias estomacales, dolores musculares, orina oscura o erupción de la piel. Los efectos secundarios comunes de XELJANZ incluyen: infecciones de las vías respiratorias superiores (resfriado común, sinusitis), dolor de cabeza, diarrea y congestión nasal, dolor de garganta y descarga nasal (nasofaringitis). MUCHOS TRATAMIENTOS. MUCHAS OPCIONES. A continuación algunas opciones de tratamiento para ayudar a aliviar el dolor y la hinchazón de las articulaciones de la AR. DMARD y NSAID Los medicamentos antirreumáticos modificadores de la enfermedad (DMARD) trabajan gradualmente para cambiar el curso de la AR y con frecuencia se recetan una vez confirmado el diagnóstico de AR. El metotrexato es uno de los tratamientos DMARD más comúnmente recetados para la AR. Los medicamentos antiinflamatorios no esteroides (NSAID, por sus siglas en inglés) y/o las dosis bajas de corticosteroides son recetados con frecuencia, junto con los DMARD, para ayudar a reducir el dolor, la hinchazón y la fiebre. Biológicos Los agentes biológicos son un tipo de DMARD que pueden ser recetados para pacientes con síntomas de AR de moderados a severos. Los biológicos van dirigidos a ciertas partes del sistema inmunológico y la señalización relacionadas con la inflamación de la AR. La mayoría de los biológicos combaten la inflamación desde afuera de la célula. Los biológicos no se administran por vía oral porque las enzimas en el tracto gastrointestinal (GI) pueden cambiarlas. En vez, son administrados por autoinyección o mediante una infusión en la oficina del médico o un centro de infusión. Inhibidores de JAK Los inhibidores asociados a la cinasa de Janus (JAK), como XELJANZ, también son un tipo de DMARD. Esta nueva clase de tratamientos trabaja profundo dentro de la célula para interrumpir las actividades que están ocurriendo en las vías de señalización. Se cree que estas vías de JAK desempeñan una función en la inflamación asociada con la AR. Como XELJANZ es una molécula pequeña, se puede tomar por vía oral. Conozca más en info.xeljanz.com 10 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 11
7 CONSIDERA UN CAMBIO? Si cree que su tratamiento actual no está haciendo lo suficiente para ayudar a reducir los síntomas de su AR de moderados a severos, puede ser hora de hablar con su reumatólogo sobre explorar una opción diferente. La forma de hablar con su médico es importante. La mayoría de las personas piensa que se comunica bien con sus médicos. Pero le sorprenderá saber cuán a menudo la mala comunicación puede interferir con una conversación efectiva sobre el tratamiento. Los médicos tienden a buscar evidencia objetiva y medible antes de tomar decisiones de tratamiento. Así que es importante poder explicar exactamente el impacto que tiene la AR en usted, cómo su condición ha cambiado con el tiempo y lo que espera del tratamiento. INFORMACIÓN IMPORTANTE DE SEGURIDAD SUGERENCIAS PARA TOMAR XELJANZ AYUDA ECONÓMICA CÓMO TOMAR XELJANZ Visite info.xeljanz.com para herramientas que le pueden ayudar: Monitoree sus síntomas Es importante medir su condición en términos específicos no solo el día de su cita sino todos los días entre citas también. Nuestro Day-By-Day RA Symptom Tracker, el cual puede descargar, le facilita llevar constancia del dolor y la rigidez de las articulaciones con el tiempo para que tanto usted como su médico entiendan y puedan tratar mejor su AR. Cambie la conversación Aprenda pasos sencillos que puede dar para asegurarse de que su médico realmente entiende cómo su AR lo está afectando y tome una prueba breve en línea para ver cuán preparado está para hablar con su médico. Conozca más en info.xeljanz.com 12 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 13
8 XELJANZ NO ES PARA TODO EL MUNDO. Antes de comenzar a tomar XELJANZ, digale a su profesional del cuidado de la salud si: tiene una infección tiene problemas de hígado tiene problemas de riñón Registro de Embarazo: Pfizer tiene un registro para mujeres embarazadas que toman XELJANZ. El propósito de este registro es comprobar la salud de la madre embarazada y su bebé. Si está embarazada o queda embarazada mientras está tomando XELJANZ, hable con su profesional del cuidado de la salud sobre cómo inscribirse en este registro de embarazo, o puede llamar directamente al registro al para inscribirse. tiene dolor en alguna zona del estómago (abdominal) o le han diagnosticado diverticulitis (una inflamación en partes del intestino grueso), o úlceras estomacales o intestinales ha tenido una reacción al tofacitinib o a alguno de los ingredientes de XELJANZ tiene planes de lactar o está lactando a su bebé. informe a su profesional del cuidado de la salud sobre todos los medicamentos que usa, especialmente cualquier otro medicamento para tratar su artritis reumatoide. Tomar XELJANZ con estos medicamentos puede aumentar su riesgo de infección. ha recibido recientemente, o tiene planes de recibir, una vacuna. Las personas que toman XELJANZ no deben recibir vacunas de microbios vivos, pero sí pueden recibir vacunas inactivas. tiene otras condiciones médicas Informe a su profesional del cuidado de la salud si está usando medicamentos que afectan la forma en que trabajan ciertas enzimas hepáticas. Pregúntele a su profesional del cuidado de la salud si no está seguro de si su medicamento es uno de estos. tiene planes de quedar embarazada o está embarazada. Se desconoce si XELJANZ perjudicaría al bebé por nacer. XELJANZ se utiliza para tratar adultos con artritis reumatoide activa de moderada a severa, para los cuales el metotrexato no funcionó bien. 14 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 15
9 SUGERENCIAS PARA TOMAR XELJANZ. Si le han recetado XELJANZ recientemente para tratar sus síntomas de AR de moderada a severa, considere las siguientes sugerencias: tome XELJANZ según recetado por su profesional del cuidado de la salud. tome XELJANZ dos veces al día con o sin alimentos. si toma demasiado XELJANZ, llame a su profesional del cuidado de la salud o acuda a la sala de emergencia del hospital más cercano de inmediato. Antes de comenzar a tomar XELJANZ, dígale a su profesional del cuidado de la salud si: piensa que tiene una infección o si tiene síntomas de una infección, como: fiebre, sudor o escalofríos, dolores musculares, tos, falta de aliento, sangre en la flema, pérdida de peso, calor, enrojecimiento o dolor en la piel o aftas en el cuerpo, diarrea o dolor de estómago, quemazón al orinar o ganas de orinar más frecuente de lo normal, o sentirse muy cansado lo están tratando para una infección suele padecer de muchas infecciones o tiene infecciones que son recurrentes Sugerencias para recordar tomar XELJANZ. Cree recordatorios diarios, como alertas en el calendario o pegar notas, para ayudarlo a mantenerse en camino. Tome XELJANZ con los alimentos de la mañana y la noche, o antes/después de cepillarse los dientes. Conozca más en info.xeljanz.com Todas las personas son diferentes. Al igual que sus síntomas de AR pueden ser diferentes a los de otra persona, lo mismo puede suceder con su respuesta al tratamiento. Como con el tiempo la respuesta al tratamiento puede variar, es importante monitorear su progreso y llevar constancia de cualquier cambio en la forma en que se siente. Déjele saber a su profesional del cuidado de la salud cómo está trabajando XELJANZ y si está experimentando o no algún efecto secundario. tiene diabetes, VIH o un sistema inmunológico débil. Las personas con estas condiciones tienen mayor probabilidad de contraer infecciones. tiene TB, o ha estado en contacto cercano con alguien que tiene TB vive o ha vivido, o ha viajado a ciertos lugares del país (como los valles Ohio y el Río Mississippi y el Suroeste de EE. UU.), donde hay una mayor posibilidad de contraer ciertos tipos de infecciones micóticas (histoplasmosis, coccidioidomicosis o blastomicosis). Estas infecciones pueden producirse, o volverse más severas, si usa XELJANZ. Pregúntele a su profesional del cuidado de la salud si usted no sabe si ha vivido en un área en donde estas infecciones son comunes. tiene, o ha tenido, hepatitis B o C Después de haber comenzado a tomar XELJANZ, llame a su profesional del cuidado de la salud cuanto antes si tiene síntomas de infección. XELJANZ puede aumentar la probabilidad de que contraiga infecciones, o empeorar una infección que usted ya tenga. 16 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 17
10 AYUDA ECONÓMICA Comenzar un programa nuevo de tratamiento puede ser abrumador. Estamos aquí para ayudar. Si actualmente está tomando XELJANZ para manejar la artritis reumatoide (AR) de moderada a severa, por favor, tome ventaja del programa XELSOURCE SM, un servicio de apoyo personalizado atendido por personas reales y apoyo verdadero para ayudar a simplificar el acceso a su tratamiento. APOYO DE XELSOURCE El apoyo incluye: 1. acceso a la tarjeta de ahorros en el copago, para pacientes elegibles*. TARJETA DE COPAGO La Tarjeta de Copago de XELJANZ está diseñada para hacer que XELJANZ sea más asequible para los pacientes. Si usted es elegible, puede recibir XELJANZ por tan poco como $0 por costos de desembolsos al mes. Límites, términos y condiciones aplican. Por favor, vea a continuación. Para más información Por favor, llame a nuestro número, libre de costo, al XELJANZ ( ), de lunes a viernes, de 8:00 a.m. a 8:00 p.m., hora del este 2. identificación de fuentes potenciales alternas de financiamiento y referido a un programa de ayuda al paciente. 3. colaboración con una farmacia para el procesamiento y la entrega de su medicamento. 4. materiales educativos y coordinación de servicios de apoyo con reembolsos a solicitud. * Límites, términos y condiciones aplican. Por favor, vea a continuación. Programa impulsado por Pfizer Helpful Answers. XELJANZ se utiliza para tratar adultos con artritis reumatoide activa de moderada a severa, para los cuales el metotrexato no funcionó bien. TÉRMINOS Y CONDICIONES DE LA TARJETA DE COPAGO Al usar la Tarjeta de Ahorros Instantáneos en el Copago de XELJANZ (citrato de tofacitinib) tabletas de 5 mg (la Tarjeta ), usted acepta que actualmente satisface los criterios de elegibilidad y que cumplirá con los siguientes términos y condiciones. Esta Tarjeta no es válida para recetas que son elegibles para reembolso, en su totalidad o en parte, por Medicaid, Medicare u otros programas de salud federales o estatales (incluidos cualquier programa estatal de ayuda con los medicamentos con receta y el Plan Médico del Gobierno disponible en Puerto Rico [conocido anteriormente como, La Reforma De Salud ]). La Tarjeta no es válida para recetas que son elegibles para reembolso por planes privados de seguros u otros programas de beneficios de salud o de farmacia que le reembolsan el costo total de sus medicamentos con receta. Usted recibirá un beneficio máximo de $8000 por año calendario, el cual se define por la fecha de inscripción hasta el 31 de diciembre del año de la inscripción, con un copago de $0 al mes. Después de un máximo de $8000, usted será responsable de desembolsar mensualmente el pago de los costos restantes. La Tarjeta podrá usarse una vez al mes, mientras esté vigente el programa. Usted tiene que deducir el valor recibido bajo este programa de cualquier solicitud de reembolso sometida a su plan médico, ya sea directamente por usted o en su nombre. No se puede combinar con ningún otro descuento o cupón, muestra gratis u ofertas similares para la receta especificada. Se aceptará la Tarjeta solo en las farmacias participantes. Esta Tarjeta no es un seguro médico. La oferta es válida solo en los Estados Unidos y en Puerto Rico. La Tarjeta está limitada a 1 por persona durante este periodo de vigencia y no es transferible. Pfizer se reserva el derecho de rescindir, revocar o enmendar este programa sin notificación. No hay cuota de membresía. La Tarjeta y el Programa expiran el 31/12/2014. Si tiene preguntas o si necesita apoyo adicional, llame al o visite Pfizer Inc, 235 E. 42nd Street, New York, NY Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Para AR de moderada a severa 19
11 20 INFORMACIÓN IMPORTANTE DE SEGURIDAD Cuál es la información más importante que debo conocer sobre XELJANZ? XELJANZ puede causar efectos secundarios graves, incluyendo: Infecciones graves. XELJANZ puede reducir la capacidad de su sistema inmunológico para combatir infecciones. Algunas personas tienen infecciones graves mientras toman XELJANZ, incluida la tuberculosis (TB) e infecciones causadas por bacterias, hongos o virus que pueden extenderse por todo el cuerpo. Algunas personas han fallecido por causa de dichas infecciones. Su profesional del cuidado de la salud debe hacerle una prueba de TB antes de comenzar a tomar XELJANZ y monitorearlo de cerca para ver si existen indicios y síntomas de una infección de TB durante el tratamiento. No debe comenzar a tomar XELJANZ si tiene algún tipo de infección, a menos que su profesional del cuidado de la salud le diga que está bien. Antes de comenzar a tomar XELJANZ, dígale a su profesional del cuidado de la salud si: g piensa que tiene una infección o si tiene síntomas de una infección, como: fiebre, sudor o escalofríos, dolores musculares, tos, falta de aliento, sangre en la flema, pérdida de peso, calor, enrojecimiento o dolor en la piel o aftas en el cuerpo, diarrea o dolor de estómago, quemazón al orinar o ganas de orinar más frecuente de lo normal, o sentirse muy cansado g lo están tratando para una infección g suele padecer de muchas infecciones o tiene infecciones que son recurrentes g tiene diabetes, VIH o un sistema inmunológico débil. Las personas con estas condiciones tienen mayor probabilidad de contraer infecciones. g tiene TB, o ha estado en contacto cercano con alguien que tiene TB g vive o ha vivido, o ha viajado a ciertos lugares del país (como los valles Ohio y el Río Mississippi y el Suroeste de EE. UU.), donde hay una mayor posibilidad de contraer ciertos tipos de infecciones micóticas (histoplasmosis, coccidioidomicosis o blastomicosis). Estas infecciones pueden producirse o volverse más severas si usa XELJANZ. Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Pregúntele a su profesional del cuidado de la salud si no sabe si ha vivido en un área en donde estas infecciones son comunes. g tiene, o ha tenido, hepatitis B o C Después de haber comenzado a tomar XELJANZ, llame a su profesional del cuidado de la salud cuanto antes si tiene síntomas de infección. XELJANZ puede hacerlo más propenso a contraer infecciones o empeorar cualquier infección que tenga. Cáncer y problemas del sistema inmunológico. XELJANZ puede aumentar el riesgo de ciertos tipos de cáncer, cambiando la forma en que funciona su sistema inmunológico. Pueden producirse linfomas y otros tipos de cáncer en pacientes que toman XELJANZ. Informe a su profesional del cuidado de la salud si ha tenido algún tipo de cáncer. Algunas personas que han tomado XELJANZ con otros medicamentos específicos para prevenir el rechazo del trasplante de riñón, han tenido problemas con ciertos glóbulos blancos que se descontrolaban (trastorno linfoproliferativo asociado con el virus de Epstein Barr). Desgarres (perforación) en el estómago o los intestinos. Algunas personas que toman XELJANZ presentan desgarres en el estómago o intestino. Esto ocurre con mayor frecuencia en personas que también toman medicamentos antiinflamatorios no esteroides (NSAID), corticosteroides, o metotrexato. Hable cuanto antes con su profesional del cuidado de la salud si tiene fiebre y dolor en el área del estómago que no desaparece y algún cambio en los hábitos de movimientos intestinales. Cambios en los resultados de ciertos análisis de laboratorio. Su profesional del cuidado de la salud debe realizar análisis de sangre antes de que comience a recibir XELJANZ, y mientras tome XELJANZ, para ver si se producen los siguientes efectos secundarios: g cambios en recuentos de linfocitos. Los linfocitos son glóbulos blancos que ayudan al cuerpo a combatir infecciones. g recuentos bajos de neutrófilos. Los neutrófilos son glóbulos blancos que ayudan al cuerpo a combatir infecciones. g recuentos bajos de glóbulos rojos. Esto puede indicar que tiene anemia, lo cual puede hacerle sentir débil y cansado. Su profesional del cuidado de la salud debe realizar rutinariamente ciertos análisis de hígado. La Información Importante y Completa de Seguridad continúa en las páginas
12 Información de Prescripción completa en el bolsillo INFORMACIÓN IMPORTANTE DE SEGURIDAD Continuación No debe recibir XELJANZ si su recuento de linfocitos, neutrófilos o glóbulos rojos es demasiado bajo, o si sus análisis de hígado son demasiado altos. Su profesional del cuidado de la salud puede parar su tratamiento con XELJANZ por un período de tiempo, si es necesario, debido a cambios en los resultados de estos análisis de sangre. Su profesional del cuidado de la salud debe realizar análisis de sangre para verificar sus niveles de colesterol de 4-8 semanas después de que haya comenzado a tomar XELJANZ, y según sea necesario después de este tiempo. Qué debo decirle a mi profesional de la salud antes de tomar XELJANZ? XELJANZ puede no ser indicado para usted. Antes de tomar XELJANZ, hable con su profesional del cuidado de la salud si usted: g tiene una infección Informe a su profesional del cuidado de la salud sobre todos los medicamentos que usa, especialmente cualquier otro medicamento para tratar su artritis reumatoide. Usted no debe usar tocilizumab (Actemra ), etanercept (Enbrel ), adalimumab (Humira ), infliximab (Remicade ), rituximab (Rituxan ), abatacept (Orencia ), anakinra (Kineret ), certolizumab (Cimzia ), golimumab (Simponi ), azatioprina, ciclosporina, u otros medicamentos inmunosupresores mientras tome XELJANZ. Tomar XELJANZ con estos medicamentos puede aumentar su riesgo de infección. Informe a su profesional del cuidado de la salud si está usando medicamentos que afectan la forma en que trabajan ciertas enzimas hepáticas. Pregúntele a su profesional del cuidado de la salud si no está seguro de si su medicamento es uno de estos. Cuáles son otros posibles efectos secundarios de XELJANZ? XELJANZ puede causar efectos secundarios graves incluida infección por activación de la hepatitis B o C en personas que tienen el virus en la sangre. Si porta el virus de la hepatitis B o C en la sangre (virus que afectan el hígado), estos virus pueden activarse mientras usa XELJANZ. Hable con su profesional del cuidado de la salud si tiene los siguientes síntomas de una posible infección de hepatitis B o C: se siente muy cansado, tiene la piel o los ojos amarillentos, tiene poco o ningún apetito, vómitos, movimientos intestinales de color arcilla, fiebre, escalofríos, molestias estomacales, dolores musculares, orina oscura o erupción de la piel. Los efectos secundarios comunes de XELJANZ incluyen: infecciones de las vías respiratorias superiores (resfriado común, sinusitis), dolor de cabeza, diarrea y congestión nasal, dolor de garganta y descarga nasal (nasofaringitis). Qué es XELJANZ? XELJANZ es un medicamento con receta llamado inhibidor de cinasa de Janus (JAK). XELJANZ se utiliza para tratar adultos con artritis reumatoide activa de moderada a severa, para los cuales el metotrexato no funcionó bien. Se desconoce si XELJANZ es seguro y eficaz en personas con hepatitis B o C. XELJANZ no es para personas con problemas hepáticos severos. Se desconoce si XELJANZ es seguro y eficaz en niños. g tiene problemas de hígado g tiene problemas de riñón g tiene dolor en la zona del estómago (abdominal) o le han diagnosticado diverticulitis (una inflamación en partes del intestino grueso), o úlceras estomacales o intestinales g ha tenido una reacción al tofacitinib o a alguno de los ingredientes de XELJANZ g ha recibido recientemente, o tiene planes de recibir, una vacuna. Las personas que toman XELJANZ no deben recibir vacunas de microbios vivos, pero sí pueden recibir vacunas inactivas. g tiene otras condiciones médicas g tiene planes de quedar embarazada o está embarazada. Se desconoce si XELJANZ perjudicaría al bebé por nacer. g Registro de Embarazo: Pfizer tiene un registro para mujeres embarazadas que toman XELJANZ. El propósito de este registro es comprobar la salud de la madre embarazada y su bebé. Si está embarazada o queda embarazada mientras toma XELJANZ, hable con su profesional del cuidado de la salud sobre cómo puede inscribirse en este registro de embarazo o puede comunicarse con el registro al para inscribirse. tiene planes de lactar o está lactando a su bebé. 22 Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. 23
13 INSCRÍBASE PARA MÁS INFORMACIÓN Independientemente de si está considerando cambiar a XELJANZ, o ya ha comenzado el tratamiento, use el formulario a continuación para solicitar más información y materiales de apoyo, incluida la Tarjeta de Ahorros en el Copago de XELJANZ. Usted también puede ordenar en línea, en signup. XELJANZ.com, o por teléfono al Por favor, complete todos los campos: Nombre Apellido Cuál, si alguno, de los medicamentos enumerados usa en la actualidad para tratar su condición? NSAID (p.ej., aspirina o ibuprofeno) Esteroides DMARD (p.ej., metotrexato, leflunomida, sulfasalazina, hidroxicloroquina) Biológicos/Anti-factor de necrosis tumoral (TNF, por sus siglas en inglés) (p.ej., Enbrel, Humira o Remicade ) XELJANZ (tofacitinib) Ninguno de los anteriores Si está tomando XELJANZ, cuándo comenzó el tratamiento? / (mes/año) Dirección 1 Dirección 2 (opcional) Ciudad Estado Código postal Dirección de correo electrónico Fecha de nacimiento: / (mes/año) Sexo: Hombre Mujer Prefiero recibir las comunicaciones de Pfizer por: Correo electrónico Correo Pfizer hará todo lo posible por enviarle los materiales en el formato que solicita. Qué tipo de médico está tratando su condición? Reumatólogo Médico de cuidado primario Ambos Otro Por favor, vea la Información Importante de Seguridad completa en las páginas Vea la Información de Prescripción completa, incluidos el recuadro de advertencia y la Guía del Medicamento, en el bolsillo de atrás. Le gustaría recibir recordatorios mensuales de repetición de la receta? Sí No Cómo le gustaría recibir estos recordatorios? Correo electrónico Texto ( ) - provea el número de teléfono Por favor, indique lo siguiente: Tengo por lo menos 18 años de edad. Al marcar esta casilla, también acepto que Pfizer o las compañías que actúan en su nombre pueden enviarme materiales sobre otras condiciones de salud, usar mi información para ayudar a desarrollar o mejorar productos y servicios o comunicarse conmigo en el futuro sobre temas relacionados con la salud. Pfizer entiende que su información personal y de salud es privada. La información provista por usted será usada por Pfizer y los terceros que actúan en su nombre para enviarle los materiales que solicitó, otra información útil y actualizaciones sobre XELJANZ, al igual que tratamientos, productos, ofertas y servicios relacionados. Los nombres de marca incluidos a lo largo de este folleto son propiedad de sus respectivos dueños. XELB
14 BUSINESS REPLY MAIL FIRST CLASS MAIL PERMIT NO.4894 MISSION KS POSTAGE WILL BE PAID BY ADDRESSEE PFIZER PO BOX MISSION, KS NO POSTAGE NECESSARY IF MAILED IN THE UNITED STATES
15 Puntos destacados de la información para la prescripción Estos puntos destacados no incluyen toda la información que se necesita para usar XELJANZ con seguridad y eficacia. Vea la información completa para la prescripción de XELJANZ. XELJANZ (tofacitinib) tabletas para administración oral Aprobación inicial en los Estados Unidos: 2012 ADVERTENCIA: INFECCIONES GRAVES Y MALIGNIDAD Vea toda la información para la prescripción para conocer la advertencia completa que aparece en el recuadro. Se han producido infecciones graves que culminaron en hospitalización o muerte, incluidas la tuberculosis e infecciones bacterianas, micóticas invasivas, virales y otras infecciones oportunistas, en pacientes que recibieron XELJANZ. (5.1) Si se produce una infección grave, interrumpa XELJANZ hasta que la infección esté controlada. (5.1) Antes de comenzar XELJANZ, haga una prueba de tuberculosis latente; si es positiva, inicie el tratamiento para la tuberculosis antes de comenzar a tomar XELJANZ. (5.1) Monitoree a todos los pacientes para detectar tuberculosis activa durante el tratamiento, aunque la prueba inicial de tuberculosis latente sea negativa. (5.1) Se han observado linfomas y otras malignidades en pacientes tratados con XELJANZ. Se ha observado el trastorno linfoproliferativo postrasplante asociado con el virus de Epstein Barr en una tasa más alta en pacientes de trasplante renal tratados con XELJANZ y medicamentos inmunosupresores concomitantes. (5.2) INDICACIONES Y USO XELJANZ, un inhibidor de cinasa de Janus (JAK, por sus siglas en inglés), está indicado para el tratamiento de pacientes adultos con artritis reumatoide activa de moderada a severa, que han tenido una respuesta inadecuada o intolerancia al metotrexato. Puede usarse como monoterapia o en combinación con metotrexato u otros medicamentos antirreumáticos modificadores de la enfermedad (DMARD, por sus siglas en inglés) no biológicos. No se debe usar XELJANZ en combinación con DMARD biológicos ni con inmunosupresores potentes como la azatioprina y la ciclosporina. (1.1) DOSIFICACIÓN Y ADMINISTRACIÓN Artritis reumatoide La dosis recomendada de XELJANZ es de 5 mg dos veces al día. 1
16 FORMULACIONES Y CONCENTRACIONES Tabletas: 5 mg (3) CONTRAINDICACIONES Ninguna (4) ADVERTENCIAS Y PRECAUCIONES Infecciones graves No administre XELJANZ durante una infección activa, incluidas las infecciones localizadas. Si se desarrolla una infección grave, interrumpa XELJANZ hasta que la infección esté controlada. (5.1) Se han reportado linfomas y otras malignidades en pacientes tratados con XELJANZ. (5.2) Perforaciones gastrointestinales Use con precaución en pacientes que pueden tener un mayor riesgo. (5.3) Monitoreo de laboratorio Se recomienda debido a cambios potenciales en los linfocitos, los neutrófilos, la hemoglobina, las enzimas hepáticas y los lípidos. (5.4) Inmunizaciones No se deben administrar vacunas de microbios vivos concurrentes con XELJANZ. (5.5) Insuficiencia hepática severa No se recomienda. (5.6) REACCIONES ADVERSAS Las reacciones adversas reportadas más comúnmente durante los 3 primeros meses en ensayos clínicos controlados (que ocurrieron en más de, o igual a, el 2% de los pacientes tratados con monoterapia de XELJANZ o en combinación con DMARD) fueron infecciones de las vías respiratorias superiores, dolor de cabeza, diarrea y nasofaringitis. (6.1) Para reportar sobre SOSPECHA DE REACCIONES ADVERSAS, llame a Pfizer, Inc al o comuníquese con la Administración de Drogas y Alimentos (Food and Drug Administration, FDA, por sus siglas en inglés) llamando al FDA 1088 o a través de INTERACCIÓN CON OTROS MEDICAMENTOS Potentes inhibidores de Citocromo P450 3A4 (CYP3A4) (ej.: quetoconazol): reduzca la dosis a 5 mg una vez por día. (2.1) 2
17 Uno o más medicamentos simultáneos que generan como resultado una inhibición moderada de CYP3A4 y una inhibición potente de CYP2C19 (ej.: fluconazol): reduzca la dosis a 5 mg una vez por día. (2.1) Inductores potentes CYP (ej.: rinfampina): puede resultar en la pérdida o reducción de la respuesta clínica. (2.2) USO EN POBLACIONES ESPECÍFICAS Insuficiencia renal moderada y severa e insuficiencia hepática moderada: reducir la dosis a 5 mg una vez por día. (8.6, 8.7) Vea el n. º 17 para la INFORMACIÓN DE ASESORAMIENTO PARA EL PACIENTE y la Guía del medicamento Revisado: 11/2012 3
18 Información completa para la prescripción: Contenido* * Las secciones o subsecciones omitidas de la información completa para la prescripción no se enumeran. 1 INDICACIONES Y USO 1.1 Artritis reumatoide DOSIFICACIÓN Y ADMINISTRACIÓN 2.1 Artritis reumatoide Consideraciones generales para la administración Modificaciones de la dosificación FORMULACIONES Y CONCENTRACIONES 4 CONTRAINDICACIONES 5 ADVERTENCIAS Y PRECAUCIONES 5.1 Infecciones graves Malignidad y trastorno linfoproliferativo Perforaciones gastrointestinales Parámetros de laboratorio Vacunas Insuficiencia hepática REACCIONES ADVERSAS 6.1 Experiencia en ensayos clínicos INTERACCIÓN CON OTROS MEDICAMENTOS 7.1 Inhibidores potentes de CYP3A Inhibidores moderados de CYP3A4 y potentes de CYP2C Inductores potentes de CYP3A Medicamentos inmunosupresores USO EN POBLACIONES ESPECÍFICAS 8.1 Embarazo Madres lactantes Uso pediátrico Uso geriátrico Insuficiencia hepática Insuficiencia renal SOBREDOSIS 11 DESCRIPCIÓN 12 FARMACOLOGÍA CLÍNICA 12.1 Mecanismo de acción Farmacodinámica Farmacocinética TOXICOLOGÍA NO CLÍNICA 13.1 Carcinogénesis, mutagénesis y deterioro de la fertilidad ESTUDIOS CLÍNICOS 16 CÓMO SE SUMINISTRA, ALMACENAMIENTO Y MANEJO 17 INFORMACIÓN DE ASESORAMIENTO PARA EL PACIENTE 4
19 Información completa para la prescripción ADVERTENCIA: INFECCIONES GRAVES Y MALIGNIDAD INFECCIONES GRAVES Los pacientes tratados con XELJANZ tienen un mayor riesgo de desarrollar infecciones graves que pueden resultar en hospitalización o en fallecimiento [vea Advertencias y precauciones (5.1) y Reacciones adversas (6.1)]. La mayoría de los pacientes que presentaron estas infecciones estaban tomando simultáneamente inmunosupresores tales como metotrexato o corticoesteroides. Si se produce una infección grave, interrumpa XELJANZ hasta que se haya controlado la infección. Las infecciones reportadas son: tuberculosis activa, la cual puede estar presente con enfermedad pulmonar o extrapulmonar. Los pacientes deben hacerse una prueba de tuberculosis latente antes de tomar XELJANZ y durante la terapia. Debe iniciarse el tratamiento para la infección latente antes de tomar XELJANZ. infecciones micóticas invasivas, incluidas la criptococosis y la pneumocistosis. Los pacientes con infecciones micóticas invasivas pueden presentar una enfermedad diseminada en lugar de localizada. infecciones bacterianas, virales y de otro tipo, debidas a patógenos oportunistas. Los riesgos y beneficios del tratamiento con XELJANZ deben considerarse detenidamente antes de iniciar la terapia en pacientes con infección crónica o recurrente. Debe monitorearse a los pacientes para ver si se producen indicios y síntomas de infección durante y después del tratamiento con XELJANZ, incluido el posible desarrollo de tuberculosis en pacientes que dieron negativo para infección de tuberculosis latente antes de iniciar la terapia [vea Advertencias y precauciones (5.1)]. MALIGNIDADES Se han observado linfomas y otras malignidades en pacientes tratados con XELJANZ. Se ha observado el trastorno linfoproliferativo postrasplante asociado con el virus de Epstein Barr en una tasa más alta en pacientes de trasplante renal tratados con XELJANZ y medicamentos inmunosupresores concomitantes [vea Advertencias y precauciones (5.2)]. 1 Indicaciones y uso 1.1 Artritis reumatoide XELJANZ (tofacitinib) está indicado para el tratamiento de pacientes adultos con artritis reumatoide activa de moderada a severa, que han tenido una respuesta inadecuada o intolerancia a 5
20 metotrexato. Puede usarse como monoterapia o en combinación con metotrexato u otros medicamentos antirreumáticos modificadores de la enfermedad (DMARD) no biológicos. No se debe usar XELJANZ en combinación con DMARD biológicos ni con inmunosupresores potentes tales como la azatioprina y la ciclosporina 2 Dosificación y administración XELJANZ se administra por vía oral, con o sin comida. 2.1 Artritis reumatoide XELJANZ puede utilizarse como monoterapia o en combinación con metotrexato u otros medicamentos antirreumáticos no biológicos modificadores de la enfermedad (DMARD). La dosis recomendada de XELJANZ es de 5 mg dos veces por día. Se recomienda interrumpir la dosis para el tratamiento de la linfopenia, neutropenia y anemia [vea Dosificación y administración (2.3), Advertencias y precauciones (5.4) y Reacciones adversas (6.1)]. Debe reducirse la dosis de XELJANZ a 5 mg una vez al día en pacientes: con insuficiencia renal moderada o severa con insuficiencia hepática moderada que reciban inhibidores potentes de Citocromo P450 3A4 (CYP3A4) (ej.: quetoconazol) que reciban uno o más medicamentos simultáneos que puedan dar como resultado la inhibición moderada de CYP3A4 y la inhibición potente de CYP2C19 (ej.: fluconazol). 2.2 Consideraciones generales para la administración XELJANZ no debe usarse en pacientes con insuficiencia hepática severa. Se recomienda no iniciar XELJANZ en pacientes con un recuento de linfocitos inferior a 500 glóbulos/mm 3, un recuento absoluto de neutrófilos (ANC) inferior a 1000 glóbulos/mm 3, o con niveles de hemoglobina inferiores a 9 g/dl. La coadministración de XELJANZ con potentes inductores de CYP3A4 (ej.: rifampina) puede generar la pérdida de o la reducción de la respuesta clínica a XELJANZ. 2.3 Modificaciones de la dosificación El tratamiento con XELJANZ debe interrumpirse si un paciente desarrolla una infección grave hasta que la infección haya sido controlada. 6
21 Tabla 1: Ajustes de dosis para linfopenia Recuento de Linfocitos Bajo [vea Advertencias y precauciones (5.4)] Valor de Laboratorio Recomendación (glóbulos/mm 3 ) Recuento de linfocitos Mantenerla dosis superior o igual a 500 Recuento de linfocitos Interrumpir XELJANZ inferior a 500 (Confirmado por pruebas repetidas) Tabla 2: Ajustes de dosis para neutropenia ANC Bajo [vea Advertencias y precauciones (5.4)] Valor de Laboratorio Recomendación (glóbulos/mm 3 ) ANC superior a 1000 Mantener la dosis ANC ANC inferior a 500 (Confirmado por pruebas repetidas) Para reducciones persistentes en este rango, interrumpir la dosis hasta que el ANC sea superior a 1000 Cuando el ANC sea superior a 1000, vuelva a continuar con XELJANZ, 5 mg dos veces por día Interrumpir XELJANZ Tabla 3: Ajustes de dosis para anemia Valor Bajo de Hemoglobina [vea Advertencias y precauciones (5.4)] Valor de Laboratorio Recomendación (g/dl) Inferior o igual a una Mantener la dosis reducción de 2 g/dl, y superior o igual a 9.0 g/dl Superior a una reducción Interrumpir la administración de XELJANZ hasta que se hayan normalizado de 2 g/dl o inferior a 8.0 los valores de hemoglobina g/dl (Confirmado por pruebas repetidas) 3 Formulaciones y concentraciones XELJANZ se proporciona en tabletas de tofacitinib de 5 mg (equivalente a 8 mg de citrato de tofacitinib): tabletas blancas, redondas, cubiertas con una película de liberación inmediata, con la palabra Pfizer en una cara y JKI 5 en la otra. 4 Contraindicaciones Ninguna 7
22 5 Advertencias y precauciones 5.1 Infecciones graves Se han reportado infecciones graves y a veces letales, debidas a patógenos bacterianos, micobacterianos, micóticos invasivos, virales u otros patógenos oportunistas, en pacientes con artritis reumatoide que reciben XELJANZ. Las infecciones graves más comunes reportadas con XELJANZ incluyeron neumonía, celulitis, herpes zóster e infecciones de las vías urinarias [vea Reacciones adversas (6.1)]. Entre las infecciones oportunistas, se reportaron la tuberculosis y otras infecciones micobacterianas, criptococosis, candidiasis esofágica, neumocistosis, herpes zóster multidermatomal, citomegalovirus y el virus BK, con XELJANZ. Algunos pacientes han presentado enfermedad diseminada en lugar de localizada y con frecuencia estaban tomando simultáneamente inmunomoduladores como el metotrexato o los corticoesteroides. Pueden producirse también otras infecciones graves que no se reportaron en los estudios clínicos, como la histoplasmosis, coccidioidomicosis y listeriosis. No debe iniciarse XELJANZ en pacientes con una infección activa, incluidas las infecciones localizadas. Deben considerarse los riesgos y beneficios del tratamiento antes de iniciar XELJANZ en pacientes: con infección crónica o recurrente que han estado expuestos a tuberculosis con un historial de infección grave u oportunista que han residido o viajado a áreas de tuberculosis endémica o micosis endémicas; o con condiciones subyacentes que pueden predisponerlos para infecciones. Debe monitorearse a los pacientes para ver si se producen indicios y síntomas de infección durante y después del tratamiento con XELJANZ. Debe interrumpirse XELJANZ si un paciente presenta una infección grave, una infección oportunista o sepsis. Un paciente que desarrolle una nueva infección durante el tratamiento con XELJANZ debe someterse rápidamente a pruebas completas de diagnóstico para un paciente con inmunidad comprometida; debe iniciarse la terapia antimicrobiana adecuada y el paciente debe ser monitoreado detalladamente. Tuberculosis Los pacientes deben someterse a evaluaciones y pruebas para infecciones latentes o activas antes de la administración de XELJANZ. También debe considerarse la terapia anti tuberculosis antes de la administración de XELJANZ en pacientes con un historial de tuberculosis latente o activa, en los cuales no se puede confirmar un curso adecuado de tratamiento, y para pacientes con una prueba negativa de tuberculosis latente, pero que tienen factores de riesgo para infección de tuberculosis. Se recomienda la consulta con un médico experto en el tratamiento de tuberculosis para asistir en la decisión de si iniciar la terapia antituberculosis es lo apropiado para ese paciente específico. Debe monitorearse a los pacientes para el desarrollo de indicios y síntomas de tuberculosis, incluidos los pacientes con resultados negativos para infección de tuberculosis latente antes de iniciar la terapia. 8
23 Debe tratarse a los pacientes con tuberculosis latente con terapia antimicobacteriana estándar antes de administrar XELJANZ. Reactivación viral Se observó la reactivación viral, incluidos casos de reactivación del virus herpes (ej.: herpes zóster), en estudios clínicos con XELJANZ. Se desconoce el impacto de XELJANZ en la reactivación de la hepatitis viral crónica. Los pacientes con resultados positivos para hepatitis B o C fueron excluidos de los ensayos clínicos. 5.2 Malignidad y trastorno linfoproliferativo Deben considerarse los riesgos y beneficios del tratamiento con XELJANZ antes de iniciar la terapia en pacientes con una malignidad conocida diferente al cáncer de piel no melanoma (NMSC) y tratado con éxito o cuando se considere continuar XELJANZ en pacientes que desarrollan una malignidad. Se observaron malignidades en estudios clínicos de XELJANZ [vea Reacciones adversas (6.1)]. En los siete estudios clínicos controlados de artritis reumatoide, se diagnosticaron 11 casos de cáncer sólido y uno de linfoma en 3328 pacientes que recibieron XELJANZ con o sin DMARD, en comparación con 0 cánceres sólidos y 0 linfomas en 809 pacientes en el grupo de placebo, con o sin DMARD, durante los 12 primeros meses de exposición. También se han observado linfomas y cánceres sólidos en los estudios de extensión a largo plazo, en pacientes con artritis reumatoide tratados con XELJANZ. En ensayos de la Fase 2B, ensayos controlados con rangos de dosis en pacientes con trasplante renal denovo, todos ellos receptores de terapia de inducción con basiliximab, corticoesteroides de dosis elevada y productos de ácido micofenólico, se observó el trastorno linfoproliferativo postrasplante asociado con el virus de Epstein Barr en 5 de 218 pacientes tratados con XELJANZ (2.3%), en comparación con 0 de 111 pacientes tratados con ciclosporina. 5.3 Perforaciones gastrointestinales Se han reportado eventos de perforación gastrointestinal en estudios clínicos con XELJANZ, en pacientes con artritis reumatoide, aunque se desconoce la función de la inhibición de JAK en estos eventos. Debe utilizarse XELJANZ con precaución en pacientes que pueden correr un mayor riesgo de perforación gastrointestinal (ej.: pacientes con un historial de diverticulitis). Los pacientes que presenten nuevos síntomas abdominales deben ser evaluados con rapidez para la identificación temprana de perforación gastrointestinal [vea Reacciones adversas (6.1)]. 5.4 Parámetros de laboratorio Linfocitos El tratamiento con XELJANZ se asoció con linfocitosis inicial luego de un mes de exposición, seguido de una reducción gradual de los recuentos medios de linfocitos por debajo de la línea base de aproximadamente un 10% durante 12 meses de terapia. Los recuentos de linfocitos inferiores a 500 glóbulos/mm 3 se asociaron con una mayor incidencia de infecciones tratadas y graves. 9
24 Evite iniciar el tratamiento con XELJANZ en pacientes con un recuento bajo de linfocitos (ej.: inferior a 500 glóbulos/mm 3 ). No se recomienda el tratamiento con XELJANZ en pacientes que desarrollen un recuento absoluto y confirmado de linfocitos inferior a 500 glóbulos/mm 3. Monitoree los recuentos de linfocitos en la línea base y cada 3 meses después. Para las modificaciones recomendadas basadas en los recuentos de linfocitos, [vea Dosis y administración (2.3)]. Neutrófilos El tratamiento con XELJANZ estuvo asociado con una mayor incidencia de neutropenia (inferior a 2000 glóbulos/mm 3 ) en comparación con el placebo. Evite iniciar el tratamiento con XELJANZ en pacientes con un recuento bajo de neutrófilos (ej.: ANC inferior a 1000 glóbulos/mm 3 ). Para pacientes que desarrollen un recuento persistente de ANC de glóbulos/mm 3, interrumpa la dosis de XELJANZ hasta que el ANC sea superior o igual a 1000 glóbulos/mm 3. En pacientes que desarrollen un ANC inferior a 500 glóbulos/mm 3, no se recomienda el tratamiento con XELJANZ. Monitoree los recuentos de neutrófilos en la línea base y después de 4 8 semanas de tratamiento, y cada 3 meses después. Para las modificaciones recomendadas basadas en los recuentos de ANC [vea Dosificación y administración (2.3)]. Hemoglobina Evite iniciar el tratamiento con XELJANZ en pacientes con un nivel bajo de hemoglobina (ej.: inferior a 9 g/dl). Debe interrumpirse el tratamiento con XELJANZ en pacientes que desarrollen niveles de hemoglobina inferiores a 8 g/dl o en aquellos cuyo nivel de hemoglobina baje más de 2 g/dl durante el tratamiento. Monitoree la hemoglobina en la línea base y después de 4 8 semanas de tratamiento, y cada 3 meses después. Para las modificaciones recomendadas basadas en los resultados de la hemoglobina [vea Dosificación y administración (2.3)]. Enzimas hepáticas Se ha asociado el tratamiento con XELJANZ con una mayor incidencia de elevación de las enzimas hepáticas en comparación con el placebo. La mayoría de estas anomalías se produjeron en estudios con terapia de fondo con DMARD (principalmente metotrexato). Se recomiendan el monitoreo de rutina de pruebas hepáticas y la investigación pronta de las causas de la elevación de las enzimas hepáticas para identificar los posibles casos de lesión hepática causada por medicamentos. Si se sospecha lesión hepática causada por medicamentos, debe interrumpirse la administración de XELJANZ hasta que se haya excluido este diagnóstico. Lípidos Se ha asociado el tratamiento con XELJANZ con aumentos en los parámetros de lípidos, incluidos el colesterol total, el colesterol de lipoproteína de baja densidad (LDL) y el colesterol de lipoproteína de 10
25 alta densidad (HDL). Se observaron, por lo general, los efectos máximos dentro de 6 semanas. No se ha determinado el efecto de estas elevaciones de parámetros de lípidos en la morbidez y mortalidad cardiovasculares. Debe realizarse una evaluación de los parámetros lípidos aproximadamente 4 8 semanas después de haber iniciado la terapia con XELJANZ. Administre a los pacientes según las pautas clínicas [ej.: Programa Nacional Educativo sobre el Colesterol (NCEP, por sus siglas en inglés)] para la administración de la hiperlipidemia. 5.5 Vacunas No existen datos disponibles sobre la respuesta a la vacunación o la transmisión secundaria de la infección por parte de vacunas de microbios vivos a pacientes que reciben XELJANZ. No deben administrarse vacunas de microbios vivos simultáneamente con XELJANZ. Actualice las vacunas de acuerdo con las pautas actuales antes de iniciar la terapia con XELJANZ. 5.6 Insuficiencia hepática No se recomienda el tratamiento con XELJANZ en pacientes con insuficiencia hepática severa [vea Reacciones adversas (6.1) y Uso en poblaciones específicas (8.6)]. 6 Reacciones adversas Puesto que los estudios clínicos se realizan en condiciones muy variadas, los índices de reacciones adversas observados en los estudios clínicos de un medicamento no pueden compararse directamente con los de los estudios clínicos de otro, y no pueden predecir los índices observados en una población de pacientes más amplia en la práctica clínica. Los siguientes datos incluyen dos ensayos multicéntricos, controlados, doble ciegos de Fase 2 y cinco de Fase 3. En dichos ensayos, los pacientes fueron seleccionados aleatoriamente para monoterapia con dosis de XELJANZ a 5 mg dos veces por día (292 pacientes) y 10 mg dos veces por día (306 pacientes), XELJANZ a 5 mg dos veces por día (1044 pacientes) y 10 mg dos veces por día (1043 pacientes) en combinación con DMARD (incluido metotrexato) y placebo (809 pacientes). Los siete protocolos incluyeron disposiciones para pacientes que tomaban placebo, para que recibieran tratamiento con XELJANZ en el mes 3 o en el mes 6, ya sea por respuesta del paciente (según la actividad de la enfermedad no controlada) o por diseño, para que no se puedan atribuir siempre los eventos adversos ambiguamente a un tratamiento dado. Por lo tanto, algunos de los siguientes análisis incluyen a pacientes que cambiaron de tratamiento por diseño o por la respuesta del paciente, de placebo a XELJANZ, tanto en el grupo de placebo como en el de XELJANZ, de un intervalo dado. Las comparaciones entre el placebo y XELJANZ se basaron en los primeros 3 meses de exposición, y las comparaciones entre XELJANZ 5 mg dos veces por día, y XELJANZ 10 mg dos veces por día se basaron en los 12 primeros meses de exposición. La población de seguridad a largo plazo incluye a todos los pacientes que participaron en un ensayo doble ciego y controlado (incluidos los estudios anteriores de la fase de desarrollo), y luego participaron en uno de los dos estudios de seguridad a largo plazo. El diseño de los estudios de seguridad a largo 11
26 plazo permitió la modificación de las dosis de XELJANZ según el juicio clínico. Esto limita la interpretación de los datos de seguridad a largo plazo en relación con la dosis. 6.1 Experiencia en ensayos clínicos Las reacciones adversas graves más comunes fueron las infecciones graves [vea Advertencias y precauciones (5.1)]. La proporción de pacientes con el tratamiento interrumpido debido a reacciones adversas durante la exposición de 0 a 3 meses en los ensayos controlados con placebo y doble ciegos fue del 4% para los pacientes que tomaban XELJANZ y del 3% para los tratados con placebo. Infecciones generales En los siete ensayos controlados, durante los 0 a 3 meses de exposición, la frecuencia general de infecciones fue del 20% y 22% en los grupos de 5 mg dos veces por día y 10 mg dos veces por día, respectivamente, y del 18% en el grupo de placebo. Las infecciones reportadas más comúnmente con XELJANZ fueron las de las vías respiratorias, nasofaringitis y las infecciones urinarias (en un 4%, 3%, y 2% de los pacientes, respectivamente). Infecciones graves En los siete ensayos controlados, durante los 0 a 3 meses de exposición, se reportaron infecciones graves en 1 paciente (0.5 eventos por 100 años paciente) que recibió placebo y en 11 pacientes (1.7 eventos por 100 años paciente) que recibieron XELJANZ 5 mg o 10 mg dos veces por día. La diferencia de índice entre grupos de tratamiento (y el correspondiente intervalo de confianza del 95%) fue de 1.1 ( 0.4, 2.5) eventos por 100 años paciente para el grupo combinado de XELJANZ 5 mg dos veces por día y 10 mg dos veces por día menos el placebo. En los siete ensayos controlados, durante los 0 a 12 meses de exposición, se reportaron infecciones graves en 34 pacientes (2.7 eventos por 100 años paciente) que recibieron XELJANZ 5 mg dos veces por día y en 33 pacientes (2.7 eventos por 100 años paciente) que recibieron XELJANZ 10 mg dos veces por día. La diferencia de índice entre dosis de XELJANZ (y el correspondiente intervalo de confianza del 95%) fue de 0.1 ( 1.3, 1.2) eventos por 100 años paciente para XELJANZ 10 mg dos veces por día menos 5 mg dos veces por día. Las infecciones graves más comunes incluyeron la neumonía, celulitis, herpes zóster y las infecciones urinarias [vea Advertencias y precauciones (5.1)]. Tuberculosis En los siete ensayos controlados, durante los 0 a 3 meses de exposición, no se reportó tuberculosis en pacientes que recibieron placebo, 5 mg dos veces por día de XELJANZ o 10 mg dos veces por día de XELJANZ. En los siete ensayos controlados, durante los 0 a 12 meses de exposición, se reportó tuberculosis en 0 pacientes que recibieron XELJANZ 5 mg dos veces por día y en 6 pacientes (0.5 eventos por 100 años 12
27 paciente) que recibieron XELJANZ 10 mg dos veces por día. La diferencia de índice entre las dosis de XELJANZ (y el correspondiente intervalo de confianza del 95%), fue 0.5 (0.1, 0.9) eventos por 100 añospaciente para XELJANZ 10 mg dos veces por día menos XELJANZ 5 mg dos veces por día. También se reportaron casos de tuberculosis diseminada. La exposición media a XELJANZ antes del diagnóstico de tuberculosis fue de 10 meses (rango de 152 a 960 días) [vea Advertencias y precauciones (5.1)]. Infecciones oportunistas (excluida la tuberculosis) En los siete ensayos controlados, durante los 0 a 3 meses de exposición, no se reportaron infecciones oportunistas en pacientes que recibieron placebo, XELJANZ 5 mg dos veces por día o XELJANZ 10 mg dos veces por día. En los siete ensayos controlados, durante los 0 a 12 meses de exposición, se reportaron infecciones oportunistas en 4 pacientes (0.3 eventos por 100 años paciente) que recibieron XELJANZ 5 mg dos veces por día y 4 pacientes (0.3 eventos por 100 años paciente) que recibieron XELJANZ 10 mg dos veces por día. La diferencia de índice entre las dosis de XELJANZ (y el correspondiente intervalo de confianza del 95%) fue de 0 ( 0.5, 0.5) eventos por 100 años paciente para XELJANZ 10 mg dos veces por día menos XELJANZ 5 mg dos veces por día. La exposición media a XELJANZ antes del diagnóstico de una infección oportunista fue de 8 meses (rango de 41 a 698 días) [vea Advertencias y precauciones (5.1)]. Malignidad En los siete ensayos controlados, durante los 0 a 3 meses de exposición, se reportaron malignidades excluido el NMSC, en 0 pacientes que recibieron placebo y en 2 pacientes (0.3 eventos por 100 añospaciente) que recibieron XELJANZ 5 mg o 10 mg dos veces por día. La diferencia de índice entre los grupos de tratamiento (y el correspondiente intervalo de confianza del 95%) fue de 0.3 ( 0.1, 0.7) eventos por 100 años paciente para el grupo combinado de XELJANZ 5 mg y 10 mg dos veces por día, menos placebo. En los siete ensayos controlados, durante los 0 a 12 meses de exposición, se reportaron malignidades excluido el NMSC, en 5 pacientes (0.4 eventos por 100 años paciente) que recibieron XELJANZ 5 mg dos veces por día y en 7 pacientes (0.6 eventos por 100 años paciente) que recibieron XELJANZ 10 mg dos veces por día. La diferencia de índice entre dosis de XELJANZ (y el correspondiente intervalo de confianza del 95%) fue de 0.2 ( 0.4, 0.7) eventos por 100 años paciente para XELJANZ 10 mg dos veces por día menos XELJANZ 5 mg dos veces por día. Una de estas malignidades fue un caso de linfoma ocurrido durante el periodo de 0 a 12 meses en un paciente tratado con XELJANZ 10 mg dos veces por día. Los tipos más comunes de malignidad, incluidas las observadas durante la extensión a largo plazo, fueron el cáncer de pulmón y de mama, seguidos del cáncer gástrico, colorrectal, de célula renal, de próstata, linfoma y melanoma maligno [vea Advertencias y precauciones (5.2)]. 13
28 Pruebas de laboratorio Linfocitos En los ensayos clínicos controlados, se produjeron reducciones confirmadas en los recuentos de linfocitos por debajo de 500 glóbulos/mm 3 en un 0.04% de los pacientes para los grupos de XELJANZ 5 mg dos veces por día y 10 mg dos veces por día combinados durante los 3 primeros meses de exposición. Los recuentos de linfocitos confirmados inferiores a 500 glóbulos/mm 3 estuvieron asociados con una incidencia mayor de infecciones tratadas y graves [vea Advertencias y precauciones (5.4)] Neutrófilos En los ensayos clínicos controlados, se produjeron reducciones confirmadas de ANC inferiores a 1000 glóbulos/mm 3 en un 0.07% de los pacientes en los grupos de XELJANZ 5 mg dos veces por día y 10 mg dos veces por día combinados durante los 3 primeros meses de exposición. No se produjeron reducciones confirmadas de ANC inferiores a 500 glóbulos/mm 3 en ningún grupo de tratamiento. No hubo una relación clara entre la neutropenia y la aparición de infecciones graves. En la población de seguridad a largo plazo, el patrón y la incidencia de reducciones confirmadas de ANC permanecieron consistentes con lo que se había visto en los ensayos clínicos controlados [vea Advertencias y precauciones (5.4)]. Pruebas de enzimas hepáticas Se observaron aumentos en enzimas hepáticas superiores al triple del límite superior de lo normal (3x ULN) en pacientes tratados con XELJANZ. En pacientes con elevación de enzimas hepáticas, la modificación del régimen de tratamiento, como por ejemplo la reducción de la dosis de DMARD simultáneos, la interrupción de XELJANZ, o la reducción de la dosis de XELJANZ, dio como resultado la reducción o normalización de enzimas hepáticas. En los ensayos controlados de monoterapia (0 3 meses), no se observaron diferencias en las elevaciones de ALT o AST entre los grupos de placebo, y XELJANZ 5 mg y 10 mg dos veces por día. En los ensayos de fondo controlados con DMARD (0 3 meses), se observaron elevaciones de ALT superiores a 3x ULN en un 1.0%, 1.3% y 1.2% de los pacientes que recibieron placebo, 5 mg, y 10 mg dos veces por día, respectivamente. En estos ensayos, se observaron elevaciones de AST superiores a 3x ULN en un 0.6%, 0.5% y 0.4% de los pacientes que recibieron placebo, 5 mg y 10 mg dos veces por día, respectivamente. Se reportó un caso de lesión hepática causada por medicamentos en un paciente tratado con XELJANZ 10 mg dos veces por día, por aproximadamente 2.5 meses. El paciente desarrolló elevaciones sintomáticas de AST y ALT superiores a 3x ULN y elevaciones de bilirrubina superiores a 2x ULN, que requirieron hospitalización y una biopsia hepática. 14
29 Lípidos En los ensayos clínicos controlados, se observaron elevaciones relacionadas con la dosis en los parámetros de lípidos (colesterol total, colesterol LDL, colesterol HDL, triglicéridos) a un mes de exposición, y permanecieron estables después. Los cambios en los parámetros lípidos durante los 3 primeros meses de exposición en los ensayos clínicos controlados se resumen a continuación: La media de colesterol LDL aumentó en un 15% en el ramo de XELJANZ 5 mg dos veces por día y en un 19% en el ramo de XELJANZ 10 mg dos veces por día. La media de colesterol HDL aumentó en un 10% en el ramo de XELJANZ 5 mg dos veces por día y en un 12% en el ramo de XELJANZ 10 mg dos veces por día. Las razones medias de LDL/HDL permanecieron fundamentalmente sin cambios en pacientes tratados con XELJANZ. En un ensayo clínico controlado, las elevaciones en colesterol LDL y ApoB se redujeron a los niveles anteriores al tratamiento en respuesta a la terapia de estatina. En la población de seguridad a largo plazo, las elevaciones en los parámetros de lípidos permanecieron consistentes con lo que fue observado en los ensayos clínicos controlados. Creatinina en suero En los ensayos clínicos controlados, se observaron elevaciones de creatinina en suero relacionadas con la dosis, con el tratamiento con XELJANZ. El aumento medio de la creatinina en suero fue de <0.1 mg/dl en el análisis de seguridad de los 12 meses agrupados; sin embargo, con el aumento en la duración de la exposición en las extensiones a largo plazo, hasta un 2% de los pacientes tuvieron que interrumpir su tratamiento con XELJANZ debido al criterio de suspensión especificado por el protocolo de un aumento de creatinina en más del 50% de la línea base. Se desconoce el significado clínico de las elevaciones observadas de creatinina en suero. Otras reacciones adversas Las reacciones adversas producidas en un 2% o más de los pacientes con XELJANZ 5 mg dos veces por día o 10 mg dos veces por día y al menos 1% superiores a las observadas en pacientes en placebo con o sin DMARD están resumidas en la Tabla 4. 15
30 Tabla 4: Reacciones adversas producidas en al menos un 2% o más de los pacientes con XELJANZ 5 mg o 10 mg dos veces por día, con o sin DMARD (0 3 meses) y al menos 1% superiores a las observadas en pacientes con placebo XELJANZ 5 mg dos veces por día XELJANZ 10 mg dos veces por día Placebo Término preferido N = 1336 (%) N = 1349 (%) N = 809 (%) Diarrea Nasofaringitis Infecciones de las vías respiratorias superiores Dolor de cabeza Hipertensión N refleja los pacientes aleatorios y tratados de los siete ensayos clínicos Otras reacciones adversas producidas en estudios de extensión controlados y de etiqueta abierta incluyeron: Trastornos del sistema sanguíneo y linfático: anemia Trastornos del metabolismo y la nutrición: deshidratación Trastornos psiquiátricos: insomnio Trastornos del sistema nervioso: parestesia Trastornos respiratorios, torácicos y mediastinales: disnea, tos, congestión nasal Trastornos gastrointestinales: dolor abdominal, dispepsia, vómitos, gastritis, náusea Trastornos hepatobiliares: esteatosis hepática Trastornos del tejido cutáneo y subcutáneo: sarpullido, eritema, prurito Trastornos del sistema musculoesquelético, tejido conectivo y óseo: dolor musculoesquelético, artralgia, tendinitis, hinchazón de las articulaciones Trastornos generales y condiciones de administración de la zona: pirexia, fatiga, edema periférico 16
31 7 Interacción con otros medicamentos 7.1 Inhibidores potentes de CYP3A4 La exposición a tofacitinib aumenta cuando XELJANZ se coadministra con inhibidores potentes de citocromo P450 (CYP) 3A4 (ej.: quetoconazol) [vea Dosificación y administración (2.1) y la Figura 3]. 7.2 Inhibidores moderados de CYP3A4 y potentes de CYP2C19 La exposición a tofacitinib aumenta cuando XELJANZ se coadministra con medicamentos que provocan la inhibición moderada de CYP3A4 y la inhibición potente de CYP2C19 (ej.: fluconazol) [vea Dosificación y administración (2.1) y la Figura 3]. 7.3 Inductores potentes de CYP3A4 La exposición a tofacitinib disminuye cuando XELJANZ se coadministra con inductores potentes de CYP3A4 (ej.: rifampina) [vea Dosificación y administración (2.1) y la Figura 3]. 7.4 Medicamentos inmunosupresores Existe riesgo de mayor inmunosupresión cuando se coadministra XELJANZ con medicamentos inmunosupresores potentes (ej.: azatioprina, tacrolimo, ciclosporina). El uso combinado de múltiples dosis de XELJANZ con inmunosupresores potentes no se ha estudiado en la artritis reumatoide. 8 Uso en poblaciones específicas 8.1 Embarazo Efectos teratogénicos: Embarazo de categoría C. No existen estudios adecuados ni debidamente controlados en mujeres embarazadas. Debe usarse XELJANZ durante el embarazo solamente si el posible beneficio justifica el riesgo potencial para el feto. Tofacitinib ha demostrado ser fetocida y teratogénico en ratas y conejos cuando fue administrado a exposiciones 146 veces y 13 veces, respectivamente, superiores a la dosis humana máxima recomendada (MRHD, por sus siglas en inglés). En un estudio de desarrollo embriofetal en ratas, el tofacitinib fue teratogénico a niveles de exposición aproximadamente 146 veces superiores a la MRHD (con carácter AUC y dosis orales de 100 mg/kg/día). Los efectos teratogénicos consistieron en deformaciones del tejido externo y blando de anasarca, defectos septales ventriculares membranosos, respectivamente, y deformaciones o variaciones esqueléticas (arco cervical ausente; fémur, fíbula, húmero, radio, escápula, tibia y cúbito doblados; esternósquisis; costilla ausente; fémur desplazado; costilla con rama; costillas fusionadas; esternebra fusionada y centro torácico hemicéntrico). Además, se produjo un aumento de pérdida post implante, formada por resorciones tempranas y tardías, resultantes en un menor número de fetos viables. Se redujo el peso corporal medio del feto. No se ha observado toxicidad del desarrollo en ratas a niveles de exposición 58 veces superiores a la MRHD (con carácter AUC y dosis orales de 30 mg/kg/día). En el estudio de desarrollo embriofetal en conejos, tofacitinib fue teratogénico a niveles de exposición 17
32 aproximadamente 13 veces superiores a la MRHD (con carácter AUC y dosis orales de 30 mg/kg/día) en ausencia de indicios de toxicidad materna. Los efectos teratogénicos incluyeron la toracogastroquisis, onfalocele, defectos septales ventriculares membranosos y deformaciones craneales/esqueléticas (microstomía, microftalmía), defectos de línea media y de cola. Asimismo, se produjo un aumento de la pérdida post implante con resorciones tardías. No se observó toxicidad en el desarrollo en conejos a niveles de exposición aproximadamente 3 veces superiores a la MRHD (con carácter AUC y dosis orales de 10 mg/kg/día). Efectos no teratogénicos: En un estudio peri y postnatal en ratas, se produjeron reducciones en el tamaño de las crías vivas, supervivencia postnatal, y peso corporal de las crías a niveles de exposición aproximadamente 73 veces superiores a la MRHD (con carácter AUC y dosis orales de 50 mg/kg/día). No se registraron efectos en las evaluaciones de la conducta y del aprendizaje, la madurez sexual o la habilidad de las ratas de la generación F1 para reproducirse y producir fetos viables de generación F2 de ratas a niveles de exposición aproximadamente 17 veces superiores a la MRHD (con carácter AUC y dosis orales de 10 mg/kg/día). Registro del embarazo: Para monitorear los resultados de las embarazadas expuestas a XELJANZ, se ha establecido un registro de embarazo. Se exhorta a los médicos a registrar a las pacientes y a que las embarazadas se registren llamando al Madres lactantes Tofacitinib fue expulsado en la leche de ratas lactantes. No se sabe si tofacitinib se excreta en la leche materna humana. Puesto que muchos medicamentos se excretan en la leche materna y debido al potencial de reacciones adversas graves de tofacitinib en bebés lactantes, debe tomarse una decisión sobre si interrumpir la lactancia o el medicamento, teniendo en cuenta la importancia del medicamento para la madre. 8.4 Uso pediátrico No se ha establecido la seguridad y la eficacia de XELJANZ en pacientes pediátricos. 8.5 Uso geriátrico De los 3315 pacientes inscritos en los Estudios I a V, un total de 505 pacientes con artritis reumatoide tenían 65 años de edad o más, incluidos 71 pacientes de 75 años de edad o más. La frecuencia de infecciones graves en los sujetos tratados con XELJANZ de 65 años de edad o mayores fue superior a la ocurrida en los menores de 65 años. Puesto que existe una mayor incidencia de infecciones en la población de edad avanzada en general, debe procederse con cuidado cuando se trate a personas de edad avanzada. 8.6 Insuficiencia hepática No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve. Debe reducirse la dosis de XELJANZ 5 mg una vez al día en pacientes con insuficiencia hepática moderada. No se ha estudiado la seguridad y eficacia de XELJANZ en pacientes con insuficiencia hepática severa o en pacientes con 18
33 serología positiva de virus de hepatitis B o C [vea Dosificación y administración (2.1) y Advertencias y precauciones (5.6)]. 8.7 Insuficiencia renal No se requiere ajuste de dosis en pacientes con insuficiencia renal leve. Debe reducirse la dosis de XELJANZ 5 mg una vez al día en pacientes con insuficiencia renal moderada y severa [vea Dosificación y administración (2.1)]. En ensayos clínicos, XELJANZ no se evaluó en pacientes con artritis reumatoide con valores iniciales de eliminación de creatinina de línea base (estimados por la ecuación Cockroft Gault) inferiores a 40 ml/min. 10 Sobredosis Indicios, síntomas y resultados de laboratorio de sobredosis aguda en humanos No hay experiencia de sobredosis de XELJANZ. Tratamiento o manejo de la sobredosis Los datos farmacocinéticos hasta (e incluyendo) una dosis única de 100 mg en voluntarios sanos indican que se espera que más del 95% de la dosis administrada se elimine dentro de 24 horas. No existe un antídoto específico para la sobredosis de XELJANZ. En caso de sobredosis, se recomienda que el paciente sea monitoreado para indicios y síntomas de reacciones adversas. Los pacientes que desarrollen reacciones adversas deben recibir tratamiento apropiado. 11 Descripción XELJANZ es la sal citrato de tofacitinib, un inhibidor de JAK. El citrato de tofacitinib es un polvo blanco o blanquecino con el siguiente nombre químico: (3R,4R) 4 metilo 3 (metilo 7H pirrolo [2,3 d]pirimidina 4 ilaminio) ßoxo 1 piperidinapropanonitrilo, 2 hidroxi 1,2,3 propanetricarboxilato (1:1). Se disuelve libremente en agua. El citrato de tofacitinib posee un peso molecular de Daltons (o Daltons como la base libre de tofacitinib) y una fórmula molecular de C 16 H 20 N 6 O C 6 H 8 O 7. La estructura química del citrato de tofacitinib es: Me Me N N N N H N N O HO 2 C HO 2 C OH CO 2 H 19
34 XELJANZ se suministra para administración oral como tableta de tofacitinib de 5 mg (equivalente a 8 mg de citrato de tofacitinib) de color blanco y redonda, cubierta con una película de liberación inmediata. Cada tableta de XELJANZ contiene la cantidad adecuada de XELJANZ como sal de citrato y los siguientes ingredientes inactivos: celulosa microcristalina, monohidrato de lactosa, sodio de croscarmelosa, estearato de magnesio, HPMC 2910/Hipromelosa 6cP, dióxido de titanio, macrogol/peg3350 y triacetina. 12 Farmacología clínica 12.1 Mecanismo de acción Tofacitinib es un inhibidor de cinasa de Janus (JAK). Las JAK son enzimas intracelulares que transmiten señales producidas por la citoquina, o interacciones del receptor del factor de crecimiento en la membrana celular, para influenciar los procesos celulares de la hematopoyesis y la función de las células inmunes. En cuanto a señalización, las JAK fosforilizan y activan los Transductores de Señal y Activadores de Transcripción (STAT, por sus siglas en inglés), los cuales modulan la actividad intracelular, incluida la expresión genética. El tofacitinib modula la vía de señalización en el punto de las JAK, evitando la fosforilización y activación de los STAT. Las enzimas JAK transmiten la señal de citoquina por medio del emparejamiento de JAK (por ejemplo, JAK1/JAK3, JAK1/JAK2, JAK1/TyK2, JAK2/JAK2). El tofacitinib inhibió las actividades in vitro de las combinaciones de JAK1/JAK2, JAK1/JAK3 y JAK2/JAK2 con IC 50 de 406, 56, y 1377 nm, respectivamente. No obstante, se desconoce la relevancia de combinaciones específicas de JAK y su efectividad terapéutica Farmacodinámica El tratamiento con XELJANZ se asoció con reducciones dependientes de la dosis de células letales naturales en circulación CD16/56+, con reducciones máximas estimadas, producidas aproximadamente a las 8 10 semanas después del inicio de la terapia. Estos cambios generalmente se resuelven dentro de 2 a 6 semanas después de la interrupción del tratamiento. El tratamiento con XELJANZ se asoció con aumentos dependientes de la dosis en los recuentos de células B. Los cambios en el recuento de linfocitos T circulantes y subconjuntos de linfocitos T (CD3+, CD4+ y CD8+) fueron pequeños e inconsistentes. Se desconoce el significado clínico de dichos cambios. Los niveles séricos totales de IgG, IgM e IgA después de una dosis de 6 meses en pacientes con artritis reumatoide, fueron inferiores a los de placebo; sin embargo, los cambios fueron pequeños y no dependieron de la dosis. Después del tratamiento con XELJANZ en pacientes con artritis reumatoide, se observaron reducciones rápidas de la proteína C reactiva en suero (CRP, por sus siglas en inglés) y se mantuvieron durante toda la dosis. Los cambios en CRP observados con el tratamiento con XELJANZ no se revirtieron completamente dentro de 2 semanas después de haber interrumpido el tratamiento, lo cual indica una mayor duración de actividad farmacodinámica, en comparación con la media vida farmacocinética Farmacocinética Tras la administración oral de XELJANZ, se logran concentraciones máximas de plasma dentro de hora; la media vida de eliminación es de ~3 horas y se observó un aumento proporcional a la dosis en 20
35 exposición sistémica en el rango de dosis terapéutica. Se logran concentraciones de equilibrio en horas con una acumulación insignificante, luego de la administración dos veces por día. Absorción La biodisponibilidad oral absoluta del tofacitinib es del 74%. La coadministración de XELJANZ con una comida alta en grasas no dio como resultado cambios en AUC, mientras que la C máx se redujo en un 32%. En ensayos clínicos, se administró XELJANZ sin tener en cuenta las comidas. Distribución Tras la administración intravenosa, el volumen de distribución es de 87 L. El enlace a proteínas del tofacitinib es de ~40%. Tofacitinib se enlaza predominantemente a la albúmina y no parece enlazarse a la glicoproteína a1 ácido. Tofacitinib se distribuye uniformemente entre los glóbulos rojos y el plasma. Metabolismo y eliminación Los mecanismos de eliminación para tofacitinib son aproximadamente de un 70% de metabolismo hepático y de un 30% de excreción renal del medicamento principal. El metabolismo de tofacitinib está mediado, principalmente, por el CYP3A4 con una contribución pequeña de CYP2C19. En un estudio radioetiquetado en humanos, más del 65% de la radiactividad circulante total estuvo causada por el tofacitinib sin cambios, mientras que el 35% restante se atribuyó a 8 metabolitos, cada uno de los cuales causó menos del 8% de la radiactividad total. La actividad farmacológica del tofacitinib se atribuye a la molécula principal. Farmacocinética en pacientes con artritis reumatoide El análisis farmacocinético de la población en pacientes con artritis reumatoide no indicó cambios clínicamente relevantes en la exposición a tofacitinib, después de tener en cuenta las diferencias en la función renal (ej.: eliminación de creatinina) entre pacientes, según la edad, peso, sexo y raza (Figura 1). Se observó una relación aproximadamente lineal entre el peso corporal y el volumen de distribución, resultando en concentraciones máximas más elevadas (C máx ) y concentraciones mínimas más bajas (C mín ) en pacientes con menor peso. No obstante, esta diferencia no se considera clínicamente relevante. La variabilidad entre sujetos (% del coeficiente de variación) en el AUC de tofacitinib es de aproximadamente 27%. Poblaciones específicas El efecto de la insuficiencia renal y hepática y otros factores intrínsecos en la farmacocinética de tofacitinib se muestra en la Figura 1. 21
36 Figura 1: Impacto de factores intrínsecos en la farmacocinética de Tofacitinib Factor intrínseco Farm. Razón e IC del 90% Recomendación Peso = 40 kg AUC Cmáx Sin ajuste de dosis Peso = 140 kg AUC Cmáx Sin ajuste de dosis Edad = 80 años AUC Cmáx Sin ajuste de dosis Mujer AUC Cmáx Sin ajuste de dosis Asiático AUC Cmáx Sin ajuste de dosis Negro AUC Cmáx Sin ajuste de dosis Hispano AUC Sin ajuste de dosis Cmáx Insuficiencia renal (Leve) Insuficiencia renal (Moderada) Insuficiencia renal (Severa) Insuficiencia hepática (Leve) Insuficiencia hepática (Moderada) AUC Cmáx AUC Cmáx AUC Cmáx AUC Cmáx AUC Cmáx Sin ajuste de dosis Reducir la dosis a 5 mg una vez al día Reducir la dosis a 5 mg una vez al día* Sin ajuste de dosis Reducir la dosis a 5 mg una vez al día Razón en relación con la referencia * No son necesarias dosis suplementarias en pacientes después de la diálisis. Los valores de referencia para comparaciones de peso, edad, sexo y raza son de 70 kg, 55 años, varón y blanco, respectivamente; los grupos de referencia para datos de insuficiencia renal y hepática son sujetos con función normal renal y hepática. Interacción con otros medicamentos Potencial de que XELJANZ ejerza influencia en la farmacocinética de otros medicamentos Los estudios in vitro indican que el tofacitinib no inhibe significativamente ni induce la actividad de los principales CYP metabolizadores de medicamentos en los humanos (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 y CYP3A4) a concentraciones 185 veces superiores a las concentraciones de equilibrio C máx de una dosis de 5 mg dos veces por día. Estos resultados in vitro fueron confirmados 22
37 por un estudio de interacción con otros medicamentos en humanos y no mostraron cambios en la farmacocinética de midazolam, un substrato altamente sensible CYP3A4, cuando se coadministró con XELJANZ. En pacientes con artritis reumatoide, la eliminación oral de tofacitinib no varía con el paso del tiempo, lo cual indica que tofacitinib no normaliza la actividad de enzimas CYP en pacientes con artritis reumatoide. Por lo tanto, no se espera que la coadministración con XELJANZ dé como resultado aumentos clínicamente relevantes en el metabolismo de substratos CYP en pacientes con artritis reumatoide. Los datos in vitro indican que el potencial de que tofacitinib inhiba transportadores tales como la P glicoproteína, o transportadores orgánicos aniónicos o catiónicos en concentraciones terapéuticas es bajo. Las recomendaciones de dosificación para medicamentos coadministrados luego de la administración de XELJANZ se muestran en la Figura 2. Figura 2: Impacto de XELJANZ en la farmacocinética de otros medicamentos Medicamento coadministrado Metotrexato Substrato CYP3A Midazolam Anticonceptivos orales Levonorgestrel Etinilestradiol Substrato OCT y MATE Metformina Farm. Razón e IC del 90% Recomendación AUC Cmáx AUC Cmáx AUC Cmáx AUC Cmáx AUC Cmáx Sin ajuste de dosis Sin ajuste de dosis para substratos CYP3A tales como midazolam Sin ajuste de dosis Sin ajuste de dosis Sin ajuste de dosis Razón en relación con la referencia Nota: El grupo de referencia es la administración de medicamentos concomitantes solamente; OCT = Transportador Orgánico Catiónico; MATE = Extrusión Multimedicamento y Compuestos Tóxicos Potencial de que otros medicamentos ejerzan influencia en la farmacocinética de tofacitinib 23
38 Puesto que el tofacitinib es metabolizado por CYP3A4, es probable la interacción con otros medicamentos que inhiben o inducen CYP3A4. Los inhibidores de CYP2C19 solo o de la P glicoproteína probablemente no alterarán sustancialmente la farmacocinética del tofacitinib. Las recomendaciones de dosis para XELJANZ para administración con inhibidores o inductores de CYP se muestran en la Figura 3. Figura 3: Impacto de otros medicamentos en la farmacocinética de XELJANZ Medicamento coadministrado Inhibidor de CYP3A Quetoconazol Inhibidor de CYP3A y CYP2C19 Fluconazol Inductor CYP Rifampina Metotrexato Tacrolimo Ciclosporina Farm. Razón e IC del 90% Recomendación AUC Cmáx AUC Cmáx AUC Cmáx AUC Cmáx AUC Cmáx AUC Cmáx Reducir la dosis de XELJANZ a 5 mg una vez por día Reducir la dosis de XELJANZ a 5 mg una vez por día Puede reducir la eficacia Sin ajuste de dosis Hay riesgo de inmunosupresión si se toma XELJANZ con Tacrolimo Hay riesgo de inmunosupresión si se toma XELJANZ con Ciclosporina Razón en relación con la referencia Nota: El grupo de referencia es la administración de tofacitinib solo. 13 Toxicología no clínica 13.1 Carcinogénesis, mutagénesis y deterioro de la fertilidad En un estudio de toxicología de 39 semanas, realizado con monos, el tofacitinib a niveles de exposición aproximadamente 6 veces superiores a la MRHD (con carácter AUC y dosis orales de 5 mg/kg dos veces por día) produjo linfomas. No se observaron linfomas en este estudio a niveles de exposición 1 vez superior a la MRHD (con carácter AUC y dosis orales de 1 mg/kg dos veces por día). Se evaluó el potencial carcinogénico del tofacitinib en estudios de carcinogenicidad de 6 meses en ratones transgénicos rash2 y en estudios de carcinogenicidad de 2 años en ratas. El tofacitinib, en 24
39 niveles de exposición aproximadamente 34 veces superiores a la MRHD (con carácter AUC y dosis orales de 200 mg/kg/día) no resultó carcinogénico en ratones. En el estudio de carcinogenicidad oral de 24 meses en ratas Sprague Dawley, el tofacitinib causó tumores de células de Leydig benignos, hibernomas (malignidad de tejido adiposo marrón), y timomas benignos en dosis superiores o iguales a 30 mg/kg/día (aproximadamente 42 veces superiores a los niveles de exposición con la MRHD con carácter AUC). Se desconoce si existe el riesgo de que aparezcan los tumores de células de Leydig benignos en humanos. Tofacitinib no fue mutagénico en el ensayo de mutación inversa bacteriana. Dio positivo para clastogenicidad en el ensayo de aberración cromosomática in vitro con linfocitos humanos en presencia de enzimas metabólicas, pero negativo en ausencia de enzimas metabólicas. El tofacitinib fue negativo en el ensayo micronucléico in vivo en ratas y en el ensayo in vitro CHO HGPRT, así como en el ensayo de síntesis de ADN no programada de hepatocitos in vivo en ratas. En ratas, tofacitinib en niveles de exposición aproximadamente 17 veces superiores a la MRHD (con carácter AUC y dosis orales de 10 mg/kg/día) redujo la fertilidad en las hembras debido al aumento de la pérdida posterior al implante. No se registró deterioro de la fertilidad de las ratas hembra en niveles de exposición a tofacitinib iguales a la MRHD (con carácter AUC y dosis orales de 1 mg/kg/día). Los niveles de exposición a tofacitinib aproximadamente 133 veces superiores a la MRHD (con carácter AUC y dosis orales de 100 mg/kg/día) no tuvieron efecto en la fertilidad de los varones, en la movilidad del esperma ni en la concentración del mismo. 14 Estudios clínicos El programa de desarrollo clínico de XELJANZ incluyó dos ensayos de rango de dosis y cinco ensayos confirmatorios. Ensayos de rango de dosis La selección de las dosis de XELJANZ se basó en dos ensayos fundamentales con rango de dosis. El Estudio 1 con Rango de Dosis fue un ensayo de monoterapia de 6 meses de duración en 384 pacientes con artritis reumatoide activa que presentaron una respuesta inadecuada a un DMARD. Se excluyó a los pacientes que habían recibido anteriormente terapia de adalimumab. Se seleccionó aleatoriamente a los pacientes para 1 de 7 tratamientos de monoterapia: XELJANZ a 1, 3, 5, 10 o 15 mg dos veces por día, adalimumab a 40 mg subcutáneamente cada dos semanas por 10 semanas, seguido de XELJANZ 5 mg dos veces por día por 3 meses o placebo. El Estudio 2 con Rango de Dosis fue un ensayo de 6 meses de duración en el cual 507 pacientes con artritis reumatoide activa, que presentaron una respuesta inadecuada a MTX solamente, recibieron uno de 6 regímenes de dosis de XELJANZ (20 mg una vez por día; 1, 3, 5, 10 o 15 mg dos veces por día), o placebo agregado al MTX de fondo. Los resultados de los pacientes tratados con XELJANZ que lograron respuestas ACR20 en los Estudios 1 y 2 y se muestran en la Figura 4. Si bien se observó una relación entre la dosis y la respuesta en el Estudio 1, la proporción de pacientes con una respuesta ACR20 no difieren claramente entre los que tomaron la dosis de 10 mg y los que tomaron la de 15 mg. Además, una proporción menor de pacientes respondió a 25
40 la monoterapia de adalimumab en comparación con los tratados con dosis de 3 mg de XELJANZ dos veces por día y mayores. En el Estudio 2, una proporción menor de pacientes logró una respuesta ACR20 en los grupos de placebo y de XELJANZ a 1 mg, en comparación con los pacientes tratados con otras dosis de XELJANZ. Sin embargo, no se produjo diferencia en la proporción de respuestas entre los pacientes tratados con dosis de XELJANZ de 3, 5, 10, 15 mg dos veces por día, o 20 mg una vez por día. Figura 4: Proporción de pacientes con respuesta ACR20 en el tercer mes, en Estudios 1 y 2 con Rango de Dosis Estudio 1 Estudio 2 % de pacientes con respuesta ACR20 * XELJANZ dos veces por día con dosis en mg, salvo 20 mg, que es una dosis una vez al día en mg. PBO es placebo; ADA es adalimumab, en inyección subcutánea de 40 mg, cada dos semanas. Ensayos confirmatorios El Estudio I fue un ensayo de monoterapia de 6 meses de duración en el cual 610 pacientes con artritis reumatoide activa de moderada a severa, que habían tenido una respuesta inadecuada a un DMARD (no biológico o biológico), recibieron XELJANZ 5 o 10 mg dos veces por día, o placebo. En la visita del tercer mes, todos los pacientes seleccionados aleatoriamente para el tratamiento con placebo fueron trasladados de forma ciega a un segundo tratamiento predeterminado con XELJANZ 5 o 10 mg dos veces por día. Los criterios de valoración primarios en el mes 3 fueron la proporción de pacientes que lograron respuestas ACR20, los cambios en el Cuestionario de Evaluación de la Salud Índice de Discapacidad (HAQ DI), y tasas de Puntaje de Actividad de Enfermedad DAS28 4(ESR) inferiores a 2.6. El Estudio II fue un ensayo de 12 meses en el cual 792 pacientes con artritis reumatoide activa de moderada a severa, que habían tenido una respuesta inadecuada a un DMARD no biológico, recibieron XELJANZ 5 o 10 mg dos veces por día o placebo agregado a un tratamiento con DMARD de fondo 26
41 (excluidos los tratamientos con potentes inmunosupresores tales como la azatioprina o la ciclosporina). En la visita del mes 3, los pacientes que no presentaron respuesta pasaron de modo ciego a un segundo tratamiento predeterminado de XELJANZ 5 o 10 mg dos veces por día. Al final del mes 6, todos los pacientes de placebo pasaron a su segundo tratamiento predeterminado de modo ciego. Los criterios de valoración primarios fueron la proporción de pacientes que lograron una respuesta ACR20 en el mes 6, los cambios en HAQ DI en el mes 3, y tasas de DAS28 4(ESR) inferiores a 2.6 en el mes 6. El Estudio III fue un ensayo de 12 meses efectuado en 717 pacientes con artritis reumatoide activa de moderada a severa, que mostraron una respuesta inadecuada a MTX. Los pacientes recibieron XELJANZ 5 o 10 mg dos veces por día, adalimumab 40 mg subcutáneamente cada dos semanas o placebo agregado a MTX de fondo. Los pacientes de placebo pasaron a otros tratamientos como en el Estudio II. Los criterios de valoración primarios fueron la proporción de pacientes que lograron una respuesta ACR20 en el mes 6, HAQ DI en el mes 3, y DAS28 4(ESR) inferior a 2.6 en el mes 6. El Estudio IV es un ensayo continuado de 2 años con un análisis planificado una vez cumplido el primer año, en el cual 797 pacientes con artritis reumatoide activa de moderada a severa, que mostraron una respuesta inadecuada a MTX, recibieron XELJANZ 5 o 10 mg dos veces por día, o placebo agregado al MTX de fondo. Los pacientes con placebo pasaron a otros tratamientos al igual que en el Estudio II. Los criterios de valoración primarios fueron la proporción de pacientes que lograron una respuesta ACR20 en el mes 6, el cambio medio con respecto al valor inicial en el índice total de la escala Van der Heijde Sharp modificado (mtss) en el mes 6, HAQ DI en el mes 3, y DAS28 4(ESR) inferior a 2.6 en el mes 6. El Estudio V fue un ensayo de 6 meses en el cual 399 pacientes con artritis reumatoide activa de moderada a severa, que mostraron una respuesta inadecuada a al menos un agente biológico inhibidor de TNF aprobado, recibieron XELJANZ 5 o 10 mg dos veces por día, o placebo agregado al MTX de fondo. En la visita del mes 3, todos los pacientes seleccionados aleatoriamente para tratamiento con placebo pasaron de modo ciego a un segundo tratamiento predeterminado de XELJANZ 5 o 10 mg dos veces por día. Los criterios de valoración primarios en el mes 3 fueron la proporción de pacientes que lograron una respuesta ACR20, HAQ DI, y DAS28 4(ESR) inferior a 2.6. Respuesta clínica Los porcentajes de pacientes tratados con XELJANZ que lograron respuestas ACR20, ACR50, y ACR70 en los Estudios I, IV y V se muestran en la Tabla 5. Se observaron resultados similares en los Estudios II y III. En todos los ensayos, los pacientes tratados con dosis de 5 o 10 mg dos veces por día de XELJANZ tuvieron mayores índices de respuestas ACR20, ACR50 y ACR70 que los que tomaron placebo, con o sin tratamiento con DMARD de fondo, en el mes 3 y en el mes 6. Se observaron mayores índices de respuesta ACR20 a las 2 semanas en comparación con el placebo. En los ensayos de 12 meses, los índices de respuesta de ACR en pacientes tratados con XELJANZ fueron consistentes a los 6 y 12 meses. 27
42 Tabla 5: Proporción de pacientes con respuesta ACR Porcentaje depacientes Estudio I Estudio IV Estudio V Monoterapia en pacientes con respuesta inadecuada a DMARD no biológico o biológico c PBO XELJANZ 5 mg dos veces por día XELJANZ 10 mg dos veces por día Pacientes con respuesta inadecuada a MTX d PBO + MTX XELJANZ 5 mg dos veces por día + MTX XELJANZ 10 mg dos veces por día + MTX Pacientes con respuesta inadecuada a inhibidor de TNF e PBO + MTX XELJANZ 5 mg dos veces por día + MTX XELJANZ 10 mg dos veces por día + MTX N a ACR20 Mes 3 Mes % 59% NA b 69% % 70% % 25% % 50% % 62% % NA % 51% % 54% ACR50 Mes 3 Mes 6 12% NA 31% 42% 36% 46% 8% 9% 29% 32% 37% 44% 8% NA 26% 37% 28% 30% ACR70 Mes 3 Mes 6 6% NA 15% 22% 20% 29% 3% 1% 11% 14% 17% 23% 2% NA 14% 16% 10% 16% a N es el número de pacientes seleccionados aleatoriamente y tratados. b NA No aplicable, puesto que los datos sobre el tratamiento con un placebo no están disponibles más allá de los 3 meses en los Estudios I y V, debido al cambio de los pacientes con placebo. c Respuesta inadecuada a, al menos, un DMARD (biológico o no biológico), debida a la falta de eficacia o toxicidad. d Respuesta inadecuada a MTX definida como la presencia de suficiente actividad de enfermedad residual para cumplir con los criterios de entrada. e Respuesta inadecuada a, al menos, un inhibidor de TNF, debida a la falta de eficacia e/o intolerancia. En el Estudio IV, una mayor proporción de pacientes tratados con XELJANZ 5 mg o 10 mg dos veces por día más MTX logró un nivel bajo de actividad de la enfermedad, según lo medido por un DAS28 4(ESR) inferior a 2.6 a los 6 meses, en comparación con los tratados solamente con MTX (Tabla 6). 28
43 Tabla 6: Proporción de pacientes con DAS28 4(ESR) inferior a 2.6 con número de articulaciones activas residuales Estudio IV DAS28 4(ESR) inferior a 2.6 Placebo + MTX XELJANZ 5 mg dos veces por día + MTX XELJANZ 10 mg dos veces por día + MTX Proporción de pacientes con respuesta en el mes 6 (n) De los pacientes con respuesta, proporción con 0 articulaciones activas (n) De los pacientes con respuesta, proporción con 1 articulación activa (n) De los pacientes con respuesta, proporción con 2 articulaciones activas (n) De los pacientes con respuesta, proporción con 3 articulaciones activas o más (n) % (2) 6% (19) 13% (42) 50% (1) 42% (8) 36% (15) 0 5% (1) 17% (7) 0 32% (6) 7% (3) 50% (1) 21% (4) 40% (17) Los resultados de los componentes de los criterios de respuesta de ACR para el Estudio IV se muestran en la Tabla 7. Se observaron resultados similares en los Estudios I, II, III y V. Tabla 7: Componentes de respuesta de ACR a los 3 meses Estudio IV XELJANZ XELJANZ 5 mg 10 mg dos veces por día + dos veces por día + MTX MTX Placebo + MTX Componente (media) a N=321 Línea Mes 3 a base N=316 Línea Mes 3 a base N=160 Línea Mes 3 a base Número de articulaciones adoloridas (0 68) Número de articulaciones hinchadas (0 66) 24 (14) 14 (8) 13 (14) 6 (8) 23 (15) 14 (8) 10 (12) 6 (7) 23 (13) 14 (9) 18 (14) 10 (9) Dolor b 58 (23) 34 (23) 58 (24) 29 (22) 55 (24) 47 (24) Evaluación global del paciente b 58 (24) 35 (23) 57 (23) 29 (20) 54 (23) 47 (24) 29
44 Índice de discapacidad (HAQ DI) c 1.41 (0.68) 0.99 (0.65) 1.40 (0.66) 0.84 (0.64) 1.32 (0.67) 1.19 (0.68) Evaluación global del médico b 59 (16) 30 (19) 58 (17) 24 (17) 56 (18) 43 (22) CRP (mg/l) 15.3 (19.0) 7.1 (19.1) 17.1 (26.9) 4.4 (8.6) 13.7 (14.9) 14.6 (18.7) a Los datos mostrados son la media (Desviación Estándar) en el mes 3. b Escala visual analógica: 0 = mejor, 100 = peor. c Índice de Discapacidad en el Cuestionario de Evaluación de la Salud: 0 = mejor, 3 = peor; 20 preguntas; categorías: vestirse y asearse, levantarse, comer, caminar, higiene, alcance, agarre y actividades. El porcentaje de pacientes con respuesta ACR20 por visita para el Estudio IV se muestra en la Figura 5. Se observaron respuestas similares en los Estudios I, II, III y V. Figura 5: Porcentaje de pacientes con respuesta ACR20 por visita para el Estudio IV Se utilizó imputación de pacientes sin repuesta. Los pacientes que se retiraron del estudio fueron contados como fracasos, al igual que aquéllos que no presentaron al menos un 20% de mejora en los recuentos de la articulación al Mes 3. 30
45 Respuesta de función física La mejora en la función física se midió con el HAQ DI. Los pacientes que recibieron XELJANZ 5 y 10 mg dos veces por día demostraron una mayor mejora de la línea base en función física, en comparación con los de placebo, en el mes 3. La diferencia media (IC del 95%) del placebo en mejora HAQ DI de la línea base en el mes 3 en el Estudio III fue de 0.22 ( 0.35, 0.10) en pacientes que recibieron 5 mg de XELJANZ dos veces por día y 0.32 ( 0.44, 0.19) en pacientes que recibieron 10 mg XELJANZ dos veces por día. Se obtuvieron resultados similares en los Estudios I, II, IV y V. En los ensayos de 12 meses, los resultados HAQ DI en pacientes tratados con XELJANZ fueron consistentes a los 6 y 12 meses. 16 Cómo se suministra, almacenamiento y manejo XELJANZ se proporciona en tabletas de 5 mg de tofacitinib (equivalente a 8 mg de citrato de tofacitinib): Tabletas blancas, redondas, con película de liberación inmediata, con la palabra Pfizer por una cara y JKI 5 por la otra y disponibles en: Frascos de 28: NDC Frascos de 60: NDC Frascos de 180: NDC Almacenamiento y manejo Guárdelo entre 20 C y 25 C (68 F y 77 F). [Vea Temperatura ambiente controlada por la Farmacopea de los Estados Unidos]. No vuelva a envasarlos. 17 Información de asesoramiento para el paciente Vea la etiqueta para pacientes aprobada por la FDA (Guía del medicamento). Informe a los pacientes de la existencia de una Guía del medicamento, e indíqueles que deben leerla antes de tomar XELJANZ. Indique a los pacientes que deben tomar XELJANZ solamente como se les recetó. La etiqueta de este producto puede haber sido actualizada. Para información actualizada completa para la prescripción, visite LAB
46 Guía del medicamento XELJANZ (tofacitinib) Lea esta Guía del medicamento antes de comenzar a tomar XELJANZ y cada vez que obtenga un nuevo surtido. Puede que exista nueva información. Esta Guía del medicamento no es sustituto de una conversación con su profesional del cuidado de la salud sobre su condición médica o tratamiento. Cuál es la información más importante que debo saber sobre XELJANZ? XELJANZ puede causar efectos secundarios graves, incluyendo: 1. Infecciones graves. XELJANZ es un medicamento que afecta su sistema inmunológico. XELJANZ puede reducir la capacidad de su sistema inmunológico para combatir infecciones. Algunas personas tienen infecciones graves mientras toman XELJANZ, incluida la tuberculosis (TB), e infecciones causadas por bacterias, hongos o virus que pueden extenderse por todo el cuerpo. Algunas personas han fallecido por causa de dichas infecciones. Su profesional del cuidado de la salud debe hacerle una prueba de TB antes de comenzar a tomar XELJANZ. Su profesional del cuidado de la salud debe monitorearlo para ver si existen indicios y síntomas de una infección de TB durante el tratamiento con XELJANZ. No debe comenzar a tomar XELJANZ si tiene algún tipo de infección, a menos que su profesional del cuidado de la salud le diga que está bien. Antes de comenzar a tomar XELJANZ, dígale a su profesional del cuidado de la salud si: piensa que tiene una infección o si tiene síntomas de una infección, tales como: fiebre, sudor o escalofríos dolores musculares tos falta de aliento sangre en la flema pérdida de peso piel caliente, roja o dolorosa, o aftas en el cuerpo diarrea o dolor de estómago quemazón al orinar o ganas de orinar más frecuente de lo normal sentirse muy cansado lo están tratando para una infección suele padecer infecciones o tiene infecciones que son recurrentes 32
47 tiene diabetes, VIH o un sistema inmunológico débil. Las personas con estas condiciones tienen mayor probabilidad de contraer infecciones. tiene TB, o ha estado en contacto cercano con alguien que tiene TB vive o ha vivido, o ha viajado a ciertos lugares del país (como los valles de Ohio y el Río Mississippi y el Suroeste de EE. UU.), donde hay una mayor posibilidad de contraer ciertos tipos de infecciones micóticas (histoplasmosis, coccidioidomicosis o blastomicosis). Estas infecciones pueden producirse o volverse más graves si usa XELJANZ. Pregúntele a su profesional del cuidado de la salud si no sabe si ha vivido en un área en donde estas infecciones sean comunes. tiene, o ha tenido, hepatitis B o C Después de haber comenzado a tomar XELJANZ, llame a su profesional del cuidado de la salud cuanto antes si tiene síntomas de infección. XELJANZ puede aumentar la probabilidad de que contraiga infecciones, o empeorar una infección que usted ya tenga. 2. Cáncer y problemas del sistema inmunológico. XELJANZ puede aumentar el riesgo de ciertos tipos de cáncer, cambiando la forma en que funciona su sistema inmunológico. Pueden producirse linfomas y otros tipos de cáncer en pacientes que toman XELJANZ. Hable con su profesional del cuidado de la salud si ha tenido algún tipo de cáncer. Algunas personas que han tomado XELJANZ con otros medicamentos específicos para prevenir el rechazo del trasplante de riñón, han tenido problemas con ciertos glóbulos blancos que se descontrolaban (trastorno linfoproliferativo asociado con el virus de Epstein Barr). 3. Desgarres (perforación) en el estómago o en los intestinos. Hable con su profesional del cuidado de la salud si ha tenido diverticulitis (inflamación en partes del intestino grueso), o úlceras en el estómago o intestinos. Algunas personas que toman XELJANZ presentan desgarres en el estómago o intestino. Esto ocurre con mayor frecuencia en personas que también toman medicamentos antiinflamatorios no esteroides (AINE), corticoesteroides o metotrexato. Hable cuanto antes con su profesional del cuidado de la salud si tiene fiebre y dolor en la zona del estómago que no desaparece y/o algún cambio en los hábitos de movimientos intestinales. 4. Cambios en ciertos resultados de análisis de laboratorio. Su profesional del cuidado de la salud debe realizar análisis de sangre antes de que comience a recibir XELJANZ, y mientras tome XELJANZ, para ver si se producen los siguientes efectos secundarios: cambios en recuento de linfocitos. Los linfocitos son glóbulos blancos que ayudan al cuerpo a combatir infecciones. 33
48 recuentos bajos de neutrófilos. Los neutrófilos son glóbulos blancos que ayudan al cuerpo a combatir infecciones. recuentos bajos de glóbulos rojos. Esto puede indicar que tiene anemia, lo cual puede hacerle sentir débil y cansado. Su profesional del cuidado de la salud debe realizar rutinariamente ciertos análisis de hígado. No debe recibir XELJANZ si su recuento de linfocitos, de neutrófilos o de glóbulos rojos es demasiado bajo, o si sus análisis de hígado son demasiado altos. Su profesional del cuidado de la salud puede parar su tratamiento con XELJANZ por un período de tiempo, si es necesario, debido a cambios en los resultados de estos análisis de sangre. También puede haber cambios en otras pruebas de laboratorio, tales como sus niveles de colesterol en la sangre. Su profesional del cuidado de la salud debe realizar análisis de sangre para verificar sus niveles de colesterol de 4 a 8 semanas después de que haya comenzado a tomar XELJANZ, y cuando sea necesario después de este tiempo. Los niveles de colesterol normales son importantes para la buena salud del corazón. Vea Cuáles son los posibles efectos secundarios de XELJANZ? para más información sobre efectos secundarios. Qué es XELJANZ? XELJANZ es un medicamento con receta llamado inhibidor de cinasa de Janus (JAK, por sus siglas en inglés). XELJANZ se utiliza para tratar a adultos con artritis reumatoide activa de moderada a severa, para los cuales el metotrexato no funcionó bien. Se desconoce si XELJANZ es seguro y eficaz en personas con hepatitis B o C. XELJANZ no es para personas con problemas hepáticos severos. Se desconoce si XELJANZ es seguro y eficaz en niños. Qué debería decirle a mi profesional del cuidado de la salud antes de tomar XELJANZ? XELJANZ puede no ser indicado para su caso. Antes de tomar XELJANZ, hable con su profesional del cuidado de la salud si: tiene una infección. Vea Cuál es la información más importante que debería saber sobre XELJANZ? tiene problemas de hígado tiene problemas de riñón 34
49 tiene dolor en la zona del estómago (abdominal) o le han diagnosticado diverticulitis, o úlceras estomacales o intestinales ha tenido una reacción a tofacitinib o a alguno de los ingredientes en XELJANZ ha recibido recientemente, o tiene planes de recibir, una vacuna. Las personas que toman XELJANZ no deberían recibir vacunas de microbios vivos, pero sí pueden recibir vacunas inactivas. tiene otras condiciones médicas tiene planes de quedar embarazada o está embarazada. Se desconoce si XELJANZ perjudicará al feto. Registro del Embarazo: Pfizer tiene un registro para mujeres embarazadas que toman XELJANZ. El propósito de este registro es comprobar la salud de la madre embarazada y su bebé. Si está embarazada o queda embarazada mientras está tomando XELJANZ, hable con su profesional del cuidado de la salud sobre cómo inscribirse en este registro del embarazo, o puede llamar directamente al registro, al para inscribirse. tiene planes de lactar o está lactando a su bebé. Usted y su profesional del cuidado de la salud deben decidir si tomará XELJANZ o lactará a su bebé. No debe hacer ambas cosas a la vez. Hable con su profesional del cuidado de la salud sobre todos los medicamentos que toma, incluidos los recetados y los vendidos sin recetas, las vitaminas y los suplementos a base de hierbas. XELJANZ y otros medicamentos pueden interactuar unos con otros, causando posibles efectos secundarios. Hable en particular con su profesional del cuidado de la salud si toma: otros medicamentos para tratar la artritis reumatoide. No debería tomar tocilizumab (Actemra ), etanercept (Enbrel ), adalimumab (Humira ), infliximab (Remicade ), rituximab (Rituxan ), abatacept (Orencia ), anakinra (Kineret ), certolizumab (Cimzia ), golimumab (Simponi ), azatioprina, ciclosporina, u otros medicamentos inmunosupresores mientras tome XELJANZ. Tomar XELJANZ con estos medicamentos puede aumentar su riesgo de infección. medicamentos que afectan la forma en que trabajan ciertas enzimas hepáticas. Pregúntele a su profesional del cuidado de la salud si no está seguro de si su medicamento es uno de éstos. Conozca los medicamentos que toma. Guarde una lista de ellos para mostrársela a su profesional del cuidado de la salud y a su farmacéutico cuando le den un medicamento nuevo. Cómo debería tomar XELJANZ? tome XELJANZ como se lo indique su profesional del cuidado de la salud. tome XELJANZ 2 veces por día, con o sin comida. si toma demasiado XELJANZ, llame a su profesional del cuidado de la salud o acuda de inmediato a la sala de emergencias más cercana. 35
50 Cuáles son los posibles efectos secundarios de XELJANZ? XELJANZ puede causar efectos secundarios graves, incluyendo: vea Cuál es la información más importante que debe saber sobre XELJANZ? infección por activación de la Hepatitis B o C en personas que tienen el virus en la sangre. Si porta el virus de la hepatitis B o C en la sangre (virus que afecta al hígado), este puede activarse mientras usa XELJANZ. Su profesional del cuidado de la salud puede hacer los análisis de sangre antes de que comience el tratamiento con XELJANZ, y mientras use XELJANZ. Hable con su profesional del cuidado de la salud si tiene alguno de los siguientes síntomas de una posible infección por hepatitis B o C: se siente muy cansado tiene la piel o los ojos amarillentos tiene poco o nada de apetito vómitos movimientos intestinales de color rojizo o arcilla fiebre escalofríos molestias estomacales dolores musculares orina oscura erupción cutánea Los efectos secundarios comunes de XELJANZ incluyen: infecciones de las vías respiratorias superiores (resfriado común, sinusitis) dolor de cabeza diarrea congestión nasal, dolor de garganta y descarga nasal (nasofaringitis) Hable con su profesional del cuidado de la salud si tiene efectos secundarios que le molestan, o que no desaparecen. Éstos no son todos los efectos secundarios posibles de XELJANZ. Para más información, pregúntele a su profesional del cuidado de la salud o a su farmacéutico. Llame a su médico para consejos médicos sobre los efectos secundarios. Puede reportar efectos secundarios a la FDA, llamando al FDA También puede reportar efectos secundarios a Pfizer, llamando al Cómo debo guardar XELJANZ? Guarde XELJANZ a una temperatura entre 68 F y 77 F (temperatura ambiente). Deshágase de modo seguro de todo medicamento caducado o que ya no sea necesario. 36
51 Guarde XELJANZ, y todos los medicamentos, fuera del alcance de los niños. Información general sobre el uso seguro y eficaz de XELJANZ. A veces se recetan medicamentos para fines que no son los mencionados en la Guía del medicamento. No utilice XELJANZ para una condición para la cual no haya sido recetado. No dé XELJANZ a otras personas, incluso aunque tengan los mismos síntomas que usted. Puede hacerles daño. Esta Guía del medicamento resume la información más importante sobre XELJANZ. Si desea más información, hable con su profesional del cuidado de la salud. Puede pedirle a su farmacéutico o a su profesional del cuidado de la salud información sobre XELJANZ que está escrita para profesionales médicos. Cuáles son los ingredientes de XELJANZ? Ingrediente activo: citrato de tofacitinib Ingredientes inactivos: celulosa microcristalina, monohidrato de lactosa, sodio de croscarmelosa, estearato de magnesio, HPMC 2910/Hipromelosa 6cP, dióxido de titanio, macrogol/peg3350 y triacetina. Esta Guía del medicamento ha sido aprobada por la Administración de Drogas y Alimentos de los EE. UU. LAB Expedido: Noviembre del 2012 TRA Pfizer Inc. Todos los derechos reservados. Julio del
SU CUERPO FUE HECHO PARA COSAS MEJORES QUE LA AR.
 XELJANZ se utiliza para tratar adultos con artritis reumatoide activa de moderada a severa, para los cuales el el metotrexato no funcionó bien. SU CUERPO FUE HECHO PARA COSAS MEJORES QUE LA AR. Se le exhorta
XELJANZ se utiliza para tratar adultos con artritis reumatoide activa de moderada a severa, para los cuales el el metotrexato no funcionó bien. SU CUERPO FUE HECHO PARA COSAS MEJORES QUE LA AR. Se le exhorta
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
Tabla 1: Ajustes de la dosis para la linfopenia Conteo de linfocitos bajo (vea Advertencias y precauciones (Sección 4.4)) Valor de laboratorio
 LLD Abreviado de XELJANZ Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: XELJANZ Cada tableta recubierta de 5 mg contiene 8,078 mg de citrato de tofacitinib equivalentes
LLD Abreviado de XELJANZ Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: XELJANZ Cada tableta recubierta de 5 mg contiene 8,078 mg de citrato de tofacitinib equivalentes
QUÉ ES LA PSORIASIS EN PLACAS?
 QUÉ ES LA PSORIASIS EN PLACAS? La psoriasis en placa es la forma más común de la psoriasis. Puede aparecer en cualquier parte del cuerpo, pero se encuentra más comúnmente en los codos, rodillas, cuero
QUÉ ES LA PSORIASIS EN PLACAS? La psoriasis en placa es la forma más común de la psoriasis. Puede aparecer en cualquier parte del cuerpo, pero se encuentra más comúnmente en los codos, rodillas, cuero
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Anticoagulantes (Por vía oral)
 Anticoagulantes (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los anticoagulantes orales
Anticoagulantes (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los anticoagulantes orales
Uso correcto de los medicamentos
 Uso correcto de los medicamentos Programa de Promoción y Educación en Salud Rev. 2014 2014, MMM Healthcare, Inc. - PMC Medicare Choice, Inc. Se prohíbe la reproducción de este material. MP-HEP-PPT-721-030413-S
Uso correcto de los medicamentos Programa de Promoción y Educación en Salud Rev. 2014 2014, MMM Healthcare, Inc. - PMC Medicare Choice, Inc. Se prohíbe la reproducción de este material. MP-HEP-PPT-721-030413-S
Medicamentos para la artritis psoriásica. Revisión de la investigación para adultos
 Medicamentos para la artritis psoriásica Revisión de la investigación para adultos Es esta información apropiada para mí? Sí, esta información es apropiada para usted si: Su médico* le ha dicho que tiene
Medicamentos para la artritis psoriásica Revisión de la investigación para adultos Es esta información apropiada para mí? Sí, esta información es apropiada para usted si: Su médico* le ha dicho que tiene
Prospecto: Información para el Paciente SIMPONI I.V. Recombinante Solución concentrada para perfusión Golimumab 50 mg/4,0 ml Vial de uso único
 Prospecto: Información para el Paciente SIMPONI I.V. Recombinante Solución concentrada para perfusión Golimumab 50 mg/4,0 ml Vial de uso único Industria Suiza Venta Bajo Receta Lea todo el prospecto detenidamente
Prospecto: Información para el Paciente SIMPONI I.V. Recombinante Solución concentrada para perfusión Golimumab 50 mg/4,0 ml Vial de uso único Industria Suiza Venta Bajo Receta Lea todo el prospecto detenidamente
sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se
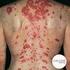 LUPUS El sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se afecta y ataca a las células y tejidos sanos.
LUPUS El sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se afecta y ataca a las células y tejidos sanos.
Consejería sobre aborto con medicamentos
 Consejería sobre aborto con medicamentos Consejería sobre aborto con medicamentos Un recurso para profesionales de la salud Protegiendo la salud de las mujeres Promoviendo el respeto a sus derechos reproductivos
Consejería sobre aborto con medicamentos Consejería sobre aborto con medicamentos Un recurso para profesionales de la salud Protegiendo la salud de las mujeres Promoviendo el respeto a sus derechos reproductivos
Medicamentos para la artritis reumatoide. Revisión de la investigación para adultos
 Medicamentos para la artritis reumatoide Revisión de la investigación para adultos Es esta información apropiada para mí? Sí, este resumen es para usted si: Su médico le ha dicho que tiene artritis reumatoide
Medicamentos para la artritis reumatoide Revisión de la investigación para adultos Es esta información apropiada para mí? Sí, este resumen es para usted si: Su médico le ha dicho que tiene artritis reumatoide
Guía de infecciones de transmisión sexual (ITS) seleccionadas
 Clamidia Una bacteria que puede infectar el cuello uterino y el útero de la mujer, así como la uretra, la garganta o el ano de hombres y mujeres. La infección por clamidia sin tratar puede ocasionar infertilidad
Clamidia Una bacteria que puede infectar el cuello uterino y el útero de la mujer, así como la uretra, la garganta o el ano de hombres y mujeres. La infección por clamidia sin tratar puede ocasionar infertilidad
Qué es la artritis juvenil?
 Qué es la artritis juvenil? Los niños pueden padecer de artritis al igual que los adultos. La artritis es causada por la inflamación de las articulaciones, lo cual ocasiona dolor, inflamación, rigidez
Qué es la artritis juvenil? Los niños pueden padecer de artritis al igual que los adultos. La artritis es causada por la inflamación de las articulaciones, lo cual ocasiona dolor, inflamación, rigidez
Pregunte a su médico si ORENCIA (abatacept) pudiera ayudarle a ver su AR de manera distinta.
 1 ARTRITIS REUMATOIDE DE MODERADA A SEVERA (AR) 1 Pregunte a su médico si ORENCIA (abatacept) pudiera ayudarle a ver su AR de manera distinta. Indicación y uso Artritis Reumatoido Adulta (AR): ORENCIA
1 ARTRITIS REUMATOIDE DE MODERADA A SEVERA (AR) 1 Pregunte a su médico si ORENCIA (abatacept) pudiera ayudarle a ver su AR de manera distinta. Indicación y uso Artritis Reumatoido Adulta (AR): ORENCIA
Influenza H1N1. Programa de Promoción y Educación en Salud PMC Medicare Choice, Inc. PM C-PRD S
 Influenza H1N1 Programa de Promoción y Educación en Salud PMC Medicare Choice, Inc. PM C-PRD-015-012710-S Objetivos Generales Al completar este tutorial, los participantes podrán: Definir qué es la Influenza
Influenza H1N1 Programa de Promoción y Educación en Salud PMC Medicare Choice, Inc. PM C-PRD-015-012710-S Objetivos Generales Al completar este tutorial, los participantes podrán: Definir qué es la Influenza
Endoscopia del tracto gastrointestinal superior. Diagnóstico de problemas del tracto digestivo superior
 Endoscopia del tracto gastrointestinal superior Diagnóstico de problemas del tracto digestivo superior 2 La endoscopia es el único procedimiento no quirúrgico para ver directamente el tracto digestivo
Endoscopia del tracto gastrointestinal superior Diagnóstico de problemas del tracto digestivo superior 2 La endoscopia es el único procedimiento no quirúrgico para ver directamente el tracto digestivo
Artritis Reumatoidea
 Artritis Reumatoidea El panorama ha mejorado drásticamente para muchas personas a quienes recientemente se les diagnosticó artritis reumatoidea (AR), una afección temida, durante mucho tiempo, por ser
Artritis Reumatoidea El panorama ha mejorado drásticamente para muchas personas a quienes recientemente se les diagnosticó artritis reumatoidea (AR), una afección temida, durante mucho tiempo, por ser
Imagine más días con menos síntomas articulares y cutáneos
 Para la artritis psoriásica activa Imagine más días con menos síntomas articulares y cutáneos STELARA es un medicamento con receta médica aprobado para tratar a adultos mayores de 18 años que padecen artritis
Para la artritis psoriásica activa Imagine más días con menos síntomas articulares y cutáneos STELARA es un medicamento con receta médica aprobado para tratar a adultos mayores de 18 años que padecen artritis
Hacia. una opción de tratamiento diferente INTRODUCCIÓN A ACTHAR
 PARA RECAÍDAS DE EM Hacia una opción de tratamiento diferente INTRODUCCIÓN A ACTHAR Las recaídas de esclerosis múltiple (EM) probablemente lo han afectado de forma muy personal e intensa. Acthar es una
PARA RECAÍDAS DE EM Hacia una opción de tratamiento diferente INTRODUCCIÓN A ACTHAR Las recaídas de esclerosis múltiple (EM) probablemente lo han afectado de forma muy personal e intensa. Acthar es una
Cómo hacer ejercicios con una insuficiencia cardiaca
 Cómo hacer ejercicios con una insuficiencia cardiaca Por qué debe usted hacer ejercicios? Su corazón y su cuerpo necesitan ejercicios para mantenerse en forma. El ejercicio regular es una manera importante
Cómo hacer ejercicios con una insuficiencia cardiaca Por qué debe usted hacer ejercicios? Su corazón y su cuerpo necesitan ejercicios para mantenerse en forma. El ejercicio regular es una manera importante
Cómo lograr tu tratamiento con éxito. Cómo lograr tu tratamiento con éxito. Si tienes un malestar durante tu tratamiento, llama a:
 Si tienes un malestar durante tu tratamiento, llama a: Para cambiar la fecha u hora de tu cita médica, llama a: Para más información sobre la tuberculosis, llama a: La Tuberculosis: Cómo lograr tu tratamiento
Si tienes un malestar durante tu tratamiento, llama a: Para cambiar la fecha u hora de tu cita médica, llama a: Para más información sobre la tuberculosis, llama a: La Tuberculosis: Cómo lograr tu tratamiento
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral)
 Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
Prevención y control de enfermedades
 Nutrición Control del sobrepeso y la obesidad La mejor manera de perder el exceso de peso debe ser lenta, gradual y progresiva; la pérdida rápida con dietas rigurosas o fórmulas mágicas llevan al fracaso
Nutrición Control del sobrepeso y la obesidad La mejor manera de perder el exceso de peso debe ser lenta, gradual y progresiva; la pérdida rápida con dietas rigurosas o fórmulas mágicas llevan al fracaso
Dolor en el anciano. Dr. Alberto José Mimenza Alvarado. Departamento de Geriatría, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán
 Dolor en el anciano Dr. Alberto José Mimenza Alvarado Departamento de Geriatría, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán F Qué entendemos por dolor? El dolor es una experiencia
Dolor en el anciano Dr. Alberto José Mimenza Alvarado Departamento de Geriatría, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán F Qué entendemos por dolor? El dolor es una experiencia
La cafeína también se puede usar para otras condiciones según lo determine su médico.
 Cafeína (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La cafeína corresponde al grupo
Cafeína (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La cafeína corresponde al grupo
Prospecto: información para el usuario Remicade 100 mg polvo para concentrado para solución para perfusión Infliximab
 Prospecto: información para el usuario Remicade 100 mg polvo para concentrado para solución para perfusión Infliximab Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Remicade 100 mg polvo para concentrado para solución para perfusión Infliximab Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
MEDICARE 101: Guía de Orientación para Beneficiarios de Medicare
 MEDICARE 101: Guía de Orientación para Beneficiarios de Medicare Índice Introducción Qué es Medicare? Partes de Medicare Opciones de planes Medicare Qué es un plan Medicare Original? Proceso de inscripción
MEDICARE 101: Guía de Orientación para Beneficiarios de Medicare Índice Introducción Qué es Medicare? Partes de Medicare Opciones de planes Medicare Qué es un plan Medicare Original? Proceso de inscripción
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
Proyecto: uso racional de analgésicos y antiinflamatorios
 Proyecto: uso racional de analgésicos y antiinflamatorios OBJETIVO -Concientizar a la población sobre el uso responsable de los medicamentos, en este caso AINES. -Revalorizar el rol del farmacéutico en
Proyecto: uso racional de analgésicos y antiinflamatorios OBJETIVO -Concientizar a la población sobre el uso responsable de los medicamentos, en este caso AINES. -Revalorizar el rol del farmacéutico en
PROSPECTO: INFORMACIÓN PARA EL USUARIO. flutamida cinfa 250 mg comprimidos EFG flutamida
 PROSPECTO: INFORMACIÓN PARA EL USUARIO flutamida cinfa 250 mg comprimidos EFG flutamida Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO flutamida cinfa 250 mg comprimidos EFG flutamida Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede
ACTHAR PARA ESPASMOS INFANTILES: El diario de tratamiento de su hijo
 ACTHAR PARA ESPASMOS INFANTILES: El diario de tratamiento de su hijo introducción A su hijo le acaban de recetar Acthar para ayudar a tratar sus espasmos infantiles. Si bien éstos podrían ser momentos
ACTHAR PARA ESPASMOS INFANTILES: El diario de tratamiento de su hijo introducción A su hijo le acaban de recetar Acthar para ayudar a tratar sus espasmos infantiles. Si bien éstos podrían ser momentos
Qué es la pancreatitis?
 Qué es la pancreatitis? La pancreatitis es la inflamación (hinchazón) del páncreas que a menudo es causada por cálculos biliares o abuso del alcohol. Hay otras causas adicionales que buscará el gastroenterólogo.
Qué es la pancreatitis? La pancreatitis es la inflamación (hinchazón) del páncreas que a menudo es causada por cálculos biliares o abuso del alcohol. Hay otras causas adicionales que buscará el gastroenterólogo.
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
INFORMACIÓN SOBRE ACTHAR: INFORMACIÓN ÚTIL PARA GUIAR SU TRATAMIENTO
 INFORMACIÓN SOBRE ACTHAR: INFORMACIÓN ÚTIL PARA GUIAR SU TRATAMIENTO QUÉ ES ACTHAR? Acthar es un medicamento de venta bajo receta, aprobado por la Administración de Alimentos y Medicamentos (Food and Drug
INFORMACIÓN SOBRE ACTHAR: INFORMACIÓN ÚTIL PARA GUIAR SU TRATAMIENTO QUÉ ES ACTHAR? Acthar es un medicamento de venta bajo receta, aprobado por la Administración de Alimentos y Medicamentos (Food and Drug
Información sobre la enfermedad por virus Ébola. Octubre 2014
 Información sobre la enfermedad por virus Ébola Octubre 2014 Enfermedad por el virus Ébola (EVE) Es una enfermedad transmisible grave causada por la infección de un virus, el virus Ébola. El virus Ébola
Información sobre la enfermedad por virus Ébola Octubre 2014 Enfermedad por el virus Ébola (EVE) Es una enfermedad transmisible grave causada por la infección de un virus, el virus Ébola. El virus Ébola
Insuficiencia cardíaca crónica
 Insuficiencia cardíaca crónica Qué es la insuficiencia cardíaca? La insuficiencia cardíaca significa que el corazón no puede bombear suficiente sangre para satisfacer todas las necesidades de su cuerpo.
Insuficiencia cardíaca crónica Qué es la insuficiencia cardíaca? La insuficiencia cardíaca significa que el corazón no puede bombear suficiente sangre para satisfacer todas las necesidades de su cuerpo.
Información de Salud para las Personas de la Tercera Edad
 Instituto Nacional Sobre el Envejecimiento Información de Salud para las Personas de la Tercera Edad Presión arterial alta Usted puede tener la presión arterial alta, o hipertensión y aun así sentirse
Instituto Nacional Sobre el Envejecimiento Información de Salud para las Personas de la Tercera Edad Presión arterial alta Usted puede tener la presión arterial alta, o hipertensión y aun así sentirse
Política de facturación y cobros del centro médico Mercy
 Política de facturación y cobros del centro médico Mercy Objetivo de la política El centro médico Mercy, de acuerdo con su misión, visión y valores, se compromete a brindar atención médica de calidad y
Política de facturación y cobros del centro médico Mercy Objetivo de la política El centro médico Mercy, de acuerdo con su misión, visión y valores, se compromete a brindar atención médica de calidad y
Medicamentos para la artritis reumatoide
 Su guía de Medicamentos para la artritis reumatoide Nosotros vivimos con la artritis reumatoide. Su guía de Medicamentos para la artritis reumatoide Capítulo 1. Página 4 Qué es la artritis reumatoide?
Su guía de Medicamentos para la artritis reumatoide Nosotros vivimos con la artritis reumatoide. Su guía de Medicamentos para la artritis reumatoide Capítulo 1. Página 4 Qué es la artritis reumatoide?
Puede ser apnea del sueño? Una guía sencilla para valorar si presenta riesgo de padecer apnea del sueño
 Puede ser apnea del sueño? Una guía sencilla para valorar si presenta riesgo de padecer apnea del sueño Guía de evaluación del S: evaluación del riesgo 1 Qué es síndrome de la apnea hipopnea del sueño
Puede ser apnea del sueño? Una guía sencilla para valorar si presenta riesgo de padecer apnea del sueño Guía de evaluación del S: evaluación del riesgo 1 Qué es síndrome de la apnea hipopnea del sueño
Cuestionario: Evaluación de preparación del estudiante para llevar consigo medicamentos
 mbre del estudiante: Fecha de la evaluación: Evaluado por: Puntaje: Cuestionario: Evaluación de preparación del estudiante para llevar consigo medicamentos Contar con acceso inmediato a medicamentos de
mbre del estudiante: Fecha de la evaluación: Evaluado por: Puntaje: Cuestionario: Evaluación de preparación del estudiante para llevar consigo medicamentos Contar con acceso inmediato a medicamentos de
Vacunas Tosferina. Quién debe recibir la vacuna?
 Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
Medicamentos para la artritis reumatoide Guía para adultos
 Medicamentos para la artritis reumatoide Guía para adultos Hechos resumidos Los medicamentos para la artritis reumatoide (AR) pueden disminuir el avance de la enfermedad y reducir el daño en las articulaciones.
Medicamentos para la artritis reumatoide Guía para adultos Hechos resumidos Los medicamentos para la artritis reumatoide (AR) pueden disminuir el avance de la enfermedad y reducir el daño en las articulaciones.
El comienzo del tratamiento con Tracleer. Todo lo que los pacientes y sus familias deben saber
 El comienzo del tratamiento con Tracleer Todo lo que los pacientes y sus familias deben saber Qué es Tracleer (bosentan)? Este folleto le ofrecerá una reseña de los beneficios y los riesgos del tratamiento
El comienzo del tratamiento con Tracleer Todo lo que los pacientes y sus familias deben saber Qué es Tracleer (bosentan)? Este folleto le ofrecerá una reseña de los beneficios y los riesgos del tratamiento
Lo que tiene que saber sobre la. diabetes gestacional
 Lo que tiene que saber sobre la diabetes gestacional Diabetes gestacional Qué es la diabetes gestacional? La diabetes gestacional es un tipo de diabetes que solo aparece durante el embarazo. En la diabetes
Lo que tiene que saber sobre la diabetes gestacional Diabetes gestacional Qué es la diabetes gestacional? La diabetes gestacional es un tipo de diabetes que solo aparece durante el embarazo. En la diabetes
SU GUÍA PARA LOS SERVICIOS DE VALOR AGREGADO GRATUITOS
 SU GUÍA PARA LOS SERVICIOS DE VALOR AGREGADO GRATUITOS Trabajemos juntos para mejorar su salud Válida del 1 de septiembre de 2015 al 31 de agosto de 2016 Área de servicio de Hidalgo Área de servicio de
SU GUÍA PARA LOS SERVICIOS DE VALOR AGREGADO GRATUITOS Trabajemos juntos para mejorar su salud Válida del 1 de septiembre de 2015 al 31 de agosto de 2016 Área de servicio de Hidalgo Área de servicio de
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
Antes de comenzar su tratamiento con Soliris.
 Antes de comenzar su tratamiento con Soliris. Información importante de seguridad para los pacientes Antes de comenzar su tratamiento con Soliris, su médico le entregará una: Guía del medicamento Tarjeta
Antes de comenzar su tratamiento con Soliris. Información importante de seguridad para los pacientes Antes de comenzar su tratamiento con Soliris, su médico le entregará una: Guía del medicamento Tarjeta
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
VARENICICLINA (TARTRATO) COMPRIMIDOS RECUBIERTOS 0,5 mg y 1 mg
 VARENICICLINA (TARTRATO) COMPRIMIDOS RECUBIERTOS 0,5 mg y 1 mg Antes de comenzar a tomar este medicamento, lea atentamente este prospecto en su totalidad. - Conserve este prospecto. Es posible que tenga
VARENICICLINA (TARTRATO) COMPRIMIDOS RECUBIERTOS 0,5 mg y 1 mg Antes de comenzar a tomar este medicamento, lea atentamente este prospecto en su totalidad. - Conserve este prospecto. Es posible que tenga
INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS
 INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS Qué es un medicamento? Una sustancia que pueden consumir las personas con distintos fines 1) Prevenir o tratar enfermedades 2) Aliviar síntomas 3) Realizar un diagnóstico
INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS Qué es un medicamento? Una sustancia que pueden consumir las personas con distintos fines 1) Prevenir o tratar enfermedades 2) Aliviar síntomas 3) Realizar un diagnóstico
Medicamentos para Artritis Reumatoide
 Página Principal Factores de Riesgo Síntomas Diagnóstico Tratamiento Revisión Reduciendo Su Riesgo Hablando con Su Médico Viviendo Con Artritis Reumatoide Guía de Fuentes Adicionales Medicamentos para
Página Principal Factores de Riesgo Síntomas Diagnóstico Tratamiento Revisión Reduciendo Su Riesgo Hablando con Su Médico Viviendo Con Artritis Reumatoide Guía de Fuentes Adicionales Medicamentos para
QUÉ HACER CUANDO ESTÁ EMBARAZADA
 QUÉ HACER CUANDO ESTÁ EMBARAZADA Lista de verificación prenatal Esta información es proporcionada por el Departamento de Atención Médica y Servicios Familiares de Illinois. INT_16_43749S Approved 06012016
QUÉ HACER CUANDO ESTÁ EMBARAZADA Lista de verificación prenatal Esta información es proporcionada por el Departamento de Atención Médica y Servicios Familiares de Illinois. INT_16_43749S Approved 06012016
Factores de Riesgo. Virus de papiloma Humano
 Factores de Riesgo Virus de papiloma Humano Las verrugas genitales son causadas por el virus papilloma humano (HPV por sus siglas en inglés). El HPV es una familia de más de 100 virus muy comunes. Muchos
Factores de Riesgo Virus de papiloma Humano Las verrugas genitales son causadas por el virus papilloma humano (HPV por sus siglas en inglés). El HPV es una familia de más de 100 virus muy comunes. Muchos
GUÍA DEL MEDICAMENTO
 GUÍA DEL MEDICAMENTO Guía del medicamento GUÍA DEL MEDICAMENTO TYSABRI (tai-sa-bri) (natalizumab) inyectable, para uso por vía intravenosa Lea esta Guía del medicamento antes de comenzar a recibir TYSABRI
GUÍA DEL MEDICAMENTO Guía del medicamento GUÍA DEL MEDICAMENTO TYSABRI (tai-sa-bri) (natalizumab) inyectable, para uso por vía intravenosa Lea esta Guía del medicamento antes de comenzar a recibir TYSABRI
10 de marzo del 2016
 10 de marzo del 2016 Qué es el Día Mundial del Riñón? El Día Mundial del Riñón es una campaña mundial dirigida a crear conciencia sobre la importancia de nuestros riñones. Pretende concientizar sobre la
10 de marzo del 2016 Qué es el Día Mundial del Riñón? El Día Mundial del Riñón es una campaña mundial dirigida a crear conciencia sobre la importancia de nuestros riñones. Pretende concientizar sobre la
Taller de Promoción de Salud/Sesión Informativa Entendiendo de qué se trata un seguro médico
 Taller de Promoción de Salud/Sesión Informativa Entendiendo de qué se trata un seguro médico LA LEY DE ATENCIÓN MÉDICA ASEQUIBLE ES UN HECHO! USTED DEBE OBTENER UN SEGURO MÉDICO PARA EVITAR RECIBIR MULTAS.
Taller de Promoción de Salud/Sesión Informativa Entendiendo de qué se trata un seguro médico LA LEY DE ATENCIÓN MÉDICA ASEQUIBLE ES UN HECHO! USTED DEBE OBTENER UN SEGURO MÉDICO PARA EVITAR RECIBIR MULTAS.
ANEXO Á NOTA INFORMATIVA 12/2007. CONDICIÓNS DE AUTORIZACIÓN DOS MEDICAMENTOS CON PIROXICAM DE ADMINISTRACIÓN SISTÉMICA (xullo de 2007)
 ANEXO Á NOTA INFORMATIVA 12/2007 CONDICIÓNS DE AUTORIZACIÓN DOS MEDICAMENTOS CON PIROXICAM DE ADMINISTRACIÓN SISTÉMICA (xullo de 2007) Información que debe ser incluída nos correspondentes apartados do
ANEXO Á NOTA INFORMATIVA 12/2007 CONDICIÓNS DE AUTORIZACIÓN DOS MEDICAMENTOS CON PIROXICAM DE ADMINISTRACIÓN SISTÉMICA (xullo de 2007) Información que debe ser incluída nos correspondentes apartados do
Influenza H1N1. Qué es la influenza H1N1 (influenza o gripe porcina)?
 Influenza H1N1 Influenza H1N1 Qué es la influenza H1N1 (influenza o gripe porcina)? La influenza H1N1 (a la que en un comienzo se le llamó gripe porcina ) es la infección por un nuevo virus de influenza
Influenza H1N1 Influenza H1N1 Qué es la influenza H1N1 (influenza o gripe porcina)? La influenza H1N1 (a la que en un comienzo se le llamó gripe porcina ) es la infección por un nuevo virus de influenza
2017 INSCRIPCIÓN ANUAL YA CASI ES LA HORA PARA DECIDIR! Octubre 2016
 2017 INSCRIPCIÓN ANUAL YA CASI ES LA HORA PARA DECIDIR! Octubre 2016 ALGUNAS COSAS QUE NECESITA SABER ANTES DE INSCRIBIRSE Atender una de las videoconferencias durante la semana del 17 de Octubre Portal
2017 INSCRIPCIÓN ANUAL YA CASI ES LA HORA PARA DECIDIR! Octubre 2016 ALGUNAS COSAS QUE NECESITA SABER ANTES DE INSCRIBIRSE Atender una de las videoconferencias durante la semana del 17 de Octubre Portal
ESTÁ CONSIDERANDO O COMENZARÁ A TRATARSE CON STELARA?
 Para psoriasis en placas moderada o grave ESTÁ CONSIDERANDO O COMENZARÁ A TRATARSE CON STELARA? Imagine las posibilidades de una piel más clara STELARA es un medicamento por receta médica aprobado para
Para psoriasis en placas moderada o grave ESTÁ CONSIDERANDO O COMENZARÁ A TRATARSE CON STELARA? Imagine las posibilidades de una piel más clara STELARA es un medicamento por receta médica aprobado para
AUDIT Cuestionario de Identificación de los Trastornos debidos al Consumo de Alcohol
 AUDIT Cuestionario de Identificación de los Trastornos debidos al Consumo de Alcohol Área de Atención Integral a las Personas Caja Costarricense de Seguro Social Alcohol Use Didorder Identification Test.
AUDIT Cuestionario de Identificación de los Trastornos debidos al Consumo de Alcohol Área de Atención Integral a las Personas Caja Costarricense de Seguro Social Alcohol Use Didorder Identification Test.
Tiene alguna pregunta? Comenzar es tan fácil como Guía de comienzo rápido de la HSA El beneficio de tener opciones.
 Comenzar es tan fácil como 1-2-3 No le gustan los trámites burocráticos? Tampoco a nosotros. Es por eso que hacemos que sea rápido y fácil el poder comenzar su HSA. Si no le gusta llenar formularios, puede
Comenzar es tan fácil como 1-2-3 No le gustan los trámites burocráticos? Tampoco a nosotros. Es por eso que hacemos que sea rápido y fácil el poder comenzar su HSA. Si no le gusta llenar formularios, puede
Trasplante de microbiota fecal (FMT)
 CLOSTRIDIUM DIFFICILE (C. DIFFICILE) Trasplante de microbiota fecal (FMT) El Trasplante de microbiota fecal (FMT) es cuando las heces de un donante saludable se convierten en una mezcla líquida y se transfieren
CLOSTRIDIUM DIFFICILE (C. DIFFICILE) Trasplante de microbiota fecal (FMT) El Trasplante de microbiota fecal (FMT) es cuando las heces de un donante saludable se convierten en una mezcla líquida y se transfieren
Solicitud de Elegibilidad al Programa
 Nombre del Centro aviso de privacidad: El llenado de la presente solicitud requiere que proporcione algunos datos personales los cuales son necesarios para asegurar que el programa pueda serle entregado
Nombre del Centro aviso de privacidad: El llenado de la presente solicitud requiere que proporcione algunos datos personales los cuales son necesarios para asegurar que el programa pueda serle entregado
Entendiendo la. Migraña
 Entendiendo la Migraña Qué es la Migraña Migraña o jaqueca es un tipo común de dolor de cabeza que puede ocurrir con síntomas como náuseas, vómitos o sensibilidad a la luz. En muchas personas, se siente
Entendiendo la Migraña Qué es la Migraña Migraña o jaqueca es un tipo común de dolor de cabeza que puede ocurrir con síntomas como náuseas, vómitos o sensibilidad a la luz. En muchas personas, se siente
Señales en la niñez: diarrea, fiebre, resfriado común Entrevista con el Dr. Miguel Ángel Franco Cervantes Pediatra, Dirección Centro Pediátrico Ninnus
 Reportaje Señales en la niñez: diarrea, fiebre, resfriado común Entrevista con el Dr. Miguel Ángel Franco Cervantes Pediatra, Dirección Centro Pediátrico Ninnus Existen enfermedades en los niños que se
Reportaje Señales en la niñez: diarrea, fiebre, resfriado común Entrevista con el Dr. Miguel Ángel Franco Cervantes Pediatra, Dirección Centro Pediátrico Ninnus Existen enfermedades en los niños que se
SU GUÍA PARA BRINDAR APOYO AL PACIENTE
 SU GUÍA PARA BRINDAR APOYO AL PACIENTE El gel H.P. Acthar (repository corticotropin injection) está indicado para la reducción de la proteinuria en las personas con síndrome nefrótico de tipo idiopático
SU GUÍA PARA BRINDAR APOYO AL PACIENTE El gel H.P. Acthar (repository corticotropin injection) está indicado para la reducción de la proteinuria en las personas con síndrome nefrótico de tipo idiopático
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Dolores de Cabeza de Tipo Tensión
 Dolores de Cabeza de Tipo Tensión Qué son los dolores de cabeza de tipo tensión? Los dolores de cabeza, o cefaleas, de tipo tensión son el tipo más común de dolor de cabeza que ocurre en los adultos. Comúnmente
Dolores de Cabeza de Tipo Tensión Qué son los dolores de cabeza de tipo tensión? Los dolores de cabeza, o cefaleas, de tipo tensión son el tipo más común de dolor de cabeza que ocurre en los adultos. Comúnmente
Ésta es una información importante que necesitamos para acoplar nuestra atención a sus necesidades.
 Autoadministrado Estimado señor o señora: Este cuestionario ayudará a su cuidador profesional sanitario (el que se ocupa de su salud) a hacerse una mejor idea de las consecuencias que la enfermedad tiene
Autoadministrado Estimado señor o señora: Este cuestionario ayudará a su cuidador profesional sanitario (el que se ocupa de su salud) a hacerse una mejor idea de las consecuencias que la enfermedad tiene
PÍLDORA DEL DÍA DESPUÉS
 Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
Sabías qué, la diabetes:
 Sabías qué, la diabetes: Es la tercera causa de muerte en Puerto Rico Se puede desarrollar a cualquier edad Los niveles de glucosa descontrolados pueden causar complicaciones de salud Con el cuidado y
Sabías qué, la diabetes: Es la tercera causa de muerte en Puerto Rico Se puede desarrollar a cualquier edad Los niveles de glucosa descontrolados pueden causar complicaciones de salud Con el cuidado y
Debe utilizarse la dosis eficaz mínima durante el periodo más corto posible a fin de reducir las reacciones adversas.
 ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca:
 Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca: Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene
Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca: Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene
La Salud Dental de los niños: Cuáles son las patologías más comunes?
 La Salud Dental de los niños: Cuáles son las patologías más comunes? La gingivitis no sólo es una enfermedad relacionada a la vida adulta, también se encuentra casi universalmente en los niños y en los
La Salud Dental de los niños: Cuáles son las patologías más comunes? La gingivitis no sólo es una enfermedad relacionada a la vida adulta, también se encuentra casi universalmente en los niños y en los
Qué es la tensión arterial?
 Qué es la tensión arterial? Cuando el corazón late, bombea sangre alrededor de su cuerpo para darle la energía y el oxígeno que necesita. La sangre se mueve y empuja las paredes de los vasos sanguíneos,
Qué es la tensión arterial? Cuando el corazón late, bombea sangre alrededor de su cuerpo para darle la energía y el oxígeno que necesita. La sangre se mueve y empuja las paredes de los vasos sanguíneos,
ARTRITIS IDIOPÁTICA JUVENIL AIJ
 1 ARTRITIS IDIOPÁTICA JUVENIL AIJ Guía del Paciente 2 Diseño de Portada: Marco Antonio Sánchez Torres Diseño y Maquetación de Interiores: Marco Antonio Sánchez Torres Dibujos Rehabilitación e Información
1 ARTRITIS IDIOPÁTICA JUVENIL AIJ Guía del Paciente 2 Diseño de Portada: Marco Antonio Sánchez Torres Diseño y Maquetación de Interiores: Marco Antonio Sánchez Torres Dibujos Rehabilitación e Información
Puede una pastilla al día ayudarle a disminuir su nivel de azúcar en sangre?
 Vea el interior para consultar la oferta de ahorro valiosa Puede una pastilla al día ayudarle a disminuir su nivel de azúcar en sangre? Qué es FARXIGA? FARXIGA es un medicamento de venta con receta que
Vea el interior para consultar la oferta de ahorro valiosa Puede una pastilla al día ayudarle a disminuir su nivel de azúcar en sangre? Qué es FARXIGA? FARXIGA es un medicamento de venta con receta que
Guía para el educador sobre la malaria. (Información sobre herramientas) FINANCIADO POR AUTORES
 Guía para el educador sobre la malaria (Información sobre s) AUTORES FINANCIADO POR Índice Índice... 2 I. Introducción... 3 II. Las s... 3 1. Juego en vídeo: Ponle freno a la malaria... 4 2. Vídeo 1 Trabajar
Guía para el educador sobre la malaria (Información sobre s) AUTORES FINANCIADO POR Índice Índice... 2 I. Introducción... 3 II. Las s... 3 1. Juego en vídeo: Ponle freno a la malaria... 4 2. Vídeo 1 Trabajar
Preguntas Frecuentes
 Información General 1. Qué es este producto? El suplemento nutricional Slimmetry de Nutrilite ofrece una manera de complementar la dieta con un extracto de té verde sin cafeína diseñado para ayudar al
Información General 1. Qué es este producto? El suplemento nutricional Slimmetry de Nutrilite ofrece una manera de complementar la dieta con un extracto de té verde sin cafeína diseñado para ayudar al
Artritis idiopática juvenil sistémica (2.3) Dosificación intravenosa recomendada para SJIA cada 2 semanas Pacientes de menos de 30 kg de
 ASPECTOS DESTACADOS SOBRE LA INFORMACIÓN DE PRESCRIPCIÓN Estos aspectos destacados no incluyen toda la información necesaria para usar ACTEMRA segura y eficazmente. Consulte la información de prescripción
ASPECTOS DESTACADOS SOBRE LA INFORMACIÓN DE PRESCRIPCIÓN Estos aspectos destacados no incluyen toda la información necesaria para usar ACTEMRA segura y eficazmente. Consulte la información de prescripción
Enfermedad diabética del ojo. Una guía para el educador
 Enfermedad diabética del ojo Una guía para el educador Desarrollado por el Programa Nacional de Educación sobre la Salud del Ojo (NEHEP, por sus siglas en inglés), Enfermedad diabética del ojo: Una guía
Enfermedad diabética del ojo Una guía para el educador Desarrollado por el Programa Nacional de Educación sobre la Salud del Ojo (NEHEP, por sus siglas en inglés), Enfermedad diabética del ojo: Una guía
PRUEBA GRATIS*DE 60 DÍAS
 EL TREN DE LAS 7:16 ESTABA A TIEMPO, PERO MIS PIERNAS ESTABAN ATRASADAS. ESO FUE CUANDO PEDÍ LA PASTILLA DE CAMINAR PRUEBA GRATIS*DE 60 DÍAS *Se aplican limitaciones y restricciones. Actriz retratada AMPYRA
EL TREN DE LAS 7:16 ESTABA A TIEMPO, PERO MIS PIERNAS ESTABAN ATRASADAS. ESO FUE CUANDO PEDÍ LA PASTILLA DE CAMINAR PRUEBA GRATIS*DE 60 DÍAS *Se aplican limitaciones y restricciones. Actriz retratada AMPYRA
Además, la riboflavina puede administrarse a los infantes que presentan niveles altos de bilirrubina (hiperbilirrubinemia).
 Riboflavina (Vitamina B2) (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las vitaminas
Riboflavina (Vitamina B2) (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las vitaminas
PROSPECTO: INFORMACIÓN PARA EL USUARIO. ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO ACETILCISTEÍNA BEXAL 100 mg polvo para solución oral EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
Asma. Introducción El asma es una enfermedad común de los pulmones que afecta a millones de estadounidenses.
 Asma Introducción El asma es una enfermedad común de los pulmones que afecta a millones de estadounidenses. Este sumario le ayuda a entender mejor las causas, los síntomas y las opciones de tratamiento
Asma Introducción El asma es una enfermedad común de los pulmones que afecta a millones de estadounidenses. Este sumario le ayuda a entender mejor las causas, los síntomas y las opciones de tratamiento
14-16 Year Well Child Exam Form - FEMALE
 ANTECEDENTES MÉDICOS Tiene usted alguna duda o pregunta sobre su salud que desee resolver el día de hoy? Cuál es su estado de salud? Bueno Regular Malo Ha visitado la sala de emergencias en los últimos
ANTECEDENTES MÉDICOS Tiene usted alguna duda o pregunta sobre su salud que desee resolver el día de hoy? Cuál es su estado de salud? Bueno Regular Malo Ha visitado la sala de emergencias en los últimos
Prospecto: información para el usuario. Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro
 Prospecto: información para el usuario Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento,
Prospecto: información para el usuario Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento,
Datos clave sobre la influenza y la vacuna contra la
 Datos clave sobre la influenza y la vacuna contra la influenza Qué es la influenza (también llamada gripe)? La influenza es una enfermedad respiratoria contagiosa provocada por los virus de la influenza
Datos clave sobre la influenza y la vacuna contra la influenza Qué es la influenza (también llamada gripe)? La influenza es una enfermedad respiratoria contagiosa provocada por los virus de la influenza
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
Comenzar tratamiento con XTANDI
 Comenzar tratamiento con XTANDI XTANDI (ex TAN dee), en cápsulas, es un medicamento de venta con receta que se utiliza para el tratamiento de cáncer de próstata resistente a la castración (cáncer de próstata
Comenzar tratamiento con XTANDI XTANDI (ex TAN dee), en cápsulas, es un medicamento de venta con receta que se utiliza para el tratamiento de cáncer de próstata resistente a la castración (cáncer de próstata
X-Plain Lupus Sumario
 X-Plain Lupus Sumario Lupus es una enfermedad que puede afectar a casi todos los órganos del cuerpo. Los síntomas que produce esta enfermedad pueden ser desde leves hasta fatales. Conocer qué es el lupus
X-Plain Lupus Sumario Lupus es una enfermedad que puede afectar a casi todos los órganos del cuerpo. Los síntomas que produce esta enfermedad pueden ser desde leves hasta fatales. Conocer qué es el lupus
Datos Acerca de la Hepatitis C
 Datos Acerca de la Hepatitis C Usted puede tomar medidas para prevenir el contagio con hepatitis C. Si tiene hepatitis C, existen nuevos tratamientos que pueden curar la hepatitis C y mantener su hígado
Datos Acerca de la Hepatitis C Usted puede tomar medidas para prevenir el contagio con hepatitis C. Si tiene hepatitis C, existen nuevos tratamientos que pueden curar la hepatitis C y mantener su hígado
SU GUÍA PARA LOS SERVICIOS DE VALOR AGREGADO GRATUITOS
 SU GUÍA PARA LOS SERVICIOS DE VALOR AGREGADO GRATUITOS Juntos, podemos mejorar su experiencia en los Centros de Enfermeria Válida del 1 de septiembre de 2015 al 31 de agosto de 2016 Hidalgo, Tarrant y
SU GUÍA PARA LOS SERVICIOS DE VALOR AGREGADO GRATUITOS Juntos, podemos mejorar su experiencia en los Centros de Enfermeria Válida del 1 de septiembre de 2015 al 31 de agosto de 2016 Hidalgo, Tarrant y
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
