CETUXIMAB en cáncer de células escamosas de cabeza y cuello Informe de evaluación Fecha 19/10/06
|
|
|
- María Teresa Castro Herrera
- hace 6 años
- Vistas:
Transcripción
1 CETUXIMAB en cáncer de células escamosas de cabeza y cuello Informe de evaluación Fecha 19/10/ IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Cetuximab (Erbitux ) Indicación clínica solicitada: Cáncer de cabeza y cuello. Autores / Revisores: Manuel Cárdenas Aranzana*; Mª del Pilar González Macías**. * Hospital Universitario Reina Sofía. **Hospital Blanca Paloma de Huelva. Revisado por el Comité de Actualización de la Guía Farmacoterapéutica de Hospitales de Andalucía. Declaración Conflicto de Intereses de los autores: Ver declaración en anexo al final del informe. 2.- SOLICITUD Y DATOS DEL PROCESO DE EVALUACIÓN Servicio: Oncología Justificación de la solicitud: La asociación cetuximab + radioterapia (RT) es más efectiva que la RT sola en aquellos pacientes en los que la quimioterapia con cisplatino no pueda utilizarse o sean refractarios al tratamiento. 3.- AREA DESCRIPTIVA DEL MEDICAMENTO Nombre genérico: Cetuximab Nombre comercial: Erbitux Laboratorio: Merck Farma y Química Grupo terapéutico. Denominación: Otros citostáticos: Anticuerpos monoclonales Vía de administración: intravenosa Tipo de dispensación: Medicamento de uso hospitalario Vía de registro: Centralizado a nivel europeo por la EMEA. Código ATC: L01XC Presentaciones y precio Forma farmacéutica y dosis Código Coste por unidad PVL con IVA Erbitux 2 mg/ml vial 50 ml , AREA DE ACCIÓN FARMACOLÓGICA. 4.1 Mecanismo de acción. Cetuximab es un anticuerpo IgG1 monoclonal quimérico cuya diana es el receptor del factor de crecimiento epidérmico (EGFR), implicado en el control de la supervivencia celular, la progresión del ciclo celular, la angiogénesis, la migración celular y la invasión/metástasis celular. El cetuximab se une al EGFR con una afinidad aproximadamente 5 a 10 veces superior a la de los ligandos endógenos, provocando la inhibición de la función del receptor. Además induce la internalización de EGFR lo que conllevaría una disminución de los receptores disponibles en la superficie celular. También dirige a las células efectoras inmunitarias citotóxicas hacia las células tumorales que expresan EGFR (citotoxicidad mediada por células dependiente de anticuerpo, ADCC). Efectos farmacodinámicos: inhibe la proliferación e induce la apoptosis de células tumorales humanas que expresan EGFR, también inhibe la expresión de factores angiogénicos por parte de las células tumorales y provoca una reducción de la neovascularización y metástasis tumorales. 4.2 Indicaciones clínicas formalmente aprobadas y fecha de aprobación AEMyPS y EMEA: En combinación con RT está indicado para el tratamiento de pacientes con cáncer de células escamosas de cabeza y cuello localmente avanzado. FDA: 1. Cáncer de células escamosas de cabeza y cuello regional o localmente avanzado. En combinación con RT. 2. Cáncer de células escamosas de cabeza y cuello recurrente o metastásico, refractario a terapia con platino. 4.3 Posología, forma de preparación y administración. Posología: se administra por vía intravenosa, inicialmente 400 mg/m2, una semana antes del inicio de la radioterapia, continuando con una dosis semanal de 250 mg/m2, unas 6 ó 7 semanas. Forma de preparación y administración: Los viales de cetuximab no deben ser diuidos ni agitados. Tampoco debe administrarse en forma de bolus. Al finalizar la administración, debe lavarse la vía con cloruro sódico 0,9%, y debe mantenerse al paciente en observación durante 1 hora. Cetuximab se administra por vía intravenosa, con filtración en línea, mediante una bomba de perfusión, goteo por gravedad o una bomba de jeringa. El tiempo de perfusión recomendado para la dosis inicial es de 120 minutos. El 1
2 tiempo de perfusión recomendado para las dosis semanales posteriores es de 60 minutos. La velocidad máxima de perfusión no debe superar los 5 ml/min. Antes de la primera perfusión se debe administrar al paciente un antihistamínico. Se recomienda esta medicación previa en todas las perfusiones posteriores. 4.4 Farmacocinética. Las perfusiones intravenosas de cetuximab presentaron una farmacocinética dosis-dependiente a dosis semanales de 5 a 500 mg/m2 de superficie corporal. - Distribución: las concentraciones séricas de cetuximab alcanzaron niveles estables al cabo de tres semanas de monoterapia con cetuximab. - Metabolismo: Se han descrito diversas vías que pueden contribuir al metabolismo de los anticuerpos. Todas ellas implican la biodegradación del anticuerpo en pequeños péptidos o aminoácidos. - Eliminación: La semivida de eliminación de cetuximab es h a la dosis establecida. Farmacocinética en poblaciones especiales: - La farmacocinética no se ve influenciada por la raza, la edad o el sexo. - Hasta la fecha solo se han realizado investigaciones en pacientes con función renal y hepática adecuada (creatinina sérica < o = 1,5 veces, transaminasas < o = 5 veces y bilirrubina < o = 1,5 veces el límite superior de la normalidad). 4.5 Características comparadas con otros medicamentos con la misma indicación disponibles en el Hospital. Características comparadas con otros medicamentos similares Presentación del esquema Cisplatino (CP) CP + Fluorouracilo (5FU) Cetuximab + Radioterapia (Cetux+RT) Posología CP 100mg/m2 d1 CP 100mg/m2 d1 + 5FU 1000mg/m2 d1:5, c/21d Características diferenciales Su administración está asociada a insuficiencia renal (>25%), a veces irreversible, y aplasia medular (25% - 30%), lo cual obliga a interrupción del tratamiento. Posible incremento de las manifestaciones tóxicas del cisplatino, especialmente cardiotoxicidad. Cetux 400 mg/m2 d1 + Cetux 250 mg/m2 y RT c/7d Su administración está asociada a rash acneiforme y reacciones relacionadas con la infusión. 5.- EVALUACIÓN DE LA EFICACIA. 5.1 Ensayos clínicos disponibles para la indicación clínica evaluada No se dispone del informe EPAR de la EMEA ni del informe CEDER de la FDA para esta indicación. En octubre de 2006 se solicita una búsqueda bibliográfica al CADIME. Adjunta 1ensayo pivotal fase III que compara la administración de cetuximab añadido a radioterapia con radioterapia sola, 6 ensayos clínicos en fase II en los que se aborda el tratamiento con cetuximab en combinación con cisplatino/carboplatino, 1ensayo clínico fase II que estudia la eficacia de cetuximab en monoterapia (abstract). También incluyen una revisión de este medicamento y 8 artículos que abordan la utilización de cetuximab en esta patología. El ensayo clínico considerado para realizar esta evaluación es el ensayo pivotal. El resto de ensayos no se han tenido en cuenta ya que no se ajustan a las indicaciones aprobadas para este medicamento en España (tratamiento de pacientes con cáncer de células escamosas de cabeza y cuello localmente avanzado en combinación con radioterapia). 5.2.a Resultados de los ensayos clínicos Bonner JA, Harari PM, Giralt J et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006; 354: Diseño: estudio fase III, multicéntrico, randomizado, abierto de evaluación ciega. Nº de pacientes: 424 (213 pacientes en el grupo control y 211 en el grupo activo) Tratamiento grupo activo y tratamiento grupo control: Todos los pacientes recibían radioterapia y los del grupo activo recibían además cetuximab: una dosis de carga de 400 mg/m2 la semana anterior al inicio de la radioterapia y 250 mg/m2 semanal en las semanas posteriores. Criterios de inclusión: pacientes con cáncer de laringe, orofaringe o hipofaringe en estadío III/iV no metastásico, función hematopoyética, renal y hepática normales. Criterios de exclusión: haber tenido cáncer o haber recibido quimioterapia en los tres años anteriores al inicio del estudio, o cirugía o radioterapia para cáncer de cabeza y cuello. Pérdidas: 3 pacientes interrumpen el tratamiento tras una dosis de cetuximab (sin radioterapia). Tipo de análisis: análisis por intención de tratar (ITT) 2
3 Resultados Variable evaluada RT+Cetuximab (n=211) RT (n=213) Diferencias HR/RR/OR p NNT Resultado principal Control locorregional de la enfermedad -Tiempo hasta progresión -% pacientes con control locorregional al año -% pacientes con control locorregional a los dos años -% pacientes con control locorregional a los tres años Resultados secundarios 24, , ,68(0,52-0,89) 0,005 <0,01 8 (5 a 24) Supervivencia -Mediana (meses) a 54 meses -Tasa de supervivencia a 2 años (%) -Tasa de supervivencia a 3 años (%) Supervivencia libre de progresión -Mediana (meses) a 54 meses -Tasa de supervivencia a 2 años (%) -Tasa de supervivencia a 3 años (%) Tasa de respuesta (%) , , , ,74 (0,57-0,97) 0,7 (0,54-0,90) 0,57 (0,36-0,90) 0,03 0,05 0,006 0,04 0,02 10 (6 a 101) 9 (5 a 41) 5.2.b Evaluación de la validez y de la utilidad práctica de los resultados -Validez interna. Limitaciones de diseño y/o comentarios: Se trata de un estudio abierto, ITT, randomizado y de evaluación ciega. Incluye 424 (213 pacientes en el grupo control y 211 en el grupo activo), y aunque 3 pacientes interrumpen el tratamiento tras una dosis de cetuximab, siguieron incluidos en el seguimiento del estudio (ITT). Los dos grupos eran muy similares en cuanto a las características de los pacientes: edad, sexo, Karnofsky, localización del tumor primario, EGFR...). -Aplicabilidad del ensayo a la práctica del hospital: El comparador (radioterapia sola) no es muy adecuado ya que en nuestro medio no es el tratamiento estándar. En cuanto al grupo estudio, las dosis utilizadas son las aprobadas para esta indicación. El tipo de pacientes incluido en el estudio es muy similar al de la práctica diaria del hospital, pero la localización de los tumores está muy limitada. -Relevancia clínica de los resultados: En cuanto a los resultados, el control locorregional de la enfermedad (mediana) pasa de 14,9 meses en el grupo control a 24,4 meses en el grupo estudio, y la supervivencia (mediana) pasa de 29,3 meses a 49,0 meses en el grupo con cetuximab. Es de destacar que los pacientes incluidos tenían como localizaciones orofaringe, laringe e hipofaringe. El análisis por subgrupos de los resultados de eficacia muestra que son los pacientes con cáncer localizado en orofaringe quienes más se benefician de la adición de cetuximab a la radioterapia, contribuyendo decisivamente este subgrupo a los resultados globales: Resultados Variable evaluada RT+Cetuximab(n=211) RT( (n=213) HR Control locorregional de la enfermedad -Tiempo hasta progresión Orofaringe Laringe Hipofaringe SupervivenciaGlobal Orofaringe Laringe Hipofaringe >
4 Los siguientes cuestionarios y escalas de valoración se presentan en forma de anexo, al final de este informe de evaluación. -Escala de Jadad para ensayos de superioridad -Cuestionario de aplicabilidad 5.3 Revisiones sistemáticas publicadas y sus conclusiones No disponibles 5.4 Evaluación de fuentes secundarias No disponible. 6. EVALUACIÓN DE LA SEGURIDAD Descripción de los efectos adversos más significativos (por su frecuencia o gravedad) Ficha técnica: - Inmunológicos: (1-10%): Reacciones de hipersensibilidad en el 5% de los pacientes; alrededor de la mitad de éstas son graves. Las reacciones leves o moderadas (grado 1 ó 2) incluyen síntomas como fiebre, escalofríos, nauseas, erupciones exantemáticas o disnea. Las reacciones de hipersensibilidad graves (grado 3 ó 4) suelen aparecer durante la perfusión inicial de cetuximab o antes de transcurrida una hora desde el final de la misma, e incluyen la aparición rápida de obstrucción de las vías aéreas ( espasmo bronquial, estridor, ronquera, dificultad para hablar), urticaria, y/o hipotension. - Oculares: conjuntivitis (5%). - Respiratorios, torácicos y mediastínicos: (>10%): disnea (25%) en estadios terminales de cáncer colorrectal. En pacientes ancianos y en pacientes con estado funcional disminuido o trastornos pulmonares previos, se observó un incremento en la incidencia de disnea, en algunas ocasiones grave. - Piel y del tejido subcutáneo: (>10%): Pueden aparecer reacciones cutáneas en más del 80% de los pacientes; aproximadamente el 15% de éstas son graves. Se manifiestan principalmente como acné y/o, con menor frecuencia, trastornos ungueales (ej. paroniquia). La mayor parte de reacciones cutáneas aparecen durante la primera semana de tratamiento y suelen resolverse sin secuelas con el tiempo tras la interrupción del tratamiento, si se respetan los ajustes de la posología recomendados. Según el NCI-CTC, las reacciones cutáneas de grado 2 se caracterizan por erupción cutánea que afectan como máximo hasta al 50% de la superficie corporal, mientras que las de grado 3, afectan a un porcentaje igual o superior al 50% de la superficie corporal Seguridad. Ensayos Clínicos comparativos. En el estudio pivotal, que estudiaba la combinación de cetuximab con radioterapia frente a RT sola, los efectos adversos registrados eran similares en cuanto a incidencia y tipología en ambos grupos, excepto en el caso del rash acneiforme que era más frecuente y de mayor gravedad en el grupo de pacientes tratados con Cetux+RT. En este grupo también fueron frecuentes las reacciones relacionadas con la perfusión. No se observó exacerbación de las reacciones adversas asociadas a la radioterapia (mucositis, disfagia, dolor, pérdida de peso...) en el grupo estudio. En la tabla adjunta se expone la incidencia comparada de efectos adversos de este estudio. Referencia: Bonner JA, Harari PM, Giralt J et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006; 354: Resultados de seguridad Variable de seguridad evaluada en el estudio Trat estudiado (211) Trat control (213) RAR (IC 95%) Diferencia Riesgo Absoluto * P NNH o NND (IC 95%)* % de pacientes que presentaron: -Rash acneiforme - Rash acneiforme grado 3-5 -Reaccion a la perfusión -Pérdida de peso -Anemia ,6% (72,6% a 84,5%) 16,4% (11,1% a 21,7%) 13,5% (8,3% a 18,7%) 12,9%( 5,2% a 20,7%) -10,3% (-15,4% a 5,2%) <0,001 <0,001 <0,001 0,005 <0,001 2 (2 a 2) 7 (5 a 10) 8 (6 a 13) 8 (5 a 20) -10 (-20 a 7) 4
5 6.3. Fuentes secundarias sobre seguridad. No disponible Precauciones de empleo en casos especiales -Contraindicaciones: No se han realizado estudios específicos en pacientes con insuficiencia hepática o renal o alteraciones hematológicas. La experiencia en pacientes de 75 años o más es limitada. -Interacciones: No se han realizado otros estudios formales de interacción con cetuximab en humanos Seguridad: prevención de errores de medicación en la selección e introducción de un nuevo fármaco Pueden producirse a distintos niveles: -Almacenamiento: al ser medicamento termolábil, hay que conservarlo en nevera para no alterar su estabilidad. -Prescripción: pueden producirse errores si no se obtienen correctamente los datos antropométricos del paciente, ya que la dosificación se realiza en relación con la superficie corporal. -Elaboración de las dosificaciones: los viales no deben diluirse con ningún disolvente. -Administración: debe realizarse utilizando un filtro en línea, debido a la posibilidad de aparición de partículas. Además, es necesario administrar un antihistamínico previamente a la administración de cetuximab para minimizar la aparición de reacciones de hipersensibilidad. Deben respetarse los tiempos de administración aconsejados. -Finalmente, es necesario mantener al paciente en observación durante al menos 1 h para detectar la aparición de reacciones adversas. Con el fin de minimizar los errores de medicación relacionados con este medicamento, es necesario que todo el personal implicado esté correctamente informado de las características particulares de este medicamento, y al mismo tiempo informar adecuadamente al paciente sobre las posibles reacciones adversas, para que colabore en la detección prematura de las mismas. 7. AREA ECONÓMICA 7.1-Coste tratamiento / día y coste del tratamiento completo. Coste incremental. Comparación con la terapia de referencia o alternativa a dosis usuales. Comparación de costes del tratamiento evaluado frente a otra/s alternativa/s Tratamientos Cetuximab + RT Cisplatino Cisplatino+5 FU Radioterapia Precio unitario (PVL+IVA) * Posología 400 mg/m mg/m2 d1 CP 100 mg/m2 d mg/m2 y RT c/7d 5FU 1000mg/m2 d1:5, c/21d Coste tratamiento completo coste de RT 12, (coste de 8 semanas de tratamiento) Coste incremental (diferencial) respecto a la terapia de referencia (CP 100 mg/m2) coste de RT Coste incremental (diferencial) respecto a la terapia alternativa (CP 100mg/m2 d1+5fu 1g/m2 d1:5, c/21d) Coste incremental (diferencial) respecto a radioterapia sola coste de RT a-Coste Eficacia Incremental (CEI). Hay que señalar que los siguientes cálculos se hacen teniendo en cuenta el estudio pivotal presentado, donde se compara cetuximab y radioterapia frente a radioterapia sola, que no es el estándar de tratamiento de estos pacientes. 5
6 Coste Eficacia Incremental (CEI) Variables binarias Referencia Tipo de resultado VARIABLE evaluada Bonner J et al. Principal Tiempo hasta progresión: Pacientes con control locoregional de la enfermedad a los 3 años Medicamento con que se compara NNT (IC 95%) * Coste incremental (A-B) CEI (IC95%) Radioterapia 8 (5 a 24) uros (A-B) x NNT: (A-B) x N inf: (A-B) x N sup: Interpretación: Según los datos de eficacia del ensayo y el coste del tratamiento, por cada paciente adicional que obtiene un control locorregional de la enfermedad a los tres años, el coste adicional estimado sobre haber empleado radioterapia es de , aunque también es compatible con un CEI de y Seleccionando los pacientes con cáncer de orofaringe, el coste/beneficio sería mucho más favorable. Con un coste incremental de /paciente se conseguiría un aumento de la mediana de supervivencia de al menos tres años. 7.2.b-Coste eficacia incremental estudios publicados No se dispone de estudios farmacoeconómicos publicados Estimación del número de pacientes/año candidatos al tratamiento en el hospital, coste estimado anual y unidades de eficacia anuales. Se estima que durante un año podrían llegar a ser tratados en nuestro hospital un total de 100 nuevos pacientes con el nuevo fármaco, pero si consideramos como candidatos a recibir cetuximab más radioterapia, aquellos en los que la terapia con platino no fuese posible y el paciente recibiera entonces sólo radioterapia, podríamos estimar el número de pacientes candidatos en 5-10/año: Estimación del número de pacientes/año candidatos al tratamiento en el hospital, coste estimado anual y unidades de eficacia anuales Nº anual de pacientes Coste incremental por paciente NNT Impacto económico anual Unidades de eficacia anuales ,6 1,25 (aprox. 1) Interpretación. Se estima que durante un año podrían llegar a ser tratados en nuestro hospital un total de 5-10 pacientes con el nuevo fármaco. El coste anual adicional para el hospital sería de a euros. El número estimado de pacientes que obtendrían beneficio respecto de la radioterapia durante el período de un año sería Estimación del impacto económico sobre la prescripción de Atención Primaria. No procede 7.5.Estimación del impacto económico global a nivel autonómico/estatal No procede 8.- AREA DE CONCLUSIONES. 8.1 Resumen de los aspectos más significativos y propuesta. Eficacia: cetuximab asociado a radioterapia ha demostrado su mayor eficacia para el tratamiento del cáncer de cabeza y cuello que la radioterapia sola en pacientes en estadío avanzado. Las localizaciones de este tumor en los pacientes incluidos en el estudio pivotal fueron orofaringe, laringe e hipofaringe. Dentro de ellas, los pacientes con cáncer de orofaringe son los que se más benefician,. Seguridad: la administración de cetuximab se asocia a aparición de reacciones adversas relacionadas con la infusión (se recomienda premedicación con antihistamínico) y rash acneiforme, pero no hubo otras diferencias respecto del grupo control (radioterapia sola). Coste: el coste incremental por paciente respecto al tratamiento estándar con cisplatino es y de respecto a radioterapia. -Resumen de beneficio riesgo y coste efectividad: No se dispone de ensayos en los que se compare el tratamiento con cisplatino frente al esquema cetuximab + radioterapia. Tenemos que considerar que la radioterapia sola no constituye el tratamiento estándar de la enfermedad, 6
7 sino más bien la alternativa terapéutica en aquellos pacientes en los que la administración de cisplatino está contraindicada, o no hay respuesta a dicho tratamiento. El subgrupo de pacientes con localización del tumor en orofaringe es el que se beneficia principalmente del tratamiento. -En consecuencia, la propuesta de los autores del informe es que sea clasificado como: Categoría D, con condiciones de uso. 8.2 Lugar en terapéutica. Condiciones de uso en el hospital. Aplicación de los datos y conclusiones al hospital. Tratamiento en adultos del cáncer de cabeza y cuello localizado en orofaringe en estadío avanzado, junto a radioterapia, en aquellos casos en los que el tratamiento de quimiorradioterapia basado en cisplatino fracase, ó esté contraindicado, o deba suspenderse por toxicidad, y el paciente quedase supeditado a recibir sólo radioterapia. 8.3 Indicaciones y servicios aprobados. Servicio en el que se aprueba su utilización: Oncología. Indicaciones: Tratamiento en adultos del cáncer de cabeza y cuello localizado en orofaringe en estadío avanzado, junto a radioterapia, en aquellos casos en los que el tratamiento de quimiorradioterapia con cisplatino fracase, o esté contraindicado, o deba suspenderse por toxicidad. 8.4 Especificar si la inclusión del fármaco va acompañada con la propuesta de retirada de algún otro fármaco. No se propone la retirada de ningún medicamento ya incluido. 8.5 Especificar si se produce algún cambio en el PIT (Programa de Intercambio Terapéutico). No se produce ningún cambio en el PIT 9.- BIBLIOGRAFÍA. Referencias empleadas para redactar el informe. 1. Cetuximab (Drug Evaluations). In: Klasko RK, editor. Drugdex System. Micromedex, Greenwood Village, Colorado (Vol. 129) 2. Trigo J et al. Cetuximab monotherapy is active in patients with platinum-refractory recurrent/metastatic squamous cell carcinoma of the head and neck (SCCHN): results of a phase II study. J Clin Oncol 2004; 22 (14S):[abst 5502]. 3. Bonner JA et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 2006; 354 (6): Cetuximab en cancer de cabeza y cuello Informe de la Comisión de Farmacia y Terapéutica del Hospital Universitario Reina Sofía. 5. Martindale. Guía completa de consulta farmacoterapéutica. Pharma editores EVALUACIÓN: Conclusiones finales Fecha de evaluación por la CFyT: 29/11/2006 Nota: cumplimentar después de finalizar el informe de evaluación Decisión adoptada por el Comité : D. Se incluye en la GFT con recomendaciones de uso. Tratamiento en adultos del cáncer de cabeza y cuello localizado en orofaringe en estadío avanzado, junto a radioterapia, en aquellos casos en los que el tratamiento de quimiorradioterapia con cisplatino fracase, o esté contraindicado, o deba suspenderse por toxicidad 7
8 ANEXO APARTADO 1 del informe modelo completo DECLARACIÓN DE CONFLICTO DE INTERESES DE LOS AUTORES/REVISORES DE LA EVALUACIÓN Los autores/revisores de este informe, Manuel Cárdenas Aranzana y Mª del Pilar González Macías declaran: -No tener ningún contrato con las compañías farmacéuticas que tienen registrado el medicamento que se evalúa, ni tampoco con los laboratorios que compiten comercialmente con el mismo. -No beneficiarse de ninguna beca o ayuda por parte de dichas compañías. -No tener ninguna otra relación personal, comercial o profesional que pueda influir en la valoración objetiva y científica del medicamento 8
9 ANEXO APARTADO 5.2.b del informe modelo base Referencia del ensayo evaluado: a) Análisis de validez interna del ensayo de superiordad 5.2.b Tabla 1 PUNTUACIÓN ESCALA DE VALIDACIÓN DE ENSAYOS CLÍNICOS DE SUPERIORIDAD ( A. JADAD) Se describe el estudio como aleatorizado? (*) 1 Se describe el estudio como doble ciego? (*) 0 Se describen los abandonos y exclusiones del estudio? (*) 1 Es adecuado el método de aleatorización? (**) 1 Es adecuado el método de doble ciego? (**) -1 TOTAL 2 (*) SÍ= 1 / NO= 0 (**) SÍ= 1 / NO= -1 Rango de puntuación: 0-5 Estudio de baja calidad: Puntuación < 3 b) Analisis de Aplicabilidad 5.2.b Tabla 3 CUESTIONARIO SOBRE LA APLICABILIDAD DE UN ENSAYO CLÍNICO SI/NO JUSTIFICAR Considera adecuado el comparador? Es el tratamiento control adecuado en nuestro medio? No No. Actualmente no se utiliza como tratamiento estándar la radioterapia sola. Son importantes clínicamente los resultados? Si Considera adecuada la variable de medida utilizada? Considera adecuados los criterios de inclusión y/o exclusión de los pacientes? Si No. Las variables que se han manejado en el ensayo son habitualmente utilizadas en la clínica. Los criterios de inclusión/exclusión son demasiado selectivos. Cree que los resultados pueden ser aplicados directamente a la práctica clínica? Otros sesgos o limitaciones encontradas en el estudio Si No Si 9
Nombre del fármaco e indicación clínica (Informe del Servicio de Farmacia Hospitalaria del Hospital xxxxxxxxxx) Fecha xx/xx/xx
 ANEXO II Modelo de Informe Técnico de Evaluación de Nuevos Medicamentos 1 Nombre del fármaco e indicación clínica (Informe del Servicio de Farmacia Hospitalaria del Hospital xxxxxxxxxx) Fecha xx/xx/xx
ANEXO II Modelo de Informe Técnico de Evaluación de Nuevos Medicamentos 1 Nombre del fármaco e indicación clínica (Informe del Servicio de Farmacia Hospitalaria del Hospital xxxxxxxxxx) Fecha xx/xx/xx
Coste por unidad PVL con IVA Vial 100 mg/ 50 ml 1 vial 745026 246,69 204,60
 Servei de Farmàcia Informe CFT: 1/6 Cetuximab Tratamiento de cáncer de células escamosas de cabeza y cuello localmente avanzado, en combinación con radioterapia Informe para la Comisión Farmacoterapéutica
Servei de Farmàcia Informe CFT: 1/6 Cetuximab Tratamiento de cáncer de células escamosas de cabeza y cuello localmente avanzado, en combinación con radioterapia Informe para la Comisión Farmacoterapéutica
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
EVALUACIÓN DE RESULTADOS DE CRIZOTINIB EN CÁNCER DE PULMÓN NO MICROCÍTICO. Mª José Moreno Fernández
 EVALUACIÓN DE RESULTADOS DE CRIZOTINIB EN CÁNCER DE PULMÓN NO MICROCÍTICO Mª José Moreno Fernández Introducción. Situación actual de Crizotinib. Objetivos. Material y métodos. Resultados. Limitaciones
EVALUACIÓN DE RESULTADOS DE CRIZOTINIB EN CÁNCER DE PULMÓN NO MICROCÍTICO Mª José Moreno Fernández Introducción. Situación actual de Crizotinib. Objetivos. Material y métodos. Resultados. Limitaciones
MIELOMA MÚLTIPLE: Bortezomib 1/6
 MIELOMA MÚLTIPLE: Bortezomib 1/6 1. DENOMINACIÓN DEL ESQUEMA: BORTEZOMIB 2. USO TERAPÉUTICO (1) : Tratamiento de pacientes con mieloma múltiple que han recibido al menos dos tratamientos previos y que
MIELOMA MÚLTIPLE: Bortezomib 1/6 1. DENOMINACIÓN DEL ESQUEMA: BORTEZOMIB 2. USO TERAPÉUTICO (1) : Tratamiento de pacientes con mieloma múltiple que han recibido al menos dos tratamientos previos y que
A. DESCRIPCIÓN DEL MEDICAMENTO Y SU INDICACIÓN
 17 INSULINA GLARGINA A. DESCRIPCIÓN DEL MEDICAMENTO Y SU INDICACIÓN 1. Denominación común internacional (DCI), denominación oficial española (DOE) o nombre genérico del principio activo. glargina (Lantus
17 INSULINA GLARGINA A. DESCRIPCIÓN DEL MEDICAMENTO Y SU INDICACIÓN 1. Denominación común internacional (DCI), denominación oficial española (DOE) o nombre genérico del principio activo. glargina (Lantus
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
Comunicación dirigida a los profesionales sanitarios
 Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
Comunicación dirigida a los profesionales sanitarios Metoclopramida (Primperan, Metoclopramida EFG): Actualización de indicaciones y posología para minimizar el riesgo de efectos adversos (principalmente
TACROLIMUS de liberación prolongada
 TACROLIMUS de liberación prolongada Profilaxis rechazo transplante hepático Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias Junio 2008 1.- IDENTIFICACIÓN
TACROLIMUS de liberación prolongada Profilaxis rechazo transplante hepático Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias Junio 2008 1.- IDENTIFICACIÓN
ABSTRACT. Estudio de una droga basado en ARNi, combinado con quimioterapia en pacientes con LAPC Método Resultado Conclusión
 TERAPIA GÉNICA ABSTRACT Estudio de una droga basado en ARNi, combinado con quimioterapia en pacientes con LAPC Método Resultado Conclusión Cáncer pancreático El adenocarcinoma de ducto pancreatico (PDAC)
TERAPIA GÉNICA ABSTRACT Estudio de una droga basado en ARNi, combinado con quimioterapia en pacientes con LAPC Método Resultado Conclusión Cáncer pancreático El adenocarcinoma de ducto pancreatico (PDAC)
Valoración de la conveniencia. Utilidad terapéutica. Puntos clave para la ayuda en la toma de decisiones.
 Valoración de la conveniencia. Utilidad terapéutica. Puntos clave para la ayuda en la toma de decisiones. Dra. Beatriz Calderón HOSPITAL SON LLÀTZER bcaldero@hsll.es 1 DIFERENTES ENFOQUES Perspectiva
Valoración de la conveniencia. Utilidad terapéutica. Puntos clave para la ayuda en la toma de decisiones. Dra. Beatriz Calderón HOSPITAL SON LLÀTZER bcaldero@hsll.es 1 DIFERENTES ENFOQUES Perspectiva
Erbitux prolonga significativamente la supervivencia como tratamiento en primera línea del cáncer no microcítico de pulmón avanzado
 Nota de prensa Contacto Pilar Caro Telf. +34 917454429; 647 533 909 pilar.caro@merck.es Erbitux prolonga significativamente la supervivencia como tratamiento en primera línea del cáncer no microcítico
Nota de prensa Contacto Pilar Caro Telf. +34 917454429; 647 533 909 pilar.caro@merck.es Erbitux prolonga significativamente la supervivencia como tratamiento en primera línea del cáncer no microcítico
MIELOMA MÚLTIPLE: MP 1/5. 1. DENOMINACIÓN DEL ESQUEMA: MP (Melfalán-Prednisona).
 MIELOMA MÚLTIPLE: MP 1/5 1. DENOMINACIÓN DEL ESQUEMA: MP (Melfalán-Prednisona). 2. USO TERAPÉUTICO (1). Mieloma múltiple. Tratamiento de primera línea cuando no está indicado el trasplante de células progenitoras
MIELOMA MÚLTIPLE: MP 1/5 1. DENOMINACIÓN DEL ESQUEMA: MP (Melfalán-Prednisona). 2. USO TERAPÉUTICO (1). Mieloma múltiple. Tratamiento de primera línea cuando no está indicado el trasplante de células progenitoras
Perfil farmacocinético de los anticuerpos monoclonales
 Perfil farmacocinético de los anticuerpos monoclonales Perfil farmacocinético de los anticuerpos monoclonales Dr. Héctor Telechea. Prof. Adjunto Departamento Farmacología y Terapéutica. F. Medicina. UdelaR.
Perfil farmacocinético de los anticuerpos monoclonales Perfil farmacocinético de los anticuerpos monoclonales Dr. Héctor Telechea. Prof. Adjunto Departamento Farmacología y Terapéutica. F. Medicina. UdelaR.
El abordaje del carcinoma de células de Merkel
 El abordaje del carcinoma de células de Merkel Iván Márquez Rodas MD, PhD Servicio de Oncología Médica Hospital General Universitario Gregorio Marañón EPIDEMIOLOGÍA, PATOLOGÍA Y DIAGNÓSTICO LA IMPORTANCIA
El abordaje del carcinoma de células de Merkel Iván Márquez Rodas MD, PhD Servicio de Oncología Médica Hospital General Universitario Gregorio Marañón EPIDEMIOLOGÍA, PATOLOGÍA Y DIAGNÓSTICO LA IMPORTANCIA
SODIOFOLIN 50 mg/ml solución para inyección o perfusión intravenosa
 L e a t o d o e l p r o s p e c t o d e t e n i d a m e n t e a n t e s d e e m p e z a r En este prospecto 1. Qué es Sodiofolin 50 mg/ml solución para inyección o perfusión intravenosa y para qué se utiliza
L e a t o d o e l p r o s p e c t o d e t e n i d a m e n t e a n t e s d e e m p e z a r En este prospecto 1. Qué es Sodiofolin 50 mg/ml solución para inyección o perfusión intravenosa y para qué se utiliza
ZOLEDRONICO, ACIDO. para enfermedad de Paget
 ZOLEDRONICO, ACIDO. para enfermedad de Paget Fecha 21/11/2006 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Ácido Zoledrónico. Indicación clínica solicitada: Tratamiento de la enfermedad
ZOLEDRONICO, ACIDO. para enfermedad de Paget Fecha 21/11/2006 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Ácido Zoledrónico. Indicación clínica solicitada: Tratamiento de la enfermedad
AUTOR (ES) Ferriols Lisart F, Ferriols Lisart R, Magraner Gil J.
 AUTOR (ES) Ferriols Lisart F, Ferriols Lisart R, Magraner Gil J. TÍTULO Evaluación farmacoeconómica del docetaxel versus paclitaxel en el tratamiento de cáncer de mama metastásico. REVISTA Farmacia Hospitalaria
AUTOR (ES) Ferriols Lisart F, Ferriols Lisart R, Magraner Gil J. TÍTULO Evaluación farmacoeconómica del docetaxel versus paclitaxel en el tratamiento de cáncer de mama metastásico. REVISTA Farmacia Hospitalaria
USO DEL ANTICUERPO MONOCLONAL ACM H-R3 EN EL TRATAMIENTO DEL CARCINOMA EPIDERMOIDE.
 Este PDF provisional corresponde a la versión final aceptada del artículo. La versión final en el formato y estilo de la revista en PDF estará prontamente disponible. USO DEL ANTICUERPO MONOCLONAL ACM
Este PDF provisional corresponde a la versión final aceptada del artículo. La versión final en el formato y estilo de la revista en PDF estará prontamente disponible. USO DEL ANTICUERPO MONOCLONAL ACM
GUÍA DE PRÁCTICAS TUTELADAS EN SERVICIOS DE FARMACIA HOSPITALARIA
 Universidad de Salamanca Facultad de Farmacia GUÍA DE PRÁCTICAS TUTELADAS EN SERVICIOS DE FARMACIA HOSPITALARIA Depósito legal: S.881-2001. Servicio Territorial de Cultura. Delegación Territorial de Salamanca.
Universidad de Salamanca Facultad de Farmacia GUÍA DE PRÁCTICAS TUTELADAS EN SERVICIOS DE FARMACIA HOSPITALARIA Depósito legal: S.881-2001. Servicio Territorial de Cultura. Delegación Territorial de Salamanca.
son candidatos a la terapia estándar con derivados de antraciclinas (1).
 1. DENOMINACIÓN DEL ESQUEMA: PACLITAXEL 2. INDICACIÓN! Carcinoma metastásico de mama en pacientes que han fracasado o no son candidatos a la terapia estándar con derivados de antraciclinas (1). 3. ESQUEMA
1. DENOMINACIÓN DEL ESQUEMA: PACLITAXEL 2. INDICACIÓN! Carcinoma metastásico de mama en pacientes que han fracasado o no son candidatos a la terapia estándar con derivados de antraciclinas (1). 3. ESQUEMA
Autores: ÍNDICE: 1. Justificación. 2. Objetivo. 3. Ámbito de aplicación. 4. Protocolo de tratamiento. 5. Recursos necesarios
 PROTOCOLO DE USO DE PLERIXAFOR (MOZOBIL ) EN MOVILIZACIÓN Y COLECTA DE PROGENITORES DE SANGRE PERIFÉRICA PARA TRASPLANTE AUTÓLOGO DE PROGENITORES HEMATOPOYÉTICOS (TPH) Autores: Dr Jorge Gayoso. Jefe Sección
PROTOCOLO DE USO DE PLERIXAFOR (MOZOBIL ) EN MOVILIZACIÓN Y COLECTA DE PROGENITORES DE SANGRE PERIFÉRICA PARA TRASPLANTE AUTÓLOGO DE PROGENITORES HEMATOPOYÉTICOS (TPH) Autores: Dr Jorge Gayoso. Jefe Sección
INSECTICIDAS: Carbamatos y organofosforados
 INSECTICIDAS: Carbamatos y organofosforados Definición: Insecticidas agrícolas, domésticos, para animales de compañía o para labores de jardinería. La intoxicación aguda puede producirse por cualquier
INSECTICIDAS: Carbamatos y organofosforados Definición: Insecticidas agrícolas, domésticos, para animales de compañía o para labores de jardinería. La intoxicación aguda puede producirse por cualquier
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012
 Fecha de publicación: 29 de marzo de 2012 - Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012 Se han producido casos de sobredosis con la administración IV de Perfalgan 10mg/ml
Fecha de publicación: 29 de marzo de 2012 - Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012 Se han producido casos de sobredosis con la administración IV de Perfalgan 10mg/ml
FICHA TÉCNICA. 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene 750 mg de Hidrocloruro
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO: GLUCOSAMINA GINELADIUS 625 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un comprimido contiene 750 mg de Hidrocloruro
SEGURIDAD, EFECTIVIDAD, COSTE-EFECTIVIDAD E IMPACTO PRESUPUESTARIO DE PANITUMUMAB (VECTIBIX ) PARA EL CÁNCER COLORRECTAL METASTÁTICO
 Seguridad, efectividad, coste-efectividad e impacto presupuestario de Panitumumab SEGURIDAD, EFECTIVIDAD, COSTE-EFECTIVIDAD E IMPACTO PRESUPUESTARIO DE PANITUMUMAB (VECTIBIX ) PARA EL CÁNCER COLORRECTAL
Seguridad, efectividad, coste-efectividad e impacto presupuestario de Panitumumab SEGURIDAD, EFECTIVIDAD, COSTE-EFECTIVIDAD E IMPACTO PRESUPUESTARIO DE PANITUMUMAB (VECTIBIX ) PARA EL CÁNCER COLORRECTAL
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ancesol 10 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Sustancia
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ancesol 10 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Sustancia
FICHA TÉCNICA. Sorbitol líquido (no cristalizante); 1 ml de jarabe contiene 495,6 mg de sorbitol (E 420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol.
 1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
En esta primera sesión de comunicaciones orales sobre melanoma y otros tumores cutáneos se han presentado las siguientes comunicaciones:
 En esta primera sesión de comunicaciones orales sobre se han presentado las siguientes comunicaciones: 1213O. Characterization of complete responses (CRs) in patients with advanced melanoma (MEL) who received
En esta primera sesión de comunicaciones orales sobre se han presentado las siguientes comunicaciones: 1213O. Characterization of complete responses (CRs) in patients with advanced melanoma (MEL) who received
Avances en Cáncer de Cabeza y Cuello
 Avances en Cáncer de Cabeza y Cuello El cáncer de cabeza y cuello es el séptimo cáncer más común en el mundo. A nivel internacional se calculan más de 680.000 casos al año y se producen unas 350.000 muertes
Avances en Cáncer de Cabeza y Cuello El cáncer de cabeza y cuello es el séptimo cáncer más común en el mundo. A nivel internacional se calculan más de 680.000 casos al año y se producen unas 350.000 muertes
FICHA TÉCNICA. Excipientes con efecto conocido: 0,458 g de maltitol líquido (E965) y 1,830 g de isomalta (E953).
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. DENOMINACIÓN DEL ESQUEMA : 5 FLUOROURACILO-LEUCOVORIN EN. Tratamiento adyuvante de cáncer colorectal estadíos B2, B3 y C según clasificación de
 1. DENOMINACIÓN DEL ESQUEMA : 5 FLUOROURACILO-LEUCOVORIN EN ADYUVANCIA 2. USO TERAPÉUTICO Tratamiento adyuvante de cáncer colorectal estadíos B2, B3 y C según clasificación de Dukes (1) 3. ESQUEMAS 3.1
1. DENOMINACIÓN DEL ESQUEMA : 5 FLUOROURACILO-LEUCOVORIN EN ADYUVANCIA 2. USO TERAPÉUTICO Tratamiento adyuvante de cáncer colorectal estadíos B2, B3 y C según clasificación de Dukes (1) 3. ESQUEMAS 3.1
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
Experiencia de enfermería oncológica en la elaboración de una guía de administración de quimioterapia antineoplásica. Marta González Fernández-Conde
 Experiencia de enfermería oncológica en la elaboración de una guía de administración de quimioterapia antineoplásica Marta González Fernández-Conde Introducción El aumento de casos cáncer ha supuesto un
Experiencia de enfermería oncológica en la elaboración de una guía de administración de quimioterapia antineoplásica Marta González Fernández-Conde Introducción El aumento de casos cáncer ha supuesto un
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
EVALUACIÓN DE LA EFICACIA I
 EVALUACIÓN DE LA EFICACIA I XIII Curso de evaluación y selección de Medicamentos Ángel García Álvarez Servicio de Farmacia Hospital Comarcal de Inca Sevilla 12 mayo 2015 Por qué se hacen ensayos clínicos?;
EVALUACIÓN DE LA EFICACIA I XIII Curso de evaluación y selección de Medicamentos Ángel García Álvarez Servicio de Farmacia Hospital Comarcal de Inca Sevilla 12 mayo 2015 Por qué se hacen ensayos clínicos?;
Núm Boletín Oficial de Aragón DEPARTAMENTO DE SALUD Y CONSUMO
 DEPARTAMENTO DE SALUD Y CONSUMO ORDEN de 22 de octubre de 2009, de la Consejera de Salud y Consumo, por la que se regula la constitución y funcionamiento de la Comisión de Evaluación del Medicamento de
DEPARTAMENTO DE SALUD Y CONSUMO ORDEN de 22 de octubre de 2009, de la Consejera de Salud y Consumo, por la que se regula la constitución y funcionamiento de la Comisión de Evaluación del Medicamento de
Coste-efectividad y beneficio
 Coste-efectividad y beneficio clínico en la fijación de precios de medicamentos. EVALUACIÓN DE MEDICAMENTOS: Presentación del Programa MADRE versión 4.0. 14 de Enero 2014, Salón de Actos del Ministerio
Coste-efectividad y beneficio clínico en la fijación de precios de medicamentos. EVALUACIÓN DE MEDICAMENTOS: Presentación del Programa MADRE versión 4.0. 14 de Enero 2014, Salón de Actos del Ministerio
ANÁLISIS DE LA DOSIFICACIÓN DE FÓRMULAS DE ESTIMACIÓN DE LA TASA
 ANÁLISIS DE LA DOSIFICACIÓN DE RIVAROXABAN SEGÚN DISTINTAS FÓRMULAS DE ESTIMACIÓN DE LA TASA DE FILTRACIÓN GLOMERULAR REBOLLAR-TORRES E 1 ; PERALES SARRÍA E; SOLANO ARAMENDÍA M D 2 ; SÁNCHEZ REBOLLAR TORRES
ANÁLISIS DE LA DOSIFICACIÓN DE RIVAROXABAN SEGÚN DISTINTAS FÓRMULAS DE ESTIMACIÓN DE LA TASA DE FILTRACIÓN GLOMERULAR REBOLLAR-TORRES E 1 ; PERALES SARRÍA E; SOLANO ARAMENDÍA M D 2 ; SÁNCHEZ REBOLLAR TORRES
Ficha técnica Página 1
 1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
Hospital Universitario Dr. Peset Valencia, 20 de octubre de 2011.
 EFICIENCIA DE BEVACIZUMAB IRINOTECÁN FLUOROURACILO VERSUS IRINOTECÁN FLUOROURACILO EN PRIMERA LÍNEA DE CARCINOMA COLORRECTAL METASTÁSICO Ruiz Millo O. 1, Sendra García A. 1, Albert Marí A. 1, González
EFICIENCIA DE BEVACIZUMAB IRINOTECÁN FLUOROURACILO VERSUS IRINOTECÁN FLUOROURACILO EN PRIMERA LÍNEA DE CARCINOMA COLORRECTAL METASTÁSICO Ruiz Millo O. 1, Sendra García A. 1, Albert Marí A. 1, González
UNIDAD DE SEGURIDAD DEL PACIENTE
 Página 1 de 5 DE: UNIDAD DE (USP) DIRIGIDA A: FACULTATIVOS ESPECIALISTAS Y PERSONAL DE ENFERMERÍA DEL ÁREA DE SALUD DE IBIZA Y FORMENTERA 1. ASUNTO: Prevención de errores durante la administración de medicamentos.
Página 1 de 5 DE: UNIDAD DE (USP) DIRIGIDA A: FACULTATIVOS ESPECIALISTAS Y PERSONAL DE ENFERMERÍA DEL ÁREA DE SALUD DE IBIZA Y FORMENTERA 1. ASUNTO: Prevención de errores durante la administración de medicamentos.
FICHA TÉCNICA. Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008
 LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco:
LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco:
Análisis de la expresión del Ligando de muerte celular programada (PD-L1) en mesotelioma pleural maligno
 Análisis de la expresión del Ligando de muerte celular programada (PD-L1) en mesotelioma pleural maligno Vázquez Benítez Greissy T, Enguita Valls AB, Susana Cedrés, Santiago Ponce-Aix, Jon Zugazagoitia,
Análisis de la expresión del Ligando de muerte celular programada (PD-L1) en mesotelioma pleural maligno Vázquez Benítez Greissy T, Enguita Valls AB, Susana Cedrés, Santiago Ponce-Aix, Jon Zugazagoitia,
Clasificación de las crisis epilépticas para la programación terapéutica Farmacocinética de los fármacos antiepilépticos...
 Índice Parte 1 - Bases para la terapéutica con fármacos antiepilépticos Clasificación de las crisis epilépticas para la programación terapéutica... 19 Clasificación de las Crisis Epilépticas (1981)...
Índice Parte 1 - Bases para la terapéutica con fármacos antiepilépticos Clasificación de las crisis epilépticas para la programación terapéutica... 19 Clasificación de las Crisis Epilépticas (1981)...
FICHA TÉCNICA VACUNA ANTIPOLIOMIELÍTICA BIVALENTE ORAL
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Bivalente Oral 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0.1 ml contiene Virus de Poliomielitis Tipo 1 1,000,000
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Vacuna Antipoliomielítica Bivalente Oral 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0.1 ml contiene Virus de Poliomielitis Tipo 1 1,000,000
PANITUMUMAB EN CANCER DE COLON METASTÁSICO:
 PANITUMUMAB EN CANCER DE COLON METASTÁSICO: Romero Soria L 1, Jaraquemada Peláez T 2, Martin Clavo S 1, Rivero Cava MS 1, Braga Fuentes JL, Rangel Mayoral JF 1. 1 Servicio de Farmacia Hospitalaria 2 Servicio
PANITUMUMAB EN CANCER DE COLON METASTÁSICO: Romero Soria L 1, Jaraquemada Peláez T 2, Martin Clavo S 1, Rivero Cava MS 1, Braga Fuentes JL, Rangel Mayoral JF 1. 1 Servicio de Farmacia Hospitalaria 2 Servicio
Mitos y realidades de la Investigación Clínica. Rol del Farmacéutico.
 Mitos y realidades de la Investigación Clínica. Rol del Farmacéutico. ESTUDIO DE FARMACOLOGÍA CLÍNICA Es un estudio sistemático científico realizado con un ingrediente farmacéutico activo (IFA) aplicados
Mitos y realidades de la Investigación Clínica. Rol del Farmacéutico. ESTUDIO DE FARMACOLOGÍA CLÍNICA Es un estudio sistemático científico realizado con un ingrediente farmacéutico activo (IFA) aplicados
Valoración nutricional en pacientes oncológicos remitidos a consulta de Nutrición Oncológica del CHUO
 Valoración nutricional en pacientes oncológicos remitidos a consulta de Nutrición Oncológica del CHUO Dra. María Teresa Fernández López de Endocrinología y Nutrición. CHUO Servicio Introducción La prevalencia
Valoración nutricional en pacientes oncológicos remitidos a consulta de Nutrición Oncológica del CHUO Dra. María Teresa Fernández López de Endocrinología y Nutrición. CHUO Servicio Introducción La prevalencia
SELECCION DE MEDICAMENTOS
 SELECCION DE MEDICAMENTOS INTRODUCCION DE CEFEPIMA EN LA GUIA FARMACOTERAPEUTICA DE UN HOSPITAL ODRIOZOLA CINCUNEGUI, B. (FIR I), LICEAGA CUNDIN, G. (FIR II), OLLOQUIEGUI BIURRARENA, E. (FIR III) Coordinador:
SELECCION DE MEDICAMENTOS INTRODUCCION DE CEFEPIMA EN LA GUIA FARMACOTERAPEUTICA DE UN HOSPITAL ODRIOZOLA CINCUNEGUI, B. (FIR I), LICEAGA CUNDIN, G. (FIR II), OLLOQUIEGUI BIURRARENA, E. (FIR III) Coordinador:
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Comunicado de prensa. Basilea, 8 de enero de 2016
 Comunicado de prensa Basilea, 8 de enero de 2016 Roche presenta resultados actualizados relativos al atezolizumab (un fármaco para la inmunoterapia oncológica, en investigación ) en el cáncer de vejiga
Comunicado de prensa Basilea, 8 de enero de 2016 Roche presenta resultados actualizados relativos al atezolizumab (un fármaco para la inmunoterapia oncológica, en investigación ) en el cáncer de vejiga
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GUIA DEL MANUAL DEL INVESTIGADOR
 RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GRUPO DE TRABAJO BUENAS PRÁCTICAS CLÍNICAS DOCUMENTO DE TRABAJO GUIA DEL MANUAL DEL INVESTIGADOR ÍNDICE 1. Introducción y
RED PANAMERICANA PARA LA ARMONIZACIÓN DE LA REGULACIÓN FARMACÉUTICA (RED PARF) GRUPO DE TRABAJO BUENAS PRÁCTICAS CLÍNICAS DOCUMENTO DE TRABAJO GUIA DEL MANUAL DEL INVESTIGADOR ÍNDICE 1. Introducción y
INFORME SOBRE LA SOLICITUD DE INCLUSIÓN DE FACTOR VIII recombinante EN LA GUÍA FARMACOTERAPÉUTICA DEL H.U. PUERTO REAL
 INFORME SOBRE LA SOLICITUD DE INCLUSIÓN DE FACTOR VIII recombinante EN LA GUÍA FARMACOTERAPÉUTICA DEL H.U. PUERTO REAL EMILIO ALEGRE DEL REY, JORGE DÍAZ NAVARRO DESCRIPCIÓN DEL MEDICAMENTO Y ALTERNATIVAS
INFORME SOBRE LA SOLICITUD DE INCLUSIÓN DE FACTOR VIII recombinante EN LA GUÍA FARMACOTERAPÉUTICA DEL H.U. PUERTO REAL EMILIO ALEGRE DEL REY, JORGE DÍAZ NAVARRO DESCRIPCIÓN DEL MEDICAMENTO Y ALTERNATIVAS
Lucía Teijeira Sánchez Oncología médica Complejo Hospitalario de Navarra
 Terapias dirigidas en el anciano Lucía Teijeira Sánchez Oncología médica Complejo Hospitalario de Navarra Epidemiología Definiciones Qué es paciente anciano? No es lo mismo que paciente frágil No es lo
Terapias dirigidas en el anciano Lucía Teijeira Sánchez Oncología médica Complejo Hospitalario de Navarra Epidemiología Definiciones Qué es paciente anciano? No es lo mismo que paciente frágil No es lo
FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA
 1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
Tratamiento inicial de pacientes con cáncer de mama metastásico o avanzado en
 1. DENOMINACIÓN DEL ESQUEMA: TRASTUZUMAB + PACLITAXEL 2. INDICACIÓN Tratamiento inicial de pacientes con cáncer de mama metastásico o avanzado en pacientes cuyos tumores tengan sobreexposición de HER2
1. DENOMINACIÓN DEL ESQUEMA: TRASTUZUMAB + PACLITAXEL 2. INDICACIÓN Tratamiento inicial de pacientes con cáncer de mama metastásico o avanzado en pacientes cuyos tumores tengan sobreexposición de HER2
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
Trinidad Caldés Laboratorio de Oncologia Molecular Servicio de Oncología Médica Hospital Clinico San Carlos. IdISSC
 VALOR PREDICTIVO DE LAS MUTACIONES EN BRAF, PIK3CA Y DE LA EXPRESIÓN DE ANFIREGULINA Y EPIREGULINA EN PACIENTES CON CANCER COLORRECTAL METASTÁSICO CON KRAS NATIVO TRATADOS EN PRIMERA LINEA CON QUIMIOTERAPIA
VALOR PREDICTIVO DE LAS MUTACIONES EN BRAF, PIK3CA Y DE LA EXPRESIÓN DE ANFIREGULINA Y EPIREGULINA EN PACIENTES CON CANCER COLORRECTAL METASTÁSICO CON KRAS NATIVO TRATADOS EN PRIMERA LINEA CON QUIMIOTERAPIA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO TOLFEDINE 4% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. INGREDIENTES ACTIVOS: Ácido tolfenámico... 4,00 g EXCIPIENTES:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO TOLFEDINE 4% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. INGREDIENTES ACTIVOS: Ácido tolfenámico... 4,00 g EXCIPIENTES:
PROSPECTO. GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable
 PROSPECTO GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable GOBEMICINA 250 (Ampicilina) INYECTABLE VIA INTRAVENOSA E INTRAMUSCULAR COMPOSICION Cada vial contiene: «250» AMPICILINA
PROSPECTO GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable GOBEMICINA 250 (Ampicilina) INYECTABLE VIA INTRAVENOSA E INTRAMUSCULAR COMPOSICION Cada vial contiene: «250» AMPICILINA
FICHA TÉCNICA. Excipientes con efecto conocido 1,38 g de sacarosa y 1,10 g glucosa. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Calcipotriol 50 microgramos/g (como hidrato). Para la lista completa de excipientes, ver sección 6.1. 3.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DAIVONEX Crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Calcipotriol 50 microgramos/g (como hidrato). Para la lista completa de excipientes, ver sección 6.1. 3.
FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM
 FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM 1.1 Acción: Antidepresivo. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Inhibe la recaptación de serotonina a nivel de la membrana neuronal,
FICHA DE INFORMACIÓN AL PACIENTE: CITALOPRAM 1.1 Acción: Antidepresivo. 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.2 Cómo actúa este fármaco: Inhibe la recaptación de serotonina a nivel de la membrana neuronal,
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 GRISEOFULVINA 125 mg/5 ml SUSPENSION ANTIMICÓTICO Página 1 GRISEOFULVINA 125 mg/5 ml Suspensión Principio Activo
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 GRISEOFULVINA 125 mg/5 ml SUSPENSION ANTIMICÓTICO Página 1 GRISEOFULVINA 125 mg/5 ml Suspensión Principio Activo
9. Profilaxis de la ITU
 9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
BORTEZOMIB EN LA GUÍA FARMACOTERAPÉUTICA DEL H.U. PUERTO REAL
 INFORME SOBRE LA SOLICITUD DE INCLUSIÓN DE BORTEZOMIB EN LA GUÍA FARMACOTERAPÉUTICA DEL H.U. PUERTO REAL Jorge Díaz Navarro, Emilio Alegre del Rey DESCRIPCIÓN DEL MEDICAMENTO Y ALTERNATIVAS Principio activo
INFORME SOBRE LA SOLICITUD DE INCLUSIÓN DE BORTEZOMIB EN LA GUÍA FARMACOTERAPÉUTICA DEL H.U. PUERTO REAL Jorge Díaz Navarro, Emilio Alegre del Rey DESCRIPCIÓN DEL MEDICAMENTO Y ALTERNATIVAS Principio activo
FICHA TÉCNICA. Alivio a corto plazo (de dos o tres meses) del edema y síntomas relacionados con la insuficiencia venosa crónica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
VACUNACIÓN FRENTE A MENINGOCOCO B (BEXSERO ) Tatiana Amil Pena MIR-4 Pediatría
 VACUNACIÓN FRENTE A MENINGOCOCO B (BEXSERO ) Tatiana Amil Pena MIR-4 Pediatría ÍNDICE Introducción: el meningococo y la enfermedad meningocócica Vacunación frente al meningococo B: Vacuna frente a meningococo
VACUNACIÓN FRENTE A MENINGOCOCO B (BEXSERO ) Tatiana Amil Pena MIR-4 Pediatría ÍNDICE Introducción: el meningococo y la enfermedad meningocócica Vacunación frente al meningococo B: Vacuna frente a meningococo
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada gramo de pomada bucal contiene:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada bucal contiene: Carbenoxolona disódica. 20 mg Excipientes: Para consultar
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada bucal contiene: Carbenoxolona disódica. 20 mg Excipientes: Para consultar
FICHA TÉCNICA. MENCEVAX AC es una preparación liofilizada de polisacáridos purificados de Neisseria meningitidis (meningococo) de los grupos A y C.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
2.1 EFICACIA. Cetuximab en combinación con quimioterapia
 EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
Evaluación del tratamiento con Sunitinib y Sorafenib en el Cáncer de Riñón Metastásico
 Evaluación del tratamiento con Sunitinib y Sorafenib en el Cáncer de Riñón Metastásico Grupo de Seguimiento Dr. Henry Albornoz, Lic. Marcela Baldizzoni, MSc. Gustavo Saona, Dr. Abayuba Perna, QF. Silvia
Evaluación del tratamiento con Sunitinib y Sorafenib en el Cáncer de Riñón Metastásico Grupo de Seguimiento Dr. Henry Albornoz, Lic. Marcela Baldizzoni, MSc. Gustavo Saona, Dr. Abayuba Perna, QF. Silvia
Novedades terapéuticas en insuficiencia cardíaca. Dr. Ramón Bover Freire Unidad de Insuficiencia Cardiaca Servicio de Cardiología
 Novedades terapéuticas en insuficiencia cardíaca Dr. Ramón Bover Freire Unidad de Insuficiencia Cardiaca Servicio de Cardiología Novedades Insuficiencia Cardiaca Aguda Insuficiencia Cardiaca Crónica
Novedades terapéuticas en insuficiencia cardíaca Dr. Ramón Bover Freire Unidad de Insuficiencia Cardiaca Servicio de Cardiología Novedades Insuficiencia Cardiaca Aguda Insuficiencia Cardiaca Crónica
FICHA TÉCNICA. Normoreum 400 mg comprimidos recubiertos con película
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normoreum 400 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: 400 mg de extracto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normoreum 400 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: 400 mg de extracto
Vehículo para la dilución y reconstitución de medicamentos por vía parenteral.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA NOMBRE DEL MEDICAMENTO Agua para inyección Meinsol, disolvente para uso parenteral COMPOSICION Agua para inyección 1 g por 1 ml. Para
agencia española de medicamentos y productos sanitarios FICHA TECNICA NOMBRE DEL MEDICAMENTO Agua para inyección Meinsol, disolvente para uso parenteral COMPOSICION Agua para inyección 1 g por 1 ml. Para
Selección de Medicamentos
 Selección de Medicamentos a) INTRODUCCIÓN Las Direcciones de Área de Salud utilizan los medicamentos que se consideran básicos según el perfil epidemiológico y capacidad resolutiva de los servicios. La
Selección de Medicamentos a) INTRODUCCIÓN Las Direcciones de Área de Salud utilizan los medicamentos que se consideran básicos según el perfil epidemiológico y capacidad resolutiva de los servicios. La
MENINGITIS ASÉPTICA POR CETUXIMAB
 MENINGITIS ASÉPTICA POR CETUXIMAB Hospital Universitari Son Espases ML. Sastre Martorell 1 ; C. Martorell Puigserver 1 ; J. Fuster Salva 2 Servicio de Farmacia 1 y Servicio de Oncología 2 Paciente varón
MENINGITIS ASÉPTICA POR CETUXIMAB Hospital Universitari Son Espases ML. Sastre Martorell 1 ; C. Martorell Puigserver 1 ; J. Fuster Salva 2 Servicio de Farmacia 1 y Servicio de Oncología 2 Paciente varón
Departamento de Farmacología y Terapéutica 2013
 Departamento de Farmacología y Terapéutica 2013 Contribuir a preservar o mejorar la salud y bienestar del paciente. Maximizar la efectividad en el uso de los medicamentos. Minimizar los riesgos a los que
Departamento de Farmacología y Terapéutica 2013 Contribuir a preservar o mejorar la salud y bienestar del paciente. Maximizar la efectividad en el uso de los medicamentos. Minimizar los riesgos a los que
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg. COMPOSICIÓN Cada comprimido recubierto contiene: Excipientes: Según lo aprobado en Registro
 ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
ANASTROZOL COMPRIMIDOS RECUBIERTOS 1 mg COMPOSICIÓN Cada comprimido recubierto contiene: Anastrozol 1 mg Excipientes: Según lo aprobado en Registro CLASIFICACION TERAPEUTICA Antineoplásico INDICACIONES
IBANDRONATO INTRAVENOSO
 IBANDRONATO INTRAVENOSO en osteoporosis en mujeres posmenopáusicas con elevado riesgo de fractura. (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias) Fecha
IBANDRONATO INTRAVENOSO en osteoporosis en mujeres posmenopáusicas con elevado riesgo de fractura. (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario Central de Asturias) Fecha
Enfermedades Raras y Medicamentos Huérfanos
 Enfermedades Raras y Medicamentos Huérfanos Prof. A. Domínguez-Gil Hurlé Hospital Universitario de Salamanca Servicio de Farmacia e-mail: adgh@usal.es Valencia, 23 de Octubre de 2008 Las enfermedades
Enfermedades Raras y Medicamentos Huérfanos Prof. A. Domínguez-Gil Hurlé Hospital Universitario de Salamanca Servicio de Farmacia e-mail: adgh@usal.es Valencia, 23 de Octubre de 2008 Las enfermedades
FICHA TÉCNICA. LORATADINA KERN PHARMA está indicado para el tratamiento sintomático de rinitis alérgica y urticaria idiopática crónica.
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO LORATADINA KERN PHARMA 10 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de loratadina. Lista de excipientes,
XIII CONGRESO ARGENTINO DE FARMACIA HOSPITALARIA San Juan, 3 al 5 de Octubre de 2013
 METODOLOGÍA PARA LA VALIDACIÓN DE LA PRESCRIPCIÓN MÉDICA EN INTERNACIÓN Farm. Daniela García garciadaniela@hotmail.com Servicio de Farmacia Hospital C.G.Durand.. C.A.B.A XIII CONGRESO ARGENTINO DE FARMACIA
METODOLOGÍA PARA LA VALIDACIÓN DE LA PRESCRIPCIÓN MÉDICA EN INTERNACIÓN Farm. Daniela García garciadaniela@hotmail.com Servicio de Farmacia Hospital C.G.Durand.. C.A.B.A XIII CONGRESO ARGENTINO DE FARMACIA
PROPUESTA DE INCORPORACIÓN DE ABACAVIR+LAMIVUDINA A LA GUÍA FARMACOTERAPÉUTICA DEL SISTEMA SANITARIO PÚBLICO DE ANDALUCÍA
 PROPUESTA DE INCORPORACIÓN DE ABACAVIRLAMIVUDINA A LA GUÍA FARMACOTERAPÉUTICA DEL SISTEMA SANITARIO PÚBLICO DE ANDALUCÍA EMILIO ALEGRE DEL REY, JORGE DÍAZ NAVARRO CUESTIONARIO DE EVALUACIÓN ADAPTADO A
PROPUESTA DE INCORPORACIÓN DE ABACAVIRLAMIVUDINA A LA GUÍA FARMACOTERAPÉUTICA DEL SISTEMA SANITARIO PÚBLICO DE ANDALUCÍA EMILIO ALEGRE DEL REY, JORGE DÍAZ NAVARRO CUESTIONARIO DE EVALUACIÓN ADAPTADO A
DEL HEMANGIOMA INFANTIL
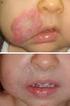 COMUNICACIÓN CIENTÍFICA PROPRANOLOL ORAL EN EL TRATAMIENTO DEL HEMANGIOMA INFANTIL Martínez Roca C 1, Yáñez Gómez P 1, Gómez Tellado M 2, Vilaboa Pedrosa C 1, Calleja Chuclá T 1, Martín Herranz MI 1. 1
COMUNICACIÓN CIENTÍFICA PROPRANOLOL ORAL EN EL TRATAMIENTO DEL HEMANGIOMA INFANTIL Martínez Roca C 1, Yáñez Gómez P 1, Gómez Tellado M 2, Vilaboa Pedrosa C 1, Calleja Chuclá T 1, Martín Herranz MI 1. 1
Novedades del programa MADRE 4.0 para
 Novedades del programa MADRE 4.0 para la evaluación de nuevos fármacos Francesc Puigventós Servicio de Farmacia. Hospital U Son Espases de Palma de Mallorca Coordinador adjunto del grupo de trabajo GENESIS
Novedades del programa MADRE 4.0 para la evaluación de nuevos fármacos Francesc Puigventós Servicio de Farmacia. Hospital U Son Espases de Palma de Mallorca Coordinador adjunto del grupo de trabajo GENESIS
Cáncer de Ovario Platino-Resistente. Tatiana Hernández Guerrero Médico Residente 4º año Servicio de Oncología Médica. Fundación Jiménez Díaz Madrid
 Cáncer de Ovario Platino-Resistente. Tatiana Hernández Guerrero Médico Residente 4º año Servicio de Oncología Médica. Fundación Jiménez Díaz Madrid Enfermedad platino-resistente. Definición La respuesta
Cáncer de Ovario Platino-Resistente. Tatiana Hernández Guerrero Médico Residente 4º año Servicio de Oncología Médica. Fundación Jiménez Díaz Madrid Enfermedad platino-resistente. Definición La respuesta
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO Respi 3 suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVALTO Respi 3 suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
Impacto de los nuevos tratamientos. Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena
 Impacto de los nuevos tratamientos Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena Indicaciones. Ipilimumab (Yervoy): EMA: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos
Impacto de los nuevos tratamientos Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena Indicaciones. Ipilimumab (Yervoy): EMA: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos
FICHA TÉCNICA. Polisacárido Vi de Salmonella typhi (cepa Ty2)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FACULTATIVOS ESPECIALISTAS EN ONCOLOGÍA MÉDICA BLOQUE B
 FACULTATIVOS ESPECIALISTAS EN ONCOLOGÍA MÉDICA BLOQUE B TEMA 13. Técnicas de trabajo en equipo. Programas multidisciplinarios intrahospitalatrios, con atención primaria y domiciliaria. Relación con otros
FACULTATIVOS ESPECIALISTAS EN ONCOLOGÍA MÉDICA BLOQUE B TEMA 13. Técnicas de trabajo en equipo. Programas multidisciplinarios intrahospitalatrios, con atención primaria y domiciliaria. Relación con otros
INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) INSULINAS
 Centro de Información de Medicamentos. Servicio de Farmacia. INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) Datos del solicitante INSULINAS Dr. Pedro José Pines Corrales, FEA del servicio
Centro de Información de Medicamentos. Servicio de Farmacia. INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) Datos del solicitante INSULINAS Dr. Pedro José Pines Corrales, FEA del servicio
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009).
 PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009). PRESCRIPCIÓN DE OSELTAMIVIR: El médico que atienda al paciente realizará la prescripción en receta
PROTOCOLO DE VIGILANCIA EPIDEMIOLÓGICA DE GRIPE (A/H1N1) EN HUMANOS (Versión 8 de 13 de Julio de 2009). PRESCRIPCIÓN DE OSELTAMIVIR: El médico que atienda al paciente realizará la prescripción en receta
Trastuzumab en tratamiento adyuvante de cáncer de mama HER2 positivo
 Trastuzumab en tratamiento adyuvante de cáncer de mama HER2 positivo Fecha 28/11/06 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Trastuzumab Indicación clínica solicitada: tratamiento
Trastuzumab en tratamiento adyuvante de cáncer de mama HER2 positivo Fecha 28/11/06 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Trastuzumab Indicación clínica solicitada: tratamiento
