Investigación Clínica ISSN: Universidad del Zulia Venezuela
|
|
|
- Enrique Plaza Ortega
- hace 6 años
- Vistas:
Transcripción
1 Investigación Clínica ISSN: Universidad del Zulia Venezuela Guerrero, Belsy; López, Mercedes Generalidades del sistema de la coagulación y pruebas para su estudio Investigación Clínica, vol. 56, núm. 4, octubre-diciembre, 2015, pp Universidad del Zulia Maracaibo, Venezuela Disponible en: Cómo citar el artículo Número completo Más información del artículo Página de la revista en redalyc.org Sistema de Información Científica Red de Revistas Científicas de América Latina, el Caribe, España y Portugal Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto
2 Invest Clin 56(4): , 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro de Medicina Experimental y 2 Laboratorio de Hemostasia y Genética Vascular. Centro de Biofísica y Bioquímica. Instituto Venezolano de Investigaciones Científicas. Caracas, Venezuela. Palabras Clave: coagulación; factores de la coagulación; modelo celular de la coagulación; trombina; pruebas de coagulación. Resumen. En la década de los años sesenta, se describió la cascada de la coagulación como una secuencia de eventos enzimáticos iniciada por dos vías, la intrínseca y la extrínseca, las cuales convergían en una vía común para generar una enzima multifuncional, denominada trombina. La principal función de esta enzima consistía en transformar el fibrinógeno, en fibrina, una proteína que se polimeriza espontáneamente para formar la base estructural del coágulo. Posteriormente, se propuso el Modelo Celular según el cual la coagulación no es la consecuencia de vías de activación enzimáticas secuenciales, sino de una red de interacciones entre proteínas plasmáticas y transmembranas, así como, varios tipos celulares, que permiten la formación de complejos enzimáticos altamente eficientes con la finalidad de generar trombina. Esta revisión explica en detalle ambos enfoques, además, aborda las diferentes funciones que cumple la trombina dentro de la hemostasia y los mecanismos de inhibición que regulan la coagulación. Finalmente, se describen diferentes pruebas empleadas en la actualidad para evaluar la funcionalidad del sistema de coagulación, como: el tiempo de tromboplastina parcial activado, el tiempo de protrombina, el tiempo de trombina, el tiempo de reptilasa, el tiempo de coagulación por ecarina y el uso de sustratos cromogénicos para evaluar cada factor de la coagulación. Finalmente, dado a que la generación de trombina es clave dentro de la coagulación y a que el potencial de generar trombina puede indicar propensión a desarrollar eventos trombóticos o hemorrágicos, en este trabajo se presentan los métodos existentes para determinar la generación de trombina. Autor de Correspondencia: Mercedes López. Instituto Venezolano de Investigaciones Científicas. Carretera Panamericana Km11. Centro de Biofísica y Bioquímica. Lab. de Hemostasia y Genética Vascular a Caracas, Venezuela Tel: /1903. Correo Electrónico: melopez73@hotmail.com
3 Sistema de la coagulación y pruebas para su estudio 433 Overwiew of the Coagulation System and laboratory tests for its study Invest Clin 2015; 56(4): Keywords: coagulation; coagulation factors; cell-based model; thrombin; coagulation test. Abstract. In the sixties, the clotting cascade was proposed, which describes the coagulation process as a sequence of enzymatic events initiated by two different pathways, the intrinsic and the extrinsic pathways, converging on a common pathway, to generate a multifunctional enzyme, thrombin, whose main function is to convert fibrinogen into fibrin, a protein that polymerizes spontaneously to form the building block of a hemostatic clot. Later, it was proposed a cell-based model of the hemostasis according to that coagulation does not occur as a consequence of linear sequential enzyme activation pathways, but rather via a network of simultaneous interactions between plasmatic and transmembrane proteins, as well as several cellular types, that allow the formation of highly efficient enzymatic complexes that lead to thrombin generation. In this review, we summarize these two approaches highlighting the functions of thrombin within the hemostasis and the inhibition mechanisms that regulate the blood coagulation. Moreover, we described different tests that are used to assess the function of the coagulation system, such as: activated partial thromboplastin time, prothrombin time, thrombin time, reptilase time, ecarin clotting time, and the use of chromogenic substrates to evaluate individual coagulation factors. Finally, because of thrombin generation is a fundamental part of the blood coagulation and, an estimation of how well a particular individual can generate thrombin may correlate with either a risk of bleeding or thrombosis, we also include the existing methods to evaluate the potential of thrombin generation in an individual. Recibido: Aceptado: INTRODUCCIÓN La hemostasia es un mecanismo de defensa del organismo, necesario para mantener la integridad de la pared vascular, evitar la pérdida de sangre ante una lesión vascular y restablecer el flujo sanguíneo cuando se ha reparado la lesión. Su función involucra a cuatro componentes que actúan de manera localizada, amplificada y modulada, estos son los sistemas: vascular, plaquetario, de coagulación y fibrinolítico (1). Ante una lesión vascular, ocurre una vasoconstricción local a nivel del endotelio, que limita el flujo de sangre a la zona lesionada. Además, se exponen a la sangre moléculas adhesivas presentes en el subendotelio como el colágeno, el factor von Willebrand y otras proteínas que favorecen la adhesión, activación y agregación plaquetaria, con liberación de diversos mediadores y factores procoagulantes que aseguran la formación del tapón hemostático primarios o tapón plaquetario. Adicionalmente, la lesión endotelial provoca la exposición del factor tisular presente en los fibroblastos del subendotelio, lo que inicia el proceso de coagulación y lleva a la formación de la malla de fibrina alrededor del tapón plaquetario, que en conjunto con otros elementos formes de la sangre y proteínas adhesivas, conforman el tapón hemostático secundario o coágulo de fibrina. En simultáneo, con la formación de fibrina se inicia la reparación del tejido lesionado y la liberación a partir del endotelio de activadores Vol. 56(4): , 2015
4 434 Guerrero y López del plasminógeno, lo que inicia la activación del sistema fibrinolítico con formación de la plasmina, enzima que limita el crecimiento de la malla de fibrina y restablece el flujo sanguíneo una vez que el tapón hemostático secundario cumple su función hemostática y ocurre la cicatrización de la lesión, evitando la formación de un trombo. Ante un desbalance de cualquiera de los componentes de la hemostasia aumenta el riesgo de manifestaciones hemorrágicas o trombóticas (2-4). En el presente trabajo se presenta una visión detallada y actualizada, del sistema de la coagulación sanguínea y de las pruebas de laboratorio más utilizadas para su estudio. Sistema de la Coagulación El sistema de la coagulación está integrado por una serie de proteínas plasmáticas, a las que se les asignó un número romano según el orden en el cual fueron descubiertas. La mayoría de estas proteínas o factores de la coagulación, existen bajo condiciones fisiológicas en forma inactiva, como cimógenos, que son convertidos a enzimas activas por ruptura de una o dos uniones peptídicas. Para indicar la forma activa de los factores de la coagulación se adiciona el sufijo a después del número romano (5). No obstante, a algunos factores de la coagulación, entre ellos la precalicreína (PK), también llamada Factor Fletcher, y los quininógenos de alto peso molecular (QAPM), no se les asignó ningún número, mientras que los fosfolípidos plaquetarios, componentes muy importantes del proceso, no están incluidos en esta clasificación. La Tabla I resume el peso molecular, las concentraciones plasmáticas y el tiempo de vida media de los factores de la coagulación, agrupados en diversas categorías, según sus características bioquímicas y funcionales. Las proteínas de la coagulación, según sus funciones o características bioquímicas, se clasifican de la siguiente forma: Factores de Contacto: representados por los factores XI, XII, PK y QAPM. Inicialmente se relacionaron con la activación del FXII o Factor Hageman, por contacto con superficies cargadas negativamente, como el colágeno subendotelial que se expone ante una lesión vascular. La deficiencia de alguno de estos componentes se manifiesta por un alargamiento del tiempo de tromboplastina parcial activado (TTPa), sin embargo, su deficiencia in vivo se ha asociado con riesgo de trombosis, lo cual se explica por la participación de estos factores en la fibrinólisis, al activar al plasminógeno, bien sea de manera directa por acción del FXIIa o indirecta por activación de la prouroquinasa mediada por la calicreína (4, 6-8). 2) Factores Dependientes de la Vitamina K: son una serie de proteínas que comparten características bioquímicas y estructurales especiales. Entre estas, la carboxilación de los residuos de ácido glutámico en el extremo amino terminal a través de la enzima glutamato-carboxilasa, en una reacción dependiente de la vitamina K. Como resultado de la carboxilación estas proteínas poseen en la región amino-terminal un dominio conocido como Dominio Gla, compuesto por 8 a 12 residuos de ácido γ-carboxiglutámico, los cuales favorecen la formación de complejos enzimáticos por su unión a los fosfolípidos de la membrana plaquetaria mediante iones calcio. Otra característica común de estos factores es que son sintetizados en el hígado y que en todos se producen cambios post-transcripcionales como la eliminación del propéptido señal y el proceso de carboxilación. Entre estos factores se encuentran el factor II (mejor conocido como protrombina) y los factores VII, IX y X (los dos últimos también llamados Factor Christmas y Factor Stuart-Power, respectivamente) y las proteínas C, S y Z. En casos de deficiencia de vitamina K o de tratamiento con anticoagulantes que actúan como antagonistas de la vitamina K, estos factores son sintetizados, pero carecen de los residuos de ácido γ-carboxiglutámico, por lo que no son funcionales (9,10). 3) Cofactores: son componentes de los complejos enzimáticos que no poseen actividad catalítica per se, sino que actúan acelerando la velocidad de reacción de la enzima presente en el complejo, asegurando una eficiencia catalítica adecuada. Entre estos se encuentran los QAPM, los factores V, VIII, la proteína S, la trombomodulina y el factor tisular (6). Investigación Clínica 56(4): 2015
5 Sistema de la coagulación y pruebas para su estudio 435 4) Cimógenos o Sustratos: están representados por las proteínas que se sintetizan como proenzimas, que en su mayoría al ser activadas se convierten en proteasas tipo serina, entre estas se encuentra la protrombina que es transformada en trombina. El FXIII y el fibrinógeno representan dos excepciones, debido a que el FXIII al ser activado se convierte en una transglutaminasa plasmática, el FXIIIa, que cataliza la reacción de entrecruzamiento de la fibrina; y el fibrinógeno que por acción de la trombina es transformado en fibrina, una proteína estructural sin función catalítica (6). 5) Inhibidores: la mayoría de los inhibidores de la coagulación se asocian a una superfamilia de proteínas denominada serpinas o inhibidores de proteasas de serina, que regulan además otros procesos como: angiogénesis, fibrinólisis e inflamación, entre otros. Uno de sus principales representantes es la antitrombina III (ATIII), que actúa junto al heparán sulfato para inhibir a la trombina, así como a los factores VIIa, IXa, Xa, XIa, XIIa y a la calicreína. El cofactor II de la heparina es otra serpina, que inhibe a la trombina en presencia de heparán o dermatán sulfato. El inhibidor del componente C1 del complemento también conocido como inhibidor de la proteína C, es una serpina que inhibe a la trombina, la proteína Ca, la calicreína, los factores XIa y XIIa, y al componente C1 del complemento, de donde proviene su nombre. Finalmente, el inhibidor de proteasas dependiente de la proteína Z (ZPI), es otro representante del grupo de las serpinas que inhibe al FXa en presencia de la proteína Z, fosfolípidos y calcio. El ZPI también inhibe al FXIa en ausencia de cofactores. Adicionalmente, existen otros importantes inhibidores de la coagulación que no pertenecen al grupo de las serpinas, como el inhibidor tipo KUNITZ denominado Inhibidor de la vía del factor tisular (TFPI), por las siglas de su nombre en inglés Tisular Factor Pathway Inhibitor, que inhibe al FXa en presencia de la Proteína S y al complejo FXa/FT/FVIIa(11-15). Así como el sistema formado por la Proteina C/Trombomodulina/Trombina, que inhibe por proteólisis a los factores Va y VIIIa. TABLA I CARACTERÍSTICAS BIOQUÍMICAS Y FUNCIÓN DE LOS FACTORES DE LA COAGULACIÓN Concentración Tiempo de Nombre PM Función Plasmática vida media (kda) (mg/dl) (horas) Factores de contacto Factor XI 160 0,4-0, En su forma activada es el activador intrínseco del FIX Factor XII 80 1,5-4, Iniciador de la vía intrínseca Precalicreína 85 1,5-4,5 36 Precursor de la Calicreína Quininógenos de alto peso molecular (QAPM) Factores dependientes de vitamina K Cofactores en la activación de Precalicreína, FXI y FXII Factor II Precursor inactivo de la trombina Factor VII ,05-0, Junto al Factor Tisular inicia la vía extrínseca Factor IX ,4-0, Factor X 58,9 0,7-1, En su forma activa es la enzima del complejo tenasa intrínseco En su forma activa es la enzima del complejo protrombinasa. Vol. 56(4): , 2015
6 436 Guerrero y López Nombre Cont... TABLA I Concentración Tiempo de PM Plasmática vida media (kda) (mg/dl) (horas) Función Proteína C 62 0,39-0, En su forma activa inactiva al FVa y FVIIIa Proteína S 69 2, Cofactor de la PCa Proteína Z 62 0,22 60 Incrementa la inhibición del FXa por el Inhibidor de la Proteína Z Cofactores Factor V 330 0,4-1, Cofactor del complejo protrombinasa Factor VIII 330 0, Cofactor del complejo tenasa intrínseco Trombomodulina 74 0 Cofactor de la trombina Factor Tisular Inicia la vía extrínseca al unirse al FVIIa Cimógenos o Sustratos Fibrinógeno Precursor de la fibrina Factor XIII Transaminasa que entrecruza la fibrina Inhibidores Antitrombina III Serpina que inhibe a la trombina y a los factores VIIa, IXa, Xa, XIa, XIIa y calicreína. Cofactor II de la heparina 66,5 6,1-8,2 60 Serpina que inhibe a trombina Inhibidor de la Proteína C 57 0,5 23,4 Serpina que inhibe PCa, trombina, calicreína, FXIa, FXIIa y al componente C1 Inhibidor de la proteína Z 72 0,1-0,16 Serpina que inhibe FXa y FXIa TFPI o Inhibidor de la vía del factor tisular 40 0, Inhibidor tipo Kunitz de los complejos TF/ FVIIa/FXa y del PS/FXa Mecanismos propuestos de la Coagulación Sanguínea La coagulación de la sangre es un proceso dinámico que requiere la participación e interacción de células y proteínas plasmáticas y/o transmembranas, que tiene como función, generar la trombina, enzima central del sistema de la coagulación que tiene como función hemostática central transformar el fibrinógeno enfibrina. Esta Investigación Clínica 56(4): 2015
7 Sistema de la coagulación y pruebas para su estudio 437 polimeriza espontáneamente y junto con el tapón plaquetario, otras proteínas plasmáticas y elementos formes de la sangre, forman el tapón hemostático secundario o coágulo. Este además de evitar la pérdida de sangre, forma la matriz provisional para iniciar el proceso de cicatrización y regeneración del vaso sanguíneo lesionado. Teoría clásica: la cascada de la coagulación En la década entre 1960 y 1970, dos grupos propusieron el modelo de la Cascada de la Coagulación, el cual explica el funcionamiento de este mecanismo como un proceso enzimático secuencial y limitado, sobre la superficie de las plaquetas, con el cual se favorece la generación de trombina (16,17). Este modelo se explica a través de dos vías conocidas como: Intrínseca y Extrínseca. La vía intrínseca se inicia tras un daño vascular, con la exposición de superficies cargadas negativamente que interaccionan con los factores de contacto (FXII, FXI, PK y QAPM) e inician el proceso de activación secuencial, donde el FXII funciona como verdadero iniciador, puesto que si bien es una proenzima, posee una pequeña actividad catalítica que alcanza para activar a la PK, convirtiéndola en calicreína. En segunda instancia la calicreína, potenciada por los QAPM, actúa sobre el factor XII para convertirlo en XIIa, una enzima mucho más eficiente que actúa sobre el factor XI para generar FXIa, que en presencia de iones de Ca ++ activa al FIX. El factor IXa generado junto al FVIIIa, iones Ca ++ y fosfolípidos conforman el complejo Tenasa Intrínseco, el cual asegura la eficiencia catalítica para activar al FX a la velocidad requerida en el momento de activarse el proceso de la coagulación. La vía extrínseca se inicia con la formación del complejo Tenasa Extrínseco conformado por el factor tisular (FT), el FVIIa circulante, iones de Ca ++ y fosfolípidos, el cual activa tanto al FX, como al FIX. Finalmente, en la vía común, convergen las dos vías antes mencionadas, a nivel del FXa que conforma junto con el FVa, la protrombina, iones de Ca ++ y fosfolípidos, el complejo Protrombinasa, encargado de generar trombina, la cual actúa sobre el fibrinógeno transformándolo en monómeros de fibrina que se polimerizan y se estabilizan por acción del FXIIIa, formando junto con los elementos formes de la sangre, el tapón hemostático o coágulo (Fig. 1). El modelo clásico es muy útil para describir la interacción entre las proteínas con actividad procoagulante y para interpretar las pruebas de laboratorio más utilizadas para la evaluación de desórdenes de la coagulación. Entre estas pruebas están el Tiempo de Protrombina (TP), para evaluar la vía extrínseca; el Tiempo de Tromboplastina Parcial activado (TTPa) para la vía intrínseca y el Tiempo de Trombina (TT), que evalúa la vía común (Fig. 1). Sin embargo, este modelo falla en explicar hallazgos in vivo, entre estos; el hecho de que el déficit de algún factor de la vía intrínseca prolonga el TTPa, pero no cursa con riesgo hemorrágico, o cómo las deficiencias de los factores VIII y IX, asociadas a la hemofilia A y B, respectivamente, cursan con hemorragias severas, a pesar de no haber alteraciones de la vía extrínseca, por la cual también se genera trombina. Más aún, el hecho de que el complejo FT/VIIa actúa sobre los factores FX y FIX, condujo a la conclusión que in vivo la vía extrínseca sería la más relevante para iniciar la coagulación. Así surgió el modelo actual de este sistema, mejor conocido como el Modelo Celular de la Coagulación, desarrollado por Hoffman y Monroe (18,19), el cual resalta la importancia de la participación de diversas células, como: fibroblastos, monocitos, células endoteliales y plaquetas, que son fundamentales para el funcionamiento del sistema hemostático en condiciones normales y en diversos estados patológicos. Vol. 56(4): , 2015
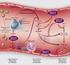
8 438 Guerrero y López Fig. 1. Cascada de la coagulación. Consiste en la confluencia de la vía extrínseca e intrínseca en una vía común. El TP se usa como ensayo para evaluar la actividad de la vía extrínseca, el TTPa para la vía intrínseca y para la vía común se emplean el TT, TR y ECT. Los factores de la coagulación aparecen representados por números romanos, para indicar su forma activa se les adiciona el sufijo a. TP, Tiempo de Protrombina; TTPa, Tiempo de Tromboplastina Parcial activada; TT, Tiempo de Trombina; TR, Tiempo de Reptilasa; ECT, Tiempo de Coagulación por Ecarina. Modelo Celular de la Coagulación Según este modelo, la coagulación ocurre en tres fases (Fig. 2). La primera de ellas, denominada Fase de Iniciación, comienza tras la exposición del FT, una proteína transmembrana que se expresa constitutivamente en los fibroblastos expuestos luego de una lesión vascular, en células musculares lisas y que puede ser inducida en células endoteliales, monocitos y macrófagos, entre otros tipos celulares, por acción de diversos estímulos proinflamatorios (20-22). El FT se une al FVII, que circula en pequeñas cantidades (cerca del 1 %) en su forma activada, formando junto con iones calcio y fosfolípidos el complejo Tenasa Extrínseco, que genera más FVIIa y activa a los factores X y IX. El FXa generado se une sobre una superficie fosfolipídica con su cofactor, el FVa (liberado en su forma activa de los gránulos plaquetarios o activado por el FXa u otras enzimas), para producir pequeñas cantidades de trombina, que serán insuficientes para completar el proceso de formación de la fibrina, pero que sirven para estimular la sobreexpresión del FT y activar a las plaquetas y al FV, así como para disociar al FVIII del Factor von Willebrand y activar al FVIII (23). Investigación Clínica 56(4): 2015
9 Sistema de la coagulación y pruebas para su estudio 439 Fig. 2. Modelo Celular de la coagulación: consiste de 3 Fases o etapas: Iniciación: La exposición de FT conlleva a la formación del complejo tenasa extrínseco, en esta etapa se forman trazas de trombina. Amplificación: la trombina activa a las plaquetas y otros factores, como el FV, el FVIII y el FIX. Propagación: La formación de los complejos Tenasa intrínseco y Protrombinasa, aseguran la generación de grandes cantidades de trombina. Esta fase culmina con la formación de fibrina entrecruzada, resultando en un coagulo estable. FT, Factor Tisular; FvW, Factor von Willebrand; C., Complejo; C.T., Complejo Tenasa Luego, se inicia la Fase de Amplificación, que es dependiente de la adhesión de las plaquetas al colágeno sub-endotelial y su activación por las trazas de trombina que se forman durante la fase de iniciación. Las plaquetas activadas experimentan un cambio morfológico, con la subsecuente exposición de fosfolípidos cargados negativamente y además, liberan el contenido de sus gránulos, los cuales almacenan sustancias que inician el proceso de la agregación y por ende, la formación del tapón hemostático primario. Más aún, otros factores procoagulantes, como el FV y el FIX, se liberan de los gránulos plaquetarios. Los factores XI, VIII y V son activados por la trombina generada para formar los complejos enzimáticos requeridos en la siguiente fase (25,26). En la Fase de Propagación, el FIXa generado en la fase de iniciación, forma junto con el FVIIIa, sobre una superficie fosfolipídica y en presencia de iones de calcio, el complejo Tenasa Intrínseco. Este complejo produce grandes cantidades de FXa, el cual a su vez, al unirse al FVa sobre una superficie celular en presencia de iones de calcio, forma el complejo Protrombinasa que activa a la protrombina y asegura la generación de grandes cantidades de trombina, fenómeno denominado explosión de trombina. Estas cantidades de trombina son suficientes para liberar los fibrinopéptidos A y B de los extremos N-terminales de las cadenas Aα y Bβ del fibrinógeno y generar monómeros de fibrina, que luego se polimerizan y entrecruzan por acción del FXIIIa, lo que genera un coágulo de fibrina estable y resistente a una lisis prematura. Una vez cumplida su función hemostática, la generación de trombina es atenuada y neutralizada por la acción de inhibidores, como: la antitrombina III, el TFPI y el sistema de la Proteína C activada (PCa) (4, 27,28). El modelo celular de la coagulación asegura que la hemostasia se localice en el sitio donde ocurre la lesión vascular y que este proceso ocurra sobre superficies celulares esenciales para el ensamblaje de las diversas reacciones enzimáticas que modulan la formación del coágulo. Formación de fibrina La malla de fibrina es esencial para estabilizar el tapón hemostático primario o tapón plaquetario. La formación de fibrina estable depende de la habilidad de la trombina para liberar adecuadamente los fibrinopéptidos A y B de la molécula del fibrinógeno e inducir la formación del polímero de fibrina, el cual Vol. 56(4): , 2015
10 440 Guerrero y López se estabiliza por el FXIII activado por la trombina. El fibrinógeno está constituido por tres pares de cadenas: dos Aα, dos Bβ y dos γ, que se enrollan formando una hélice alfa. La estructura terciaria del fibrinógeno está representada por tres dominios: un nódulo central o dominio E, constituido por los extremos N-terminales de las cadenas y dos nódulos laterales o dominios D, formados por los extremos C-terminales (Fig.3). Los fibrinopéptidos A y B ubicados en el dominio central E son ricos en residuos de ácido glutámico y ácido aspártico que le confieren una alta densidad de cargas negativas inducen la repulsión entre moléculas de fibrinógeno adyacentes. La formación de fibrina estable depende de la habilidad de la trombina para escindir los enlaces Arg 16 -Gly 17 y Arg 14 -Gly 15, en los extremos N-terminales de las cadenas Aα y Bβ del fibrinógeno y liberar los fibrinopéptidos A y B, respectivamente. Esto causa la pérdida de las cargas negativas presentes en los dominios E y favorece la formación de los monómeros de fibrina que se asocian entre sí por uniones electrostáticas débiles, para formar los polímeros de fibrina, que se estabilizan por el FXIII activado (29). Fig. 3. Formación de fibrina. El Fibrinógeno está compuesto por 3 dominios globulares, uno central denominado Dominio E (en rojo) y dos dominios D (en negro) a cada lado. Luego de la liberación de los fibrinopéptidos A y B por la trombina. Los monómeros de fibrina polimerizan formando un polímero de fibrina soluble, el cual será estabilizado gracias a la acción del FXIIIa, formando un polímero insoluble o coágulo estable. El FXIII es activado por la trombina en presencia del fibrinógeno, que sirve de cofactor, y de iones de calcio. El FXIIIa actúa como una transglutaminasa al inducir la formación de enlaces covalentes entre: las cadenas α de moléculas de fibrina adyacentes formando los polímeros α; entre las cadenas γ formando los dímeros γ; y entre las cadenas α y γ formando los heteropolímeros α/γ, lo que origina una estructura de fibrina estable y resistente a la lisis prematura por la plasmina. Además, el FXIIIa entrecruza a las cadenas α de la fibrina con la α2-antiplasmina, principal inhibidor de la plasmina y con la fibronectina, una proteína adhesiva importante, que actúa como cofactor de la fibrina, en el proceso de cicatrización del tejido lesionado. Las cadenas γ de la fibrina también se entrecruzan con la integrina plaquetaria αiibβ3 lo que favorece la retracción del coágulo (29). Funciones de la Trombina La trombina tiene numerosas funciones dentro de la hemostasia, las cuales pueden ser clasificadas como: procoagulantes, anticoagulantes, profibrinolíticas y antifibrinolíticas (Fig. 4). Esta enzima posee también una gran cantidad de efectos pleiotrópicos sobre una gran variedad de células, tales como: Investigación Clínica 56(4): 2015
11 Sistema de la coagulación y pruebas para su estudio 441 células endoteliales, monocitos, fibroblastos, células de músculo liso, etc. Estos efectos celulares son mediados por la activación de los receptores PARs e incluyen entre otros, efectos quimiotácticos directos, regulación de la expresión genética, secreción de citoquinas y otros mediadores bioquímicos de interés para el proceso de la hemostasia (21, 29, 30). En esta revisión se han enfocado únicamente los efectos de la trombina sobre la hemostasia. Los efectos procoagulantes de la trombina incluyen la conversión del fibrinógeno en fibrina, así como la activación de los factores X, XI y XIII y de los cofactores V y VIII. La trombina también induce la agregación plaquetaria, por su acción sobre los receptores PAR 1 y PAR 4. Estos efectos procoagulantes representan un sistema de retroalimentación positiva que favorece la generación de más trombina (27, 31-33). Fig. 4. Funciones de la trombina. La trombina tiene numerosas funciones dentro de la hemostasia, las cuales pueden ser clasificadas como: procoagulantes, anticoagulantes, profibrinolíticas y anfibrinolíticas.tm, Trombomodulina; PC, Proteina C; FvW, Factor von Willebrand; GPIb, Glicoproteína Ib de las plaquetas; t-pa, activador de plasminógeno tisular; TAFI, Inhibidor de la Fibrinólisis Activable por Trombina. Por otra parte, la principal función anticoagulante de la trombina ocurre, tras su unión a un receptor de membrana presente en las células endoteliales, la trombomodulina (TM), para formar el complejo trombina-tm. Cuando la trombina se une a la TM, ocurre un cambio en su conformación, que frena su acción sobre el fibrinógeno y las plaquetas y facilita su acción sobre la Proteína C, la cual en su forma activa, en presencia de la Proteína S, regula negativamente el sistema de la coagulación por degradación de los cofactores FVa y FVIIIa (34). Esto se explica con más detalle en la sección correspondiente a Inhibición de la coagulación. Otra función anticoagulante de la trombina es disminuir la unión del Factor von Willebrand (FvW) a la glicoproteína Ib (GPIb) de las plaquetas (35). La acción profibrinolítica de la trombina consiste en inducir la secreción del activador de plasminógeno tisular (t-pa) por las células endoteliales (36), mientras que su principal efecto antifibrinolítico viene dado por la activación del Inhibidor de la Fibrinólisis Activable por Trombina (TAFI, por las siglas de su nombre en inglés thrombin-activable fibrinolysis inhibitor). El TAFI activado modula negativamente la fibrinólisis al remover residuos de Vol. 56(4): , 2015
12 442 Guerrero y López lisina expuestos en la fibrina, parcialmente degradada por la plasmina, los cuales son requeridos para la formación del complejo Fibrina/Plasminógeno/t- PA, lo que asegura que la fibrinólisis ocurra a una velocidad adecuada y de manera localizada (4, 28, 37). Inhibición de la Coagulación El sistema de la coagulación en condiciones normales es finamente regulado por diversos mecanismos que aseguran que la generación de trombina y la posterior formación de la fibrina, sean procesos localizados. Bajo condiciones fisiológicas, el mantenimiento del flujo sanguíneo adecuado y la actividad anticoagulante del endotelio vascular, limitan la acumulación local de factores de la coagulación activados y la formación de los complejos procoagulantes, evitando así que se active el sistema de la coagulación y ocurra la oclusión de algún vaso sanguíneo (38). Entre los mecanismos anticoagulantes naturales, el más importante es el constituido por la Antitrombina III (ATIII), una glicoproteína plasmática perteneciente a la familia de las serpinas (Fig.5). La ATIII inhibe a la trombina y al FXa y en menor extensión también a los factores FIXa, FXIa, calicreína, plasmina y uroquinasa, entre otras proteasas de la hemostasia. El mecanismo de inhibición involucra la formación de un complejo estable 1:1 entre la ATIII y la proteasa blanco. La velocidad de inhibición es incrementada en presencia de glicosaminoglicanos, tales como las moléculas de heparán sulfato presentes en la superficie de las células endoteliales, o la heparina usada frecuentemente como anticoagulante. La ATIII posee un dominio de unión a la heparina, que se fija específicamente a una secuencia pentasacárida presente en esta molécula, lo que induce un cambio conformacional en la ATIII, que acelera la inhibición del FXa. Sin embargo, la inhibición de la trombina requiere que la ATIII se una tanto a la heparina como a la trombina, para formar un complejo ternario. La secuencia de eventos propuesta, describe que primero la ATIII interacciona con el dominio pentasácarido y luego, la trombina se une a la heparina; de esta manera, la orientación de estas moléculas en el complejo, favorece la inhibición de la trombina por la formación de un complejo enzima-inhibidor irreversible y muy estable, el cual será finalmente removido de la circulación (38-41). Fig. 5. Inhibición de la coagulación. Los tres principales mecanismos que regulan la coagulación son: A) El complejo trombina-tm-epcr, que transforma a la PC en PCa, la cual junto a la PS inactiva a los factores Va y VIIIa. B) La ATIII que inhibe a la trombina, al FIXa, y al FXa en presencia de heparina. C) El TFPI, que se une al complejo TF-FVIIa-FXa. La PS también puede unirse al TFPI para inhibir la actividad del FXa. TM, Trombomodulina; EPRC, Receptor endotelial de la PC; Proteína C; PS, Proteína S; ATIII, Antitrombina III; TFPI, Inhibidor de la vía del factor tisular; TF, Factor Tisular. Investigación Clínica 56(4): 2015
13 Sistema de la coagulación y pruebas para su estudio 443 Otro de los mecanismos anticoagulantes que controlan la coagulación sanguínea es el Sistema de la Proteína C, el cual se inicia por la formación del complejo Trombina/TM a nivel de las células endoteliales. En este complejo, la trombina pierde la mayoría de sus funciones procoagulantes y asume funciones anticoagulantes al activar a la Proteína C (PC) a Proteína C activada (PCa), en una reacción que se incrementa en presencia del receptor endotelial de la PC (EPCR; por las siglas de su nombre en inglés Endothelial cell Protein C Receptor ) (42,43). Una vez que la PCa se disocia del EPCR, se une a la proteína S y este complejo PCa-PS inactiva por proteólisis, a las formas activadas (unidas a la membrana) de los cofactores V y VIII, mientras que tiene poco efecto sobre los cofactores nativos circulantes. En el caso del FVIIIa, su inactivación aumenta en presencia del FVa (44). En pacientes con deficiencia de PC o con resistencia a la PCa, como en los casos de Factor V Leiden, una mutación en el FV, que lo hace resistente a la proteólisis por la PCa, se ha observado un incremento en el riesgo de sufrir trombosis (45). Además, la unión de la trombina a la TM hace que esta proteasa sea más sensible a la inhibición por la ATIII, en comparación con la trombina libre. La PCa también tiene una importante función en los procesos inflamatorios y en la fibrinólisis (4, 46). La fase de iniciación del proceso de la coagulación se encuentra regulada por el Inhibidor de la vía del factor tisular (TFPI), el cual se sintetiza principalmente en las células endoteliales y circula unido a lipoproteínas que incluyen las LDL, las HDL y la Lp(a) (47). El TFPI bloquea al complejo FT/ FVIIa inmediatamente después que se genera FXa, formando un complejo cuaternario TFPI/FXa/FT/ FVIIa. Inicialmente, el TFPI se une al FXa y lo inhibe de manera reversible en un proceso que no requiere de Ca ++, sin embargo, en presencia de superficies fosfolipídicas, este ión potencia la inhibición del FXa por el TPFI. Posteriormente, el complejo TFPI/FXa se une al complejo FT/FVIIa en un proceso dependiente de Ca ++, formando el complejo cuaternario inactivo TFPI/FXa/FT/FVIIa (48-50). La proteína S también muestra actividad anticoagulante en ausencia de PCa por varios mecanismos, uno de ellos es facilitando la interacción FXa-TFPI. Pruebas de Coagulación Las pruebas de coagulación son ensayos funcionales que tienen como objetivo replicar in vitro la activación del sistema de la coagulación y evaluar la funcionalidad del mismo, lo que permite fundamentar y orientar el diagnóstico clínico. Las pruebas clásicas son: el Tiempo de Tromboplastina Parcial activado (TTPa) que evalúa la vía intrínseca; el Tiempo de Protrombina (TP) el cual evalúa la vía extrínseca y el Tiempo de Trombina (TT) que evalúa la vía común. Estas pruebas de laboratorio son útiles para detectar deficiencias congénitas o adquiridas de factores de la coagulación, de allí que se usen para estudiar pacientes con manifestaciones hemorrágicas. En contraste, la deficiencia congénita de la mayoría de las proteínas anticoagulantes como ATIII, PC y PS está asociada a la aparición de un estado de hipercoagulabilidad, protrombótico o trombofilico, sin embargo, en estos casos no se observan alteraciones en las pruebas clásicas, por lo que estas no se emplean en el estudio de pacientes con trombofilias primarias (51-54). Las pruebas para evaluar la coagulación emplean plasma fresco citratado, el cual debe ser procesado lo más rápidamente posible y mantenerse en frio, sin ser expuesto a contacto directo con hielo. Para la obtención de plasma citratado se extrae sangre por punción venosa, de voluntarios aparentemente sanos, con agujas de 21 G. La sangre se mezcla suavemente en tubos de plástico con citrato de sodio al 3,8% en una proporción 1:9 e inmediatamente se centrifuga a 4 C a 1400 g durante 15 ó 20 minutos para obtener Plasma Pobre en Plaquetas (PPP). Las pruebas se deben realizar lo más rápido posible, sobre todo si se evalúan factores lábiles como el FVIII o FV. Los plasmas no deben almacenarse por más de dos semanas a -20 C o de 6 meses a -70 C (55-56). Los resultados obtenidos en las diversas pruebas de coagulación de una muestra de plasma en estudio, se comparan con los tiempos de coagulación obtenidos con un plasma control, el cual se prepara mezclando el plasma de al menos tres personas aparentemente sanas, cuyos tiempos de coagulación individuales estén dentro de los valores normales Vol. 56(4): , 2015
14 444 Guerrero y López establecidos por cada laboratorio. Los ensayos con ambas muestras se deben realizar en paralelo y por el mismo operador. La sensibilidad de estas pruebas está vinculada al reactivo y a la técnica utilizada, de allí que es importante establecer los rangos de referencia de cada laboratorio e indicar la fuente de los reactivos empleados (55-56). Cuando el tiempo de coagulación de la muestra en estudio es muy prologado debe realizarse la corrección con plasma control, es decir, mezclar plasma del paciente con plasma control en una proporción 1:1. Si la alteración en el tiempo de coagulación se corrige, se está ante la deficiencia de algún factor de la coagulación, mas si no se corrige, se está ante la posible presencia de algún inhibidor. Tiempo de tromboplastina parcial activada (TTPa) El TTPa evalúa el funcionamiento de la vía intrínseca de la coagulación y emplea como activadores ácido elágico, celite, sílica o caolín, en presencia de fosfolípidos. Esta prueba detecta la deficiencia de los factores VIII, IX, XI y XII. Adicionalmente, el TTPa se prolonga por deficiencia de los factores de la vía común como V, X, II y el fibrinógeno en menor grado. El TTPa no se altera cuando las deficiencias de los factores son moderadas ( 40%). Esta prueba también es muy útil para evaluar el tratamiento con anticoagulantes no orales tipo heparina y para rastrear el anticoagulante lúpico (56,57). El TTPa también resulta prolongado ante la deficiencia de los factores que intervienen en la fase de contacto, como la precalicreína o los QAPM, a menos que la prueba utilice un reactivo que contenga ácido elágico como activador. En ese caso, esta prueba será normal, incluso ante la ausencia total de dichos factores (57). Entre los métodos reportados para medir el TTPa están: a) Tiempo de Tromboplastina con cefalina: Este método fue descrito inicialmente por Langdell y col. en 1953 (58). El procedimiento es el siguiente: Se incuban 0,1 ml de PPP fresco citratado del paciente o del control y 0,1 ml de solución de cefalina a 37 C durante el tiempo recomendado por el fabricante de este reactivo, luego se agregan 0,1 ml de CaCl 2 25 mm preincubado a 37 C y se determina el tiempo de coagulación. b) Tiempo de Tromboplastina con caolín: tiene como finalidad unificar la activación por contacto, teniendo en cuenta que los tiempos de incubación cortos son más sensibles para detectar defectos de los factores de contacto. En este método descrito por Proctor y Rapaport en 1961 (59), se sigue el procedimiento siguiente: 0,1 ml de PPP fresco citratado se incuba a 37 C; luego se agregan 0,1 ml de una mezcla de caolín (5%) y cefalina (1/10), se mantiene a 37 C, finalmente se agrega 0,1 ml de CaCl 2 25 mm, se mezcla y se determina el tiempo de coagulación. Este método es sensible para seguir tratamientos con anticoagulantes (cumarínicos o heparina) y para evaluar los niveles de los factores de la vía intrínseca, pero no para diagnosticar deficiencias de fibrinógeno y protrombina (55). Tiempo de protrombina (TP) El TP evalúa el funcionamiento de la vía extrínseca de la coagulación. Esta prueba mide el tiempo de formación de un coágulo en presencia de un exceso de factor tisular (FT), representado por la tromboplastina o una mezcla comercial que contiene FT recombinante o de origen tisular, con diferente composición de fosfolípidos y cuya heterogeneidad determina diferentes respuestas ante la disminución en los niveles de algún factor. Es una prueba empleada para la evaluación prequirúrgica, para el seguimiento de pacientes con hepatopatías o con deficiencias de factores de la coagulación. Además, es muy usada para evaluar la terapia anticoagulante con cumarínicos, para lo cual se debe determinar el Índice de Sensibilidad Internacional (ISI) de la tromboplastina a emplear para poder unificar los resultados. El fabricante de la tromboplastina calcula el valor ISI comparado con una tromboplastina de origen humano estándar internacional a la cual se le asigna un ISI de 1,0; lo que garantiza compensar las distintas sensibilidades de los reactivos disponibles en el mercado (55, 60). Investigación Clínica 56(4): 2015
15 Sistema de la coagulación y pruebas para su estudio 445 El TP en una etapa reportado por Arocha Piñango y col. (60), fue modificado del método originalmente descrito por Quick en 1935 (61) y es sensible para determinar la deficiencia de los factores VII, X, V y en menor medida las deficiencias de protrombina. Sin embargo, no detecta deficiencias de fibrinógeno, incluso cuando estas son moderadas. Para realizar el TP se aplica el siguiente procedimiento: se mezclan 0,1 ml de PPP fresco citratado con 0,1 ml de tromboplastina tisular y 0,1 ml de CaCl 2 25 mm (estos últimos preincubados a 37 C), se agita y se determina el tiempo de coagulación. Las variaciones entre los duplicados no deben ser mayores a 0,5 seg en tiempos cortos y no más de 2 a 3 seg en tiempos mayores a 30 seg. Los resultados deben expresarse como la relación o cociente entre el tiempo de coagulación obtenido con el plasma del paciente y el plasma control (60). En pacientes tratados con cumarínicos, el resultado debe expresarse como INR o International Normalized Ratio, en español Razón Internacional Normalizada, que se obtiene elevando la relación (r) obtenida entre el paciente y el control al ISI (INR= r ISI ), lo que permite comparar los resultados obtenidos con diferentes tromboplastinas comerciales. La OMS recomienda emplear tromboplastinas con un ISI menor a 2,5. El valor del INR tomado como rango terapéutico depende de la patología que motive el tratamiento (60). Tiempo de trombina (TT) El TT mide el tiempo de formación de fibrina a partir del fibrinógeno presente en el plasma, en presencia de una cantidad estandarizada de trombina. Esta prueba es muy útil para determinar la presencia de fibrinógenos anormales (disfibrinogenemias) o bajos niveles de fibrinógeno circulante (hipofibrinogenemias); también da tiempos prolongados en cuadros de coagulación intravascular diseminada, así como también en presencia de heparina, en hiperfibrinólisis primaria y en presencia de productos de degradación de fibrinógeno/fibrina (56, 62). Para el ensayo, inicialmente se debe preparar una solución de trombina estándar entre 2-3 UI/ ml, que debe dar un tiempo de coagulación con un plasma control entre 18 y 22 seg. Con tiempos de coagulación menores a 15 seg debe hacerse una mayor dilución de la trombina (54). En general, se aplica el siguiente procedimiento: se mezclan 0,1 ml de PPP fresco citratado y 0,1 ml de la solución de trombina y se determina el tiempo de coagulación a 37 C. Tiempo de reptilasa (TR) Es una prueba especial que emplea la reptilasa, una enzima similar a la trombina obtenida del veneno de la serpiente Bothrops atrox, que actúa directamente sobre las cadenas α del fibrinógeno lo que libera el fibrinopéptido A, sin que su acción sea inhibida por la antitrombina, por lo que esta prueba no es afectada por la presencia de heparina. Si el TT está prolongado y el TR es normal, probablemente el plasma evaluado contiene heparina. Si ambos tiempos dan prolongados, pero en mayor proporción el TT, debe sospecharse de la presencia de productos de degradación del fibrinógeno/fibrina. En casos de disfibrinogenemias, esta prueba es más sensible que el TT. Los valores de TR normales deben encontrarse similares a los obtenidos con una muestra de plasma control, con diferencias dentro de los 3 seg, de allí que deben informarse los valores obtenidos con el plasma del paciente y con el plasma control. La prueba se realiza de manera similar al TT, ajustando el TR del control entre 15 y 18 seg (56). Tiempo de coagulación por ecarina (ECT) El ECT (por las siglas de su nombre en inglés Ecarin Clotting Time) es una prueba de coagulación basada en la activación de la protrombina por acción de la ecarina, una enzima aislada del veneno de la serpiente Echis carinatus, generando meizotrombina, un precursor catalíticamente activo de la trombina capaz de transformar el fibrinógeno en fibrina (63). Vol. 56(4): , 2015
16 446 Guerrero y López Esta prueba de coagulación, descrita originalmente por Nowak y Bucha en 1993 (64), exhibe una correlación lineal entre la concentración de inhibidores directos de trombina presentes en el plasma y su tiempo de coagulación. Por esta característica favorable en comparación a los métodos descritos anteriormente, el ECT ha sido ampliamente usado en la caracterización bioquímica y farmacológica de inhibidores directos de trombina y para controlar los niveles de éstos compuestos en la terapia anticoagulante (65-68). López y Nowak en el año 2008 (68) describieron una modificación a este método que permite cuantificar inhibidores directos de trombina en sangre. Para ello se prepara una solución de ecarina a una concentración final de 1 U/mL en tampón Tris/HCl 50 mm ph 7,5 con NaCl 0,154 M y CaCl 2 10 mm, que se preincuba por 5 min a 37 C. Para determinar el ECT, se incuban 0,1 ml de sangre citratada con 0,1 ml de la solución de ecarina, se agita y se determina el tiempo de coagulación. La concentración del inhibidor se determina por comparación con una curva de calibración realizada usando concentraciones conocidas del compuesto en estudio. Determinación de factores de la coagulación La cuantificación de un factor específico del sistema de la coagulación se puede realizar por medio de la evaluación de su actividad funcional por métodos cromogénicos o más comúnmente, por algún método coagulante antes mencionado. También, se puede evaluar el nivel de proteína circulante por métodos inmunológicos como: ELISA, pruebas de aglutinación, inmunoelectroforesis, entre otros. Metodos cromogénicos Estos métodos evalúan la actividad enzimática del factor en estudio, por medio del uso de sustratos cromogénicos. Estos sustratos son péptidos sintéticos cuya secuencia de aminoácidos es similar a la que precede al sitio de corte del sustrato natural de la enzima en estudio, a la cual se le ha acoplado un cromóforo como la paranitroanilina (pna). Cuando la enzima escinde el enlace amida libera el cromóforo que puede ser detectado por cambios en la absorbancia a una determinada longitud de onda, en el caso de la pna, se detecta a 405 nm. Los sustratos cromogénicos muestran una alta selectividad por las enzimas que los activan. Existen diversos sustratos cromogénicos para los distintos factores activados del sistema de la coagulación y de la fibrinólisis y se pueden elaborar curvas de calibración empleando estándares comerciales. Los sustratos cromogénicos son utilizados también para evaluar algunas sustancias terapéuticas, como niveles de heparina no fraccionada y de bajo peso molecular (69). Estos ensayos requieren un volumen de muestra bajo, lo que facilita el estudio en pacientes pediátricos. Los sustratos cromogénicos también permiten detectar la presencia de inhibidores de factores de la coagulación de manera indirecta y evaluar su actividad funcional. En el caso de la ATIII, esta prueba se basa en la función antitrombínica de este inhibidor en presencia de heparina (70,71). La ATIII presente en el plasma en estudio se pone en contacto con una cantidad fija y en exceso de trombina en un tampón heparinizado. Una parte de la trombina en el medio se neutraliza por la ATIII presente en el plasma en estudio y la cantidad residual de trombina se determina por medio de su actividad amidolítica sobre un sustrato cromogénico específico. La concentración de ATIII se determina a partir de una curva de calibración empleando estándares comerciales o diluciones de un plasma control en tampón heparinizado (71). La Proteína C puede ser dosificada por el método cromogénico descrito por Bertina y col. en 1984 (72), que consiste en adsorber la PC con hidróxido de aluminio, luego activar esta proteína con trombina y medir la actividad de la PCa generada con un sustrato cromogénico. Brevemente, se mezclan 0,4 ml de plasma pobre en plaquetas con 40 µl de una suspensión acuosa de Al(OH) 3 a temperatura ambiente y se agita por 15 minutos; luego se centrifuga a 4 C por 15 minutos a 3000 g Investigación Clínica 56(4): 2015
17 Sistema de la coagulación y pruebas para su estudio 447 y se descarta el sobrenadante. Al precipitado se le agrega 0,2 ml de tampón citrato trisódico (0,313 %; ph 7,4) y se agita durante 15 minutos, luego se agrega 40 µl de una solución de trombina (20 UI/ ml en agua destilada) y se incuba por 1 h a 37 C con agitación continua. Al cabo de este tiempo, la trombina se neutraliza con 100 µl de heparina a 25 UI/mL en NaCl 0,15 M y se incuba por 15 minutos más y luego se centrifuga a 3000 g por 5 minutos a 4 C. Finalmente, se toma 50 µl del sobrenadante y se le agrega 50 µl de sustrato cromogénico S-2366 (1 mg/ml en agua destilada), se mezcla e incuba por 20 minutos a 37 C, luego se detiene la reacción agregando 200 µl de ácido acético glacial y se determina la densidad óptica a 405 nm. Para determinar la actividad de la PC en la muestra del paciente, se emplea una curva de calibración que se realiza con un plasma control a diferentes diluciones. Las determinaciones deben realizarse por triplicado. Métodos Coagulantes La actividad coagulante para determinar la concentración de factores de la coagulación se realiza generalmente por el método en una etapa, el cual es rápido, sencillo y cuyos resultados muestran una buena correlación con la clínica y la respuesta a tratamientos. En el caso de deficiencia en algún factor de la vía de intrínseca o la presencia de algún inhibidor de estos, se emplea el TTPa. Para la cuantificación se emplea un plasma deficiente del factor en estudio, el cual aporta la actividad coagulante de los demás factores. Por ejemplo, en el caso de pacientes donde se sospeche la presencia de una patología como la hemofilia, se emplea un plasma deficiente de FVIII, un plasma control a diferentes diluciones en tampón imidazol salino, ph 7,4, por ejemplo: 1/2, 1/10, 1/20, 1/40, 1/80, 1/200, una mezcla de cefalina-caolín o cefalina activada, una solución de cloruro de calcio y el plasma en estudio. El procedimiento es el siguiente: se incuban 0,1 ml del plasma deficiente de FVIII con 0,1 ml de la dilución del plasma en estudio o de las diferentes diluciones del plasma control y 0,1 ml del reactivo de cefalina activada, se incuba por 3 min a 37 C. Posteriormente, se agregan 0,1 ml de CaCl 2 25 mm, se mezcla suavemente y se determina el tiempo de formación del coágulo. Las determinaciones se realizan por duplicado y la concentración del factor en el plasma en estudio se calcula extrapolando su tiempo de coagulación a una curva estándar realizada con el tiempo de coagulación de las diferentes diluciones del plasma control (73,74). La cuantificación de los inhibidores, por ejemplo del FVIII, se realiza mediante la prueba Bethesda, en la cual, se incuba el plasma en estudio con plasma control a una relación 1:1 y luego de 2 h a 37 ºC se determina la actividad residual del FVIII en la mezcla. Paralelamente, se incuba un control consistente de plasma control diluido con tampón de coagulación para considerar el deterioro del FVIII durante el tiempo de incubación. La diferencia entre ambas muestras, tomando en cuenta el factor de dilución, se utiliza para calcular las unidades del inhibidor. El porcentaje de FVIII residual (FVIIIR) se expresa en Unidad Bethesda (UB), que se calcula con la siguiente fórmula: El plasma del paciente que presenta una actividad residual del FVIII de 50% equivale a una UB de inhibidor (75). En el caso de deficiencia en algún factor de la vía de extrínseca, se emplea el TP en una etapa, el cual utiliza tromboplastina como fuente de factor tisular. Para la cuantificación se emplea un plasma deficiente del factor en estudio, el cual aporta la actividad coagulante de los demás factores, por ejemplo; para la determinación de protrombina, se emplea plasma deficiente en este factor, diluciones del plasma control y del plasma en estudio con tampón imidazol salino, ph 7,4; tromboplastina y solución de cloruro de calcio. El procedimiento que se emplea es el siguiente: se incuban 0,1 ml del plasma deficiente de protrombina, 0,1 ml de la dilución del plasma en estudio o del plasma control y 0,1 ml de tromboplastina, se incuba por 1 min a Vol. 56(4): , 2015
Teoría Actual del Mecanismo de la Coagulación Sanguínea
 Teoría Actual del Mecanismo de la Coagulación Sanguínea Prof. Delfina Almagro Vázquez Instituto de Hematología e Inmunología Componentes del mecanismo hemostático Pared Vascular Plaquetas Mecanismo de
Teoría Actual del Mecanismo de la Coagulación Sanguínea Prof. Delfina Almagro Vázquez Instituto de Hematología e Inmunología Componentes del mecanismo hemostático Pared Vascular Plaquetas Mecanismo de
Generalidades del sistema de la coagulación y pruebas para su estudio.
 Invest Clin 56(3): 432-454, 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro
Invest Clin 56(3): 432-454, 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro
CAPÍTULO 1. Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral?
 CAPÍTULOS de Anticoagulación Oral para Enfermería CAPÍTULO 1 Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral? Dra. Amparo Santamaría
CAPÍTULOS de Anticoagulación Oral para Enfermería CAPÍTULO 1 Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral? Dra. Amparo Santamaría
HEMOSTASIA. Dra. Carmen Aída Martínez
 HEMOSTASIA Dra. Carmen Aída Martínez Hemostasia Detención del sangrado ocasionado por un vaso dañado Trombo: tapón sanguíneo Hemo: sangre stasis: detención Tras una Lesión Vascular se dan 3 Acontecimientos:
HEMOSTASIA Dra. Carmen Aída Martínez Hemostasia Detención del sangrado ocasionado por un vaso dañado Trombo: tapón sanguíneo Hemo: sangre stasis: detención Tras una Lesión Vascular se dan 3 Acontecimientos:
REACCION BASICA DE LA COAGULACION. cascada de la coagulación. trombina. fibrina (polímero insoluble) tico. fibrinolisis cicatrización
 HEMOSTASIA II REACCION BASICA DE LA COAGULACION fibrinógeno (proteína soluble) cascada de la coagulación trombina fibrina (polímero insoluble) tapón n plaquetario tapón n hemostático tico fibrinolisis
HEMOSTASIA II REACCION BASICA DE LA COAGULACION fibrinógeno (proteína soluble) cascada de la coagulación trombina fibrina (polímero insoluble) tapón n plaquetario tapón n hemostático tico fibrinolisis
Generalidades del sistema de la coagulación y pruebas para su estudio.
 Invest Clin 56(4): 432-454, 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro
Invest Clin 56(4): 432-454, 2015 Generalidades del sistema de la coagulación y pruebas para su estudio. Belsy Guerrero 1 y Mercedes López 2 1 Laboratorio de Fisiopatología, Sección Coagulación, Centro
HEMOSTASIA. Dra. Ana Cecilia Haro 2017
 HEMOSTASIA Dra. Ana Cecilia Haro 2017 Etapa Pre-analítica Evaluación de la Hemostasia ANAMNESIS Antecedentes familiares Antecedentes personales Fármacos, hábitos dietéticos, etc CLÍNICA Hemorrágica Trombótica
HEMOSTASIA Dra. Ana Cecilia Haro 2017 Etapa Pre-analítica Evaluación de la Hemostasia ANAMNESIS Antecedentes familiares Antecedentes personales Fármacos, hábitos dietéticos, etc CLÍNICA Hemorrágica Trombótica
COAGULACIÓN SANGUÍNEA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la Hemostasia Vasoconstricción
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la Hemostasia Vasoconstricción
COAGULACIÓN SANGUÍNEA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la
Hemostasia y Trombosis: dos caras de una misma moneda
 SOCIEDAD VENEZOLANA DE HEMATOLOGIA DIA MUNDIAL DE LA TROMBOSIS 13 DE OCTUBRE Jornadas sobre avances en hemostasia y trombosis 10 de octubre. Hotel Rasil. Puerto Ordáz. Estado Bolivar Hemostasia y Trombosis:
SOCIEDAD VENEZOLANA DE HEMATOLOGIA DIA MUNDIAL DE LA TROMBOSIS 13 DE OCTUBRE Jornadas sobre avances en hemostasia y trombosis 10 de octubre. Hotel Rasil. Puerto Ordáz. Estado Bolivar Hemostasia y Trombosis:
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I
 Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I Tema 29 Prof. Miguel Skirzewski Prevención de la pérdida de
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I Tema 29 Prof. Miguel Skirzewski Prevención de la pérdida de
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excresión
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excresión
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez 2009
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez 2009 Vasoconstricción inicial del vaso dañado. Formación de agregado plaquetario. Formación de una malla de fibrina (trombo blanco, rojo y/o depósito diseminado).
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez 2009 Vasoconstricción inicial del vaso dañado. Formación de agregado plaquetario. Formación de una malla de fibrina (trombo blanco, rojo y/o depósito diseminado).
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM Hemostasis y coagulación
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM 2016 Hemostasis y coagulación HEMOSTASIS Definición: Conjunto de respuestas que llevan a la detención de la pérdida de sangre cuando las paredes de los vasos han
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM 2016 Hemostasis y coagulación HEMOSTASIS Definición: Conjunto de respuestas que llevan a la detención de la pérdida de sangre cuando las paredes de los vasos han
Diagnóstico de laboratorio de las enfermedades hemorrágicas. Dra. Dunia Castillo González Lic. Yaneth Zamora González
 Diagnóstico de laboratorio de las enfermedades hemorrágicas Dra. Dunia Castillo González Lic. Yaneth Zamora González Hemostasia Complejo mecanismo de defensa del organismo, que impide las pérdidas de sangre
Diagnóstico de laboratorio de las enfermedades hemorrágicas Dra. Dunia Castillo González Lic. Yaneth Zamora González Hemostasia Complejo mecanismo de defensa del organismo, que impide las pérdidas de sangre
El proceso fisiológico de la hemostasia y sus dianas terapéuticas.
 El proceso fisiológico de la hemostasia y sus dianas terapéuticas. Madrid 7-Octubre-2015 Dr. Jose A. Romero Garrido.. Hospital Universitario La Paz. INTRODUCCIÓN: Sistema Circulatorio INTRODUCCIÓN: Sangre
El proceso fisiológico de la hemostasia y sus dianas terapéuticas. Madrid 7-Octubre-2015 Dr. Jose A. Romero Garrido.. Hospital Universitario La Paz. INTRODUCCIÓN: Sistema Circulatorio INTRODUCCIÓN: Sangre
Mecanismos de producción del coágulo
 Mecanismos de producción del coágulo Prof. Germán Detarsio Bioquímico Especialista en Hematología Cátedra y Servicio de Hematología Fac. de Cs. Bioq. y Farm. U.N.R. Argentina Mecanismo de producción de
Mecanismos de producción del coágulo Prof. Germán Detarsio Bioquímico Especialista en Hematología Cátedra y Servicio de Hematología Fac. de Cs. Bioq. y Farm. U.N.R. Argentina Mecanismo de producción de
CÁTEDRA DE FISIOLOGÍA FACULTAD DE ODONTOLOGÍA UNC
 CÁTEDRA DE FISIOLOGÍA FACULTAD DE ODONTOLOGÍA UNC TEMAS: Facultad de Odontología UNC. 1 TRABAJO PRÁCTICO VOLEMIA- HEMOSTASIA- GRUPOS SANGUÍNEOS Objetivos: Destacar la importancia de la volemia e interpretar
CÁTEDRA DE FISIOLOGÍA FACULTAD DE ODONTOLOGÍA UNC TEMAS: Facultad de Odontología UNC. 1 TRABAJO PRÁCTICO VOLEMIA- HEMOSTASIA- GRUPOS SANGUÍNEOS Objetivos: Destacar la importancia de la volemia e interpretar
Hemostasia. Dra. Cynthia González Ruíz
 Hemostasia Dra. Cynthia González Ruíz Contenido Temático Hemostasia Mecanismos Primarios Mecanismos Secundarios Referencias Consultadas Hemo stasia = Prevención perdida de la sangre. Detención de la Sangre.
Hemostasia Dra. Cynthia González Ruíz Contenido Temático Hemostasia Mecanismos Primarios Mecanismos Secundarios Referencias Consultadas Hemo stasia = Prevención perdida de la sangre. Detención de la Sangre.
PLAQUETAS, HEMOSTASIA Y COAGULACIÓN
 UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE CIENCIAS FUNCIONALES PLAQUETAS, HEMOSTASIA Y COAGULACIÓN Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE CIENCIAS FUNCIONALES PLAQUETAS, HEMOSTASIA Y COAGULACIÓN Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO
Fisiología de la Hemostasia.
 Fisiología de la Hemostasia. J. Mateo. Unitat d Hemostàsia I Trombosi. Hospital de la Santa Creu I Sant Pau. Barcelona Barcelona 2016 INTRODUCCIÓN Introducción La Hemostasia permite al organismo: Bloquear
Fisiología de la Hemostasia. J. Mateo. Unitat d Hemostàsia I Trombosi. Hospital de la Santa Creu I Sant Pau. Barcelona Barcelona 2016 INTRODUCCIÓN Introducción La Hemostasia permite al organismo: Bloquear
Pruebas básicas de Coagulación. Departamento de Hemostasia y Trombosis. IIHEMA Academia Nacional de Medicina
 Pruebas básicas de Coagulación Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina Vía Intrínseca de la coagulación Bioq.. Luis Bastos Dpto. Hemostasia y Trombosis Academia Nacional de
Pruebas básicas de Coagulación Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina Vía Intrínseca de la coagulación Bioq.. Luis Bastos Dpto. Hemostasia y Trombosis Academia Nacional de
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Nutrición y excreción Defensa:
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Nutrición y excreción Defensa:
ENDOTELIO Y COAGULACION. Erick Valencia MD. EDIC. Anestesiólogo Intensivista
 ENDOTELIO Y COAGULACION Erick Valencia MD. EDIC. Anestesiólogo Intensivista Nuevos mecanismos de coagulacion FVII FT Xa X Va FT FII FIIa VIII/vWF FVIIa X IX V FII Va Plaqueta VIIIa XIa IXa IXa FVIIIa Xa
ENDOTELIO Y COAGULACION Erick Valencia MD. EDIC. Anestesiólogo Intensivista Nuevos mecanismos de coagulacion FVII FT Xa X Va FT FII FIIa VIII/vWF FVIIa X IX V FII Va Plaqueta VIIIa XIa IXa IXa FVIIIa Xa
P07 FISIOLOGÍA DE LA HEMOSTASIA
 P07 FISIOLOGÍA DE LA HEMOSTASIA Objetivos de la práctica Conocer las pruebas para el estudio de las diferentes vías coagulación y su significado clínico. Adquirir los conceptos de tiempo de sangría, tiempo
P07 FISIOLOGÍA DE LA HEMOSTASIA Objetivos de la práctica Conocer las pruebas para el estudio de las diferentes vías coagulación y su significado clínico. Adquirir los conceptos de tiempo de sangría, tiempo
Coagulopatías en la Práctica Clínica AMA. Julio Dr. Dardo Riveros Sección Hematología Departamento de Medicina Interna CEMIC
 Coagulopatías en la Práctica Clínica AMA. Julio 2016 Dr. Dardo Riveros Sección Hematología Departamento de Medicina Interna CEMIC Metas del Sistema Hemostático Flujo sanguíneo Flujo sanguíneo Primero:
Coagulopatías en la Práctica Clínica AMA. Julio 2016 Dr. Dardo Riveros Sección Hematología Departamento de Medicina Interna CEMIC Metas del Sistema Hemostático Flujo sanguíneo Flujo sanguíneo Primero:
Pruebas básicas de Coagulación. Departamento de Hemostasia y Trombosis. IIHEMA Academia Nacional de Medicina
 Pruebas básicas de Coagulación Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina VIA EXTRINSECA DE LA COAGULACION Bioq. Silvia Grosso Departamento Hemostasia y Trombosis Academia Nacional
Pruebas básicas de Coagulación Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina VIA EXTRINSECA DE LA COAGULACION Bioq. Silvia Grosso Departamento Hemostasia y Trombosis Academia Nacional
FARMACOLOGÍA DE LA FIBRINOLISIS VIAS DE LA COAGULACION
 FARMACOLOGÍA DE LA FIBRINOLISIS S VIAS DE LA COAGULACION 1 TROMBOSIS -Por exceso en la respuesta hemostática -Por desencadenamiento intravascular sin finalidad fisiológica TROMBO ARTERIAL (trombo blanco)
FARMACOLOGÍA DE LA FIBRINOLISIS S VIAS DE LA COAGULACION 1 TROMBOSIS -Por exceso en la respuesta hemostática -Por desencadenamiento intravascular sin finalidad fisiológica TROMBO ARTERIAL (trombo blanco)
Sólo basta que se que produzca una destrucción del endotelio vascular para que se produzca el trombo plaquetario primario.
 HEMOSTASIA La hemostasia se defina como la serie de mecanismos que evitan que se mantenga en el tiempo una pérdida de sangre cuando se produce situación de continuidad entre el vaso y el medio interno
HEMOSTASIA La hemostasia se defina como la serie de mecanismos que evitan que se mantenga en el tiempo una pérdida de sangre cuando se produce situación de continuidad entre el vaso y el medio interno
Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio. Dra. Maria Mercedes Morales Hospital Roberto del Rio
 Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio Dra. Maria Mercedes Morales Hospital Roberto del Rio Síndromes Hemorrágicos. Consulta frecuente Impacto en morbi-mortalidad Diagnóstico y
Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio Dra. Maria Mercedes Morales Hospital Roberto del Rio Síndromes Hemorrágicos. Consulta frecuente Impacto en morbi-mortalidad Diagnóstico y
La hemostasia es el conjunto de mecanismos fisiológicos que mantienen la sangre circulante en estado fluido y que facilitan la reparación de lesiones
 1 La hemostasia es el conjunto de mecanismos fisiológicos que mantienen la sangre circulante en estado fluido y que facilitan la reparación de lesiones vasculares. Cuando se produce una lesión vascular,
1 La hemostasia es el conjunto de mecanismos fisiológicos que mantienen la sangre circulante en estado fluido y que facilitan la reparación de lesiones vasculares. Cuando se produce una lesión vascular,
FISIOLOGÍA HUMANA. BLOQUE 4. HEMATOLOGÍA Tema 16. Hemostasia y. Prof. Miguel García Salom
 Facultad de Medicina Departamento de Fisiología FISIOLOGÍA HUMANA BLOQUE 4. HEMATOLOGÍA Tema 16. Hemostasia y coagulación sanguínea Prof. Miguel García Salom E mail: mgsalom@um.es. Tlfno. 868 88 3952 Facultad
Facultad de Medicina Departamento de Fisiología FISIOLOGÍA HUMANA BLOQUE 4. HEMATOLOGÍA Tema 16. Hemostasia y coagulación sanguínea Prof. Miguel García Salom E mail: mgsalom@um.es. Tlfno. 868 88 3952 Facultad
Lic. Jürgen Freer B.
 Lic. Jürgen Freer B. Distintos estudios han demostrado una relación entre la desestabilización del control fisiológico de la hemostasia y la incidencia de enfermedades cardiovasculares. Así la angina de
Lic. Jürgen Freer B. Distintos estudios han demostrado una relación entre la desestabilización del control fisiológico de la hemostasia y la incidencia de enfermedades cardiovasculares. Así la angina de
Pruebas de laboratorio convencionales en hemostasia
 Pruebas de laboratorio convencionales en hemostasia J. Mateo. Unitat d Hemostàsia i Trombosi. Hospital de la Santa Creu i Sant Pau. Barcelona. Curso Anestesia. Barcelona. 2016. PREANALÍTICA Preanalítica
Pruebas de laboratorio convencionales en hemostasia J. Mateo. Unitat d Hemostàsia i Trombosi. Hospital de la Santa Creu i Sant Pau. Barcelona. Curso Anestesia. Barcelona. 2016. PREANALÍTICA Preanalítica
GUÍA DE TRABAJOS PRÁCTICOS Nº 9
 Facultad de Bioquímica, Química y Farmacia Universidad Nacional de Tucumán GUÍA DE TRABAJOS PRÁCTICOS Nº 9 Pruebas básicas y especiales para el estudio de la coagulación sanguínea 1 MECANISMO DE LA HEMOSTASIA
Facultad de Bioquímica, Química y Farmacia Universidad Nacional de Tucumán GUÍA DE TRABAJOS PRÁCTICOS Nº 9 Pruebas básicas y especiales para el estudio de la coagulación sanguínea 1 MECANISMO DE LA HEMOSTASIA
COAGULOPATIA OBSTETRICA
 COAGULOPATIA OBSTETRICA Agosto 2006 Mª Teresa Cardemil J. Sistema Hemostático: mantiene la sangre dentro del sistema circulatorio sellando las fugas y sin comprometer el flujo sanguineo. Principales elementos:
COAGULOPATIA OBSTETRICA Agosto 2006 Mª Teresa Cardemil J. Sistema Hemostático: mantiene la sangre dentro del sistema circulatorio sellando las fugas y sin comprometer el flujo sanguineo. Principales elementos:
Coagulación sanguínea
 34 Coagulación sanguínea I. VISIÓN GENERAL La formación de coágulos sanguíneos (coagulación) tiene por objetivo detener rápidamente la hemorragia causada por la afectación de un vaso sanguíneo y mantener
34 Coagulación sanguínea I. VISIÓN GENERAL La formación de coágulos sanguíneos (coagulación) tiene por objetivo detener rápidamente la hemorragia causada por la afectación de un vaso sanguíneo y mantener
TEMA 8: HEMATOLOGÍA. Hematíes: < Anemia, > Policitemia Leucocitos:<Leucopenia,>Leucocitosis Plaquetas: <Trombocitopenia, > Trombocitosis
 b) Métodos automáticos: basados en variaciones en la conductividad o resistencia, basados en la difracción Células: TEMA 8: HEMATOLOGÍA Hematíes: < Anemia, > Policitemia Leucocitos:Leucocitosis
b) Métodos automáticos: basados en variaciones en la conductividad o resistencia, basados en la difracción Células: TEMA 8: HEMATOLOGÍA Hematíes: < Anemia, > Policitemia Leucocitos:Leucocitosis
EL PROCESO DE LA. Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada
 EL PROCESO DE LA HEMOSTASIA. DIANAS TERAPEUTICAS Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada FUNCIONES DE LA SANGRE - Función de transporte de oxígeno y nutrientes a las células,
EL PROCESO DE LA HEMOSTASIA. DIANAS TERAPEUTICAS Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada FUNCIONES DE LA SANGRE - Función de transporte de oxígeno y nutrientes a las células,
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS
 FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Entender los mecanismos que regulan la Hemostasia. 2.- Clasificar los fármacos
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Entender los mecanismos que regulan la Hemostasia. 2.- Clasificar los fármacos
TEMA 24. PLAQUETAS. HEMOSTASIA Y COAGULACIÓN
 TEMA 24. PLAQUETAS. HEMOSTASIA Y COAGULACIÓN 24.1. INTRODUCCIÓN Es un sistema encargado de impedir la extravasación de sangre cuando se rompe algún vaso (hemorragia). Asimismo se encarga de mantener la
TEMA 24. PLAQUETAS. HEMOSTASIA Y COAGULACIÓN 24.1. INTRODUCCIÓN Es un sistema encargado de impedir la extravasación de sangre cuando se rompe algún vaso (hemorragia). Asimismo se encarga de mantener la
EL PROCESO DE LA HEMOSTASIA. DIANAS TERAPEUTICAS. Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada
 EL PROCESO DE LA HEMOSTASIA. DIANAS TERAPEUTICAS Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada FUNCIONES DE LA SANGRE - Función de transporte de oxígeno y nutrientes a las células,
EL PROCESO DE LA HEMOSTASIA. DIANAS TERAPEUTICAS Antonio Zarzuelo Zurita Departamento Farmacología Universidad de Granada FUNCIONES DE LA SANGRE - Función de transporte de oxígeno y nutrientes a las células,
Para entender los estados protrombóticos y su tratamiento.. debo seguir leyendo. Marce López
 Para entender los estados protrombóticos y su tratamiento.. debo seguir leyendo. Marce López Resumen basado en la lectura del capítulo de Hemostasia. Dvorkin, Cardinali, Iermoli. Best & Taylor. Bases Fisiológicas
Para entender los estados protrombóticos y su tratamiento.. debo seguir leyendo. Marce López Resumen basado en la lectura del capítulo de Hemostasia. Dvorkin, Cardinali, Iermoli. Best & Taylor. Bases Fisiológicas
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS
 FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Describir el mecanismo anticoagulante de la Heparina. 2.- Valorar las reacciones
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Describir el mecanismo anticoagulante de la Heparina. 2.- Valorar las reacciones
NUEVAS TENDENCIAS EN EL TRATAMIENTO ANTICOAGULANTE ORAL. Santiago del Castillo Málaga mayo 2009
 NUEVAS TENDENCIAS EN EL TRATAMIENTO ANTICOAGULANTE ORAL Santiago del Castillo Málaga mayo 2009 CAUSAS DE MUERTE EN ESPAÑA EN 2007 En 2007 se produjeron en España 385.361 defunciones, 13.883 más que en
NUEVAS TENDENCIAS EN EL TRATAMIENTO ANTICOAGULANTE ORAL Santiago del Castillo Málaga mayo 2009 CAUSAS DE MUERTE EN ESPAÑA EN 2007 En 2007 se produjeron en España 385.361 defunciones, 13.883 más que en
UNIVERSIDAD DE NAVARRA Dpto. de Hematología
 UNIVERSIDAD DE NAVARRA Dpto. de Hematología PREVALENCIA DEL FACTOR V LEIDEN Y LA MUTACIÓN G20210A DEL GEN DE LA PROTROMBINA EN NAVARRA, Y SU PAPEL COMO FACTORES DE RIESGO TROMBÓTICO. Memoria presentada
UNIVERSIDAD DE NAVARRA Dpto. de Hematología PREVALENCIA DEL FACTOR V LEIDEN Y LA MUTACIÓN G20210A DEL GEN DE LA PROTROMBINA EN NAVARRA, Y SU PAPEL COMO FACTORES DE RIESGO TROMBÓTICO. Memoria presentada
TRASTORNOS CIRCULATORIOS LOCALES
 Hiperemia TRASTORNOS CIRCULATORIOS LOCALES Patología General Universidad Mayor Aumento del contenido sanguíneo intravascular de un tejido u órgano Hiperemia Activa Hiperemia Pasiva Hiperemia activa Hiperemia
Hiperemia TRASTORNOS CIRCULATORIOS LOCALES Patología General Universidad Mayor Aumento del contenido sanguíneo intravascular de un tejido u órgano Hiperemia Activa Hiperemia Pasiva Hiperemia activa Hiperemia
Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE LA SANGRE
 CCáát tt eeddr raa ddee FFi iissi iiool llooggí ííaa II I TTeer rcc eer r SSeemeesst ttr ree FFaaccuul llt tt aadd ddee Meeddi iicci iinnaa,, UU...AA..EE..M... 1 Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE
CCáát tt eeddr raa ddee FFi iissi iiool llooggí ííaa II I TTeer rcc eer r SSeemeesst ttr ree FFaaccuul llt tt aadd ddee Meeddi iicci iinnaa,, UU...AA..EE..M... 1 Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE
Sistemas HemoStat Detección de coágulos semi- y completamente automatizada
 Sistemas HemoStat Detección de coágulos semi- y completamente automatizada > Diseñado para laboratorios de volumen reducido a medio > Gama de ensayos rutinarios desde una única fuente > Ajustes de aplicación
Sistemas HemoStat Detección de coágulos semi- y completamente automatizada > Diseñado para laboratorios de volumen reducido a medio > Gama de ensayos rutinarios desde una única fuente > Ajustes de aplicación
GUIAS DE ESTUDIO PARA QUINTO PARCIAL DE TEORIA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,015 GUIAS DE ESTUDIO PARA QUINTO PARCIAL DE TEORIA DR. H. ESTUARDO
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,015 GUIAS DE ESTUDIO PARA QUINTO PARCIAL DE TEORIA DR. H. ESTUARDO
ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA. La velocidad de reacciones químicas: Para una reacción:
 ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA La velocidad de reacciones químicas: Para una reacción: A B La velocidad depende de la concentración del reactante: v = k[a] k = constante
ESTUDIOS CINÉTICOS SE MIDE LA VELOCIDAD DE LA REACCIÓN CATALIZADA La velocidad de reacciones químicas: Para una reacción: A B La velocidad depende de la concentración del reactante: v = k[a] k = constante
Acta Pediátrica de México ISSN: Instituto Nacional de Pediatría México
 Acta Pediátrica de México ISSN: 0186-2391 editor@actapediatrica.org.mx Instituto Nacional de Pediatría México López-Santiago, N Pruebas de coagulación Acta Pediátrica de México, vol. 37, núm. 4, julio-agosto,
Acta Pediátrica de México ISSN: 0186-2391 editor@actapediatrica.org.mx Instituto Nacional de Pediatría México López-Santiago, N Pruebas de coagulación Acta Pediátrica de México, vol. 37, núm. 4, julio-agosto,
ENFERMEDAD TROMBOEMBOLICA ESTUDIO EN EL LABORATORIO
 ESTUDIO EN EL LABORATORIO Hipercoagulabilidad: desviación del balance hemostático hacia depósito intravascular de fibrina Trombofilia o estados trombofílicos Flujo sanguíneo Estructuras vasculares Factores
ESTUDIO EN EL LABORATORIO Hipercoagulabilidad: desviación del balance hemostático hacia depósito intravascular de fibrina Trombofilia o estados trombofílicos Flujo sanguíneo Estructuras vasculares Factores
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
REGULACION DE LA HEMOSTASIA SANGUÍNEA. FÁRMACOS HEMOSTÁTICOS
 Prof.ª Dra. D.ª Susana Abdala Kuri Prof. Dr. D. Domingo Martín Herrera Prof.ª Dra. D.ª Sandra Dévora Gutiérrez http://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_es REGULACION DE LA HEMOSTASIA SANGUÍNEA.
Prof.ª Dra. D.ª Susana Abdala Kuri Prof. Dr. D. Domingo Martín Herrera Prof.ª Dra. D.ª Sandra Dévora Gutiérrez http://creativecommons.org/licenses/by-nc-nd/4.0/deed.es_es REGULACION DE LA HEMOSTASIA SANGUÍNEA.
Algunos aspectos sobre Trombofilias Adquiridas. Dr Guillermo Pérez Román Hospital Clínico Quirúrgico Hermanos Ameijeiras
 Algunos aspectos sobre Trombofilias Adquiridas Dr Guillermo Pérez Román Hospital Clínico Quirúrgico Hermanos Ameijeiras Relación Trombofilias - Factores de Riesgo Factores de Riesgo Trombofilias Primarias
Algunos aspectos sobre Trombofilias Adquiridas Dr Guillermo Pérez Román Hospital Clínico Quirúrgico Hermanos Ameijeiras Relación Trombofilias - Factores de Riesgo Factores de Riesgo Trombofilias Primarias
Estudio de Trombofilia: Enfoque práctico
 Estudio de Trombofilia: Enfoque práctico Elena Delgado Casado Servicio de Hematología Hemoterapia Enero 2012 Hemostasia: equilibrio dinámico Mecanismo dinámico, regulado sobre superficies celulares Prohemostáticos
Estudio de Trombofilia: Enfoque práctico Elena Delgado Casado Servicio de Hematología Hemoterapia Enero 2012 Hemostasia: equilibrio dinámico Mecanismo dinámico, regulado sobre superficies celulares Prohemostáticos
En el estudio de los mecanismos de acción farmacológica hay que distinguir.
 TEMA : ASPECTOS MOLECULARES DEL MECANISMO DE ACCIÓN DE LOS FÁRMACOS En el estudio de los mecanismos de acción farmacológica hay que distinguir. Fármacos de Acción Específica: son aquellos que han de interaccionar
TEMA : ASPECTOS MOLECULARES DEL MECANISMO DE ACCIÓN DE LOS FÁRMACOS En el estudio de los mecanismos de acción farmacológica hay que distinguir. Fármacos de Acción Específica: son aquellos que han de interaccionar
ANTICOAGULANTES HIPOCOLESTEROLÉMICOS E HIPOLIPEMIANTES
 ANTICOAGULANTES HIPOCOLESTEROLÉMICOS E HIPOLIPEMIANTES 2013 ANTICOAGULANTES ACCIÓN DIRECTA: Hirudina ACCIÓN INDIRECTA: Heparina no fraccionada Heparinas de bajo peso molecular Danaparoide Dicumarol (warfarina)
ANTICOAGULANTES HIPOCOLESTEROLÉMICOS E HIPOLIPEMIANTES 2013 ANTICOAGULANTES ACCIÓN DIRECTA: Hirudina ACCIÓN INDIRECTA: Heparina no fraccionada Heparinas de bajo peso molecular Danaparoide Dicumarol (warfarina)
ESTADOS DE HIPERCOAGULABILIDAD
 ESTADOS DE HIPERCOAGULABILIDAD CONGÉNITOS Y ADQUIRIDOS Esperanza Castelar Delgado Residente de Medicina Interna 22 de Noviembre de 2010 DEFINICIÓN (I) En nuestro organismo, de forma fisiológica, existe
ESTADOS DE HIPERCOAGULABILIDAD CONGÉNITOS Y ADQUIRIDOS Esperanza Castelar Delgado Residente de Medicina Interna 22 de Noviembre de 2010 DEFINICIÓN (I) En nuestro organismo, de forma fisiológica, existe
CAPITULO 1 FISIOLOGIA DE LA HEMOSTASIA
 CAPITULO 1 FISIOLOGIA DE LA HEMOSTASIA TROMBOPOYESIS MEGACARIOCITO. REGULACION DE LA PRODUCCION DE PLAQUETAS. DINAMICA PLAQUETARIA. ULTRAESTRUCTURA PLAQUETARIA: ZONA PERIFERICA, ZONA GEL, ZONA ORGANELAS.
CAPITULO 1 FISIOLOGIA DE LA HEMOSTASIA TROMBOPOYESIS MEGACARIOCITO. REGULACION DE LA PRODUCCION DE PLAQUETAS. DINAMICA PLAQUETARIA. ULTRAESTRUCTURA PLAQUETARIA: ZONA PERIFERICA, ZONA GEL, ZONA ORGANELAS.
Complemento. Introducción. Activación del complemento. Activación del complemento
 Introducción Las tres funciones principales del sistema del complemento en la inflamación Complemento Introducción.. Receptores del complemento. Comparación de las vías clásica y alternativa del complemento
Introducción Las tres funciones principales del sistema del complemento en la inflamación Complemento Introducción.. Receptores del complemento. Comparación de las vías clásica y alternativa del complemento
Sistemas Hemostat Detección de coagulación semiautomática a completamente automatizada
 Sistemas Hemostat Detección de coagulación semiautomática a completamente automatizada > Para laboratorios pequeños a medianos > Gama de ensayos rutinarios desde una única fuente > Ajustes de aplicación
Sistemas Hemostat Detección de coagulación semiautomática a completamente automatizada > Para laboratorios pequeños a medianos > Gama de ensayos rutinarios desde una única fuente > Ajustes de aplicación
Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009
 Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009 MANIFESTACIONES HEMORRÁGICAS Medidas generales a tener en cuenta en pacientes con tendencia hemorrágica Realizar un interrogatorio
Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009 MANIFESTACIONES HEMORRÁGICAS Medidas generales a tener en cuenta en pacientes con tendencia hemorrágica Realizar un interrogatorio
Universidad Nacional de la Patagonia San Juan Bosco Facultad de Ciencias Naturales Química Biológica Introducción
 Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
DIAGNOSTICO DE LOS TRASTORNOS AUTOINMUNES DE LA COAGULACION
 DIAGNOSTICO DE LOS TRASTORNOS AUTOINMUNES DE LA COAGULACION Dr. José Pardos-Gea Unidad Investigación Enfermedades Autoinmunes Servicio Medicina Interna. Hospital Universitario Vall d Hebrón Barcelona.
DIAGNOSTICO DE LOS TRASTORNOS AUTOINMUNES DE LA COAGULACION Dr. José Pardos-Gea Unidad Investigación Enfermedades Autoinmunes Servicio Medicina Interna. Hospital Universitario Vall d Hebrón Barcelona.
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
La sangre. Departamento de Fisiología, Facultad de medicina Juan Manuel Moreno
 La sangre Departamento de Fisiología, Facultad de medicina Juan Manuel Moreno jmmayuso@ugr.es 1 BIBLIOGRAFÍA RECOMENDADA BERNE Y LEVY. Fisiología + Student consult Koeppen, B.M. / Stanton, B.A. Editorial
La sangre Departamento de Fisiología, Facultad de medicina Juan Manuel Moreno jmmayuso@ugr.es 1 BIBLIOGRAFÍA RECOMENDADA BERNE Y LEVY. Fisiología + Student consult Koeppen, B.M. / Stanton, B.A. Editorial
La coagulación normal Un enfoque práctico para el neurólogo. Normal clotting A practical approach to the neurologist
 La coagulación normal Un enfoque práctico para el neurólogo Normal clotting A practical approach to the neurologist Hernán Bayona, Carlos Martínez, Alexandra Gómez RESUMEN La hemostasis es un mecanismo
La coagulación normal Un enfoque práctico para el neurólogo Normal clotting A practical approach to the neurologist Hernán Bayona, Carlos Martínez, Alexandra Gómez RESUMEN La hemostasis es un mecanismo
Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones
 Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones Por: Dr. Carlos Eduardo Rojas Martínez Dr José Fernando García Jaramillo Índice 1. 2. 3. 4. 5 Concepto de la medicina regenerativa.
Conceptos del Manejo de Factores de Crecimiento en sus distintas Aplicaciones Por: Dr. Carlos Eduardo Rojas Martínez Dr José Fernando García Jaramillo Índice 1. 2. 3. 4. 5 Concepto de la medicina regenerativa.
OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas.
 Química Biológica I TP : PROTEINAS Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Química Biológica I TP : PROTEINAS Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Lección 32. Antiagregantes, Anticoagulantes y Fibrinolíticos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS
 Ricardo Brage e Isabel Trapero - Lección 32 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 32 Antiagregantes, Anticoagulantes y Fibrinolíticos 1. FUNDAMENTOS 2. CLASIFICACIÓN Guión Ricardo
Ricardo Brage e Isabel Trapero - Lección 32 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 32 Antiagregantes, Anticoagulantes y Fibrinolíticos 1. FUNDAMENTOS 2. CLASIFICACIÓN Guión Ricardo
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Diagnóstico Molecular de Trombofilias
 Diagnóstico Molecular de Trombofilias Juan Carlos Gómez de la Torre Pretell Patología Clínica-Biología Molecular Medicina de Enfermedades Infecciosas y Tropicales Master of Buissnes Administration HCFAP-Laboratorios
Diagnóstico Molecular de Trombofilias Juan Carlos Gómez de la Torre Pretell Patología Clínica-Biología Molecular Medicina de Enfermedades Infecciosas y Tropicales Master of Buissnes Administration HCFAP-Laboratorios
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
11 Número de publicación: Int. Cl.: 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 29 114 1 Int. Cl.: C07K 16/36 (06.01) C12N / (06.01) C07K 2/00 (06.01) C07K 14/74 (06.01) A61K 39/39 (06.01) G01N 33/77 (06.01)
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 29 114 1 Int. Cl.: C07K 16/36 (06.01) C12N / (06.01) C07K 2/00 (06.01) C07K 14/74 (06.01) A61K 39/39 (06.01) G01N 33/77 (06.01)
ANTIAGREGANTES Y ANTICOAGULANTES. LEANDRO BARBOZA (dpto. farmacologia y terapeutica)
 ANTIAGREGANTES Y ANTICOAGULANTES LEANDRO BARBOZA (dpto. farmacologia y terapeutica) mecanismos de agregacion plaquetaria SISTEMAS DE COAGULACIÓN Proteasas: II, VI, IX, X, XI, XII y XIII cofactores no enzimáticos:
ANTIAGREGANTES Y ANTICOAGULANTES LEANDRO BARBOZA (dpto. farmacologia y terapeutica) mecanismos de agregacion plaquetaria SISTEMAS DE COAGULACIÓN Proteasas: II, VI, IX, X, XI, XII y XIII cofactores no enzimáticos:
ENZIMAS-2005 CINÉTICA ENZIMÁTICA
 ENZIMAS-00 Las enzimas son catalizadores biológicos en su mayoría de naturaleza proteica (99,99%) y las ribosimas (fragmentos de RNA) (0,%). Las enzimas tienen tres propiedades bien definidas e inigualables
ENZIMAS-00 Las enzimas son catalizadores biológicos en su mayoría de naturaleza proteica (99,99%) y las ribosimas (fragmentos de RNA) (0,%). Las enzimas tienen tres propiedades bien definidas e inigualables
El metabolismo es un conjunto de reacciones químicas que tienen lugar en las células del cuerpo
 METABOLISMO El metabolismo es un conjunto de reacciones químicas que tienen lugar en las células del cuerpo El metabolismo transforma la energía que contienen los alimentos que ingerimos en el combustible
METABOLISMO El metabolismo es un conjunto de reacciones químicas que tienen lugar en las células del cuerpo El metabolismo transforma la energía que contienen los alimentos que ingerimos en el combustible
endoenzimas exoenzimas:
 Enzimas Enzimas:son proteínas altamente especializadas que tienen como función la catálisis o regulación de la velocidad de las reacciones químicas que se llevan a cabo en los seres vivos. Son macromoléculas
Enzimas Enzimas:son proteínas altamente especializadas que tienen como función la catálisis o regulación de la velocidad de las reacciones químicas que se llevan a cabo en los seres vivos. Son macromoléculas
ACCIÓN DE LOS INHIBIDORES COMPETITIVOS Y NO COMPETITIVOS SOBRE LA ACTIVIDAD ENZIMÁTICA
 ACCIÓN DE LOS INHIBIDORES COMPETITIVOS Y NO COMPETITIVOS SOBRE LA ACTIVIDAD ENZIMÁTICA I. INTRODUCCIÓN Una propiedad característica de las enzimas es su sensibilidad a diversos reactivos químicos que reaccionan
ACCIÓN DE LOS INHIBIDORES COMPETITIVOS Y NO COMPETITIVOS SOBRE LA ACTIVIDAD ENZIMÁTICA I. INTRODUCCIÓN Una propiedad característica de las enzimas es su sensibilidad a diversos reactivos químicos que reaccionan
Página 1 de 5 ANÁLISIS CLÍNICOS:
 Página 1 de 5 ANÁLISIS CLÍNICOS: Esta sección esta sujeta a cambios, en la medida que se vayan incorporando nuevos valores de referencia, la interpretación de los resultados debe ser realizada por un experto
Página 1 de 5 ANÁLISIS CLÍNICOS: Esta sección esta sujeta a cambios, en la medida que se vayan incorporando nuevos valores de referencia, la interpretación de los resultados debe ser realizada por un experto
INTRODUCCIÓN MECANISMOS DE LA COAGULACION SANGUINEA.
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS CICLO 2017 CIENCIAS BASICAS Y BIOLOGICAS SEGUNDO AÑO UNIDAD DIDACTICA BIOQUIMICA PRACTICA DE LABORATORIO No. 9: COAGULACIÓN SANGUINEA.
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS CICLO 2017 CIENCIAS BASICAS Y BIOLOGICAS SEGUNDO AÑO UNIDAD DIDACTICA BIOQUIMICA PRACTICA DE LABORATORIO No. 9: COAGULACIÓN SANGUINEA.
Consejo de Salubridad General Identificación de tratamientos y medicamentos asociados a gastos catastróficos PROTOCOLO TÉCNICO
 Diagnóstico Unidad Médica con Pediatra, Hematólogo Estudios de laboratorio: Biometría hemática completa, con cuenta de plaquetas. Estudio de hemostasia: tiempo de trombina (TT), tiempo de sangrado, tiempo
Diagnóstico Unidad Médica con Pediatra, Hematólogo Estudios de laboratorio: Biometría hemática completa, con cuenta de plaquetas. Estudio de hemostasia: tiempo de trombina (TT), tiempo de sangrado, tiempo
Tema 5.- Respuesta innata II. Fagocitosis. Complemento
 Tema 5.- Respuesta innata II. Fagocitosis. Complemento Principales características Descubierto por Bordet en 1895 Sistema de mas de 30 proteínas que actúan an de modo secuencial Sintetizadas por los hepatocitos
Tema 5.- Respuesta innata II. Fagocitosis. Complemento Principales características Descubierto por Bordet en 1895 Sistema de mas de 30 proteínas que actúan an de modo secuencial Sintetizadas por los hepatocitos
TRASTORNOS DE SANGRADOS.
 1 TRASTORNOS DE SANGRADOS. Una persona que sangra no únicamente puede tener como causa de su sangrado algún defecto de la coagulación, sino también de las plaquetas ó de vasos sanguíneos, de modo que lo
1 TRASTORNOS DE SANGRADOS. Una persona que sangra no únicamente puede tener como causa de su sangrado algún defecto de la coagulación, sino también de las plaquetas ó de vasos sanguíneos, de modo que lo
PLAQUETAS ENFERMEDAD HEPATICA ENFERMEDAD RENAL. Dra Ana María Nuñez Banco de Sangre.
 PLAQUETAS ENFERMEDAD HEPATICA ENFERMEDAD RENAL Dra Ana María Nuñez Banco de Sangre. Revisión Enfermedad renal y hepática alteran el numero de plaquetas y función. Impacto de la trombocitopenia en las complicaciones
PLAQUETAS ENFERMEDAD HEPATICA ENFERMEDAD RENAL Dra Ana María Nuñez Banco de Sangre. Revisión Enfermedad renal y hepática alteran el numero de plaquetas y función. Impacto de la trombocitopenia en las complicaciones
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
Perfil farmacocinético de los anticuerpos monoclonales
 Perfil farmacocinético de los anticuerpos monoclonales Perfil farmacocinético de los anticuerpos monoclonales Dr. Héctor Telechea. Prof. Adjunto Departamento Farmacología y Terapéutica. F. Medicina. UdelaR.
Perfil farmacocinético de los anticuerpos monoclonales Perfil farmacocinético de los anticuerpos monoclonales Dr. Héctor Telechea. Prof. Adjunto Departamento Farmacología y Terapéutica. F. Medicina. UdelaR.
EL CONTROL DE LAS ACTIVIDADES CELULARES
 EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
Metabolismo de eicosanoides DRA. CARMEN AÍDA MARTÍNEZ
 Metabolismo de eicosanoides DRA. CARMEN AÍDA MARTÍNEZ INFLAMACIÓN CASCADA INFLAMATORIA ACIDOS GRASOS ESENCIALES Acido araquidónico (C20:4) Características acido araquidónico ácido 5, 8, 11, 14-eicosatetraenoico
Metabolismo de eicosanoides DRA. CARMEN AÍDA MARTÍNEZ INFLAMACIÓN CASCADA INFLAMATORIA ACIDOS GRASOS ESENCIALES Acido araquidónico (C20:4) Características acido araquidónico ácido 5, 8, 11, 14-eicosatetraenoico
COMPLEMENTO El sistema del complemento es el mediador humoral primario de las reacciones antígeno-anticuerpo anticuerpo. Está compuesto por más de 30
 COMPLEMENTO Dr. Carlos R. Kunzle COMPLEMENTO El sistema del complemento es el mediador humoral primario de las reacciones antígeno-anticuerpo anticuerpo. Está compuesto por más de 30 proteínas en el plasma
COMPLEMENTO Dr. Carlos R. Kunzle COMPLEMENTO El sistema del complemento es el mediador humoral primario de las reacciones antígeno-anticuerpo anticuerpo. Está compuesto por más de 30 proteínas en el plasma
Sistema hemostático: fisiopatología y aproximación clínica y diagnóstica
 ACTUALIZACIÓN Sistema hemostático: fisiopatología y aproximación clínica y diagnóstica J. A. Páramo Fernández Servicio de Hematología. Clínica Universidad de Navarra. Pamplona. España. Palabras Clave:
ACTUALIZACIÓN Sistema hemostático: fisiopatología y aproximación clínica y diagnóstica J. A. Páramo Fernández Servicio de Hematología. Clínica Universidad de Navarra. Pamplona. España. Palabras Clave:
IES La Gándara PREGUNTAS PAU CyL Dpto. Biología y Geología. EJERCICIOS PAU Y EBAU (Castilla y León) Fuente:
 Tema 4. PRTEÍNAS y ENZIMAS EJERCICIS PAU Y EBAU (Castilla y León) Fuente: http://www.usal.es/node/100506 1. a) Dibuje la fórmula estructural del hexapéptido Gly-Ser-Gly-Ala-Gly-Ala y señale con claridad
Tema 4. PRTEÍNAS y ENZIMAS EJERCICIS PAU Y EBAU (Castilla y León) Fuente: http://www.usal.es/node/100506 1. a) Dibuje la fórmula estructural del hexapéptido Gly-Ser-Gly-Ala-Gly-Ala y señale con claridad
Las Proteínas BIOLOGÍA 2º BACHILLERATO TEMA 4: Actividades: 1º DÍA Los aminoácidos. Pg
 BIOLOGÍA 2º BACHILLERATO TEMA 4: Las Proteínas Actividades: 1º DÍA Los aminoácidos Pg 58-59-60 1. Define el concepto de aminoácido. Escribe su fórmula general explicando su estructura molecular. 2. a)
BIOLOGÍA 2º BACHILLERATO TEMA 4: Las Proteínas Actividades: 1º DÍA Los aminoácidos Pg 58-59-60 1. Define el concepto de aminoácido. Escribe su fórmula general explicando su estructura molecular. 2. a)
