Poco después el científico estadounidense Millikan midió la masa y la carga del electrón.
|
|
|
- Daniel San Martín Cortés
- hace 6 años
- Vistas:
Transcripción
1 UNIDAD 8. SISTEMA PERIÓDICO Y ENLACE REPASO El átomo: de Demócrito a Dalton El filósofo griego Leucipo y su discípulo Demócrito defendieron, en los siglos V y IV a. C., la teoría atomista, según la cual la materia está formada por partículas muy pequeñas e indivisibles llamadas átomos, pero por esa misma época otros filósofos griegos, como Platón y Aristóteles, apoyaron la teoría según la cual la materia es algo continuo que se puede dividir en parte más pequeñas hasta el infinito. Dado el mayor prestigio de estos últimos, sus teorías se tomaron como ciertas hasta finales del siglo XVIII, cuando científicos como el francés Lavoisier y el británico Dalton demostraron, con una serie de experiencias realizadas en sus laboratorios, que la materia estaba formada por átomos. La teoría atómica de Dalton se resume en los siguientes enunciados: La materia está formada por átomos, que son partículas muy pequeñas e indivisibles. Todos los átomos de un mismo elemento químico son iguales entre sí en masa y en propiedades, y distintos de los átomos de cualquier otro elemento. Los compuestos se forman por combinaciones de átomos de distintos elementos. Descubrimiento de las partículas que forman el átomo La teoría de Dalton, que consideraba los átomos como partículas indivisibles, fue superada al observar que, en determinadas situaciones, la materia presenta propiedades eléctricas. Se hicieron experiencias que relacionaron las propiedades eléctricas de la materia con la existencia en el interior de los átomos de otras partículas más pequeñas responsables del comportamiento eléctrico. Thomson realizó experiencias en tubos de descarga y encontró que en los átomos de los elementos químicos existe una partícula con carga eléctrica negativa, a la que denominó electrón. En el interior de todos los átomos hay una o más partículas cargadas negativamente, a las que se llamó electrones. Poco después el científico estadounidense Millikan midió la masa y la carga del electrón. Como la materia solo muestra sus propiedades eléctricas en determinadas condiciones, debemos pensar que es neutra. Si los átomos tienen partículas con carga negativa, también deben poseer partículas con carga positiva, de tal manera que cada átomo tenga tantas partículas positivas como negativas. Posteriores experiencias permitieron al científico Rutherford descubrir el protón, partícula que tiene la misma carga que el electrón, pero positiva, mientras que su masa es mayor. Finalmente, el científico Chadwick descubrió que en los átomos había una tercera partícula que no tenía carga eléctrica, pero cuya masa era similar a la del protón, a la que llamó neutrón. Hoy día sabemos que en el átomo hay otras partículas más pequeñas, llamadas quarks, que forman los protones y los neutrones. Modelos atómicos Después de demostrar que el átomo estaba formado por otras partículas más pequeñas, en contra de lo que suponía Dalton, los científicos diseñaron modelos atómicos y realizaron experiencias para comprobarlos. Los resultados de algunas de ellas demostraron que los modelos no eran adecuados y fueron modificados. 1
2 El modelo de Thomson Dado que los átomos tenían una masa mucho mayor que la de los electrones, Thomson supuso que la carga positiva debía ocupar mucho más espacio. Según Thomson, el átomo debía ser como una gran masa de carga positiva, e incrustados en ella, debían estar los electrones. La carga negativa de los electrones compensaba la carga positiva, para que el átomo fuera neutro. LA EXPERIENCIA DE LA LÁMINA DE ORO Para comprobar si el modelo de Thomson era cierto, científicos colaboradores de Rutherford diseñaron una experiencia aprovechando algunos descubrimientos que se habían hecho sobre la radiactividad. En el interior de un bloque de plomo se hizo una cavidad con una salida al exterior en la que se colocó el material radiactivo que producía los rayos alfa (mineral de uranio). Todos los rayos que no tuviesen la dirección del orificio de salida serían absorbidos por el plomo de modo que a la lámina de oro llegasen unos rayos procedentes directamente del material radiactivo. Realizada la experiencia, se obtuvieron los siguientes resultados: La mayoría de las partículas alfa atravesaba la lámina de oro sin desviarse. Una pequeña proporción de partículas atravesaba la lámina, pero sufrían una leve desviación. Una de cada partículas alfa rebotaba al llegar a la lámina y volvía hacia atrás. El modelo de Rutherford El resultado de la experiencia de la lámina de oro sorprendió a los científicos, que no podían explicar que algunas partículas alfa, al chocar a gran velocidad contra la finísima lámina, salieran rebotadas. Para Rutherford esto solo se podía explicar si la carga positiva, en lugar de estar distribuida por todo el átomo, está concentrada en una parte muy pequeña. De esta forma, cuando las partículas alfa chocan contra ese punto del átomo en el que se concentra la carga positiva, la repulsión entre las cargas del mismo signo hace que salgan rebotadas. 2
3 Según Rutherford, el átomo está formado por un núcleo muy pequeño y una corteza. En el núcleo está concentrada toda su carga positiva y casi toda su masa. En la corteza están los electrones girando alrededor del núcleo. El modelo de Bohr El científico danés Bohr realizó una serie de estudios de los que dedujo que los electrones de la corteza giran alrededor del núcleo describiendo solo determinadas órbitas circulares. Así, los electrones en el átomo se organizan en capas denominadas niveles de energía y, a medida que estos niveles se van llenando, los electrones se van situando en niveles superiores. El modelo actual Fue establecido por Schrödinger y sustituye la idea de que el electrón se sitúa en determinadas capas o niveles de energía por la probabilidad de encontrar al electrón en una determinada región del espacio: orbital. Un orbital es una región del espacio en la que existe la máxima probabilidad de encontrar al electrón. 1. La constitución del átomo El átomo es una estructura con un núcleo, donde se encuentran los protones y los neutrones, y una corteza, en la que se sitúan los electrones. Para representar los átomos de un elemento se utiliza un símbolo y dos números: Z X. El símbolo es la inicial del nombre latino del elemento y va seguido de otra letra en los casos en que hay varios elementos con la misma inicial. El número atómico, Z, indica el número de protones. El número másico, A, indica el número de protones más el número de neutrones. En un átomo neutro, el número de protones coincide con el de electrones. Todos los átomos de un mismo elemento químico tienen el mismo número de protones, pero se pueden diferenciar en el número de neutrones. Se llaman isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Tienen, por tanto, el mismo número atómico y diferente número másico. Frecuentemente, cuando los átomos de distintos elementos se unen para formar compuestos, lo hacen ganando o perdiendo electrones. Cuando esto ocurre, los átomos dejan de ser neutros y pasan a tener carga, convirtiéndose en iones. Cuando un átomo pierde electrones, adquiere carga positiva y se convierte en un ion positivo o catión. Cuando un átomo gana electrones, adquiere carga negativa y se convierte en un ion negativo o anión. 3
4 2. Los elementos químicos Cuando los átomos se unen pueden dar lugar a: Elementos: son sustancias formadas por un único tipo de átomos. Compuestos: son sustancias que resultan de la agrupación de átomos de distintos elementos. Los elementos químicos que conocemos hoy en día se han ido descubriendo poco a poco y, a medida que aumentó el número de elementos conocidos se hizo necesario clasificarlos agrupando aquellos que tenían propiedades comunes. El criterio de clasificación ha ido cambiando también a lo largo de la historia. Hasta comienzos del siglo XIX los elementos se clasificaron basándose en el aspecto y en las propiedades físicas. Se establecieron dos grupos: metales y no metales. En 1829, Dobëreiner los ordenó según sus masas atómicas y observó la existencia de grupos de tres elementos (tríadas) con propiedades similares. Sólo encontró tres: Ca, Sr, Ba; Cl, Br, I y S, Se, Te. En 1864 Newlands ordenó también los elementos según sus masas y comprobó que cada ocho elementos (octavas) se repetían las propiedades. Los dispuso en columnas verticales de siete, de forma que los que tenían propiedades parecidas tendían a quedar en la misma fila horizontal. En 1869, Mendeleiev publicó la primera tabla de los elementos químicos. Al igual que Newlands, los ordenó por sus masas atómicas; los agrupó según sus propiedades en filas y columnas pero dejó huecos en aquellos lugares que no correspondían con las propiedades de ninguno de los elementos conocidos. La llamó tabla periódica de los elementos porque las propiedades se repetían cada cierto número de elementos. Cuando en 1895 Ramsay aisló el argón y el helio, como no presentaban ninguna propiedad de tipo químico, se decidió formar un nuevo grupo, que hoy conocemos como el de los gases nobles. En 1914, Moseley demostró que es el número atómico el que responde a las propiedades químicas de los elementos. Así, en la tabla periódica actual los elementos se ordenan en orden creciente de sus números atómicos y, tal como había previsto Mendeleiev, los elementos de una misma columna presentan propiedades semejantes Clasificación de los elementos: metales, no metales y gases nobles La clasificación más sencilla que se hace de los elementos químicos es como metales, no metales y gases nobles. PROPIEDADES DE LOS METALES Tienen un brillo característico que se denomina brillo metálico. Conducen bien el calor y la electricidad. Son dúctiles (se estiran en hilos) y maleables (forman láminas). Excepto el mercurio, que es líquido, son sólidos a temperatura ambiente y funden a alta temperatura. Tienden a perder electrones y formar iones positivos. PROPIEDADES DE LOS NO METALES Son malos conductores del calor y la electricidad. A temperatura ambiente pueden ser sólidos (azufre), líquidos (bromo) o gases (flúor). La mayoría de los sólidos son blandos. La temperatura de fusión para la mayoría de los sólidos es baja, y también la de ebullición para los líquidos. Suelen captar electrones formando iones negativos. 4
5 PROPIEDADES DE LOS GASES NOBLES Se encuentran como átomos aislados. Son gases a temperatura ambiente. Son muy estables desde el punto de vista químico, no forman compuestos. No ganan ni pierden electrones, no forman iones. 3. El sistema periódico de los elementos 3.1. Configuración electrónica de los elementos En el átomo los electrones se distribuyen, alrededor del núcleo, en determinados niveles que tienen distinta energía y se denominan niveles energéticos. El nivel de menor energía es el que está más próximo al núcleo y, desde ahí, la energía aumenta hasta llegar al exterior. En la corteza de los átomos existen hasta siete niveles energéticos que se designan con un número (o una letra) según su proximidad al núcleo, y en cada nivel energético se diferencian, a su vez, distintos subniveles, también llamados orbitales, que se identifican con las letras s, p, d y f. Los electrones se distribuyen alrededor del núcleo de un átomo siguiendo ciertas normas: 1. Los electrones van ocupando los orbitales en orden creciente de energía, empezando por los de menor energía, que son los más cercanos al núcleo. 2. En cada orbital solo puede haber dos electrones. 3. Cuando se llenan orbitales de la misma energía (3 orbitales p, 5 orbitales d o 7 orbitales f) primero se coloca un electrón en cada uno de los orbitales y, cuando todos tienen uno, se coloca el segundo. El objetivo es que exista el mayor número de electrones girando en el mismo sentido, pues esta es la configuración más estable. Para recordar el orden de llenado de los orbitales se aplica la regla de las diagonales o diagrama de Moeller. A partir de las configuraciones electrónicas de los elementos vamos a poder obtener una serie de datos sobre los mismos, como pueden ser, su situación en la tabla periódica, el carácter metálico o no metálico y el tipo de ion que tiene tendencia a formar. 5
6 3.2. La tabla periódica La distribución de los elementos químicos en la tabla periódica viene determinada por su configuración electrónica, esto es, la forma en que se distribuyen los electrones en la corteza del átomo. En la tabla periódica actual los elementos están distribuidos en 7 filas, llamadas periodos, y 18 columnas, llamadas grupos. Todos los elementos del mismo periodo tienen sus últimos electrones en el mismo nivel, cuyo número coincide con el número del periodo. Todos los elementos del mismo grupo tienen propiedades químicas parecidas y su configuración electrónica termina de la misma forma. En función de cuál es el último nivel ocupado se agrupan también en bloques. Bloque s: Grupos 1 y 2 (alcalinos y alcalino-térreos), tienen su último electrón (electrón diferenciador) en el orbital s. Bloque d: Grupos 3 al 12 (elementos de transición), su electrón diferenciador ocupa un orbital d. Bloque p: Grupos 13 al 18, su último electrón se encuentra en un orbital p. Bloque f: Lantánidos y actínidos (elementos de transición interna), su último electrón ocupa un orbital f. Dado un determinado elemento de número atómico Z=17, hacemos su configuración electrónica y vemos qué información podemos obtener a partir de ésta. 17Cl 1s 2 2s 2 2p 6 3s 2 3p 5 - El periodo en que se encuentra coincide con el número de capas ocupadas, esto es, 3. - El grupo depende de dónde se sitúe le electrón diferenciador (el último). Si el electrón diferenciador se coloca en un orbital s, el número del grupo coincide con el número de electrones que haya en ese orbital (s 1 grupo 1 o s 2 grupo 2). Si el electrón diferenciador se encuentra en un orbital p, el número del grupo se obtiene sumando 12 (2 grupos del bloque s y 10 grupos del bloque d) al número de electrones que haya en el orbital p. Si el electrón diferenciador se encuentra en un orbital d, el número del grupo se obtiene sumando 2 (2 grupos del bloque s) al número de electrones que haya en el orbital d. Si el electrón diferenciador se encuentra en un orbital f, para determinar el grupo miramos en qué periodo se encuentra. Si está en el periodo 6 diremos que está en el grupo de los lantánidos y si está en el periodo 7, pertenece al grupo de los actínidos. 6
7 CRISTALINOS MOLECULARES Física y Química 4º ESO 4. Agrupación de los elementos para formar los compuestos Todos los procesos que ocurren en la naturaleza lo hacen de forma que se alcance la máxima estabilidad. En la naturaleza solo los elementos del grupo 18 del sistema periódico tienen una configuración estable y sus átomos casi nunca se combinan con otros átomos, por lo que se denominan gases nobles. Esto no sucede con los demás elementos químicos, cuyos átomos aparecen casi siempre combinados con otros para conseguir obtener la configuración de los gases nobles. Se denomina enlace químico entre átomos a la unión que los mantiene unidos, formando compuestos químicos, que son más estables que los átomos por separados Pueden ser de tres tipos: iónico, covalente y metálico Enlace iónico El enlace iónico se produce cuando se combinan un metal y un no metal. El metal tiende a ceder electrones para alcanzar la configuración de gas noble (convirtiéndose en un catión) y el no metal tiende a captar electrones (convirtiéndose en un anión). PROPIEDADES DE LOS COMPUESTOS IÓNICOS A temperatura ambiente son sólidos cristalinos. Tienen altos puntos de fusión y de ebullición. Son duros y frágiles. Son solubles en agua. No conducen la electricidad en estado sólido, pero sí lo hacen cuando están fundidos o en disolución Enlace covalente El enlace covalente tiene lugar entre elementos no metálicos que comparten electrones para adquirir una configuración electrónica más estable. PROPIEDADES DE LOS COMPUESTOS COVALENTES A temperatura ambiente la mayoría son gases, como el cloro; los hay también líquidos, como el agua y el etanol, e incluso algunos sólidos, como el azufre y el yodo. En el caso de los sólidos tienen bajos puntos de fusión y de ebullición. Son blandos y elásticos. No conducen la electricidad. Los compuestos polares (agua, amoniaco, ) disuelven a los polares y los apolares (yodo, tetracloruro de carbono, ) disuelven a los apolares. A temperatura ambiente son sólidos. Tienen puntos de fusión y de ebullición muy altos. Son duros y frágiles. A excepción del grafito, no son conductores de electricidad y tampoco son buenos conductores del calor. Prácticamente son insolubles en cualquier tipo de disolvente Enlace metálico El enlace metálico tiene lugar entre metales, que se desprenden de sus electrones de valencia y forman cationes que se rodean de ese mar de electrones, evitando de esta forma la repulsión entre los iones positivos. 7
8 PROPIEDADES DE LOS COMPUESTOS METÁLICOS A excepción del mercurio, que es líquido, todos son sólidos a temperatura ambiente. Tienen altos puntos de fusión y de ebullición. Tienen una dureza intermedia y son dúctiles y maleables. Son insolubles en los disolventes ordinarios. Son excelentes conductores del calor y de la electricidad. 8
9 9
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1.- MODELOS ATÓMICOS * TEORÍA ATÓMICA DE DALTON (1808) - La materia está formada por átomos, que son pequeñas
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE EL ÁTOMO, EL SISTEMA PERIÓDICO Y ENLACE QUÍMICO 1.- MODELOS ATÓMICOS * TEORÍA ATÓMICA DE DALTON (1808) - La materia está formada por átomos, que son pequeñas
La Teoría atómica de Dalton se resume en los siguientes enunciados:
 1. EL ÁTOMO. Hasta ahora hemos estudiado cómo se presenta la materia y cómo se clasifica pero hay todavía muchas preguntas sin responder: cuál es la naturaleza de la materia?, cómo es por dentro?, Existe
1. EL ÁTOMO. Hasta ahora hemos estudiado cómo se presenta la materia y cómo se clasifica pero hay todavía muchas preguntas sin responder: cuál es la naturaleza de la materia?, cómo es por dentro?, Existe
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
FÍSICA Y QUÍMICA 4º ESO Tema 8: Átomo, sistema periódico y enlace.
 FÍSICA Y QUÍMICA 4º ESO Tema 8: Átomo, sistema periódico y enlace. 1. El modelo atómico de Rutherford: (www. cdpdp. blogspot. com) El experimento que realizó Rutherfurd demostró que la materia está prácticamente
FÍSICA Y QUÍMICA 4º ESO Tema 8: Átomo, sistema periódico y enlace. 1. El modelo atómico de Rutherford: (www. cdpdp. blogspot. com) El experimento que realizó Rutherfurd demostró que la materia está prácticamente
Los átomos y sus enlaces
 Los átomos y sus enlaces Unidad 11 El modelo nuclear de átomo Demócrito Dalton Thompson Rutherford 1 El modelo nuclear de átomo Núcleo central / carga positiva / protones. Corteza / carga negativa / electrones.
Los átomos y sus enlaces Unidad 11 El modelo nuclear de átomo Demócrito Dalton Thompson Rutherford 1 El modelo nuclear de átomo Núcleo central / carga positiva / protones. Corteza / carga negativa / electrones.
TEMA 5. Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS
 TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
TEMA 5 Elementos y compuestos 1 CLASIFICACIÓN DE LOS ELEMENTOS La primera clasificación de los elementos fue la que distinguió entre metales y no metales y se basaba en el aspecto que presentaban los elementos
Materia.- Realidad primaria de la que están hechas las cosas.
 TEORÍA FÍSICA Y QUÍMICA, 2º TRIMESTRE TEMA 4 EL ÁTOMO Materia.- Realidad primaria de la que están hechas las cosas. Un átomo es la unidad constituyente más pequeña de la materia ordinaria que tiene las
TEORÍA FÍSICA Y QUÍMICA, 2º TRIMESTRE TEMA 4 EL ÁTOMO Materia.- Realidad primaria de la que están hechas las cosas. Un átomo es la unidad constituyente más pequeña de la materia ordinaria que tiene las
FÍSICA Y QUÍMICA 4º ESO
 Tema 2. Tabla periódica de los elementos FÍSICA Y QUÍMICA 4º ESO 1. modelos ATÓMICOS. 2. CONFIGURACIÓN ELECTRÓNICA. 3. TABLA PERIÓDICA D E LOS ELEMENTOS. 4. METALES Y NO METALES. 5. PROPIEDADES DE LOS
Tema 2. Tabla periódica de los elementos FÍSICA Y QUÍMICA 4º ESO 1. modelos ATÓMICOS. 2. CONFIGURACIÓN ELECTRÓNICA. 3. TABLA PERIÓDICA D E LOS ELEMENTOS. 4. METALES Y NO METALES. 5. PROPIEDADES DE LOS
IES LEOPOLDO QUEIPO. DEPARTAMENTO FÍSICA Y QUÍMICA 4ºESO. Tema 2 : El átomo y sus uniones
 Tema 2 : El átomo y sus uniones Esquema de trabajo: 1.- El átomo. A. Partículas subatómicas. B. Número atómico y número másico C. Estructura interna del átomo: clásica y actual. 2.- Organización de los
Tema 2 : El átomo y sus uniones Esquema de trabajo: 1.- El átomo. A. Partículas subatómicas. B. Número atómico y número másico C. Estructura interna del átomo: clásica y actual. 2.- Organización de los
4º E.S.O. FÍSICA Y QUÍMICA 2. ÁTOMOS Y SISTEMA PERIÓDICO. Dpto. de Física y Química. R. Artacho
 4º E.S.O. FÍSICA Y QUÍMICA 2. ÁTOMOS Y SISTEMA PERIÓDICO R. Artacho Dpto. de Física y Química Índice CONTENIDOS 1. Las partículas y el átomo 2. Modelos atómicos 3. Distribución de los electrones en un
4º E.S.O. FÍSICA Y QUÍMICA 2. ÁTOMOS Y SISTEMA PERIÓDICO R. Artacho Dpto. de Física y Química Índice CONTENIDOS 1. Las partículas y el átomo 2. Modelos atómicos 3. Distribución de los electrones en un
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
ESTRUCTURA ATÓMICA DE LA MATERIA
 ESTRUCTURA ATÓMICA DE LA MATERIA 1.MODELOS ATÓMICOS: EVOLUCIÓN HISTÓRICA. Fueron los griegos los primeros en profundizar en el conocimiento de la estructura íntima de la materia. Postularon que la materia
ESTRUCTURA ATÓMICA DE LA MATERIA 1.MODELOS ATÓMICOS: EVOLUCIÓN HISTÓRICA. Fueron los griegos los primeros en profundizar en el conocimiento de la estructura íntima de la materia. Postularon que la materia
TEMA 2. ENLACES QUIMICOS
 TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que
TEMA 2. ENLACES QUIMICOS En la naturaleza los átomos que constituyen la materia se encuentran unidos formando moléculas o agrupaciones más complejas. A pesar de ello existen una serie de elementos que
SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO.
 SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos 1. Solución: Descubrimiento de los dos «tipos» de electricidad. Siglo XVIII. Descubrimiento del electrón. 1897.
SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos 1. Solución: Descubrimiento de los dos «tipos» de electricidad. Siglo XVIII. Descubrimiento del electrón. 1897.
TEMA 4: EL ENLACE QUÍMICO
 TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
TEMA 4: EL ENLACE QUÍMICO 1. QUÉ ES EL ENLACE QUÍMICO? Todas las sustancias que existen en la naturaleza están formadas por átomos de elementos químicos. Generalmente estos átomos no se encuentran aislados,
UNIDAD 3: EL ENLACE QUÍMICO
 UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
UNIDAD 3: EL ENLACE QUÍMICO 1.- REGLA DEL OCTETO Casi todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las fuerzas que mantienen unidos los átomos en las distintas
UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción En la naturaleza, son muy pocos los átomos que se encuentran libres y aislados, sólo los átomos de
UNIONES ENTRE ÁTOMOS. EL ENLACE QUÍMICO Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción En la naturaleza, son muy pocos los átomos que se encuentran libres y aislados, sólo los átomos de
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
ELEMENTOS Y COMPUESTOS. EL ENLACE QUÍMICO CURSO 2013/2014
 ELEMENTOS Y COMPUESTOS. EL ENLACE QUÍMICO CURSO 2013/2014 ÍNDICE 1. El átomo 1.1. Partículas subatómicas 1.2. Modelos atómicos 2. Caracterización de los átomos 2.1. Número atómico y número másico 2.2.
ELEMENTOS Y COMPUESTOS. EL ENLACE QUÍMICO CURSO 2013/2014 ÍNDICE 1. El átomo 1.1. Partículas subatómicas 1.2. Modelos atómicos 2. Caracterización de los átomos 2.1. Número atómico y número másico 2.2.
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS
 I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016
 PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016 I. ESTRUCTURA ATÓMICA 1.1 PARTÍCULAS SUBATÓMICAS Partícula subatómica Símbolo Carga fundamental (Q) Carga relativa
PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016 I. ESTRUCTURA ATÓMICA 1.1 PARTÍCULAS SUBATÓMICAS Partícula subatómica Símbolo Carga fundamental (Q) Carga relativa
Enlace químico Educación Secundaria Obligatoria Física y Química
 EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
EL ENLACE QUÍMICO Hay tres maneras en que se unen los átomos: enlace iónico, enlace covalente y enlace metálico. Los enlaces entre átomos se producen porque éstos quieren cumplir la regla del octeto. La
TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO
 TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO. Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3
TEMA 4 LOS ÁTOMOS Y EL SISTEMA PERIÓDICO. Objetivos / Criterios de evaluación O.5.1 Conocer la importancia de la búsqueda de los elementos químicos. O.5.2 Diferenciar entre metales y no metales. O.5.3
3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos. 3. El sistema periódico de los elementos
 3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
3. El sistema periódico de los elementos Clasificación de los elementos químicos en el siglo XIX: los químicos de la época tenían una idea vaga de los átomos; no conocían p + ni e -. Clasificaban los elementos
TEMA 4. ELEMENTOS Y COMPUESTOS
 TEMA 4. ELEMENTOS Y COMPUESTOS Responde a las siguientes preguntas sobre el texto Qué significa el término átomo? Qué es un elemento? De qué están formados los materiales que nos rodean? Sabrías poner
TEMA 4. ELEMENTOS Y COMPUESTOS Responde a las siguientes preguntas sobre el texto Qué significa el término átomo? Qué es un elemento? De qué están formados los materiales que nos rodean? Sabrías poner
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
Física y Química 4 ESO EL ÁTOMO Pág. 1
 Física y Química 4 ESO EL ÁTOMO Pág. 1 UN POCO DE HISTORIA Demócrito y Leucipo (Siglo V a.c.) Algunos filósofos griegos creían que toda la materia estaba formada por una combinación de unas pocas sustancias
Física y Química 4 ESO EL ÁTOMO Pág. 1 UN POCO DE HISTORIA Demócrito y Leucipo (Siglo V a.c.) Algunos filósofos griegos creían que toda la materia estaba formada por una combinación de unas pocas sustancias
El átomo y el sistema periódico
 El átomo y el sistema periódico Conceptos previos Notación A-Z Conceptos previos En las reacciones químicas se cumple: 1) La ley de conservación de la masa 2) La ley de proporciones definidas Modelos atómicos
El átomo y el sistema periódico Conceptos previos Notación A-Z Conceptos previos En las reacciones químicas se cumple: 1) La ley de conservación de la masa 2) La ley de proporciones definidas Modelos atómicos
FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES 1.* Indiquen cuántos electrones tienen en la última capa cada uno de estos elementos. a) C f) O k) K b) F g) P l) S c) Ne h) H m) He d) Br
FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES 1.* Indiquen cuántos electrones tienen en la última capa cada uno de estos elementos. a) C f) O k) K b) F g) P l) S c) Ne h) H m) He d) Br
ESTRUCTURA DE LA MATERIA 3
 ESTRUCTURA DE LA MATERIA 3 SISTEMA PERIÓDICO Mendeleiev (columnas) y Meyer (filas) clasificaron periodicamente los elementos basandose 1º) colocar los elementos por orden creciente de sus masa atómicas
ESTRUCTURA DE LA MATERIA 3 SISTEMA PERIÓDICO Mendeleiev (columnas) y Meyer (filas) clasificaron periodicamente los elementos basandose 1º) colocar los elementos por orden creciente de sus masa atómicas
El enlace químico 3 ESO SEK-CATALUNYA
 El enlace químico 3 ESO SEK-CATALUNYA Contenidos Enlace químico Enlace metálico Propiedades de los metales Enlace iónico Propiedades de los compuestos iónicos Enlace covalente Propiedades de los compuestos
El enlace químico 3 ESO SEK-CATALUNYA Contenidos Enlace químico Enlace metálico Propiedades de los metales Enlace iónico Propiedades de los compuestos iónicos Enlace covalente Propiedades de los compuestos
Unidad didáctica Sistema Periódico y enlace químico
 Física Química 4º de ESO Unidad didáctica Sistema Periódico y enlace químico. Ficha nº 2: S.P. y enlace químico Física Química 4º de ESO 1.- Características de las partículas constituyentes del átomo.
Física Química 4º de ESO Unidad didáctica Sistema Periódico y enlace químico. Ficha nº 2: S.P. y enlace químico Física Química 4º de ESO 1.- Características de las partículas constituyentes del átomo.
Ejercicios tabla periódica. Enlace 4º ESO
 1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
1. a) Indica la configuración electrónica de los átomos de los elementos A, B y C cuyos números atómicos son respectivamente: 12, 17 y 19. b) Escribe la configuración electrónica del ion más estable de
ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA
 ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA La teoría atómica de Dalton se mantuvo con éxito durante casi un siglo pero tuvo que ser abandonada a partir del descubrimiento
ESTRUCTURA ATÓMICA DE LA MATERIA. SISTEMA PERIÓDICO ESTRUCTURA ATÓMICA DE LA MATERIA La teoría atómica de Dalton se mantuvo con éxito durante casi un siglo pero tuvo que ser abandonada a partir del descubrimiento
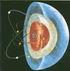
El átomo MODELOS ATÓMICOS
 El átomo Es la porción más pequeña de la materia. Los primeros en utilizar este término fueron Leucipo y Demócrito (los atomistas), quienes creían que la materia estaba formados por pequeñas partículas
El átomo Es la porción más pequeña de la materia. Los primeros en utilizar este término fueron Leucipo y Demócrito (los atomistas), quienes creían que la materia estaba formados por pequeñas partículas
EL INTERIOR DE LA MATERIA
 EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
Numero másico (A). Suma del numero de protones y el numero de neutrones de un átomo.
 PROPIEDADES DE LOS MATERIALES. UNIDAD El Estado Solido. Estructura Atómica. Protón- partícula con carga positiva. Neutro-partícula con carga neutra. Electron-particula con carga negativa. Numero atómico
PROPIEDADES DE LOS MATERIALES. UNIDAD El Estado Solido. Estructura Atómica. Protón- partícula con carga positiva. Neutro-partícula con carga neutra. Electron-particula con carga negativa. Numero atómico
El átomo. 4. Enuncia los postulados de la Teoría Atómica de Dalton.
 El átomo 1. Ordena cronológicamente los siguientes hechos. a) Descubrimiento del protón. b) Experimento de Rutherford. c) Descubrimiento del electrón. d) Modelo atómico de Rutherford. e) Modelo atómico
El átomo 1. Ordena cronológicamente los siguientes hechos. a) Descubrimiento del protón. b) Experimento de Rutherford. c) Descubrimiento del electrón. d) Modelo atómico de Rutherford. e) Modelo atómico
Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza.
 Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza. Tipos de sustancias Sustancias metálicas: tienen puntos de fusión variables,
Tema 1: Enlace químico. Se llama enlace químico a las fuerzas que mantienen unidos a los átomos, cualquiera que sea su naturaleza. Tipos de sustancias Sustancias metálicas: tienen puntos de fusión variables,
ESTRUCTURA BÁSICA DEL ÁTOMO Y SUS INTERACCIONES
 ESTRUCTURA BÁSICA DEL ÁTOMO Y SUS INTERACCIONES Estructura del átomo NÚCLEO: PROTONES Y NEUTRONES CORTEZA: ELECTRONES Hoy sabemos que el átomo es divisible, puesto que está formado por partículas más pequeñas,
ESTRUCTURA BÁSICA DEL ÁTOMO Y SUS INTERACCIONES Estructura del átomo NÚCLEO: PROTONES Y NEUTRONES CORTEZA: ELECTRONES Hoy sabemos que el átomo es divisible, puesto que está formado por partículas más pequeñas,
EL ÁTOMO. Departamento de Física y Química 3º ESO
 EL ÁTOMO Departamento de Física y Química 3º ESO 0. Mapa conceptual Metales No metales Tabla periódica Elementos Cationes Isótopos ÁTOMO Iones Aniones Protones Núcleo Neutrones Electrones Número atómico
EL ÁTOMO Departamento de Física y Química 3º ESO 0. Mapa conceptual Metales No metales Tabla periódica Elementos Cationes Isótopos ÁTOMO Iones Aniones Protones Núcleo Neutrones Electrones Número atómico
FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES Niveles de energía Modelo atómico actual Orbitales Configuración electrónica Tabla periódica Cada electrón puede encontrarse con más probabilidad en
FÍSICA Y QUÍMICA Versión impresa ELECTRONES Y ENLACES Niveles de energía Modelo atómico actual Orbitales Configuración electrónica Tabla periódica Cada electrón puede encontrarse con más probabilidad en
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
Electrón: LAS PARTÍCULAS SUBATÓMICAS. Electrón: e - Carga eléctrica: 1,602x10-19 C Masa: 9,109x10-31 C
 ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular
 UNIDAD 1: DIVERSIDAD Y UNIDAD DE ESTRUCTURA DE LA MATERIA 1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular 4. Sustanciaspuras puras,
UNIDAD 1: DIVERSIDAD Y UNIDAD DE ESTRUCTURA DE LA MATERIA 1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular 4. Sustanciaspuras puras,
ESTRUCTURA ATÓMICAA. Cómo podemos representar un átomo? Se puede hacer a través
 GUÍA DE APLICACIÓN 2 Profesora Verónica Abasto Córdova Ciencias Naturales 7 Básico Nombre: Curso: Fecha: ESTRUCTURA ATÓMICAA I.- ESTRUCTURA DEL ÁTOMO El átomo es la unidad estructural básica de la materia.
GUÍA DE APLICACIÓN 2 Profesora Verónica Abasto Córdova Ciencias Naturales 7 Básico Nombre: Curso: Fecha: ESTRUCTURA ATÓMICAA I.- ESTRUCTURA DEL ÁTOMO El átomo es la unidad estructural básica de la materia.
TEMA 7: ELEMENTOS Y COMPUESTOS
 TEMA 7: ELEMENTOS Y COMPUESTOS FÍSICA Y QUÍMICA 4º ESO IES ZOCO LAS PARTÍCULAS DEL ÁTOMO MODELO ATÓMICO DE DALTON Cada elemento químico se compone de partículas diminutas e indestructibles denominadas
TEMA 7: ELEMENTOS Y COMPUESTOS FÍSICA Y QUÍMICA 4º ESO IES ZOCO LAS PARTÍCULAS DEL ÁTOMO MODELO ATÓMICO DE DALTON Cada elemento químico se compone de partículas diminutas e indestructibles denominadas
Teoría atómica de Dalton (1803)
 EL ÁTOMO DIVISIBLE El átomo Desde los tiempos de la antigua Grecia,los pensadores se preguntaban cómo estaba constituida la materia en su interior? Demócrito (S.V a.c.) introduce el término de átomo como
EL ÁTOMO DIVISIBLE El átomo Desde los tiempos de la antigua Grecia,los pensadores se preguntaban cómo estaba constituida la materia en su interior? Demócrito (S.V a.c.) introduce el término de átomo como
TEMA 4.- Estructura de la. materia
 TEMA 4.- Estructura de la 1.- Concepto y tipos de sustancias puras. 2.- El átomo. 2.1.- Concepto de átomo. 2.2.- Estructura del átomo. 2.3.- Número atómico y número másico. 2.4.- Concepto y tipos de iones.
TEMA 4.- Estructura de la 1.- Concepto y tipos de sustancias puras. 2.- El átomo. 2.1.- Concepto de átomo. 2.2.- Estructura del átomo. 2.3.- Número atómico y número másico. 2.4.- Concepto y tipos de iones.
Tema 2. La agrupación de los átomos en la materia.
 Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
Tema 2. La agrupación de los átomos en la materia. En la naturaleza podemos encontrar: Sustancias simples: constituidas por átomos iguales. Compuestos: constituidos por átomos de distinta clase. Para poder
b) La zona externa del átomo se llama CORTEZA. y ahí es donde se mueven los ELECTRONES
 PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
UNIDAD 5: ESTRUCTURA ATÓMICA CLASIFICACIÓN PERIÓDICA
 UNIDAD 5: ESTRUCTURA ATÓMICA CLASIFICACIÓN PERIÓDICA 1 Recordando la unidad 1, el átomo esta formado por un núcleo (con protones y neutrones) y una corteza de electrones. Composición del átomo: Atomo Núcleo
UNIDAD 5: ESTRUCTURA ATÓMICA CLASIFICACIÓN PERIÓDICA 1 Recordando la unidad 1, el átomo esta formado por un núcleo (con protones y neutrones) y una corteza de electrones. Composición del átomo: Atomo Núcleo
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
El mundo material: los átomos. Física y Química 2º ESO
 El mundo material: los átomos Física y Química 2º ESO Viaje a lo más profundo de la materia Oxford University Press España, S. A. Física y Química 2º ESO 2 Hoy en día sabemos que la materia está constituida
El mundo material: los átomos Física y Química 2º ESO Viaje a lo más profundo de la materia Oxford University Press España, S. A. Física y Química 2º ESO 2 Hoy en día sabemos que la materia está constituida
Tabla Periódica y Propiedades Periódicas
 Tabla Periódica y Propiedades Periódicas Primeras clasificaciones periódicas. Fines S. XVIII Metales y no metales. 1829, Döbereiner Tríadas de comportamiento químico similar. A principios del siglo XIX
Tabla Periódica y Propiedades Periódicas Primeras clasificaciones periódicas. Fines S. XVIII Metales y no metales. 1829, Döbereiner Tríadas de comportamiento químico similar. A principios del siglo XIX
EL ÁTOMO. En una reacción química, los átomos se agrupan de forma diferente a como lo estaban inicialmente, pero ni aparecen ni desaparecen
 EL ÁTOMO 1. Conceptos generales 2. Modelos atómicos. 3. Teoría cuántica. Fundamentos. 4. Números cuánticos. 5. Distribución de los electrones en el átomo: configuraciones electrónicas ÁTOMO: Es la parte
EL ÁTOMO 1. Conceptos generales 2. Modelos atómicos. 3. Teoría cuántica. Fundamentos. 4. Números cuánticos. 5. Distribución de los electrones en el átomo: configuraciones electrónicas ÁTOMO: Es la parte
TEMA 5 Estructura del átomo. IES Sierra de San Quílez Departamento de Física y Química
 TEMA 5 Estructura del átomo IES Sierra de San Quílez Departamento de Física y Química El átomo Naturaleza eléctrica de la materia Fenómenos eléctricos Algunos fenómenos de electrización pusieron de manifiesto
TEMA 5 Estructura del átomo IES Sierra de San Quílez Departamento de Física y Química El átomo Naturaleza eléctrica de la materia Fenómenos eléctricos Algunos fenómenos de electrización pusieron de manifiesto
2.- Los átomos de un mismo elemento son iguales en masa y propiedades. Y los átomos de elementos diferentes son diferentes en masa y propiedades.
 FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
Unidad 1: Estructura atómica de la materia
 ACTIVIDADES Unidad 1: Estructura atómica de la materia Para a realización de ditas actividades recoméndase seguir a seguinte páxina de internet do Ministerio de Educación e ciencia na cal se explica de
ACTIVIDADES Unidad 1: Estructura atómica de la materia Para a realización de ditas actividades recoméndase seguir a seguinte páxina de internet do Ministerio de Educación e ciencia na cal se explica de
EL ENLACE QUÍMICO. Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o iones.
 EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. Enlace iónico. Reacciones de ionización. 1.2. Enlace covalente. Modelo de Lewis. 2.- Justificación de la fórmula de los principales compuestos
TABLA PERIÓDICA. La colocación de los elementos en la tabla periódica se hace teniendo en cuenta la configuración electrónica.
 TABLA PERIÓDICA La historia de la tabla periódica está marcada principalmente por el descubrimiento de los elementos químicos. Elementos como oro, plata, hierro o cobre eran conocidos desde la antigüedad;
TABLA PERIÓDICA La historia de la tabla periódica está marcada principalmente por el descubrimiento de los elementos químicos. Elementos como oro, plata, hierro o cobre eran conocidos desde la antigüedad;
TEMA 1. ELEMENTOS Y COMPUESTOS
 TEMA 1. ELEMENTOS Y COMPUESTOS 0. Índice COLEGIO SAN JOSÉ - Hijas de María Auxiliadora 1. Estructura atómica: las partículas del átomo...2 1.1. Modelo atómico de Dalton...2 1.2. Partículas subatómicas...2
TEMA 1. ELEMENTOS Y COMPUESTOS 0. Índice COLEGIO SAN JOSÉ - Hijas de María Auxiliadora 1. Estructura atómica: las partículas del átomo...2 1.1. Modelo atómico de Dalton...2 1.2. Partículas subatómicas...2
Atomos, Moleculas, y Iones
 Atomos, Moleculas, y Iones La teoría atómica de la materia John Dalton: Cada elemento esta compuesto por átomos. Todos los átomos de un elemento son iguales. En las reacciones químicas los átomos no sufren
Atomos, Moleculas, y Iones La teoría atómica de la materia John Dalton: Cada elemento esta compuesto por átomos. Todos los átomos de un elemento son iguales. En las reacciones químicas los átomos no sufren
SEMANA 01 Estructura Atómica y Tabla Periódica. Licda. Lilian Judith Guzmán Melgar
 SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
SEMANA 01 Estructura Atómica y Tabla Periódica Licda. Lilian Judith Guzmán Melgar 2016 ATOMO Es la partícula mas pequeña de un elemento que mantiene sus características. John Dalton formuló la TEORIA ATOMICA
Como esta formada la materia?
 Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
LA ESTRUCTURA DE LA MATERIA TEMA 1
 LA ESTRUCTURA DE LA MATERIA TEMA 1 ESPECTRO ATÓMICO Es el conjunto de ondas de radiación de un átomo, caracterizadas por determinados valores de longitudes de onda, y recogido en una pantalla. Tipos de
LA ESTRUCTURA DE LA MATERIA TEMA 1 ESPECTRO ATÓMICO Es el conjunto de ondas de radiación de un átomo, caracterizadas por determinados valores de longitudes de onda, y recogido en una pantalla. Tipos de
ESTRUCTURA DE LA MATERIA
 Se tuvo que esperar a los siglos XVI-XVII para poderse romper con la tradición alquimista, estableciéndose las bases del método científico y desapareciendo el hermetismo de los escritos, comunicándose
Se tuvo que esperar a los siglos XVI-XVII para poderse romper con la tradición alquimista, estableciéndose las bases del método científico y desapareciendo el hermetismo de los escritos, comunicándose
Guía de Problemas- 5 BTO
 Química Guía de Problemas- 5 BTO Primera Parte Liliana Pagliano 2012 1 Introducción: 1. Qué diferencias existen entre un proceso físico y un proceso químico? 2. Qué es el conocimiento científico? 3. Ante
Química Guía de Problemas- 5 BTO Primera Parte Liliana Pagliano 2012 1 Introducción: 1. Qué diferencias existen entre un proceso físico y un proceso químico? 2. Qué es el conocimiento científico? 3. Ante
LA MATERIA. Características de los átomos
 LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
4 Elementos y compuestos
 4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
4 Elementos y compuestos Elementos Las sustancias puras son aquellas que se caracterizan por el hecho de que todas sus partes tienen las mismas propiedades, es decir, todas sus partículas son del mismo
LOS ÁTOMOS. En una reacción química, la masa total de los reactivos es igual a la masa total de las sustancias obtenidas tras el proceso.
 LOS ÁTOMOS 1. LEYES PONDERALES. MODELO ATÓMICO DE DALTON Se denominan leyes ponderales de las reacciones químicas aquellas que establecen las proporciones de los pesos en cualquier proceso químico. Son
LOS ÁTOMOS 1. LEYES PONDERALES. MODELO ATÓMICO DE DALTON Se denominan leyes ponderales de las reacciones químicas aquellas que establecen las proporciones de los pesos en cualquier proceso químico. Son
Conocer las formas de clasificación de los elementos según grupo y periodo. Identificar los criterios de clasificación de los elementos químicos.
 Conocer las formas de clasificación de los elementos según grupo y periodo. Identificar los criterios de clasificación de los elementos químicos. Relacionar características de los átomos y su orden en
Conocer las formas de clasificación de los elementos según grupo y periodo. Identificar los criterios de clasificación de los elementos químicos. Relacionar características de los átomos y su orden en
TEMA 3 LA MATERIA Y SU ESTRUCTURA
 TEMA 3 LA MATERIA Y SU ESTRUCTURA 1. Clasificación de la materia (página 58) Def. Sistema material: Es una porción de materia seleccionada para su estudio. Def. Sustancia pura: Decimos que una sustancia
TEMA 3 LA MATERIA Y SU ESTRUCTURA 1. Clasificación de la materia (página 58) Def. Sistema material: Es una porción de materia seleccionada para su estudio. Def. Sustancia pura: Decimos que una sustancia
El átomo y las sustancias químicas
 El átomo y las sustancias químicas Conceptos previos En la naturaleza existen cargas eléctricas Si tienen el mismo signo se repelen, sin embargo se atraen si tienen signo distinto. Conceptos previos Las
El átomo y las sustancias químicas Conceptos previos En la naturaleza existen cargas eléctricas Si tienen el mismo signo se repelen, sin embargo se atraen si tienen signo distinto. Conceptos previos Las
 0. INTRODUCCIÓN Vamos a comenzar esta historia repasando algo que ya vimos el curso pasado: el átomo y los modelos atómicos. Como muchos no tendréis el libro, vamos a hacer dicho repaso de forma interactiva.
0. INTRODUCCIÓN Vamos a comenzar esta historia repasando algo que ya vimos el curso pasado: el átomo y los modelos atómicos. Como muchos no tendréis el libro, vamos a hacer dicho repaso de forma interactiva.
Elementos y compuestos químicos
 5 Elementos y compuestos químicos PARA EMPEZAR Esquema de contenidos Los elementos químicos Clasificación de los elementos La tabla periódica Bioelementos Oligoelementos Agrupación de elementos Moléculas
5 Elementos y compuestos químicos PARA EMPEZAR Esquema de contenidos Los elementos químicos Clasificación de los elementos La tabla periódica Bioelementos Oligoelementos Agrupación de elementos Moléculas
Tema 1 Átomos y Tabla Periódica
 Tema Átomos y Tabla Periódica Tres partículas subatómicas: el protón (carga +), el neutrón (carga = ) y el electrón (carga -) : son las partículas principales que afectan el comportamiento químico de los
Tema Átomos y Tabla Periódica Tres partículas subatómicas: el protón (carga +), el neutrón (carga = ) y el electrón (carga -) : son las partículas principales que afectan el comportamiento químico de los
Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2016/2017 FÍSICA Y QUÍMICA. UNIDAD 3 (parte 1): LAS SUSTANCIAS QUÍMICAS
 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2016/2017 1 FÍSICA Y QUÍMICA UNIDAD 3 (parte 1): LAS SUSTANCIAS QUÍMICAS Física y Química 3º Curso Educación Secundaria Obligatoria
Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2016/2017 1 FÍSICA Y QUÍMICA UNIDAD 3 (parte 1): LAS SUSTANCIAS QUÍMICAS Física y Química 3º Curso Educación Secundaria Obligatoria
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA 1. Atomos y partículas subatómicas La materia, sea el estado en el que se encuentre (sólido líquido gas) está constituida por partículas diminutas llamadas átomos. Actualmente,
ESTRUCTURA DE LA MATERIA 1. Atomos y partículas subatómicas La materia, sea el estado en el que se encuentre (sólido líquido gas) está constituida por partículas diminutas llamadas átomos. Actualmente,
ÁTOMOS Y RADIACTIVIDAD
 ÁTOMOS Y RADIACTIVIDAD 1 ATOMOS, MOLECULAS E IONES Atomo: Según Dalton un átomo se define como la cantidad básica de un elemento que puede intervenir en una combinación química. Los átomos están formados
ÁTOMOS Y RADIACTIVIDAD 1 ATOMOS, MOLECULAS E IONES Atomo: Según Dalton un átomo se define como la cantidad básica de un elemento que puede intervenir en una combinación química. Los átomos están formados
Electrónica SODIO CLORO NEÓN ARGÓN
 Capítulo 3: UNIONES QUÍMICAS Uniones químicas Los elementos que encontramos en la tabla periódica, en la naturaleza no se hallan aislados. Por qué? Porque buscan lograr la estabilidad, como la piedra que
Capítulo 3: UNIONES QUÍMICAS Uniones químicas Los elementos que encontramos en la tabla periódica, en la naturaleza no se hallan aislados. Por qué? Porque buscan lograr la estabilidad, como la piedra que
3 d 7 Siete electrones
 1 1. CONFIGURACIÓN ELECTRONICA: La forma en que los electrones están dispuestos en el átomo se denomina configuración electrónica. Esta se fundamenta en tres principios: Los electrones entran primero al
1 1. CONFIGURACIÓN ELECTRONICA: La forma en que los electrones están dispuestos en el átomo se denomina configuración electrónica. Esta se fundamenta en tres principios: Los electrones entran primero al
Ejercicios resueltos de 3º de E.S.O.
 Ejercicios resueltos de 3º de E.S.O. Estructura de la materia. Modelos atómicos Ejercicio resuelto nº 1 Si el número másico de un átomo es A = 30 y tiene 12 protones, calcula su número de neutrones. Resolución
Ejercicios resueltos de 3º de E.S.O. Estructura de la materia. Modelos atómicos Ejercicio resuelto nº 1 Si el número másico de un átomo es A = 30 y tiene 12 protones, calcula su número de neutrones. Resolución
TEMA 1. ELEMENTOS Y COMPUESTOS
 TEMA 1. ELEMENTOS Y COMPUESTOS 0. Índice 1. El átomo. Estructura atómica. Las partículas del átomo...2 1.1. Primer modelo atómico...2 1.2. Partículas subatómicas...2 1.3. Número atómico (Z) y número másico
TEMA 1. ELEMENTOS Y COMPUESTOS 0. Índice 1. El átomo. Estructura atómica. Las partículas del átomo...2 1.1. Primer modelo atómico...2 1.2. Partículas subatómicas...2 1.3. Número atómico (Z) y número másico
Un modelo atómico, por lo tanto consiste en representar de manera grafica, la dimensión atómica de la materia. El objetivo de estos modelos es que el
 Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Enlace iónico. Propiedades de los compuestos iónicos
 Enlace iónico Un ión no es más que un átomo o molécula que ha perdido su neutralidad eléctrica, debido a que ha perdido o ganado electrones de su capa externa El enlace iónico está presente en todos los
Enlace iónico Un ión no es más que un átomo o molécula que ha perdido su neutralidad eléctrica, debido a que ha perdido o ganado electrones de su capa externa El enlace iónico está presente en todos los
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS. Cuestiones de evaluación inicial. 2.- Cuántos protones y cuantos neutrones tiene el Carbono?
 UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
UNIDAD 10.- LAS UNIONES ENTRE ÁTOMOS Cuestiones de evaluación inicial 1.- Cuántos elementos químicos conoces? 2.- Cuántos protones y cuantos neutrones tiene el Carbono? 3.- Qué es el sistema periódico?
UNIDAD EDUCATIVA COLEGIO LAS COLINAS BARQUISIMETO
 CONTENIDOS Clasificación de las sustancias puras. Características de las sustancias compuestas. Características de las sustancias simples (elementos). Clasificación de los elementos. Disposición de los
CONTENIDOS Clasificación de las sustancias puras. Características de las sustancias compuestas. Características de las sustancias simples (elementos). Clasificación de los elementos. Disposición de los
QUÍMICA FUNDAMENTAL. Tabla Periódica
 QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
QUÍMICA FUNDAMENTAL Tabla Periódica 1 TEMAS DE ESTUDIO Construcción de la Tabla Periódica con base en la configuración electrónica Propiedades periódicas de los elementos 2 ANTECEDENTES HISTÓRICOS: ELEMENTOS
BIOLOGIA. Unidad 0.- Conceptos básicos de química para biología. - Los átomos constituyen la unidad más pequeña de la materia ( aprox cm).
 .- Conceptos básicos de química para biología. 1. Los átomos. - Los átomos constituyen la unidad más pequeña de la materia ( aprox. 10-8 cm). - Los átomos están formados por partículas sub-atómicas denominadas
.- Conceptos básicos de química para biología. 1. Los átomos. - Los átomos constituyen la unidad más pequeña de la materia ( aprox. 10-8 cm). - Los átomos están formados por partículas sub-atómicas denominadas
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS. TEMA 7 Pág. 155 libro nuevo
 PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
LA LA ESTRUCTURA DE LA MATERIA. 1.-Desarrollo histórico del concepto de átomo. Teoría de Demócrito. Teoría de Dalton. Componentes del átomo
 ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B
 Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B * Historia del Átomo: -El átomo en la antigüedad (pág. 3) -Leucipo y Demócrito (pág.4)
Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B * Historia del Átomo: -El átomo en la antigüedad (pág. 3) -Leucipo y Demócrito (pág.4)
ENLACES QUÍMICOS. Enlace iónico
 ENLACES QUÍMICOS De los aproximadamente 90 elementos químicos que se encuentran en la naturaleza sólo en unos pocos casos, los gases nobles, sus átomos constituyen entidades individuales. En los demás
ENLACES QUÍMICOS De los aproximadamente 90 elementos químicos que se encuentran en la naturaleza sólo en unos pocos casos, los gases nobles, sus átomos constituyen entidades individuales. En los demás
Metales Alcalinos. Propiedades periódicas. Propiedades periódicas
 Tabla periódica: es un rearreglo tabular de los elementos químicos. Ley periódica: las propiedades físicas como químicas de los elementos varían en forma periódica conforme aumenta la masa atómica. 1 Radios
Tabla periódica: es un rearreglo tabular de los elementos químicos. Ley periódica: las propiedades físicas como químicas de los elementos varían en forma periódica conforme aumenta la masa atómica. 1 Radios
TEMA 4: ESTRUCTURA DEL ÁTOMO IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA
 TEMA 4: ESTRUCTURA DEL ÁTOMO IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA 1. MATERIA DIVISIBLE O INDIVISIBLE El término átomo aparece en el siglo IV a.c. para designar a la porción indivisible más pequeña que
TEMA 4: ESTRUCTURA DEL ÁTOMO IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA 1. MATERIA DIVISIBLE O INDIVISIBLE El término átomo aparece en el siglo IV a.c. para designar a la porción indivisible más pequeña que
EL ENLACE QUÍMICO (FisQuiWeb)
 EL ENLACE QUÍMICO (FisQuiWeb) Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden a unirse y no permanecen
EL ENLACE QUÍMICO (FisQuiWeb) Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. Por qué los átomos tienden a unirse y no permanecen
