Catálisis Heterogénea
|
|
|
- José Miguel Ramírez Vega
- hace 6 años
- Vistas:
Transcripción
1 Universidad de los Andes Facultad de Ciencias Departamento de Química Catálisis Heterogénea Profesor Pedro J. Rodríguez S. 1
2 Estructuración de la materia Introducción Aplicaciones de los catalizadores Conceptos Teorías Catálisis Heterogénea Caracterización Fisicoquímica de catalizadores Importancia Preparación de los catalizadores 2
3 Caracterización Fisicoquímica de catalizadores Introducción Determinación de la Composición química. Procesos industriales y tecnológicos. Determinación de las estructura de los catalizadores heterogéneos. Estudio de las propiedades catalíticas de la superficie. Establecimiento de posibles mecanismos de formación de las fases presentes en un determinado sólido. Proposición de mecanismos de reacción por medio de técnicas de caracterización in situ. 42
4 Caracterización Fisicoquímica de catalizadores Composición Química EAA ICP EDX XPS RMNS Análisis Estructural DRX Análisis Textural ASE Vp y Dp Análisis de Acidez TPD-NH 3 TPD-Pyr FTIR Análisis Metálico QH Tp 2 QCO Análisis Morfológico MET MEB 44
5 XPSX-Ray Photoelectron Spectroscopy. ESCA Electron Spectrocopy for Chemical Analisis Espectroscopia de Fotoelectrones por Rayos X Una técnica de análisis superficial en catálisis heterogénea Cuales son las condiciones experimentales de análisis? En qué efecto se fundamenta? Que información nos provee la técnica? Aplicación de la técnica. La definición de superficie limpia. Una superficie limpia implica Ultra Alto Vacío. 45
6 La definición de superficie limpia Grado de Vacío Vacío Bajo Vacío medio Alto Vacío Ultra Alto Vacío Presión (Torr) Remover gases adsorvidos sobre la muestra. Eliminar contaminantes adsorbidos sobre la muestra. Incrementar IMFP para los electrones, iones y fotones. Bombas difusoras de trampa fría, bombas iónicas, bombas turbomoleculares y las criobombas 46
7 Una superficie limpia implica Ultra Alto Vacío (10-9 torr). Los rayos X penetran profundamente dentro de la muestra y estimulan la emisión de electrones a partir de los átomos contenidos en esta. 10 nm =100Å= 2 y 10 capas atómicas. XPS, técnica sensible a la superficie. λ(e C,Z) Es la distancia promedio (en nanómetros) que viaja un electrón con una energía dada entre colisiones inelásticas sucesivas λ monocapas El recorrido libre medio (IMFP) de un electrón depende de su energía cinética y es determinante en la obtención de información superficial 47
8 En que efecto se fundamenta? La Espectroscopia de Fotoelectrones por Rayos - X, se basa en el efecto fotoeléctrico, [1,2] y esta técnica fue desarrollada por Kai Siegbahn [3] y su grupo de investigación a mediados de 1960 en la Universidad de Uppsala, Suecia. [1] H. Hertz, Ann. Physik 31,983 (1887). [2] A. Einstein, Ann. Physik 17,132 (1905) Nobel Prize in Physics. [3] K. Siegbahn, Et. Al.,Nova Acta Regiae Soc.Sci., Ser. IV, Vol. 20 (1967). En 1981 recibio el Premio Nobel en Física por sus aportes en esta área. 48
9 En que efecto se fundamenta? Haz de Rayos - X La profundidad de penetración de los rayos - X es de ~1µm. Los electrones pueden ser excitados en todo este volumen 10 nm Muestra El área efectiva de excitación de los rayos-x es de ~1x1 cm 2. 49
10 En que efecto se fundamenta? E C = hν E B φ Esp Ecu. 1 Relación de Einstein Donde: E C Energía cinética E B Energía de enlace φ Esp Función Trabajo del Espectrómetro Las líneas de energía del fotoelectrón: Son dependientes de la energía del fotón. Las líneas de energía del electrón Auger: No son dependientes de la energía del fotón. Si el espectro XPS es presentado en energía cinética, es necesario conocer el tipo de fuente utilizada para obtener la data, de manera que se puedan comparar los estados químicos en la muestra con datos obtenidos con otra fuente. E B = hν E C φ Esp Ecu. 2 50
11 Haz de Rayos - X Que información nos provee la técnica? Fotoelectrón 2p 2s 1s Banda de Conducción Banda de Valencia L2,L3 L1 K Nivel del Electrón libre Las líneas espectrales del XPS estan en correspondencia con las capas de donde se extraen los electrones (1s, 2s, 2p, etc.). El electrón saliente posee una energía cinética igual a: E c =hv-e B -φ Seguido a este proceso el átomo podría relajarse a través de la emisión de un electrón Auger o un cuanto de energía hv Representación del Efecto Fotoeléctrico Si se determina la energía de los fotoelectrones expulsados podemos calcular su energía de enlace Los elementos de la cual esta hecha la muestra. La cantidad relativa de cada elemento. El estado químico de los elementos presentes 51
12 Que información nos provee la técnica? En un espectro de XPS, se mide la intensidad de los fotoelectrones como una función de su energía cinética (Ec) Espectro XPS de un catalizador modelo de Rh/Al 2 O 3 Espectro XPS típico 53
13 Picos Fotoelectrónicos Un Fotoelectrón Que información nos provee la técnica? Estructuras Primarias en el XPS Números Cuánticos momento orbital l (0,1,2,3,...indicados como s, p, d, f,...) momento total j = l + s nivel l 1=dos subniveles Spin Orbit Splitting Spin Orbit Doublet es determinado por la multiplicidad de los correspondientes niveles; igual a 2j + 1 momento de spin s s = +½ ó s = -½ Ejemplo: Pt 4f da dos picos de fotoemisión 4f 7 / 2 (con l = 3 y j = 3 + ½) 4f 5 / 2 (l = 3 y j = 3 - ½) 54
14 Que información nos provee la técnica? Por lo tanto, la proporción en intensidad de las componentes j = 7/2 y j = 5/2 del doblete 4f del Pt es 8:6 Mientras que la proporción de las componentes j= 5/2 y j=3/2 del doblete 4d es 6:4 Los picos obtenidos de los niveles del interior se muestran como dobletes pares; excepto para los niveles s, los cuales dan picos singletes. C 1s Espectros XPS Orbital=s l=0 s=+/-1/2 ls=1/2 Cu 2p 2p 1/2 2p 3/ Peak Area 1 : 2 Orbital=p l=1 s=+/-1/2 ls=1/2,3/2 3d 5/ Binding Energy (ev) Ag 3d 3d 3/2 6.0 Peak Area 2 : Binding Energy (ev) Orbital=d l=2 s=+/-1/2 ls=3/2,5/ Binding Energy (ev) Au 4f 3.65 Peak Area 3 : 4 4f 5/2 4f 7/2 Orbital=f l=3 s=+/-1/2 ls=5/2,7/ Binding Energy (ev) 55
15 Aplicación de la técnica Ti Metálico Ti en óxido 56
Espectroscopía de electrón Auger (AES)
 ESPECTROSCOPIAS Espectroscopía de electrón Auger (AES) Técnica superficial específica mediante emisión de electrones de baja energía en el proceso Auger. Determinación de composición de las capas superficiales
ESPECTROSCOPIAS Espectroscopía de electrón Auger (AES) Técnica superficial específica mediante emisión de electrones de baja energía en el proceso Auger. Determinación de composición de las capas superficiales
ÍNDICE Deshidratación de metanol Catalizadores híbridos empleados en la síntesis. directa de DME y problemática...
 ÍNDICE 1. INTRODUCCIÓN GENERAL.... 1 1.1. La catálisis: energía y sostenibilidad.... 2 1.2. Escenario actual y futuro de los sectores energético y petroquímico.... 3 1.3. Rutas catalíticas de conversión
ÍNDICE 1. INTRODUCCIÓN GENERAL.... 1 1.1. La catálisis: energía y sostenibilidad.... 2 1.2. Escenario actual y futuro de los sectores energético y petroquímico.... 3 1.3. Rutas catalíticas de conversión
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica
 Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Curso 2015-2016 Problema 1 La línea principal del espectro
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Curso 2015-2016 Problema 1 La línea principal del espectro
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS. Partícula Masa (g) Carga (Coulombs) Carga unitaria. Electrón
 MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica
 Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 3 de febrero de 205 Índice. Aproximación
Estados cuánticos para átomos polielectrónicos y espectroscopía atómica Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 3 de febrero de 205 Índice. Aproximación
Tabla de Contenido. Introducción 1
 Tabla de Contenido Introducción 1 1. Antecedentes 4 1.1. Resistividad del cobre en baja dimensionalidad................. 4 1.2. Crecimiento de óxido en superficies de cobre.................. 5 1.3. Tioles
Tabla de Contenido Introducción 1 1. Antecedentes 4 1.1. Resistividad del cobre en baja dimensionalidad................. 4 1.2. Crecimiento de óxido en superficies de cobre.................. 5 1.3. Tioles
N i,m e ( χ i,m. kt ) (4.1)
 4.3. Excitación térmica. Formula de Boltzmann # Intensidad de una línea depende de ( al menos en sentido cualitativo): Número de átomos del elemento en el estado de ionización correspondiente Número de
4.3. Excitación térmica. Formula de Boltzmann # Intensidad de una línea depende de ( al menos en sentido cualitativo): Número de átomos del elemento en el estado de ionización correspondiente Número de
INTERACCION DE LAS RADIACIONES ELECTROMAGNETICAS CON LA MATERIA
 NTERACCON DE LAS RADACONES ELECTROMAGNETCAS CON LA MATERA B.C. Paola Audicio Asistente de Radiofarmacia, CN Radiación ionizante: ionización del material atravesado M M + + e - excitación de las estructuras
NTERACCON DE LAS RADACONES ELECTROMAGNETCAS CON LA MATERA B.C. Paola Audicio Asistente de Radiofarmacia, CN Radiación ionizante: ionización del material atravesado M M + + e - excitación de las estructuras
Nombre de la asignatura: Química. Créditos: Aportación al perfil
 Nombre de la asignatura: Química Créditos: 2 2-4 Aportación al perfil Conoce la composición de los materiales usados en la fabricación de productos y su comportamiento con otros materiales. Aplica procedimientos,
Nombre de la asignatura: Química Créditos: 2 2-4 Aportación al perfil Conoce la composición de los materiales usados en la fabricación de productos y su comportamiento con otros materiales. Aplica procedimientos,
FÍSICA MODERNA. a) Explique las transformaciones energéticas en el proceso de fotoemisión y calcule la
 FÍSICA MODERNA 2001 1. Un haz de luz de longitud de onda 546 10-9 m incide en una célula fotoeléctrica de cátodo de cesio, cuyo trabajo de extracción es de 2 ev: a) Explique las transformaciones energéticas
FÍSICA MODERNA 2001 1. Un haz de luz de longitud de onda 546 10-9 m incide en una célula fotoeléctrica de cátodo de cesio, cuyo trabajo de extracción es de 2 ev: a) Explique las transformaciones energéticas
INTERACCIÓN DE LA RADIACIÓN IONIZANTE CON LA MATERIA.
 CAPÍTULO 2 INTERACCIÓN DE LA RADIACIÓN IONIZANTE CON LA MATERIA. La radiación ionizante es aquella capaz de excitar y ionizar átomos en la materia con que interactúa. Entre las radiaciones ionizantes tenemos
CAPÍTULO 2 INTERACCIÓN DE LA RADIACIÓN IONIZANTE CON LA MATERIA. La radiación ionizante es aquella capaz de excitar y ionizar átomos en la materia con que interactúa. Entre las radiaciones ionizantes tenemos
Thompson (1898) Rutherford (1911) Bohr (1913) Schrödinger (1926) NUMEROS CUANTICOS
 Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
TEMARIO DE QUÍMICA GLOBALES
 TEMARIO DE QUÍMICA GLOBALES Séptimo Básico Unidad 1: Conceptos de materia. Estados de la materia Propiedades de la materia: físicas y químicas Clasificación de la materia: sustancias puras (elementos y
TEMARIO DE QUÍMICA GLOBALES Séptimo Básico Unidad 1: Conceptos de materia. Estados de la materia Propiedades de la materia: físicas y químicas Clasificación de la materia: sustancias puras (elementos y
CARACTERIZACION QUÍMICA DE NANOSUPERFICIES. INTRODUCCION A LA ESPECTROSCPIA FOTOELECTRONICA DE RAYOS X (XPS)
 CARACTERIZACION QUÍMICA DE NANOSUPERFICIES. INTRODUCCION A LA ESPECTROSCPIA FOTOELECTRONICA DE RAYOS X (XPS) S. Feliu (Jr) Centro Nacional de Investigaciones Metalúrgicas (CENIM), CSIC, Avda. Gregorio
CARACTERIZACION QUÍMICA DE NANOSUPERFICIES. INTRODUCCION A LA ESPECTROSCPIA FOTOELECTRONICA DE RAYOS X (XPS) S. Feliu (Jr) Centro Nacional de Investigaciones Metalúrgicas (CENIM), CSIC, Avda. Gregorio
RADIACIÓN ELECTROMAGNÉTICA
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 1 RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL, 4 ed.; Ed. McGraw-Hill (1994), págs.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 1 RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL, 4 ed.; Ed. McGraw-Hill (1994), págs.
FíSICA MODERNA. Maestría en Ciencias (Materiales) Otoño 2013 Dra. Lilia Meza Montes Instituto de Física Luis Rivera Terrazas
 FíSICA MODERNA Maestría en Ciencias (Materiales) Otoño 2013 Dra. Lilia Meza Montes Instituto de Física Luis Rivera Terrazas Parte I. Introducción a la Mecánica Cuántica 1. Orígenes de las ideas cuánticas
FíSICA MODERNA Maestría en Ciencias (Materiales) Otoño 2013 Dra. Lilia Meza Montes Instituto de Física Luis Rivera Terrazas Parte I. Introducción a la Mecánica Cuántica 1. Orígenes de las ideas cuánticas
MODELOS ATOMICOS. Solución Å; Ultravioleta; 1106 m/s
 MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
QUIMICA CUANTICA. Trabajos Prácticos: Resolución de problemas Cálculos computacionales
 Contenidos Mínimos: Formalismos Matemáticos de Química Cuántica Métodos computacionales Formalismos mecano cuánticos. Tratamiento atómico y molecular Aplicaciones a moléculas sencillas. Trabajos Prácticos:
Contenidos Mínimos: Formalismos Matemáticos de Química Cuántica Métodos computacionales Formalismos mecano cuánticos. Tratamiento atómico y molecular Aplicaciones a moléculas sencillas. Trabajos Prácticos:
Unidad 1: Teoría Cuántica y Estructura Atómica. 1.2 Base experimental de la teoría cuántica
 Unidad 1: Teoría Cuántica y Estructura Atómica 1.2 Base experimental de la teoría cuántica Thompson Dalton Rutherford Demócrito Naturaleza eléctrica de la materia La naturaleza de la luz CUANTOS Descubrimiento
Unidad 1: Teoría Cuántica y Estructura Atómica 1.2 Base experimental de la teoría cuántica Thompson Dalton Rutherford Demócrito Naturaleza eléctrica de la materia La naturaleza de la luz CUANTOS Descubrimiento
Unidad 1: Materia, estructura y Periodicidad Base experimental de la teoría cuántica y estructura atómica.
 Unidad 1: Materia, estructura y Periodicidad 1.7. Base experimental de la teoría cuántica y estructura atómica. Modelo de Dalton En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia
Unidad 1: Materia, estructura y Periodicidad 1.7. Base experimental de la teoría cuántica y estructura atómica. Modelo de Dalton En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia
Superficies de metales-el modelo del Gel (Jellium)
 ESTRUCTURA ELECTRÓNICA DE SUPERFICIES En esta parte nos dedicaremos a la estructura electrónica de la superficie de un sólido. Nos concentraremos a la pregunta: Donde están los electrones? En término de
ESTRUCTURA ELECTRÓNICA DE SUPERFICIES En esta parte nos dedicaremos a la estructura electrónica de la superficie de un sólido. Nos concentraremos a la pregunta: Donde están los electrones? En término de
PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera
 Universidad Nacional Experimental del Táchira Departamento de Química San Cristóbal, Estado Táchira-Venezuela Soluciones. PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera 1. Calcule la molaridad de
Universidad Nacional Experimental del Táchira Departamento de Química San Cristóbal, Estado Táchira-Venezuela Soluciones. PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera 1. Calcule la molaridad de
Estructura de la materia
 Estructura de la materia Cuestiones y problemas 1. Si la energía de ionización del K gaseoso es de 418 kj.mol 1 : a) Calcule la energía mínima que ha de tener un fotón para poder ionizar un átomo de K.
Estructura de la materia Cuestiones y problemas 1. Si la energía de ionización del K gaseoso es de 418 kj.mol 1 : a) Calcule la energía mínima que ha de tener un fotón para poder ionizar un átomo de K.
ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO. Lola Castelao
 ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO DALTON: el átomo es indivisible. MODELOS ATÓMICOS THOMSON: el átomo es una especie de pudín, formado por una masa cargada positivamente, dentro del cual se
ESTRUCTURA DE LA MATERIA Y SISTEMA PERIÓDICO DALTON: el átomo es indivisible. MODELOS ATÓMICOS THOMSON: el átomo es una especie de pudín, formado por una masa cargada positivamente, dentro del cual se
d 2 MICROSCOPÍA ELECTRÓNICA DE BARRIDO 1. Poder de resolución
 MICROSCOPÍA ELECTRÓNICA DE BARRIDO 1. Poder de resolución Resolución es el espaciado más pequeño entre dos puntos que se pueden ver claramente como entidades separadas Poder de resolución = r = d 2 1 =
MICROSCOPÍA ELECTRÓNICA DE BARRIDO 1. Poder de resolución Resolución es el espaciado más pequeño entre dos puntos que se pueden ver claramente como entidades separadas Poder de resolución = r = d 2 1 =
TEMA 8: Espectroscopía Fotoelectrónica de rayos X (XPS)
 TEMA 8: Espectroscopía Fotoelectrónica de rayos X (XPS) 8.1 Descripción de la técnica. 8.2 Interacción de la radiación X sobre la materia. 8.3 Energía de enlace y ajuste químico. 8.4 Características de
TEMA 8: Espectroscopía Fotoelectrónica de rayos X (XPS) 8.1 Descripción de la técnica. 8.2 Interacción de la radiación X sobre la materia. 8.3 Energía de enlace y ajuste químico. 8.4 Características de
Laboratorio 1. Efecto fotoeléctrico
 Laboratorio 1 Efecto fotoeléctrico 1.1 Objetivos 1. Determinar la constante de Planck h 2. Determinar la dependencia del potencial de frenado respecto de la intensidad de la radiación incidente. 1.2 Preinforme
Laboratorio 1 Efecto fotoeléctrico 1.1 Objetivos 1. Determinar la constante de Planck h 2. Determinar la dependencia del potencial de frenado respecto de la intensidad de la radiación incidente. 1.2 Preinforme
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA
 QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013)
QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013)
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
ESTRUCTURA DE LA MATERIA 1. Naturaleza de la materia (el átomo). 2. Modelos atómicos clásicos. 3. Modelo mecánico cuántico. 4. Mecánica ondulatoria de Schrödinger. 5. Números cuánticos. 6. Orbitales atómicos.
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León.
 Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Calcula la energía de un mol de fotones de una radiación infrarroja de longitud de onda de 900 nm.
 Calcula la frecuencia y la longitud de onda de una onda electromagnética cuyos fotones tienen una energía de 7,9.10-19 J. A qué región del espectro electromagnético pertenece? Calcula la energía de un
Calcula la frecuencia y la longitud de onda de una onda electromagnética cuyos fotones tienen una energía de 7,9.10-19 J. A qué región del espectro electromagnético pertenece? Calcula la energía de un
Interacción de neutrones con la materia. Laura C. Damonte 2014
 Interacción de neutrones con la materia Laura C. Damonte 2014 Interacción de neutrones con la materia La interacción de los neutrones con la materia tiene interés tanto experimental y teórico como también
Interacción de neutrones con la materia Laura C. Damonte 2014 Interacción de neutrones con la materia La interacción de los neutrones con la materia tiene interés tanto experimental y teórico como también
XIII OLIMPIADA CHILENA DE FISICA 2005 Sociedad Chilena de Física
 XIII OLIMPIADA CHILENA DE FISICA 2005 Sociedad Chilena de Física PRUEBA EXPERIMENTAL A NOMBRE: RUT: CURSO: NUMERO TOTAL DE PAGINAS ESCRITAS: PUNTAJE TOTAL La constante de Planck de la física cuántica y
XIII OLIMPIADA CHILENA DE FISICA 2005 Sociedad Chilena de Física PRUEBA EXPERIMENTAL A NOMBRE: RUT: CURSO: NUMERO TOTAL DE PAGINAS ESCRITAS: PUNTAJE TOTAL La constante de Planck de la física cuántica y
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: El átomo y sus enlaces
 1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
1(9) Ejercicio nº 1 Calcula el número atómico y el número másico, así como el número de protones, neutrones y electrones de los siguientes aniones: 35 1 80 1 1 31 3 17 Cl ; Br ; O ; P 35 8 15 Ejercicio
Comportamiento Electrónico de los Materiales. Tema 2. Electrones en Sólidos. Teoría de Bandas de Energía.
 Comportamiento Electrónico de los Materiales Tema. Electrones en Sólidos. Teoría de Bandas de Energía. .1 Teoría de Bandas de Energía..1.1 Partículas en interacción con objetos múltiples. Molécula de Hidrógeno.
Comportamiento Electrónico de los Materiales Tema. Electrones en Sólidos. Teoría de Bandas de Energía. .1 Teoría de Bandas de Energía..1.1 Partículas en interacción con objetos múltiples. Molécula de Hidrógeno.
Tema 7.- Principios de fotoquímica
 Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Determinación de la constante de Rydberg
 Determinación de la constante de Rydberg Gustav Robert Kirchhoff (1824-1887) En termodinámica, la ley de Kirchhoff de la radiación térmica, es un teorema de carácter general que equipara la emisión y absorción
Determinación de la constante de Rydberg Gustav Robert Kirchhoff (1824-1887) En termodinámica, la ley de Kirchhoff de la radiación térmica, es un teorema de carácter general que equipara la emisión y absorción
Curso de Radiactividad y Medioambiente clase 4
 Curso de Radiactividad y Medioambiente clase 4 Departamento de Física, Facultad de Ciencias Exactas - UNLP Instituto de Física La Plata CONICET Calle 49 y 115 La Plata Interacción de la radiación con la
Curso de Radiactividad y Medioambiente clase 4 Departamento de Física, Facultad de Ciencias Exactas - UNLP Instituto de Física La Plata CONICET Calle 49 y 115 La Plata Interacción de la radiación con la
Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas
 Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas Objetivos: Recordar y actualizar los conocimientos sobre las características de electrones, protones y neutrones Describir la
Capítulo 1. Antecedentes de la Química Cuántica y primeras Teorías Atómicas Objetivos: Recordar y actualizar los conocimientos sobre las características de electrones, protones y neutrones Describir la
LOS RAYOS X FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI
 LOS RAYOS X FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI -Se propagan en línea recta. -Ionizan el aire.
LOS RAYOS X FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI FUNDAMENTOS FÍSICOS DE IMÁGENES DIAGNÓSTICAS - PILAR INFANTE L - FIACIBI -Se propagan en línea recta. -Ionizan el aire.
Fluorescencia de Rayos X. Química Analítica Inorgánica
 Fluorescencia de Rayos X Química Analítica Inorgánica LOS RAYOS X Wilhelm Conrad Röntgen Físico Aleman El 8 de noviembre de 1895 produjo y detectó la radiación eletromagnética (rango de los Rayos X o rayos
Fluorescencia de Rayos X Química Analítica Inorgánica LOS RAYOS X Wilhelm Conrad Röntgen Físico Aleman El 8 de noviembre de 1895 produjo y detectó la radiación eletromagnética (rango de los Rayos X o rayos
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
En el presente trabajo de investigación se hace referencia al trabajo. realizado por el grupo del Instituto de Ciencias de los Materiales de
 4. PROCEDIMIENTO EXPERIMENTAL En el presente trabajo de investigación se hace referencia al trabajo realizado por el grupo del Instituto de Ciencias de los Materiales de Sevilla quienes sintetizaron la
4. PROCEDIMIENTO EXPERIMENTAL En el presente trabajo de investigación se hace referencia al trabajo realizado por el grupo del Instituto de Ciencias de los Materiales de Sevilla quienes sintetizaron la
IEO-394 Semiconductores. Juan E. Martínez P. Docente. UdeA
 IEO-394 Semiconductores Juan E. Martínez P. Docente. UdeA Bandas de Energía Y Corrientes de Portadores en Semiconductores. PARTICION DE LOS NIVELES DE ENERGIA A medida que se traen juntos N átomos Cada
IEO-394 Semiconductores Juan E. Martínez P. Docente. UdeA Bandas de Energía Y Corrientes de Portadores en Semiconductores. PARTICION DE LOS NIVELES DE ENERGIA A medida que se traen juntos N átomos Cada
Química. Carrera: Ingeniería Civil CIC 0532
 1.-DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos: Química Ingeniería Civil CIC 0532 4 2 10 2.- HISTORIA DEL PROGRAMA Lugar y fecha
1.-DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos: Química Ingeniería Civil CIC 0532 4 2 10 2.- HISTORIA DEL PROGRAMA Lugar y fecha
PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA
 PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA CURSO 013 014 CONVOCATORIA: PROBLEMAS OPCIÓN A MATERIA: FÍSICA De las dos opciones propuestas, sólo hay que desarrollar
PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA CURSO 013 014 CONVOCATORIA: PROBLEMAS OPCIÓN A MATERIA: FÍSICA De las dos opciones propuestas, sólo hay que desarrollar
Ejercicios de Física cuántica y nuclear. PAU (PAEG)
 1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
Nombre de la asignatura: Química. Créditos: Aportación al perfil
 Nombre de la asignatura: Química Créditos: 4 2 6 Aportación al perfil Crear y transferir tecnología aplicando métodos y procedimientos en proyectos de ingeniería electrónica, tomando en cuenta el desarrollo
Nombre de la asignatura: Química Créditos: 4 2 6 Aportación al perfil Crear y transferir tecnología aplicando métodos y procedimientos en proyectos de ingeniería electrónica, tomando en cuenta el desarrollo
PLAN DE EVALUACIÓN 2015
 PLAN DE EVALUACIÓN 2015 Año: 2015 Período: I Semestre Sub-sector: Química Nivel: NM1 Curso: I Medio Profesor: Alejandra Sotomaor A. Aprendizajes Esperados Indicadores Aprendizajes Evaluados Procedimientos
PLAN DE EVALUACIÓN 2015 Año: 2015 Período: I Semestre Sub-sector: Química Nivel: NM1 Curso: I Medio Profesor: Alejandra Sotomaor A. Aprendizajes Esperados Indicadores Aprendizajes Evaluados Procedimientos
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS.
 ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Estructura de la materia y Sistema Periódico
 Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
M8: Solid State Lasers (SSL) and their Applications Pulse Laser Deposition
 FIRST ICO-ICTP-TWAS Central American Workshop in Lasers, Laser Applications and laser Safety Regulations M8: Solid State Lasers (SSL) and their Applications Pulse Laser Deposition Prof. Luis V. Ponce CICATA
FIRST ICO-ICTP-TWAS Central American Workshop in Lasers, Laser Applications and laser Safety Regulations M8: Solid State Lasers (SSL) and their Applications Pulse Laser Deposition Prof. Luis V. Ponce CICATA
INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3.
 El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
TEMA 5: INTROD. AL ESTADO SÓLIDO
 5.3 Electrones libres en metales: modelo de Drude Se pretende explicar las propiedades de los metales a partir de diferentes modelos (5.3: Drude y 5.4: bandas) Propiedades de los metales: Todos, excepto
5.3 Electrones libres en metales: modelo de Drude Se pretende explicar las propiedades de los metales a partir de diferentes modelos (5.3: Drude y 5.4: bandas) Propiedades de los metales: Todos, excepto
DEPARTAMENTO DE QUÍMICA SERIE DE EJERCICIOS. Tema 1: Estructura Atómica Semestre
 DEPARTAMENTO DE QUÍMICA SERIE DE EJERCICIOS (Basada en reactivos de exámenes colegiados) Tema 1: Estructura Atómica Semestre 2017-2 Experimento de Thomson 1. En un experimento como el de Thomson, un haz
DEPARTAMENTO DE QUÍMICA SERIE DE EJERCICIOS (Basada en reactivos de exámenes colegiados) Tema 1: Estructura Atómica Semestre 2017-2 Experimento de Thomson 1. En un experimento como el de Thomson, un haz
Estudia la velocidad a la que ocurren las reacciones químicas
 www.clasesalacarta.com Cinética Química Estudia la velocidad a la que ocurren las reacciones químicas Termodinámica Es espontánea? Cinética A qué velocidad ocurre la reacción? Velocidad de una Reacción
www.clasesalacarta.com Cinética Química Estudia la velocidad a la que ocurren las reacciones químicas Termodinámica Es espontánea? Cinética A qué velocidad ocurre la reacción? Velocidad de una Reacción
Solución de los problemas del Capítulo 1
 Nota: los valores de las constantes que puede necesitar para los cálculos están dados en la bibliografía de referencia. Complete la siguiente tabla Qué información mínima se necesita para caracterizar
Nota: los valores de las constantes que puede necesitar para los cálculos están dados en la bibliografía de referencia. Complete la siguiente tabla Qué información mínima se necesita para caracterizar
Química Inorgánica Bloque d 1. BLOQUE d
 Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Química Inorgánica Bloque d 1 BLOQUE d Los elementos del bloque d están ubicados entre los grupos 2 y 13 de la tabla periódica y se los suele llamar metales de transición. elemento de transición: es un
Diapositiva 1 PRINCIPIOS DE LA ENERGÍA FOTOVOLTAICA. Radiación solar. Radiación electromagnética emitida por el el Sol. Espectro. Prof. J.G.
 Diapositiva 1 Radiación solar Radiación electromagnética emitida por el el Sol Espectro Diapositiva 2 Radiación luminosa Parte Parte de de la la radiación electromagnética emitida emitida por por el el
Diapositiva 1 Radiación solar Radiación electromagnética emitida por el el Sol Espectro Diapositiva 2 Radiación luminosa Parte Parte de de la la radiación electromagnética emitida emitida por por el el
FIZ Física Contemporánea
 FIZ1111 - Física Contemporánea Interrogación N o 3 17 de Junio de 2008, 18 a 20 hs Nombre completo: hrulefill Sección: centering Buenas Malas Blancas Nota Table 1. Instrucciones - Marque con X el casillero
FIZ1111 - Física Contemporánea Interrogación N o 3 17 de Junio de 2008, 18 a 20 hs Nombre completo: hrulefill Sección: centering Buenas Malas Blancas Nota Table 1. Instrucciones - Marque con X el casillero
Química inorgánica. Carrera: IAF Participantes. Representantes de las academias de Ingeniería Ambiental. Academia de Ingeniería
 1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Química inorgánica Ingeniería Ambiental IAF - 0427 4-2-10 2.- HISTORIA DEL PROGRAMA
1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Química inorgánica Ingeniería Ambiental IAF - 0427 4-2-10 2.- HISTORIA DEL PROGRAMA
Implementación de un sistema básico para Espectroscopia de gases atómicos ABSTRACT KEY WORDS RESUMEN
 Implementación de un sistema básico para Espectroscopia de gases atómicos Heriberto Peña Pedraza Facultad de Ciencias Básicas. Departamento de Física Universidad de Pamplona Grupo de Investigaciones Ópticas
Implementación de un sistema básico para Espectroscopia de gases atómicos Heriberto Peña Pedraza Facultad de Ciencias Básicas. Departamento de Física Universidad de Pamplona Grupo de Investigaciones Ópticas
ESTRUCTURA ATÓMICA. SISTEMA PERIÓDICO Y ENLACE QUÍMICO
 1.- Un átomo A tiene como configuración electrónica: 1s 2 2s 2 2p 6 3s 2 3p 6 5s 1. a) Cuáles son los números cuánticos de su electrón más externo? b) Justifica la veracidad o falsedad de las siguientes
1.- Un átomo A tiene como configuración electrónica: 1s 2 2s 2 2p 6 3s 2 3p 6 5s 1. a) Cuáles son los números cuánticos de su electrón más externo? b) Justifica la veracidad o falsedad de las siguientes
CENTRO DE ESTUDIOS MIRASIERRA
 El ÁTOMO TEORÏAS ATÓMICAS1 Ya hemos visto el modelo atómico de Dalton, que decía que la materia estaba formada por partículas indivisibles llamadas átomos. Actualmente, se sabe que los átomos si son divisibles
El ÁTOMO TEORÏAS ATÓMICAS1 Ya hemos visto el modelo atómico de Dalton, que decía que la materia estaba formada por partículas indivisibles llamadas átomos. Actualmente, se sabe que los átomos si son divisibles
EL ÁTOMO CONTENIDOS. ANTECEDENTES HISTÓRICOS. ( ) MODELOS ATÓMICOS. RAYOS CATÓDICOS. MODELO DE THOMSON.
 EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
Física moderna. José Mariano Lucena Cruz Física 2 o Bachillerato
 José Mariano Lucena Cruz chenalc@gmail.com Física 2 o Bachillerato Radiación térmica Todo cuerpo, no importa a la temperatura que se encuentre, es fuente de radiación térmica. (Emite energía en forma de
José Mariano Lucena Cruz chenalc@gmail.com Física 2 o Bachillerato Radiación térmica Todo cuerpo, no importa a la temperatura que se encuentre, es fuente de radiación térmica. (Emite energía en forma de
Más tarde Millikam calcula la relación caraga masa del electrón con su famoso experimento de la gota de aceite.
 TEMA 1: ESTRUCTURA ATÓMICA. 1.- Primeros modelos atómicos: La primera vez que se habla de átomos es en la antiguaa Grecia, en el siglo V a.c. donde se dice que la materia puede dividirse hasta un determinado
TEMA 1: ESTRUCTURA ATÓMICA. 1.- Primeros modelos atómicos: La primera vez que se habla de átomos es en la antiguaa Grecia, en el siglo V a.c. donde se dice que la materia puede dividirse hasta un determinado
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS
 Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1. Para el isótopo del elemento con Z = 36 y número másico 84 indique: (a) su número de protones; (b) su
Problemas de Química (1ero Grado de Química). Tema 2. ESTRUCTURA ATÓMICA Y PROPIEDADES PERIÓDICAS 1. Para el isótopo del elemento con Z = 36 y número másico 84 indique: (a) su número de protones; (b) su
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Problemas. Cuestiones. Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA. Nombre: [2 PUNTOS /UNO]
![Problemas. Cuestiones. Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA. Nombre: [2 PUNTOS /UNO] Problemas. Cuestiones. Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA. Nombre: [2 PUNTOS /UNO]](/thumbs/49/25535199.jpg) Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA Problemas Nombre: [2 PUNTOS /UNO] 1. Al iluminar una célula fotoeléctrica con radiación electromagnética de longitud de onda 185
Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA Problemas Nombre: [2 PUNTOS /UNO] 1. Al iluminar una célula fotoeléctrica con radiación electromagnética de longitud de onda 185
Pontificia Universidad Católica del Ecuador
 Pontificia Universidad Católica del Ecuador Escuela de Ciencias Químicas 1.- DATOS INFORMATIVOS: MATERIA: Química General I (Teoría y Laboratorio) CODIGO: 12793 CARRERA: Ciencias Químicas, mención Química
Pontificia Universidad Católica del Ecuador Escuela de Ciencias Químicas 1.- DATOS INFORMATIVOS: MATERIA: Química General I (Teoría y Laboratorio) CODIGO: 12793 CARRERA: Ciencias Químicas, mención Química
Tema 12: EL NACIMIENTO DE LA MECÁNICA CUÁNTICA.
 º BACHILLERATO FÍSICA Parte V: INTRODUCCIÓN A LA FÍSICA MODERNA. Tema : EL NACIMIENTO DE LA MECÁNICA CUÁNTICA... La radiación del cuerpo negro... Efectos fotoeléctrico y Compton..3. Espectros y modelos
º BACHILLERATO FÍSICA Parte V: INTRODUCCIÓN A LA FÍSICA MODERNA. Tema : EL NACIMIENTO DE LA MECÁNICA CUÁNTICA... La radiación del cuerpo negro... Efectos fotoeléctrico y Compton..3. Espectros y modelos
Masterclass Aceleradores de partículas
 Unidad de Divulgación Científica del Centro Nacional de Aceleradores (CNA) Masterclass Aceleradores de partículas 1. Técnicas experimentales empleadas en el CNA 2. Ley de decaimiento radiactivo y su aplicación
Unidad de Divulgación Científica del Centro Nacional de Aceleradores (CNA) Masterclass Aceleradores de partículas 1. Técnicas experimentales empleadas en el CNA 2. Ley de decaimiento radiactivo y su aplicación
EJERCICIOS DE REPASO DEL TEMA 3
 EJERCICIOS DE REPASO DEL TEMA 3 1.- Los números atómicos de los elementos A, B y C son respectivamente, Z, Z+1 y Z+2. Se sabe que B es el gas noble del tercer período. Indica: En qué grupos de la tabla
EJERCICIOS DE REPASO DEL TEMA 3 1.- Los números atómicos de los elementos A, B y C son respectivamente, Z, Z+1 y Z+2. Se sabe que B es el gas noble del tercer período. Indica: En qué grupos de la tabla
INTRODUCCIÓN A LOS METALES DE TRANSICIÓN QUÍMICA INORGÁNICA AVANZADA
 INTRODUCCIÓN A LOS METALES DE TRANSICIÓN QUÍMICA INORGÁNICA AVANZADA Los elementos de transición. Bloque d: elementos situados entre los bloque s y p. Tienen ocupados, en su estado fundamental, los niveles
INTRODUCCIÓN A LOS METALES DE TRANSICIÓN QUÍMICA INORGÁNICA AVANZADA Los elementos de transición. Bloque d: elementos situados entre los bloque s y p. Tienen ocupados, en su estado fundamental, los niveles
Física P.A.U. FÍSICA MODERNA 1 FÍSICA MODERNA
 Física P.A.U. FÍSICA MODERNA FÍSICA MODERNA PROBLEMAS MECÁNICA CUÁNTICA.. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 5 nm, el potencial de frenado para los electrones
Física P.A.U. FÍSICA MODERNA FÍSICA MODERNA PROBLEMAS MECÁNICA CUÁNTICA.. En una célula fotoeléctrica, el cátodo metálico se ilumina con una radiación de λ = 5 nm, el potencial de frenado para los electrones
Puntos de ebullición.
 1.-Indica el tipo de enlace de los siguientes hidruros. Ayundándote de la siguiente tabla comenta la polaridad de los enlaces. Hidruro % carácter iónico HF 43 HCl 17 HBr 11 HI 6 Representa gráficamente
1.-Indica el tipo de enlace de los siguientes hidruros. Ayundándote de la siguiente tabla comenta la polaridad de los enlaces. Hidruro % carácter iónico HF 43 HCl 17 HBr 11 HI 6 Representa gráficamente
Universidad Central del Este U C E Facultad de Ciencias de las Ingenierías y Recursos Naturales Escuela de Ingeniería Industrial
 Universidad Central del Este U C E Facultad de Ciencias de las Ingenierías y Recursos Naturales Escuela de Ingeniería Industrial Programa de la asignatura: (QUI-011) Química General Total de Créditos:
Universidad Central del Este U C E Facultad de Ciencias de las Ingenierías y Recursos Naturales Escuela de Ingeniería Industrial Programa de la asignatura: (QUI-011) Química General Total de Créditos:
El Modelo Moderno y resultados de nuestro interés
 CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
EL MODELO ATOMICO DE BOHR
 EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
Espectros de emisión y absorción.
 Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Estructura del Átomo Química Cuántica
 Estructura del Átomo Química Cuántica Anécdota del gato de Scrödinger http://www.youtube.com/watch?v=jc9a_e5kg7y Descripción de fenómenos no observables en términos probabilísticos Finales siglo XIX, todo
Estructura del Átomo Química Cuántica Anécdota del gato de Scrödinger http://www.youtube.com/watch?v=jc9a_e5kg7y Descripción de fenómenos no observables en términos probabilísticos Finales siglo XIX, todo
I.E. SEMINARIO MENOR DIOCESANO CONFIGURACIÓN. Configuración ELECTRÓNICA. electrónica. Esp. HARRISON MELENDEZ TARAZONA
 I.E. SEMINARIO MENOR DIOCESANO CONFIGURACIÓN Configuración ELECTRÓNICA electrónica Docente : Esp. HARRISON MELENDEZ TARAZONA APRENDIZAJE ESPERADO : Utiliza el diagrama de MOELLER para determinar la configuración
I.E. SEMINARIO MENOR DIOCESANO CONFIGURACIÓN Configuración ELECTRÓNICA electrónica Docente : Esp. HARRISON MELENDEZ TARAZONA APRENDIZAJE ESPERADO : Utiliza el diagrama de MOELLER para determinar la configuración
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
FÍSICA CUÁNTICA. máx = 2, mk/ T
 FÍSICA CUÁNTICA A finales del siglo XIX, la física clásica, con sus leyes de la mecánica de Newton y la teoría electromagnética de Maxwell, parecía suficiente para explicar todos los fenómenos naturales.
FÍSICA CUÁNTICA A finales del siglo XIX, la física clásica, con sus leyes de la mecánica de Newton y la teoría electromagnética de Maxwell, parecía suficiente para explicar todos los fenómenos naturales.
Unidad 1 Estructura atómica de la materia. Teoría cuántica
 Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
- Marie Curie. - Joseph Thomson. - Ernest Rutherford. - Max Planck. - Albert Einstein. - Niels Bohr. - Louis de Broglie. - Werner Heisenberg
 - Marie Curie - Joseph Thomson - Ernest Rutherford - Max Planck - Albert Einstein - Niels Bohr - Louis de Broglie - Werner Heisenberg - Wolfgang Pauli - Arnorld Sommerfeld Autores (Orden Alfabético): Celia
- Marie Curie - Joseph Thomson - Ernest Rutherford - Max Planck - Albert Einstein - Niels Bohr - Louis de Broglie - Werner Heisenberg - Wolfgang Pauli - Arnorld Sommerfeld Autores (Orden Alfabético): Celia
ESTADOS DE LA MATERIA. Según su tipo de enlace: Pueden ser covalentes, iónicos y metálicos
 SEMICONDUCTORES ESTADOS DE LA MATERIA Según su tipo de enlace: Pueden ser covalentes, iónicos y metálicos Sólidos covalentes.- Caracterizados porque los átomos están unidos por medio de enlaces direccionales
SEMICONDUCTORES ESTADOS DE LA MATERIA Según su tipo de enlace: Pueden ser covalentes, iónicos y metálicos Sólidos covalentes.- Caracterizados porque los átomos están unidos por medio de enlaces direccionales
A-PDF Manual Split Demo. Purchase from to remove the watermark = -2, J
 APDF Manual Split Demo. Purchase from www.apdf.com to remove the watermark ESTRUCTURA DE LA MATERIA 0 5 j Actividades. La longitud de onda de un fotón de luz roja es 6,5 0 7 m. Calcula su frecuencia y
APDF Manual Split Demo. Purchase from www.apdf.com to remove the watermark ESTRUCTURA DE LA MATERIA 0 5 j Actividades. La longitud de onda de un fotón de luz roja es 6,5 0 7 m. Calcula su frecuencia y
Efecto Fotoeléctrico
 Universidad Nacional Autónoma de Honduras Facultad de Ciencias Escuela de Física Elaborado por: Ing Francisco Solórzano Efecto Fotoeléctrico I INTRODUCCIÓN El efecto fotoeléctrico fue descubierto en 1886
Universidad Nacional Autónoma de Honduras Facultad de Ciencias Escuela de Física Elaborado por: Ing Francisco Solórzano Efecto Fotoeléctrico I INTRODUCCIÓN El efecto fotoeléctrico fue descubierto en 1886
Capacidad de combinación. Capacidad de combinación La última capa de electrones de un átomo, se le conoce como capa de electrones de valencia
 Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
Capacidad de combinación Para los elementos representativos, se define que el número de electrones de valencia de un elemento es igual al de la familia a la que pertenece Y está relacionado a la manera
Representa la cantidad de reactivo que desaparece por unidad de tiempo, o la cantidad de producto que aparece por unidad de tiempo.
 TEMA 5: CINÉTICA QUÍMICA. 1.- Velocidad de las reacciones químicas. Representa la cantidad de reactivo que desaparece por unidad de tiempo, o la cantidad de producto que aparece por unidad de tiempo. En
TEMA 5: CINÉTICA QUÍMICA. 1.- Velocidad de las reacciones químicas. Representa la cantidad de reactivo que desaparece por unidad de tiempo, o la cantidad de producto que aparece por unidad de tiempo. En
PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA
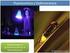 PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA Objetivos. La práctica se divide en dos partes. En la primera, se registran los espectros de absorción, fluorescencia y excitación de un conjunto de colorantes
PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA Objetivos. La práctica se divide en dos partes. En la primera, se registran los espectros de absorción, fluorescencia y excitación de un conjunto de colorantes
Química I. Contenido. Bloque I Reconoces a la Química como una herramienta para la vida 2
 Contenido Bloque I Reconoces a la Química como una herramienta para la vida 2 Sesión A. Qué es la Química? 5 Qué es la Química? 5 La Química en nuestro mundo cotidiano 6 Sesión B. Desarrollo histórico
Contenido Bloque I Reconoces a la Química como una herramienta para la vida 2 Sesión A. Qué es la Química? 5 Qué es la Química? 5 La Química en nuestro mundo cotidiano 6 Sesión B. Desarrollo histórico
ESTRUCTURA DE LA MATERIA 3
 ESTRUCTURA DE LA MATERIA 3 SISTEMA PERIÓDICO Mendeleiev (columnas) y Meyer (filas) clasificaron periodicamente los elementos basandose 1º) colocar los elementos por orden creciente de sus masa atómicas
ESTRUCTURA DE LA MATERIA 3 SISTEMA PERIÓDICO Mendeleiev (columnas) y Meyer (filas) clasificaron periodicamente los elementos basandose 1º) colocar los elementos por orden creciente de sus masa atómicas
