TEMA 8 ESTRUCTURA CRISTALINA
|
|
|
- Francisco Javier Venegas Salazar
- hace 8 años
- Vistas:
Transcripción
1 Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan de manera aleatoria (Ejemplo: el vidrio) 1b. Sólidos cristalinos: Están constituidos por una ordenación tridimensional de unidades (átomos o moléculas) muy bien definida, formando cristales. 2.- Por su composición y enlace: 1a. Sólidos moleculares: están formados por moléculas 1b. Sólidos covalentes no moleculares: Con enlaces localizados (diamante, SiO 2 ) Con enlaces deslocalizados (metales) 1c. Sólidos Iónicos (NaCl) CELDILLA UNIDAD Parte del cristal que reproduce el cristal completo por repetición de la misma mediante traslaciones. Aunque no hay una única celdilla unidad posible, se suele elegir la que sea más simple y represente mejor la simetría del cristal. Por ejemplo en la estructura del NaCl vemos que la celdilla de la figura izquierda contiene un eje de simetría C 4 y 4 ejes C 2 que no están contenidos en la celdilla unidad (más pequeña) propuesta en la figura de la derecha. Por lo tanto es mejor elegir la celdilla de la izquierda.
2 2 Tema 8. Estructura cristalina ESTRUCTURA CRISTALINA MEDIANTE EMPAQUETAMIENTO DE ESFERAS La estructura cristalina describe la ordenación de átomos o moléculas en un cristal. La estructura de muchos sólidos se puede describir considerando que proceden de empaquetar (o, lo que es lo mismo, colocar lo más próximas posible) esferas. Estas esferas representan a los átomos, iones o moléculas sencillas, que forman la estructura del sólido. Es un sistema muy sencillo que da resultados razonablemente buenos. El ejemplo más simple es la representación de la estructura de los metales: - Están formados por un solo tipo de átomos, de manera que se pueden considerar esferas del mismo tamaño. - Sus enlaces no son direccionales, por lo que los átomos tenderán a rodearse del mayor número de átomos (índice de coordinación IC de 12 por geometría de esferas es el máximo posible). La estructura del metal, por tanto, es el resultado de empaquetar esferas del mismo tamaño de la forma más compacta posible, por lo tanto con IC de 12. Empaquetamiento de esferas en una dimensión: Empaquetamiento de esferas en dos dimensiones. Índice de coordinación 4 (Figura izquierda) y 6 (Figura derecha). El de la derecha es compacto porque tiene el hueco mínimo; por geometría, una esfera puede estar rodeada como máximo de 6 esferas iguales en un mismo plano (todas en contacto entre sí). IC = 4 NO COMPACTO IC = 6 COMPACTO
3 Tema 8. Estructura cristalina 3 Empaquetamiento de esferas en tres dimensiones. Para estudiar el empaquetamiento hemos de fijarnos en el centro de las esferas. Cualquiera de las dos posibilidades descritas en el empaquetamiento en dos dimensiones puede ponerse como AA (dos capas superpuestas) o como AB (dos capas no superpuestas) cuando pasamos a tres dimensiones. CASOS CON EMPAQUETAMIENTO DE TIPO AA: - Dos capas con IC = 4 superpuestas (AA): empaquetamiento cúbico simple o primitivo (un hueco central cúbico): IC 6. Es una celdilla de tipo P (primitiva). - Dos capas con IC = 6 superpuestas (AA): empaquetamiento hexagonal simple (no compacto con huecos en forma de prisma trigonal): IC 8 CASOS CON EMPAQUETAMIENTO DE TIPO AB: - Dos capas con IC = 4 no superpuestas (AB): Empaquetamiento Cúbico Centrado en el Cuerpo (acrónimo cc): IC 8. Se denomina celdilla de tipo I.
4 4 Tema 8. Estructura cristalina - Dos capas con IC = 6 no superpuestas (AB): Empaquetamiento Hexagonal Compacto (acrónimo ehc). Se trata de un empaquetamiento compacto al tener el mínimo hueco y un IC de 12. Partimos de una capa A compacta (IC = 6) y la segunda capa (B) se dispone sobre los huecos de la primera capa (A). La tercera capa se coloca sobre los huecos de la segunda capa de manera que coincida sobre la primera. La celdilla unidad de esta disposición ABAB es hexagonal. huecos sin ocupar La celdilla en la misma dirección que empaquetamiento: IC Tres capas compactas con IC = 6 no superpuestas (ABC): Empaquetamiento Cúbico Compacto o cúbico centrado en las caras (acrónimo: ecc o ccc; una capa tapa unos huecos y la siguiente los otros): IC 12 como corresponde a un empaquetamiento compacto de esferas iguales.
5 Tema 8. Estructura cristalina 5 En el siguiente figura se resumen los tipos de empaquetamientos tridimensionales a partir de empaquetamientos bidimensionales de esferas (no compacto IC =4 en un primer caso, compacto IC = 6 en el segundo caso), así como las celdillas unidad de cada uno de ellos. En esta figura se usan los acrónimos en inglés: Simple cubic (sc), body centered cubic (bcc).
6 6 Tema 8. Estructura cristalina En esta figura se usan los acrónimos en inglés: Simple Hexagonal (sh), Hexagonal Close Packing (hcp) y Cubic Close Packing (ccp). Parámetros de la Celdilla Unidad de Empaquetamientos de Esferas. Número de átomos por celda unidad: Dado que la celdilla no está aislada, deben diferenciarse aquellos átomos que pertenecen solamente a una determinada celda de los que se comparten con las celdas vecinas.
7 Tema 8. Estructura cristalina 7 Número de coordinación: Es el número de vecinos más próximos que rodean 1 a un determinado átomo en una estructura. Para los empaquetamientos cúbico centrado en las caras (compacto) y hexagonal compacto el IC es 12. Cúbica simple: 6 CCCuerpo: 8 C compacto: 12 Factor de ocupación el espacio: es la fracción del espacio disponible de la celdilla unidad que está ocupada por los átomos contenidos en la misma suponiendo que cada átomo sea una esfera rígida de radio r. El % de ocupación se define como: % ocupación = [(V esfera x N) / V cubo ] x 100 (N = nº de esferas pertenecen exclusivamente a la celdilla) La relación entre el radio de una esfera (r) y la longitud de la arista del cubo (a) de los átomos de distintas redes cúbicas viene dada en la siguiente figura: Con esta expresión, se puede calcular fácilmente la eficiencia de los diferentes empaquetamientos. Los resultados aparecen en la siguiente tabla. 1 Siempre se trata de esferas en contacto. Por comodidad las esferas se suelen representar como puntos o esferas muy pequeñas por lo que se pierde este dato que no hay que olvidar.
8 8 Tema 8. Estructura cristalina EMPAQUETAMIENTO IC Nº ATOMOS/CELDILLA ESPACIO VACÍO Hexagonal compacto % Cúbico compacto % Cúbico centrado en el cuerpo % Cúbico primitivo % Para una estructura compacta, la porción de espacio no ocupada, es decir, la cantidad de espacio libre por huecos, es el 26 % del total. Huecos en empaquetamientos compactos: localización, nº y tamaño. Una de las características de los empaquetamientos es el tipo de huecos (espacio sin ocupar) que se genera entre las esferas. Frecuentemente se contemplan los sólidos iónicos o las aleaciones como estructuras de esferas de empaquetamiento compacto, situándose el ión más pequeño en los huecos de este ordenamiento. Estos huecos en empaquetamientos compactos pueden ser octaédricos o tetraédricos: Un hueco octaédrico es el espacio sin ocupar en el centro de seis esferas que forman un octaedro, por lo que presenta simetría octaédrica. Cada hueco se sitúa entre dos triángulos
9 Tema 8. Estructura cristalina 9 formados por esferas, opuestos y pertenecientes a capas adyacentes. En una estructura compacta de N átomos existen N huecos octaédricos, como demostraremos posteriormente. Un hueco tetraédrico es el espacio sin ocupar en el centro de cuatro esferas que forman un tetraedro, por lo que presenta simetría tetraédrica. Cada hueco se forma cuando sobre un triángulo de esferas de una capa se coloca otra esfera de la capa contigua, formando un tetraedro que puede apuntar hacia arriba o hacia abajo. Existen dos tipos de huecos tetraédricos, dependiendo de que el vértice del mismo está orientado hacia arriba o hacia abajo. En un empaquetamiento compacto con N átomos existen N huecos de cada tipo, para dar un total de 2N huecos tetraédricos, como demostraremos posteriormente. Importante: Un cristal con N átomos contiene N huecos octaédricos y 2N huecos tetraédricos. Localización de los huecos: Siempre se sitúan entre dos capas de esferas adyacentes, pero la distancia a cada una de las capas depende del tipo de hueco. Octaédricos: Se sitúan donde no hay esferas en las dos capas A y B. Si se representa una vista lateral del empaquetamiento, los huecos Oh se sitúan exactamente en el centro de las dos capas. En un empaquetamiento cúbico compacto están en el centro de arista y en el centro del cubo. En un empaquetamiento hexagonal compacto no están ni encima ni debajo de cada esfera. Ver figuras siguientes. Tetraédricos: Se sitúan debajo o encima de cada esfera, por lo tanto donde hay una esfera hay un hueco Td. Como se puede observar en la representación de la vista lateral, encima de cada esfera de la capa inferior hay un hueco Td que está más cerca de la capa B que de la A. Debajo de cada esfera de la capa superior hay un hueco Td que se sitúa más cerca de la capa inferior. Como cada esfera tiene encima o debajo un hueco tetraédrico hay, por cada N esferas, 2N huecos tetraédricos. -En un empaquetamiento cúbico compacto están en el centro de cada uno de los 8 cubos en que se divide la celdilla unidad (uno por vértice: es el centro del tetraedro formado por el vértice y las esferas de las tres caras de ese vértice). -En un empaquetamiento hexagonal compacto están encima y debajo de cada esfera.
10 10 Tema 8. Estructura cristalina Bola azul: átomo. Bola verde: hueco octaédrico. Bola roja: hueco tetraédrico.
11 Tema 8. Estructura cristalina 11 a) Huecos tetraédricos en empaquetamiento cúbico compacto b) Huecos octaédricos en empaquetamiento cúbico compacto c) Huecos octaédricos en empaquetamiento hexagonal compacto d) Huecos tetraédricos en empaquetamiento hexagonal compacto e) Huecos tetraédricos en empaquetamiento hexagonal compacto Número de huecos y su localización en cada tipo de empaquetamiento En lugar de aprender donde están los huecos y su nº como acabamos de hacer, podemos localizar los huecos y contarlos en la celdilla unidad, llegando obviamente al mismo resultado. La siguiente figura muestra la colocación de los huecos en un empaquetamiento hexagonal compacto, así como el cálculo del número de huecos octaédricos y tetraédricos.
12 12 Tema 8. Estructura cristalina Se representa a continuación la colocación de los huecos en un empaquetamiento cúbico compacto y, de nuevo, el cálculo del número de huecos octaédricos y tetraédricos. La siguiente tabla resume los parámetros de los empaquetamientos más habituales: EMPAQUETAMIENTO IC Nº ATOMOS/CELDILLA Nº HUECOS Hexagonal compacto O (0.414r) 12 T (0.225r) Cúbico compacto O (0.414r) 8 T (0.225r) Cúbico primitivo cúbico (0.732r) De nuevo se verifica que en empaquetamientos compactos el nº de huecos octaédricos coincide con el de esferas constituyentes, mientras que el nº de huecos tetraédricos es el doble. Relación entre el radio de la esfera constituyente del empaquetamiento y el del hueco Dado que generalmente las estructuras de los sólidos iónicos se basan en esferas de empaquetamiento compacto donde el ión más pequeño se sitúa en los huecos, es importante conocer el espacio de que se dispone para colocar los iones en los huecos. Para un hueco octaédrico, si cada esfera tiene un radio r, puede demostrarse fácilmente que un hueco de estas características puede acomodar otra esfera de radio 0.414r.
13 Tema 8. Estructura cristalina 13 Por su parte, un hueco tetraédrico puede acomodar una esfera de radio igual o inferior a 0.225r (r c +r a es la mitad de la diagonal del cubo y r a es la mitad de la diagonal de una cara del cubo). EMPAQUETAMIENTO DE POLIEDROS Es un sistema alternativo de representar fácilmente la estructura cristalina. El método consiste en describir las estructuras cristalinas como un conjunto de poliedros que comparten vértices, aristas o caras. Qué representa un poliedro? Los átomos son los vértices del poliedro y el átomo central no se representa (ocuparía el centro del poliedro). Se pueden encontrar una gran variedad de poliedros, aunque los tetraedros y octaedros son los más comunes. La descripción estructural mediante este modelo no implica la existencia de tales poliedros como entidades separadas. Ejemplos: NaCl: Esto se puede representar como un octaedro con iones Cl en los vertices y el Na + en el
14 14 Tema 8. Estructura cristalina centro. El poliedro de coordinación del Na + sería un octaedro, tal y como se describe en la Figura. Cl - Cl - Cl - Na + Cl - Cl - Cl - La estructura completa del NaCl se muestra en la siguiente figura y se describe como un conjunto de octaedros NaCl 6 que están compartiendo todas las aristas, de tal modo que cada vértice pertenece a seis octaedros: Las descripciones de estructuras basadas en empaquetamiento de poliedros no son demasiado realistas ya que con ellas se omiten los átomos que están en el centro del poliedro (normalmente el catión) y se representa a los aniones mediante los vértices del poliedro. Además, no se muestran los enlaces catión anión, y las aristas de los poliedros representan las interacciones entre aniones. A pesar de esto, este método permite destacar el tipo de coordinación que presenta el catión, su índice de coordinación y su geometría, así como la forma en que se comparten los aniones. El método de empaquetamiento de poliedros se utiliza con mucha frecuencia para describir estructuras complejas, generalmente de sales de grandes polianiones, o bien de alguno óxidos de elementos de transición. Por ejemplo se utilizan habitualmente en: -Sólidos moleculares como los derivados de aluminio: Al 2 Br 6 -Los compuestos que contienen iones complejos, silicatos: Estos oxoaniones se describen representando a la agrupación SiO 4 mediante un tetraedro. O - - O Si O -O-
15 Tema 8. Estructura cristalina 15 Estas unidades tetraédricas pueden unirse compartiendo uno, dos o tres vértices, lo que genera polianiones silicato muy variados, como muestran los siguientes casos: La fórmula empírica de estos polianiones se determina teniendo en cuenta el número de tetraedros que entran en la unidad mínima que se repite en cada tipo de estructura, y contabilizando una carga negativa por cada átomo de oxígeno terminal.
ESTRUCTURAS CRISTALINAS (P2)
 ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1. PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS
 LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1 PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS 1. INTRODUCCIÓN 1.1 Red de Bravais y celda primitiva unidad Uno de los conceptos fundamentales
LABORATORIO DE ESTADO SÓLIDO Y SEMICONDUCTORES 1.1 PRÁCTICA N o 1 REDES DE BRAVAIS Y ESTRUCTURAS CRISTALINAS 1. INTRODUCCIÓN 1.1 Red de Bravais y celda primitiva unidad Uno de los conceptos fundamentales
TEMA 5: INTROD. AL ESTADO SÓLIDO
 ESTADO SÓLIDO Figuras p1143 y p1146, Tipler 5ª Ed SEMICONDUCTORES Figuras p1141 y p1160, Tipler 5ª Ed DISPOSITIVOS http://axxon.com.ar/zap/c-zapping0127.htm Enlace químico: fuerza que mantiene unidos los
ESTADO SÓLIDO Figuras p1143 y p1146, Tipler 5ª Ed SEMICONDUCTORES Figuras p1141 y p1160, Tipler 5ª Ed DISPOSITIVOS http://axxon.com.ar/zap/c-zapping0127.htm Enlace químico: fuerza que mantiene unidos los
Estructura de los Sólidos
 Estructura de los Sólidos Estructura Cristalina OBJETIVOS a) Definir sólidos cristalinos y amorfos b) Definir estructura cristalina c) Describir las diferentes estructuras cristalinas d) Utilizar índices
Estructura de los Sólidos Estructura Cristalina OBJETIVOS a) Definir sólidos cristalinos y amorfos b) Definir estructura cristalina c) Describir las diferentes estructuras cristalinas d) Utilizar índices
Tema 3. Medidas de tendencia central. 3.1. Introducción. Contenido
 Tema 3 Medidas de tendencia central Contenido 31 Introducción 1 32 Media aritmética 2 33 Media ponderada 3 34 Media geométrica 4 35 Mediana 5 351 Cálculo de la mediana para datos agrupados 5 36 Moda 6
Tema 3 Medidas de tendencia central Contenido 31 Introducción 1 32 Media aritmética 2 33 Media ponderada 3 34 Media geométrica 4 35 Mediana 5 351 Cálculo de la mediana para datos agrupados 5 36 Moda 6
1.-La Cristalografía. 2.-Simetría
 1.-La Cristalografía La Cristalografía es la ciencia que se ocupa de los sólidos cristalinos y describe su estructura interna, es decir, como están distribuidos los átomos en su interior. También estudia
1.-La Cristalografía La Cristalografía es la ciencia que se ocupa de los sólidos cristalinos y describe su estructura interna, es decir, como están distribuidos los átomos en su interior. También estudia
SÓLIDOS I. Tipos de sólidos. Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada.
 SÓLIDOS I Tipos de sólidos Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada. Sólidos amorfos: no presentan estructuras ordenadas. 1 Sólidos cristalinos Hay posiciones
SÓLIDOS I Tipos de sólidos Sólidos cristalinos: los átomos, iones o moléculas se empaquetan en forma ordenada. Sólidos amorfos: no presentan estructuras ordenadas. 1 Sólidos cristalinos Hay posiciones
Lección 22: Probabilidad (definición clásica)
 LECCIÓN 22 Lección 22: Probabilidad (definición clásica) Empezaremos esta lección haciendo un breve resumen de la lección 2 del libro de primer grado. Los fenómenos determinísticos son aquellos en los
LECCIÓN 22 Lección 22: Probabilidad (definición clásica) Empezaremos esta lección haciendo un breve resumen de la lección 2 del libro de primer grado. Los fenómenos determinísticos son aquellos en los
ESTADO SOLIDO Al contrario de lo que sucede con los estados líquido y gaseoso, una sustancia en estado sólido posee forma definida y rigidez.
 ESTADO SOLIDO Al contrario de lo que sucede con los estados líquido y gaseoso, una sustancia en estado sólido posee forma definida y rigidez. Por rigidez se entiende que la energía de las atracciones intermoleculares
ESTADO SOLIDO Al contrario de lo que sucede con los estados líquido y gaseoso, una sustancia en estado sólido posee forma definida y rigidez. Por rigidez se entiende que la energía de las atracciones intermoleculares
5º de E. Primaria LOS CUERPOS GEOMÉTRICOS -TEMA 15
 LOS POLIEDROS Los poliedros son cuerpos geométricos que tienen todas sus caras formadas por polígonos. Muchos objetos de nuestro alrededor tienen forma de poliedro: Los elementos de un poliedro son caras,
LOS POLIEDROS Los poliedros son cuerpos geométricos que tienen todas sus caras formadas por polígonos. Muchos objetos de nuestro alrededor tienen forma de poliedro: Los elementos de un poliedro son caras,
LOS CUERPOS GEOMÉTRICOS POLIEDROS Y CUERPOS REDONDOS
 LOS CUERPOS GEOMÉTRICOS POLIEDROS Y CUERPOS REDONDOS Se llaman poliedros todos los cuerpos geométricos que tienen todas sus caras planas. Los cuerpos redondos son aquellos que tienen alguna de sus superficies
LOS CUERPOS GEOMÉTRICOS POLIEDROS Y CUERPOS REDONDOS Se llaman poliedros todos los cuerpos geométricos que tienen todas sus caras planas. Los cuerpos redondos son aquellos que tienen alguna de sus superficies
4. El ClNa cristaliza en el sistema cúbico con parámetro [a]=5.631å. Calcular su densidad sabiendo que su masa molecular es 58.45 uma.
![4. El ClNa cristaliza en el sistema cúbico con parámetro [a]=5.631å. Calcular su densidad sabiendo que su masa molecular es 58.45 uma. 4. El ClNa cristaliza en el sistema cúbico con parámetro [a]=5.631å. Calcular su densidad sabiendo que su masa molecular es 58.45 uma.](/thumbs/28/12696458.jpg) Síntesis y Caracterización Estructural de los Materiales: Bases Cristalográficas. 1. Dibuje en las celdas fundamentales cúbicas adjuntas (a = 3 Å): a. Las filas reticulares de índices de Weiss [02-1],
Síntesis y Caracterización Estructural de los Materiales: Bases Cristalográficas. 1. Dibuje en las celdas fundamentales cúbicas adjuntas (a = 3 Å): a. Las filas reticulares de índices de Weiss [02-1],
Tema 2.- Estructura de la Materia
 BLOQUE II.- ESTRUCTURA Estructura de la Materia * James F. Shackerlford Introducción a la Ciencia de Materiales para Ingenieros. Cuarta edición. Ed. Prentice Hall (1998) * Pat L. Mangonon Ciencia de Materiales:
BLOQUE II.- ESTRUCTURA Estructura de la Materia * James F. Shackerlford Introducción a la Ciencia de Materiales para Ingenieros. Cuarta edición. Ed. Prentice Hall (1998) * Pat L. Mangonon Ciencia de Materiales:
Tema 2 Estructuras Cristalinas
 Tema 2 Estructuras Cristalinas Para poder comprender las propiedades de los materiales, y poder por tanto seleccionar el material idóneo para una aplicación específica, se hace necesario comprender la
Tema 2 Estructuras Cristalinas Para poder comprender las propiedades de los materiales, y poder por tanto seleccionar el material idóneo para una aplicación específica, se hace necesario comprender la
GRUPOS PUNTUALES. 4.- Si un plano de simetría contiene un eje de orden n, existen n planos que contienen el eje. formando entre ellos ángulos de
 GRUPOS PUNTUALES Existen algunas relaciones entre elementos de simetría que pueden ser útiles a la hora de deducir cuales son los conjuntos de estos que forman grupo. 1.- Todos los elementos de simetría
GRUPOS PUNTUALES Existen algunas relaciones entre elementos de simetría que pueden ser útiles a la hora de deducir cuales son los conjuntos de estos que forman grupo. 1.- Todos los elementos de simetría
Sobre la estructura periódica de los sólidos elementales
 Sobre la estructura periódica de los sólidos elementales Gonzalo Gutiérrez * gonzalo@fisica.ciencias.uchile.cl 3 Agosto 2004 Las diferentes propiedades de los materiales se reflejan con mucha claridad
Sobre la estructura periódica de los sólidos elementales Gonzalo Gutiérrez * gonzalo@fisica.ciencias.uchile.cl 3 Agosto 2004 Las diferentes propiedades de los materiales se reflejan con mucha claridad
Orbitales híbridos. Cajón de Ciencias
 Orbitales híbridos Cajón de Ciencias Los orbitales híbridos son aquellos que se forman por la fusión de otros orbitales. Estudiarlos es un paso básico para entender la geometría y la estructura de las
Orbitales híbridos Cajón de Ciencias Los orbitales híbridos son aquellos que se forman por la fusión de otros orbitales. Estudiarlos es un paso básico para entender la geometría y la estructura de las
LA DUALIDAD PAR-IMPAR. 1. En una reunión de 25 personas. Puede ser que cada una se salude dándose la mano con todas las demás excepto con una?
 NOTAS Un sencillo principio matemático que da mucho más juego del que parece a primera vista es la simple distinción entre los números pares e impares. Conviene tener presente las siguientes propiedades,
NOTAS Un sencillo principio matemático que da mucho más juego del que parece a primera vista es la simple distinción entre los números pares e impares. Conviene tener presente las siguientes propiedades,
a De los siguientes cuerpos geométricos, di cuáles son poliedros y cuáles no. Razona tu respuesta.
 POLIEDROS Ejercicio nº 1.- a De los siguientes cuerpos geométricos, di cuáles son poliedros y cuáles no. Razona tu respuesta. b Cuál es la relación llamada fórmula de Euler que hay entre el número de caras,
POLIEDROS Ejercicio nº 1.- a De los siguientes cuerpos geométricos, di cuáles son poliedros y cuáles no. Razona tu respuesta. b Cuál es la relación llamada fórmula de Euler que hay entre el número de caras,
1. Dominio, simetría, puntos de corte y periodicidad
 Estudio y representación de funciones 1. Dominio, simetría, puntos de corte y periodicidad 1.1. Dominio Al conjunto de valores de x para los cuales está definida la función se le denomina dominio. Se suele
Estudio y representación de funciones 1. Dominio, simetría, puntos de corte y periodicidad 1.1. Dominio Al conjunto de valores de x para los cuales está definida la función se le denomina dominio. Se suele
La geometría molecular viene dada por la distribución de los átomos periféricos unidos al átomo central.
 Estructuras moleculares: Modelo VSPR (RPECV) Las estructuras de Lewis son útiles para establecer la distribución de los pares electrónicos en las moléculas pero no aportan nada sobre su previsible geometría.
Estructuras moleculares: Modelo VSPR (RPECV) Las estructuras de Lewis son útiles para establecer la distribución de los pares electrónicos en las moléculas pero no aportan nada sobre su previsible geometría.
Consideraciones sobre estructuras representativas
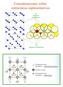 Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Consideraciones sobre estructuras representativas CONSIDERACIONES SOBRE ESTRUCTURAS REPRESENTATIVAS: En el empacamiento compacto hcp y ccp el número de coordinación es 12 Los elementos metálicos son los
Talento Matemático 2002/2003. Real Academia de Ciencias
 Volvemos al hermoso tema de la simetría. Además de la imágenes de multitud de objetos y de seres vivos que poseen simetrías recuerdas en qué consistía una simetría desde el punto de vista matemático?,
Volvemos al hermoso tema de la simetría. Además de la imágenes de multitud de objetos y de seres vivos que poseen simetrías recuerdas en qué consistía una simetría desde el punto de vista matemático?,
De cualquier manera, solo estudiaremos en esta unidad los compuestos inorgánicos.
 Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
Unidad 3 Ácidos, Hidróxidos y Sales: óxidos básicos, óxidos ácidos, hidróxidos, hidrácidos o ácidos binarios, ácidos ternarios, sales binarias, ternarias y cuaternarias. Formación y nomenclatura. Enlaces
El agua como disolvente
 hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
6. VECTORES Y COORDENADAS
 6. VECTORES Y COORDENADAS Página 1 Traslaciones. Vectores Sistema de referencia. Coordenadas. Punto medio de un segmento Ecuaciones de rectas. Paralelismo. Distancias Página 2 1. TRASLACIONES. VECTORES
6. VECTORES Y COORDENADAS Página 1 Traslaciones. Vectores Sistema de referencia. Coordenadas. Punto medio de un segmento Ecuaciones de rectas. Paralelismo. Distancias Página 2 1. TRASLACIONES. VECTORES
MICROECONOMÍA II. PRÁCTICA TEMA II: Equilibrio parcial
 MICROECONOMÍA II PRÁCTICA TEMA II: Equilibrio parcial EJERCICIO 1 A) En equilibrio, la cantidad demandada coincide con la cantidad ofrecida, así como el precio de oferta y demanda. Por lo tanto, para hallar
MICROECONOMÍA II PRÁCTICA TEMA II: Equilibrio parcial EJERCICIO 1 A) En equilibrio, la cantidad demandada coincide con la cantidad ofrecida, así como el precio de oferta y demanda. Por lo tanto, para hallar
Aplicación de programas 3D en la docencia universitaria. Estudio de estructuras cristalinas
 Aplicación de programas 3D en la docencia universitaria. Estudio de estructuras cristalinas F. Parres García; J.E. Crespo Amoros; S. Sanchez Caballero; M.A. Sellés Cantó; E. Perez Bernabeu Escuela Politçecnica
Aplicación de programas 3D en la docencia universitaria. Estudio de estructuras cristalinas F. Parres García; J.E. Crespo Amoros; S. Sanchez Caballero; M.A. Sellés Cantó; E. Perez Bernabeu Escuela Politçecnica
Estado Sólido. Estado Sólido. Estado Sólido. Estado Sólido - + Sólidos cristalinos y sólidos amorfos
 Sólidos cristalinos y sólidos amorfos Sólidos cristalinos: presentan un ordenamiento regular en el espacio Sólidos amorfos: no presentan el ordenamiento típico de los cristalinos Región cristalina Región
Sólidos cristalinos y sólidos amorfos Sólidos cristalinos: presentan un ordenamiento regular en el espacio Sólidos amorfos: no presentan el ordenamiento típico de los cristalinos Región cristalina Región
CUPES L. Ciencias experimentales. Configuración Electrónica. Recopiló: M.C. Macaria Hernández Chávez
 CUPES L Ciencias experimentales Configuración Electrónica Recopiló: M.C. Macaria Hernández Chávez 1. Existen 7 niveles de energía o capas donde pueden situarse los electrones, numerados del 1, el más interno,
CUPES L Ciencias experimentales Configuración Electrónica Recopiló: M.C. Macaria Hernández Chávez 1. Existen 7 niveles de energía o capas donde pueden situarse los electrones, numerados del 1, el más interno,
GEOMETRÍA MOLECULAR. Lic. Lidia Iñigo
 GEOMETRÍA MOLECULAR Lic. Lidia Iñigo Hemos dicho al estudiar uniones químicas que un enlace covalente es polar cuando existe cierta diferencia de electronegatividad entre los átomos que se unen. La magnitud
GEOMETRÍA MOLECULAR Lic. Lidia Iñigo Hemos dicho al estudiar uniones químicas que un enlace covalente es polar cuando existe cierta diferencia de electronegatividad entre los átomos que se unen. La magnitud
Química Inorgánica-63.13- Dra.Silvia E. Jacobo. Sólidos. Estructuras Cristalinas
 Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
Sólidos Estructuras Cristalinas Ordenamientos atómicos En gases no hay orden En líquidos hay orden de corto alcance En sólidos hay orden de largo alcance El ordenamiento está determinado por el tipo de
UNIVERSIDAD COMPLUTENSE DE MADRID
 TIEMPO: INSTRUCCIONES GENERALES Y VALORACIÓN 120 minutos. INSTRUCCIONES: La prueba consiste en la realización de cinco ejercicios, a elegir entre dos opciones, denominadas A y B. El alumno realizará una
TIEMPO: INSTRUCCIONES GENERALES Y VALORACIÓN 120 minutos. INSTRUCCIONES: La prueba consiste en la realización de cinco ejercicios, a elegir entre dos opciones, denominadas A y B. El alumno realizará una
TEMA 8: SÓLIDOS INORGÁNICOS. 2.- Redes bidimensionales y tridimensionales
 TEMA 8: SÓLIDOS INORGÁNICOS 1.- Tipos de sólidos 2.- Redes bidimensionales y tridimensionales 3.- Celda unidad y sus parámetros: - nº de átomos / celda - nº de coordinación (NC) - fracción de volumen ocupado
TEMA 8: SÓLIDOS INORGÁNICOS 1.- Tipos de sólidos 2.- Redes bidimensionales y tridimensionales 3.- Celda unidad y sus parámetros: - nº de átomos / celda - nº de coordinación (NC) - fracción de volumen ocupado
Qué son los cuerpos geométricos?
 Qué son los cuerpos geométricos? Definición Los cuerpos geométricos son regiones cerradas del espacio. Una caja de tetrabrick es un ejemplo claro de la figura que en matemáticas se conoce con el nombre
Qué son los cuerpos geométricos? Definición Los cuerpos geométricos son regiones cerradas del espacio. Una caja de tetrabrick es un ejemplo claro de la figura que en matemáticas se conoce con el nombre
Estructura Interna de los Materiales
 TEMA III Estructura Interna de los Materiales LECCIÓN 3 Estructura Cristalina y Amorfa 1 3.1 ESTADOS DE LA MATERIA Ciencia y Tecnología de los Materiales La materia puede presentarse en tres estados: gaseoso,
TEMA III Estructura Interna de los Materiales LECCIÓN 3 Estructura Cristalina y Amorfa 1 3.1 ESTADOS DE LA MATERIA Ciencia y Tecnología de los Materiales La materia puede presentarse en tres estados: gaseoso,
Lectura: LA PIRÁMIDE DE KEOPS. Consideraciones didácticas y soluciones
 Lectura: LA PIRÁMIDE DE KEOPS Consideraciones didácticas y soluciones 1 El tema de las pirámides nos parece atractivo y motivador para el alumnado y, por ello, nos sirve como excelente punto de partida
Lectura: LA PIRÁMIDE DE KEOPS Consideraciones didácticas y soluciones 1 El tema de las pirámides nos parece atractivo y motivador para el alumnado y, por ello, nos sirve como excelente punto de partida
Se enfría una sandía al ponerla abierta al sol?
 Se enfría una sandía al ponerla abierta al sol? RESUMEN Realizamos este experimento para comprobar una afirmación que se solía comentar mucho en nuestra localidad. La mayoría de la gente mayor de Villafranca
Se enfría una sandía al ponerla abierta al sol? RESUMEN Realizamos este experimento para comprobar una afirmación que se solía comentar mucho en nuestra localidad. La mayoría de la gente mayor de Villafranca
SÓLIDOS INORGÁNICOS. Tema 6. FUNDAMENTOS
 SÓLIDOS INORGÁNICOS Tema 6. Fundamentos Tema 7. Sólidos metálicos Tema 8. Sólidos iónicos Tema 9. Sólidos covalentes Tema 10. Sólidos moleculares Tema 11. Defectos y no-estequiometría Tema 12. Propiedades
SÓLIDOS INORGÁNICOS Tema 6. Fundamentos Tema 7. Sólidos metálicos Tema 8. Sólidos iónicos Tema 9. Sólidos covalentes Tema 10. Sólidos moleculares Tema 11. Defectos y no-estequiometría Tema 12. Propiedades
El agua. El agua. Se pueden ver muy bien los 4 puentes de hidrógeno que forma la molécula de agua central.
 El agua El agua es una de las sustancias más peculiares conocidas. Es una molécula pequeña y sencilla, pero tras su aparente simplicidad presenta una complejidad sorprendente que la hace especialmente
El agua El agua es una de las sustancias más peculiares conocidas. Es una molécula pequeña y sencilla, pero tras su aparente simplicidad presenta una complejidad sorprendente que la hace especialmente
Funciones, x, y, gráficos
 Funciones, x, y, gráficos Vamos a ver los siguientes temas: funciones, definición, dominio, codominio, imágenes, gráficos, y algo más. Recordemos el concepto de función: Una función es una relación entre
Funciones, x, y, gráficos Vamos a ver los siguientes temas: funciones, definición, dominio, codominio, imágenes, gráficos, y algo más. Recordemos el concepto de función: Una función es una relación entre
PROBLEMAS MÉTRICOS. Página 183 REFLEXIONA Y RESUELVE. Diagonal de un ortoedro. Distancia entre dos puntos. Distancia de un punto a una recta
 PROBLEMAS MÉTRICOS Página 3 REFLEXIONA Y RESUELVE Diagonal de un ortoedro Halla la diagonal de los ortoedros cuyas dimensiones son las siguientes: I) a =, b =, c = II) a = 4, b =, c = 3 III) a =, b = 4,
PROBLEMAS MÉTRICOS Página 3 REFLEXIONA Y RESUELVE Diagonal de un ortoedro Halla la diagonal de los ortoedros cuyas dimensiones son las siguientes: I) a =, b =, c = II) a = 4, b =, c = 3 III) a =, b = 4,
NÚMEROS NATURALES Y NÚMEROS ENTEROS
 NÚMEROS NATURALES Y NÚMEROS ENTEROS Los números naturales surgen como respuesta a la necesidad de nuestros antepasados de contar los elementos de un conjunto (por ejemplo los animales de un rebaño) y de
NÚMEROS NATURALES Y NÚMEROS ENTEROS Los números naturales surgen como respuesta a la necesidad de nuestros antepasados de contar los elementos de un conjunto (por ejemplo los animales de un rebaño) y de
Definición de vectores
 Definición de vectores Un vector es todo segmento de recta dirigido en el espacio. Cada vector posee unas características que son: Origen: O también denominado Punto de aplicación. Es el punto exacto sobre
Definición de vectores Un vector es todo segmento de recta dirigido en el espacio. Cada vector posee unas características que son: Origen: O también denominado Punto de aplicación. Es el punto exacto sobre
_ Antología de Física I. Unidad II Vectores. Elaboró: Ing. Víctor H. Alcalá-Octaviano
 24 Unidad II Vectores 2.1 Magnitudes escalares y vectoriales Unidad II. VECTORES Para muchas magnitudes físicas basta con indicar su valor para que estén perfectamente definidas y estas son las denominadas
24 Unidad II Vectores 2.1 Magnitudes escalares y vectoriales Unidad II. VECTORES Para muchas magnitudes físicas basta con indicar su valor para que estén perfectamente definidas y estas son las denominadas
Ing. Fredy Velázquez Soto
 Ing. Fredy Velázquez Soto TIPOS DE SÓLIDOS Sólidos cristalinos Los átomos, iones o moléculas se empaquetan en un arreglo ordenado Sólidos covalentes ( diamante, cristales de cuarzo), sólidos metálicos,
Ing. Fredy Velázquez Soto TIPOS DE SÓLIDOS Sólidos cristalinos Los átomos, iones o moléculas se empaquetan en un arreglo ordenado Sólidos covalentes ( diamante, cristales de cuarzo), sólidos metálicos,
Química I. Objetivos de aprendizaje del tema
 Tema 3 Estados de la materia Objetivos de aprendizaje del tema Al finalizar el tema serás capaz de: Distinguir los estados físicos de la materia. Explicar los cambios de la materia en estado gaseoso identificando
Tema 3 Estados de la materia Objetivos de aprendizaje del tema Al finalizar el tema serás capaz de: Distinguir los estados físicos de la materia. Explicar los cambios de la materia en estado gaseoso identificando
Teoría de repulsión de pares electrónicos de la capa de Valencia
 Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
TEMA 1: NOCIONES DE ESTADO SÓLIDO. La importancia de la estructura, el enlace y los estados electrónicos sobre las propiedades del material
 TEMA 1: NOCIONES DE ESTADO SÓLIDO La importancia de la estructura, el enlace y los estados electrónicos sobre las propiedades del material Sólido: Substancias elásticas rígidas, es decir, substancias que
TEMA 1: NOCIONES DE ESTADO SÓLIDO La importancia de la estructura, el enlace y los estados electrónicos sobre las propiedades del material Sólido: Substancias elásticas rígidas, es decir, substancias que
Movimientos en el plano
 7 Movimientos en el plano Objetivos En esta quincena aprenderás a: Manejar el concepto de vector como elemento direccional del plano. Reconocer los movimientos principales en el plano: traslaciones, giros
7 Movimientos en el plano Objetivos En esta quincena aprenderás a: Manejar el concepto de vector como elemento direccional del plano. Reconocer los movimientos principales en el plano: traslaciones, giros
Operación de Microsoft Excel
 Representación gráfica de datos Generalidades Excel puede crear gráficos a partir de datos previamente seleccionados en una hoja de cálculo. El usuario puede incrustar un gráfico en una hoja de cálculo,
Representación gráfica de datos Generalidades Excel puede crear gráficos a partir de datos previamente seleccionados en una hoja de cálculo. El usuario puede incrustar un gráfico en una hoja de cálculo,
0.1 Introducción. 0.2 Un modelo del cubo. El grupo de Rubik
 0.1 Introducción i El grupo de Rubik 0.1 Introducción La primera vez que alguien se enfrenta con el cubo de Rubik, es muy posible que tan solo aprenda a moverlo. Y ya entonces se percata que tiene ante
0.1 Introducción i El grupo de Rubik 0.1 Introducción La primera vez que alguien se enfrenta con el cubo de Rubik, es muy posible que tan solo aprenda a moverlo. Y ya entonces se percata que tiene ante
LÍMITES Y CONTINUIDAD DE FUNCIONES
 Capítulo 9 LÍMITES Y CONTINUIDAD DE FUNCIONES 9.. Introducción El concepto de ite en Matemáticas tiene el sentido de lugar hacia el que se dirige una función en un determinado punto o en el infinito. Veamos
Capítulo 9 LÍMITES Y CONTINUIDAD DE FUNCIONES 9.. Introducción El concepto de ite en Matemáticas tiene el sentido de lugar hacia el que se dirige una función en un determinado punto o en el infinito. Veamos
El enlace covalente se explica mediante la Teoría del Orbital Molecular (TOM).(Bueno para moléculas sencillas, complicado para las complejas).
 . Aplicación de la Teoría de Grupos. Moléculas triatómicas lineales y angulares. Moléculas mono y bidimensionales. Moléculas poliédricas sencillas. Objetivos: Recordar los conceptos generales del enlace
. Aplicación de la Teoría de Grupos. Moléculas triatómicas lineales y angulares. Moléculas mono y bidimensionales. Moléculas poliédricas sencillas. Objetivos: Recordar los conceptos generales del enlace
MÓDULO Nº 4. Nivelación. Matemática 2005. Módulo Nº4. Contenidos. Circunferencia y Círculo Volúmenes
 MÓDULO Nº 4 Nivelación Matemática 2005 Módulo Nº4 Contenidos Circunferencia y Círculo Volúmenes Nivelación Circunferencia y Círculo Circunferencia. Es una línea curva cerrada, cuyos puntos tienen la propiedad
MÓDULO Nº 4 Nivelación Matemática 2005 Módulo Nº4 Contenidos Circunferencia y Círculo Volúmenes Nivelación Circunferencia y Círculo Circunferencia. Es una línea curva cerrada, cuyos puntos tienen la propiedad
Unidad. Ciencias de la Naturaleza 2. ESO
 omo ya sabes, un espejo es una superficie pulimentada que refleja toda la luz que recibe. Según la forma geométrica de su superficie, podemos clasificar los espejos en dos tipos, planos y esféricos, y
omo ya sabes, un espejo es una superficie pulimentada que refleja toda la luz que recibe. Según la forma geométrica de su superficie, podemos clasificar los espejos en dos tipos, planos y esféricos, y
Estructura atómica de superficies
 Estructura atómica de superficies El número de coordinación de los átomos en una superficie es mucho menor que el número de coordinación de los átomos en el sólido. Uno puede pensar que forma una superficie
Estructura atómica de superficies El número de coordinación de los átomos en una superficie es mucho menor que el número de coordinación de los átomos en el sólido. Uno puede pensar que forma una superficie
ESTRUCTURA DE LA MATERIA QCA 09 ANDALUCÍA
 1.- Considere el elemento cuya configuración electrónica es 1s 2 2s 2 2p 6 3s 2 3p 4. a) De qué elemento se trata? b) Justifique el periodo y el grupo del sistema periódico a los que pertenece. c) Cuál
1.- Considere el elemento cuya configuración electrónica es 1s 2 2s 2 2p 6 3s 2 3p 4. a) De qué elemento se trata? b) Justifique el periodo y el grupo del sistema periódico a los que pertenece. c) Cuál
PRISMAS Y PIRÁMIDES. Qué es un poliedro? Un poliedro es un cuerpo geométrico que tiene alto, ancho y largo.
 PRISMAS Y PIRÁMIDES. 06 1 Comprende la relación que existe entre el volumen de un prisma con respecto al volumen de una pirámide que tienen la misma base y altura. En Presentación de Contenidos para explicar
PRISMAS Y PIRÁMIDES. 06 1 Comprende la relación que existe entre el volumen de un prisma con respecto al volumen de una pirámide que tienen la misma base y altura. En Presentación de Contenidos para explicar
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Tema 2. Espacios Vectoriales. 2.1. Introducción
 Tema 2 Espacios Vectoriales 2.1. Introducción Estamos habituados en diferentes cursos a trabajar con el concepto de vector. Concretamente sabemos que un vector es un segmento orientado caracterizado por
Tema 2 Espacios Vectoriales 2.1. Introducción Estamos habituados en diferentes cursos a trabajar con el concepto de vector. Concretamente sabemos que un vector es un segmento orientado caracterizado por
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
Cuerpos geométricos OBJETIVOS CONTENIDOS PROCEDIMIENTOS. Elementos de un poliedro y su desarrollo. Los poliedros regulares y sus características.
 826464 _ 0385-0396.qxd /2/07 09:27 Página 385 Cuerpos geométricos INTRODUCCIÓN Esta unidad completa la serie dedicada a la Geometría y afianza su comprensión mediante la descripción y desarrollo de las
826464 _ 0385-0396.qxd /2/07 09:27 Página 385 Cuerpos geométricos INTRODUCCIÓN Esta unidad completa la serie dedicada a la Geometría y afianza su comprensión mediante la descripción y desarrollo de las
METROS CÚBICOS O LITROS?
 METROS CÚBICOS O LITROS? 10 Comprende qué son las unidades de volumen (litros y decímetros cúbicos). En Presentación de Contenidos, para explicar las unidades de volumen se explica la diferencia entre
METROS CÚBICOS O LITROS? 10 Comprende qué son las unidades de volumen (litros y decímetros cúbicos). En Presentación de Contenidos, para explicar las unidades de volumen se explica la diferencia entre
Hay 5 sólidos platónicos
 1 Un sólido es un poliedro, o sea una figura tridimensional conformada por planos de diversas formas (polígonos) que se intersectan. Hay 5 sólidos platónicos Fueron estudiados y descriptos por los geómetras
1 Un sólido es un poliedro, o sea una figura tridimensional conformada por planos de diversas formas (polígonos) que se intersectan. Hay 5 sólidos platónicos Fueron estudiados y descriptos por los geómetras
1. Producto escalar, métrica y norma asociada
 1. asociada Consideramos el espacio vectorial R n sobre el cuerpo R; escribimos los vectores o puntos de R n, indistintamente, como x = (x 1,..., x n ) = n x i e i i=1 donde e i son los vectores de la
1. asociada Consideramos el espacio vectorial R n sobre el cuerpo R; escribimos los vectores o puntos de R n, indistintamente, como x = (x 1,..., x n ) = n x i e i i=1 donde e i son los vectores de la
1. (2 puntos) En la V Caminata Madrileño Manchega, los participantes caminan de Madrid
 Matemática Discreta Segundo de Ingeniería Informática UAM Curso 2006-2007 Solucionario del examen final del 26-1-2007 Nota bene: A continuación exhibimos algunas de las distintas maneras de abordar los
Matemática Discreta Segundo de Ingeniería Informática UAM Curso 2006-2007 Solucionario del examen final del 26-1-2007 Nota bene: A continuación exhibimos algunas de las distintas maneras de abordar los
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 4: Vectores
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 4: Vectores Universidad Politécnica de Madrid 5 de marzo de 2010 2 4.1. Planificación
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 4: Vectores Universidad Politécnica de Madrid 5 de marzo de 2010 2 4.1. Planificación
El palacio de la Alhambra: La primera expansión. El favor de los visires
 El palacio de la Alhambra: La primera expansión El favor de los visires Traducido al español por javche Esta expansión contiene cuatro módulos diferentes, que pueden combinarse individualmente o todos
El palacio de la Alhambra: La primera expansión El favor de los visires Traducido al español por javche Esta expansión contiene cuatro módulos diferentes, que pueden combinarse individualmente o todos
1.1. Introducción y conceptos básicos
 Tema 1 Variables estadísticas Contenido 1.1. Introducción y conceptos básicos.................. 1 1.2. Tipos de variables estadísticas................... 2 1.3. Distribuciones de frecuencias....................
Tema 1 Variables estadísticas Contenido 1.1. Introducción y conceptos básicos.................. 1 1.2. Tipos de variables estadísticas................... 2 1.3. Distribuciones de frecuencias....................
DIBUJO TÉCNICO. UNIDAD DIDÁCTICA 9: Geometría 2D (V)
 UNIDAD DIDÁCTICA 9: Geometría 2D (V) ÍNDICE Página: 1 CURVAS CÓNICAS. ELEMENTOS CARACTERÍSTICOS.. 2 2 TRAZADO MEDIANTE RADIOS VECTORES 4 3 RECTAS TANGENTES A CÓNICAS 5 3.1 CIRCUNFERENCIAS FOCALES 6 3.2
UNIDAD DIDÁCTICA 9: Geometría 2D (V) ÍNDICE Página: 1 CURVAS CÓNICAS. ELEMENTOS CARACTERÍSTICOS.. 2 2 TRAZADO MEDIANTE RADIOS VECTORES 4 3 RECTAS TANGENTES A CÓNICAS 5 3.1 CIRCUNFERENCIAS FOCALES 6 3.2
a < b y se lee "a es menor que b" (desigualdad estricta) a > b y se lee "a es mayor que b" (desigualdad estricta)
 Desigualdades Dadas dos rectas que se cortan, llamadas ejes (rectangulares si son perpendiculares, y oblicuos en caso contrario), un punto puede situarse conociendo las distancias del mismo a los ejes,
Desigualdades Dadas dos rectas que se cortan, llamadas ejes (rectangulares si son perpendiculares, y oblicuos en caso contrario), un punto puede situarse conociendo las distancias del mismo a los ejes,
Ablandamiento de agua mediante el uso de resinas de intercambio iónico.
 Ablandamiento de agua por intercambio iónica página 1 Ablandamiento de agua mediante el uso de resinas de intercambio iónico. (Fuentes varias) Algunos conceptos previos: sales, iones y solubilidad. Que
Ablandamiento de agua por intercambio iónica página 1 Ablandamiento de agua mediante el uso de resinas de intercambio iónico. (Fuentes varias) Algunos conceptos previos: sales, iones y solubilidad. Que
SISTEMAS DE COORDENADAS SISTEMA COORDENADO UNIDIMENSIONAL
 SISTEMAS DE COORDENADAS En la vida diaria, nos encontramos con el problema de ordenar algunos objetos; de tal manera que es necesario agruparlos, identificarlos, seleccionarlos, estereotiparlos, etc.,
SISTEMAS DE COORDENADAS En la vida diaria, nos encontramos con el problema de ordenar algunos objetos; de tal manera que es necesario agruparlos, identificarlos, seleccionarlos, estereotiparlos, etc.,
Operaciones Morfológicas en Imágenes Binarias
 Operaciones Morfológicas en Imágenes Binarias Introducción La morfología matemática es una herramienta muy utilizada en el procesamiento de i- mágenes. Las operaciones morfológicas pueden simplificar los
Operaciones Morfológicas en Imágenes Binarias Introducción La morfología matemática es una herramienta muy utilizada en el procesamiento de i- mágenes. Las operaciones morfológicas pueden simplificar los
10.8. Balances de carga y materia
 10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
Tema 2 : Códigos Binarios
 Tema 2 : Códigos Binarios Objetivo: Conocer diferentes códigos binarios Conocer algunos códigos de detección y corrección de errores. Códigos alfanuméricos 1 Códigos Binarios A la representación de cifras,
Tema 2 : Códigos Binarios Objetivo: Conocer diferentes códigos binarios Conocer algunos códigos de detección y corrección de errores. Códigos alfanuméricos 1 Códigos Binarios A la representación de cifras,
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS ORBITALES ATÓMICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS Integrantes: Walter Bermúdez Lizbeth Sánchez Curso: Jueves 10:00 a 12:00 ORBITALES ATÓMICOS 1.- Definición de
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS Integrantes: Walter Bermúdez Lizbeth Sánchez Curso: Jueves 10:00 a 12:00 ORBITALES ATÓMICOS 1.- Definición de
TEMA 1: REPRESENTACIÓN GRÁFICA. 0.- MANEJO DE ESCUADRA Y CARTABON (Repaso 1º ESO)
 TEMA 1: REPRESENTACIÓN GRÁFICA 0.- MANEJO DE ESCUADRA Y CARTABON (Repaso 1º ESO) Son dos instrumentos de plástico transparente que se suelen usar de forma conjunta. La escuadra tiene forma de triángulo
TEMA 1: REPRESENTACIÓN GRÁFICA 0.- MANEJO DE ESCUADRA Y CARTABON (Repaso 1º ESO) Son dos instrumentos de plástico transparente que se suelen usar de forma conjunta. La escuadra tiene forma de triángulo
TRABAJO PRÁCTICO: MODELOS EXTREMOS DE SUSTANCIA
 1 Complemento TRABAJO PRÁCTICO: S EXTREMOS DE SUSTANCIA FUNDAMENTOS TEÓRICOS BÁSICOS Todas las sustancias pueden considerarse formadas por un conjunto de unidades estructurales o fundamentales. La clase
1 Complemento TRABAJO PRÁCTICO: S EXTREMOS DE SUSTANCIA FUNDAMENTOS TEÓRICOS BÁSICOS Todas las sustancias pueden considerarse formadas por un conjunto de unidades estructurales o fundamentales. La clase
Cap. 24 La Ley de Gauss
 Cap. 24 La Ley de Gauss Una misma ley física enunciada desde diferentes puntos de vista Coulomb Gauss Son equivalentes Pero ambas tienen situaciones para las cuales son superiores que la otra Aquí hay
Cap. 24 La Ley de Gauss Una misma ley física enunciada desde diferentes puntos de vista Coulomb Gauss Son equivalentes Pero ambas tienen situaciones para las cuales son superiores que la otra Aquí hay
Antes de empezar con la resolución de este caso vamos a analizar las funciones financieras que vamos a utilizar.
 SOLUCIÓN CASO PRÉSTAMOS I Antes de empezar con la resolución de este caso vamos a analizar las funciones financieras que vamos a utilizar. Excel incorpora varias funciones que permiten efectuar cálculos
SOLUCIÓN CASO PRÉSTAMOS I Antes de empezar con la resolución de este caso vamos a analizar las funciones financieras que vamos a utilizar. Excel incorpora varias funciones que permiten efectuar cálculos
Características de funciones que son inversas de otras
 Características de funciones que son inversas de otras Si f es una función inyectiva, llamamos función inversa de f y se representa por f 1 al conjunto. f 1 = a, b b, a f} Es decir, f 1 (x, y) = { x =
Características de funciones que son inversas de otras Si f es una función inyectiva, llamamos función inversa de f y se representa por f 1 al conjunto. f 1 = a, b b, a f} Es decir, f 1 (x, y) = { x =
PARÁBOLA. 1) para la parte positiva: 2) para la parte negativa: 3) para la parte positiva: 4) para la parte negativa:
 Página 90 5 LA PARÁBOLA 5.1 DEFINICIONES La parábola es el lugar geométrico 4 de todos los puntos cuyas distancias a una recta fija, llamada, y a un punto fijo, llamado foco, son iguales entre sí. Hay
Página 90 5 LA PARÁBOLA 5.1 DEFINICIONES La parábola es el lugar geométrico 4 de todos los puntos cuyas distancias a una recta fija, llamada, y a un punto fijo, llamado foco, son iguales entre sí. Hay
CASO PRÁCTICO DISTRIBUCIÓN DE COSTES
 CASO PRÁCTICO DISTRIBUCIÓN DE COSTES Nuestra empresa tiene centros de distribución en tres ciudades europeas: Zaragoza, Milán y Burdeos. Hemos solicitado a los responsables de cada uno de los centros que
CASO PRÁCTICO DISTRIBUCIÓN DE COSTES Nuestra empresa tiene centros de distribución en tres ciudades europeas: Zaragoza, Milán y Burdeos. Hemos solicitado a los responsables de cada uno de los centros que
13Soluciones a los ejercicios y problemas PÁGINA 280
 Soluciones a los ejercicios y problemas PÁGINA 0 Pág. P RACTICA Muy probable, poco probable Tenemos muchas bolas de cada uno de los siguientes colores: negro (N), rojo (R), verde (V) y azul (A), y una
Soluciones a los ejercicios y problemas PÁGINA 0 Pág. P RACTICA Muy probable, poco probable Tenemos muchas bolas de cada uno de los siguientes colores: negro (N), rojo (R), verde (V) y azul (A), y una
COORDENADAS CURVILINEAS
 CAPITULO V CALCULO II COORDENADAS CURVILINEAS Un sistema de coordenadas es un conjunto de valores que permiten definir unívocamente la posición de cualquier punto de un espacio geométrico respecto de un
CAPITULO V CALCULO II COORDENADAS CURVILINEAS Un sistema de coordenadas es un conjunto de valores que permiten definir unívocamente la posición de cualquier punto de un espacio geométrico respecto de un
Unidad Didáctica. Códigos Binarios
 Unidad Didáctica Códigos Binarios Programa de Formación Abierta y Flexible Obra colectiva de FONDO FORMACION Coordinación Diseño y maquetación Servicio de Producción Didáctica de FONDO FORMACION (Dirección
Unidad Didáctica Códigos Binarios Programa de Formación Abierta y Flexible Obra colectiva de FONDO FORMACION Coordinación Diseño y maquetación Servicio de Producción Didáctica de FONDO FORMACION (Dirección
PRISMA OBLICUO > REPRESENTACIÓN Y DESARROLLO POR EL MÉTODO DE LA SECCIÓN NORMAL
 1. CARACTERÍSTICAS GENERALES DEL PRISMA OBLICUO Desde el punto de vista de la representación en SISTEMA DIÉDRICO, el prisma oblicuo presenta dos características importantes que lo diferencian del prisma
1. CARACTERÍSTICAS GENERALES DEL PRISMA OBLICUO Desde el punto de vista de la representación en SISTEMA DIÉDRICO, el prisma oblicuo presenta dos características importantes que lo diferencian del prisma
CURSO BÁSICO DE FÍSICA MECÁNICA PROYECTO UNICOMFACAUCA TU PROYECTO DE VIDA
 UNICOMFACAUCA TU DE VIDA Tabla de contenido... 2 PARTES DE UN VECTOR... 3 Notación... 5 Tipos de vectores... 5 Componentes de un vector... 6 Operaciones con vectores... 7 Suma de vectores... 7 Resta de
UNICOMFACAUCA TU DE VIDA Tabla de contenido... 2 PARTES DE UN VECTOR... 3 Notación... 5 Tipos de vectores... 5 Componentes de un vector... 6 Operaciones con vectores... 7 Suma de vectores... 7 Resta de
MÓDULO 2: TRATAMIENTO DE DATOS CON HOJA DE CÁLCULO. Tema 1: Gestión de listas de datos y tablas dinámicas. Leire Aldaz, Begoña Eguía y Leire Urcola
 MÓDULO 2: TRATAMIENTO DE DATOS CON HOJA DE CÁLCULO Tema 1: Gestión de listas de datos y tablas dinámicas Leire Aldaz, Begoña Eguía y Leire Urcola Índice del tema - Introducción a las listas de datos -
MÓDULO 2: TRATAMIENTO DE DATOS CON HOJA DE CÁLCULO Tema 1: Gestión de listas de datos y tablas dinámicas Leire Aldaz, Begoña Eguía y Leire Urcola Índice del tema - Introducción a las listas de datos -
Tarea 2: Diseño CrossOver
 Tarea 2: Diseño CrossOver Tomas Neira 7 de Junio de 2006 CrossOver El tema principal de este juego es el conflicto por territorio. Esto no es en el mismo sentido que en el GO, sino que las posiciones relativas
Tarea 2: Diseño CrossOver Tomas Neira 7 de Junio de 2006 CrossOver El tema principal de este juego es el conflicto por territorio. Esto no es en el mismo sentido que en el GO, sino que las posiciones relativas
Relaciones binarias. ( a, b) = ( c, d) si y solamente si a = c y b = d
 Relaciones binarias En esta sección estudiaremos formalmente las parejas de objetos que comparten algunas características o propiedades en común. La estructura matemática para agrupar estas parejas en
Relaciones binarias En esta sección estudiaremos formalmente las parejas de objetos que comparten algunas características o propiedades en común. La estructura matemática para agrupar estas parejas en
Gráfico nº 1: Sectores. fueran comunes a las empresas industriales de servicios o de la construcción 0% 20% 40% 60% 80% 16,61% 69,16% 14,23%
 LA CALIDAD TOTAL Y LA CERTIFICACIÓN EN LAS NORMAS ISO 9000: EVIDENCIA EMPÍRICA EN LA COMUNIDAD VALENCIANA. INTRODUCCIÓN La implantación de los sistemas de calidad, vía las normas ISO 9000, está teniendo
LA CALIDAD TOTAL Y LA CERTIFICACIÓN EN LAS NORMAS ISO 9000: EVIDENCIA EMPÍRICA EN LA COMUNIDAD VALENCIANA. INTRODUCCIÓN La implantación de los sistemas de calidad, vía las normas ISO 9000, está teniendo
FICHA DE CONSULTA DE EXCURSIÓN POR LA RED ELÉCTRICA
 FICHA DE CONSULTA Sumario 1. Glosario 1.1. Siglas 3 1.2. Términos 3 2. Paneles solares 2.1. Qué es un panel solar? 4 2.2. Cómo funciona un panel solar? 6 2 1. Glosario 1.1. Siglas 1.2. Términos W/m² Watts
FICHA DE CONSULTA Sumario 1. Glosario 1.1. Siglas 3 1.2. Términos 3 2. Paneles solares 2.1. Qué es un panel solar? 4 2.2. Cómo funciona un panel solar? 6 2 1. Glosario 1.1. Siglas 1.2. Términos W/m² Watts
Capítulo 10. Gráficos y diagramas
 Capítulo 10. Gráficos y diagramas 1. Introducción Los gráficos y diagramas que se acostumbran a ver en libros e informes para visualizar datos estadísticos también se utilizan con propósitos cartográficos,
Capítulo 10. Gráficos y diagramas 1. Introducción Los gráficos y diagramas que se acostumbran a ver en libros e informes para visualizar datos estadísticos también se utilizan con propósitos cartográficos,
Estructura Cristalina de Sólidos
 Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
Estructura Cristalina de Sólidos Relación entre estructura periódica y propiedades Bibliografía: 1. Solid State Physics. Ashcroft and Mermin. 2. Solid State Chemistry. West. 3. Química del Estado Sólido.
CAPÍTULO VI PREPARACIÓN DEL MODELO EN ALGOR. En este capítulo, se hablará acerca de los pasos a seguir para poder realizar el análisis de
 CAPÍTULO VI PREPARACIÓN DEL MODELO EN ALGOR. En este capítulo, se hablará acerca de los pasos a seguir para poder realizar el análisis de cualquier modelo en el software Algor. La preparación de un modelo,
CAPÍTULO VI PREPARACIÓN DEL MODELO EN ALGOR. En este capítulo, se hablará acerca de los pasos a seguir para poder realizar el análisis de cualquier modelo en el software Algor. La preparación de un modelo,
