ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
|
|
|
- Agustín Lucero Gómez
- hace 8 años
- Vistas:
Transcripción
1 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1
2 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de la reconstitución, 1 dosis (0,65 ml) contiene: Virus varicela-zóster 1, cepa Oka/Merck (vivos, atenuados) > UFP 2 1 Producidos en células diploides humanas (MRC-5) 2 UFP = Unidades formadoras de placa Esta vacuna puede contener trazas de neomicina. Ver secciones 4.3 y 4.4. Excipientes con efecto conocido: Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Polvo y disolvente para suspensión inyectable. El polvo es una masa compacta cristalina de color blanco o blanquecino. El disolvente es un líquido transparente incoloro. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas ZOSTAVAX está indicado para la prevención del herpes zóster ( zóster o culebrilla) y la neuralgia post-herpética (NPH) relacionada con herpes zóster. ZOSTAVAX está indicado para la inmunización de individuos de 50 años de edad o mayores. 4.2 Posología y forma de administración Posología Los individuos deben recibir una dosis única (0,65 ml) administrada subcutáneamente. Se desconoce actualmente la necesidad de una segunda dosis. Ver sección 5.1. Población pediátrica ZOSTAVAX no está indicado para la prevención de la infección primaria por el virus de la varicela (varicela) y no debe ser utilizado en niños y adolescentes. Forma de administración La vacuna ha de ser administrada por VIA SUBCUTÁNEA, preferiblemente en la región deltoidea. No inyectar intravascularmente. 2
3 Precauciones que deben tomarse antes de manipular o administrar este medicamento: ver sección 6.6. Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección Contraindicaciones Antecedentes de hipersensibilidad al principio activo o a alguno de los excipientes o a residuos en cantidades de trazas (ej. neomicina) (ver secciones 4.4 y 6.1). Estados de inmunodeficiencia primaria o adquirida debidos a afecciones tales como: leucemias agudas y crónicas; linfoma; otras enfermedades que afectan a la médula ósea o al sistema linfático; inmunosupresión debida a VIH/SIDA (ver secciones 4.8 y 5.1); deficiencias de la inmunidad celular. Terapia inmunosupresora (incluyendo altas dosis de corticosteroides). Sin embargo, ZOSTAVAX no está contraindicado en sujetos que estén recibiendo corticosteroides tópicos/inhalados o dosis bajas de corticosteroides sistémicos o en pacientes que estén recibiendo corticoides como terapia de sustitución, por ejemplo, para la insuficiencia adrenal (ver secciones 4.8 y 5.1). Tuberculosis activa no tratada. Embarazo. Además, se debe evitar un embarazo durante 1 mes después de la vacunación (ver sección 4.6). 4.4 Advertencias y precauciones especiales de empleo Debe estar siempre disponible un tratamiento médico adecuado y supervisión para el caso de que sucediera una reacción anafiláctica/anafilactoide rara después de la administración de la vacuna, ya que existe la posibilidad de reacciones de hipersensibilidad, no sólo al principio activo, sino también a los excipientes y residuos en cantidades de trazas (por ejemplo, neomicina) presentes en la vacuna (ver secciones 4.3, 4.8 y 6.1). La alergia a neomicina generalmente se manifiesta como una dermatitis de contacto. Sin embargo, un antecedente de dermatitis de contacto debida a neomicina no es una contraindicación para recibir vacunas de virus vivos. ZOSTAVAX no está indicado para el tratamiento de zóster o de NPH. En presencia de fiebre debe considerarse un aplazamiento de la vacunación. Como con cualquier otra vacuna, la vacunación con ZOSTAVAX puede no proteger a todos los vacunados. Ver sección 5.1. No se ha establecido la seguridad y eficacia de ZOSTAVAX en adultos que se sabe que están infectados con VIH, con o sin evidencia de inmunodepresión (ver sección 4.3) sin embargo, ha finalizado un estudio de fase II de seguridad e inmunogenicidad en adultos infectados por VIH con la función inmune inalterada (Recuento de células T CD células/µl), ver secciones 4.8 y 5.1. Transmisión En los ensayos clínicos con ZOSTAVAX no se ha notificado la transmisión del virus de la vacuna. Sin embargo, la experiencia tras la comercialización de las vacunas de varicela sugiere que puede ocurrir raramente la transmisión del virus de la vacuna entre vacunados que desarrollan una erupción varicelosa y contactos susceptibles (por ejemplo, nietos pequeños susceptibles al virus varicela-zóster, VVZ). También se ha notificado la transmisión del virus de la vacuna desde vacunados frente a varicela que no desarrollan una erupción varicelosa. Éste es un riesgo teórico de la vacunación con ZOSTAVAX. El riesgo de transmisión de virus atenuados de la vacuna desde un vacunado a un 3
4 contacto susceptible debe ser sopesado frente al riesgo de desarrollar zóster natural y la potencial transmisión del VVZ salvaje a un contacto susceptible. 4.5 Interacción con otros medicamentos y otras formas de interacción ZOSTAVAX puede ser administrado de forma concomitante con vacuna antigripal inactivada mediante inyecciones separadas y en diferentes sitios del cuerpo (ver sección 5.1). ZOSTAVAX no debe administrarse de forma concomitante con la vacuna antineumocócica de polisacáridos de 23 serotipos, ya que en un ensayo clínico se observó una reducción de la inmunogenicidad de ZOSTAVAX como resultado del uso concomitante (ver sección 5.1). Actualmente no se dispone de datos relativos al uso concomitante con otras vacunas. No se ha evaluado la administración concurrente de ZOSTAVAX y medicaciones anti-virales de eficacia conocida frente al VVZ. 4.6 Fertilidad, embarazo y lactancia Embarazo No se han realizado estudios en mujeres embarazadas. Se desconoce también si ZOSTAVAX puede causar daño en el feto cuando se administra a mujeres embarazadas, o si puede afectar a la capacidad de reproducción. Sin embargo, se sabe que la infección por el virus varicela-zóster que ocurre de forma natural puede causar daño fetal. Como ZOSTAVAX no está indicado en individuos menores de 50 años, ZOSTAVAX no está destinado a mujeres embarazadas. En cualquier caso, se debe evitar un embarazo durante 1 mes después de la vacunación (ver sección 4.3). Lactancia No se conoce si VVZ se secreta en la leche humana. Sin embargo, como algunos virus son secretados en la leche humana, debe tenerse precaución si se administra ZOSTAVAX a mujeres en período de lactancia. Fertilidad No se ha evaluado ZOSTAVAX en estudios de fertilidad. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se espera una nula o insignificante influencia de ZOSTAVAX sobre la capacidad para conducir y utilizar máquinas. 4.8 Reacciones adversas a. Resumen del perfil de seguridad Se ha evaluado la seguridad general en ensayos clínicos con más de adultos vacunados con ZOSTAVAX. Estudio de Prevención de Herpes zóster (Estudio SPS Shingles Prevention Study) en individuos de 60 años de edad y mayores En el mayor de estos ensayos, el Estudio de Prevención de Herpes zóster (SPS), individuos recibieron una dosis única de la formulación congelada de ZOSTAVAX (n=19.270) o placebo (n=19.276) y se monitorizó la seguridad a lo largo del ensayo. Durante el ensayo, se notificaron reacciones adversas graves relacionadas con la vacuna en 2 sujetos vacunados con ZOSTAVAX (exacerbación de asma y polimialgia reumática) y en 3 sujetos que recibieron placebo (Síndrome de Goodpasture, reacción anafiláctica y polimialgia reumática). 4
5 En el Subestudio de Monitorización de Acontecimientos Adversos, se le proporcionó a un subgrupo de individuos del SPS (n=3.345 recibieron ZOSTAVAX y n=3.271 recibieron placebo) tarjetas de vacunación para registrar los acontecimientos adversos que tuvieron lugar desde el Día 0 al Día 42 después de la vacunación, además del control rutinario de seguridad que se llevó a cabo durante todo el ensayo. Las reacciones adversas en el lugar de inyección y sistémicas relacionadas con la vacuna que fueron notificadas con una incidencia significativamente mayor en el grupo de la vacuna frente al grupo del placebo en el Subestudio de Monitorización de Acontecimientos Adversos figuran en la Tabla 1. La mayoría de estas reacciones adversas fueron notificadas como de intensidad leve. La Tabla 1 también incluye acontecimientos adversos adicionales que han sido notificados espontáneamente durante el seguimiento post-comercialización. La incidencia general de las reacciones adversas en el lugar de inyección relacionadas con la vacuna fue significativamente mayor en los sujetos vacunados con ZOSTAVAX frente a los sujetos que recibieron placebo (48% en ZOSTAVAX y 17% en placebo). En el resto de sujetos del SPS se realizó una monitorización rutinaria de la seguridad, pero no se les proporcionó tarjetas de vacunación. Los tipos de acontecimientos adversos notificados en estos pacientes fueron generalmente similares a los del subgrupo de pacientes del Subestudio de Monitorización de Acontecimientos Adversos. Dentro de los 42 días del periodo de notificación post-vacunación en el SPS, el número de erupciones tipo herpes zóster notificadas entre todos los sujetos fue pequeño (17 para ZOSTAVAX, 36 para placebo; p=0,009). De estas 53 erupciones tipo herpes zóster, en 41 se obtuvieron muestras adecuadas para la prueba de PCR. Se detectó el VVZ salvaje en 25 de ellas (5 para ZOSTAVAX, 20 para placebo). La cepa Oka/Merck del VVZ no se detectó en ninguna de estas muestras. Dentro de esos mismos 42 días del periodo de notificación post-vacunación en el estudio SPS, el número (n=59) de notificaciones de erupción varicelosa también fue pequeño. De éstas, en 10 se obtuvieron muestras adecuadas para PCR. No se detectó VVZ en ninguna de estas muestras. Estudio de Eficacia y Seguridad de ZOSTAVAX (Estudio ZEST) in individuos de 50 a 59 años de edad En el estudio ZEST, los individuos recibieron una dosis única de ZOSTAVAX (n=11.184) o de placebo (n=11.212) y se hizo un seguimiento de la seguridad a lo largo del estudio. Durante el estudio se notificó un acontecimiento adverso grave relacionado con la vacuna en 1 sujeto vacunado con ZOSTAVAX (reacción anafiláctica). Todos los sujetos recibieron una tarjeta de vacunación con la finalidad de registrar los acontecimientos adversos ocurridos entre los días 1 a 42 posteriores a la vacunación, adicionalmente al seguimiento rutinario de la seguridad llevado a cabo a lo largo del estudio. En la Tabla 1 se recogen los acontecimientos adversos sistémicos y en el lugar de inyección relacionados con la vacuna que fueron notificados en el estudio ZEST. La Tabla 1 también incluye acontecimientos adversos adicionales que habían sido notificados espontáneamente durante el seguimiento post-comercialización. La incidencia global de acontecimientos adversos en el lugar de inyección relacionados con la vacuna fue significativamente mayor para los sujetos vacunados con ZOSTAVAX frente a los sujetos que recibieron placebo (63,9% para ZOSTAVAX y 14,4% para el placebo). La mayoría de estas reacciones adversas se notificaron como de intensidad leve. Dentro del periodo de notificación de 42 días tras la vacunación en el estudio ZEST, se notificaron erupciones tipo herpes zóster fuera del lugar de inyección en 34 sujetos (19 para ZOSTAVAX y 15 5
6 para el placebo). De las 24 muestras que fueron adecuadas para la prueba de la Reacción en Cadena de la Polimerasa (PCR) se detectó VVZ salvaje en 10 de estas muestras (3 para ZOSTAVAX, 7 para el placebo). No se detectó la cepa Oka/Merck del VVZ en ninguna de estas muestras. Dentro del mismo periodo de notificación de 42 días tras la vacunación en el estudio ZEST, se notificaron erupciones varicelosas en 124 sujetos (69 para ZOSTAVAX y 55 para el placebo). De 23 muestras disponibles y adecuadas para la prueba PCR, el VVZ se detectó en una de esas muestras procedente del grupo de sujetos que habían recibido ZOSTAVAX; sin embargo, la cepa del virus (salvaje o cepa Oka/Merck) no pudo ser determinada. Otros estudios Adultos sanos En los demás ensayos clínicos que respaldan la autorización inicial de la formulación congelada de ZOSTAVAX, las tasas de notificación de las erupciones tipo herpes zóster y varicelosas fuera del lugar de inyección durante los 42 días posteriores a la vacunación también fueron bajas, tanto en los vacunados como en los que recibieron placebo. De las 17 erupciones tipo herpes zóster y varicelosas fuera del lugar de inyección notificadas, en 10 casos se obtuvieron muestras adecuadas para PCR. La cepa Oka/Merck se identificó mediante análisis de PCR a partir de muestras de lesiones en sólo dos sujetos que notificaron erupción varicelosa (comienzo en Día 8 y Día 17). En otros ensayos clínicos que evaluaron ZOSTAVAX en sujetos de 50 años o mayores, incluyendo un estudio de la vacuna antigripal inactivada administrada concomitantemente, el perfil de seguridad fue generalmente similar al que se vio en el Subestudio de Monitorización de Acontecimientos Adversos del SPS. Sin embargo, en estos ensayos se notificó una tasa mayor de acontecimientos adversos en el lugar de inyección, de intensidad leve a moderada, entre los sujetos de años en comparación con sujetos > 60 años (ver sección 5.1). Los datos obtenidos de un ensayo clínico (n=368) demostraron que la actual formulación refrigerada es generalmente bien tolerada con un perfil de seguridad comparable al de la formulación congelada. En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, en el que ZOSTAVAX se administró a 100 individuos de 50 años o mayores con antecedentes de herpes zóster (HZ) antes de la vacunación, el perfil de seguridad fue generalmente similar al observado en el Subestudio de Monitorización de Acontecimientos Adversos del SPS. En base a los datos limitados obtenidos de dos ensayos clínicos que incluyeron a individuos seronegativos o con bajos títulos de anticuerpos para el VVZ (27 individuos de al menos 30 años recibieron la vacuna frente a zóster de virus vivos atenuados), las reacciones adversas sistémicas y en el lugar de inyección fueron en general similares a las notificadas por otros individuos que recibieron ZOSTAVAX en los ensayos clínicos, notificándose fiebre en 2 de los 27 individuos. Ningún individuo notificó erupciones similares a las de la varicela o a las producidas por el virus herpes zóster. No se notificaron reacciones adversas graves relacionadas con la vacuna. Adultos con tratamiento crónico/de mantenimiento con corticosteroides sistémicos En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a 206 individuos de 60 años o mayores que estuvieron recibiendo tratamiento crónico/de mantenimiento con corticosteroides sistémicos a una dosis diaria equivalente de 5 a 20 mg de prednisona desde al menos 2 semanas antes del reclutamiento y hasta 6 semanas o más después de la vacunación, con el fin de evaluar la inmunogenicidad y el perfil de seguridad de ZOSTAVAX. Los acontecimientos adversos se monitorizaron hasta el día 42 post-vacunación y los acontecimientos adversos graves durante el periodo que dura el estudio (180 días). En este ensayo clínico el perfil de seguridad fue comparable en general al observado en el Subestudio de Monitorización de Acontecimientos Adversos del SPS (ver sección 4.3 Contraindicaciones en lo relativo a corticosteroides). Adultos infectados por VIH con la función inmune inalterada 6
7 En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a adultos infectados por VIH (18 años de edad o mayores) (ver sección 5.1). 286 sujetos recibieron 2 dosis y 9 sujetos recibieron una sola dosis. Los acontecimientos adversos se monitorizaron hasta el día 42 post vacunación y los acontecimientos adversos graves durante el periodo que dura el estudio (180 días). Se notificó un caso grave de erupción maculo-papular relacionado con la vacuna en el día 4 después de la primera dosis de ZOSTAVAX. El perfil de seguridad fue, por lo general, similar al observado en el sub-estudio de monitorización de acontecimientos adversos del SPS (ver sección 4.3 relacionado con la inmunosupresión debida a VIH/SIDA). b. Resumen tabulado de acontecimientos adversos La Tabla 1 incluye las reacciones adversas en el lugar de inyección y sistémicas relacionadas con la vacuna que fueron notificadas con una incidencia significativamente mayor en el grupo de la vacuna frente al grupo del placebo en el Subestudio de Monitorización de Acontecimientos Adversos. Las reacciones adversas se clasifican en función de su frecuencia utilizando la siguiente convención: [Muy frecuentes (>1/10); Frecuentes (>1/100 a <1/10); Poco frecuentes (>1/1.000 a <1/100); Raras (>1/ a <1/1.000); Muy raras (<1/10.000)] La Tabla 1 también incluye acontecimientos adversos adicionales que han sido notificados espontáneamente durante el seguimiento post-comercialización. Debido a que estos acontecimientos se notificaron de forma voluntaria a partir de una población de tamaño indeterminado, no siempre es posible valorar de forma fiable su frecuencia ni establecer una relación causal con la exposición a la vacuna. Por lo tanto, se asigna la categoría de frecuencia No conocida a estos acontecimientos adversos. Tabla 1 Clasificación de órganos del Reacciones adversas Frecuencia sistema MedDRA Infecciones e infestaciones Varicela Herpes zóster (cepa vacunal) Muy raras Muy raras 1 Trastornos de la sangre y del Linfoadenopatía (cervical, axilar) No conocida** sistema linfático Trastornos del sistema Reacciones de hipersensibilidad incluyendo No conocida** inmunológico reacciones anafilácticas Trastornos del sistema nervioso Dolor de cabeza Frecuentes Trastornos gastrointestinales Náuseas No conocida** Trastornos de la piel y del Erupción No conocida** tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Artralgia, Mialgia No conocida** Dolor en una extremidad Frecuentes Trastornos generales y alteraciones en el lugar de administración Eritema *, Dolor/dolor al tacto *, Hinchazón *, Prurito Muy frecuentes Hematoma, Calor, Induración Frecuentes Erupción, Urticaria, Pirexia No conocida** 7
8 * Reacciones adversas de notificación solicitada en el protocolo del ensayo (en los 5 días postvacunación). ** Acontecimientos adversos post-comercialización (no se puede estimar la frecuencia a partir de los datos disponibles). Reacciones adversas en el lugar de inyección. 1 Esta reacción adversa se identificó mediante vigilancia post-comercialización pero no se observó en el programa de desarrollo clínico. La categoría de frecuencia se estimó a partir de un cálculo estadístico basado en cero casos de un número total de pacientes expuestos a Zostavax en el programa de desarrollo clínico (n > ). Notificación de sospechas de reacciones adversas: Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación, incluido en el Anexo V. 4.9 Sobredosis Se ha notificado raramente la administración de una dosis de ZOSTAVAX más alta de la recomendada y el perfil de acontecimientos adversos fue comparable al observado con la dosis recomendada de ZOSTAVAX. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Vacunas, Vacuna vírica. Código ATC: J07BK02 Mecanismo de acción Cualquiera que haya sido infectado con VVZ, incluyendo a aquéllos sin historial clínico de varicela, está en riesgo de desarrollar zóster. Este riesgo parece estar relacionado causalmente con un declive en la inmunidad específica frente a VVZ. ZOSTAVAX ha demostrado reforzar la inmunidad específica frente a VVZ, lo que se presume como mecanismo por el que protege frente a zóster y sus complicaciones (Ver Inmunogenicidad). Evaluación de la eficacia clínica proporcionada por ZOSTAVAX Estudio de Prevención de Herpes zóster (Estudio SPS Shingles Prevention Study) en individuos de 60 años de edad y mayores: ZOSTAVAX redujo significativamente el riesgo de desarrollar zóster y NPH en comparación con placebo. Además, ZOSTAVAX redujo significativamente el dolor asociado a zóster medido mediante la escala de carga de enfermedad (BOI) del dolor asociado a HZ (ver resultados y definición en la Tabla 2). Tabla 2 Eficacia de ZOSTAVAX comparada con placebo en el Estudio de Prevención de Herpes zóster (SPS) Variable Eficacia de la IC 95% vacuna* Incidencia de Zóster 51% 44 a 58% Incidencia de NPH** 67% 48 a 79% BOI del dolor asociado a HZ*** 61% 51 a 69% *Eficacia de la vacuna: reducción relativa en la medición de la variable en el grupo de vacunados 8
9 comparada con el grupo placebo. **Dolor asociado a zóster clínicamente relevante que persiste o aparece al menos 90 días después de la aparición de la erupción. ***La escala de BOI del dolor asociado a zóster es una escala combinada que incorpora la incidencia, intensidad y duración del dolor agudo y crónico asociado a zóster durante un periodo de seguimiento de 6 meses. En el Estudio de Prevención de Herpes zóster (SPS), ensayo clínico de ZOSTAVAX, doble ciego y controlado con placebo, se aleatorizaron sujetos de 60 años o mayores para recibir una dosis única de ZOSTAVAX (n= ) o placebo (n= ). ZOSTAVAX disminuyó significativamente la incidencia de zóster comparado con placebo (315 casos [5,4/1.000 personas-año] frente a 642 casos [11,1/1.000 personas-año], respectivamente; p<0,001). La eficacia protectora de ZOSTAVAX frente a zóster fue del 51% (IC 95%: [de 44 a 58%]). ZOSTAVAX redujo la incidencia de zóster en un 64% (IC 95%: [de 56 a 71%]) en individuos de años y en un 38% (IC 95%: [de 25 a 48%]) en individuos de 70 años. En el SPS, la reducción de zóster se vio en casi todos los dermatomas. Se produjo zóster oftálmico en 35 sujetos vacunados con ZOSTAVAX frente a 69 sujetos que recibieron placebo. Aparecieron problemas de visión en 2 sujetos vacunados con ZOSTAVAX frente a 9 sujetos que recibieron placebo. ZOSTAVAX redujo la incidencia de NPH comparado con placebo (27 casos [0,5/1.000 personas-año] frente a 80 casos [1,4/1.000 personas-año], respectivamente; p<0,001). En este ensayo, la definición de NPH fue dolor clínicamente significativo asociado a zóster que persiste o aparece al menos 90 días después de la aparición de la erupción. La eficacia protectora de ZOSTAVAX frente a NPH fue del 67% (IC 95%: [de 48 a 79%]). Con referencia sólo a los sujetos que desarrollaron zóster, hubo una reducción en el riesgo de desarrollar posteriormente NPH. En el grupo de la vacuna, el riesgo de desarrollar NPH después de zóster fue del 9% (27/315), mientras que en el grupo del placebo fue del 13% (80/642). Este efecto fue más destacado en el grupo de sujetos de más edad ( 70 años), donde el riesgo de desarrollar NPH después de zóster se redujo al 10% en el grupo de la vacuna frente al 19% en el grupo del placebo. ZOSTAVAX redujo la escala de BOI del dolor asociado a zóster en aproximadamente un 61% (IC 95%: [de 51 a 69%]), comparado con placebo. El efecto fue más pronunciado en el grupo de edad más joven (60 a 69 años), donde la eficacia de ZOSTAVAX en BOI del dolor asociado a zóster fue del 66% comparado con el 55% en pacientes 70 años; sin embargo, esta diferencia no fue estadísticamente significativa (p=0,266). Prevención de los casos de HZ con dolor intenso en toda la población del estudio ZOSTAVAX redujo la incidencia de zóster con dolor intenso y de larga duración (puntuación de intensidad-duración > 600) en un 73% (IC 95%: [de 46 a 87%]) comparado con placebo (11 frente a 40 casos, respectivamente). Reducción de la intensidad por duración del dolor asociado a zóster en individuos vacunados que desarrollaron zóster Con respecto al dolor agudo (dolor entre 0-30 días) no hubo diferencias estadísticamente significativas entre el grupo de la vacuna y el grupo del placebo. La escala de intensidad por duración del dolor asociado a zóster fue de 89 (IC 95%: [de 82 a 97%]) para el grupo de la vacuna frente a 92 (IC 95%: [de 87 a 97%]) para el grupo del placebo. El uso global de medicación analgésica fue similar en ambos grupos de estudio. Entre los individuos vacunados que desarrollaron NPH, ZOSTAVAX redujo significativamente el dolor (crónico) asociado a NPH comparado con placebo. En el periodo a partir de los 90 días después de la aparición de la erupción hasta el final del seguimiento, hubo una reducción del 57% en la escala de intensidad por duración (puntuación media de 347 para ZOSTAVAX y 805 para placebo; 9
10 p=0,016). Entre los individuos vacunados que desarrollaron zóster, ZOSTAVAX redujo significativamente el dolor global agudo y crónico asociado a zóster comparado con placebo. A lo largo de un periodo de 6 meses de seguimiento (agudo y crónico), hubo una reducción del 22% (p=0,008) en la puntuación de intensidad por duración y un 52% (IC 95%: [de 7 a 74%]) de reducción (desde el 6,2% al 3,5%) del riesgo de padecer HZ con dolor intenso y de larga duración (puntuación de intensidad por duración >600). Subestudio de Persistencia a Corto Plazo (Subestudio STPS - Short-term Persistence Substudy): El subestudio STPS se inició para obtener información adicional sobre la persistencia de la eficacia de la vacuna y para preservar un subgrupo de sujetos del estudio SPS para el subestudio de Persistencia a Largo Plazo (LTPS). El STPS incluyó sujetos que habían sido previamente vacunados con ZOSTAVAX y sujetos que previamente habían recibido placebo en el SPS. La edad media en el momento del reclutamiento en el STPS fue de 73,3 años. Durante el desarrollo del STPS se ofreció ZOSTAVAX a los sujetos que habían recibido placebo, momento en el que se consideró que habían completado el STPS. Los análisis de eficacia de la vacuna en el STPS se basan fundamentalmente en los datos recogidos 4 a 7 años después de la vacunación en el SPS. El seguimiento medio en el STPS fue de aproximadamente 1,2 años (rango de 1 día a 2,2 años). En el STPS hubo 84 casos de HZ evaluables [8,4/1.000 persona-año] en el grupo de ZOSTAVAX y 95 casos evaluables [14,0/1.000 persona-año] en el grupo placebo. La eficacia estimada de la vacuna durante el periodo de seguimiento del STPS fue del 40% (IC 95%: [18 a 56%]) para la incidencia de HZ, del 60% (IC 95%: [-10 a 87%]) para la incidencia de NPH y del 50% (IC 95%: [14 a 71%]) en BOI de dolor asociado a HZ. Subestudio de Persistencia a Largo Plazo (Subestudio LTPS - Long-term Persistence Substudy): Después de finalizar el STPS, el LTPS evaluó la duración de la protección frente a HZ, NPH y BOI de dolor asociado a HZ en un total de sujetos que habían sido vacunados previamente con ZOSTAVAX en el SPS. La edad media en el momento del reclutamiento para el LTPS fue de 74,5 años. En el LTPS no estuvo disponible un control con placebo simultáneo; se utilizaron datos de anteriores receptores de placebo para estimar la eficacia de la vacuna. Los análisis de eficacia de la vacuna en el LTPS se basan fundamentalmente en los datos recogidos desde el año 7 al año 10 después de la vacunación en el SPS. El seguimiento medio durante el LTPS fue de aproximadamente 3,9 años (rango de 1 semana a 4,75 años). Durante el LTPS se notificaron 263 casos de HZ evaluables en 261 pacientes [10,3/1.000 persona-año]. La eficacia estimada de la vacuna durante el periodo de seguimiento del LTPS fue del 21% (IC 95%: [11 a 30%]) para la incidencia de HZ, del 35% (IC 95%: 9 a 56%]) para la incidencia de NPH y del 37% (IC 95%: [27 a 46%]) en BOI de dolor asociado a HZ. Estudio de Eficacia y Seguridad de ZOSTAVAX (Estudio ZEST) en individuos de 50 a 59 años de edad: El Estudio de Eficacia y Seguridad de ZOSTAVAX (ZEST) fue un ensayo clínico doble ciego, controlado con placebo, en el que se aleatorizaron sujetos de 50 a 59 años para recibir una dosis única de ZOSTAVAX (n=11.211) o de placebo (n= ) y se les hizo un seguimiento en cuanto al desarrollo de zóster durante una media de 1,3 años (rango de 0 a 2 años). Todos los casos sospechosos de zóster fueron evaluados por un comité de evaluación clínica. La determinación final de los casos de zóster se realizó mediante la Reacción en Cadena de la Polimerasa (PCR) [86%], o en ausencia de detección del virus, según lo determinado por un comité de evaluación clínica [14%]. ZOSTAVAX redujo significativamente la incidencia de zóster comparado con el placebo (30 casos [2,0/1.000 persona-años] frente a 99 casos [6,6/1.000 persona-años], respectivamente; p<0,001). La eficacia protectora de ZOSTAVAX frente a zóster fue del 70% (IC 95%: [54 a 81%]. Inmunogenicidad de ZOSTAVAX 10
11 En el Estudio de Prevención de Herpes zóster (SPS), se evaluó la respuesta inmune a la vacunación en un subgrupo de los sujetos reclutados (N=1.395). ZOSTAVAX logró obtener una mayor respuesta inmune específica frente a VVZ a las 6 semanas post-vacunación comparada con placebo. Se ha demostrado un incremento, tanto en los niveles de anticuerpos frente a VVZ, medidos mediante ensayo inmunoenzimático de adsorción de glicoproteína (gpelisa) (diferencia de 1,7 veces, media geométrica de los títulos [GMT] de 479 frente a 288 unidades gpelisa/ml, p<0,001), como en la actividad de células T, medida mediante el inmunoensayo enzimático de interferón gamma (IFN- ELISPOT) (diferencia de 2,2 veces, media geométrica del recuento [GMC] de 70 frente a 32 células formadoras de manchas por millón de células mononucleares de sangre periférica [SFC/10 6 PBMCs], p<0,001). Al evaluarse a las 4 semanas post-vacunación, la inmunogenicidad de la actual formulación refrigerada estable ha demostrado ser similar a la inmunogenicidad de la anterior formulación congelada de ZOSTAVAX. Dentro del Ensayo de Eficacia y Seguridad de ZOSTAVAX (ZEST), se evaluaron las respuestas inmunes a la vacunación en una subcohorte aleatoria del 10% (n= para ZOSTAVAX y n= para el placebo) de los sujetos reclutados en el estudio ZEST. ZOSTAVAX obtuvo mayores respuestas inmunes específicas de VVZ a las 6 semanas tras la vacunación en comparación con el placebo. Se demostraron los incrementos en el nivel de anticuerpos VVZ, medidos mediante el ensayo inmunoenzimático de adsorción de glicoproteína (gpelisa) (diferencia de 2,3 veces (IC 95% [2,2; 2,4], media geométrica del título [GMT] de 664 frente a 288 unidades gpelisa/ml, p< 0,001). Inmunogenicidad después de la administración concomitante En un ensayo clínico controlado, doble ciego, 762 adultos de 50 años o mayores fueron randomizados para recibir una dosis única de ZOSTAVAX administrado bien de forma concomitante con vacuna antigripal de virus fraccionados inactivados (N=382) o no concomitante (N= 380). La respuesta de anticuerpos frente a ambas vacunas a las 4 semanas después de la vacunación fue similar, ya fueran administradas de forma concomitante o no. En un ensayo clínico controlado, doble ciego, 473 adultos a partir de 60 años fueron aleatorizados para recibir una dosis única de ZOSTAVAX administrado bien de forma concomitante con vacuna antineumocócica de polisacáridos de 23 serotipos (N=237) o no concomitante (N=236). A las 4 semanas de la administración concomitante, los niveles de anticuerpos frente a VVZ no fueron similares a los obtenidos después de la administración no concomitante (GMT de 338 frente a 484 unidades gpelisa/ml respectivamente; ratio GMT = 0,70 (IC 95%: [0,61; 0,80])). Los niveles de anticuerpos frente a VVZ a las 4 semanas de la vacunación aumentaron 1,9 veces (IC 95%: [1,7; 2,1]; cumpliendo con el criterio de aceptación preestablecido) en el grupo con administración concomitante frente a 3,1 veces (IC 95%: [2,8; 3,5]) en el grupo con administración no concomitante. Las GMT para los antígenos de la vacuna antineumocócica de polisacáridos de 23 serotipos fueron similares en los dos grupos. No hubo diferencia significativa en el perfil de seguridad entre la administración concomitante de ZOSTAVAX y la vacuna antineumocócica de polisacáridos de 23 serotipos y su administración no concomitante, salvo que el dolor de cabeza, el eritema y la hinchazón en el lugar de inyección de la vacuna antineumocócica fueron más frecuentes en el grupo con administración concomitante. Inmunogenicidad en individuos con antecedentes de herpes zóster (HZ) antes de la vacunación En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, ZOSTAVAX se administró a 100 individuos de 50 años o mayores con antecedentes de herpes zóster (HZ) antes de la vacunación para evaluar la inmunogenicidad y seguridad (ver sección 4.8) de ZOSTAVAX. ZOSTAVAX indujo una respuesta inmune específica frente a VVZ significativamente mayor, medida mediante gpelisa a las 4 semanas después de la vacunación, comparada con placebo (diferencia de 2,1 veces (IC 95%: [1,5 a 2,9]), p<0,001, GMT de 812 frente a 393 unidades gpelisa/ml). Las respuestas de anticuerpos frente a VVZ fueron generalmente similares en individuos de 50 a 59 años comparado con individuos de 60 años o mayores. Inmunogenicidad en individuos en tratamiento sistémico crónico/de mantenimiento con corticosteroides 11
12 En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a 206 individuos de 60 años o mayores que estaban recibiendo tratamiento sistémico crónico/de mantenimiento con corticosteroides a una dosis diaria equivalente de 5 a 20 mg de prednisona desde al menos 2 semanas antes del reclutamiento y hasta 6 semanas o más después de la vacunación, con el fin de evaluar la inmunogenicidad y el perfil de seguridad de ZOSTAVAX. Comparado con el placebo, ZOSTAVAX indujo una GMT de anticuerpos específicos frente a VVZ medidos por gpelisa más alta a las 6 semanas tras la vacunación (GMT de 531,1 frente a 224,3 unidades gpelisa/ml, respectivamente). El incremento de la media geométrica de la respuesta inmune después de la vacunación medida por gpelisa fue de 2,3 veces (IC 95%: [2,0 a 2,7]) comparado con 1,1 veces (IC 95%: [1,0 a 1,2]) en el grupo placebo. Inmunogenicidad en adultos infectados por VIH con la función inmune inalterada En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a adultos infectados por VIH (18 años de edad o mayores; mediana de edad 49 años) en tratamiento antirretroviral adecuado con la función inmune inalterada (Recuento de células T CD células/µl). A pesar de que ZOSTAVAX está indicado en un régimen de una única dosis, se utilizó un régimen de 2 dosis (ver sección 4.2). 286 sujetos recibieron 2 dosis y 9 sujetos recibieron una sola dosis. La respuesta de anticuerpos después de la primera y la segunda dosis fueron similares (GMT de 534,4 y 530,3 gpelisa unidades/ml, respectivamente). El incremento, en número de veces, de la media geométrica de los anticuerpos VZV, medidos por gpelisa, desde el inicio hasta la semana 6 y 12 fue de 1,78 (IC 95%: [1,64 a 1,92]) y 1,80 veces (IC 95%: [1,66 a 1,95]), respectivamente, en receptores de la vacuna (ver sección 4.3 relacionado con la inmunosupresión debida a VIH/SIDA). Revacunación La necesidad o el momento de revacunación con ZOSTAVAX no se ha determinado todavía. En un ensayo doble ciego, controlado con placebo, 98 adultos de 60 años o mayores recibieron una segunda dosis de ZOSTAVAX 42 días después de la dosis inicial; la vacuna fue generalmente bien tolerada. La frecuencia de acontecimientos adversos relacionados con la vacuna después de la segunda dosis de ZOSTAVAX fue generalmente similar a la que se vio con la primera dosis. Sujetos inmunocomprometidos La vacuna no ha sido evaluada en individuos con alteraciones de la inmunidad. 5.2 Propiedades farmacocinéticas No aplicable. 5.3 Datos preclínicos sobre seguridad No se han realizado estudios no-clínicos convencionales, pero no existen motivos de preocupación a partir de los datos no-clínicos que se consideren relevantes para la seguridad clínica, aparte de los datos incluidos en otras secciones de la Ficha Técnica. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Polvo: Sacarosa Gelatina hidrolizada Cloruro sódico Dihidrógeno fosfato potásico Cloruro potásico L-Glutamato monosódico 12
13 Fosfato disódico anhidro Hidróxido sódico (para ajustar el ph) Urea Disolvente: Agua para preparaciones inyectables 6.2 Incompatibilidades En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros en la misma jeringa. 6.3 Periodo de validez 18 meses. Después de la reconstitución, la vacuna debe utilizarse inmediatamente. Sin embargo, se ha demostrado una estabilidad de 30 minutos hasta su utilización, si se conserva entre 20º y 25ºC. 6.4 Precauciones especiales de conservación Conservar y transportar refrigerado (entre 2ºC y 8ºC). No congelar. Conservar en el embalaje original para protegerlo de la luz. Para las condiciones de conservación tras la reconstitución del medicamento, ver sección Naturaleza y contenido del envase Polvo en un vial (vidrio) con un tapón (goma de butilo) y tapa flip-off (aluminio) y disolvente en un vial (vidrio) con un tapón (goma de clorobutilo) y tapa flip-off (aluminio) en envases de 1 ó 10. Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones Evitar el contacto con desinfectantes. Para la reconstitución de la vacuna utilizar el disolvente suministrado. Cuando está reconstituido, ZOSTAVAX es un líquido de semi-turbio a traslúcido, de casi blanco a amarillo pálido. Es importante la utilización de una nueva jeringa y nueva aguja estériles para cada paciente con el fin de prevenir la transmisión de agentes infecciosos de un individuo a otro. Instrucciones para la reconstitución Extraer el contenido completo del vial de disolvente en una jeringa. Inyectar todo el disolvente en el vial de la vacuna liofilizada. Agitar suavemente para disolver completamente. Extraer el contenido completo de la vacuna reconstituida utilizando la misma jeringa. Inyectar la vacuna. Se recomienda que la vacuna sea administrada inmediatamente después de la reconstitución, para minimizar la pérdida de potencia. Deseche la vacuna reconstituida si no es utilizada en 30 minutos. No utilice la vacuna reconstituida si advierte cualquier partícula extraña o si el aspecto del disolvente 13
14 o de la vacuna reconstituida difiere de lo descrito anteriormente. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN SANOFI PASTEUR MSD SNC 162, avenue Jean Jaurès Lyon Francia 8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN EU/1/06/341/001 EU/1/06/341/ FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 23 de Mayo de 2006 Fecha de la última renovación: 23 de Mayo de FECHA DE LA REVISIÓN DEL TEXTO La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos 14
15 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de la reconstitución, 1 dosis (0,65 ml) contiene: Virus varicela-zóster 1, cepa Oka/Merck (vivos, atenuados) > UFP 2 1 Producidos en células diploides humanas (MRC-5) 2 UFP = Unidades formadoras de placa Esta vacuna puede contener trazas de neomicina. Ver secciones 4.3 y 4.4. Excipientes con efecto conocido: Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Polvo y disolvente para suspensión inyectable en jeringa precargada. El polvo es una masa compacta cristalina de color blanco o blanquecino. El disolvente es un líquido transparente incoloro. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas ZOSTAVAX está indicado para la prevención del herpes zóster ( zóster o culebrilla) y la neuralgia post-herpética (NPH) relacionada con herpes zóster. ZOSTAVAX está indicado para la inmunización de individuos de 50 años de edad o mayores. 4.2 Posología y forma de administración Posología Los individuos deben recibir una dosis única (0,65 ml) administrada subcutáneamente. Se desconoce actualmente la necesidad de una segunda dosis. Ver sección 5.1. Población pediátrica ZOSTAVAX no está indicado para la prevención de la infección primaria por el virus de la varicela (varicela) y no debe ser utilizado en niños y adolescentes. Forma de administración La vacuna ha de ser administrada por VIA SUBCUTÁNEA, preferiblemente en la región deltoidea. 15
16 No inyectar intravascularmente. Precauciones que deben tomarse antes de manipular o administrar este medicamento: ver sección 6.6. Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección Contraindicaciones Antecedentes de hipersensibilidad al principio activo o a alguno de los excipientes o a residuos en cantidades de trazas (ej. neomicina) (ver secciones 4.4 y 6.1). Estados de inmunodeficiencia primaria o adquirida debidos a afecciones tales como: leucemias agudas y crónicas; linfoma; otras enfermedades que afectan a la médula ósea o al sistema linfático; inmunosupresión debida a VIH/SIDA (ver secciones 4.8 y 5.1); deficiencias de la inmunidad celular. Terapia inmunosupresora (incluyendo altas dosis de corticosteroides). Sin embargo, ZOSTAVAX no está contraindicado en sujetos que estén recibiendo corticosteroides tópicos/inhalados o dosis bajas de corticosteroides sistémicos, o en pacientes que estén recibiendo corticoides como terapia de sustitución, por ejemplo, para la insuficiencia adrenal (ver secciones 4.8 y 5.1). Tuberculosis activa no tratada. Embarazo. Además, se debe evitar un embarazo durante 1 mes después de la vacunación (ver sección 4.6). 4.4 Advertencias y precauciones especiales de empleo Debe estar siempre disponible un tratamiento médico adecuado y supervisión para el caso de que sucediera una reacción anafiláctica/anafilactoide rara después de la administración de la vacuna, ya que existe la posibilidad de reacciones de hipersensibilidad, no sólo al principio activo, sino también a los excipientes y residuos en cantidades de trazas (por ejemplo, neomicina) presentes en la vacuna (ver secciones 4.3, 4.8 y 6.1). La alergia a neomicina generalmente se manifiesta como una dermatitis de contacto. Sin embargo, un antecedente de dermatitis de contacto debida a neomicina no es una contraindicación para recibir vacunas de virus vivos. ZOSTAVAX no está indicado para el tratamiento de zóster o de NPH. En presencia de fiebre debe considerarse un aplazamiento de la vacunación. Como con cualquier otra vacuna, la vacunación con ZOSTAVAX puede no proteger a todos los vacunados. Ver sección 5.1. No se ha establecido la seguridad y eficacia de ZOSTAVAX en adultos que se sabe que están infectados con VIH, con o sin evidencia de inmunodepresión (ver sección 4.3) sin embargo, ha finalizado un estudio de fase II de seguridad e inmunogenicidad en adultos infectados por VIH con la función inmune inalterada (Recuento de células T CD células/µl), ver secciones 4.8 y 5.1. Transmisión En los ensayos clínicos con ZOSTAVAX no se ha notificado la transmisión del virus de la vacuna. Sin embargo, la experiencia tras la comercialización de las vacunas de varicela sugiere que puede ocurrir raramente la transmisión del virus de la vacuna entre vacunados que desarrollan una erupción varicelosa y contactos susceptibles (por ejemplo, nietos pequeños susceptibles al virus varicela-zóster, VVZ). También se ha notificado la transmisión del virus de la vacuna desde vacunados frente a 16
17 varicela que no desarrollan una erupción varicelosa. Éste es un riesgo teórico de la vacunación con ZOSTAVAX. El riesgo de transmisión de virus atenuados de la vacuna desde un vacunado a un contacto susceptible debe ser sopesado frente al riesgo de desarrollar zóster natural y la potencial transmisión del VVZ salvaje a un contacto susceptible. 4.5 Interacción con otros medicamentos y otras formas de interacción ZOSTAVAX puede ser administrado de forma concomitante con vacuna antigripal inactivada mediante inyecciones separadas y en diferentes sitios del cuerpo (ver sección 5.1). ZOSTAVAX no debe administrarse de forma concomitante con la vacuna antineumocócica de polisacáridos de 23 serotipos, ya que en un ensayo clínico se observó una reducción de la inmunogenicidad de ZOSTAVAX como resultado del uso concomitante (ver sección 5.1). Actualmente no se dispone de datos relativos al uso concomitante con otras vacunas. No se ha evaluado la administración concurrente de ZOSTAVAX y medicaciones anti-virales de eficacia conocida frente al VVZ. 4.6 Fertilidad, embarazo y lactancia Embarazo No se han realizado estudios en mujeres embarazadas. Se desconoce también si ZOSTAVAX puede causar daño en el feto cuando se administra a mujeres embarazadas, o si puede afectar a la capacidad de reproducción. Sin embargo, se sabe que la infección por el virus varicela-zóster que ocurre de forma natural puede causar daño fetal. Como ZOSTAVAX no está indicado en individuos menores de 50 años, ZOSTAVAX no está destinado a mujeres embarazadas. En cualquier caso, se debe evitar un embarazo durante 1 mes después de la vacunación (ver secciones 4.3). Lactancia No se conoce si VVZ se secreta en la leche humana. Sin embargo, como algunos virus son secretados en la leche humana, debe tenerse precaución si se administra ZOSTAVAX a mujeres en período de lactancia. Fertilidad No se ha evaluado ZOSTAVAX en estudios de fertilidad. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, se espera una nula o insignificante influencia de ZOSTAVAX sobre la capacidad para conducir y utilizar máquinas. 4.8 Reacciones adversas a. Resumen del perfil de seguridad Se ha evaluado la seguridad general en ensayos clínicos con más de adultos vacunados con ZOSTAVAX. Estudio de Prevención de Herpes zóster (Estudio SPS Shingles Prevention Study) en individuos de 60 años de edad y mayores En el mayor de estos ensayos, el Estudio de Prevención de Herpes zóster (SPS), individuos recibieron una dosis única de la formulación congelada de ZOSTAVAX (n=19.270) o placebo (n=19.276) y se monitorizó la seguridad a lo largo del ensayo. Durante el ensayo, se notificaron reacciones adversas graves relacionadas con la vacuna en 2 sujetos vacunados con ZOSTAVAX 17
18 (exacerbación de asma y polimialgia reumática) y en 3 sujetos que recibieron placebo (Síndrome de Goodpasture, reacción anafiláctica y polimialgia reumática). En el Subestudio de Monitorización de Acontecimientos Adversos, se le proporcionó a un subgrupo de individuos del SPS (n=3.345 recibieron ZOSTAVAX y n=3.271 recibieron placebo) tarjetas de vacunación para registrar los acontecimientos adversos que tuvieron lugar desde el Día 0 al Día 42 después de la vacunación, además del control rutinario de seguridad que se llevó a cabo durante todo el ensayo. Las reacciones adversas en el lugar de inyección y sistémicas relacionadas con la vacuna que fueron notificadas con una incidencia significativamente mayor en el grupo de la vacuna frente al grupo del placebo en el Subestudio de Monitorización de Acontecimientos Adversos figuran en la Tabla 1. La mayoría de estas reacciones adversas fueron notificadas como de intensidad leve. La Tabla 1 también incluye los acontecimientos adversos adicionales que han sido notificados espontáneamente durante el seguimiento post-comercialización. La incidencia general de las reacciones adversas en el lugar de inyección relacionadas con la vacuna fue significativamente mayor en los sujetos vacunados con ZOSTAVAX frente a los sujetos que recibieron placebo (48% en ZOSTAVAX y 17% en placebo). En el resto de sujetos del SPS se realizó una monitorización rutinaria de la seguridad, pero no se les proporcionó tarjetas de vacunación. Los tipos de acontecimientos adversos notificados en estos pacientes fueron generalmente similares a los del subgrupo de pacientes del Subestudio de Monitorización de Acontecimientos Adversos. Dentro de los 42 días del periodo de notificación post-vacunación en el SPS, el número de erupciones tipo herpes zóster notificadas entre todos los sujetos fue pequeño (17 para ZOSTAVAX, 36 para placebo; p=0,009). De estas 53 erupciones tipo herpes zóster, en 41 se obtuvieron muestras adecuadas para la prueba de PCR. Se detectó el VVZ salvaje en 25 de ellas (5 para ZOSTAVAX, 20 para placebo). La cepa Oka/Merck del VVZ no se detectó en ninguna de estas muestras. Dentro de esos mismos 42 días del periodo de notificación post-vacunación en el estudio SPS, el número (n=59) de notificaciones de erupción varicelosa también fue pequeño. De éstas, en 10 se obtuvieron muestras adecuadas para PCR. No se detectó VVZ en ninguna de estas muestras. Estudio de Eficacia y Seguridad de ZOSTAVAX (Estudio ZEST) in individuos de 50 a 59 años de edad En el estudio ZEST, los individuos recibieron una dosis única de ZOSTAVAX (n=11.184) o de placebo (n=11.212) y se hizo un seguimiento de la seguridad a lo largo del estudio. Durante el estudio se notificó un acontecimiento adverso grave relacionado con la vacuna en 1 sujeto vacunado con ZOSTAVAX (reacción anafiláctica). Todos los sujetos recibieron una tarjeta de vacunación con la finalidad de registrar los acontecimientos adversos ocurridos entre los días 1 a 42 posteriores a la vacunación, adicionalmente al seguimiento rutinario de la seguridad llevado a cabo a lo largo del estudio. En la Tabla 1 se recogen los acontecimientos adversos sistémicos y en el lugar de inyección relacionados con la vacuna que fueron notificados en el estudio ZEST. La Tabla 1 también incluye acontecimientos adversos adicionales que habían sido notificados espontáneamente durante el seguimiento post-comercialización. La incidencia global de acontecimientos adversos en el lugar de inyección relacionados con la vacuna fue significativamente mayor para los sujetos vacunados con ZOSTAVAX frente a los sujetos que recibieron placebo (63,9% para ZOSTAVAX y 14,4% para el placebo). La mayoría de estas reacciones adversas se notificaron como de intensidad leve. 18
19 Dentro del periodo de notificación de 42 días tras la vacunación en el estudio ZEST, se notificaron erupciones tipo herpes zóster fuera del lugar de inyección en 34 sujetos (19 para ZOSTAVAX y 15 para el placebo). De las 24 muestras que fueron adecuadas para la prueba de la Reacción en Cadena de la Polimerasa (PCR) se detectó VVZ salvaje en 10 de estas muestras (3 para ZOSTAVAX, 7 para el placebo). No se detectó la cepa Oka/Merck del VVZ en ninguna de estas muestras. Dentro del mismo periodo de notificación de 42 días tras la vacunación en el estudio ZEST, se notificaron erupciones varicelosas en 124 sujetos (69 para ZOSTAVAX y 55 para el placebo). De 23 muestras disponibles y adecuadas para la prueba PCR, el VVZ se detectó en una de esas muestras procedente del grupo de sujetos que habían recibido ZOSTAVAX; sin embargo, la cepa del virus (salvaje o cepa Oka/Merck) no pudo ser determinada. Otros estudios Adultos sanos En los demás ensayos clínicos que respaldan la autorización inicial de la formulación congelada de ZOSTAVAX, las tasas de notificación de las erupciones tipo herpes zóster y varicelosas fuera del lugar de inyección durante los 42 días posteriores a la vacunación también fueron bajas, tanto en los vacunados como en los que recibieron placebo. De las 17 erupciones tipo herpes zóster y varicelosas fuera del lugar de inyección notificadas, en 10 casos se obtuvieron muestras adecuadas para PCR. La cepa Oka/Merck se identificó mediante análisis de PCR a partir de muestras de lesiones en sólo dos sujetos que notificaron erupción varicelosa (comienzo en Día 8 y Día 17). En otros ensayos clínicos que evaluaron ZOSTAVAX en sujetos de 50 años o mayores, incluyendo un estudio de la vacuna antigripal inactivada administrada concomitantemente, el perfil de seguridad fue generalmente similar al que se vio en el Subestudio de Monitorización de Acontecimientos Adversos del SPS. Sin embargo, en estos ensayos se notificó una tasa mayor de acontecimientos adversos en el lugar de inyección, de intensidad leve a moderada, entre los sujetos de años en comparación con sujetos > 60 años (ver sección 5.1). Los datos obtenidos de un ensayo clínico (n=368) demostraron que la actual formulación refrigerada es generalmente bien tolerada con un perfil de seguridad comparable al de la formulación congelada. En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, en el que ZOSTAVAX se administró a 100 individuos de 50 años o mayores con antecedentes de herpes zóster (HZ) antes de la vacunación, el perfil de seguridad fue generalmente similar al observado en el Subestudio de Monitorización de Acontecimientos Adversos del SPS. En base a los datos limitados obtenidos de dos ensayos clínicos que incluyeron a individuos seronegativos o con bajos títulos de anticuerpos para el VVZ (27 individuos de al menos 30 años recibieron la vacuna frente a zóster de virus vivos atenuados), las reacciones adversas sistémicas y en el lugar de inyección fueron en general similares a las notificadas por otros individuos que recibieron ZOSTAVAX en los ensayos clínicos, notificándose fiebre en 2 de los 27 individuos. Ningún individuo notificó erupciones similares a las de la varicela o a las producidas por el virus herpes zóster. No se notificaron reacciones adversas graves relacionadas con la vacuna. Adultos con tratamiento crónico/de mantenimiento con corticosteroides sistémicos En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a 206 individuos de 60 años o mayores que estuvieron recibiendo tratamiento crónico/de mantenimiento con corticosteroides sistémicos a una dosis diaria equivalente de 5 a 20 mg de prednisona desde al menos 2 semanas antes del reclutamiento y hasta 6 semanas o más después de la vacunación, con el fin de evaluar la inmunogenicidad y el perfil de seguridad de ZOSTAVAX. Los acontecimientos adversos se monitorizaron hasta el día 42 post-vacunación y los acontecimientos adversos graves durante el periodo que dura el estudio (180 días). En este ensayo clínico el perfil de seguridad fue comparable en general al observado en el Subestudio de Monitorización de Acontecimientos Adversos del SPS (ver sección 4.3 Contraindicaciones en lo relativo a corticosteroides). 19
20 Adultos infectados por VIH con la función inmune inalterada En un ensayo clínico aleatorizado, doble ciego, controlado con placebo, se administró ZOSTAVAX a adultos infectados por VIH (18 años de edad o mayores) (ver sección 5.1). 286 sujetos recibieron 2 dosis y 9 sujetos recibieron una sola dosis. Los acontecimientos adversos se monitorizaron hasta el día 42 post vacunación y los acontecimientos adversos graves durante el periodo que dura el estudio (180 días). Se notificó un caso grave de erupción maculo-papular relacionado con la vacuna en el día 4 después de la primera dosis de ZOSTAVAX. El perfil de seguridad fue, por lo general, similar al observado en el sub-estudio de monitorización de acontecimientos adversos del SPS (ver sección 4.3 relacionado con la inmunosupresión debida a VIH/SIDA). b. Resumen tabulado de acontecimientos adversos La Tabla 1 incluye las reacciones adversas en el lugar de inyección y sistémicas relacionadas con la vacuna que fueron notificadas con una incidencia significativamente mayor en el grupo de la vacuna frente al grupo del placebo en el Subestudio de Monitorización de Acontecimientos Adversos. Las reacciones adversas se clasifican en función de su frecuencia utilizando la siguiente convención: [Muy frecuentes (>1/10); Frecuentes (>1/100 a <1/10); Poco frecuentes (>1/1.000 a <1/100); Raras (>1/ a <1/1.000); Muy raras (<1/10.000)] La Tabla 1 también incluye acontecimientos adversos adicionales que han sido notificados espontáneamente durante el seguimiento post-comercialización. Debido a que estos acontecimientos se notificaron de forma voluntaria a partir de una población de tamaño indeterminado, no siempre es posible valorar de forma fiable su frecuencia ni establecer una relación causal con la exposición a la vacuna. Por lo tanto, se asigna la categoría de frecuencia No conocida a estos acontecimientos adversos. Tabla 1 Clasificación de órganos del Reacciones adversas Frecuencia sistema MedDRA Infecciones e infestaciones Varicela Herpes zóster (cepa vacunal) Muy raras Muy raras 1 Trastornos de la sangre y del Linfoadenopatía (cervical, axilar) No conocida** sistema linfático Trastornos del sistema Reacciones de hipersensibilidad incluyendo No conocida** inmunológico reacciones anafilácticas Trastornos del sistema nervioso Dolor de cabeza Frecuentes Trastornos gastrointestinales Náuseas No conocida** Trastornos de la piel y del Erupción No conocida** tejido subcutáneo Trastornos musculoesqueléticos y del tejido conjuntivo Artralgia, Mialgia No conocida** Dolor en una extremidad Frecuentes Trastornos generales y alteraciones en el lugar de administración Eritema *, Dolor/dolor al tacto *, Hinchazón *, Prurito Muy frecuentes Hematoma, Calor, Induración Frecuentes Erupción, Urticaria, Pirexia No conocida** 20
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
FICHA TÉCNICA. Polisacárido capsular Vi purificado de Salmonella typhi (cepa Ty2)...25 microgramos
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA. STREPSILS pastillas para chupar sabor miel y limón
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA. Pastillas circulares de color rosa con sabor a fresa y el icono de Strepsils grabado en ambos lados.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA. Excipientes con efecto conocido: 1,38 g de sacarosa y 1,10 g de glucosa.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
Prospecto: información para el usuario
 Prospecto: información para el usuario ZOSTAVAX Polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos) Lea todo el prospecto detenidamente antes
Prospecto: información para el usuario ZOSTAVAX Polvo y disolvente para suspensión inyectable en jeringa precargada Vacuna frente a herpes zóster (virus vivos) Lea todo el prospecto detenidamente antes
ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER. Inyectable para administración subcutánea
 ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER Inyectable para administración subcutánea INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FORMULA CUALI-CUANTITATIVA: ZOSTAVAX es una
ZOSTAVAX VACUNA CON VIRUS VIVOS ATENUADOS (OKA/ MERCK) DEL HERPES ZOSTER Inyectable para administración subcutánea INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FORMULA CUALI-CUANTITATIVA: ZOSTAVAX es una
Vacunas Varicela- Herpes Zoster. Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC
 Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SUVAXYN MH-ONE (todos los países excepto Francia y Dinamarca) Emulsión inyectable para cerdos Suvaxyn M. Hyo Mono
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SUVAXYN MH-ONE (todos los países excepto Francia y Dinamarca) Emulsión inyectable para cerdos Suvaxyn M. Hyo Mono
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VERSICAN DHPPi/L3R, liofilizado y disolvente para suspensión inyectable para perros.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSICAN DHPPi/L3R, liofilizado y disolvente para suspensión inyectable para perros. 2. COMPOSICIÓN CUALITATIVA Y
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSICAN DHPPi/L3R, liofilizado y disolvente para suspensión inyectable para perros. 2. COMPOSICIÓN CUALITATIVA Y
FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Parvoduk suspensión y disolvente para suspensión inyectable para patos de Berbería 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Parvoduk suspensión y disolvente para suspensión inyectable para patos de Berbería 2. COMPOSICIÓN
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TECNICA. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
POLIOMIELITIS INTRODUCCIÓN INDICACIONES
 POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
ASPECTOS GENERALES SOBRE VACUNACIÓN
 Qué es la vacunación? La vacunación es el proceso que tiene por objetivo conseguir una respuesta inmunitaria o protección frente a una enfermedad determinada mediante la administración de una vacuna. Es
Qué es la vacunación? La vacunación es el proceso que tiene por objetivo conseguir una respuesta inmunitaria o protección frente a una enfermedad determinada mediante la administración de una vacuna. Es
Anexo III. Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto
 Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/5 1. NOMBRE DEL MEDICAMENTO VETERINARIO AVINEW 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Virus vivo de la enfermedad de Newcastle, cepa VG/GA, como mínimo:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/5 1. NOMBRE DEL MEDICAMENTO VETERINARIO AVINEW 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Virus vivo de la enfermedad de Newcastle, cepa VG/GA, como mínimo:
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS
 ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
Varicela 1. Agente inmunizante 2. Conservación
 Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
FICHA TÉCNICA. Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125 g Lisozima hidrocloruro...0,100 g Neomicina (sulfato)...
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO RINO DEXA gotas nasales en solución. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen: Dexametasona fosfato de sodio... 0,050 g Clorfenamina maleato...0,125
PROSPECTO: INFORMACIÓN PARA EL USUARIO. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
FICHA TÉCNICA. Nota: La utilización de Priorix debe realizarse de acuerdo a las recomendaciones oficiales.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
FICHA TÉCNICA. Adsorbido en hidróxido de aluminio hidratado Total: 0,50 mg Al 3+ Una dosis (0,5 ml) de Havrix 720 contiene: 720 Unidades ELISA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
MÁS QUE UN ESTORNUDO. Preguntas más frecuentes. Con la colaboración de: + que un estornud. www.masqueunestornudo.es. www.portalfarma.
 MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
FICHA TÉCNICA. STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STAMARIL, polvo y disolvente para suspensión inyectable en jeringa precargada. Vacuna (viva) frente a la fiebre amarilla. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. Glucosa
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
FICHA TÉCNICA. * cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTÍCAS DEL PRODUCTO 0 1. NOMBRE DEL MEDICAMENTO VIRGAN 1,5 mg/g gel oftálmico 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 1g de gel contiene 1,5 mg de ganciclovir
PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado)
 1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
1. NOMBRE DEL MEDICAMENTO PANENZA suspensión inyectable en vial multidosis Vacuna antigripal pandémica (H1N1) (virus fraccionado inactivado) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la gripe*
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Calcitonina Almirall 100 UI Solución inyectable Calcitonina sintética de salmón
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lote 5: 3.000 vacunas contra la Meningitis Tetravalente ACWY
 PLIEGO DE PRESCRIPCIONES TÉCNICAS PARA LA CONTRATACIÓN DEL SUMINISTRO DE VACUNAS CON DESTINO AL CENTRO DE SALUD INTERNACIONAL, PERTENECIENTE AL INSTITUTO DE SALUD PÚBLICA DEL ORGANISMO AUTÓNOMO MADRID
PLIEGO DE PRESCRIPCIONES TÉCNICAS PARA LA CONTRATACIÓN DEL SUMINISTRO DE VACUNAS CON DESTINO AL CENTRO DE SALUD INTERNACIONAL, PERTENECIENTE AL INSTITUTO DE SALUD PÚBLICA DEL ORGANISMO AUTÓNOMO MADRID
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO ZOSTAVAX polvo y disolvente para suspensión inyectable Vacuna frente a herpes zóster (virus vivos) 2. COMPOSICIÓN
BUCOMAX Pastillas para chupar sabor menta
 BUCOMAX Pastillas para chupar sabor menta PROSPECTO Bucomax pastillas para chupar sabor menta Amilmetacresol / alcohol 2,4- diclorobencílico Lea todo el prospecto detenidamente antes de empezar a tomar
BUCOMAX Pastillas para chupar sabor menta PROSPECTO Bucomax pastillas para chupar sabor menta Amilmetacresol / alcohol 2,4- diclorobencílico Lea todo el prospecto detenidamente antes de empezar a tomar
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG.
 1. NOMBRE DEL MEDICAMENTO GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada sobre contiene 1.500 mg de glucosamina sulfato como 1.884 mg de glucosamina
1. NOMBRE DEL MEDICAMENTO GLUCOSAMINA NORMON 1500 mg Polvo para solución oral EFG. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada sobre contiene 1.500 mg de glucosamina sulfato como 1.884 mg de glucosamina
VACUNACIÓN del personal sanitario
 VACUNACIÓN del personal sanitario 21 INTRODUCCIÓN El personal que trabaja en el ámbito sanitario constituye un grupo de riesgo de adquisición y de transmisión de determinadas enfermedades infecciosas,
VACUNACIÓN del personal sanitario 21 INTRODUCCIÓN El personal que trabaja en el ámbito sanitario constituye un grupo de riesgo de adquisición y de transmisión de determinadas enfermedades infecciosas,
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Por dosis de 0,4 ml de vacuna reconstituida con el diluyente (agua para preparaciones inyectables):
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac KC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 0,4 ml de vacuna reconstituida con el diluyente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobivac KC 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 0,4 ml de vacuna reconstituida con el diluyente
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
Algunas personas infectadas no parecen estar enfermas, pero igual pueden transmitir el microbio a otros.
 Vacuna Contra el Tifus Vivo (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La vacuna
Vacuna Contra el Tifus Vivo (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La vacuna
Vacuna triple vírica (sarampión, rubeola, parotiditis)
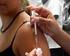 Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Tuberculosis Hospital Event
 Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL
 INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL Desde la perspectiva de Salud Pública, disminuir la incidencia y/o prevenir enfermedades como el cáncer de cuello de útero, producido
INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL Desde la perspectiva de Salud Pública, disminuir la incidencia y/o prevenir enfermedades como el cáncer de cuello de útero, producido
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014
 ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014 La influenza es una de las 15 enfermedades objetivo del Plan Nacional de Inmunizaciones del Ministerio de Salud de Chile. La vacunación anti-influenza
ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014 La influenza es una de las 15 enfermedades objetivo del Plan Nacional de Inmunizaciones del Ministerio de Salud de Chile. La vacunación anti-influenza
Qué es la tarjeta amarilla?
 Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
No lo dude, la vacunación es la prevención más efectiva contra la gripe. Prevenir la gripe es más simple de lo que usted piensa
 No lo dude, la vacunación es la prevención más efectiva contra la gripe Prevenir la gripe es más simple de lo que usted piensa Arriesgarse a contraer la gripe o vacunarse? Qué es la gripe? La gripe es
No lo dude, la vacunación es la prevención más efectiva contra la gripe Prevenir la gripe es más simple de lo que usted piensa Arriesgarse a contraer la gripe o vacunarse? Qué es la gripe? La gripe es
. Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje.
 . Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje. GMSI C/09 Las vacunaciones recomendadas para destinos
. Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje. GMSI C/09 Las vacunaciones recomendadas para destinos
Terapia de reposición en adultos y niños en síndromes de inmunodeficiencia primaria tales como:
 1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
1. NOMBRE DEL MEDICAMENTO IGAMPLIA 160 mg/ml SOLUCIÓN INYECTABLE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 320 mg/2 ml 800 mg/5 ml Inmunoglobulina humana normal (Proteínas humanas (Proporción
Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina)
 1. DENOMINACIÓN DEL MEDICAMENTO Glucomed 625 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina) Para la lista
1. DENOMINACIÓN DEL MEDICAMENTO Glucomed 625 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 625 mg de glucosamina (en forma de hidrocloruro de glucosamina) Para la lista
1. QUÉ ES VACUNA ANTIGRIPAL POLIVALENTE LETI, VIRUS FRACCIONADOS Y PARA QUÉ SE UTILIZA
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Vacuna Antigripal Polivalente LETI, Virus Fraccionados Suspensión Inyectable en Jeringa Precargada Vacuna antigripal (virus fraccionados, inactivados) Lea todo el
PROSPECTO: INFORMACIÓN PARA EL USUARIO Vacuna Antigripal Polivalente LETI, Virus Fraccionados Suspensión Inyectable en Jeringa Precargada Vacuna antigripal (virus fraccionados, inactivados) Lea todo el
FICHA TÉCNICA. Carbocisteína 50 mg
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO cinfamucol carbocisteína 50 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Carbocisteína 50 mg Excipientes: maltitol líquido (E-965):
FICHA TECNICA. Alivio local de los síntomas ocasionados por el herpes labial, tales como: picor, escozor u hormigueo.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
agencia española de medicamentos y productos sanitarios FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Maynar Labial 50 mg/g crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo contiene: Aciclovir (DOE)
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zulex 333 mg Comprimidos recubiertos Acamprosato
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
FICHA TÉCNICA. Esta vacuna puede contener una cantidad residual de neomicina (ver secciones 4.3 y 4.4).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Varivax polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de su reconstitución,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Varivax polvo y disolvente para suspensión inyectable [Vacuna antivaricela (virus vivos)] 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Después de su reconstitución,
Las infecciones de transmisión sexual. Generalitat de Catalunya Diseño: WHADS ACCENT. Sífilis. Preguntas y respuestas
 Las infecciones de transmisión sexual Generalitat de Catalunya Diseño: WHADS ACCENT Sífilis Preguntas y respuestas Qué es la sífilis? Es una infección causada por la bacteria Treponema pallidum, y forma
Las infecciones de transmisión sexual Generalitat de Catalunya Diseño: WHADS ACCENT Sífilis Preguntas y respuestas Qué es la sífilis? Es una infección causada por la bacteria Treponema pallidum, y forma
15 Respuestas Acerca de La Influenza (la gripe)
 15 Respuestas Acerca de La Influenza (la gripe) (Todo lo que necesita saber para participar en la discusión) Compromiso Público Acerca de la Influenza Influenza (la gripe) 1. Qué es la influenza (la gripe)?
15 Respuestas Acerca de La Influenza (la gripe) (Todo lo que necesita saber para participar en la discusión) Compromiso Público Acerca de la Influenza Influenza (la gripe) 1. Qué es la influenza (la gripe)?
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Proteq West Nile suspensión inyectable para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Proteq West Nile suspensión inyectable para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO HBVAXPRO 5 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO HBVAXPRO 5 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y
PROTOCOLO DE VACUNACION DE PACIENTES CON PSORIASIS
 Hospital PROTOCOLO DE VACUNACION DE PACIENTES CON PSORIASIS Los pacientes con psoriasis tienen un mayor riesgo de infecciones asociado tanto a la disregulacion inmune endógena generada por su enfermedad
Hospital PROTOCOLO DE VACUNACION DE PACIENTES CON PSORIASIS Los pacientes con psoriasis tienen un mayor riesgo de infecciones asociado tanto a la disregulacion inmune endógena generada por su enfermedad
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Sustancias activas: Virus RSB, cepa EV908, inactivado mínimo 10 5,5 *
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BOVIPAST RSP, suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BOVIPAST RSP, suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS
 VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS VICTRELIS (BOCEPREVIR): INTERACCIÓN CON LOS INHIBIDORES DE LA PROTEASA DEL VIH ATAZANAVIR, DARUNAVIR Y LOPINAVIR Fecha de
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS VICTRELIS (BOCEPREVIR): INTERACCIÓN CON LOS INHIBIDORES DE LA PROTEASA DEL VIH ATAZANAVIR, DARUNAVIR Y LOPINAVIR Fecha de
vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida)
 EMA/90006/2015 EMEA/H/C/001104 Resumen del EPAR para el público general vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida) El presente documento resume el Informe Público Europeo de
EMA/90006/2015 EMEA/H/C/001104 Resumen del EPAR para el público general vacuna antineumocócica polisacárida conjugada (13-valente, adsorbida) El presente documento resume el Informe Público Europeo de
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Dexametasona (Para Náuseas y Vómitos: Por vía oral/por Inyección)
 Dexametasona (Para Náuseas y Vómitos: Por vía oral/por Inyección) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
Dexametasona (Para Náuseas y Vómitos: Por vía oral/por Inyección) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II
 EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II MBE Cáncer de cuello uterino y VPH CA de cérvix: Segundo tipo de CA en las mujeres. Principal causa de muerte por
EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II MBE Cáncer de cuello uterino y VPH CA de cérvix: Segundo tipo de CA en las mujeres. Principal causa de muerte por
FICHA TÉCNICA. Glucosamina Teva 1.500 mg polvo para solución oral EFG
 1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
1.- NOMBRE DEL MEDICAMENTO FICHA TÉCNICA Glucosamina Teva 1.500 mg polvo para solución oral EFG 2.- COMPOSICION CUANTITATIVA-CUALITATIVA Cada sobre contiene 1.500 mg de sulfato de glucosamina como 1.990
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Autor: Dres. Freynhagen R, Serpell M, Latymer M y colaboradores Fuente: SIIC Pain Practice 1-11, Nov 2013. Introducción y objetivos
 Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria
 TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
FICHA TÉCNICA. Cantidad: Los ingredientes activos en 1 ml de VITALIPID INFANTIL corresponden a:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO VITALIPID INFANTIL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de VITALIPID INFANTIL contiene: Principios activos: Retinolpalmitato (equivalente a Retinol 69
GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE
 FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
EVALUACIÓN DE LOS FACTORES DE RIESGOS
 EVALUACIÓN DE LOS FACTORES DE RIESGOS La Ley 31/1995, de 8 de noviembre, de prevención de Riesgos Laborales, publicada en el B.O.E. del 10 de noviembre de 1995, establece, en su artículo 16 la obligación
EVALUACIÓN DE LOS FACTORES DE RIESGOS La Ley 31/1995, de 8 de noviembre, de prevención de Riesgos Laborales, publicada en el B.O.E. del 10 de noviembre de 1995, establece, en su artículo 16 la obligación
Prospecto: información para el usuario. DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral)
 Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Prospecto: información para el usuario DUKORAL suspensión y granulado efervescente para suspensión oral Vacuna para el cólera (inactivada, oral) Lea todo el prospecto detenidamente antes de empezar a usar
Herpes zóster. Este sumario le enseñará sobre el herpes zoster, sus causas, síntomas, complicaciones, diagnóstico, y tratamiento.
 Herpes zóster Introducción El herpes zóster es una enfermedad que causa dolor y ampollas graves en la cara o el cuerpo. Millones de personas se ven afectadas cada año por el herpes zóster. El herpes zoster
Herpes zóster Introducción El herpes zóster es una enfermedad que causa dolor y ampollas graves en la cara o el cuerpo. Millones de personas se ven afectadas cada año por el herpes zóster. El herpes zoster
