INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA (7-ABRIL-2008)
|
|
|
- María Carmen Castellanos Gómez
- hace 8 años
- Vistas:
Transcripción
1 Centro de Información de Medicamentos Servicio de Farmacia INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA (7-ABRIL-2008) DATOS DEL SOLICITANTE Dra. Blanca Nalla Gutiérrez del Servicio de Neurología solicita la inclusión de Natalizumab para la indicación: - Esclerosis múltiple 2ª línea o agresiva DATOS DEL MEDICAMENTO DCI: NATALIZUMAB Grupo terapéutico: Forma farmacéutica: L04AA INMUNOSUPRESORES SELECTIVOS Vial, concentrado de solución para perfusión Composición por unidad: Natalizumab: 300mg Excipientes: Fosfato monobásico de sodio monohidrato Fosfato dibásico de sodio heptahidrato Cloruro sódico Polisorbato 80 (E433) Agua para preparaciones inyectables Presentaciones comerciales: Código Nacional Nombre comercial Dosificación Laboratorio PVL + 4% IVA TYSABRI 300MG BIOGEN IDEC IBERIA, S.L FARMACOLOGÍA expresa en el parénquima del encéfalo, sin Acción farmacológica: Natalizumab es un inmunomodulador, anticuerpo monoclonal, anti-integrina que previene la migración de los leucocitos (excepto neutrófilos) a través del endotelio al parénquima inflamado mediante su unión a la subunidad alfa-4 de las integrinas de superficie, y la inflamación mediada por la unión de la misma subunidad a sus receptores diana, entre los que se encuentra la molécula de adhesión celular vascular-1 (VCAM- 1). En condiciones normales, la VCAM-1 no se embargo en la esclerosis múltiple (EM), la interacción de alfa-4-beta-1 con la VCAM-1, el CS-1 y la osteopontina constituyen el mecanismo de mediación de la migración y la firme adhesión de los leucocitos al parénquima encefálico y puede perpetuar la cascada inflamatoria. El bloqueo de las interacciones moleculares de alfa- 4-beta-1 con sus dianas reduce la actividad inflamatoria presente en el encéfalo en la EM e inhibe el reclutamiento de nuevas células inmunes y su migración al tejido inflamado, CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 1
2 reduciendo así la formación o la extensión de lesiones de EM. Indicaciones clínicas autorizadas: TYSABRI está indicado como tratamiento modificador de la enfermedad en monoterapia en la esclerosis múltiple remitente recidivante muy activa para los siguientes grupos de pacientes: - Pacientes con elevada actividad de la enfermedad a pesar del tratamiento con un interferón beta - Pacientes con esclerosis múltiple remitente recidivante grave de evolución rápida Farmacocinética : Tras la administración repetida por vía intravenosa de una dosis de 300 mg de natalizumab a pacientes con EM, la Cmax observada fue 110 ± 52 µg/ml. La media de las concentraciones promedio de natalizumab en el estado de equilibrio durante el periodo de administración osciló entre 23 µg/ml y 29 µg/ml. El tiempo previsto hasta alcanzar el estado de equilibrio fue de aproximadamente 36 semanas. Posología: Vía intravenosa, Adultos: 300 mg por perfusión intravenosa una vez cada 4 semanas. NORMAS PARA LA CORRECTA ADMINISTRACIÓN - Una vez efectuada la dilución, la solución para perfusión se administrará durante un periodo aproximado de 1 hora y los pacientes deberán estar bajo observación durante la perfusión y durante 1 hora después de finalizada ésta, para detectar posibles signos y síntomas de reacciones de hipersensibilidad. No debe administrarse mediante inyección en embolada. - Los pacientes pueden cambiar directamente de interferón beta o de acetato de glatirámero a natalizumab, siempre que no haya signos de anomalías relevantes relacionadas con el tratamiento, como neutropenia. Si existen signos de anomalías relacionadas con el tratamiento, éstas deberán normalizarse antes de iniciar el tratamiento con natalizumab. Interacciones: - Combinación con interferones beta o con acetato de glatirámero. - Combinación con inmunosupresores Contraindicaciones : - Hipersensibilidad a natalizumab o a alguno de los excipientes. - Historia o presencia de Leucoencefalopatía Multifocal Progresiva (LMP). - Neoplasias malignas activas conocidas, excepto en pacientes con carcinoma basocelular de la piel. Precauciones - Leucoencefalopatía multifocal progresiva (LMP) El uso de natalizumab se ha asociado a un incremento del riesgo de LMP, una infección viral oportunista del cerebro, que puede ocasionar morbilidad severa o la muerte. Si aparecen síntomas neurológicos, deberá interrumpirse la administración hasta que se haya descartado una LMP. El médico deberá evaluar al paciente para determinar si los síntomas son indicativos de disfunción neurológica y, si es así, si estos síntomas son típicos de la EM o posiblemente indicativos de LMP. El médico debe estar especialmente alerta a los síntomas indicativos de LMP que el paciente puede no advertir (p.ej. síntomas cognitivos o CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 2
3 psiquiátricos). Si un paciente presenta cortos de corticosteroides en combinación LMP, deberá suspenderse con este medicamento. permanentemente la administración de este medicamento. Reacciones adversas: - Infecciones oportunistas Las reacciones se comunican usando los Se han detectado otras infecciones términos recomendados en la clasificación oportunistas en pacientes con EM primaria de órganos y sistemas MedDRA. Las tratados con natalizumab en monoterapia, algunas de ellas pueden ser graves. Los médicos responsables de la prescripción deben tener en cuenta la posibilidad de frecuencias se definen como sigue: Frecuentes (> 1/100, < 1/10), poco frecuentes (> 1/1.000, < 1/100). Las reacciones adversas se presentan en orden que aparezcan infecciones oportunistas decreciente de gravedad dentro de cada durante el tratamiento. Si un paciente frecuencia. tratado con natalizumab presenta una Infecciones e infestaciones: infección urinaria y infección oportunista, deberá nasofaringitis (frecuentes). suspenderse permanentemente la Trastornos del sistema inmunológico: Urticaria administración. (frecuente), hipersensibilidad (poco frecuente). - Tratamiento concomitante o previo con Trastornos del sistema nervioso: mareo y cefalea inmunodepresores/ inmunomoduladores (frecuentes). El uso concomitante con fármacos Trastornos gastrointestinales: vómitos y náuseas inmunodepresores o antineoplásicos (frecuentes). puede incrementar el riesgo de Trastornos del sistema musculoesquelético y infecciones, incluidas las infecciones tejido conjuntivo: dolor osteomuscular (frecuente). oportunistas, por lo que no está Trastornos generales: temblor, fiebre y astenia recomendado. Los pacientes con (frecuente). antecedentes de tratamiento con Reacciones a la perfusión. fármacos inmunodepresores, incluidas la Los acontecimientos comunicados con más ciclofosfamida y la mitoxantrona, pueden frecuencia con el natalizumab que con el placebo experimentar una inmunodepresión fueron mareo, náuseas, urticaria y temblores. prolongada y, por consiguiente, pueden presentar un aumento del riesgo de LMP. Debe tenerse precaución en los pacientes Advertencias especiales: que hayan recibido previamente Consejos al paciente: inmunodepresores a fin de dejar - Este medicamento tiene que ser administrado transcurrir el tiempo suficiente para que por vía intravenosa por personal cualificado y en se recupere la función inmunitaria. No las instalaciones sanitarias apropiadas bajo obstante, en ensayos clínicos en Fase 3 supervisión médica especializada. de la EM, el tratamiento concomitante de las recidivas con corticoides durante -Advierta a su médico si está tomando otros fármacos inmunosupresores como interferón beta ciclos cortos no se asoció a un o corticosteroides. incremento de la frecuencia de -Advierta a su médico si está embarazada o infecciones. Pueden utilizarse ciclos pudiera estarlo, o está en periodo de lactancia. CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 3
4 -Avise a su médico si experimenta un empeoramiento de la enfermedad, o presenta nuevos síntomas neurológicos, así como dolores de cabeza, problemas de memoria, problemas de visión o habla, debilidad muscular o torpeza. -Póngase en contacto inmediatamente con su médico si presenta alguno de los siguientes efectos adversos: síntomas alérgicos y dificultad para respirar; dolor en el pecho y taquicardias; coloración amarilla de la piel; quemazón al orinar y cambios en la cantidad de orina. estos acontecimientos hay que evaluar la presencia de anticuerpos, y si éstos siguen siendo positivos en una prueba de confirmación al cabo de 6 semanas, debe interrumpirse el tratamiento, ya que los anticuerpos persistentes se asocian con una reducción importante de la efectividad del medicamento y un aumento de la incidencia de reacciones de hipersensibilidad. - Si se toma la decisión de detener el tratamiento con natalizumab, el médico deberá tener en cuenta que el natalizumab permanece en la sangre y que tiene efectos farmacodinámicos (p. Consideraciones especiales: ej., aumento de los recuentos de linfocitos) durante aproximadamente 12 semanas después - Es posible que algunos pacientes hayan estado de la última dosis. El comienzo de otros expuestos a fármacos inmunodepresores (p. ej., tratamientos durante este intervalo dará lugar a mitoxantrona, ciclofosfamida, azatioprina). Estos una exposición concomitante al natalizumab. En fármacos pueden causar una inmunodepresión el caso de fármacos como el interferón y el prolongada, incluso después de suspender la acetato de glatirámero, la exposición administración. Por consiguiente, el médico debe concomitante de esta duración no se asoció a confirmar que estos pacientes no presentan riesgos de seguridad en ensayos clínicos. No se inmunodepresión antes de iniciar el tratamiento dispone de datos en pacientes con EM en con natalizumab. relación con la exposición concomitante con - Antes de iniciar el tratamiento con este fármacos inmunodepresores. El uso de estos medicamento se debe disponer de una imagen fármacos poco después de la retirada del reciente de resonancia magnética. Debe vigilarse natalizumab puede dar lugar a un efecto a los pacientes a intervalos regulares para inmunodepresor adicional. Esto debe analizarse detectar cualquier aparición o empeoramiento de detenidamente caso por caso, y puede ser signos o síntomas neurológicos que pudieran ser adecuado efectuar un período de lavado del indicativos de LMP. natalizumab. Los ciclos cortos de esteroides - Debe reconsiderarse detenidamente la utilizados para tratar las recidivas no se asociaron continuación del tratamiento en pacientes que no a un aumento de la incidencia de infecciones en muestren signos de beneficio terapéutico después ensayos clínicos. de 6 meses. No se dispone de datos sobre la seguridad y la eficacia del natalizumab después de 2 años. La continuación del tratamiento después de dicho periodo de tiempo debe considerarse sólo después de volver a evaluar los Advertencias sobre excipientes: Este medicamento contiene sales de sodio. Para conocer el contenido exacto en sodio, se recomienda revisar la composición. Las formas posibles efectos beneficiosos y riesgos. farmacéuticas parenterales con un contenido en - Los agravamientos de la enfermedad o los acontecimientos relacionados con la infusión pueden indicar la formación de anticuerpos contra el natalizumab. En el caso de que se produzcan sodio inferior a 23 mg/dosis se considerarán exentas en sodio. Las formas farmacéuticas orales y parenterales con cantidades de sodio superiores de 23 mg/dosis deberán usarse con CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 4
5 precaución en pacientes con dietas pobres en sodio. EVALUACIÓN DE LA EFICACIA La FDA aprobó en noviembre de 2004 la indicación de natalizumab en la esclerosis múltiple remitente-recurrente a partir de los resultados intermedios de dos ensayos clínicos de fase III: AFFIRM y SENTINEL. Sin embargo, en las semanas siguientes a esta aprobación y en base a la aparición de casos de leucoencefalopatía multifocal progresiva se decidió retirar del mercado. En junio de 2006 la FDA volvió a autorizar su comercialización. Dicha autorización se volvió a conceder en base al ensayo AFFIRM (natalizumab en monoterapia) y tras detectar que no se habían vuelto a detectar más casos de LMP, aunque cabe tener en cuenta que la autorización de su indicación se basa en estudios post hoc en el subgrupo de pacientes que presentaron EM muy activa. Para evaluar su eficacia se puede estudiar sobretodo los ensayos clínicos antes citados (AFFIRM y SENTINEL). Ambos aleatorizados, multicéntricos, controlados frente a placebo y de dos años de duración, cuyos objetivos primarios de eficacia fueron variables clínicas (concretamente el objetivo principal en ambos estudios fue la probabilidad acumulada de progresión mantenida medido a partir de la escala de discapacidad Expanded Disability Status Scale (EDSS)). La escala EDSS. La puntuación final de la escala EDSS se obtiene a partir de los grados o puntos asignados a cada sistema funcional, de la siguiente manera: 0. Exploración neurológica normal (grado 0 en todos los sistemas funcionales (SF); se acepta función mental de grado 1). 1.0 Sin discapacidad, signos mínimos en un SF (es decir, grado 1 en cualquier función que no sea la mental). 1.5 Sin discapacidad, signos mínimos en más de un SF (más de un grado 1 en cualquier función que no sea la cerebral). 2.0 Discapacidad mínima en un SF (grado 2 en uno de ellos y 0 ó 1 en el resto). 2.5 Discapacidad mínima en dos SF (grado 2 en dos SF y 0 ó 1 en el resto). 3.0 Discapacidad moderada en un SF (grado 3 en un SF y 0 ó 1 en el resto), o discapacidad leve en 3 ó 4 SF (grado 2 en 3 ó 4 SF y 0 ó 1 en el resto), aunque con plena capacidad de deambulación. 3.5 Plena capacidad de deambulación con discapacidad moderada en un SF (un grado 3) y grado 2 en 1 ó 2 SF, grado 3 en dos SF o grado 2 en 5 SF (0 ó 1 en el resto). 4.0 Plena capacidad de deambulación sin ayuda, autosuficiencia durante un período máximo de 12 horas diarias pese a una discapacidad relativamente grave de grado 4 en un SF (0 ó 1 en el resto) o bien una combinación de grados menores que excedan los límites establecidos en los puntos anteriores. Capacidad para andar unos 500 metros sin ayuda ni descanso. 4.5 Plena capacidad de deambulación sin ayuda durante gran parte del día; capacidad para trabajar la jornada completa, a pesar de presentar ciertas limitaciones para realizar una actividad plena o necesitar ayuda mínima; caracterizado por una discapacidad relativamente grave consistente habitualmente en grado 4 en un SF (0 ó 1 en el resto) o una combinación de grados menores que excedan los límites de los puntos anteriores. Capacidad para andar unos 300 metros sin ayuda ni descanso. CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 5
6 5.0 Capacidad para andar unos 200 metros sin ayuda ni descanso. Discapacidad lo suficientemente grave como para afectar a la actividad diaria habitual (por ejemplo, para trabajar la jornada completa sin medidas especiales). Equivalente a un grado 5 en un solo SF y 0 ó 1 en el resto, o una combinación de grados menores que suelen superar las especificaciones del punto Capacidad para andar unos 100 metros sin ayuda ni descanso; discapacidad lo suficientemente grave como para impedir la actividad diaria habitual. (Equivalente a un grado 5 en un solo SF y 0 ó 1 en el resto o una combinación de grados menores que suelen superar a los del punto 4.0). 6.0 Necesidad de ayuda ocasional o constante unilateral (bastón, muleta o corsé) para andar unos 100 metros con o sin descanso (Equivalente a combinaciones de más de dos grados 3 en los SF). 6.5 Necesidad de ayuda bilateral constante (bastones, muletas o corsé) para andar unos 20 metros sin descansar. (Equivalente a combinaciones de más de dos grados 3 en los SF). 7.0 Incapaz de andar más de 5 metros incluso con ayuda; limitado esencialmente a permanecer en silla de ruedas; capaz de desplazarse solo en la silla de ruedas y de levantarse de ella; permanece en la silla de ruedas unas 12 horas diarias. (Equivale a combinaciones de más de un grado 4 en los SF y, muy raramente, a un grado 5 de la función piramidal únicamente). 7.5 Incapaz de dar unos cuantos pasos; limitado a permanecer en silla de ruedas; puede necesitar ayuda para levantarse de la silla; capaz de desplazarse solo en la silla, aunque no todo el día; puede necesitar una silla de ruedas con motor. (Equivale a combinaciones de más de un grado 4 de los SF). 8.0 Limitado esencialmente a estar en cama o sentado o a ser trasladado en silla de ruedas, aunque puede permanecer fuera de la cama gran parte del día; capaz de realizar gran parte del aseo personal; puede utilizar las manos eficazmente. (Equivale a combinaciones de grado 4 en varios sistemas). 8.5 Limitado a permanecer en cama gran parte del día; puede utilizar parcialmente las manos y realizar algunas labores de aseo personal. (Equivale a combinaciones de grado 4 en varios sistemas). 9.0 Paciente encamado e inválido; puede comunicarse y comer. (Equivale a combinaciones de grado 4 en la mayoría de los sistemas). 9.5 Paciente encamado e inválido total, incapaz de comunicarse eficazmente y de comer o de deglutir. (Equivale a combinaciones de grado 4 en casi todos los sistemas) Muerte debida a una complicación de la Esclerosis Múltiple. resonancia magnética, utilizando imágenes T1 de Estudio AFFIRM La eficacia como monoterapia ha sido evaluada en un estudio aleatorizado, doble ciego controlado con placebo de 2 años de duración en pacientes con EM remitente recidivante que habían experimentado al menos 1 recidiva clínica durante el año anterior a su inclusión y tenían una puntuación entre 0 y 5 en la escala expandida del estado de discapacidad de Kurtzke (EDSS). La mediana de la edad de los pacientes fue de 37 años, y la de la duración de la enfermedad, de 5 años. Los pacientes (n. = 942) fueron asignados aleatoriamente para recibir en una relación de 2 a 1, Natalizumab 300 mg (n = 627) o placebo (n = 315) cada 4 semanas, hasta un total de 30 perfusiones. Se realizaron evaluaciones neurológicas cada 12 semanas y en los momentos de sospecha de recidivas. Se realizaron anualmente evaluaciones mediante lesiones realzadas con gadolinio (Gd) e imágenes T2 de lesiones hiperintensas. A los 13 meses, en el grupo tratado se redujo (en valor relativo) la tasa de brotes clínicos un 66% 0.27 ( ) para natalizumab versus 0.78 ( ) para placebo p<0.001 y el número de nuevas lesiones con captación de gadolinio un 90%. Al cabo de 24 meses, la reducción relativa en la tasa de brotes fue de 67% 0.23 ( ) y 0.73 ( ) p<0.001, y el porcentaje de pacientes que no habían progresado en la EDSS se redujo un 42% en valor relativo; probabilidad de progresión en la EDSS 17% para natalizumab versus 29% para placebo. El valor medio en la EDSS fue de 2.3 (RANGO 0-6) en ambos grupos, y la media de cambio en la escala evaluado a los 2 años fue de 0.04 (±0.86) para natalizumab versus 0.41 para placebo p< Sin embargo es difícil interpretar la significación clínica de esta diferencia de 0.37 puntos en la escala EDSS. CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 6
7 En el subgrupo de pacientes que cumplen criterios para el tratamiento de la EM remitente recidivante de evolución rápida (pacientes con 2 o más recidivas y 1 o más lesiones Gd+), la tasa anualizada de recidiva fue de 0.28 en el grupo tratado con Natalizumab (n = 148) y de 1.45 en el grupo del placebo (n = 61) (p <0,001). El cociente de riesgo para la progresión de la discapacidad fue de 0,36 (IC 95%: 0,17-0,76) p = 0,008. Estos resultados se obtuvieron en un análisis post hoc y deben interpretarse con cautela. Adicionalmente no se dispone de información acerca de la gravedad de las recidivas antes de la inclusión de los pacientes en el estudio. Estudio SENTINEL El estudio SENTINEL incluyó pacientes con esclerosis múltiple remitente-recurrente (n= 1171), quienes estaban recibiendo tratamiento con interferón beta-1a intramuscular desde hacía más de 12 meses. Se aleatorizaron en dos grupos: interferón beta-1a (30 mg/semana) más natalizumab (300 mg/4 semana) (n= 589) o interferón beta-1a (30 mg/semana) más placebo (n= 582). Después de 13 meses la tasa de brotes fue un 54% (en valor relativo) menor en los enfermos tratados con natalizumab que en los que recibieron placebo (tasa de recaídas 0.38 ( ) para natalizumab/interferon beta 1a versus 0.81 ( ) p<0.001) para interferon beta 1a/placebo, porcentaje relativo que al final del estudio ascendió al 56% (0.34 ( ) para la terapia combinada versus 0.75 para la monoterapia con interferon ( ) p= A los 2 años la probabilidad acumulada de una progresión mantenida fue de 23% para la terapia de combinación versus 29% para la monoterapia con interferon con una reducción absoluta de riesgo (RAR) del 6%. Debe tenerse en cuenta que el número de pacientes cuya discapacidad progresó durante el ensayo fue pequeña. El porcentaje de pacientes que completaron el estudio sin progresión y/o sin brotes fue elevado y no fueron tenidos en cuenta en la evaluación al final del estudio. Con lo que la interpretación de los datos depende del análisis realizado y por tanto debe tenerse en cuenta a la hora de establecer conclusiones. A pesar de que las poblaciones de sujetos basales eran diferentes en los estudios AFFIRM y SENTINEL, se puede observar que la estimación de la probabilidad acumulada de progresión mantenida de discapacidad para el grupo placebo en el estudio AFFIRM, fue la misma que la probabilidad acumulada de progresión mantenida de discapacidad para el grupo control interferon beta1a en el estudio SENTINEL (29%). Adicionalmente la mejora en este resultado en el estudio AFFIRM (12%; NNT=8.3) fue superior que en el estudio SENTINEL (6%; NNT= 16.6). Estos resultados muestran la variabilidad existente inter e intra individuo en la esclerosis múltiple remitente recidivante, así como la dificultad en aplicar los resultados en ensayos clínicos relativamente cortos a la situación real. CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 7
8 EVALUACIÓN DE LA SEGURIDAD de natalizumab desde abril de 2002 hasta enero En ensayos controlados con placebo en pacientes con EM tratados con natalizumab durante un máximo de 2 años (placebo: 1.135), de 2005, interferón -1a intramuscular desde febrero de 2000 hasta enero de 2005 y tres bolos de metilprednisolona durante ese período. se produjeron acontecimientos adversos que motivaron la retirada del tratamiento en el 5,8 % Otro paciente de 60 años de edad con de los pacientes tratados con natalizumab enfermedad de Crohn falleció a mediados del año (placebo: 4,8 %). Durante el periodo de 2 años 2003 por una leucoencefalopatía multifocal que duraron los estudios, el 43,5 % de los pacientes tratados con natalizumab comunicó reacciones farmacológicas adversas (placebo: 39,6 %). progresiva tras haber recibido ocho dosis de 300 mg de natalizumab desde marzo de En los cuatro años previos había recibido tratamiento con infliximab y azatioprina. En este caso cabe destacar que en el estudio seriado de la viremia En todos los estudios realizados, natalizumab ha mostrado tener un perfil de seguridad adecuado. El riesgo de infecciones ha sido semejante en los en sangre desde 1999 sólo se detectaron copias del virus JC tras el inicio del tratamiento con natalizumab, así como que la viremia en este grupos placebo y de tratamiento activo período se incrementó de manera acelerada, lo (infecciones graves: 1,3% y 2,1% que hace muy probable la relación entre el respectivamente). El mecanismo de acción de natalizumab provoca una elevación en la sangre tratamiento y la leucoencefalopatía multifocal progresiva. de los linfocitos, los monocitos y los eosinófilos, pero no de los neutrófilos. Menos del 1% de los El tercer caso es el de un paciente con pacientes desarrolla una reacción de antecedentes de Ramsay-Hunt en 1998 y un hipersensibilidad a natalizumab. El porcentaje de pacientes que desarrollaron anticuerpos antinatalizumab osciló entre el 7% y el 11%, y en el 6% esta síntesis fue permanente. melanoma maligno correctamente tratado en 1996, que recibía tratamiento con interferón -1a intramuscular desde 1998 y que fue incluido en el estudio SENTINEL en octubre de En diciembre de 2004, tras 28 infusiones de Natalizumab y leucoencefalopatía multifocal progresiva natalizumab, se iniciaron los síntomas de la leucoencefalopatía multifocal progresiva. Al cabo de 6 meses de interrumpir el tratamiento con A los 4 meses de que la FDA aprobara la indicación de natalizumab para el tratamiento de la esclerosis múltiple, el medicamento fue retirado del mercado debido a que tres pacientes incluidos natalizumab y tras haber sido tratado con citarabina e inmunoglobulinas, el paciente seguía vivo, y en la resonancia magnética se observó que las lesiones de leucoencefalopatía multifocal en ensayos clínicos desarrollaron una progresiva captaban contraste, lo que refleja la leucoencefalopatía multifocal progresiva. Uno de ellos era un enfermo de 46 años incluido reconstitución de su estado inmunológico previo al tratamiento con natalizumab. en el estudio SENTINEL, que falleció por una Para algunos autores la relación entre el leucoencefalopatía multifocal progresiva en tratamiento con natalizumab y la ocurrencia de febrero de 2005 tras recibir 37 dosis de 300 mg CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 8
9 leucoencefalopatía multifocal progresiva es clara. Sin embargo, se desconoce todavía la relación precisa entre el tratamiento con natalizumab y el desarrollo de esta enfermedad en términos de riesgos y, en su caso, de patogenia. Durante el tiempo que natalizumab estuvo comercializado en los Estados Unidos se calcula que unos 5000 pacientes recibieron este tratamiento, a los que hay que añadir los incluidos en ensayos clínicos. En la evaluación realizada a todos estos enfermos para detectar leucoencefalopatías multifocales progresivas subclínicas, finalizada en agosto de 2005, no se han declarado hasta la fecha nuevos casos Por otro lado, la EMEA en marzo de 2008 advierte de la necesidad de añadir una advertencia adicional en la información del producto tras la aparición de casos de lesiones hepáticas en pacientes tratados con natalizumab. EVALUACIÓN ECONÓMICA Se adjunta una tabla con los precios de los medicamentos y datos comparativos del tratamiento anual de los diferentes medicamentos comercializados para la Esclerosis Múltiple, incluidos en nuestro hospital, junto con el tratamiento solicitado. Medicamento PVL + 4% IVA Coste anual por paciente Natalizumab (Tysabri ) Interferon β 1A (Avonex ) 217, Interferon β 1A (Rebif 22mcg) 101, Interferon β 1B (Betaferon ) 61, Glatiramero (Copaxone ) El más caro es el Natalizumab con diferencia, además habría que sumarle los costes de la administración de una perfusión intravenosa en hospital de día. La ventaja del Natalizumab es su administración una vez al mes, a diferencia del resto de tratamientos que son una vez a la semana, 3 veces a la semana o cada 48 h. Pero los tratamientos incluidos en nuestro hospital tienen como ventaja la administración subcutánea. CONCLUSIONES La Food and Drug Administration (FDA) multifocal progresiva se decidió retirar del autorizó en noviembre de 2004 la mercado. comercialización de natalizumab como Se volvió a solicitar su autorización en base al tratamiento de la esclerosis múltiple remitenterecurrente. ensayo AFFIRM (natalizumab en monoterapia) y Sin embargo, en las semanas tras detectar que no se habían vuelto a detectar siguientes a esta aprobación y en base a la más casos de LMP esta se concedió en junio de aparición de casos de leucoencefalopatía 2006, aunque cabe tener en cuenta que la autorización de su indicación se basa en estudios CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 9
10 post hoc en el subgrupo de pacientes que presentaron EM muy activa. En todos los estudios realizados, natalizumab ha mostrado tener un perfil de seguridad adecuado. Sin embargo hay que remarcar el desconocimiento de los posibles riesgos a mediolargo plazo como infeccionesy/o cáncer. En el transcurso de un tratamiento de 2 años, un 6% de pacientes desarrollaron anticuerpos antinatalizumab persistentes que se acompañaron de una disminución de la eficacia y de una incidencia elevada de reacciones tras la perfusión y reacciones de hipersensibilidad. La FDA en marzo de 2008 ha notificado a los profesionales sanitarios comunicaciones sobre daño hepático clínicamente significativo, incluyendo elevaciones marcadamente elevadas de enzimas hepáticos y bilirrubina total elevada, con el uso de natalizumab (Tysabri ). Se ha observado que los signos de daño hepático se producen tan tempranamente como seis días después de la primera dosis. La combinación de elevaciones de las transaminasas y bilirrubina elevada sin evidencia de obstrucción es reconocida como un importante predictor de daño hepático grave que puede conducir a la muerte o a la necesidad de trasplante hepático en algunos pacientes. El medicamento deberá discontinuarse en pacientes con ictericia u otras evidencias de daño hepático significativo, y los clínicos deben informar a los pacientes de este riesgo. La información de prescripción americana ha sido revisada para reflejar este aspecto de seguridad. Tras una revisión de comunicados de lesiones hepáticas en pacientes tratados con natalizumab (Tysabri ), la EMEA ha concluido que se debe añadir una advertencia adicional en la información de producto. La EMEA tiene conocimiento de 29 comunicaciones de lesiones hepáticas en pacientes tratados con Natalizumab, aproximadamente 2/3 de los mismos están clasificados como graves. El CHMP (Comité de Medicamentos de Uso Humano) ha recomendado que se actualice la información del producto sobre riesgo de lesiones hepáticas- esto incluye advertencias sobre la necesidad de monitorizar la función hepática en estos pacientes, y que los pacientes deben acudir al médico si desarrollan síntomas de problemas hepáticos. Los médicos deben interrumpir el tratamiento si juzgan que existe una alteración hepática significativa. BIBLIOGRAFIA 1. Tysabri. Ficha técnica. 2. Avonex Ficha técnica. 3. Rebif Ficha técnica. 4. Betaferon Ficha técnica. 5. Copaxone Ficha técnica. 6. Informe del Hospital Universitario de Son Dureta 7. Informe del Hospital General de Alicante 8. Estudio AFFIRM. A Randomized, Placebo- Controlled Trial of Natalizumab for Relapsing Multiple Sclerosis. Chris H. Polman, M.D., Paul W. O'Connor, M.D.,et al. 9. Estudio SENTINEl. Natalizumab plus Interferon Beta-1a for Relapsing Multiple Sclerosis. Richard A. Rudick, M.D., William H. Stuart, et al. 10. Página web: CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 10
1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME
 NATALIZUMAB EM remitente recidivante grave de evolución rápida y elevada actividad de EM a pesar de tratamiento con interferon beta. (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario
NATALIZUMAB EM remitente recidivante grave de evolución rápida y elevada actividad de EM a pesar de tratamiento con interferon beta. (Informe para la Comisión de Farmacia y Terapéutica del Hospital Universitario
GUÍA DEL MEDICAMENTO
 GUÍA DEL MEDICAMENTO Guía del medicamento GUÍA DEL MEDICAMENTO TYSABRI (tai-sa-bri) (natalizumab) inyectable, para uso por vía intravenosa Lea esta Guía del medicamento antes de comenzar a recibir TYSABRI
GUÍA DEL MEDICAMENTO Guía del medicamento GUÍA DEL MEDICAMENTO TYSABRI (tai-sa-bri) (natalizumab) inyectable, para uso por vía intravenosa Lea esta Guía del medicamento antes de comenzar a recibir TYSABRI
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Introducción. Nuevos anticoagulantes orales
 Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
Calcitonina Almirall 100 UI Solución inyectable Calcitonina sintética de salmón
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
Tuberculosis Hospital Event
 Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
TUMOR CEREBRAL 15 CUESTIONES LAS MÁS FRECUENTES. Dr. Pedro Pérez Segura Servicio de Oncología Médica Hospital Clínico San Carlos.
 TUMOR CEREBRAL LAS 15 CUESTIONES MÁS FRECUENTES Dr. Pedro Pérez Segura Servicio de Oncología Médica Hospital Clínico San Carlos. Madrid 1 2 QUÉ SÍNTOMAS PUEDE PRODUCIR UN TUMOR CEREBRAL? Los síntomas son
TUMOR CEREBRAL LAS 15 CUESTIONES MÁS FRECUENTES Dr. Pedro Pérez Segura Servicio de Oncología Médica Hospital Clínico San Carlos. Madrid 1 2 QUÉ SÍNTOMAS PUEDE PRODUCIR UN TUMOR CEREBRAL? Los síntomas son
riesgos con Xolair. Información sobre Xolair (omalizumab)
 La FDA aprueba cambios en la etiqueta del medicamento para el asma Xolair (omalizumab), los que incluyen la descripción de un riesgo ligeramente mayor de acontecimientos adversos cardíacos y cerebrales
La FDA aprueba cambios en la etiqueta del medicamento para el asma Xolair (omalizumab), los que incluyen la descripción de un riesgo ligeramente mayor de acontecimientos adversos cardíacos y cerebrales
HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA.
 HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA. Mª Victoria Rodríguez, Nelida Madrazo, Asunción Aguilera, Eva Mª Aguirre, Concepción Herrero, Mª Eugenia Plagaro,
HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA. Mª Victoria Rodríguez, Nelida Madrazo, Asunción Aguilera, Eva Mª Aguirre, Concepción Herrero, Mª Eugenia Plagaro,
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL
 FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
Autor: Dres. Freynhagen R, Serpell M, Latymer M y colaboradores Fuente: SIIC Pain Practice 1-11, Nov 2013. Introducción y objetivos
 Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
Qué es la tarjeta amarilla?
 Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Algunas personas infectadas no parecen estar enfermas, pero igual pueden transmitir el microbio a otros.
 Vacuna Contra el Tifus Vivo (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La vacuna
Vacuna Contra el Tifus Vivo (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La vacuna
QUÉ ES LA HEPATITIS C? CÓMO SE CONTAGIA?
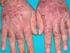 QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
Anticoncepción oral sin estrógenos Qué debes saber?
 Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Oxacilina (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La oxacilina corresponde
Oxacilina (Por vía inyectable) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La oxacilina corresponde
Anexo III. Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto
 Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA
 PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA 22.05.2015 Este procedimiento de actuación se enmarca en el desarrollo
PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA 22.05.2015 Este procedimiento de actuación se enmarca en el desarrollo
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
MEDICAMENTOS QUE CONTIENEN YODOCASEÍNA/TIAMINA CON AUTORIZACION EN LA UNION EUROPEA
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 MEDICAMENTOS QUE CONTIENEN YODOCASEÍNA/TIAMINA
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN Y TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS 1 MEDICAMENTOS QUE CONTIENEN YODOCASEÍNA/TIAMINA
Calculadora de Tamaño muestral GRANMO
 Calculadora de Tamaño muestral GRANMO Versión 7.12 Abril 2012 http://www.imim.es/ofertadeserveis/software-public/granmo/ Entre las distintas ofertas que existen para el cálculo del tamaño muestral, ofrecemos
Calculadora de Tamaño muestral GRANMO Versión 7.12 Abril 2012 http://www.imim.es/ofertadeserveis/software-public/granmo/ Entre las distintas ofertas que existen para el cálculo del tamaño muestral, ofrecemos
Que son "inyecciones para la alergia"?
 Que son "inyecciones para la alergia"? Este folleto está diseñado para responder las preguntas básicas de quién, qué, cuándo, dónde, cómo y por qué que pueda tener con respecto a la inmunoterapia alergénica,
Que son "inyecciones para la alergia"? Este folleto está diseñado para responder las preguntas básicas de quién, qué, cuándo, dónde, cómo y por qué que pueda tener con respecto a la inmunoterapia alergénica,
PREGUNTAS FRECUENTES SOBRE VPH.
 PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
Clasificación de problemas relacionados con medicamentos
 Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
Virus del Ébola ÉBOLA. Durante un brote, quienes mayor riesgo de infección corren son:
 ÉBOLA Lo que se debemos saber. 1. Qué es la enfermedad provocada por el virus del Ébola? Denominada anteriormente Fiebre hemorrágica del Ébola, es una enfermedad grave y con frecuencia letal, cuya tasa
ÉBOLA Lo que se debemos saber. 1. Qué es la enfermedad provocada por el virus del Ébola? Denominada anteriormente Fiebre hemorrágica del Ébola, es una enfermedad grave y con frecuencia letal, cuya tasa
ESTRATEGIA DE DINAMARCA: INFORME SOBRE EL FUTURO DEL ENTORNO LABORAL
 ESTRATEGIA DE DINAMARCA: INFORME SOBRE EL FUTURO DEL ENTORNO LABORAL NUEVAS PRIORIDADES PARA EL ENTORNO LABORAL ESTRATEGIA DE DINAMARCA: INFORME SOBRE EL FUTURO DEL ENTORNO LABORAL Página 1 ÍNDICE INTRODUCCIÓN
ESTRATEGIA DE DINAMARCA: INFORME SOBRE EL FUTURO DEL ENTORNO LABORAL NUEVAS PRIORIDADES PARA EL ENTORNO LABORAL ESTRATEGIA DE DINAMARCA: INFORME SOBRE EL FUTURO DEL ENTORNO LABORAL Página 1 ÍNDICE INTRODUCCIÓN
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS
 ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
Índice de contenidos DESCRIPCIÓN GENERAL. Esteroides Anabólicos (Por via oral)
 Esteroides Anabólicos (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los esteroides anabólicos
Esteroides Anabólicos (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los esteroides anabólicos
Mª Ángeles Suárez Rodríguez. Noviembre 2015
 Mª Ángeles Suárez Rodríguez. Noviembre 2015 MOTIVO DE CONSULTA Paciente varón de 20 meses que acude a consulta por manchas en la piel. Comenta la familia que las manchas aparecieron hace 24 horas. No han
Mª Ángeles Suárez Rodríguez. Noviembre 2015 MOTIVO DE CONSULTA Paciente varón de 20 meses que acude a consulta por manchas en la piel. Comenta la familia que las manchas aparecieron hace 24 horas. No han
PROTEJASE + PROTEJA A SU PAREJA. virus del papiloma humano genital LA REALIDAD
 PROTEJASE + PROTEJA A SU PAREJA virus del papiloma humano genital LA REALIDAD PROTEJASE + PROTEJA A SU PAREJA LA REALIDAD El virus del papiloma humano genital (VPH) es el virus de transmisión sexual más
PROTEJASE + PROTEJA A SU PAREJA virus del papiloma humano genital LA REALIDAD PROTEJASE + PROTEJA A SU PAREJA LA REALIDAD El virus del papiloma humano genital (VPH) es el virus de transmisión sexual más
APRENDIENDO CON NEFRON SUPERHEROE
 APRENDIENDO CON NEFRON SUPERHEROE DIABETES - UN FACTOR DE RIESGO PARA LA ENFERMEDAD RENAL La Diabetes mellitus, generalmente conocida como diabetes, es una enfermedad en la que su cuerpo no produce suficiente
APRENDIENDO CON NEFRON SUPERHEROE DIABETES - UN FACTOR DE RIESGO PARA LA ENFERMEDAD RENAL La Diabetes mellitus, generalmente conocida como diabetes, es una enfermedad en la que su cuerpo no produce suficiente
GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR
 GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR CLÍNICA UNIVERSITARIA universidad de navarra QUÉ SON LOS ANTICOAGULANTES? Son sustancias utilizadas para la prevención y tratamiento de la trombosis,
GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR CLÍNICA UNIVERSITARIA universidad de navarra QUÉ SON LOS ANTICOAGULANTES? Son sustancias utilizadas para la prevención y tratamiento de la trombosis,
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
ESCLEROSIS MÚLTIPLE. Los fármacos que modifican la enfermedad
 ESCLEROSIS MÚLTIPLE Los fármacos que modifican la enfermedad Febrero 2009 Índice Opciones Indicación (uso aprobado por la EMEA) Frecuencia/Método de administración/dosis habitual Efectos secundarios comunes
ESCLEROSIS MÚLTIPLE Los fármacos que modifican la enfermedad Febrero 2009 Índice Opciones Indicación (uso aprobado por la EMEA) Frecuencia/Método de administración/dosis habitual Efectos secundarios comunes
COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS INTERFERONES BETA: RIESGO DEMICROANGIOPATÍA TROMBÓTICAY SÍNDROME NEFRÓTICO
 COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS INTERFERONES BETA: RIESGO DEMICROANGIOPATÍA TROMBÓTICAY SÍNDROME NEFRÓTICO 01/septiembre/2014 Estimado profesional sanitario: La Agencia Española de Medicamentos
COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS INTERFERONES BETA: RIESGO DEMICROANGIOPATÍA TROMBÓTICAY SÍNDROME NEFRÓTICO 01/septiembre/2014 Estimado profesional sanitario: La Agencia Española de Medicamentos
Anexo II. Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos
 Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
Anexo II Conclusiones científicas y motivos para la denegación presentados por la Agencia Europea de Medicamentos 5 Conclusiones científicas Resumen general de la evaluación científica de Etinilestradiol-Drospirenona
FICHA TÉCNICA. Pastillas circulares de color rosa con sabor a fresa y el icono de Strepsils grabado en ambos lados.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
Prospecto: información para el usuario. INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína
 Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Prospecto: información para el usuario INISTON MUCOLITICO 50 mg/ml solución oral Carbocisteína Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información
Subsecretaría de Prevención y Promoción de la Salud Dirección General de Promoción de la Salud
 Contenido I. Introducción II. III. IV. Preguntas frecuentes sobre el virus del Ébola Medidas de prevención para viajeros Mensajes clave I. Introducción El virus del Ébola causa una enfermedad aguda grave
Contenido I. Introducción II. III. IV. Preguntas frecuentes sobre el virus del Ébola Medidas de prevención para viajeros Mensajes clave I. Introducción El virus del Ébola causa una enfermedad aguda grave
LO QUE DEBE SABER ACERCA DEL TRATAMIENTO CON CELULAS MADRE. 1. Hay diferentes tipos de células madre, cada una, con su propósito establecido.
 LO QUE DEBE SABER ACERCA DEL TRATAMIENTO CON CELULAS MADRE 1. Hay diferentes tipos de células madre, cada una, con su propósito establecido. Hay muchos tipos de células madre que provienen de diferentes
LO QUE DEBE SABER ACERCA DEL TRATAMIENTO CON CELULAS MADRE 1. Hay diferentes tipos de células madre, cada una, con su propósito establecido. Hay muchos tipos de células madre que provienen de diferentes
Nota de prensa. La AEMPS presenta una aplicación para móviles que acercará la información de los medicamentos a profesionales y ciudadanos
 GABINETE DE PRENSA MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E Nota de prensa Criterios de transparencia, independencia y rigor científico en la Agencia Española de Medicamentos y Productos Sanitarios
GABINETE DE PRENSA MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E Nota de prensa Criterios de transparencia, independencia y rigor científico en la Agencia Española de Medicamentos y Productos Sanitarios
ENFERMEDAD DE CROHN. Qué es la enfermedad de crohn?
 ENFERMEDAD DE CROHN Qué es la enfermedad de crohn? La enfermedad de Crohn es un proceso inflamatorio que afecta primariamente al tracto intestinal, aunque puede afectar a cualquier parte del aparato digestivo,
ENFERMEDAD DE CROHN Qué es la enfermedad de crohn? La enfermedad de Crohn es un proceso inflamatorio que afecta primariamente al tracto intestinal, aunque puede afectar a cualquier parte del aparato digestivo,
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
TRATAMIENTO CON BUPRENORFINA: UN ADIESTRAMIENTO PARA PROFESIONALES MULTIDISCIPLINARIOS EN ADICCION. Módulo III Buprenorfina 101
 TRATAMIENTO CON BUPRENORFINA: UN ADIESTRAMIENTO PARA PROFESIONALES MULTIDISCIPLINARIOS EN ADICCION Módulo III Buprenorfina 101 Módulo III Metas del Módulo Este módulo repasa lo siguiente: El desarrollo
TRATAMIENTO CON BUPRENORFINA: UN ADIESTRAMIENTO PARA PROFESIONALES MULTIDISCIPLINARIOS EN ADICCION Módulo III Buprenorfina 101 Módulo III Metas del Módulo Este módulo repasa lo siguiente: El desarrollo
Datos: Propecia está aprobado para tratar la calvicie masculina.
 Comunicación de seguridad de Medicamentos de la FDA: la 5-alfa reductasa (5-ARI) puede aumentar el riesgo de una forma más grave de cáncer de próstata. Datos: Inhibidores de la 5-alfa-reductasa son un
Comunicación de seguridad de Medicamentos de la FDA: la 5-alfa reductasa (5-ARI) puede aumentar el riesgo de una forma más grave de cáncer de próstata. Datos: Inhibidores de la 5-alfa-reductasa son un
FICHA TÉCNICA. STREPSILS pastillas para chupar sabor miel y limón
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
INFORME DE ANÁLISIS DE ENCUESTAS DE SATISFACCIÓN DE USUARIOS PERÍODO 2009-2010
 INFORME DE ANÁLISIS DE ENCUESTAS DE SATISFACCIÓN DE USUARIOS PERÍODO 2009-2010 UNIDAD FUNCIONAL DE TÉCNICOS DE LABORATORIOS DOCENTES UNIVERSIDAD PABLO DE OLAVIDE. SEVILLA Sevilla, Diciembre de 2010 1 1.
INFORME DE ANÁLISIS DE ENCUESTAS DE SATISFACCIÓN DE USUARIOS PERÍODO 2009-2010 UNIDAD FUNCIONAL DE TÉCNICOS DE LABORATORIOS DOCENTES UNIVERSIDAD PABLO DE OLAVIDE. SEVILLA Sevilla, Diciembre de 2010 1 1.
Conocer la esclerosis múltiple
 DEPARTAMENTO DE RECURSOS HUMANOS Conocer la esclerosis múltiple ES UNA ENFERMEDAD QUE AFECTA AL SISTEMA NERVIOSO CENTRAL Y CUYA EVOLUCION ES IMPREDECIBLE Y VARIABLE. ESTAS CARACTERISTICAS, ENTRE OTRAS,
DEPARTAMENTO DE RECURSOS HUMANOS Conocer la esclerosis múltiple ES UNA ENFERMEDAD QUE AFECTA AL SISTEMA NERVIOSO CENTRAL Y CUYA EVOLUCION ES IMPREDECIBLE Y VARIABLE. ESTAS CARACTERISTICAS, ENTRE OTRAS,
La mayoría de exposiciones no ocasionan una infección. Después de una exposición, el riesgo de infección depende de factores como los siguientes:
 Exposición a la sangre Lo que deben saber los trabajadores de la salud Departamento de Salud y Servicios Humanos Centros para el Control y la Prevención de Enfermedades Exposiciones ocupacionales a la
Exposición a la sangre Lo que deben saber los trabajadores de la salud Departamento de Salud y Servicios Humanos Centros para el Control y la Prevención de Enfermedades Exposiciones ocupacionales a la
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Lincomicina (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las lincomicinas corresponden
Lincomicina (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las lincomicinas corresponden
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC
 6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
TALLER BÁSICO DE EXPERIMENTOS CONTROLADOS ALEATORIOS
 TALLER BÁSICO DE EXPERIMENTOS CONTROLADOS ALEATORIOS 1. INTRODUCCIÓN Y JUSTIFICACIÓN Este Taller Básico de Experimentos Controlados Aleatorios (ECA) está dirigido a profesionales de la salud interesados
TALLER BÁSICO DE EXPERIMENTOS CONTROLADOS ALEATORIOS 1. INTRODUCCIÓN Y JUSTIFICACIÓN Este Taller Básico de Experimentos Controlados Aleatorios (ECA) está dirigido a profesionales de la salud interesados
DECLARACIÓN DE ELEGIBILIDAD PARA EDUCACIÓN ESPECIAL ECSE (continúa hasta la edad escolar) (DISCAPACIDAD ESPECÍFICA DE APRENDIZAJE 90)
 DECLARACIÓN DE ELEGIBILIDAD PARA EDUCACIÓN ESPECIAL ECSE (continúa hasta la edad escolar) (DISCAPACIDAD ESPECÍFICA DE APRENDIZAJE 90) Nombre del niño Fecha de nacimiento Escuela Fecha de elegibilidad inicial
DECLARACIÓN DE ELEGIBILIDAD PARA EDUCACIÓN ESPECIAL ECSE (continúa hasta la edad escolar) (DISCAPACIDAD ESPECÍFICA DE APRENDIZAJE 90) Nombre del niño Fecha de nacimiento Escuela Fecha de elegibilidad inicial
Guía del paciente. Braquiterapia: El mejor modo de tratar el cáncer. Porque la vida es para vivirla
 Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
El sobrepeso puede reducir seriamente la calidad de vida de su perro.
 El sobrepeso puede reducir seriamente la calidad de vida de su perro. Un perro con sobrepeso puede no sentirse tan bien como realmente podría. De hecho, si su perro Tiene problemas a la hora de levantarse
El sobrepeso puede reducir seriamente la calidad de vida de su perro. Un perro con sobrepeso puede no sentirse tan bien como realmente podría. De hecho, si su perro Tiene problemas a la hora de levantarse
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS
 INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
ESTA INFORMACIÓN ES PROPORCIONADA POR EL CENTRO MEDICO ABC. Concusión
 ESTA INFORMACIÓN ES PROPORCIONADA POR EL CENTRO MEDICO ABC INFORMACIÓN GENERAL: Concusión Qué es una concusión? La concusión cerebral es una lesión en el tejido o en los vasos sanguíneos del cerebro. También
ESTA INFORMACIÓN ES PROPORCIONADA POR EL CENTRO MEDICO ABC INFORMACIÓN GENERAL: Concusión Qué es una concusión? La concusión cerebral es una lesión en el tejido o en los vasos sanguíneos del cerebro. También
Qué son el VIH y el SIDA?
 VIH/SIDA Qué son el VIH y el SIDA? SIDA: son las siglas de Síndrome de Inmunodeficiencia Adquirida. El SIDA es causado por el VIH (Virus de Inmunodeficiencia Humana). El VIH ataca al sistema inmunológico
VIH/SIDA Qué son el VIH y el SIDA? SIDA: son las siglas de Síndrome de Inmunodeficiencia Adquirida. El SIDA es causado por el VIH (Virus de Inmunodeficiencia Humana). El VIH ataca al sistema inmunológico
Dr. José Raúl Recinos Deras
 http://www.medicosdeelsalvador.com Este artículo salió de la página web de Médicos de El Salvador. Fue escrito por: Dr. José Raúl Recinos Deras Clínica Médico Psiquiátrica y de Salud Mental Todos los derechos
http://www.medicosdeelsalvador.com Este artículo salió de la página web de Médicos de El Salvador. Fue escrito por: Dr. José Raúl Recinos Deras Clínica Médico Psiquiátrica y de Salud Mental Todos los derechos
Preguntas y respuestas del CIM Virtual del
 Preguntas y respuestas del CIM Virtual del Problemas de suministro De undecanoato de testosterona (Reandron 1000 mg/4 ml solución inyectable) 27 de agosto de 2014 Para qué se utiliza el undecanoato de
Preguntas y respuestas del CIM Virtual del Problemas de suministro De undecanoato de testosterona (Reandron 1000 mg/4 ml solución inyectable) 27 de agosto de 2014 Para qué se utiliza el undecanoato de
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zulex 333 mg Comprimidos recubiertos Acamprosato
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
CONVENIO 036 de 2012
 CONVENIO 036 de 2012 Guía de Práctica Clínica basada en la evidencia científica para la atención integral del VIH/Sida en niñas y niños. Guía de práctica clínica basada en la evidencia científica para
CONVENIO 036 de 2012 Guía de Práctica Clínica basada en la evidencia científica para la atención integral del VIH/Sida en niñas y niños. Guía de práctica clínica basada en la evidencia científica para
Analizan los beneficios vasculares
 Analizan los beneficios vasculares Artículo: La terapia con estatinas reduce el riesgo de presentar eventos vasculares graves, sin importar la concentración basal de proteína C reactiva que presente el
Analizan los beneficios vasculares Artículo: La terapia con estatinas reduce el riesgo de presentar eventos vasculares graves, sin importar la concentración basal de proteína C reactiva que presente el
POR QUÉ YA NO SE RECOMIENDA ESPERAR 3 MESES PARA HACERSE LA PRUEBA DEL VIH?
 QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad
 El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad No. DE AUTORIZACION: 093300201B1730 SSA El cáncer cérvico uterino P1 Dónde se
El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad No. DE AUTORIZACION: 093300201B1730 SSA El cáncer cérvico uterino P1 Dónde se
REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria
 TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
Diplomático de la Junta Americana de Alergia & Inmunología
 Reacciones de la droga y La mayoría de nosotros hemos tenido problemas con un medicamento u otro. Algunos medicamentos pueden causar un malestar estomacal o sentirse con sueno. Algunas drogas pueden poner
Reacciones de la droga y La mayoría de nosotros hemos tenido problemas con un medicamento u otro. Algunos medicamentos pueden causar un malestar estomacal o sentirse con sueno. Algunas drogas pueden poner
MÁS QUE UN ESTORNUDO. Preguntas más frecuentes. Con la colaboración de: + que un estornud. www.masqueunestornudo.es. www.portalfarma.
 MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
Transfusión de sangre
 Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Granisetrón NORMON 1 mg/1 ml solución inyectable EFG Granisetrón Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto,
Vacunas para la alergia
 Vacunas para la alergia 1 Las vacunas para la alergia o inmunoterapia específica con alergenos, es una forma de tratamiento con el objetivo de disminuir la sensibilidad a sustancias a las que se es alérgico.
Vacunas para la alergia 1 Las vacunas para la alergia o inmunoterapia específica con alergenos, es una forma de tratamiento con el objetivo de disminuir la sensibilidad a sustancias a las que se es alérgico.
Agencia Española de Medicamentos y Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES
 Nota informativa Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES Fecha de publicación: 25 de junio de 2012 Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.
Nota informativa Productos Sanitarios AEMPS TRIMETAZIDINA (IDAPTAN, TRIMETAZIDINA EFG): RESTRICCIÓN DE INDICACIONES Fecha de publicación: 25 de junio de 2012 Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.
Prospecto: información para el usuario. Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG. Atosiban
 Prospecto: información para el usuario Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de que le administren el medicamento, porque contiene
Prospecto: información para el usuario Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de que le administren el medicamento, porque contiene
constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético.
 Qué es la glutamina? La glutamina es el más abundante aminoácido libre en el cuerpo humano, y constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético. La glutamina es un
Qué es la glutamina? La glutamina es el más abundante aminoácido libre en el cuerpo humano, y constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético. La glutamina es un
5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS
 5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS 5.1. Consideraciones generales Para abordar las actuaciones a realizar en un edificio/instalación asociado con casos de legionelosis se deben tener
5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS 5.1. Consideraciones generales Para abordar las actuaciones a realizar en un edificio/instalación asociado con casos de legionelosis se deben tener
INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL
 INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL Desde la perspectiva de Salud Pública, disminuir la incidencia y/o prevenir enfermedades como el cáncer de cuello de útero, producido
INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL Desde la perspectiva de Salud Pública, disminuir la incidencia y/o prevenir enfermedades como el cáncer de cuello de útero, producido
INDICADOR URGENCIAS HOSPITALARIAS EN CONSUMIDORES DE SUSTANCIAS PSICOACTIVAS
 INDICADOR URGENCIAS HOSPITALARIAS EN CONSUMIDORES DE SUSTANCIAS PSICOACTIVAS DATOS 2010 Dirección General de Salud Pública Servicio de Promoción de la Salud y Prevención de la Enfermedad Indicador Urgencias
INDICADOR URGENCIAS HOSPITALARIAS EN CONSUMIDORES DE SUSTANCIAS PSICOACTIVAS DATOS 2010 Dirección General de Salud Pública Servicio de Promoción de la Salud y Prevención de la Enfermedad Indicador Urgencias
Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento.
 Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento. ENTENDIENDO SU INFORME DE PATOLOGÍA Usualmente se realiza
Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento. ENTENDIENDO SU INFORME DE PATOLOGÍA Usualmente se realiza
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Clorhexidina (Dental)
 Clorhexidina (Dental) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La clorexidina se usa para tratar
Clorhexidina (Dental) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La clorexidina se usa para tratar
QUÉ ES LA PSORIASIS EN PLACAS?
 QUÉ ES LA PSORIASIS EN PLACAS? La psoriasis en placa es la forma más común de la psoriasis. Puede aparecer en cualquier parte del cuerpo, pero se encuentra más comúnmente en los codos, rodillas, cuero
QUÉ ES LA PSORIASIS EN PLACAS? La psoriasis en placa es la forma más común de la psoriasis. Puede aparecer en cualquier parte del cuerpo, pero se encuentra más comúnmente en los codos, rodillas, cuero
Cómo actuar cuando aparece dolor en el pecho
 Cómo actuar cuando aparece dolor en el pecho Como actuar cuando aparece dolor en el pecho Qué hacer ante una crisis de dolor? TOMAR NITROGLICERINA. Lo primero que debe hacer si aparece el dolor, es interrumpir
Cómo actuar cuando aparece dolor en el pecho Como actuar cuando aparece dolor en el pecho Qué hacer ante una crisis de dolor? TOMAR NITROGLICERINA. Lo primero que debe hacer si aparece el dolor, es interrumpir
LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO
 LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO Xenaro Graña 7 de Julio de 2007 Servicio de Reumatología del Complejo Hospitalario Universitario Juan Canalejo de A Coruña El tratamiento de la Enfermedad
LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO Xenaro Graña 7 de Julio de 2007 Servicio de Reumatología del Complejo Hospitalario Universitario Juan Canalejo de A Coruña El tratamiento de la Enfermedad
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO
 ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
PROYECTO MEDICINA PERSONALIZADA PARA EL CÁNCER INFANTIL CÁNCER INFANTIL. Javier Alonso
 Página: 1 de 8 PROYECTO MEDICINA PERSONALIZADA PARA EL Javier Alonso Jefe de Área de Genética Humana. Jefe de la Unidad de Tumores Sólidos Infantiles del Instituto de Investigación de Enfermedades Raras,
Página: 1 de 8 PROYECTO MEDICINA PERSONALIZADA PARA EL Javier Alonso Jefe de Área de Genética Humana. Jefe de la Unidad de Tumores Sólidos Infantiles del Instituto de Investigación de Enfermedades Raras,
VERACIDAD EN LA PUBLICIDAD DE MEDICAMENTOS
 VERACIDAD EN LA PUBLICIDAD DE MEDICAMENTOS Iñigo Aizpurua Comité Evaluación de Nuevos Medicamentos de AP de Euskadi Dirección de Farmacia. Departamento de Salud. Gobierno Vasco. Barcelona, 17 de junio
VERACIDAD EN LA PUBLICIDAD DE MEDICAMENTOS Iñigo Aizpurua Comité Evaluación de Nuevos Medicamentos de AP de Euskadi Dirección de Farmacia. Departamento de Salud. Gobierno Vasco. Barcelona, 17 de junio
7.- INFECCIÓN POR VIRUS DE INMUNODEFICIENCIA HUMANA (VIH)
 1.- INTRODUCCION. 7.- INFECCIÓN POR VIRUS DE INMUNODEFICIENCIA HUMANA (VIH) El tratamiento antirretroviral constituye un punto clave en el manejo de las personas que viven con la infección por el VIH,
1.- INTRODUCCION. 7.- INFECCIÓN POR VIRUS DE INMUNODEFICIENCIA HUMANA (VIH) El tratamiento antirretroviral constituye un punto clave en el manejo de las personas que viven con la infección por el VIH,
ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014
 ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014 La influenza es una de las 15 enfermedades objetivo del Plan Nacional de Inmunizaciones del Ministerio de Salud de Chile. La vacunación anti-influenza
ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014 La influenza es una de las 15 enfermedades objetivo del Plan Nacional de Inmunizaciones del Ministerio de Salud de Chile. La vacunación anti-influenza
de la empresa Al finalizar la unidad, el alumno:
 de la empresa Al finalizar la unidad, el alumno: Identificará el concepto de rentabilidad. Identificará cómo afecta a una empresa la rentabilidad. Evaluará la rentabilidad de una empresa, mediante la aplicación
de la empresa Al finalizar la unidad, el alumno: Identificará el concepto de rentabilidad. Identificará cómo afecta a una empresa la rentabilidad. Evaluará la rentabilidad de una empresa, mediante la aplicación
en tratamiento con Toctino ... Nombre de la paciente (alitretinoína) Para el médico Soluciones pensando en ti
 (alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
(alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar?
 Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar? Salvador Blanch Tormo Servicio de Oncología Médica FUNDACIÓN INSTITUTO VALENCIANO DE ONCOLOGIA 11 de Junio de 2015 Sabes
Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar? Salvador Blanch Tormo Servicio de Oncología Médica FUNDACIÓN INSTITUTO VALENCIANO DE ONCOLOGIA 11 de Junio de 2015 Sabes
Qué es el herpes genital?
 Qué es el herpes genital? Es una infección de transmisión sexual muy extendida causada por el virus del herpes simple (VHS) de tipo 2 (VHS-2) y de tipo 1 (VHS-1), que también es causa habitual del herpes
Qué es el herpes genital? Es una infección de transmisión sexual muy extendida causada por el virus del herpes simple (VHS) de tipo 2 (VHS-2) y de tipo 1 (VHS-1), que también es causa habitual del herpes
PROSPECTO: INFORMACIÓN PARA EL USUARIO. BICALUTAMIDA PHARMAGENUS 50 mg comprimidos recubiertos con película EFG
 PROSPECTO PROSPECTO: INFORMACIÓN PARA EL USUARIO BICALUTAMIDA PHARMAGENUS 50 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve
PROSPECTO PROSPECTO: INFORMACIÓN PARA EL USUARIO BICALUTAMIDA PHARMAGENUS 50 mg comprimidos recubiertos con película EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve
Huntexil como tratamiento de los síntomas de la enfermedad de Huntington: Y ahora qué?
 Novedades en la investigación de la EH. En lenguaje sencillo. Escrito por científicos. Para toda la comunidad EH. Se ha publicado un nuevo artículo con más información sobre este tema: FDA: es necesario
Novedades en la investigación de la EH. En lenguaje sencillo. Escrito por científicos. Para toda la comunidad EH. Se ha publicado un nuevo artículo con más información sobre este tema: FDA: es necesario
