GENOTROPIN POLVO Y SOLVENTE PARA SOLUCIÓN INYECTABLE PRODUCTO BIOTECNOLÓGICO INNOVADOR
|
|
|
- Felisa Giménez Robles
- hace 5 años
- Vistas:
Transcripción
1 1. NOMBRE DEL MEDICAMENTO GENOTROPIN POLVO Y SOLVENTE PARA SOLUCIÓN INYECTABLE PRODUCTO BIOTECNOLÓGICO INNOVADOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Somatropina (DCI) hormona de crecimiento humana recombinante derivada de ADN producido por E.coli. 3. FORMA FARMACÉUTICA Cartucho de dos cámaras: polvo y solvente para solución para inyección. En el cartucho de dos cámaras hay un polvo blanco en el compartimiento anterior y una solución clara en el compartimiento posterior. El cartucho de dos cámaras se proporciona sellado en dispositivo desechable multidosis pluma precargada (GoQuick). 4. DETALLES CLÍNICOS 4.1. Indicaciones Terapéuticas La somatropina está indicada en el tratamiento de largo plazo de niños con trastornos del crecimiento debidos a las siguientes condiciones: Secreción insuficiente de hormona del crecimiento Síndrome de Turner Insuficiencia renal crónica Talla baja al nacer según edad gestacional Síndrome de Prader-Willi Talla baja idiopática Somatropina está indicada también para mejorar la composición corporal en niños con síndrome de Prader-Willi. La somatropina está indicada como terapia de reemplazo en adultos con deficiencia de hormona del crecimiento Posología y método de administración DOSIS Y ADMINISTRACION Deberá individualizarse la dosificación y el programa de administración. La somatropina deberá suministrarse subcutáneamente y la variación del sitio de inyección ayuda a prevenir la lipoatrofia. Tabla 1. Dosificación Recomendada para Pacientes Pediátricos Pfizer Información Confidencial Pág 1 de 33
2 Indicación peso corporal mg/kg peso corporal UI/kg Dosis Diaria área superficial corporal mg/m² área superficial corporal UI/m² Deficiencia de hormona del crecimiento Síndrome de Turner Insuficiencia renal crónica Síndrome de Prader-Willi Talla pequeña al nacer según edad gestacional Talla baja idiopática Hasta Hasta 0.20 Hasta 2.0 Hasta 6.0 Recomendaciones sobre Dosificación en Pacientes Adultos con Deficiencia de Hormona del Crecimiento La dosis inicial recomendada es mg ( UI) por día. La dosis final deberá ajustarse individualmente según sea necesario con respecto a la edad y sexo del paciente. La dosis diaria de mantenimiento escasamente excede de 1.3 mg (4 UI) por día. Las mujeres pueden requerir dosis superiores a las de los hombres. Dado que la producción normal de hormona del crecimiento fisiológica decrece con la edad, pueden reducirse los requerimientos de la dosis. La respuesta clínica, los efectos secundarios observados, y la determinación de IGF-I en el suero pueden usarse como guía para la titulación -ajuste- de la dosis. 4.3 Contraindicaciones La somatropina está contraindicada en pacientes que presenten evidencia de actividad neoplásica y en pacientes con crecimiento descontrolado de tumores intracraneanos benignos. La terapia antitumoral debe completarse antes de iniciar el tratamiento con somatropina. La somatropina está contraindicada en pacientes con enfermedad crítica aguda causada por complicaciones presentadas posteriormente a cirugías a corazón abierto o abdominal, a politraumatismo accidental, o a insuficiencia respiratoria aguda. Dos estudios clínicos controlados con placebo (N=522), realizados en pacientes adultos a fin de evaluar los efectos de la somatropina a dosis de 5.3 u 8 mg (16 o 24 UI) sobre el período de estadía en las unidades de cuidados intensivos, revelaron una tasa de mortalidad significativamente superior (41.9% versus 19.3%) entre los pacientes tratados con somatropina frente a quienes recibieron placebo (véase sección 4.4. Precauciones y Advertencias Especiales para el Uso en pacientes que estén recibiendo somatropina como reemplazo de la hormona del crecimiento). Hipersensibilidad a la sustancia activa o a cualquiera de sus excipientes No se administrará para fomentar el crecimiento en los niños con epífisis ya cerradas. Pfizer Información Confidencial Pág 2 de 33
3 4.4. Advertencias y Precauciones Especiales para el Uso Ha habido reportes de casos fatales asociados con el uso de la hormona del crecimiento en pacientes pediátricos con síndrome de Prader-Willi quienes presentaban uno o más de los siguientes factores de riesgo: obesidad severa, antecedentes de deterioro respiratorio o apnea durante el sueño, o infección respiratoria no identificada. Otro posible factor de riesgo puede ser el pertenecer al género masculino. Los pacientes con síndrome de Prader-Willi deberán evaluarse en busca de obstrucción de las vías aéreas superiores antes del inicio del tratamiento con somatropina. Si durante el tratamiento con somatropina los pacientes revelan signos de obstrucción de las vías aéreas superiores (incluyendo la instauración de ronquidos o el incremento de éstos), el tratamiento deberá interrumpirse. Todos los pacientes con síndrome de Prader-Willi deberán evaluarse respecto del desarrollo de apnea durante el sueño y vigilarse en caso de que se sospeche la aparición de dicha apnea. Tales pacientes deberán también ser objeto de un control efectivo del peso corporal y de vigilancia en busca de signos de infecciones respiratorias, las cuales deberán diagnosticarse y tratarse agresivamente tan temprano como sea posible. La miositis constituye un evento adverso muy raro que puede estar relacionado con el uso del agente preservante m-cresol en la formulación del producto. Si se desarrolla mialgia o un dolor desproporcionado en el sitio de inyección, deberá considerarse el diagnóstico de miositis y, si se confirma, deberá usarse una presentación de somatropina que no contenga m-cresol. La somatropina reduce la sensibilidad a la insulina y por lo tanto los pacientes deberán observarse en busca de evidencias de intolerancia a la glucosa. En casos aislados, la terapia con somatropina puede producir una intolerancia a la glucosa suficiente para alcanzar los criterios de diagnóstico establecidos para la diabetes mellitus de Tipo 2. El riesgo de desarrollar diabetes durante el tratamiento con somatropina es mayor en aquellos pacientes que presenten otros factores de riesgo de desarrollar diabetes mellitus Tipo 2, tales como la obesidad, historia familiar de diabetes, tratamiento con esteroides, o previo agravamiento de la intolerancia a la glucosa. En pacientes con diabetes mellitus preexistente, la dosis de terapia antidiabética puede requerir ajuste una vez que se instaure el tratamiento con somatropina. En términos generales, los niveles periféricos de la hormona tiroidea permanecen dentro del rango normal de referencia durante el tratamiento con somatropina. Sin embargo, existe un aumento de la conversión de T4 a T3 que puede dar como resultado una reducción en las concentraciones séricas de T4 y un incremento en las concentraciones séricas de T3. Este efecto puede ser de relevancia clínica en aquellos pacientes con hipotiroidismo central subclínico, en quienes el hipotiroidismo puede en teoría desarrollarse. En contraste, puede ocurrir leve hipertiroidismo en pacientes que reciban terapia de reemplazo con tiroxina. Es, por lo tanto, aconsejable efectuar pruebas de la función de la tiroides después del inicio del tratamiento con somatropina, y después de realizar ajustes en la dosificación. En pacientes con deficiencia de hormona del crecimiento secundaria al tratamiento de tumores malignos, se recomienda vigilar los signos de recidiva de la enfermedad maligna. Pfizer Información Confidencial Pág 3 de 33
4 En pacientes con desórdenes endocrinos, incluyendo deficiencia de hormona del crecimiento, pueden ocurrir deslizamientos de las epífisis de la cadera de manera más frecuente que en la población en general. Deberán evaluarse los niños que desarrollen debilidad musculoesquelética durante el tratamiento con somatropina ver sección: 4.8 Efectos indeseables En caso de que se presenten cefaleas severas o recurrentes, problemas visuales, náuseas, o vómito, se recomienda efectuar un fondo de ojo a fin de diagnosticar signos de papiledema. Si se confirma el diagnóstico de papiledema, deberá considerarse el diagnóstico de hipertensión intracraneana benigna, y si es apropiado, se deberá descontinuar el tratamiento con hormona del crecimiento. En la actualidad, no existen parámetros que sirvan al momento de tomar una decisión de si reanudar o no la terapia con hormona del crecimiento en pacientes con hipertensión intracraneana resuelta. En caso de que se opte por retomar el tratamiento con la hormona del crecimiento, será necesaria una vigilancia cuidadosa de síntomas y signos de hipertensión intracraneana. Puede presentarse un aumento de escoliosis en pacientes que experimenten un crecimiento rápido. Debido a que la hormona del crecimiento incrementa la velocidad de crecimiento, los médicos deberán estar vigilantes ante el posible desarrollo de dicha anormalidad, la cual puede manifestarse durante la terapia con hormona del crecimiento. La escoliosis suele observarse con frecuencia en pacientes con el síndrome de Prader-Willi. En pacientes con insuficiencia renal crónica, la función renal deberá encontrarse por lo menos por debajo del 50% de lo normal antes de instituir la terapia con somatropina. A fin de verificar los trastornos del crecimiento, el crecimiento deberá ser objeto de seguimiento durante el año previo a la institución de la terapia. El tratamiento conservador de la insuficiencia renal deberá estar ya establecido y deberá mantenerse durante la terapia con la hormona del crecimiento. La somatropina deberá suspenderse antes de un trasplante renal. En aquellos pacientes en terapia de reemplazo con la hormona del crecimiento que se enfermen en forma aguda y crítica, los beneficios potenciales de continuar el tratamiento con somatropina deberán sopesarse contra los riesgos potenciales (véase sección 4.3. Contraindicaciones). La somatropina no es eficaz para promover el crecimiento en niños con epífisis cerradas. 4.5 Interacción con Otros Productos Médicos y Otras Formas de Interacción La administración de somatropina puede incrementar la depuración de compuestos metabolizados por el citocromo P4503A4 (por ejemplo, esteroides sexuales, corticosteroides, anticonvulsivos, y ciclosporina). Se desconoce la significancia clínica de esta interacción potencial Fertilidad, Embarazo y Lactancia No se han evidenciado efectos nocivos de la droga en el feto en estudios de reproducción con animales. No existen estudios en mujeres embarazadas. Debido a que los estudios de Pfizer Información Confidencial Pág 4 de 33
5 reproducción en animales no son siempre predictivos de la respuesta en humanos, la somatropina deberá usarse durante el embarazo únicamente si es claramente necesario. Durante el embarazo normal, los niveles de la hormona de crecimiento pituitaria caen marcadamente después de la semana 20 de gestación, siendo reemplazada casi por completo por la hormona del crecimiento placentaria hacia la semana 30. Por lo tanto, es improbable que la continua terapia de reemplazo con somatropina sea necesaria en mujeres con deficiencia de hormona del crecimiento durante el tercer trimestre del embarazo. Se desconoce si la somatropina se excreta en la leche materna, sin embargo, se sabe que la absorción de la proteína intacta en el tracto gastrointestinal del lactante es extremadamente improbable. 4.7 Efectos sobre la Capacidad para Manejar y Usar Máquinas No se han observado efectos sobre la capacidad de conducir y de utilizar maquinaria 4.8. Efectos Indeseables Los pacientes con deficiencia de hormona del crecimiento se caracterizan por un déficit de volumen extracelular. Luego de iniciar el tratamiento con somatropina, dicho déficit es rápidamente corregido. En general, en pacientes adultos los efectos adversos relacionados con la retención de fluidos, tales como el edema periférico, rigidez musculoesquelética, artralgia, mialgia y parestesia son leves a moderados en cuanto a su naturaleza, aparecen dentro de los primeros meses del tratamiento, y se desvanecen espontáneamente, o desaparecen luego de una reducción de la dosis. La incidencia de estos efectos adversos está relacionada con la dosis empleada, la edad de los pacientes, y posiblemente inversamente relacionada con la edad de los pacientes al momento de la instauración de la deficiencia de hormona del crecimiento. Tabla de valores de los efectos adversos Las tablas 2 a 8 muestran los efectos adversos ordenados según los títulos de la Clasificación de órganos y sistemas y según la frecuencia mediante la siguiente convención: muy frecuente ( 1/10), frecuente ( 1/100 a <1/10), infrecuente ( 1/1000 a < 1/100), casos aislados ( 1/ a <1/1000), casos muy aislados (<1/10.000), se desconoce (no se puede calcular a partir de los datos disponibles) para cada una de las condiciones indicadas. Ensayos clínicos en niños con GHD Tabla 2 Tratamiento a largo plazo en niños con trastorno de crecimiento debido a la secreción insuficiente de la hormona de crecimiento Caso Caso Se desconoce (no Clasificación de Muy Frecuente Infrecuente aislado muy se puede calcular a órganos y frecuente 1/100 a 1/1000 a 1/ aislado partir de los datos sistemas 1/10 <1/10 <1/100 a <1000 <1/ disponibles) Pfizer Información Confidencial Pág 5 de 33
6 Tabla 2 Tratamiento a largo plazo en niños con trastorno de crecimiento debido a la secreción insuficiente de la hormona de crecimiento Caso Caso Clasificación de Muy Frecuente Infrecuente aislado muy órganos y frecuente 1/100 a 1/1000 a 1/ aislado sistemas 1/10 <1/10 <1/100 a <1000 <1/ Neoplasias benignas, malignas y no especificadas (que incluyen quistes y pólipos) Trastornos de metabolismo y nutrición Trastornos del sistema nervioso Trastornos musculoesqueléticos y del tejido conectivo Trastornos generales y afecciones en el sitio de administración Pruebas Reacción en el sitio de inyección $ Leucemia Artralgia* Se desconoce (no se puede calcular a partir de los datos disponibles) Diabetes tipo 2 Parestesia* Hipertensión intracraneal benigna Mialgia* Rigidez musculoesquelética * Edema periférico* Cortisol sanguíneo disminuido complementarias *Por lo general, estos efectos adversos van de leves a moderados, surgen dentro de los primeros meses de tratamiento y disminuyen espontáneamente o con la reducción de la dosis. La frecuencia de estos efectos adversos es proporcional a la dosis administrada, la edad de los pacientes y posiblemente inversamente proporcional a la edad del paciente al comienzo de la deficiencia en la hormona de crecimiento. $ Se han informado reacciones transitorias en el sitio de inyección en niños. Se desconoce la importancia clínica. Informado en niños con deficiencia en la hormona de crecimiento tratados con somatropina, pero la frecuencia parece ser similar a la de los niños sin deficiencia en la hormona de crecimiento. Ensayos clínicos en niños con Síndrome de Turner Pfizer Información Confidencial Pág 6 de 33
7 Tabla 3 Tratamiento a largo plazo en niños con trastorno de crecimiento debido al Síndrome de Turner Caso Caso Clasificación de Muy Frecuente Infrecuente aislado muy órganos y frecuente 1/100 to 1/1000 a 1/ aislado sistemas 1/10 <1/10 <1/100 a <1000 <1/ Neoplasias benignas, malignas y no especificadas (que incluyen quistes y pólipos) Trastornos de metabolismo y nutrición Trastornos del sistema nervioso Trastornos musculoesqueléticos y del tejido conectivo Trastornos generales y condiciones en el sitio de administración Pruebas Artralgia* Se desconoce (no se puede calcular a partir de los datos disponibles) Leucemia Diabetes tipo 2 Parestesia* Hipertensión intracraneal benigna Mialgia* Rigidez musculoesquelética * Edema periférico* Reacción en el sitio de inyección $ Cortisol sanguíneo disminuido complementarias *Por lo general, estos efectos adversos van de leves a moderados, surgen dentro de los primeros meses de tratamiento y disminuyen espontáneamente o con la reducción de la dosis. La frecuencia de estos efectos adversos es proporcional a la dosis administrada, la edad de los pacientes y posiblemente inversamente proporcional a la edad del paciente al comienzo de la deficiencia en la hormona de crecimiento. $ Se han informado reacciones transitorias en el sitio de inyección en niños. Se desconoce la importancia clínica. Informado en niños con deficiencia en la hormona de crecimiento tratados con somatropina, pero la frecuencia parece ser similar a la de los niños sin deficiencia en la hormona de crecimiento. Ensayos clínicos en niños con insuficiencia renal crónica Pfizer Información Confidencial Pág 7 de 33
8 Tabla 4 Tratamiento a largo plazo en niños con trastorno de crecimiento debido a la insuficiencia renal crónica Caso Caso Se desconoce (no Clasificación de Muy Frecuente Infrecuente aislado muy se puede calcular órganos y frecuente 1/100 a 1/1000 a 1/ aislado a partir de los sistemas 1/10 <1/10 <1/100 a <1000 <1/ datos disponibles) Neoplasias benignas, malignas y no especificadas Leucemia (que incluyen quistes y pólipos) Trastornos de metabolismo y nutrición Trastornos del sistema nervioso Diabetes tipo 2 Parestesia* Hipertensión intracraneal benigna Trastornos musculoesqueléticos y del tejido conectivo Trastornos generales y condiciones en el sitio de administración Pruebas Reacción en el sitio de inyección $ Artralgia* Mialgia* Rigidez musculoesquelética * Edema periférico* Cortisol sanguíneo disminuido complementarias *Por lo general, estos efectos adversos van de leves a moderados, surgen dentro de los primeros meses de tratamiento y disminuyen espontáneamente o con la reducción de la dosis. La frecuencia de estos efectos adversos es proporcional a la dosis administrada, la edad de los pacientes y posiblemente inversamente proporcional a la edad del paciente al comienzo de la deficiencia en la hormona de crecimiento. $ Se han informado reacciones transitorias en el sitio de inyección en niños. Se desconoce la importancia clínica. Informado en niños con deficiencia en la hormona de crecimiento tratados con somatropina, pero la frecuencia parece ser similar a la de los niños sin deficiencia en la hormona de crecimiento. Ensayos clínicos en niños SGA Pfizer Información Confidencial Pág 8 de 33
9 Tabla 5 Tratamiento a largo plazo en niños con trastorno de crecimiento debido a que nacieron pequeños para su edad gestacional Caso Caso Se desconoce (no Clasificación de Muy Frecuente Infrecuente aislado muy se puede calcular órganos y frecuente 1/100 a 1/1000 a 1/ aislado a partir de los sistemas 1/10 <1/10 <1/100 a <1000 <1/ datos disponibles) Neoplasias benignas, malignas y no Leucemia especificadas (que incluyen quistes y pólipos) Trastornos de metabolismo y Diabetes tipo 2 nutrición Trastornos del sistema nervioso Trastornos musculoesqueléticos y del tejido conectivo Trastornos generales y condiciones en el sitio de administración Pruebas Reacción en el sitio de inyección $ Artralgia* Parestesia* Hipertensión intracraneal benigna Mialgia* Rigidez musculoesquelética * Edema periférico* Cortisol sanguíneo disminuido complementarias *Por lo general, estos efectos adversos van de leves a moderados, surgen dentro de los primeros meses de tratamiento y disminuyen espontáneamente o con la reducción de la dosis. La frecuencia de estos efectos adversos es proporcional a la dosis administrada, la edad de los pacientes y posiblemente inversamente proporcional a la edad del paciente al comienzo de la deficiencia en la hormona de crecimiento. $ Se han informado reacciones transitorias en el sitio de inyección en niños. Se desconoce la importancia clínica. Informado en niños con deficiencia en la hormona de crecimiento tratados con somatropina, pero la frecuencia parece ser similar a la de los niños sin deficiencia en la hormona de crecimiento. Ensayos clínicos en niños con Síndrome de Prader-Willi Pfizer Información Confidencial Pág 9 de 33
10 Tabla 6 Tratamiento a largo plazo y mejora de la composición corporal en niños con trastorno de crecimiento debido al Síndrome de Prader-Willi. Caso Caso Se desconoce (no Clasificación de Muy Frecuente Infrecuente aislado muy se puede calcular órganos y frecuente 1/100 a 1/1000 a 1/ aislado a partir de los sistemas 1/10 <1/10 <1/100 a <1000 <1/ datos disponibles) Neoplasias benignas, malignas y no Leucemia especificadas (que incluyen quistes y pólipos) Trastornos de metabolismo y Diabetes tipo 2 nutrición Trastornos del sistema nervioso Trastornos musculoesqueléticos y del tejido conectivo Trastornos generales y condiciones en el sitio de administración Pruebas Parestesia* Hipertensión intracraneal benigna Artralgia* Mialgia* Edema periférico* Rigidez musculoesquelética * Reacción en el sitio de inyección $ Cortisol sanguíneo disminuido complementarias *Por lo general, estos efectos adversos van de leves a moderados, surgen dentro de los primeros meses de tratamiento y disminuyen espontáneamente o con la reducción de la dosis. La frecuencia de estos efectos adversos es proporcional a la dosis administrada, la edad de los pacientes y posiblemente inversamente proporcional a la edad del paciente al comienzo de la deficiencia en la hormona de crecimiento. $ Se han informado reacciones transitorias en el sitio de inyección en niños. Se desconoce la importancia clínica. Informado en niños con deficiencia en la hormona de crecimiento tratados con somatropina, pero la frecuencia parece ser similar a la de los niños sin deficiencia en la hormona de crecimiento. Pfizer Información Confidencial Pág 10 de 33
11 Tabla 7 Tratamiento a largo plazo en niños con trastorno de crecimiento debido a la talla baja idiopática Caso Caso Clasificación de Muy Frecuente Infrecuente aislado muy órganos y frecuente 1/100 a 1/1000 a 1/ aislado sistemas 1/10 <1/10 <1/100 a <1000 <1/ Neoplasias benignas, malignas y no especificadas (que incluyen quistes y pólipos) Trastornos de metabolismo y nutrición Trastornos del sistema nervioso Trastornos musculoesqueléticos y del tejido conectivo Trastornos generales y condiciones en el sitio de administración Pruebas Artralgia* Edema periférico* Parestesia* Reacción en el sitio de inyección $ Se desconoce (no se puede calcular a partir de los datos disponibles) Leucemia Diabetes tipo 2 Hipertensión intracraneal benigna Mialgia* Rigidez musculoesquelética * Cortisol sanguíneo disminuido complementarias *Por lo general, estos efectos adversos van de leves a moderados, surgen dentro de los primeros meses de tratamiento y disminuyen espontáneamente o con la reducción de la dosis. La frecuencia de estos efectos adversos es proporcional a la dosis administrada, la edad de los pacientes y posiblemente inversamente proporcional a la edad del paciente al comienzo de la deficiencia en la hormona de crecimiento. $ Se han informado reacciones transitorias en el sitio de inyección en niños. Se desconoce la importancia clínica. Informado en niños con deficiencia en la hormona de crecimiento tratados con somatropina, pero la frecuencia parece ser similar a la de los niños sin deficiencia en la hormona de crecimiento. Pfizer Información Confidencial Pág 11 de 33
12 Ensayos clínicos en adultos con deficiencia en la hormona de crecimiento. Tabla 8 Terapia de reemplazo en adultos con deficiencia en la hormona de crecimiento Caso Clasificación de Muy Frecuente Infrecuente aislado órganos y frecuente 1/100 a 1/1000 a 1/ sistemas 1/10 <1/10 <1/100 a <1000 Trastornos de metabolismo y nutrición Trastornos del sistema nervioso Trastornos musculoesqueléticos y de tejido conectivo Trastornos generales y condiciones en el sitio de administración Pruebas complementarias Artralgia* Edema periférico * Parestesia* Mialgia* Rigidez musculoesquelética* Caso muy aislado <1/ Se desconoce (no se puede calcular a partir de los datos disponibles) Diabetes tipo 2 Hipertensión intracraneal benigna Cortisol sanguíneo disminuido *Por lo general, estos efectos adversos van de leves a moderados, surgen dentro de los primeros meses de tratamiento y disminuyen espontáneamente o con la reducción de la dosis. La frecuencia de estos efectos adversos es proporcional a la dosis administrada, la edad de los pacientes y posiblemente inversamente proporcional a la edad del paciente al comienzo de la deficiencia en la hormona de crecimiento. Se desconoce la importancia clínica. En niños se han reportado reacciones en el sitio de inyección transitorias. Se ha informado que la somatropina reduce los niveles del cortisol. Se desconoce la significancia clínica de tal hallazgo. Casos aislados de leucemia se han reportado en niños con deficiencia de hormona de crecimiento, tratados con somatropina, sin embargo, la incidencia parece ser similar a la observada en niños sin dicha deficiencia. En la experiencia post-comercialización se han reportado casos raros de muerte repentina en pacientes afectados por el síndrome de Prader-Willi tratados con somatropina, sin embargo, no se ha demostrado ninguna relación causal. Se han informado deslizamiento de la epífisis capital femoral y enfermedad de Legg-Calvé- Perthes en niños tratados con hormona del crecimiento. No se han observado relaciones causales con la somatropina. Pfizer Información Confidencial Pág 12 de 33
13 4.9 Sobredosificación La sobredosificación aguda podría conducir inicialmente a hipoglicemia y subsiguientemente a hiperglicemia. La sobredosis por largo plazo podría dar como resultado signos y síntomas consistentes con los efectos del exceso de hormona humana del crecimiento. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades Farmacodinámicas La somatropina es una potente hormona metabólica de importancia para el metabolismo de lípidos, carbohidratos y proteínas. En niños con hormona de crecimiento endógena inadecuada, la somatropina estimula el crecimiento lineal y aumenta la tasa de crecimiento. En adultos, así como en niños, la somatropina mantiene una composición corporal normal incrementando la retención de nitrógeno y estimulando el crecimiento del músculo esquelético, así como movilizando la grasa corporal. El tejido adiposo visceral responde de forma especial a la somatropina. Además del incremento de la lipólisis, la somatropina disminuye la absorción de triglicéridos en los depósitos adiposos del cuerpo. Las concentraciones séricas de IGF-I (factor de crecimiento tipo insulina-i) y de IGFBP3 (proteína 3 de unión a factor de crecimiento similar a la insulina) son incrementadas por la somatropina. Además, se han demostrado las siguientes acciones: Metabolismo lipídico: La somatropina actúa sobre los receptores hepáticos de colesterol LDL y afecta al perfil de lípidos séricos y lipoproteínas. En general, la administración de somatropina a pacientes con deficiencia de hormona de crecimiento causa una reducción en los niveles séricos de colesterol LDL y apolipoproteína B. También puede observarse una reducción de colesterol total sérico. Metabolismo de los hidratos de carbono: La somatropina aumenta la insulina pero normalmente no varía la glucosa en sangre en ayunas. Los niños con hipopituitarismo pueden experimentar hipoglucemia en ayunas. La somatropina puede revertir esta situación. Metabolismo del agua y mineral: La deficiencia de hormona de crecimiento está asociada a la disminución del volumen plasmático y extracelular. Ambos aumentan rápidamente después del tratamiento con somatropina. La somatropina causa retención de sodio, potasio y fósforo. Metabolismo óseo: La somatropina estimula la producción de masa ósea esquelética. La administración de somatropina a largo plazo a pacientes con deficiencia de hormona de crecimiento con osteopenia produce un aumento del contenido mineral óseo y densidad ósea en las partes del cuerpo que soportan peso. Capacidad física: La fuerza muscular y la capacidad de ejercicio físico mejoran después del tratamiento a largo plazo con somatropina. La somatropina también incrementa el gasto cardíaco pero el mecanismo no ha quedado todavía aclarado. Una disminución en la resistencia vascular periférica puede contribuir a este efecto. En estudios clínicos realizados en niños nacidos pequeños para su edad gestacional (SGA), se han utilizado dosis de y mg/kg de peso corporal por día para el tratamiento hasta alcanzar la altura final. En 56 pacientes que recibieron tratamiento continuo y alcanzaron (cercana) la Pfizer Información Confidencial Pág 13 de 33
14 altura final, la variación media de altura al comienzo del tratamiento fue SDS (0.033 mg/kg de peso corporal por día) y SDS (0.067 mg/kg de peso corporal por día). Los datos bibliográficos de niños SGA no tratados sin una recuperación de altura espontánea inicial, sugieren un crecimiento tardío de 0.5 SDS. Los datos de seguridad a largo plazo son todavía limitados Propiedades Farmacocinéticas Absorción Después de una inyección subcutánea (SC) de 0.03 mg/kg en el muslo de 1.3 mg/ml de Somatropina en pacientes GHD adultos, aproximadamente 80% de la dosis estuvo sistemáticamente disponible cuando se comparó con la disponibilidad después de una dosis intravenosa. Los resultados fueron comparables en pacientes femeninos y masculinos. Se observó una biodisponibilidad similar en sujetos masculinos adultos saludables. En mujeres adultas saludables, después de una inyección SC en el muslo de 0.03 mg/kg, el grado de absorción (AUC) de una concentración de 5.3 mg/ml de Somatropina fue 35% mayor que aquel alcanzado con una concentración de 1.3 mg/ml de Somatropina. Los niveles séricos promedio ( desviación estándar) del pico (C máx ) fueron 23.0 ( 9.4) ng/ml y 17.4 ( 9.2) ng/ml, respectivamente. En un estudio similar en donde se involucraron pacientes GHD pediátricos, 5.3 mg/ml de Somatropina produjo un AUC promedio que fue 17% mayor a aquel producido con 1.3 mg/ml de Somatropina. Los niveles C máx promedios fueron 21.0 ng/ml y 16.3 ng/ml, respectivamente. Los pacientes GHD adultos recibieron dos dosis SC únicas de 0.03 mg/kg de Somatropina con una concentración de 1.3 mg/ml, con un periodo de desintoxicación de una a cuatro semanas entre inyecciones. Los niveles C máx promedios fueron 12.4 ng/ml (primera inyección) y 12.2 ng/ml (segunda inyección), alcanzados a aproximadamente seis horas después de la dosis. No existen datos sobre la bioequivalencia entre la formulación de 12-mg/mL y las formulaciones de 1.3-mg/mL o 5.3-mg/mL. Distribución El volumen promedio de distribución de Somatropina después de la administración a adultos GHD se estimó que era 1.3 ( 0.8) L/kg. Metabolismo El destino metabólico de Somatropina involucra el catabolismo de proteína clásica en los riñones e hígado. En las células renales, al menos una porción de los productos de descomposición son devueltos a la circulación sistémica. La vida media terminal promedio de Somatropina intravenosa en adultos normales es 0.4 horas, mientras que la Somatropina administrada subcutáneamente tiene una vida media de 3.0 horas en adultos GHD. La diferencia observada se debe a la lenta absorción del sitio de inyección subcutáneo. Pfizer Información Confidencial Pág 14 de 33
15 Excreción La depuración promedio de la Somatropina administrada subcutáneamente en 16 pacientes adultos GHD fue 0.3 ( 0.11) L/horas/kg. Poblaciones especiales Pediátrica: La farmacocinética de Somatropina es similar en los pacientes adultos y pediátricos GHD. Género: No se han realizado estudios de género en pacientes pediátricos; sin embargo, en adultos GHD, la biodisponibilidad absoluta de Somatropina fue similar en hombres y mujeres. Raza: No se han realizado estudios con Somatropina para evaluar las diferencias farmacocinéticas entre las razas. Insuficiencia renal o hepática: No existe información suficiente relacionada con la farmacocinética de somatropina en pacientes con insuficiencia renal o hepática Información de Seguridad Preclínica No se han observado efectos clínicamente relevantes en estudios relacionados con toxicidad en general, tolerancia local y toxicidad reproductiva Los estudios de genotoxicidad in vitro e in vivo sobre mutaciones genéticas e inducción de aberraciones cromosómicas han sido negativos. Se ha observado un aumento de la fragilidad cromosómica en un estudio in vitro en los linfocitos de pacientes sometidos a tratamiento a largo plazo con somatropina y posterior a la adición de bleomicina, fármaco radio mimético. La significancia clínica de este hallazgo no está clara. En otro estudio, no se encontró ningún incremento de anormalidades cromosómicas en los linfocitos de pacientes sometidos a terapia con somatropina a largo plazo. 6. DETALLES FARMACÉUTICOS 6.1 Lista de Excipientes Genotropin 16 UI/ml Polvo y solvente para Solución inyectable, Excipientes: Glicina 2.30 mg, Manitol 1.80 mg, Fosfato dihidrogenado de sodio anhidro 0.33 mg, fosfato disódico anhidro 0.32 mg. Compartimiento II: Metacresol 3.40 mg, Manitol mg, Agua para Inyectable c.s.p ml Genotropin 36 UI/ml Polvo y solvente para Solución inyectable, Excipientes: Glicina 2.30 mg, Manitol 14 mg, Fosfato dihidrogenado de sodio anhidro 0.47 mg, fosfato disódico anhidro 0.46 mg. Compartimiento II: Metacresol 3.40 mg, Manitol 32 mg, Agua para Inyectable c.s.p ml Pfizer Información Confidencial Pág 15 de 33
16 6.2 Incompatibilidades Sólo debe reconstituirse con el solvente para solución inyectable incluido. 6.3 Período de Validez 24 meses Precauciones Especiales de Almacenamiento Todo medicamento debe conservarse fuera del alcance de los niños. El polvo de inyección puede durar hasta 24 meses si se mantiene a una temperatura de 2 a 8 C. El almacenamiento por un mes puede darse a temperatura ambiente. El polvo reconstituido debe almacenarse a una temperatura de 2 a 8 C por no más de 4 semanas y protegido de la luz. No se debe utilizar el polvo congelado Naturaleza y Contenido del Envase Genotropin 16 UI/ml (5.3 mg) Polvo y solvente para Solución inyectable Envase Externo: Caja de Cartón Empaque Interno Mediato: Blíster PVC / Papel Empaque Interno Inmediato: Cartucho de vidrio tipo I, el compartimiento delantero se sella con un casquillo de aluminio con un disco bromo butílico y el compartimiento posterior se sella con un émbolo de caucho bromo butílico. Pluma Dosificadora (GoQuick) tapa de color blanco de polibutileno tereftalato portacartucho de policarbonato poliéster copolímero o polibutileno tereftalato, en donde el cuerpo es de color blanco con un anillo negro, disco gris émbolo de color azul con logo impreso. Presentación Comercial: Caja x 1 Cartucho con Doble Compartimiento x 6.10 mg de Somatropina ml de Disolvente + Pluma Dosificadora (Go Quick) + Inserto Genotropin 36 UI/ml (12 mg) Polvo y solvente para Solución inyectable Envase Externo: Caja de Cartón Empaque Interno Mediato: Blíster PVC / Papel Empaque Interno Inmediato: Cartucho de vidrio tipo I, el compartimiento delantero se sella con un casquillo de aluminio con un disco de caucho bromo butílico y el compartimiento posterior se sella con un émbolo de caucho bromo butílico. Presentación Comercial: Caja x 1 Cartucho con Doble Compartimiento x 12 mg de Somatropina ml de Disolvente + Pluma Dosificadora (Go Quick) + inserto. Pfizer Información Confidencial Pág 16 de 33
17 6.6. Instrucciones para el Uso/Manipulación La solución se reconstituye dentro del Genotropin Pen en el momento que en el que se atornillan las dos partes del autoinyector después de haber insertado el cartucho al mismo. Para mezclar la solución, suavemente meza el dispositivo. Nunca agitar el producto reconstituido, ya que se puede desnaturalizar el ingrediente activo. La aguja del Genotropin Pen debe colocarse antes de la reconstitución de la solución. Fabricado por: Pfizer Manufacturing Belgium NV. Puurs, Bélgica Importado y Distribuido por. Pfizer Cía., Ltda. Quito Ecuador. Basado en Documento de Producto V7.0 del 18 de diciembre de 2014 Nombre Genérico: Somatropina (DCI) hormona de crecimiento humana recombinante derivada de ADN producido por E.coli. Número del Documento de Producto: 7.0 Fecha: 18 de Diciembre de 2014 Reemplaza: 11 de Julio de 2014 Pfizer Información Confidencial Pág 17 de 33
18 INSTRUCCIONES DE USO GENOTROPIN 16 UI (5,3mg) Somatropina Recombinante Aplicador Pre-cargado GoQuick en Ecuador: Pluma dosificadora "GoQuick" Información importante Por favor, lea completamente estas instrucciones antes de usar GoQuick. Aplicador pre-cargado (en Ecuador: Pluma dosificadora). Si tiene alguna duda sobre su dosis o su tratamiento con Genotropin, llame a su médico o enfermera. Acerca del Aplicador Pre-cargado GoQuick Aplicador Pre-cargado GoQuick (en Ecuador: pluma dosificadora) es una dispositivo para inyección precargada, multidosis y desechable que contiene 5,3 mg de somatropina. El contenido de Genotropin debe mezclarse sólo una vez, cuando empieza a usarse un aplicador. Se puede usar el mismo aplicador hasta 28 días después de mezclar el contenido. Nunca tendrá que cambiar cartuchos. Cuando el aplicador se vacíe, simplemente empiece a usar uno nuevo. El Aplicador pre-cargado tiene memoria de la dosis. La dosis se fija una sola vez en el aplicador. El Aplicador pre-cargado usará luego la misma dosis en cada inyección. El aplicador puede usarse con o sin el cubreaguja optativo. Antes de usar el aplicador Precargado "Go-Quick" Solicite a su médico o enfermera que le enseñen a usarla. Conozca su dosis. Conozca las partes del aplicador. Compruebe que tiene el aplicador con el botón de inyección violeta. Lávese las manos. Paso 1. Conecte la aguja a. Hale hacia afuera la tapa blanca del aplicador. b. Quítele el seguro a una aguja nueva. c. Sostenga firmemente el portacartuchos (Figura 1). d. Empuje la aguja sobre la punta del portacartucho. e. Enrosque suavemente la aguja en el aplicador. No apriete demasiado. f. Deje puestas las dos tapas de la aguja. Pfizer Información Confidencial Pág 18 de 33
19 Paso 2. Mezcle el Genotropin a. Sostenga el aplicador con la aguja hacia arriba y con A hacia usted (Figura 2). b. Gire firmemente el portacartucho hasta que B entre en la muesca. Incline suavemente el aplicador de lado a lado. No agite el aplicador. Podría deteriorarse la hormona del crecimiento. c. Revise que el líquido del cartucho esté transparente. Todo el polvo debe estar disuelto. De no ser así, continúe inclinando suavemente el aplicador a un lado y otro. d. Vuelva a revisar el líquido. Compruebe que esté transparente. Si el líquido está transparente, vaya al Paso 3. Si el líquido sigue estando turbio o todavía se ve polvo, use el aplicador nuevo. Paso 3. Elimine el aire a. Quite la tapa exterior de la aguja. Guárdela para volver a tapar la aguja (Figura 3a). b. Deje puesta la tapa interior de la aguja. c. Sostenga el aplicador con la aguja apuntando hacia arriba (Figura 3b). d. Golpee suavemente el portacartucho para hacer que suba a la superficie cualquier aire atrapado. e. Haga girar firmemente el portacartucho en el aplicador hasta que C entre en la muesca. Puede aparecer algo de líquido alrededor de la cubierta interior de la aguja. Paso 4. Coloque el protector de aguja (opcional) a. Quite la tapa negra del cubreaguja (Figura 4a). Si el capuchón de la aguja se sale, empújelo dentro del cubreaguja hasta oír que queda trabado en su sitio. b. Sostenga el aplicador en una mano por abajo del emblema azul. Con la otra mano, sostenga el protector de aguja por debajo de la cubierta de la aguja (Figura 4b). Pfizer Información Confidencial Pág 19 de 33
20 c. Alinee el emblema negro del cubreaguja con el emblema azul del aplicador. Empuje con cuidado el cubreaguja sobre el aplicador hasta que quede trabado en su lugar. Paso 5. Purgue el aplicador a. Quite la tapa interior de la aguja. Deséchela (Figura 5a). b. Compruebe que la ventana de memoria indique 0,1 mg. c. Haga girar el disco gris como indican las flechas, hasta que deje de sonar (Figura 5b). d. Sostenga el aplicador con la aguja apuntando hacia arriba (Figura 5c con y sin el protector de aguja). e. Empuje el botón de inyección azul hasta que aparezca líquido. f. Si no aparece líquido en el Paso "e", repita los Pasos b a e de esta sección hasta otras dos veces. g. Si aún no aparece líquido, no use el aplicador. Encontrará mayor información en la sección Preguntas y respuestas, más adelante. h. Si utiliza el cubreaguja, oprima el botón negro para soltar la cubierta de la aguja (Figura 5d). Pfizer Información Confidencial Pág 20 de 33
21 Paso 6. Fije la dosis Haga girar el aro negro para fijar la dosis. Tenga cuidado de no hacer girar el disco gris mientras fija la dosis. a. Sostenga el aro negro como se muestra en la Figura 6. b. Haga girar el aro negro hasta que su dosis coincida con el indicador blanco. Su médico o enfermera le han indicado su dosis. c. Si al marcar su dosis se pasa del indicador blanco, haga retroceder el aro negro para marcar la dosis correcta. d. Una vez que marque su dosis, no la cambie si no se lo ordenan su médico o enfermera. Nota: Si no puede hacer girar el aro negro, oprima el botón de inyección azul hasta que deje de sonar. Luego, continúe fijando su dosis con el aro negro (encontrará información adicional también en la sección de Preguntas y respuestas). Paso 7. Extraiga una dosis a. Haga girar el disco gris como indica la flecha, hasta que deje de sonar (Figura 7a). b. La dosis que muestra la barra negra debe coincidir con el indicador blanco. c. Revise que la dosis extraída que muestra la barra negra sea la misma que indicó en la ventana de memoria. La Figura 7b. presenta un ejemplo. d. Si la dosis no coincide, verifique que haya girado el disco gris en la dirección de la flecha hasta que dejó de sonar. Paso 8. Aplique la inyección a. Prepare el sitio de inyección como le explicó su médico o enfermera. b. Sostenga el aplicador sobre el sitio de inyección. c. Empuje el aplicador hacia abajo para introducir la aguja en la piel. d. Con el dedo pulgar, empuje el botón de inyección azul hasta que deje de sonar (Figura 8). Cuente 5 segundos antes de sacar la aguja de la piel. Mientras cuenta, mantenga el botón oprimido suavemente con el pulgar. Pfizer Información Confidencial Pág 21 de 33
22 e. Separe el aplicador de la piel sin inclinarla. Paso 9. Quite la aguja: Tape el aplicador y guárdela Paso 9a. Con el protector de aguja a. Ponga la tapa exterior de la aguja en la punta de la cubierta (Figura 9a). b. Con la tapa de la aguja, empuje hacia adentro la cubierta hasta que quede trabado en su lugar. c. Con la tapa de la aguja, desenrosque la aguja y póngala en un envase apropiado para agujas usadas. d. Deje el cubreaguja puesto en el aplicador. e. Ponga la tapa negra en el protector de la aguja. Guarde el aplicador en el refrigerador. Paso 9b: Sin protector de aguja a. No toque la aguja. b. Cubra con cuidado la aguja, con su tapa exterior (Figura 9b). c. Con la tapa de la aguja, desenrosque la aguja y póngala en un envase apropiado para agujas usadas. d. Ponga la tapa blanca en el aplicador. Guarde su aplicador en el refrigerador. 1. Hale hacia afuera la tapa negra del protector de aguja o la tapa blanca de la pluma. Pfizer Información Confidencial Pág 22 de 33
23 2. Monte una aguja nueva. Si usa el protector de aguja: Si el cubierta de la aguja se suelta, colóquelo de nuevo en su lugar. Monte una aguja nueva en la punta del portacartucho. Si no usa el protector de aguja: Monte una aguja nueva en la punta del portacartucho. 3. Retire las dos tapas de la aguja. Guarde la tapa exterior de la aguja 4. Si utiliza el protector de aguja, oprima el botón liberador negro para extender la cubierta. 5. Para extraer la dosis, haga girar el disco gris hasta que deje de sonar. 6. Compruebe que la dosis extraída sea la misma que indicó en la ventana de memoria. Si la dosis extraída es menor, puede deberse a que el aplicador no contiene ya suficiente Genotropin para completar la dosis. Haga lo que su médico o enfermera le indicaron hacer cuando el aplicador no tuviera ya la dosis completa Pfizer Información Confidencial Pág 23 de 33
24 7. Prepare el sitio de inyección como le explicó su médico o enfermera. 8. Aplique la inyección. Empuje el aplicador hacia abajo para introducir la aguja en la piel. Empuje el botón de inyección azul hasta que deje de sonar. Cuente 5 segundos antes de sacar la aguja de la piel. Mientras cuenta, mantenga el botón oprimido suavemente con el pulgar. Separe el aplicador de la piel sin inclinarla. 9. Quite la aguja. Si usa el protector de aguja Con la tapa exterior de la aguja, empuje hacia adentro el capuchón hasta que quede trabado en su lugar. Si no usa el protector de aguja Cubra con cuidado la aguja, con su tapa exterior. Con la tapa exterior, desenrosque la aguja. Deseche la aguja en un envase apropiado para agujas usadas 10. Tape el cubreaguja o el aplicador y guárdela en el refrigerador. Almacenamiento Consulte la forma de almacenar su aplicador en el folleto de información para el paciente. Pasados 28 días, deseche el aplicador, aunque todavía contenga medicamento. No congele ni exponga a la escarcha. No use el aplicador después de su fecha de caducidad. Cumpla las leyes locales de salud y seguridad para desechar el aplicador. Pregunte a su médico o enfermera, si no sabe bien qué hacer. Manipulación No mezcle el polvo y el líquido de aplicador si el aplicador no tiene colocada la aguja. No guarde el aplicador con la aguja colocada. Puede fugarse Genotropin del aplicador y formarse burbujas en el cartucho. Antes de guardar el aplicador, siempre quítele la aguja y póngale su tapa o el protector de aguja. No deje caer el aplicador. Si se le cae el aplicador, deberá prepararla de nuevo, como se describe en el Paso 5 (Preparación y uso). Pero si alguna parte de su aplicador parece haberse roto o dañado, no use el aplicador. Póngase en contacto con su médico o enfermera para obtener otra. Limpie el aplicador y el protector de la aguja con un paño húmedo. No ponga el aplicador en agua Pfizer Información Confidencial Pág 24 de 33
25 Agujas Siempre use una aguja nueva para cada inyección. Ponga todas las agujas usadas en un envase apropiado de "objetos punzantes". Al desechar sus agujas, respete las leyes locales de salud y seguridad. Pregunte a su médico o enfermera, si no sabe bien qué hacer. No comparta su aplicador ni sus agujas. Generalidades Los números y marcas del portacartucho le ayudarán a calcular la cantidad aproximada de GENOTROPIN que queda en el aplicador. Si en el Paso 6 del uso regular el aplicador no tiene una dosis completa de Genotropin, la escala de la barra negra indicará la cantidad de medicamento que queda en el aplicador. Los pacientes ciegos o con problemas visuales deben usar el aplicador solamente con ayuda de otra persona capacitadapara usarla. Siga las instrucciones de su médico o enfermera respecto a asearse las manos y la piel al prepararse para aplicar la inyección. No deseche su cubreaguja; para retirarlo, desenrósquelo del aplicador. Guárdelo para usarlo con cada pluma nueva. Si tiene alguna duda sobre cómo usar el aplicador, consulte a su médico o enfermera. Pregunta Qué debo hacer si veo más de una gotita de líquido en la aguja después de aplicar la inyección? Hay problema si se ven burbujas en el cartucho? Qué debo hacer si veo que se escapa medicamento del aplicador? Respuesta Cuando se vuelva a inyectar, antes de sacar la aguja de la piel espere 5 segundos completos. Si todavía ve algo de líquido después de sacar la aguja, la próxima vez déjela adentro un poco más de tiempo. No, durante el uso normal puede haber cantidades pequeñas de aire en el cartucho. Compruebe que la aguja esté bien conectada. Qué debo hacer si el aplicador que estoy utilizando no estuvo en el refrigerador durante la noche? Qué hago si no puedo hacer girar al aro negro? Deseche el aplicador y use un aplicador nuevo. Es probable que haya hecho girar accidentalmente el disco gris. Cuando se hace girar el disco gris, el aplicador impide que el aro negro dé vuelta, para evitar que la dosis se cambie durante la inyección. Para liberar el aro negro, oprima hasta el tope el botón azul de inyección. Tenga en cuenta que saldrá líquido de la aguja. Luego, proceda a fijar su dosis con el aro negro. Qué pasa si mi médico me cambia la dosis cuando ya había empezado a usar mi aplicador? Qué pasa si me inyecto una dosis equivocada? Qué hago si el aplicador no se purga (o sea, si no sale líquido en el Paso 5 c)? Qué dosis puede aplicar mi aplicador? Marque la nueva dosis haciendo girar al aro negro. Llame inmediatamente a su médico o enfermera y siga sus instrucciones. Llame a su médico o enfermera y siga sus instrucciones. El aplicador puede aplicar dosis de 0,10mg a 1,5 mg de Genotropin. Cada paso (clic) del aro negro cambia la dosis en 0,05 mg. Pfizer Información Confidencial Pág 25 de 33
26 INSTRUCCIONES DE USO GENOTROPIN 36 UI (12mg) Somatropina Recombinante Aplicador Pre-cargado GoQuick en Ecuador: Pluma dosificadora "GoQuick" Información importante Por favor, lea completamente estas instrucciones antes de usar GoQuick. Aplicador pre-cargado (en Ecuador: Pluma dosificadora). Si tiene alguna duda sobre su dosis o su tratamiento con Genotropin, llame a su médico o enfermera. Acerca del Aplicador Pre-cargado GoQuick Aplicador Pre-cargado GoQuick (en Ecuador: pluma dosificadora) es una dispositivo para inyección precargada, multidosis y desechable que contiene 12 mg de somatropina. El contenido de Genotropin debe mezclarse sólo una vez, cuando empieza a usarse un aplicador. Se puede usar el mismo aplicador hasta 28 días después de mezclar el contenido. Nunca tendrá que cambiar cartuchos. Cuando el aplicador se vacíe, simplemente empiece a usar uno nuevo. El Aplicador pre-cargado tiene memoria de la dosis. La dosis se fija una sola vez en el aplicador. El Aplicador pre-cargado usará luego la misma dosis en cada inyección. El aplicador puede usarse con o sin el cubreaguja optativo. Antes de usar el aplicador Precargado "Go-Quick" Solicite a su médico o enfermera que le enseñen a usarla. Conozca su dosis. Conozca las partes del aplicador. Compruebe que tiene el aplicador con el botón de inyección violeta. Lávese las manos. Paso 1. Conecte la aguja a. Hale hacia afuera la tapa blanca del aplicador b. Quítele el seguro a una aguja nueva c. Sostenga firmemente el portacartuchos (Figura 1). d. Empuje la aguja sobre la punta del portacartucho. e. Enrosque suavemente la aguja en el aplicador. No apriete demasiado. f. Deje puestas las dos tapas de la aguja. Pfizer Información Confidencial Pág 26 de 33
27 Paso 2. Mezcle el Genotropin a. Sostenga el aplicador con la aguja hacia arriba y con A hacia usted (Figura 2). b. Gire firmemente el portacartucho hasta que B entre en la muesca. Incline suavemente el aplicador de lado a lado. No agite el aplicador. Podría deteriorarse la hormona del crecimiento. c. Revise que el líquido del cartucho esté transparente. Todo el polvo debe estar disuelto. De no ser así, continúe inclinando suavemente el aplicador a un lado y otro. d. Vuelva a revisar el líquido. Compruebe que esté transparente. Si el líquido está transparente, vaya al Paso 3. Si el líquido sigue estando turbio o todavía se ve polvo, use el aplicador nuevo. Paso 3. Elimine el aire a. Quite la tapa exterior de la aguja. Guárdela para volver a tapar la aguja (Figura 3a). b. Deje puesta la tapa interior de la aguja. c. Sostenga el aplicador con la aguja apuntando hacia arriba (Figura 3b). d. Golpee suavemente el portacartucho para hacer que suba a la superficie cualquier aire atrapado. e. Haga girar firmemente el portacartucho en el aplicador hasta que C entre en la muesca. Puede aparecer algo de líquido alrededor de la cubierta interior de la aguja. Paso 4. Coloque el protector de aguja (opcional) a. Quite la tapa negra del cubreaguja (Figura 4a). Si el capuchón de la aguja se sale, empújelo dentro del cubreaguja hasta oír que queda trabado en su sitio. b. Sostenga el aplicador en una mano por abajo del emblema violeta. Con la otra mano, sostenga el protector de aguja por debajo de la cubierta de la aguja (Figura 4b). c. Alinee el emblema negro del cubreaguja con el emblema violeta del aplicador. Empuje con cuidado el cubreaguja sobre el aplicador hasta que quede trabado en su lugar. d. Sostenga el aplicador en una mano por abajo del emblema violeta. Con la otra mano, sostenga el protector de aguja por debajo de la cubierta de la aguja (Figura 4b). Pfizer Información Confidencial Pág 27 de 33
28 e. Alinee el emblema negro del cubreaguja con el emblema violeta del aplicador. Empuje con cuidado el cubreaguja sobre el aplicador hasta que quede trabado en su lugar. Paso 5. Purgue el aplicador a. Quite la tapa interior de la aguja. Deséchela (Figura 5a). b. Compruebe que la ventana de memoria indique 0,3 mg. c. Haga girar el disco gris como indican las flechas, hasta que deje de sonar (Figura 5b). e. Sostenga el aplicador con la aguja apuntando hacia arriba (Figura 5c con y sin el protector de aguja). f. Empuje el botón de inyección violeta hasta que aparezca líquido. g. Si no aparece líquido en el Paso "e", repita los Pasos b a e de esta sección hasta otras dos veces. h. Si aún no aparece líquido, no use el aplicador. Encontrará mayor información en la sección Preguntas y respuestas, más adelante. i. Si utiliza el cubreaguja, oprima el botón negro para soltar la cubierta de la aguja (Figura 5d). Pfizer Información Confidencial Pág 28 de 33
29 Paso 6. Fije la dosis Haga girar el aro negro para fijar la dosis. Tenga cuidado de no hacer girar el disco gris mientras fija la dosis. a. Sostenga el aro negro como se muestra en la Figura 6. b. Haga girar el aro negro hasta que su dosis coincida con el indicador blanco. Su médico o enfermera le han indicado su dosis. c. Si al marcar su dosis se pasa del indicador blanco, haga retroceder el aro negro para marcar la dosis correcta. d. Una vez que marque su dosis, no la cambie si no se lo ordenan su médico o enfermera. Nota: Si no puede hacer girar el aro negro, oprima el botón de inyección púrpura hasta que deje de sonar. Luego, continúe fijando su dosis con el aro negro (encontrará información adicional también en la sección de Preguntas y respuestas). Paso 7. Extraiga una dosis a. Haga girar el disco gris como indica la flecha, hasta que deje de sonar (Figura 7a). b. La dosis que muestra la barra negra debe coincidir con el indicador blanco. c. Revise que la dosis extraída que muestra la barra negra sea la misma que indicó en la ventana de memoria. La Figura 7b. presenta un ejemplo. d. Si la dosis no coincide, verifique que haya girado el disco gris en la dirección de la flecha hasta que dejó de sonar. Paso 8. Aplique la inyección a. Prepare el sitio de inyección como le explicó su médico o enfermera. b. Sostenga el aplicador sobre el sitio de inyección. c. Empuje el aplicador hacia abajo para introducir la aguja en la piel. d. Con el dedo pulgar, empuje el botón de inyección púrpura hasta que deje de sonar (Figura 8). Cuente 5 segundos antes de sacar la aguja de la piel. Mientras cuenta, mantenga el botón oprimido suavemente con el pulgar. e. Separe el aplicador de la piel sin inclinarla. Pfizer Información Confidencial Pág 29 de 33
30 Paso 9. Quite la aguja: Tape el aplicador y guárdela Paso 9a. Con el protector de aguja a. Ponga la tapa exterior de la aguja en la punta de la cubierta (Figura 9a). b. Con la tapa de la aguja, empuje hacia adentro la cubierta hasta que quede trabado en su lugar. c. Con la tapa de la aguja, desenrosque la aguja y póngala en un envase apropiado para agujas usadas. d. Deje el cubreaguja puesto en el aplicador. e. Ponga la tapa negra en el protector de la aguja. Guarde el aplicador en el refrigerador. Paso 9b: Sin protector de aguja a. No toque la aguja. b. Cubra con cuidado la aguja, con su tapa exterior (Figura 9b). c. Con la tapa de la aguja, desenrosque la aguja y póngala en un envase apropiado para agujas usadas. d. Ponga la tapa blanca en el aplicador. Guarde su aplicador en el refrigerador. 1. Hale hacia afuera la tapa negra del protector de aguja o la tapa blanca de la pluma. 2. Monte una aguja nueva. Si usa el protector de aguja: Si el cubierta de la aguja se suelta, colóquelo de nuevo en su lugar. Monte una aguja nueva en la punta del portacartucho. Pfizer Información Confidencial Pág 30 de 33
31 Si no usa el protector de aguja: Monte una aguja nueva en la punta del portacartucho. 3. Retire las dos tapas de la aguja. Guarde la tapa exterior de la aguja 4. Si utiliza el protector de aguja, oprima el botón liberador negro para extender la cubierta. 5. Para extraer la dosis, haga girar el disco gris hasta que deje de sonar. 6. Compruebe que la dosis extraída sea la misma que indicó en la ventana de memoria. Si la dosis extraída es menor, puede deberse a que el aplicador no contiene ya suficiente Genotropin para completar la dosis. Haga lo que su médico o enfermera le indicaron hacer cuando el aplicador no tuviera ya la dosis completa 7. Prepare el sitio de inyección como le explicó su médico o enfermera. 8. Aplique la inyección. Empuje el aplicador hacia abajo para introducir la aguja en la piel. Empuje el botón de inyección púrpura hasta que deje de sonar. Cuente 5 segundos antes de sacar la aguja de la piel. Mientras cuenta, mantenga el botón oprimido suavemente con el pulgar. Separe el aplicador de la piel sin inclinarla. Pfizer Información Confidencial Pág 31 de 33
32 9. Quite la aguja. Si usa el protector de aguja Con la tapa exterior de la aguja, empuje hacia adentro el capuchón hasta que quede trabado en su lugar. Si no usa el protector de aguja Cubra con cuidado la aguja, con su tapa exterior. Con la tapa exterior, desenrosque la aguja. Deseche la aguja en un envase apropiado para agujas usadas 10. Tape el cubreaguja o el aplicador y guárdela en el refrigerador. Almacenamiento Consulte la forma de almacenar su aplicador en el folleto de información para el paciente. Pasados 28 días, deseche el aplicador, aunque todavía contenga medicamento. No congele ni exponga a la escarcha. No use el aplicador después de su fecha de caducidad. Cumpla las leyes locales de salud y seguridad para desechar el aplicador. Pregunte a su médico o enfermera, si no sabe bien qué hacer. Manipulación No mezcle el polvo y el líquido de aplicador si el aplicador no tiene colocada la aguja. No guarde el aplicador con la aguja colocada. Puede fugarse Genotropin del aplicador y formarse burbujas en el cartucho. Antes de guardar el aplicador, siempre quítele la aguja y póngale su tapa o el protector de aguja. No deje caer el aplicador. Si se le cae el aplicador, deberá prepararla de nuevo, como se describe en el Paso 5 (Preparación y uso). Pero si alguna parte de su aplicador parece haberse roto o dañado, no use el aplicador. Póngase en contacto con su médico o enfermera para obtener otra. Limpie el aplicador y el protector de la aguja con un paño húmedo. No ponga el aplicador en agua Agujas Siempre use una aguja nueva para cada inyección. Ponga todas las agujas usadas en un envase apropiado de "objetos punzantes". Al desechar sus agujas, respete las leyes locales de salud y seguridad. Pregunte a su médico o enfermera, si no sabe bien qué hacer. No comparta su aplicador ni sus agujas. Generalidades Los números y marcas del portacartucho le ayudarán a calcular la cantidad aproximada de GENOTROPIN que queda en el aplicador. Si en el Paso 6 del uso regular el aplicador no tiene una dosis completa de Genotropin, la escala de la barra negra indicará la cantidad de medicamento que queda en el aplicador. Los pacientes ciegos o con problemas visuales deben usar el aplicador solamente con ayuda de otra persona capacitada para usarla. Siga las instrucciones de su médico o enfermera respecto a asearse las manos y la piel al prepararse para aplicar la inyección. No deseche su cubreaguja; para retirarlo, desenrósquelo del aplicador. Guárdelo para usarlo con cada pluma nueva. Si tiene alguna duda sobre cómo usar el aplicador, consulte a su médico o enfermera. Pfizer Información Confidencial Pág 32 de 33
DOCUMENTO LOCAL DE PRODUCTO
 1 DOCUMENTO LOCAL DE PRODUCTO Título del Documento del Producto: Somatropina Fecha de la última revisión: 11 de julio de 2014 Fecha Efectiva: 18 de diciembre de 2014 CDS versión: 7.0 1 NOMBRE DEL PRODUCTO
1 DOCUMENTO LOCAL DE PRODUCTO Título del Documento del Producto: Somatropina Fecha de la última revisión: 11 de julio de 2014 Fecha Efectiva: 18 de diciembre de 2014 CDS versión: 7.0 1 NOMBRE DEL PRODUCTO
DOCUMENTO LOCAL DE PRODUCTO
 1 DOCUMENTO LOCAL DE PRODUCTO Título del Documento del Producto: Somatropina Fecha de la última revisión: 11 de julio de 2014 Fecha Efectiva: 18 de diciembre de 2014 CDS versión: 7.0 1 NOMBRE DEL PRODUCTO
1 DOCUMENTO LOCAL DE PRODUCTO Título del Documento del Producto: Somatropina Fecha de la última revisión: 11 de julio de 2014 Fecha Efectiva: 18 de diciembre de 2014 CDS versión: 7.0 1 NOMBRE DEL PRODUCTO
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO
 1. NOMBRE DEL MEDICAMENTO GENOTONORM MINIQUICK 0,2 mg GENOTONORM MINIQUICK 0,4 mg GENOTONORM MINIQUICK 0,6 mg GENOTONORM MINIQUICK 0,8 mg GENOTONORM MINIQUICK 1 mg GENOTONORM MINIQUICK 1,2 mg GENOTONORM
1. NOMBRE DEL MEDICAMENTO GENOTONORM MINIQUICK 0,2 mg GENOTONORM MINIQUICK 0,4 mg GENOTONORM MINIQUICK 0,6 mg GENOTONORM MINIQUICK 0,8 mg GENOTONORM MINIQUICK 1 mg GENOTONORM MINIQUICK 1,2 mg GENOTONORM
FOLLETO DE INFORMACIÓN AL PROFESIONAL
 FOLLETO DE INFORMACIÓN AL PROFESIONAL CONFIDENCIAL 1. NOMBRE DEL MEDICAMENTO GENOTROPIN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Genotropin contiene Somatropina humana recombinante 16 UI y 36 UI. 3. FORMA
FOLLETO DE INFORMACIÓN AL PROFESIONAL CONFIDENCIAL 1. NOMBRE DEL MEDICAMENTO GENOTROPIN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Genotropin contiene Somatropina humana recombinante 16 UI y 36 UI. 3. FORMA
ANEXO III RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO MODIFICADO DEL ESTADO MIEMBRO DE REFERENCIA
 ANEXO III RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO MODIFICADO DEL ESTADO MIEMBRO DE REFERENCIA Nota: Este RCP es el que estaba anexo a la Decisión de la Comisión de esta remisión conforme al Artículo
ANEXO III RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO MODIFICADO DEL ESTADO MIEMBRO DE REFERENCIA Nota: Este RCP es el que estaba anexo a la Decisión de la Comisión de esta remisión conforme al Artículo
DOCUMENTO DE PRODUCTO LOCAL PFIZER VENEZUELA, S.A.
 DOCUMENTO DE PRODUCTO LOCAL PFIZER VENEZUELA, S.A. Preparado por Pfizer Inc. Fecha de vigencia del LLD: 18 de Diciembre de 2014 Fecha de LLD sustituida: 11 de Julio de 2014 SOMATROPINA Inyección VERSIÓN
DOCUMENTO DE PRODUCTO LOCAL PFIZER VENEZUELA, S.A. Preparado por Pfizer Inc. Fecha de vigencia del LLD: 18 de Diciembre de 2014 Fecha de LLD sustituida: 11 de Julio de 2014 SOMATROPINA Inyección VERSIÓN
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO
 1. NOMBRE DEL MEDICAMENTO Genotonorm Miniquick 0,2 mg polvo y disolvente para solución inyectable Genotonorm Miniquick 0,4 mg polvo y disolvente para solución inyectable Genotonorm Miniquick 0,6 mg polvo
1. NOMBRE DEL MEDICAMENTO Genotonorm Miniquick 0,2 mg polvo y disolvente para solución inyectable Genotonorm Miniquick 0,4 mg polvo y disolvente para solución inyectable Genotonorm Miniquick 0,6 mg polvo
Genotonorm Kabipen 5,3 mg polvo y disolvente para solución inyectable Genotonorm Kabipen 12 mg polvo y disolvente para solución inyectable
 1. NOMBRE DEL MEDICAMENTO Genotonorm Kabipen 5,3 mg polvo y disolvente para solución inyectable Genotonorm Kabipen 12 mg polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1. NOMBRE DEL MEDICAMENTO Genotonorm Kabipen 5,3 mg polvo y disolvente para solución inyectable Genotonorm Kabipen 12 mg polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
GENOTROPIN 16 UI (5.3 mg) (Somatropina) Polvo Liofilizado para Solución Inyectable
 GENOTROPIN 16 UI (5.3 mg) (Somatropina) Polvo Liofilizado para Solución Inyectable 1. NOMBRE DEL PRODUCTO FARMACÉUTICO GENOTROPIN 16 UI (5,3 mg) Polvo Liofilizado para Solución Inyectable 2. COMPOSICIÓN
GENOTROPIN 16 UI (5.3 mg) (Somatropina) Polvo Liofilizado para Solución Inyectable 1. NOMBRE DEL PRODUCTO FARMACÉUTICO GENOTROPIN 16 UI (5,3 mg) Polvo Liofilizado para Solución Inyectable 2. COMPOSICIÓN
INSTRUCCIONES DE USO
 Pluma Eperzan 30 mg una vez a la semana INSTRUCCIONES DE USO Leer todas las instrucciones incluyendo las Preguntas y Respuestas y seguir los pasos siguientes para mezclar el medicamento y preparar la pluma
Pluma Eperzan 30 mg una vez a la semana INSTRUCCIONES DE USO Leer todas las instrucciones incluyendo las Preguntas y Respuestas y seguir los pasos siguientes para mezclar el medicamento y preparar la pluma
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. GHRH 50 microgramos polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO GHRH 50 microgramos polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ampolla de GHRH contiene 66,7 microgramos de somatorelina
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO GHRH 50 microgramos polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ampolla de GHRH contiene 66,7 microgramos de somatorelina
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
PROSPECTO: INFORMACIÓN PARA EL USUARIO. GlucaGen Hypokit 1 mg Polvo y disolvente para solución inyectable. Glucagón biosintético
 PROSPECTO: INFORMACIÓN PARA EL USUARIO GlucaGen Hypokit 1 mg Polvo y disolvente para solución inyectable Glucagón biosintético Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
PROSPECTO: INFORMACIÓN PARA EL USUARIO GlucaGen Hypokit 1 mg Polvo y disolvente para solución inyectable Glucagón biosintético Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
Resumen de las características del producto. 1 ml. Para consultar la lista completa de excipientes, ver sección 6.1.
 Resumen de las características del producto 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables B.Braun Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio Activo
Resumen de las características del producto 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables B.Braun Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio Activo
ambroxol cinfa 15 mg / 5 ml jarabe EFG
 FICHA TÉCNICA ambroxol cinfa 15 mg / 5 ml jarabe EFG 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contienen 15 mg de clorhidrato
FICHA TÉCNICA ambroxol cinfa 15 mg / 5 ml jarabe EFG 1. NOMBRE DEL MEDICAMENTO ambroxol cinfa 15 mg/5 ml jarabe EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 5 ml de jarabe contienen 15 mg de clorhidrato
FICHA TÉCNICA. MENCEVAX AC es una preparación liofilizada de polisacáridos purificados de Neisseria meningitidis (meningococo) de los grupos A y C.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol.
 1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
1. NOMBRE DEL MEDICAMENTO TROSID 280 mg/ml barniz de uñas medicamentoso 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de barniz de uñas medicamentoso contiene 280 mg de tioconazol. Para consultar la
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA. No exceder la dosis máxima de 480 mg de simeticona (4 comprimidos masticables) al día.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 120 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona.. 120 mg Excipientes con efecto conocido:
Tratamiento del herpes genital inicial y recurrente, herpes labial y de infecciones mucocutáneas localizadas, producidas por virus de herpes simple
 1. NOMBRE DEL MEDICAMENTO ACICLOVIR DEXTER Crema E.F.G. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA ACICLOVIR DEXTER Crema E.F.G. Cada gramo contiene: Aciclovir (DCI)... 50 mg Excipientes, c.s. 3. FORMA
1. NOMBRE DEL MEDICAMENTO ACICLOVIR DEXTER Crema E.F.G. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA ACICLOVIR DEXTER Crema E.F.G. Cada gramo contiene: Aciclovir (DCI)... 50 mg Excipientes, c.s. 3. FORMA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Entero-Silicona 9 mg/ml emulsión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de emulsión oral contiene:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Entero-Silicona 9 mg/ml emulsión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de emulsión oral contiene:
FICHA TÉCNICA. Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral. Agua para preparaciones inyectables 1 g por 1 ml. ph entre 4,5 y 7,0.
 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por 1 ml. ph entre
1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por 1 ml. ph entre
FICHA TÉCNICA. Excipientes con efecto conocido: Cada comprimido contiene: 200 mg de sacarosa y 240 mg de sorbitol (E-420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Simeticona Normon 40 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona... 40 mg Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Simeticona Normon 40 mg comprimidos masticables 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Simeticona... 40 mg Excipientes con efecto conocido:
FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA
 1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
Instrucciones de uso. TRULICITY (Tru-li-si-ti) (dulaglutide) inyección, para uso subcutáneo. Pluma de dosis única de 0.75 mg/0.
 Instrucciones de uso 1 TRULICITY (Tru-li-si-ti) (dulaglutide) inyección, para uso subcutáneo Pluma de dosis única de 0.75 mg/0.5 ml una vez por semana RETIRAR EL SELLO RETIRAR EL SELLO Abrir y aplanar
Instrucciones de uso 1 TRULICITY (Tru-li-si-ti) (dulaglutide) inyección, para uso subcutáneo Pluma de dosis única de 0.75 mg/0.5 ml una vez por semana RETIRAR EL SELLO RETIRAR EL SELLO Abrir y aplanar
FICHA TÉCNICA (RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO)
 FICHA TÉCNICA (RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO) 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO IMMITICIDE liofilizado y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA (RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO) 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO IMMITICIDE liofilizado y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Composición. Cada 100 ml de solución contiene: cloruro de sodio 10 g. agua para inyectables c.s.p. 100 ml. Proporciona meq/ml:
 Composición Cada 100 ml de solución contiene: cloruro de sodio 10 g agua para inyectables c.s.p. 100 ml Proporciona meq/ml: 1 / 13 sodio 1,711 Cloruro 1,711 Osmolaridad 3,422 mosmol/ml. Acción farmacológica
Composición Cada 100 ml de solución contiene: cloruro de sodio 10 g agua para inyectables c.s.p. 100 ml Proporciona meq/ml: 1 / 13 sodio 1,711 Cloruro 1,711 Osmolaridad 3,422 mosmol/ml. Acción farmacológica
Ficha técnica Página 1
 1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
1. NOMBRE DEL MEDICAMENTO: Difur 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada cápsula contiene 120 mg de extracto seco de rizoma de Polypodium leucotomos L. (DER nativo 4-6:1)
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DE PRODUCTO
 FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DE PRODUCTO 1. NOMBRE DEL MEDICAMENTO AFLUON 1 mg/ml solución para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada ml de solución contiene
FICHA TÉCNICA O RESUMEN DE CARACTERÍSTICAS DE PRODUCTO 1. NOMBRE DEL MEDICAMENTO AFLUON 1 mg/ml solución para pulverización nasal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada ml de solución contiene
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO MARBOVET 20 mg/ml SOLUCIÓN INYECTABLE Solución inyectable para bovino y porcino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO MARBOVET 20 mg/ml SOLUCIÓN INYECTABLE Solución inyectable para bovino y porcino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Toujeo 300 unidades/ml solución inyectable en una pluma precargada (SoloStar) INSTRUCCIONES DE USO
 Toujeo 300 unidades/ml solución inyectable en una pluma precargada (SoloStar) INSTRUCCIONES DE USO Lea esto primero Toujeo SoloStar contiene 300 unidades/ml de insulina glargina en una pluma precargada
Toujeo 300 unidades/ml solución inyectable en una pluma precargada (SoloStar) INSTRUCCIONES DE USO Lea esto primero Toujeo SoloStar contiene 300 unidades/ml de insulina glargina en una pluma precargada
3. PROPIEDADES FARMACOLOGICAS Grupo farmacoterapéutico: Simpaticomiméticos usados como descongestivos. Código ATC: S01GA
 1. NOMBRE DEL PRINCIPIO ACTIVO (DCI) NAFAZOLINA CLORHIDRATO 2. VIA DE ADMINISTRACION TOPICO NASAL 3. PROPIEDADES FARMACOLOGICAS Grupo farmacoterapéutico: Simpaticomiméticos usados como descongestivos.
1. NOMBRE DEL PRINCIPIO ACTIVO (DCI) NAFAZOLINA CLORHIDRATO 2. VIA DE ADMINISTRACION TOPICO NASAL 3. PROPIEDADES FARMACOLOGICAS Grupo farmacoterapéutico: Simpaticomiméticos usados como descongestivos.
Instrucciones de uso. Inyección TRULICITY (Trū-li-si-tee) (dulaglutida), para uso subcutáneo mg/0.5 ml Pluma de una sola dosis
 1 RETIRAR EL SELLO Instrucciones de uso Inyección TRULICITY (Trū-li-si-tee) (dulaglutida), para uso subcutáneo 0.75 mg/0.5 ml Pluma de una sola dosis una vez por semana RETIRAR EL SELLO Abrir y aplanar
1 RETIRAR EL SELLO Instrucciones de uso Inyección TRULICITY (Trū-li-si-tee) (dulaglutida), para uso subcutáneo 0.75 mg/0.5 ml Pluma de una sola dosis una vez por semana RETIRAR EL SELLO Abrir y aplanar
Instrucciones para preparar y administrar una inyección subcutánea de ORENCIA:
 Instrucciones para preparar y administrar una inyección subcutánea de ORENCIA: Lea cuidadosamente estas instrucciones y sígalas paso a paso. Recibirá instrucciones de su médico o enfermera acerca de cómo
Instrucciones para preparar y administrar una inyección subcutánea de ORENCIA: Lea cuidadosamente estas instrucciones y sígalas paso a paso. Recibirá instrucciones de su médico o enfermera acerca de cómo
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Regender 120 mg cápsulas duras. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 120 mg de extracto
* Producida en Escherichia coli mediante tecnología de DNA recombinante.
 1. NOMBRE DEL MEDICAMENTO Omnitrope 5 mg/1,5 ml solución inyectable Omnitrope 10 mg/1,5 ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Omnitrope 5 mg/1,5 ml solución inyectable Cada ml
1. NOMBRE DEL MEDICAMENTO Omnitrope 5 mg/1,5 ml solución inyectable Omnitrope 10 mg/1,5 ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Omnitrope 5 mg/1,5 ml solución inyectable Cada ml
FICHA TÉCNICA. La cantidad de principios activos presentes en 1 ml de ADDAMEL es de:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ADDAMEL concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de ADDAMEL contiene: Principio activo Cantidad Cloruro de cromo,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ADDAMEL concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml de ADDAMEL contiene: Principio activo Cantidad Cloruro de cromo,
DIABETES DE TU MASCOTA
 nuevo Con VetPen... sado para su comodidad en el control eficaz de la diabetes Nunca fue tan fácil controlar la DIABETES DE TU MASCOTA VetPen Especialmente diseñado para SU TRANQUILIDAD EN EL DÍA A DÍA
nuevo Con VetPen... sado para su comodidad en el control eficaz de la diabetes Nunca fue tan fácil controlar la DIABETES DE TU MASCOTA VetPen Especialmente diseñado para SU TRANQUILIDAD EN EL DÍA A DÍA
FOLLETO DE INFORMACIÓN AL PROFESIONAL GENTAMICINA SOLUCIÓN OFTÁLMICA 0,3% FOLLETO DE INFORMACIÓN AL PROFESIONAL
 Gentamicina solución oftálmica 0,3% 1. Denominación Gentamicina solución oftálmica 0,3% 2. Composición cuantitativa y cualitativa Gentamicina base 3 mg/ml (como gentamicina sultafo BP) Excipientes: Incluir
Gentamicina solución oftálmica 0,3% 1. Denominación Gentamicina solución oftálmica 0,3% 2. Composición cuantitativa y cualitativa Gentamicina base 3 mg/ml (como gentamicina sultafo BP) Excipientes: Incluir
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada gramo de pomada bucal contiene:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada bucal contiene: Carbenoxolona disódica. 20 mg Excipientes: Para consultar
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO SANODIN 20 mg/g pomada bucal 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada bucal contiene: Carbenoxolona disódica. 20 mg Excipientes: Para consultar
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Passiflorine solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Passiflorine solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: 100 mg de extracto líquido de partes aéreas de Passiflora incarnata L, (pasiflora)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Passiflorine solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: 100 mg de extracto líquido de partes aéreas de Passiflora incarnata L, (pasiflora)
Instrucciones de uso de Saxenda 6 mg/ml solución inyectable en pluma precargada
 Instrucciones de uso de Saxenda 6 mg/ml solución inyectable en pluma precargada Lea atentamente estas instrucciones antes de utilizar su pluma precargada Saxenda. No utilice la pluma sin haber recibido
Instrucciones de uso de Saxenda 6 mg/ml solución inyectable en pluma precargada Lea atentamente estas instrucciones antes de utilizar su pluma precargada Saxenda. No utilice la pluma sin haber recibido
Instrucciones de uso: Guía de los componentes
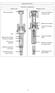 Cabeza del émbolo Antes de usar Instrucciones de uso: Guía de los componentes Después de usar Cabeza del émbolo de la jeringa usada Etiqueta de la jeringa Cuerpo de la jeringa usada Alas Etiqueta de la
Cabeza del émbolo Antes de usar Instrucciones de uso: Guía de los componentes Después de usar Cabeza del émbolo de la jeringa usada Etiqueta de la jeringa Cuerpo de la jeringa usada Alas Etiqueta de la
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Duartron 625 mg, cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 625 mg de glucosamina
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Duartron 625 mg, cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 625 mg de glucosamina
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea
 FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
FICHA TÉCNICA ECHINACIN MADAUS solución oral Echinacea purpurea 1. NOMBRE DEL MEDICAMENTO ECHINACIN MADAUS solución oral Echinacea purpurea 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml contiene: Jugo
Resumen de las Características del Producto: Norditropin SimpleXx 5 mg / 1,5 ml 10 mg / 1,5 ml 15 mg / 1,5 ml
 Resumen de las Características del Producto: Norditropin SimpleXx 5 mg / 1,5 ml 10 mg / 1,5 ml 15 mg / 1,5 ml Indice 1. Denominación del medicamento... 3 2. Composición cualitativa y cuantitativa... 3
Resumen de las Características del Producto: Norditropin SimpleXx 5 mg / 1,5 ml 10 mg / 1,5 ml 15 mg / 1,5 ml Indice 1. Denominación del medicamento... 3 2. Composición cualitativa y cuantitativa... 3
FICHA TÉCNICA. Excipientes con efecto conocido: 0,458 g de maltitol líquido (E965) y 1,830 g de isomalta (E953).
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
Gonadotropina sérica equina (PMSG) Gonadotropina coriónica (HCG)
 FERTIPIG liofilizado y disolvente para solución inyectable para cerdos 1. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA El vial de liofilizado contiene: El vial de solvente contiene: 2 000 UI 1 000 UI 375 mg
FERTIPIG liofilizado y disolvente para solución inyectable para cerdos 1. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA El vial de liofilizado contiene: El vial de solvente contiene: 2 000 UI 1 000 UI 375 mg
Razones para hacer de Genotonorm tu hormona de crecimiento de elección
 Razones para hacer de Genotonorm tu hormona de crecimiento de elección Eficacia probada en las siguientes indicaciones 1 Proceso de fabricación único, sin pasos enzimáticos intermedios 2 Déficit de hormona
Razones para hacer de Genotonorm tu hormona de crecimiento de elección Eficacia probada en las siguientes indicaciones 1 Proceso de fabricación único, sin pasos enzimáticos intermedios 2 Déficit de hormona
ANEXO III RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO MODIFICADO DEL ESTADO MIEMBRO DE REFERENCIA
 ANEXO III RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO MODIFICADO DEL ESTADO MIEMBRO DE REFERENCIA Nota: Este RCP es el que estaba anexo a la Decisión de la Comisión de esta remisión conforme al Artículo
ANEXO III RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO MODIFICADO DEL ESTADO MIEMBRO DE REFERENCIA Nota: Este RCP es el que estaba anexo a la Decisión de la Comisión de esta remisión conforme al Artículo
PREPARACIÓN PARA LA INYECCIÓN. Conozca las partes de la pluma. Antes de utilizar (Figura A) Después de utilizar (Figura B)
 PREPARACIÓN PARA LA INYECCIÓN Conozca las partes de la pluma Antes de utilizar (Figura A) Después de utilizar (Figura B) Prepare la superficie de trabajo Localice una superficie llana, limpia y bien iluminada,
PREPARACIÓN PARA LA INYECCIÓN Conozca las partes de la pluma Antes de utilizar (Figura A) Después de utilizar (Figura B) Prepare la superficie de trabajo Localice una superficie llana, limpia y bien iluminada,
FICHA TECNICA. HIDROCORTISONA PENSA Crema Hidrocortisona
 FICHA TECNICA HIDROCORTISONA PENSA Crema Hidrocortisona 1. NOMBRE DEL MEDICAMENTO HIDROCORTISONA PENSA Crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 100 g contienen: Hidrocortisona (DCI)...0,5 g.
FICHA TECNICA HIDROCORTISONA PENSA Crema Hidrocortisona 1. NOMBRE DEL MEDICAMENTO HIDROCORTISONA PENSA Crema 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 100 g contienen: Hidrocortisona (DCI)...0,5 g.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. Excipientes con efecto conocido 1,38 g de sacarosa y 1,10 g glucosa. Para consultar la lista completa de excipientes ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor menta 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
Tras la reconstitución, un vial contiene 1,3 mg de somatropina* (que corresponde a 4 UI) por ml.
 1. NOMBRE DEL MEDICAMENTO Omnitrope 1,3 mg/ml polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Tras la reconstitución, un vial contiene 1,3 mg de somatropina* (que
1. NOMBRE DEL MEDICAMENTO Omnitrope 1,3 mg/ml polvo y disolvente para solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Tras la reconstitución, un vial contiene 1,3 mg de somatropina* (que
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA. GLUCOSAMINA PHARMA NORD 400 mg CÁPSULAS
 agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA GLUCOSAMINA PHARMA NORD 400 mg CÁPSULAS 1. NOMBRE DEL MEDICAMENTO Glucosamina Pharma Nord
agencia española de medicamentos y productos sanitarios RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA GLUCOSAMINA PHARMA NORD 400 mg CÁPSULAS 1. NOMBRE DEL MEDICAMENTO Glucosamina Pharma Nord
FICHA TÉCNICA. Normoreum 400 mg comprimidos recubiertos con película
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normoreum 400 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: 400 mg de extracto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Normoreum 400 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principios activos: 400 mg de extracto
FICHA TÉCNICA O RES UMEN DE LAS CARACTERÍS TICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RES UMEN DE LAS CARACTERÍS TICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GLEPTOSIL 200 mg/ml solución inyectable 2. COMPOS ICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RES UMEN DE LAS CARACTERÍS TICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GLEPTOSIL 200 mg/ml solución inyectable 2. COMPOS ICIÓN
MANUAL DEL USUARIO Humalog KwikPen 100 unidades/ml, solución inyectable
 MANUAL DEL USUARIO Humalog KwikPen 100 unidades/ml, solución inyectable POR FAVOR LEA ESTE MANUAL DEL USUARIO ANTES DE USAR Lea el Manual del Usuario antes de empezar a usar su insulina y cada vez que
MANUAL DEL USUARIO Humalog KwikPen 100 unidades/ml, solución inyectable POR FAVOR LEA ESTE MANUAL DEL USUARIO ANTES DE USAR Lea el Manual del Usuario antes de empezar a usar su insulina y cada vez que
FICHA TÉCNICA. (fitomenadiona, DCI) en 0,2 ml (volumen de llenado: 0,3 ml). Solución contenida en ampollas para administración oral o parenteral.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Konakion 2 mg pediátrico 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ampolla contiene 2 mg de vitamina K 1 (fitomenadiona, DCI) en 0,2 ml (volumen de llenado:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO TOLFEDINE 4% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. INGREDIENTES ACTIVOS: Ácido tolfenámico... 4,00 g EXCIPIENTES:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO TOLFEDINE 4% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. INGREDIENTES ACTIVOS: Ácido tolfenámico... 4,00 g EXCIPIENTES:
FICHA TÉCNICA. Sorbitol líquido (no cristalizante); 1 ml de jarabe contiene 495,6 mg de sorbitol (E 420).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bisolvon Expectorante jarabe Extracto seco de hojas de hiedra 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa 1 ml de jarabe de
- Como disolvente de medicamentos en polvo o liofilizados, previamente a su administración. - Como diluyente de soluciones y/o medicamentos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
Sustancias activas: Circovirus porcino recombinante quimérico inactivado tipo 1 expresando la proteína ORF2 del circovirus porcino tipo 2
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Suvaxyn Circo emulsión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 2 ml contiene: Sustancias activas: Circovirus porcino recombinante
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Suvaxyn Circo emulsión inyectable para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 2 ml contiene: Sustancias activas: Circovirus porcino recombinante
FICHA TÉCNICA. Alivio de los síntomas del dolor agudo de garganta en adultos y niños mayores de 6 años.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor menta amilmetacresol / alcohol dichlorobencílico Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor miel y limón
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor menta amilmetacresol / alcohol dichlorobencílico Geisil 0.6 mg / 1.2 mg pastillas para chupar sabor miel y limón
FICHA TÉCNICA. Polisacárido Vi de Salmonella typhi (cepa Ty2)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Typherix, solución inyectable en jeringa precargada Vacuna de polisacárido antitifoideo. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml de la vacuna
FICHA TECNICA. Composición para 1 litro (contenido en dos soluciones: A y B)
 FICHA TECNICA 1. NOMBRE COMERCIAL DEL MEDICAMENTO AMINOMIX II 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición para 1 litro (contenido en dos soluciones: A y B) Solución A Solución B L-arginina 6,00
FICHA TECNICA 1. NOMBRE COMERCIAL DEL MEDICAMENTO AMINOMIX II 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición para 1 litro (contenido en dos soluciones: A y B) Solución A Solución B L-arginina 6,00
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO SYNCROSTIM 500 UI LIOFILIZADO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE PARA BOVINO Y OVINO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SYNCROSTIM 500 UI LIOFILIZADO Y DISOLVENTE PARA SOLUCIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SYNCROSTIM 500 UI LIOFILIZADO Y DISOLVENTE PARA SOLUCIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
Materiales incluidos en el envase: - 1 o 28 viales con 5 mg de teduglutida en forma de polvo. - 1 o 28 jeringas precargadas con disolvente.
 Instrucciones para la preparación e inyección de Revestive Información importante: - Leer el prospecto antes de usar Revestive. - Revestive se inyecta por debajo de la piel (vía subcutánea). - No inyectar
Instrucciones para la preparación e inyección de Revestive Información importante: - Leer el prospecto antes de usar Revestive. - Revestive se inyecta por debajo de la piel (vía subcutánea). - No inyectar
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Braun 0,9% Disolvente para uso parenteral Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Documento Local de Producto
 1 Documento Local de Producto Título del Documento del Producto: Oxitetraciclina con Polimixina B en Preparación Tópica Fecha de Ultima Revisión: 28 de Abril de 1995 Fecha de Última Revisión de Farmacovigilancia:
1 Documento Local de Producto Título del Documento del Producto: Oxitetraciclina con Polimixina B en Preparación Tópica Fecha de Ultima Revisión: 28 de Abril de 1995 Fecha de Última Revisión de Farmacovigilancia:
GUÍA RÁPIDA DE. SoloStar
 GUÍA RÁPIDA DE SoloStar Le acaban de recetar Lantus, Apidra o Insuman Basal en la pluma de insulina precargada SoloStar. Puede fijar dosis de 1 a 80 unidades, de una en una. En esta guía rápida encontrará
GUÍA RÁPIDA DE SoloStar Le acaban de recetar Lantus, Apidra o Insuman Basal en la pluma de insulina precargada SoloStar. Puede fijar dosis de 1 a 80 unidades, de una en una. En esta guía rápida encontrará
FICHA TÉCNICA. Alivio a corto plazo (de dos o tres meses) del edema y síntomas relacionados con la insuficiencia venosa crónica.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Troxerutina NORMON 1000 mg granulado para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 1000 mg de troxerutina. Excipientes: Isomaltosa,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MICRALAX Macrogol 5,9 g polvo para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Macrogol 5,9 g polvo para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 5,9 gramos de Macrogol 3350. Excipientes con efecto
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MICRALAX Macrogol 5,9 g polvo para solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre contiene 5,9 gramos de Macrogol 3350. Excipientes con efecto
EL KIT CONTIENE: EL KIT CONTIENE: Jeringa de diluyente precargada. Adaptador del vial en su envase. Vial con el fármaco en polvo. Vástago del émbolo
 ALPROLIX Factor IX de coagulación (recombinante), proteína de fusión a Fc INSTRUCCIONES DE USO Lea las Instrucciones de uso antes de comenzar a usar el ALPROLIX y cada vez que obtenga un suministro nuevo
ALPROLIX Factor IX de coagulación (recombinante), proteína de fusión a Fc INSTRUCCIONES DE USO Lea las Instrucciones de uso antes de comenzar a usar el ALPROLIX y cada vez que obtenga un suministro nuevo
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Otilonio Qualigen 40 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 40 mg de otilonio bromuro. Para
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO TOLFEDINE 20 MG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA EN PRINCIPIOS ACTIVOS Y COMPONENTES DEL
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO, ESPECIES DE DESTINO TOLFEDINE 20 MG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA EN PRINCIPIOS ACTIVOS Y COMPONENTES DEL
HIPERLIPEN. Ciprofibrato. Tableta. 100,0 mg
 RESUMEN DE CARACTERISTICAS DE PRODUCTO Nombre del producto: HIPERLIPEN (Ciprofibrato) Forma farmacéutica: Fortaleza: Tableta 100,0 mg Presentación: Titular del Registro Sanitario, país: Fabricante, país:
RESUMEN DE CARACTERISTICAS DE PRODUCTO Nombre del producto: HIPERLIPEN (Ciprofibrato) Forma farmacéutica: Fortaleza: Tableta 100,0 mg Presentación: Titular del Registro Sanitario, país: Fabricante, país:
FICHA TÉCNICA CORREO ELECTRÓNICO C/ CAMPEZO, 1 EDIFICIO MADRID.
 FICHA TÉCNICA CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO Salina Fisiológica Grifols 0,9% Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO Salina Fisiológica Grifols 0,9% Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 100 mg/ml gotas orales en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aero-red 100 mg/ml gotas orales en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 100 mg de simeticona. Excipientes con efecto conocido:
Prospecto: información para el usuario
 Prospecto: información para el usuario GENOTONORM KABIPEN 5,3 MG Y 12 MG POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE SOMATROPINA Lea todo el prospecto detenidamente antes de empezar a usar este medicamento.
Prospecto: información para el usuario GENOTONORM KABIPEN 5,3 MG Y 12 MG POLVO Y DISOLVENTE PARA SOLUCIÓN INYECTABLE SOMATROPINA Lea todo el prospecto detenidamente antes de empezar a usar este medicamento.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. CUNISER 500 Gonadotropina sérica equina (PMSG), en polvo y disolvente para solución inyectable.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CUNISER 500 Gonadotropina sérica equina (PMSG), en polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CUNISER 500 Gonadotropina sérica equina (PMSG), en polvo y disolvente para solución inyectable. 2. COMPOSICIÓN CUALITATIVA
