Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C en pacientes coinfectados
|
|
|
- Agustín Rodríguez Martin
- hace 8 años
- Vistas:
Transcripción
1 INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-BOC/TEL-COINF-TRAS/V3/ Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C en pacientes coinfectados por el VIH y trasplantados hepáticos Fecha de publicación: 18 de Noviembre de 2014 La infección por el virus de la hepatitis C (VHC) es un grave problema de salud en el mundo occidental donde la prevalencia de infección crónica por VHC varía entre el 1,5 y el 3% de la población. El tratamiento de la hepatitis crónica C (HCC), con la combinación de interferón pegilado (P-INF) alfa 2a ó 2b y ribavirina (RBV), consigue una respuesta viral sostenida (RVS) en aproximadamente el 50 % de pacientes infectados por el genotipo 1 del VHC que es el más común en nuestro entorno (75% de los infectados). Boceprevir y telaprevir, los primeros agentes anti-vhc directos comercializados, están indicados, en combinación con P-INF y RBV, para el tratamiento de pacientes adultos con HCC (genotipo 1) con enfermedad hepática compensada. En pacientes mono-infectados, la triple terapia basada en P-INF alfa, RBV y un agente antiviral directo como boceprevir o telaprevir mejora la tasa de RVS hasta un 75 % (pacientes naïve) y hasta un 50 % en el caso de pacientes que han fracasado al tratamiento previo. Sin embargo, la triple terapia puede asociarse a ciertas reacciones adversas tales como exantema cutáneo (telaprevir) que puede ser grave hasta en un 5% de los casos, anemia (telaprevir y boceprevir) o disgeusia (boceprevir). Por otro lado, la ausencia de respuesta a la triple terapia se asocia de manera casi universal al desarrollo de mutaciones de resistencia en el VHC. Estas mutaciones tienden a desaparecer de manera progresiva con el tiempo, pero su significado clínico es incierto ya que no hay ningún estudio que haya valorado la respuesta al tratamiento con otros antivirales de la misma familia de pacientes con variantes víricas con mutaciones de resistencia. Así mismo, se debe tener en cuenta que existen un número elevado de agentes antivirales directos en distintas fases de desarrollo (incluidos dos actualmente en fase de registro), que pueden estar disponibles en un futuro próximo y que pueden significar un incremento aún mayor de la tasa de respuesta, con menor tiempo de tratamiento y un menor número de efectos adversos. Por tanto, se debe adoptar una actitud prudente en cuanto a la incorporación a la práctica de estas primeras pautas triples. En definitiva, la triple terapia tiene una eficacia superior a la del tratamiento clásico, pero ocasiona generalmente más efectos adversos e implica, además, la necesidad de una evaluación más minuciosa y un seguimiento más frecuente de los enfermos en tratamiento. Ambos hechos pueden tener un impacto asistencial importante en los centros que atienden enfermos con HCC así como en el coste asociado al tratamiento. No hay estudios que hayan comparado directamente boceprevir y telaprevir por lo que la comparación entre ambos sólo puede ser indirecta. Con los datos actuales, el perfil beneficio/riesgo de ambos es similar cuando se usan ateniéndose a las recomendaciones que se establecen en este documento. BOCEPREVIR Y TELAPREVIR EN PACIENTES CO-INFECTADOS POR EL VIH, TRASPLANTADOS DE HÍGADO Y NIÑOS/ADOLESCENTES Boceprevir y telaprevir han sido autorizados por la Comisión Europea mediante un procedimiento centralizado en base a los resultados de ensayos clínicos en pacientes mono-infectados. El nivel de evidencia en pacientes co-infectados por el VIH y en trasplantados de hígado, ha aumentado de forma sustancial desde su autorización. Aún así, se espera recabar más información de los ensayos clínicos en marcha en estas poblaciones. Puede consultarse un listado completo y actualizado de los ensayos clínicos autorizados en España para el tratamiento de la hepatitis C en pacientes coinfectados por VIH y en pacientes con trasplante hepático en la dirección De momento no se recomienda el uso de estos medicamentos en niños y adolescentes debido a la falta de datos de eficacia y seguridad. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha decidido elaborar las siguientes recomendaciones de uso para pacientes coinfectados y trasplantados. Dado el aumento del conocimiento generado en estas situaciones y la existencia de un sistema activo de farmacovigilancia, el registro obligatorio de casos de la AEMPS no seguirá operativo a partir de la fecha de publicación de este documento. Los criterios se han elaborado partiendo de los utilizados para el programa de acceso precoz de la AEMPS que fueron elaborados por un grupo de expertos entre los que estaban los implicados en la evaluación de estos medicamentos para su autorización por parte de la AEMPS y clínicos expertos en el manejo de la HCC en pacientes monoinfectados, co-infectados por VIH y trasplantados hepáticos. A ellos se han sumado expertos designados por las Comunidades Autónomas de Cataluña, Madrid, Andalucía y Galicia (ver anexo el listado de autores al final del documento). 1. CRITERIOS DE USO PARA PACIENTES CO- INFECTADOS POR EL VIH Y VHC Los pacientes co-infectados candidatos a triple terapia con P- INF, RBV y un inhibidor de la proteasa del VHC (boceprevir o telaprevir) han de cumplir todos los criterios siguientes (1 a 8) Criterios dependientes del VHC (1) Infección por VHC genotipo 1, independientemente de que el paciente haya recibido o no tratamiento previo para la HCC (2) Fibrosis F2, F3 y F4 confirmada por biopsia hepática o rigidez hepática medida por Fibroscan 7.6 Kilopascales (3) Determinación del polimorfismo IL28B únicamente en pacientes con fibrosis F2 antes del inicio del tratamiento. En el caso particular de pacientes F2 con genotipo favorable CC, se recomienda iniciar tratamiento con P-INF y RBV, valorando la Respuesta Viral Rápida (RVR) definida como la ausencia de detección del ARN del VHC a las 4 semanas de tratamiento. Si hay RVR, se recomienda mantener el tratamiento con interferón pegilado y ribavirina durante 48 semanas. Si no hubiera RVR, se recomienda utilizar triple terapia. DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO smhaem@aemps.es Página 1 de 7
2 En pacientes F3 y F4, independientemente del genotipo IL28B se recomienda iniciar tratamiento con triple terapia. La información disponible acerca de la historia natural de la hepatitis C en pacientes infectados por VIH teniendo en cuenta el estadio de fibrosis hepática confirmado por biopsia indica que las tasas de eventos hepáticos (muerte hepática, descompensación y carcinoma hepatocelular) aumentan de forma gradual según los estadios de METAVIR. Así, el riesgo de padecer algún evento hepático a cinco años es bajo en pacientes con F0 o F1 y muy elevado para los pacientes con F4. Es destacable, sin embargo, que el riesgo de padecer algún evento hepático con ese horizonte temporal no es significativamente diferente para los pacientes con fibrosis F2 en comparación con los pacientes con fibrosis F3. Antes de iniciar tratamiento con triple terapia en pacientes coinfectados por VIH/VHC con cirrosis hepática, debe tenerse en cuenta que en pacientes mono-infectados con cirrosis y enfermedad hepática avanzada caracterizada por una cifra de plaquetas < /mm 3 y una albúmina sérica <3,5 g/dl el riesgo de padecer efectos adversos graves (algunos de ellos mortales) aumenta significativamente. Aunque en el paciente co-infectado las alteraciones analíticas arriba mencionadas (en particular la trombocitopenia) no tienen el mismo significado clínico que en el mono-infectado, y en espera de más información al respecto, se recomienda valorar la existencia de alternativas terapéuticas más adecuadas para estos pacientes. En caso de iniciar el tratamiento con triple terapia, éste deberá llevarse a cabo en centros con experiencia en el manejo de cirróticos descompensados y con fácil accesibilidad al trasplante hepático. (4) Hepatopatía compensada (Child-Pugh grado A) (5) Concentración de hemoglobina >11 g/dl en mujeres y >12 g/dl en hombres (6) Independientemente del estadio de fibrosis, serán candidatos a iniciar terapia triple aquellos pacientes coinfectados con manifestaciones extra-hepáticas graves de la infección por VHC como por ejemplo aquellas derivadas de la crioglobulinemia mixta. Criterios dependientes del VIH (7) Pacientes con tratamiento antirretroviral Linfocitos CD4+ totales en sangre periférica >100 /ml o porcentaje de linfocitos CD4+ >12% Carga viral plasmática de VIH <1000 copias/ml (8) No se aplican los criterios anteriormente mencionados de CD4+ ni de carga viral plasmática del VIH en aquellos pacientes que no requieran tratamiento antirretroviral según las recomendaciones actuales de tratamiento del VIH. Tratamiento antirretroviral concomitante 1 Antirretrovirales permitidos con boceprevir Análogos nucleós(t)idos: Abacavir; Emtricitabina; Lamivudina; Tenofovir Análogos no nucleósidos Etravirina ( 200mg cada 12 horas) 2,3 Rilpivirina (25mg una vez al día) Inhibidores de la proteasa 4 Atazanavir/ritonavir 5,6 Inhibidores de la integrasa Raltegravir Inhibidores de la entrada Maraviroc (150mg/12h) 7 Inhibidores de la fusión (Enfuvirtide) No están permitidos por el momento Antirretrovirales permitidos con telaprevir Análogos nucleós(t)idos: Abacavir; Emtricitabina; Lamivudina; Tenofovir Análogos no nucleósidos Efavirenz (incrementando la dosis de telaprevir a mg/8h) Etravirina 3 Rilpivirina Inhibidores de la proteasa 4 Atazanavir/ritonavir Inhibidores de la integrasa Raltegravir Inhibidores de la entrada Maraviroc (150mg/24h) 7 Inhibidores de la fusión (Enfuvirtide) No están permitidos por el momento 1 La información sobre el tratamiento antirretroviral permitido y no permitido se mantendrá actualizada en base a los datos procedentes de los diferentes ensayos clínicos actualmente en marcha. 2 Los parámetros farmacocinéticos de etravirina disminuyen, como también disminuye la Cmin de boceprevir. Se desconoce la relevancia clínica de estos hallazgos, por lo que está justificado un incremento de la vigilancia clínica y de los valores de laboratorio. 3 Ver sección Recomendaciones para el manejo del exantema. 4 No se recomienda el uso de darunavir, lopinavir/ritonavir y fosamprenavir 5 Únicamente en pacientes con carga viral del VIH suprimida y cepa viral del VIH sin sospecha de resistencia al tratamiento antirretroviral. Está justificado un incremento de la vigilancia clínica de la respuesta al tratamiento y de parámetros de laboratorio. 6 Se recomienda un seguimiento clínico y analítico por si aparece hiperbilirrubinemia 7 Los datos disponibles indican que el AUC de maraviroc aumenta con la administración de telaprevir y boceprevir (hasta 9 veces mayor con telaprevir y 3 veces mayor con boceprevir), mientras que la exposición a éstos no se modifica. Boceprevir y maraviroc pueden utilizarse conjuntamente a las dosis habituales. En caso de considerar el uso de telaprevir, se recomienda reducir la dosis de maraviroc a 150mg una vez al día, con el objetivo de reducir el riesgo de posibles eventos adversos, fundamentalmente prolongación del QT e hipotensión ortostática. Estas recomendaciones están avaladas por el grupo de expertos en base a los datos existentes y podrían ser revisadas en el futuro tras su evaluación formal por el Comité de Medicamentos de Uso Humano (CHMP). NOTA: la ficha técnica de los medicamentos puede haber variado desde la publicación de este documento. La ficha técnica actualizada que contiene los últimos cambios incorporados se encuentra disponible en DOSIS Y PAUTAS DE ADMINISTRACIÓN EN PACIENTES COINFECTADOS POR VIH Y VHC El tratamiento con ambos medicamentos debe ser iniciado y supervisado por un médico con experiencia en el manejo de la infección por VIH y de la hepatitis crónica C. Boceprevir La dosis habitual de boceprevir es de 800mg (4 cápsulas) cada 8 horas (se recomienda un intervalo de 7 a 9 horas), administrados con comida. Esta dosis debe modificarse como se ha indicado anteriormente dependiendo del tratamiento antirretroviral que esté recibiendo el paciente. Las cápsulas deben tragarse enteras. La duración total del tratamiento es de 48 semanas. Boceprevir debe administrarse en combinación con P-IFN alfa (2a o 2b) y RBV, iniciándose después de un periodo inicial de 4 semanas («lead-in») sólo con P-IFN y RBV. La triple terapia (boceprevir, P-IFN y RBV) debe mantenerse durante 44 semanas más hasta completar las 48 semanas totales de tratamiento. A diferencia de lo que ocurre con telaprevir, la mayoría de los estudios de boceprevir se han realizado en combinación con P-INF alfa 2b. + BOCEPREVIR PAUTA DE ADMINISTRACIÓN DE BOCEPREVIR EN PACIENTES COINFECTADOS Página 2 de 7
3 Telaprevir La dosis habitual de telaprevir es de 750mg (2 comprimidos) cada 8 horas, administrados con comida. Esta dosis debe modificarse como se ha indicado anteriormente dependiendo del tratamiento antirretroviral que esté recibiendo el paciente. Los comprimidos deben tragarse enteros (sin masticar o triturar o disolver). Aunque no existen datos en pacientes coinfectados y trasplantados, telaprevir se podrá administrar también a dosis de 1.125mg (3 comprimidos) cada 12 horas. En cualquier caso, siempre que se utilice efavirenz la dosis recomendada es de 1.125mg (3 comprimidos) cada 8 horas. La duración total del tratamiento es de 48 semanas. Telaprevir debe administrarse en combinación con P-IFN alfa (2a o 2b) y RBV durante 12 semanas, seguidas de 36 semanas de tratamiento con P- IFN y RBV hasta completar las 48 semanas totales de tratamiento A diferencia de lo que ocurre con boceprevir, la mayor parte del desarrollo clínico de telaprevir se ha realizado utilizando P-INF alfa 2a. + TELAPREVIR PAUTA DE ADMINISTRACIÓN DE TELAPREVIR EN PACIENTES COINFECTADOS CRITERIOS DE SUSPENSIÓN DEL TRATAMIENTO EN PACIENTES COINFECTADOS POR VIH Y VHC Para boceprevir (1) Determinación del ARN-VHC en la semana 12 de tratamiento (semana 8 de triple terapia), y si es mayor o igual a 100 UI/ml todos los tratamientos (boceprevir, P-IFN y RBV) deben ser suspendidos. (2) Determinación del ARN-VHC en la semana 24 y 36 de tratamiento (semana 20 y 32, respectivamente, de triple terapia), y si es detectable todos los tratamientos (boceprevir, P-IFN y RBV) deben ser suspendidos (esta decisión debe de basarse en una prueba con un límite inferior de detección de UI). (3) Si por cualquier razón se tuviera que suspender el P-IFN y la RBV, también se debe suspender el boceprevir. Para telaprevir (1) Determinación del RNA-VHC en la semana 4 de tratamiento, y si es superior a UI/ml todos los tratamientos (telaprevir, P- IFN y RBV) deben ser suspendidos. (2) Determinación del RNA-VHC en la semana 12 de tratamiento, y si es superior a 1000 UI/ml todos los tratamientos (P- IFN y RBV) deben ser suspendidos. (3) Determinación del RNA-VHC en la semana 24 y 36 de tratamiento, y si es detectable todos los tratamientos (P-IFN y RBV) deben ser suspendidos. (4) Si por cualquier razón se tuviera que suspender el P-IFN y la RBV, también se debe suspender el telaprevir 2. CRITERIOS DE USO EN PACIENTES CON TRASPLANTE HEPÁTICO Y VHC Los pacientes trasplantados de hígado con recurrencia de la hepatitis por el VHC candidatos a triple terapia con P-INF, RBV y un inhibidor de la proteasa del VHC (boceprevir o telaprevir) han de cumplir todos los siguientes criterios de inclusión y ninguno de los de exclusión: Criterios de inclusión (1) Infección por VHC genotipo 1 (2) Fibrosis significativa o cirrosis (F2-F4) o hepatitis colestásica o colestásica fibrosante confirmada por biopsia hepática. A pesar de la fiabilidad de la elasticidad hepática para identificar el estadio de la fibrosis en pacientes trasplantados con recurrencia de la hepatitis C, la realización de una biopsia hepática es un requisito indispensable antes de iniciar el tratamiento. (3) Concentración de hemoglobina >10,5 g/dl en mujeres y >11 g/dl en hombres (4) Inmunosupresión con ciclosporina o tacrolimus (y prednisona a dosis inferiores o iguales a 10 mg/día). Los datos de interacción farmacológica de telaprevir/boceprevir con everolimus o rapamicina son limitados por lo que su uso debería restringirse a situaciones especiales (ver abajo). Criterios de exclusión (1) Cualquier contraindicación al tratamiento con interferón (2) Presencia de rechazo o de hepatitis autoinmune en la biopsia hepática realizada antes de iniciar el tratamiento antiviral. (3) Presencia de descompensación en el momento de indicar el tratamiento (ascitis, encefalopatía, hemorragia, ictericia). (4) No existen suficientes datos sobre la incidencia de complicaciones graves en pacientes con cirrosis establecida tras un trasplante hepático en tratamiento con inhibidores de proteasa. En pacientes inmunocompetentes la presencia de plaquetopenia (< plaquetas/mm 3 ) y de una albúmina <3,5 g/dl se asocian a una incidencia elevada de efectos adversos graves. Aunque en el contexto del trasplante estas variables pudieran no tener el mismo valor predictivo, sería recomendable aplicar estos mismos criterios en el contexto de la cirrosis post-trasplante. (5) Infección activa (ya sea bacteriana, por citomegalovirus o fúngica) (6) Insuficiencia renal (filtrado glomerular estimado inferior a 50 ml/min). (7) Historia de complicaciones neurológicas relacionadas con el tratamiento inmunosupresor (convulsiones, encefalopatía, etc.) DOSIS Y PAUTAS DE ADMINISTRACIÓN EN PACIENTES VHC TRASPLANTADOS El tratamiento con ambos medicamentos debe ser iniciado y supervisado por un médico con experiencia en el manejo de pacientes trasplantados de hígado y de la hepatitis crónica C. Boceprevir La dosis habitual de boceprevir es de 800mg (4 cápsulas) cada 8 horas (se recomienda intervalo de 7 a 9 horas), administrados con comida. Las cápsulas deben tragarse enteras. La duración total del tratamiento es de 48 semanas. Boceprevir debe administrarse en combinación con P-IFN alfa (2a o 2b) y RBV, iniciándose después de un periodo inicial de 4 semanas («lead-in») sólo con P-IFN y RBV. La triple terapia (boceprevir, P-IFN y RBV) debe mantenerse durante 44 semanas más hasta completar las 48 semanas totales de tratamiento. + BOCEPREVIR PAUTA DE ADMINISTRACIÓN DE BOCEPREVIR EN PACIENTES TRASPLANTADOS Página 3 de 7
4 Telaprevir La dosis habitual de telaprevir es de 750mg (2 comprimidos) cada 8 horas, administrados con comida. Los comprimidos deben tragarse enteros (sin masticar o triturar o disolver). Aunque no existen datos en pacientes coinfectados y trasplantados, telaprevir se podrá administrar también a dosis de 1.125mg (3 comprimidos) cada 12 horas. La duración total del tratamiento es de 48 semanas. Telaprevir debe administrarse en combinación con P-IFN alfa (2a o 2b) y RBV durante 12 semanas, seguidas de 36 semanas de tratamiento con P- IFN y RBV hasta completar las 48 semanas totales de tratamiento. + TELAPREVIR PAUTA DE ADMINISTRACIÓN DE TELAPREVIR EN PACIENTES TRASPLANTADOS CRITERIOS DE SUSPENSIÓN DEL TRATAMIENTO EN PACIENTES CON HCC TRASPLANTADOS Para boceprevir (1) Determinación del ARN-VHC en la semana 12 de tratamiento (semana 8 de la triple terapia), y si es mayor o igual a 100 UI/ml todos los tratamientos (boceprevir, P-IFN y RBV) deben ser suspendidos. (2) Determinación del ARN-VHC en la semana 24 y 36 de tratamiento (semana 20 y 32, respectivamente, de triple terapia), y si es detectable todos los tratamientos (boceprevir, P-IFN y RBV) deben ser suspendidos. (3) Si por cualquier razón se tuviera que suspender el P-IFN y la RBV, también se debe suspender el boceprevir. Para telaprevir (1) Determinación del RNA-VHC en la semana 4 de tratamiento, y si es superior a UI/ml todos los tratamientos (telaprevir, P- IFN y RBV) deben ser suspendidos. (2) Determinación del RNA-VHC en la semana 12 de tratamiento, y si es superior a 1000 UI/ml todos los tratamientos (telaprevir, P-IFN y RBV) deben ser suspendidos. (3) Determinación del RNA-VHC en la semana 24 y 36 de tratamiento, y si es detectable todos los tratamientos (P-IFN y RBV) deben ser suspendidos. (4) Si por cualquier razón se tuviera que suspender el P-IFN y la RBV, también se debe suspender el telaprevir. MANEJO DE LA CICLOSPORINA (CSA) Y TACROLIMUS (TAC) [1] Dadas las interacciones farmacológicas entre los inhibidores de la proteasa y los inmunosupresores, se recomienda: (1) En el caso de tratamiento con boceprevir: la dosis de CsA se debe reducir a la mitad el día del inicio del tratamiento antiviral (por ejemplo, un paciente con una dosis de CsA de 100mg/12 horas - dosis total diaria de 200mg- debe reducir la dosis a 100mg/24 horas). En cuanto a tacrolimus, se debe reducir la dosis 1/8 el día del inicio del tratamiento con boceprevir (por ejemplo, un paciente con una dosis de 2mg/12 horas dosis total diaria de 4mg/día- debe reducir la dosis a 0,5mg/24 horas). Se puede también considerar también un ajuste de dosis espaciando la toma. (2) En el caso de tratamiento con telaprevir, la dosis de CsA se debe reducir a una cuarta parte el día del inicio del tratamiento con telaprevir (por ejemplo, un paciente con una dosis de CsA de 100mg/12 horas dosis total diaria de 200mg/día- debe reducir la dosis a 50mg/día). En cuanto a tacrolimus, la dosis se debe reducir a un 1/30 el día del inicio del tratamiento con telaprevir (por ejemplo, un paciente con una dosis de 1mg/12 horas -dosis total diaria de 2mg/día- debe reducir la dosis a 0,2mg/72 horas). La dosis de 0,2mg está comercializada (formulación pediátrica). Se puede también considerar ajuste de dosis espaciando la toma (en el ejemplo anterior el paciente debería tomar 0,5mg/semana). (3) Dado que los cambios en las dosis e intervalos de CsA o TAC recomendados en los apartados anteriores son aproximaciones, se deben monitorizar los niveles valle de CsA o TAC en días alternos durante la primera semana de tratamiento con la triple terapia, realizando los ajustes de dosis necesarios para alcanzar los niveles deseados. (4) En el caso de pacientes con recidiva grave e inmunosupresión no estable, el manejo de la CsA en el contexto de inhibidores de la proteasa es menos complejo que el del TAC y por tanto, sería recomendable cambiar a CsA. (5) Una vez interrumpido el tratamiento con telaprevir o boceprevir se reiniciará el tratamiento inmunosupresor a las dosis previas al inicio de los inhibidores de la proteasa (y se procederá a monitorizar los niveles a días alternos durante la primera semana y semanalmente durante el primer mes). Una proporción significativa de pacientes requerirán dosis superiores a las basales tras la suspensión del inhibidor de la proteasa, especialmente si estaban recibiendo tacrolimus. 3. CARACTERÍSTICAS DE LOS CENTROS La incorporación de telaprevir o boceprevir al tratamiento estándar de la HCC plantea problemas nuevos, como es el manejo de los efectos adversos inducidos por estos medicamentos, y el acceso rápido a los resultados de las pruebas de laboratorio necesarias para actuar con racionalidad y eficiencia. Prolongar indebidamente el tratamiento, cuando no se produce respuesta, incrementa la aparición de mutaciones de resistencia en el virus e incrementa innecesariamente el coste. El tratamiento con triple terapia debe realizarse en unidades que cumplan una serie de requisitos mínimos para la óptima vigilancia de la seguridad de los pacientes. Es esencial que los pacientes sean tratados en el contexto de unidades que estén acostumbradas a la detección y manejo de las potenciales complicaciones. La idoneidad de los centros resulta particularmente relevante en los pacientes F4 con enfermedad muy avanzada. La posibilidad de consulta con especialistas que puedan abordar el manejo de problemas extrahepáticos, como depresión o manifestaciones cutáneas resulta imprescindible. Estos tratamientos exigen unas reglas de suspensión muy estrictas que están reguladas por la determinación del ARN-VHC, que se debe realizar de manera muy frecuente. Cualquier centro o unidad que utilice estos fármacos debe disponer de los resultados de esta determinación en menos de una semana (máximo 7 días). Igualmente, tienen que poder disponer del resultado del polimorfismo IL28B, realizado en el laboratorio del propio hospital o en un laboratorio externo que pueda hacer esta determinación de manera regular y rápida. Página 4 de 7
5 Los centros que no cumplan estos requisitos tendrían que poder remitir a los pacientes que consideren potencialmente tributarios de recibir triple terapia a otro centro. 4. ENSAYOS CLÍNICOS AUTORIZADOS EN ESPAÑA CON BOCEPREVIR, TELAPREVIR U OTROS MEDICAMENTOS PARA EL TRATAMIENTO DE LA HEPATITIS C EN COINFECTADOS Y TRASPLANTADOS Puede consultarse un listado completo y actualizado de los ensayos clínicos autorizados en España para el tratamiento de la hepatitis C crónica en pacientes coinfectados por VIH y en pacientes con trasplante hepático en la dirección Desde enero de 2013 esta misma información está disponible también en el Registro Español de estudios clínicos, en la dirección 5. NOTIFICACIÓN DE REACCIONES ADVERSAS Se recuerda la importancia de notificar todas las sospechas de reacciones adversas a los Centros Autonómicos de Farmacovigilancia, pudiéndose realizar a través de la web Estos medicamentos son de reciente comercialización y están sujetos a un seguimiento adicional por lo que la notificación de sospechas de reacciones adversas es prioritaria. 6. RECOMENDACIONES PARA EL MANEJO DEL EXANTEMA El manejo y tratamiento de la toxicidad cutánea debe llevarse a cabo en base a la práctica clínica habitual, recomendándose adicionalmente los siguientes procedimientos para la evaluación y manejo de la misma: Evaluación del grado de severidad Todos los acontecimientos cutáneos se evaluarán junto con otros síntomas sistémicos y anomalías analíticas. El grado y la severidad de la lesión deben ser evaluados utilizando los criterios descritos a continuación: (1) Grado 1, leve: el exantema leve se define como una erupción cutánea localizada o una erupción cutánea con una distribución limitada (por ejemplo, en varias localizaciones aisladas del cuerpo), con o sin prurito acompañante. Un exantema leve no tendrá lesiones en escarapela, signos sistémicos ni afectación de las mucosas ni signos de desprendimiento epidérmico. (2) Grado 2, moderado: el exantema moderado se define como una erupción cutánea difusa que afecta, como máximo, al 50% de la superficie corporal, con o sin separación de la piel superficial o prurito. Puede haber inflamación de las mucosas sin úlceras. Obsérvese que los trastornos de las mucosas que no estén relacionados con episodios cutáneos, como úlceras aftosas, estomatitis o liquen plano bucal, deben quedar bien documentados y no se tienen en cuenta para graduar el exantema. Un exantema moderado no tendrá signos de lesiones en escarapela ni desprendimiento epidérmico. Puede haber signos y síntomas sistémicos moderados, como fiebre, artralgia o eosinofilia, con un exantema morbiliforme moderado. Por consiguiente, para la gradación del exantema se necesitan el tipo de éste y una evaluación minuciosa del grado de todo signo sistémico y su relación temporal con el inicio del exantema o su progresión. (3) Grado 3, intenso: el exantema intenso se define como un exantema generalizado que afecta a más del 50% de la superficie corporal o que presenta alguna de las características siguientes: exantema con vesículas o ampollas; úlceras superficiales en las mucosas; desprendimiento epidérmico (necrosis de todo el espesor epidérmico y separación de la epidermis de la dermis subyacente); lesiones en escarapela atípicas o típicas; púrpura palpable o eritema que no blanquea a la presión; diagnóstico de eosinofilia farmacológica con síntomas sistémicos (DRESS), eritema multiforme (EM) o pustulosis exantemática generalizada aguda (PEGA). Un exantema con presencia de signos o síntomas sistémicos importantes que sean nuevos y se consideren relacionados con el inicio o la progresión del mismo se considerará de grado 3. (4) Grado 4, potencialmente mortal: Diagnóstico de erupción ampollosa generalizada, síndrome de Stevens-Johnson (SSJ) o necrolisis epidérmica tóxica (NET). Recomendaciones profilácticas Se debe recomendar a los pacientes el uso diario de cremas hidratantes y emolientes. Recomendaciones de tratamiento Los antihistamínicos y corticosteroides tópicos pueden proporcionar alivio sintomático a los pacientes que presenten exantema y síntomas acompañantes, como prurito. El tratamiento del exantema durante el periodo de tratamiento debe ajustarse siempre a la práctica clínica habitual. Entre los antihistamínicos tópicos y sistémicos recomendados en todos los grados de exantema figuran difenhidramina, hidroxizina, levocetirizina y desloratadina. Deberá realizarse un seguimiento sintomático de los pacientes para detectar un posible aumento de la exposición y empeoramiento de acontecimientos adversos. Dado que la inmunodepresión debida a los corticosteroides sistémicos puede causar elevaciones del ARN del VHC y debido a la sospecha de interacciones farmacológicas, éstos sólo deberán utilizarse cuando sea clínicamente necesario y tras haber empleado otros tratamientos y medidas. Se permitirá el uso de corticosteroides tópicos, aunque deberá limitarse a períodos breves, p. ej., un máximo de 2 semanas de uso continuo o regular y limitado al 50% de la superficie corporal como máximo. En esta situación se recomendará encarecidamente el uso de cremas o lociones, por su menor potencial de absorción. Se desaconseja el uso de geles o pomadas de corticosteroides tópicos, pues su potencial de absorción es relativamente mayor. Los pacientes que presenten un exantema (de cualquier grado) que requiera tratamiento con corticosteroides sistémicos deberán interrumpir el tratamiento de manera inmediata y definitiva. Recomendaciones de tratamiento en los pacientes que presenten un exantema de grado 1 ó 2. El seguimiento se llevará a cabo bajo criterio del médico responsable de la prescripción. Podrán emplearse medicamentos para aliviar los síntomas según lo descrito anteriormente. Además, a los pacientes que manifiesten exantema o prurito cutáneo se les recomendarán otras estrategias para reducir al mínimo la intensidad o progresión de sus signos y síntomas (p. ej., limitar la exposición al sol y el calor, baños con bicarbonato sódico o avena o prendas de Página 5 de 7
6 vestir poco ajustadas). En todos los casos se vigilará de cerca a los pacientes para detectar la progresión del exantema o el empeoramiento de los signos y síntomas de afectación sistémica y se realizará un seguimiento hasta la resolución completa del exantema. En general, no será necesario interrumpir el tratamiento en los pacientes que presenten un exantema grado 1, mientras que en los que presenten un exantema de grado 2 que progrese o no mejore, se considerará la conveniencia de esa interrupción. Si es preciso interrumpir el tratamiento por un exantema, se interrumpirá en primer lugar el inhibidor de la proteasa, si el exantema no mejora sintomática ni objetivamente en el plazo de 7 días después de interrupción, se interrumpirá el uso de RBV. La administración de P-IFN alfa podrá mantenerse, a menos que también esté médicamente indicada su interrupción. La administración de los inhibidores de la proteasa no podrá reanudarse después de haberla suspendido a consecuencia de un acontecimiento adverso. Si se suspende P-IFN alfa o RBV por un exantema, podrá reanudarse si éste mejora en los 14 días siguientes a la interrupción del medicamento respectivo. Recomendaciones de tratamiento en los pacientes que presenten un exantema de grado 3 En los pacientes que presenten un exantema de grado 3 se aplicarán las mismas recomendaciones generales dadas para el exantema de grado 1 y 2. En los pacientes que presenten un exantema de grado 3, deberá interrumpirse el uso de los inhibidores de la proteasa inmediata y definitivamente. Si el exantema no mejora sintomática ni objetivamente en el plazo de 7 días después de su interrupción, se deberá considerar la interrupción o discontinuación del tratamiento con RBV y/o P-INF alfa de forma secuencial o simultánea. Si se considera médicamente indicado, podría ser necesaria una interrupción o discontinuación de RBV y peg-interferón alfa de forma más temprana. Se podrán interrumpir los tres fármacos simultáneamente si está clínicamente indicado. En todo caso, los pacientes que presenten un exantema grave progresivo o aquellos con diagnóstico o sospecha de DRESS, EM o PEGA interrumpirán todo el tratamiento de manera inmediata y definitiva. La administración de los inhibidores de la proteasa no podrá reanudarse después de haberla suspendido a consecuencia de un acontecimiento adverso. Si se suspende peg-ifn alfa o RBV por un exantema, podrá reanudarse si éste mejora en los 14 días siguientes a la interrupción del medicamento respectivo. Si no es posible su reintroducción, debería suspenderse todo el tratamiento pues la monoterapia no está justificada en estos pacientes. Los pacientes que suspendan el tratamiento por DRESS, EM o PEGA no deberán reanudar la toma de ninguno de los tres fármacos. Se recomienda la derivación a un dermatólogo en caso de exantema de grado 3. Se recomienda la realización de controles analíticos que incluyan: hemograma (con fórmula), ALT, AST y creatinina. Se realizarán otros estudios analíticos según proceda. Se instaurará un seguimiento clínico estrecho y la intervención médica oportuna. Es posible que se requiera un seguimiento diario, para vigilar la progresión del acontecimiento desde su aparición hasta que se observe mejoría. Se vigilará a todos los pacientes hasta la resolución completa del exantema. Recomendaciones de tratamiento en los pacientes que presenten un exantema de grado 4 En los pacientes que presenten un exantema de grado 4 se aplicarán las mismas recomendaciones generales dadas para un exantema de grado 1, 2 y 3. Los pacientes con diagnóstico o sospecha de un exantema que se considere potencialmente mortal (exantema de grado 4), incluidos el SSJ y NET, interrumpirán todo el tratamiento de manera inmediata y definitiva. Tal y como se indica en la Ficha Técnica de telaprevir, durante la experiencia postcomercialización se han notificado casos de NET con desenlace mortal. Se recomienda la derivación a un dermatólogo como en el caso anterior. Se recomienda la realización de controles analíticos que incluyan: hemograma (con fórmula), ALT, AST y creatinina. Se realizarán otros estudios analíticos según proceda. Se instaurará un seguimiento clínico estrecho y la intervención médica oportuna. Es posible que se requiera un seguimiento diario, para vigilar la progresión del acontecimiento desde su aparición hasta que se observe mejoría. Se vigilará a todos los pacientes hasta la resolución completa del exantema. 7. RECOMENDACIONES PARA EL MANEJO DE LA ANEMIA SECUNDARIA AL TRATAMIENTO En primer lugar, la estrategia recomendada para el manejo de la anemia inducida por el tratamiento es la reducción de las dosis de ribavirina. Los cambios en la dosis de ribavirina deben hacerse basándose en las recomendaciones de la ficha técnica del producto. Debido a la limitada experiencia clínica con el uso de ribavirina a dosis inferiores a 600mg al día, no se recomiendan reducciones de dosis por debajo de ésta en la medida de lo posible. La reducción de la dosis de ribavirina debe hacerse con especial precaución en pacientes con cirrosis ya que la evidencia del impacto en la tasa de curación es más escasa. Debe tenerse en cuenta que si para el tratamiento de la anemia se decide la suspensión permanente de ribavirina, los inhibidores de la proteasa deben suspenderse de forma permanente. Otras intervenciones para el manejo de la anemia, incluyendo el uso de agentes estimulantes de la eritropoyesis (AES) y la trasfusión de concentrado de hematíes, pueden ser necesarias si las medidas anteriores son insuficientes. No obstante, deben tenerse en cuenta el riesgo de eventos trombóticos asociados al uso de AES en estos pacientes, así como las advertencias específicas de la AEMPS sobre el riesgo de aplasia eritrocítica pura, mediada por anticuerpos antieritropoyetina, y proliferación tumoral. REFERENCIAS 1. Coilly A, Roche B, Samuel D. Current management and perspectives for HCV recurrence after liver transplantation. Liver International (2013) 33 (1): Página 6 de 7
7 GRUPO DE EXPERTOS (por orden alfabético) Juan Berenguer Berenguer Unidad de Enfermedades Infecciosas/VIH. Hospital General Universitario Gregorio Marañón de Madrid José Luis Calleja Panero Servicio de Gastroenterología (Unidad de Hepatología). Hospital Universitario Puerta de Hierro Majadahonda Rafael Esteban Mur Servicio de Hepatología. Hospital Vall d'hebron, Barcelona Mª Jesús Fernández Cortizo División de Farmacología y Evaluación Clínica. Agencia Española de Medicamentos y Productos Sanitarios Xavier Forns Bernhardt Servicio de Hepatología. Hospital Clinic de Barcelona, Ciberehd, IDIBAPS Juan González García Servicio de Medicina Interna (Unidad de VIH). Hospital Universitario La Paz de Madrid Antonio López Navas División de Farmacología y Evaluación Clínica. Agencia Española de Medicamentos y Productos Sanitarios Luis Margusino Framiñán Servicio de Farmacia. Hospital A Coruña, Complexo Hospitalario Universitario A Coruña. Ramón Morillo Verdugo Servicio de Farmacia. Hospital de Valme, Sevilla Óscar Pinar López Subdirección de Compras de Farmacia y Productos Sanitarios. Servicio Madrileño de Salud Manuel Romero Gómez Unidad de Gestión Médico-Quirúrgica de Enfermedades Digestivas y Ciberehd. Hospital Universitario de Valme. Universidad de Sevilla Belén Ruiz Antorán Servicio de Farmacología Clínica. Hospital Universitario Puerta de Hierro Majadahonda Arantxa Sancho López Comité de Medicamentos de Uso Humano (CHMP) de la EMA; Agencia Española de Medicamentos y Productos Sanitarios Maria Jesús Téllez Molina Servicio de Medicina Interna (Unidad de VIH). Hospital Clínico San Carlos de Madrid Miguel Angel von Wichmann de Miguel Unidad de Enfermedades Infecciosas. Hospital Donostia (San Sebastián) Todos los expertos han realizado una declaración de conflictos de interés. Este documento ha sido aprobado por el Grupo de Coordinación del posicionamiento Terapéutico, que ha elevado, a su vez, un documento de revisión de la estrategia terapéutica recomendada para el uso de inhibidores de la proteasa en el tratamiento de la hepatitis C crónica (VHC) a la Comisión Permanente de Farmacia. Página 7 de 7
EFICACIA Y SEGURIDAD DE BOCEPREVIR Y TELAPREVIR RECOMENDACIONES DE USO DE MEDICAMENTOS EN CONDICIONES DISTINTAS A LAS AUTORIZADAS
 RECOMENDACIONES DE USO DE MEDICAMENTOS EN CONDICIONES DISTINTAS A LAS AUTORIZADAS Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C en pacientes
RECOMENDACIONES DE USO DE MEDICAMENTOS EN CONDICIONES DISTINTAS A LAS AUTORIZADAS Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C en pacientes
Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C (VHC) en pacientes monoinfectados
 INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-BOC/TEL-MONOINF/V2/01112014 Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C (VHC) en pacientes
INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-BOC/TEL-MONOINF/V2/01112014 Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C (VHC) en pacientes
Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C (VHC) en pacientes monoinfectados
 DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO INFORME DE UTILIDAD TERAPÉUTICA UT/V1/28022012 Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C
DEPARTAMENTO DE MEDICAMENTOS DE USO HUMANO INFORME DE UTILIDAD TERAPÉUTICA UT/V1/28022012 Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C
CRITERIOS Y RECOMENDACIONES PARA EL ACCESO PRECOZ AL TRATAMIENTO CON INHIBIDORES DE LA PROTEASA DEL VIRUS DE LA HEPATITIS C (VHC)
 CRITERIOS Y RECOMENDACIONES PARA EL ACCESO PRECOZ AL TRATAMIENTO CON INHIBIDORES DE LA PROTEASA DEL VIRUS DE LA HEPATITIS C (VHC) Información dirigida a profesionales sanitarios Grupo de Expertos Hepatitis
CRITERIOS Y RECOMENDACIONES PARA EL ACCESO PRECOZ AL TRATAMIENTO CON INHIBIDORES DE LA PROTEASA DEL VIRUS DE LA HEPATITIS C (VHC) Información dirigida a profesionales sanitarios Grupo de Expertos Hepatitis
Guias Terapeuticas Hepatitis C. Rafael ESteban Hospital Valle de Hebron Barcelona
 Guias Terapeuticas Hepatitis C Rafael ESteban Hospital Valle de Hebron Barcelona JORNADAS DE OTOÑO A.E.E.H. Coordinador Rafael Esteban Documento del II Consenso español sobre tratamiento de la hepatitis
Guias Terapeuticas Hepatitis C Rafael ESteban Hospital Valle de Hebron Barcelona JORNADAS DE OTOÑO A.E.E.H. Coordinador Rafael Esteban Documento del II Consenso español sobre tratamiento de la hepatitis
6º Curso-Taller de Casos Clínicos para Farmacéuticos de Hospital. Sevilla, 7 y 8 de Marzo de 2013
 6º Curso-Taller de Casos Clínicos para Farmacéuticos de Hospital Sevilla, 7 y 8 de Marzo de 2013 Tratamiento de Hepatitis C en paciente coinfectado VIH: Telaprevir y efectos adversos cutáneos Teresa García
6º Curso-Taller de Casos Clínicos para Farmacéuticos de Hospital Sevilla, 7 y 8 de Marzo de 2013 Tratamiento de Hepatitis C en paciente coinfectado VIH: Telaprevir y efectos adversos cutáneos Teresa García
Documento acordado por la Comisión Permanente de Farmacia del Consejo Interterritorial del Sistema Nacional de Salud
 Estrategia terapéutica de priorización para el uso de antivirales de acción directa para el tratamiento de la hepatitis crónica por virus C (VHC) en el ámbito del Sistema Nacional de Salud Documento acordado
Estrategia terapéutica de priorización para el uso de antivirales de acción directa para el tratamiento de la hepatitis crónica por virus C (VHC) en el ámbito del Sistema Nacional de Salud Documento acordado
"No hay una verdadera asociación si no es entre hombres libres e iguales" MIÉRCOLES 19-11-2014
 "No hay una verdadera asociación si no es entre hombres libres e iguales" (Giuseppe Mazzini) MIÉRCOLES 19-11-2014 Edita: SANIFAX, S.L. Pso. San Francisco de Sales, 41 28003 Madrid Tfno. 91-533.46.05 sanifax@sanifax.es
"No hay una verdadera asociación si no es entre hombres libres e iguales" (Giuseppe Mazzini) MIÉRCOLES 19-11-2014 Edita: SANIFAX, S.L. Pso. San Francisco de Sales, 41 28003 Madrid Tfno. 91-533.46.05 sanifax@sanifax.es
Agencia Española de Medicamentos y Productos Sanitarios AEMPS
 Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS VICTRELIS (BOCEPREVIR): INTERACCIÓN CON LOS INHIBIDORES DE LA PROTEASA DEL VIH ATAZANAVIR, DARUNAVIR Y LOPINAVIR Fecha de
Nota informativa Agencia Española de Medicamentos y Productos Sanitarios AEMPS VICTRELIS (BOCEPREVIR): INTERACCIÓN CON LOS INHIBIDORES DE LA PROTEASA DEL VIH ATAZANAVIR, DARUNAVIR Y LOPINAVIR Fecha de
Manejo de la hepatitis crónica C en Atención Primaria
 Manejo de la hepatitis crónica C en Atención Primaria Virus C 9 genotipos diferentes 40 subgenotipos 170 millones personas infectadas 800.000 portadores en España Prevalencia hepatitis C crónica: 1,5-2%
Manejo de la hepatitis crónica C en Atención Primaria Virus C 9 genotipos diferentes 40 subgenotipos 170 millones personas infectadas 800.000 portadores en España Prevalencia hepatitis C crónica: 1,5-2%
RESUMEN EJECUTIVO EN ESPAÑOL
 RESUMEN EJECUTIVO EN ESPAÑOL Guía de Práctica Clínica para la prevención, diagnóstico, evaluación y tratamiento de la Hepatitis C en enfermedad renal crónica Page 1 of 8 GUIA 1: DETECCIÓN Y EVALUACIÓN
RESUMEN EJECUTIVO EN ESPAÑOL Guía de Práctica Clínica para la prevención, diagnóstico, evaluación y tratamiento de la Hepatitis C en enfermedad renal crónica Page 1 of 8 GUIA 1: DETECCIÓN Y EVALUACIÓN
ACADEMIA DE FARMACIA DE CASTILLA Y LEÓN
 Resumen de la conferencia pronunciada por la Dra. Dª. Cristina Arenas Departamento Médico. Laboratorios Gilead con el título Situación actual del tratamiento farmacológico " Salamanca, 1 de Junio de 2015
Resumen de la conferencia pronunciada por la Dra. Dª. Cristina Arenas Departamento Médico. Laboratorios Gilead con el título Situación actual del tratamiento farmacológico " Salamanca, 1 de Junio de 2015
XXI Congreso de la Sociedad Española de Trasplante Hepático (SETH). Badajoz, 7-9 de Octubre de 2.009
 XXI Congreso de la Sociedad Española de Trasplante Hepático (SETH). Badajoz, 7-9 de Octubre de 2.009 LA PROLONGACIÓN DEL TRATAMIENTO ANTIVIRAL EN LA HEPATITIS POR VIRUS C RECURRENTE POSTRASPLANTE HEPÁTICO
XXI Congreso de la Sociedad Española de Trasplante Hepático (SETH). Badajoz, 7-9 de Octubre de 2.009 LA PROLONGACIÓN DEL TRATAMIENTO ANTIVIRAL EN LA HEPATITIS POR VIRUS C RECURRENTE POSTRASPLANTE HEPÁTICO
Escenario actual en Catalunya en el tratamiento del VHC. Antoni Gilabert Perramon Gerente de Farmacia y del Medicamento
 Escenario actual en Catalunya en el tratamiento del VHC Antoni Gilabert Perramon Gerente de Farmacia y del Medicamento Jornada sobre tratamiento de las hepatitis víricas en coinfectados con VIH Barcelona,
Escenario actual en Catalunya en el tratamiento del VHC Antoni Gilabert Perramon Gerente de Farmacia y del Medicamento Jornada sobre tratamiento de las hepatitis víricas en coinfectados con VIH Barcelona,
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
@ Artículo disponible en:
 @ Artículo disponible en: www.sietediasmedicos.com Solicitada acreditación TEMA 3 HEPATITIS C Tratamiento actual de la hepatitis C Rosa María Morillas, Marga Sala, Helena Masnou, Esther Soler Unidad de
@ Artículo disponible en: www.sietediasmedicos.com Solicitada acreditación TEMA 3 HEPATITIS C Tratamiento actual de la hepatitis C Rosa María Morillas, Marga Sala, Helena Masnou, Esther Soler Unidad de
Qué es la tarjeta amarilla?
 Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
Efectos Secundarios Telaprevir Boceprevir. Anemia 32% 49% Neutropenia 5 % grado 3-4 29 % grado 3-4. Molestias anorrectales 27 % - Rash 55 % 15-18 %
 FARMACOTERAPIA Manejo del tratamiento de la Hepatitis C Crónica Genotipo 1 María Pérez Abánades 1 y Concepción Martínez Nieto 1 La infección por el virus de la hepatitis C (VHC) es un problema de salud
FARMACOTERAPIA Manejo del tratamiento de la Hepatitis C Crónica Genotipo 1 María Pérez Abánades 1 y Concepción Martínez Nieto 1 La infección por el virus de la hepatitis C (VHC) es un problema de salud
Preguntas y respuestas del CIM Virtual del
 Preguntas y respuestas del CIM Virtual del Problemas de suministro De undecanoato de testosterona (Reandron 1000 mg/4 ml solución inyectable) 27 de agosto de 2014 Para qué se utiliza el undecanoato de
Preguntas y respuestas del CIM Virtual del Problemas de suministro De undecanoato de testosterona (Reandron 1000 mg/4 ml solución inyectable) 27 de agosto de 2014 Para qué se utiliza el undecanoato de
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA.
 HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA. Mª Victoria Rodríguez, Nelida Madrazo, Asunción Aguilera, Eva Mª Aguirre, Concepción Herrero, Mª Eugenia Plagaro,
HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA. Mª Victoria Rodríguez, Nelida Madrazo, Asunción Aguilera, Eva Mª Aguirre, Concepción Herrero, Mª Eugenia Plagaro,
Exposición de motivos
 José Antonio Carracao Meléndez, portavoz del Grupo Parlamentario Socialista, de conformidad con lo establecido en el artículo 52 del Reglamento de la Asamblea de la Ciudad Autónoma de Ceuta eleva, para
José Antonio Carracao Meléndez, portavoz del Grupo Parlamentario Socialista, de conformidad con lo establecido en el artículo 52 del Reglamento de la Asamblea de la Ciudad Autónoma de Ceuta eleva, para
Complicaciones hematologicas del tratamiento de las hepatitis virales
 Complicaciones hematologicas del tratamiento de las hepatitis virales JL López Banco Municipal de Sangre SOCIEDAD VENEZOLANA DE HEMATOLOGÍA EDUCACIÓN MÉDICA CONTÍNUA DECLARACIÓN DE POTENCIALES CONFLICTOS
Complicaciones hematologicas del tratamiento de las hepatitis virales JL López Banco Municipal de Sangre SOCIEDAD VENEZOLANA DE HEMATOLOGÍA EDUCACIÓN MÉDICA CONTÍNUA DECLARACIÓN DE POTENCIALES CONFLICTOS
QUÉ ES LA HEPATITIS C? CÓMO SE CONTAGIA?
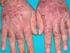 QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
Autor: Dres. Freynhagen R, Serpell M, Latymer M y colaboradores Fuente: SIIC Pain Practice 1-11, Nov 2013. Introducción y objetivos
 Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
CONVENIO 036 de 2012
 CONVENIO 036 de 2012 Guía de Práctica Clínica basada en la evidencia científica para la atención integral del VIH/Sida en niñas y niños. Guía de práctica clínica basada en la evidencia científica para
CONVENIO 036 de 2012 Guía de Práctica Clínica basada en la evidencia científica para la atención integral del VIH/Sida en niñas y niños. Guía de práctica clínica basada en la evidencia científica para
Introducción. Nuevos anticoagulantes orales
 Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
Manifestaciones clínicas. Cuadro mononucleósido asociado a la primoinfección. Clasificación de la infección VIH.
 Manifestaciones clínicas. Cuadro mononucleósido asociado a la primoinfección. Clasificación de la infección VIH. Jose Maria Kindelán. Hospital Universitario Reina Sofía. Córdoba I. Historia natral de la
Manifestaciones clínicas. Cuadro mononucleósido asociado a la primoinfección. Clasificación de la infección VIH. Jose Maria Kindelán. Hospital Universitario Reina Sofía. Córdoba I. Historia natral de la
6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1)
 6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1) (1.1) Es importante valorar la intensidad, la frecuencia y la duración de los síntomas de reflujo,
6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1) (1.1) Es importante valorar la intensidad, la frecuencia y la duración de los síntomas de reflujo,
Coinfección VIH / VHC /VHB. Aspectos relevantes de su seguimiento.
 Coinfección VIH / VHC /VHB. Aspectos relevantes de su seguimiento. VIH VHC VHB Porque es importante tener en cuenta la coinfección por VHC y por VHB en el paciente VIH? Importancia epidemiológica 1ª) Alta
Coinfección VIH / VHC /VHB. Aspectos relevantes de su seguimiento. VIH VHC VHB Porque es importante tener en cuenta la coinfección por VHC y por VHB en el paciente VIH? Importancia epidemiológica 1ª) Alta
CONSEJERÍA DE IGUALDAD, SALUD Y POLÍTICAS SOCIALES
 ctualización tras la CONSEJERÍA DE IGUALDAD, SALUD Y POLÍTICAS SOCIALES AGENCIA DE EVALUACIÓN DE TECNOLOGÍAS SANITARIAS DE ANDALUCÍA (AETSA) Criterios de selección de Agentes Antivirales Directos para
ctualización tras la CONSEJERÍA DE IGUALDAD, SALUD Y POLÍTICAS SOCIALES AGENCIA DE EVALUACIÓN DE TECNOLOGÍAS SANITARIAS DE ANDALUCÍA (AETSA) Criterios de selección de Agentes Antivirales Directos para
ANTECEDENTES DE HECHO
 DIRECCIÓN Madrid, 23 de mayo de 2013 ASUNTO: RESOLUCIÓN POR LA QUE SE ESTABLECE LA CLASIFICACIÓN DEL USO TERAPÉUTICO NO SUSTITUTIVO DEL PLASMA AUTÓLOGO Y SUS FRACCIONES, COMPONENTES O DERIVADOS, COMO MEDICAMENTO
DIRECCIÓN Madrid, 23 de mayo de 2013 ASUNTO: RESOLUCIÓN POR LA QUE SE ESTABLECE LA CLASIFICACIÓN DEL USO TERAPÉUTICO NO SUSTITUTIVO DEL PLASMA AUTÓLOGO Y SUS FRACCIONES, COMPONENTES O DERIVADOS, COMO MEDICAMENTO
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
GUÍA RÁPIDA. Comisión Farmacoterapéutica Autonómica Servei de Salut de les Illes Balears
 Guía para la elección de tratamiento anticoagulante oral en la prevención de las complicaciones tromboembólicas asociadas a la fibrilación auricular no valvular GUÍA RÁPIDA Comisión Farmacoterapéutica
Guía para la elección de tratamiento anticoagulante oral en la prevención de las complicaciones tromboembólicas asociadas a la fibrilación auricular no valvular GUÍA RÁPIDA Comisión Farmacoterapéutica
Clasificación de problemas relacionados con medicamentos
 Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
Qué es el herpes genital?
 Qué es el herpes genital? Es una infección de transmisión sexual muy extendida causada por el virus del herpes simple (VHS) de tipo 2 (VHS-2) y de tipo 1 (VHS-1), que también es causa habitual del herpes
Qué es el herpes genital? Es una infección de transmisión sexual muy extendida causada por el virus del herpes simple (VHS) de tipo 2 (VHS-2) y de tipo 1 (VHS-1), que también es causa habitual del herpes
COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS INTERFERONES BETA: RIESGO DEMICROANGIOPATÍA TROMBÓTICAY SÍNDROME NEFRÓTICO
 COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS INTERFERONES BETA: RIESGO DEMICROANGIOPATÍA TROMBÓTICAY SÍNDROME NEFRÓTICO 01/septiembre/2014 Estimado profesional sanitario: La Agencia Española de Medicamentos
COMUNICACIÓN DIRIGIDA A PROFESIONALES SANITARIOS INTERFERONES BETA: RIESGO DEMICROANGIOPATÍA TROMBÓTICAY SÍNDROME NEFRÓTICO 01/septiembre/2014 Estimado profesional sanitario: La Agencia Española de Medicamentos
Anexo III. Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto
 Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
FUNCIONES DEL RESPONSABLE TECNICO DE IMPORTACIÓN/FABRICACIÓN DE PRODUCTOS COSMETICOS.
 FUNCIONES DEL RESPONSABLE TECNICO DE IMPORTACIÓN/FABRICACIÓN DE PRODUCTOS COSMETICOS. FUNDAMENTOS JURIDICOS ESPAÑOLES La Ley 14/1986, de 25 de abril, General de Sanidad, en su artículo 40, atribuye a la
FUNCIONES DEL RESPONSABLE TECNICO DE IMPORTACIÓN/FABRICACIÓN DE PRODUCTOS COSMETICOS. FUNDAMENTOS JURIDICOS ESPAÑOLES La Ley 14/1986, de 25 de abril, General de Sanidad, en su artículo 40, atribuye a la
Informe de Posicionamiento Terapéutico de Sofosbuvir (Sovaldi )
 INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-SOFOSBUVIR/V1/01112014 Informe de Posicionamiento Terapéutico de Sofosbuvir (Sovaldi ) Fecha de publicación: 18 de noviembre de 2014 Fecha de corrección: 20 de
INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-SOFOSBUVIR/V1/01112014 Informe de Posicionamiento Terapéutico de Sofosbuvir (Sovaldi ) Fecha de publicación: 18 de noviembre de 2014 Fecha de corrección: 20 de
Las nuevas terapias disponibles para la hepatitis C pueden lograr una tasa de curación de hasta el 80%.
 Page 1 of 5 El canal de noticias médicas de PortalesMedicos.com Busca Ultimas Noticias Noticias por especialidad Noticias por tema Archivo de noticias Canales Publique sus Las nuevas terapias disponibles
Page 1 of 5 El canal de noticias médicas de PortalesMedicos.com Busca Ultimas Noticias Noticias por especialidad Noticias por tema Archivo de noticias Canales Publique sus Las nuevas terapias disponibles
HEPATITIS C, EPIDEMIA SILENTE
 PILDORAS EPIDEMIOLOGICAS Hepatitis C en el Mundo Se estima una prevalencia de 200 millones de portadores a nivel mundial con una mortalidad anual de 350 mil personas como consecuencia del efecto crónico
PILDORAS EPIDEMIOLOGICAS Hepatitis C en el Mundo Se estima una prevalencia de 200 millones de portadores a nivel mundial con una mortalidad anual de 350 mil personas como consecuencia del efecto crónico
LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA
 LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA Se identifican diversos síntomas atípicos de la primo infección, algunos de ellos graves, aunque poco frecuentes Nota:
LOS SÍNTOMAS DE LA INFECCIÓN AGUDA POR VIH SERÍAN MÁS VARIADOS DE LO QUE SE PENSABA Se identifican diversos síntomas atípicos de la primo infección, algunos de ellos graves, aunque poco frecuentes Nota:
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL
 FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD
 PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
Tuberculosis Hospital Event
 Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
ANTIVIRALES. Od.Viviana Karaben Cátedra de Farmacología FOUNNE.
 ANTIVIRALES Od.Viviana Karaben Cátedra de Farmacología FOUNNE. 2008 Los virus son parásitos intracelulares obligados, su replicación depende básicamente de procesos de síntesis de la célula huésped. Los
ANTIVIRALES Od.Viviana Karaben Cátedra de Farmacología FOUNNE. 2008 Los virus son parásitos intracelulares obligados, su replicación depende básicamente de procesos de síntesis de la célula huésped. Los
4.4.1 Servicio de Prevención Propio.
 1 Si se trata de una empresa entre 250 y 500 trabajadores que desarrolla actividades incluidas en el Anexo I del Reglamento de los Servicios de Prevención, o de una empresa de más de 500 trabajadores con
1 Si se trata de una empresa entre 250 y 500 trabajadores que desarrolla actividades incluidas en el Anexo I del Reglamento de los Servicios de Prevención, o de una empresa de más de 500 trabajadores con
A TODOS LOS GASTROENTERÓLOGOS E INFECTÓLOGOS PARTICIPANTES DE TRIPLE-S SALUD
 CARTA CIRCULAR #M1312239 30 de diciembre de 2013 A TODOS LOS GASTROENTERÓLOGOS E INFECTÓLOGOS PARTICIPANTES DE TRIPLE-S SALUD REVISIÓN DE POLÍTICA SOBRE HEPATITIS C Esta carta sustituye la carta circular
CARTA CIRCULAR #M1312239 30 de diciembre de 2013 A TODOS LOS GASTROENTERÓLOGOS E INFECTÓLOGOS PARTICIPANTES DE TRIPLE-S SALUD REVISIÓN DE POLÍTICA SOBRE HEPATITIS C Esta carta sustituye la carta circular
CAMPAÑA PARA EL CONTROL Y LA PREVENCIÓN DE LA LEGIONELOSIS INFORMACIÓN COMPLEMENTARIA DE INTERÉS
 CAMPAÑA PARA EL CONTROL Y LA PREVENCIÓN DE LA LEGIONELOSIS INFORMACIÓN COMPLEMENTARIA DE INTERÉS Ministerio de Sanidad y Consumo Dirección General de Salud Pública y Consumo Subdirección General de Sanidad
CAMPAÑA PARA EL CONTROL Y LA PREVENCIÓN DE LA LEGIONELOSIS INFORMACIÓN COMPLEMENTARIA DE INTERÉS Ministerio de Sanidad y Consumo Dirección General de Salud Pública y Consumo Subdirección General de Sanidad
Capítulo 5: METODOLOGÍA APLICABLE A LAS NORMAS NE AI
 Capítulo 5: METODOLOGÍA APLICABLE A LAS NORMAS NE AI La segunda fase del NIPE corresponde con la adecuación de las intervenciones de enfermería del sistema de clasificación N.I.C. (Nursing Intervention
Capítulo 5: METODOLOGÍA APLICABLE A LAS NORMAS NE AI La segunda fase del NIPE corresponde con la adecuación de las intervenciones de enfermería del sistema de clasificación N.I.C. (Nursing Intervention
BIBLIOGRAFÍA COMENTADA
 BIBLIOGRAFÍA COMENTADA American Journal of Transplantation Donor and recipient IL-28B polymorphisms in HCV-infected patients undergoing antiviral therapy before and after liver transplantation Polimorfismos
BIBLIOGRAFÍA COMENTADA American Journal of Transplantation Donor and recipient IL-28B polymorphisms in HCV-infected patients undergoing antiviral therapy before and after liver transplantation Polimorfismos
Hepatitis C Manejo del Paciente Vírgen a Tratamiento David Kershenobich, MD, PhD Instituto Nacional de Ciencias Médicas y Nutrición, Salvador Zubirán
 Hepatitis C Manejo del Paciente Vírgen a Tratamiento David Kershenobich, MD, PhD Instituto Nacional de Ciencias Médicas y Nutrición, Salvador Zubirán México, Distrito Federal Hepatitis C La FDA aprobo
Hepatitis C Manejo del Paciente Vírgen a Tratamiento David Kershenobich, MD, PhD Instituto Nacional de Ciencias Médicas y Nutrición, Salvador Zubirán México, Distrito Federal Hepatitis C La FDA aprobo
trasplante hepático y la recidiva de la hepatitis C en el embargo, la historia natural de la recidiva de la hepatitis C es
 Evoluciones atípicas de la recidiva de la hepatitis C en el trasplante hepático. Dra. Teresa Serrano. Hospital de Bellvitge. Barcelona. La cirrosis por hepatitis C es la principal indicación de trasplante
Evoluciones atípicas de la recidiva de la hepatitis C en el trasplante hepático. Dra. Teresa Serrano. Hospital de Bellvitge. Barcelona. La cirrosis por hepatitis C es la principal indicación de trasplante
1/ Frecuencia y fechas de reunión programada del CEIC.
 1/ Frecuencia y fechas de reunión programada del CEIC. El CEIC tiene programadas reuniones mensuales, excepto en el mes de Agosto. Estas reuniones tienen lugar entre los días 21 y 30 de cada mes (Normalmente
1/ Frecuencia y fechas de reunión programada del CEIC. El CEIC tiene programadas reuniones mensuales, excepto en el mes de Agosto. Estas reuniones tienen lugar entre los días 21 y 30 de cada mes (Normalmente
25 años de progreso HEPATITIS C. Innovación Biofarmacéutica: Una nueva esperanza para los pacientes
 25 años de progreso HEPATITIS C Innovación Biofarmacéutica: Una nueva esperanza para los pacientes HEPATITIS C Causa principal de cáncer y trasplante hepático en Chile La Hepatitis C es una enfermedad
25 años de progreso HEPATITIS C Innovación Biofarmacéutica: Una nueva esperanza para los pacientes HEPATITIS C Causa principal de cáncer y trasplante hepático en Chile La Hepatitis C es una enfermedad
LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO
 LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO Xenaro Graña 7 de Julio de 2007 Servicio de Reumatología del Complejo Hospitalario Universitario Juan Canalejo de A Coruña El tratamiento de la Enfermedad
LA ENFERMEDAD DE BEHÇET. TRATAMIENTOS PRESENTE Y FUTURO Xenaro Graña 7 de Julio de 2007 Servicio de Reumatología del Complejo Hospitalario Universitario Juan Canalejo de A Coruña El tratamiento de la Enfermedad
Mª Ángeles Suárez Rodríguez. Noviembre 2015
 Mª Ángeles Suárez Rodríguez. Noviembre 2015 MOTIVO DE CONSULTA Paciente varón de 20 meses que acude a consulta por manchas en la piel. Comenta la familia que las manchas aparecieron hace 24 horas. No han
Mª Ángeles Suárez Rodríguez. Noviembre 2015 MOTIVO DE CONSULTA Paciente varón de 20 meses que acude a consulta por manchas en la piel. Comenta la familia que las manchas aparecieron hace 24 horas. No han
Este documento enumera los diferentes tipos de Diagramas Matriciales y su proceso de construcción. www.fundibeq.org
 DIAGRAMA MATRICIAL 1.- INTRODUCCIÓN Este documento enumera los diferentes tipos de Diagramas Matriciales y su proceso de construcción. Muestra su potencial, como herramienta indispensable para la planificación
DIAGRAMA MATRICIAL 1.- INTRODUCCIÓN Este documento enumera los diferentes tipos de Diagramas Matriciales y su proceso de construcción. Muestra su potencial, como herramienta indispensable para la planificación
ESTRATEGIA TERAPÉUTICA PARA LA HEPATITIS CRÓNICA CAUSADA POR EL VIRUS DE LA HEPATITIS C EN EL SISTEMA NACIONAL DE SALUD
 ESTRATEGIA TERAPÉUTICA PARA LA HEPATITIS CRÓNICA CAUSADA POR EL VIRUS DE LA HEPATITIS C EN EL SISTEMA NACIONAL DE SALUD Recomendaciones generales y pautas actuales de tratamiento Plan Estratégico para
ESTRATEGIA TERAPÉUTICA PARA LA HEPATITIS CRÓNICA CAUSADA POR EL VIRUS DE LA HEPATITIS C EN EL SISTEMA NACIONAL DE SALUD Recomendaciones generales y pautas actuales de tratamiento Plan Estratégico para
CUANDO INICIAR TRATAMIENTO ANTIRRETROVIRAL INICIO PRECOZ O TARDÍO. Mar Gutiérrez Gracia Mateo Hospital de la Santa Creu i Sant Pau
 CUANDO INICIAR TRATAMIENTO ANTIRRETROVIRAL INICIO PRECOZ O TARDÍO Mar Gutiérrez Gracia Mateo Hospital de la Santa Creu i Sant Pau 19/11/2008 Cuestiones Básicas en el Inicio del Tratamiento Antirretroviral.
CUANDO INICIAR TRATAMIENTO ANTIRRETROVIRAL INICIO PRECOZ O TARDÍO Mar Gutiérrez Gracia Mateo Hospital de la Santa Creu i Sant Pau 19/11/2008 Cuestiones Básicas en el Inicio del Tratamiento Antirretroviral.
CONFIRMACIÓN EPIDEMIOLÓGICA DE LA ENFERMEDAD DE AUJESZKY ANTE LA PRESENCIA DE ANIMALES POSITIVOS AISLADOS O FALSOS POSITIVOS
 MINISTERIO DE MEDIO AMBIENTE Y MEDIO RURAL Y MARINO DG DE RECURSOS AGRICOLAS Y GANADEROS SUBDIRECCIÓN GENERAL DE SANIDAD DE LA PRODUCCIÓIN PRIMARIA PROTOCOLO DE ACTUACIÓN PARA LA CONFIRMACIÓN EPIDEMIOLÓGICA
MINISTERIO DE MEDIO AMBIENTE Y MEDIO RURAL Y MARINO DG DE RECURSOS AGRICOLAS Y GANADEROS SUBDIRECCIÓN GENERAL DE SANIDAD DE LA PRODUCCIÓIN PRIMARIA PROTOCOLO DE ACTUACIÓN PARA LA CONFIRMACIÓN EPIDEMIOLÓGICA
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
HEPATITIS B -Qué sucede
 Qué es la hepatitis? La hepatitis es una inflamación del hígado. Puede ser causada por las drogas, el consumo de alcohol, o ciertas condiciones médicas. Pero en la mayoría de los casos es causada por un
Qué es la hepatitis? La hepatitis es una inflamación del hígado. Puede ser causada por las drogas, el consumo de alcohol, o ciertas condiciones médicas. Pero en la mayoría de los casos es causada por un
Virus del Ébola ÉBOLA. Durante un brote, quienes mayor riesgo de infección corren son:
 ÉBOLA Lo que se debemos saber. 1. Qué es la enfermedad provocada por el virus del Ébola? Denominada anteriormente Fiebre hemorrágica del Ébola, es una enfermedad grave y con frecuencia letal, cuya tasa
ÉBOLA Lo que se debemos saber. 1. Qué es la enfermedad provocada por el virus del Ébola? Denominada anteriormente Fiebre hemorrágica del Ébola, es una enfermedad grave y con frecuencia letal, cuya tasa
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES
 DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES DEFINICIÓN El déficit selectivo de IgA se define como la ausencia total de Inmunoglobulina de tipo IgA en sangre. Existen cinco tipos (clases)
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES DEFINICIÓN El déficit selectivo de IgA se define como la ausencia total de Inmunoglobulina de tipo IgA en sangre. Existen cinco tipos (clases)
INFORMACION SOBRE GESTIÓN ELECTRÓNICA DE ENSAYOS CLÍNICOS CON MEDICAMENTOS
 INFORMACION SOBRE GESTIÓN ELECTRÓNICA DE ENSAYOS CLÍNICOS CON MEDICAMENTOS La Dirección General de Farmacia y Productos Sanitarios, a través del Centro Coordinador de Comités Éticos de Investigación Clínica,
INFORMACION SOBRE GESTIÓN ELECTRÓNICA DE ENSAYOS CLÍNICOS CON MEDICAMENTOS La Dirección General de Farmacia y Productos Sanitarios, a través del Centro Coordinador de Comités Éticos de Investigación Clínica,
Proyecto LYDIA Leucemia Aguda Infantil Dr. Antonio Pérez Martínez, Hospital Universitario La Paz, Madrid Dr. Joaquín Martínez, Hospital Universitario
 Proyecto LYDIA Leucemia Aguda Infantil Dr. Antonio Pérez Martínez, Hospital Universitario La Paz, Madrid Dr. Joaquín Martínez, Hospital Universitario 12 de Octubre, Madrid Qué es CRIS? Somos una organización
Proyecto LYDIA Leucemia Aguda Infantil Dr. Antonio Pérez Martínez, Hospital Universitario La Paz, Madrid Dr. Joaquín Martínez, Hospital Universitario 12 de Octubre, Madrid Qué es CRIS? Somos una organización
EVOLUCION A CORTO Y LARGO PLAZO DEL TRASPLANTE HEPATICO EN PACIENTES CON HEPATITIS AUTOINMUNE
 EVOLUCION A CORTO Y LARGO PLAZO DEL TRASPLANTE HEPATICO EN PACIENTES CON HEPATITIS AUTOINMUNE Pablo Ruiz, Lydia Sastre, Gonzalo Crespo, Jordi Colmenero, Miquel Navasa. Unidad de Trasplante Hepático Hospital
EVOLUCION A CORTO Y LARGO PLAZO DEL TRASPLANTE HEPATICO EN PACIENTES CON HEPATITIS AUTOINMUNE Pablo Ruiz, Lydia Sastre, Gonzalo Crespo, Jordi Colmenero, Miquel Navasa. Unidad de Trasplante Hepático Hospital
MINISTERIO DE ECONOM~A Y HACIENDA
 SECRETARIA, DE ESTADO DE ECONOMIA Y En relación con su consulta sobre adaptación de las normas de funcionamiento de los fondos de pensiones a las modificaciones del Reglamento de Planes y Fondos de Pensiones
SECRETARIA, DE ESTADO DE ECONOMIA Y En relación con su consulta sobre adaptación de las normas de funcionamiento de los fondos de pensiones a las modificaciones del Reglamento de Planes y Fondos de Pensiones
programación y guías docentes, el trabajo fin de grado y las prácticas externas.
 Informe de Seguimiento Graduado o Graduada en Administración y Dirección de Empresas de la Universidad de Málaga 1. ÁMBITO NORMATIVO El artículo 27 del Real Decreto 1393/2007, de 29 de octubre, modificado
Informe de Seguimiento Graduado o Graduada en Administración y Dirección de Empresas de la Universidad de Málaga 1. ÁMBITO NORMATIVO El artículo 27 del Real Decreto 1393/2007, de 29 de octubre, modificado
Gestión de la Prevención de Riesgos Laborales. 1
 UNIDAD Gestión de la Prevención de Riesgos Laborales. 1 FICHA 1. LA GESTIÓN DE LA PREVENCIÓN DE RIESGOS LABORALES. FICHA 2. EL SISTEMA DE GESTIÓN DE LA PREVENCIÓN DE RIESGOS LABORALES. FICHA 3. MODALIDAD
UNIDAD Gestión de la Prevención de Riesgos Laborales. 1 FICHA 1. LA GESTIÓN DE LA PREVENCIÓN DE RIESGOS LABORALES. FICHA 2. EL SISTEMA DE GESTIÓN DE LA PREVENCIÓN DE RIESGOS LABORALES. FICHA 3. MODALIDAD
ESTADO LIBRE ASOCIADO DE PUERTO RICO SENADO DE PUERTO RICO. P. del S. 58. 2 de enero de 2009. Presentado por el señor Arango Vinent
 ESTADO LIBRE ASOCIADO DE PUERTO RICO 16 ta Asamblea 1 ra Sesión Legislativa Ordinaria SENADO DE PUERTO RICO P. del S. 58 2 de enero de 2009 Presentado por el señor Arango Vinent Referido a la Comisión
ESTADO LIBRE ASOCIADO DE PUERTO RICO 16 ta Asamblea 1 ra Sesión Legislativa Ordinaria SENADO DE PUERTO RICO P. del S. 58 2 de enero de 2009 Presentado por el señor Arango Vinent Referido a la Comisión
IAP 1009 - TÉCNICAS DE AUDITORÍA APOYADAS EN ORDENADOR (TAAO)
 IAP 1009 - TÉCNICAS DE AUDITORÍA APOYADAS EN ORDENADOR (TAAO) Introducción 1. Como se indica en la Norma Internacional de Auditoría 401, "Auditoría en un contexto informatizado", los objetivos globales
IAP 1009 - TÉCNICAS DE AUDITORÍA APOYADAS EN ORDENADOR (TAAO) Introducción 1. Como se indica en la Norma Internacional de Auditoría 401, "Auditoría en un contexto informatizado", los objetivos globales
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES
 DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
La documentación remitida para evaluación por parte del solicitante debe enviarse del 1 al 5 de cada mes.
 ANEXO III: REQUISITOS PARA LA PRESENTACIÓN DE PROTOCOLOS AL CEIC Como norma general todas las solicitudes se realizarán exclusivamente en soporte electrónico. 1. PRESENTACIÓN DE SOLICITUDES REFERIDAS A
ANEXO III: REQUISITOS PARA LA PRESENTACIÓN DE PROTOCOLOS AL CEIC Como norma general todas las solicitudes se realizarán exclusivamente en soporte electrónico. 1. PRESENTACIÓN DE SOLICITUDES REFERIDAS A
SCREENING DE LA DISPLASIA / CÁNCER ANAL POR EL VIRUS DEL PAPILOMA HUMANO (VPH) EN HOMBRES QUE MANTIENEN RELACIONES SEXUALES CON HOMBRES
 SCREENING DE LA DISPLASIA / CÁNCER ANAL POR EL VIRUS DEL PAPILOMA HUMANO (VPH) EN HOMBRES QUE MANTIENEN RELACIONES SEXUALES CON HOMBRES Servicio de Enfermedades Infecciosas Hospital Universitari Vall d
SCREENING DE LA DISPLASIA / CÁNCER ANAL POR EL VIRUS DEL PAPILOMA HUMANO (VPH) EN HOMBRES QUE MANTIENEN RELACIONES SEXUALES CON HOMBRES Servicio de Enfermedades Infecciosas Hospital Universitari Vall d
MÁS QUE UN ESTORNUDO. Preguntas más frecuentes. Con la colaboración de: + que un estornud. www.masqueunestornudo.es. www.portalfarma.
 MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
www.fip.org/statements 1 Informe de Referencia de la FIP sobre Prácticas de Colaboración (2009),
 Preámbulo En 2009, el Comité de Práctica Farmacéutica (BPP) de la Federación Farmacéutica Internacional (FIP) creó el Grupo de Trabajo sobre Prácticas de Colaboración Interprofesional teniendo cuatro objetivos
Preámbulo En 2009, el Comité de Práctica Farmacéutica (BPP) de la Federación Farmacéutica Internacional (FIP) creó el Grupo de Trabajo sobre Prácticas de Colaboración Interprofesional teniendo cuatro objetivos
La hepatitis C es prevalente en todo el mundo. Las regiones más afectadas son Asia central y oriental y el norte de África.
 Hepatitis C Nota descriptiva N 164 Abril de 2014 Cifras y datos La hepatitis C es una enfermedad del hígado causada por el virus del mismo nombre; ese virus puede causar una infección, tanto aguda como
Hepatitis C Nota descriptiva N 164 Abril de 2014 Cifras y datos La hepatitis C es una enfermedad del hígado causada por el virus del mismo nombre; ese virus puede causar una infección, tanto aguda como
POR QUÉ YA NO SE RECOMIENDA ESPERAR 3 MESES PARA HACERSE LA PRUEBA DEL VIH?
 QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
Preguntas que se hacen con frecuencia sobre los estudios clínicos
 Preguntas que se hacen con frecuencia sobre los estudios clínicos Son seguros? Todos los ensayos clínicos deben ser aprobados por el gobierno federal y deben cumplir con una reglamentación estricta que
Preguntas que se hacen con frecuencia sobre los estudios clínicos Son seguros? Todos los ensayos clínicos deben ser aprobados por el gobierno federal y deben cumplir con una reglamentación estricta que
MIELOMA MULTIPLE. Se manifiesta en estos pacientes, debilidad, fatiga, y hemorragias como consecuencia de una medula ósea insuficiente.
 MIELOMA MULTIPLE 1. Qué es el mieloma múltiple? Es un cáncer de unas células llamadas plasmáticas, que nacen de nuestro sistema de defensa llamado también inmunológico, éstas células que producen a las
MIELOMA MULTIPLE 1. Qué es el mieloma múltiple? Es un cáncer de unas células llamadas plasmáticas, que nacen de nuestro sistema de defensa llamado también inmunológico, éstas células que producen a las
I Jornada de debat sobre eficàcia i seguretat en la utilització de medicaments. Análisis y gestión de riesgos en farmacovigilancia
 Análisis y gestión de riesgos en farmacovigilancia Francisco J. de Abajo,, AEMPS Barcelona, 1 de desembre de 2006 1 Ley de Garantías Los medicamentos deben demostrar que son eficaces, seguros y de calidad
Análisis y gestión de riesgos en farmacovigilancia Francisco J. de Abajo,, AEMPS Barcelona, 1 de desembre de 2006 1 Ley de Garantías Los medicamentos deben demostrar que son eficaces, seguros y de calidad
CÓMO LEER LOS RESULTADOS DE NUESTRAS PRUEBAS DE SANGRE*
 Competencias Esenciales: VIH/SIDA: Los Valores de Laboratorio CÓMO LEER LOS RESULTADOS DE NUESTRAS PRUEBAS DE SANGRE* SOBRE ESTA ACTIVIDAD Tiempo: 60 minutos Objectivos: Al finalizar esta sesión, los participantes
Competencias Esenciales: VIH/SIDA: Los Valores de Laboratorio CÓMO LEER LOS RESULTADOS DE NUESTRAS PRUEBAS DE SANGRE* SOBRE ESTA ACTIVIDAD Tiempo: 60 minutos Objectivos: Al finalizar esta sesión, los participantes
2.11.1 CONTRATAS Y SUBCONTRATAS NOTAS
 NOTAS 1 Cuando en un mismo centro de trabajo desarrollen actividades trabajadores de dos o más empresas, éstas deberán cooperar en la aplicación de la normativa sobre prevención de riesgos laborales. A
NOTAS 1 Cuando en un mismo centro de trabajo desarrollen actividades trabajadores de dos o más empresas, éstas deberán cooperar en la aplicación de la normativa sobre prevención de riesgos laborales. A
Control de la Salud de los Trabajadores
 UNIDAD Control de la Salud de los Trabajadores 6 FICHA 1. RECONOCIMIENTO MÉDICO A LOS TRABAJADORES FICHA 2. PRINCIPIOS BÁSICOS DE LOS RECONOCIMIENTOS MÉDICOS PREVENTIVOS A LOS TRABAJADORES. FICHA 3. OBJETIVOS
UNIDAD Control de la Salud de los Trabajadores 6 FICHA 1. RECONOCIMIENTO MÉDICO A LOS TRABAJADORES FICHA 2. PRINCIPIOS BÁSICOS DE LOS RECONOCIMIENTOS MÉDICOS PREVENTIVOS A LOS TRABAJADORES. FICHA 3. OBJETIVOS
INFORME DE PATOLOGIA ONCOLOGICA EN DOCENTES EN LA PROVINCIA DE MISIONES. AÑO 2011.
 INFORME DE PATOLOGIA ONCOLOGICA EN DOCENTES EN LA PROVINCIA DE MISIONES. AÑO 2011. FUNDAMENTOS Y OBJETIVOS: La Patología Oncológica es actualmente la principal causa de muerte en el mundo por enfermedad.
INFORME DE PATOLOGIA ONCOLOGICA EN DOCENTES EN LA PROVINCIA DE MISIONES. AÑO 2011. FUNDAMENTOS Y OBJETIVOS: La Patología Oncológica es actualmente la principal causa de muerte en el mundo por enfermedad.
LAS VACUNAS PARA LA ALERGIA. Vacunas
 LAS VACUNAS PARA LA ALERGIA Vacunas 1 Qué son las vacunas para la alergia? La vacunación alérgica o inmunoterapia con alergenos consiste en la administración de pequeñas cantidades crecientes de un alergeno
LAS VACUNAS PARA LA ALERGIA Vacunas 1 Qué son las vacunas para la alergia? La vacunación alérgica o inmunoterapia con alergenos consiste en la administración de pequeñas cantidades crecientes de un alergeno
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS
 ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
Las infecciones de transmisión sexual. Generalitat de Catalunya Diseño: WHADS ACCENT. Sífilis. Preguntas y respuestas
 Las infecciones de transmisión sexual Generalitat de Catalunya Diseño: WHADS ACCENT Sífilis Preguntas y respuestas Qué es la sífilis? Es una infección causada por la bacteria Treponema pallidum, y forma
Las infecciones de transmisión sexual Generalitat de Catalunya Diseño: WHADS ACCENT Sífilis Preguntas y respuestas Qué es la sífilis? Es una infección causada por la bacteria Treponema pallidum, y forma
PRUEBA DE VIH. Universidad de Panamá USAID Proyecto Capacity Centroamérica
 PRUEBA DE VIH Universidad de Panamá USAID Proyecto Capacity Centroamérica Es la prueba de detección que produce los resultados rápidamente, en aproximadamente 20 minutos y utiliza sangre de una vena o
PRUEBA DE VIH Universidad de Panamá USAID Proyecto Capacity Centroamérica Es la prueba de detección que produce los resultados rápidamente, en aproximadamente 20 minutos y utiliza sangre de una vena o
!"#$%&'()#*$(+$*#$,+-#.).)/$
 "#$%&'()#*$(+$*#$,+-#.).)/$ 01$(+$2&*)3$(+$0455$ "#$%"%&%'()$*+&(,-.+"/* La celebración del primer Día Mundial contra la Hepatitis, establecido por la OMS, tiene por objeto fomentar la toma de conciencia
"#$%&'()#*$(+$*#$,+-#.).)/$ 01$(+$2&*)3$(+$0455$ "#$%"%&%'()$*+&(,-.+"/* La celebración del primer Día Mundial contra la Hepatitis, establecido por la OMS, tiene por objeto fomentar la toma de conciencia
ANÁLISIS DE DUPLICIDADES DEL SUBGRUPO TERAPÉUTICO C10 AGENTES MODIFICADORES DE LÍPIDOS
 ANÁLISIS DE ES DEL SUBGRUPO TERAPÉUTICO C10 AGENTES MODIFICADORES DE LÍPIDOS CLASIFICACIÓN Subgrupo Inhibidores de la HMG-CoA reductasa Simvastatina Lovastatina Pravastatina Fluvastatina Atorvastatina
ANÁLISIS DE ES DEL SUBGRUPO TERAPÉUTICO C10 AGENTES MODIFICADORES DE LÍPIDOS CLASIFICACIÓN Subgrupo Inhibidores de la HMG-CoA reductasa Simvastatina Lovastatina Pravastatina Fluvastatina Atorvastatina
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Sistemas de Gestión de Calidad. Control documental
 4 Sistemas de Gestión de Calidad. Control documental ÍNDICE: 4.1 Requisitos Generales 4.2 Requisitos de la documentación 4.2.1 Generalidades 4.2.2 Manual de la Calidad 4.2.3 Control de los documentos 4.2.4
4 Sistemas de Gestión de Calidad. Control documental ÍNDICE: 4.1 Requisitos Generales 4.2 Requisitos de la documentación 4.2.1 Generalidades 4.2.2 Manual de la Calidad 4.2.3 Control de los documentos 4.2.4
PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA
 PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA 22.05.2015 Este procedimiento de actuación se enmarca en el desarrollo
PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA 22.05.2015 Este procedimiento de actuación se enmarca en el desarrollo
