INTRODUCCION A LOS METODOS ELECTROANALITICOS
|
|
|
- Celia Pérez Pereyra
- hace 8 años
- Vistas:
Transcripción
1 Introduccón a los Métodos Electro-analítcos 2 Tema 7 INTRODUCCION A LOS METODOS ELECTROANALITICOS Los métodos electroquímcos de análss, o métodos electro-analítcos, son, en general, menos utlzados que los espectroscópcos o cromatográfcos. Posblemente, una de las causas radque en el poco conocmento que se tene de esta rama de la Cenca, pues, aunque la teoría de la Electroquímca no es más compleja n abstracta que la de la Espectro-químca, sn embargo, es mucho menos conocda. Los estudantes toman contacto con los procesos y mecansmos de nteraccón entre la radacón electromagnétca y la matera desde las prmeras etapas de su formacón, mentras que la Electroquímca, o no se ncluye en los programas académcos, o no se trata con la sufcente extensón y profunddad. Otra causa, por la que los métodos electro-analítcos no se utlzan muy extensamente en la práctca analítca ordnara, es que, por su propa naturaleza, ofrecen menos posbldades de automatzacón que otros métodos analítcos. Frente a los nconvenentes menconados, los métodos electro-analítcos ofrecen mportantes ventajas, entre las que cabe ctar: * Mayor especfcdad para un determnado estado de oxdacón. Por ejemplo, por métodos electroquímcos puede determnarse la cantdad de Fe 2+ y la de Fe 3+ presentes en una mezcla de ambas especes, mentras que muchos métodos espectro-químcos proporconan úncamente la cantdad total de herro. * Muchos métodos electro-analítcos proporconan nformacón sobre la actvdad de una determnada espece, en lugar de hacerlo sobre la concentracón, lo cual puede ser nteresante en certas ocasones. * La nstrumentacón es, en general, relatvamente barata. Los métodos electro-analítcos se basan en reaccones electroquímcas. Por ello, en prmer lugar, se consderarán algunas cuestones relaconadas con estos procesos y su relacón con las reaccones químcas.
2 Claudo González Pérez 3 REACCIONES ELECTROQUIMICAS Una reaccón químca de oxdacón reduccón es la que se produce con ntercambo de electrones entre oxdantes y reductores: a Ox 1 + b Red 2 = a Red 1 + b Ox 2 En una reaccón redox sempre están mplcados, al menos, dos sstemas redox, y la constante de equlbro está relaconada con los potencales normales de los sstemas mplcados, a través de la expresón: log K = E o o 1 E n donde E 1 o y E 2 o son los potencales normales, y n el número de moles de electrones ntercambados. Cuando se conoce el valor de la constante de equlbro, puede deducrse el sentdo de la reaccón. Esta se produce por smple mezcla de los reactvos y generalmente en un tempo muy corto (muchas veces, nstantáneamente). Una reaccón electroquímca es una reaccón redox en la que el ntercambo de electrones tene lugar en un electrodo. Ello hace que, por ser un proceso heterogéneo que se lleva a cabo en la nterfase electrodo dsolucón, el tempo para que se efectúe puede ser largo, lo cual supone una lmtacón en lo que respecta a su utlzacón cuanttatva. Sn embargo, el hecho de que en las reaccones electroquímcas el reactvo sea el propo electrón, consttuye una ventaja mportante respecto a oxdantes y reductores químcos, al evtarse todo tpo de procesos secundaros (precptacones, reaccones de complejacón, etc.) que pueden producrse con estas especes. Además, el flujo de electrones es fáclmente medble e ncluso mponble. Por otra parte, las reaccones electroquímcas se producen sempre asocadas con el fenómeno de la electrólss. Para llevar a cabo una electrolss es necesaro lo sguente: una célula electrolítca, o recpente en el que se realza el proceso, una fuente de corrente contnua, dferentes aparatos de medda (ml-voltímetros, mcro-amperímetros, etc) y unos electrodos. El electrodo en el que se llevan a cabo oxdacones recbe el nombre de ánodo, y en el que se efectúan reduccones se denomna cátodo. Estas defncones de cátodo y ánodo son aplcables, tanto a células electrolítcas, como a plas galváncas *. * Una pla galvánca es un dspostvo que permte obtener energía eléctrca a partr de un proceso químco. En una pla el ánodo es el electrodo negatvo, y el cátodo es el postvo. Una célula electrolítca es opuesta en su funconamento a una pla voltaca.
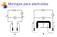
3 Introduccón a los Métodos Electro-analítcos 4 Los electrodos que úncamente ejercen el papel de soporte de electrones se denomnan electrodos natacables o nertes, mentras que cuando el propo electrodo expermenta una transformacón se denomna atacable. Las especes que pueden transformarse como consecuenca de una reaccón electroquímca, se denomnan sustancas electro-actvas. En la fgura 7.1. se ha representado dos montajes smplfcados para llevar a cabo la electrólss, con los electrodos en el msmo recpente (fgura 7.1.a.) y con los compartmentos anódco y catódco separados (fgura 7.1.b.). En este últmo caso, es mprescndble que las dos dsolucones estén en contacto medante una pared porosa que mpda la mezcla y que permta el paso de cargas (puente salno). A e e A V V + + puente salno. a Fgura 7.1. Montajes para electrólss. b Cuando se cerra el crcuto, los electrones crculan por el crcuto externo desde el ánodo al cátodo *, mentras que en el seno de la dsolucón el paso de la corrente corresponde al movmento de las cargas transportadas por los ones (mgracón ónca). PROCESOS FARADAICOS Y NO FARADAICOS En los electrodos pueden tener lugar dos tpos de procesos. Unos son los ya ndcados, en los que tene lugar transferenca de cargas entre el electrodo y la dsolucón (oxdacones y reduccones). Debdo a que estos procesos están regdos por la ley de Faraday, se denomnan procesos faradacos. En determnadas condcones puede exstr un margen de potencales en el que no se produce transferenca de * La corrente crcula en sentdo contraro, ya que, por convenenca, se consdera que está determnada por el sentdo de crculacón de las cargas eléctrcas postvas.
4 Claudo González Pérez 5 cargas entre un electrodo y la dsolucón, por ser procesos termodnámca o cnétcamente desfavorables, aunque, pueden tener lugar otros procesos, como adsorcones, crstalzacones, etc., que modfcan la nterfase electrodo-dsolucón, orgnando transtoramente cambos en la ntensdad o en el potencal. Estos procesos se denomnan no faradacos. Un ejemplo de proceso no faradaco es la corrente de carga de un electrodo al varar el potencal. Consdérese un electrodo a un determnado potencal E A (fgura 7.2.a.) al que no tene lugar electrólss. En esas condcones, hay una certa carga por undad de area en el electrodo y una carga gual, pero de sgno contraro, en la zona de la dsolucón nmedatamente adyacente, formándose lo que se conoce como doble capa eléctrca. Electrodo Solucón C. C = q V. ( ) (+) a b c Fgura 7.2. Interfase electrodo-dsolucón y corrente de carga. S el potencal del electrodo se hace más negatvo, al pasar a E B, donde la carga por undad de área es mayor (fgura 7.2.b.), la corrente deberá flur para hacer llegar mayor número de cargas a la nterfase. Se produce la llamada corrente de carga, que tene lugar de forma momentánea, solo hasta que se alcanza el nuevo equlbro. En nngún momento se produce transferenca de cargas entre el electrodo y la dsolucón (por supuesto, en ausenca de reaccones redox). Un electrodo en el cual no se produce cambo alguno en la velocdad de transferenca de cargas entre él y la dsolucón, a pesar de tener mpuesto un determnado potencal, se dce que está polarzado; esto es, un electrodo polarzado es aquél que acepta el potencal mpuesto externamente sn que tenga lugar cambo alguno en la velocdad de la reaccón electródca. En consecuenca, no hay cambo (o
5 Introduccón a los Métodos Electro-analítcos 6 muy pequeño) en la ntensdad de la corrente, y ésta puede ser cero, o tener un valor fnto. El electrodo polarzado deal en todo el margen de potencales dsponble en una dsolucón, no exste, pero hay algunos sstemas que se aproxman a ese comportamento. Así, un electrodo de mercuro en contacto con una dsolucón (desareada) de cloruro sódco se aproxma al electrodo polarzado deal en un margen de potencales de unos 2 voltos, ya que la oxdacón del mercuro hasta Hg 2 Cl 2 ocurre a unos 0.2 V. y la reduccón del Na + hasta la correspondente amalgama se produce a unos 2.5 V. (La reduccón del agua, H 2 O+e > 1/2H 2 +OH, es termodnámcamente posble en ese margen de potencales, pero transcurre con una velocdad muy pequeña). En esa zona, el comportamento de la nterfase electrodo-dsolucón es análogo al de un condensador (fgura 7.2.c.). Al aplcar un potencal, la carga se acumula en las placas hasta que se satsface la ecuacón C = q/e. Durante el proceso de carga, fluye una corrente de carga. El tempo de duracón de la corrente de carga depende de la capacdad del electrodo y de la resstenca de la dsolucón. Para los electrodos con área constante y para dsolucones de baja resstenca, el tempo durante el cual fluye la corrente de carga es muy pequeño (fraccones de segundo), mentras que s el área del electrodo varía con el tempo (como en el electrodo de gotas de mercuro) la corrente fluye durante más tempo, sendo cas proporconal a la velocdad de expansón de la superfce. En las reaccones electródcas con muy bajas concentracones de especes electroactvas, la corrente de carga (capactva) puede ser ncluso más grande que la corrente faradaca. De hecho, la corrente capactva es frecuentemente el factor lmtante en cuanto a la sensbldad de un determnado método electro-analítco. Cuando a la dsolucón en contacto con un electrodo polarzado deal se añade una sustanca capaz de oxdarse o reducrse a un determnado potencal, el electrodo se despolarza, y a la sustanca responsable de este hecho se llama despolarzador. Un electrodo no polarzado deal es aquel cuyo potencal no camba al hacerlo la ntensdad, esto es, un electrodo a un potencal fjo.
6 Claudo González Pérez 7 En la fgura 7.3. se muestran las curvas ntensdad potencal para un electrodo polarzado entre A y B y para un electrodo despolarzado deal entre C y D. A B C E E D a b Fgura 7.3. Curvas I E para un electrodo polarzado (a) y despolarzado (b). ETAPAS DEL PROCESO ELECTRODICO Consdérese la reduccón de un oxdante, Ox, sobre la superfce de un electrodo: Ox + n e < > Red El proceso, de forma smplfcada, mplca tres etapas, representadas en la fgura 7.4. Electrodo Interfase Dsolucón ne Ox b Red a c Ox Red Fgura 7.4. Reduccón electroquímca de un oxdante. Proceso smplfcado. La etapa a) corresponde a la transferenca de matera desde el seno de la dsolucón hasta la nterfase electrodo dsolucón, mentras que en la b) tene lugar la transferenca de electrones sobre la superfce del electrodo. Fnalmente, el producto de la reaccón electroquímca, Red, debe abandonar la nterfase para pasar a la dsolucón (etapa c).
7 Introduccón a los Métodos Electro-analítcos 8 El proceso real puede ser, en muchas ocasones, más complcado, como se muestra en la fgura 7.5. Electrodo Interfase Dsolucón Ox' 3 Ox' 2 Ox 1 Ox ne 4 Red' 3 Red' 2 Red 1 Red Fgura 7.5. Etapas del proceso electródco. La etapa 1 mplca transferenca de masas, y corresponde al movmento del oxdante, Ox, desde el seno de la dsolucón hasta la nterfase electrodo dsolucón, así como tambén la transferenca de masas nversa de la forma reducda, Red, hasta la dsolucón. En el proceso smplfcado, representado en la fgura 7.4., se consdera que la espece Ox se reduce electro-químcamente nada más ponerse en contacto con el electrodo. Sn embargo, puede ocurrr que tenga lugar reaccones químcas, preceddas o segudas de la propa reaccón electroquímca (etapa 2 en la fgura 7.5.). Estas reaccones pueden ser procesos homogéneos, como protonacones o dmerzacones, o procesos heterogéneos, tales como descomposcón catalítca sobre la superfce del electrodo. Asmsmo, pueden tener lugar tambén procesos físcos, tales como adsorcón, desorcón, crstalzacón, etc. antes o después de la transferenca electrónca (etapa 3 en la fgura 7.5.). Fnalmente, la etapa 4 corresponde a la reaccón electroquímca propamente dcha. Cada una de las etapas menconadas puede transcurrr a dferente velocdad, sendo la de menor velocdad, la etapa controlante del proceso global. Cuando la etapa controlante es la correspondente a la transferenca de masas, se dce que hay una polarzacón por concentracón, mentras que s es alguna reaccón químca ntermeda, tene lugar una reaccón de polarzacón. Por otra parte, s el paso lmtante es de tpo físco, puede estar presente una polarzacón por adsorcón, desorcón o crstalzacón, y s es la propa reaccón electroquímca, tene lugar una polarzacón por transferenca de carga. Prescndendo de posbles reaccones químcas y procesos físcos que puedan preceder o segur a la reaccón electródca, y atendendo a las velocdades de
8 Claudo González Pérez 9 transferenca de masas y de ntercambo de electrones, se consderan tres casos: A. La transferenca de electrones y el transporte de masas tene lugar a velocdades nfntamente grandes. B. La transferenca de masas sgue sendo nfntamente rápda y el ntercambo de electrones, lento. C. La velocdad de transferenca de masas transcurre tambén a velocdad fnta. A. Transferenca de electrones y transporte de masas a velocdades nfntas. Cuando las reaccones de oxdacón y de reduccón en el electrodo y el desplazamento de ones y moléculas tene lugar a velocdad nfntamente grande, el sstema puede tratarse como se hace con las reaccones químcas redox rápdas, esto es, a través de los potencales de equlbro. Consdérese un hlo de platno ntroducdo en una dsolucón que contene una mezcla de ones Fe 2+ y Fe 3+. En esas condcones, se establece un ntercambo de electrones entre los ones presentes en la dsolucón y el alambre de platno, alcanzándose un equlbro en el que el cambo Fe 3+ + e > Fe 2+ se hace a la msma velocdad que el nverso Fe 2+ e > Fe 3+. En ese momento, la composcón de la dsolucón en las proxmdades del hlo permanece constante y el hlo alcanza un potencal de equlbro, expresado por la ecuacón de Nernst: E eq =E o n Fe3+ log donde E o es el potencal normal del sstema Fe 3+ /Fe 2+ y [Fe 3+ ] y [Fe 2+ ] las concentracones de ambas especes (en sentdo estrcto, actvdades). Fe 2+ S se mpone al electrodo (hlo) un potencal dstnto de E eq, se produce una reaccón de oxdacón o de reduccón. Así, s se aplca un potencal, E, de forma que E>Eeq, se produce la oxdacón del Fe 2+ hasta Fe 3+, aumentando la relacón [Fe 3+ ]/[Fe 2+ ] hasta que E eq sea gual a E, momento en que de nuevo está el sstema en equlbro. La predccón de las reaccones que se producrán en los electrodos, en estos sstemas puede hacerse smplemente sobre la base de los potencales redox. Cuando en una dsolucón hay más de una sustanca capaz de oxdarse o de reducrse, de entre
9 Introduccón a los Métodos Electro-analítcos 10 las sustancas oxdables, aquella cuyo potencal sea más bajo será la prmera en oxdarse en el ánodo. De las especes reducbles, aquella con potencal más alto será la prmera en reducrse en el cátodo. Ejemplo 7.1. En la electrólss de cada una de las sguentes dsolucones tamponadas a ph=7, y a 25 ºC, predecr el producto prncpal en cada electrodo. a) NBr 2 1 M con electrodos nertes (Pt). b) NSO 4 1 M con electrodos de palado. Potencales normales: N 2+ /N= 0.25 V.; 2 H + /H 2 =0.00 V.; O 2 /H 2 O=1.23 V.; Pd 2+ /Pd=0.91 V.; S 2 O 8 2 /SO 4 2 =1.96 V.; Br 2 /2 Br =1.06 V. a) Las posbles reaccones de reduccón son: y las de oxdacón son: N e > N E eq = E o = 0.25 V. 2 H e > H 2 E eq = log [H + ] = 0.42 V. 2 Br > Br e Eeq = 1.06 V. 2 H 2 O > O 2 (g) + 4 H e E eq = log [H + ] = 0.81 V. En el cátodo tene lugar la reduccón del N 2+, mentras que en el ánodo se oxdará el agua, desprendéndose oxígeno. b) Las reaccones de reduccón posbles son las msmas que en el apartado a) Las reaccones de oxdacón posbles son: 2 SO 4 2 > S 2 O e E eq = E o = 1.96 V. 2 H 2 O > O 2 (g) + 4 H e E eq = log [H + ] = 0.81 V. Pd > Pd 2+ +2e E eq = log K s OH 2 =0.58V. *. En el cátodo ocurre la reduccón del N 2+, como en el apartado a), mentras que en el ánodo deberá oxdarse el propo electrodo.. * El potencal del sstema Pd 2+ /Pd es 0.91 V cuando [Pd 2+ ] = 1 M. Sn embargo, a ph = 7 precpta Pd(OH) 2 y la concentracón de Pd 2+ en dsolucón es la que permte el producto de solubldad del Pd(OH) 2.
10 Claudo González Pérez 11 B. Transferenca de masas a velocdad nfnta y velocdad de ntercambo de electrones fnta. Con esta premsa, es necesaro tener en cuenta que la composcón de la dsolucón es la msma en las proxmdades del electrodo y en el seno de la dsolucón. La velocdad de una reaccón electroquímca que tene lugar sobre un determnado electrodo se puede medr fáclmente, ya que se defne como el número de electrones ntercambados por undad de tempo, por lo que la ntensdad de la corrente que crcula por el electrodo es una medda de la velocdad. Se tratarán en prmer lugar los fenómenos que tenen lugar en un electrodo. Consdérese la oxdacón de un reductor: Red n e > Ox. Cuando se aumenta progresvamente el potencal del ánodo, a partr del potencal de equlbro, E a,(fgura 7.6.a.) comenza la reaccón electroquímca, aumentando la ntensdad de la corrente (velocdad de la reaccón electródca) al hacerlo el potencal. Esta relacón se traduce en una gráfca denomnada curva ntensdad potencal. Red Ox E a E E c E Red Ox a b Fgura 7.6. Curvas I E. a: oxdacón de un reductor. b: reduccón de un oxdante. Para la reduccón de un oxdante, la ntensdad aumenta en valor absoluto * cuando el potencal dsmnuye por debajo del de equlbro, E c (fgura 7.6.b.). La curva ntensdad potencal varía con la naturaleza del electrodo, forma, dmensones, etc., así como tambén con la actvdad (concentracón) del oxdante o * En el caso de reaccones catódcas suelen consderarse las ntensdades como negatvas.
11 Introduccón a los Métodos Electro-analítcos 12 reductor. Cuando se trata de un oxdante y un reductor del msmo sstema redox, las curvas de oxdacón del reductor y de reduccón del oxdante pueden trazarse separadamente, pudendo ocupar dstntas poscones relatvas, según que el sstema sea electro-químcamente "rápdo" o "lento". En la fgura 7.7. se ha representado un sstema rápdo. Las curvas de trazo fno corresponden a las reaccones parcales, y la curva de trazo grueso, al proceso global. El potencal de equlbro está determnado por el punto de corte de la curva global con el eje de potencales. A ese potencal, la velocdad de oxdacón ( o ) es gual a la de reduccón ( o ) y la composcón de la dsolucón no camba. Sn embargo, al potencal E 1 se produce la oxdacón del reductor a la velocdad 1 y smultáneamente tene lugar la reduccón del oxdante a la velocdad 2, con lo que la velocdad neta corresponderá con el punto 1 2 de la curva global. Un sstema muy rápdo presentará una curva ntensdad potencal que es cas una línea vertcal y se comporta según se ha explcado en el apartado A. Red Ox 1 o E 1 E eq 2 o E Red Ox Fgura 7.7. Sstema electroqumcamente "rápdo". En un sstema lento (fgura 7.8.) no exste valor alguno de potencal para el que las dos reaccones se produzcan al msmo tempo con velocdad aprecable. En estos
12 Claudo González Pérez 13 casos, no es posble determnar el potencal de equlbro a partr de la curva ntensdad potencal. A este potencal, las velocdades de oxdacón y de reduccón son práctcamente cero. Para oxdar el reductor con velocdad aprecable, 1, es precso aumentar el potencal hasta E 1, valor bastante superor al potencal de equlbro, esto es, exste una sobretensón anódca. Algo smlar ocurre para la reduccón de un oxdante *. Red Ox E eq 1 E 1 E Red Ox Fgura 7.8. Sstema electroquímco "lento". En toda electrólss hay dos electrodos, que pueden ser guales o dferentes. S los dos electrodos son déntcos, las curvas ntensdad potencal de las dferentes especes contendas en la dsolucón son guales en ambos electrodos, mentras que s se trata de electrodos dferentes, tambén podrán serlo las curvas ntensdad potencal regstradas sobre ellos. En cualquer caso, es fundamental tener en cuenta que la ntensdad que pasa a través de ambos electrodos tene que ser la msma. Oxdacón y reduccón del agua El agua se utlza en muchas ocasones como dsolvente, por lo que es mportante consderar las posbles reaccones redox en las que puede ntervenr. Así, puede oxdarse a oxígeno, según el proceso: * En los sstemas rápdos, para oxdar al reductor, basta con elevar el potencal a un valor muy poco superor al de equlbro, por lo que la sobretensón es muy pequeña. En estos casos, es posble efectuar una oxdacón o reduccón con una velocdad fnta en unas condcones muy semejantes a las de reversbldad termodnámca, por lo cual a estos sstemas tamben se los denomna reversbles, mentras que a los sstemas lentos, se les llama rreversbles.
13 Introduccón a los Métodos Electro-analítcos 14 o reducrse a hdrógeno según, 2 H 2 O 4 e > O H + 4 OH 4 e > O H 2 O 2 H 2 O + 2 e > H OH 2 H e > H 2 Las curvas ntensdad potencal correspondentes a estos procesos, se muestran aproxmadamente en la fgura 7.9. Como se pone de manfesto en dcha fgura, afortunadamente, el agua se comporta como un sstema electro-químcamente lento, lo cual hace potencalmente vables una gran cantdad de oxdacones y reduccones en su presenca, s ben las curvas se desplazan haca potencales más postvos o negatvos en funcón del medo (líneas de puntos en la fgura 7.9.). De cualquer forma, la presenca del agua puede producr lmtacones en algunos procesos electroquímcos efectuados en su seno. Así, todos los reductores cuyas curvas I E estén stuadas a la derecha de la del agua (zona rayada en la fgura 7.9.) solo podrán oxdarse después del agua. Análogamente, todos los oxdantes cuyas curvas I E estén stuadas a la zquerda de la del agua, no pueden reducrse en dsolucón acuosa. OH O 2 H O 2 O 2 E H 2 H O 2 H 2 H + Fgura 7.9. Curvas I E para el agua. La predccón de las reaccones que tendrán lugar en los electrodos no se puede hacer según los valores termodnámcos de los potencales redox. Es necesaro conocer las curvas ntensdad potencal. Ejemplo 7.2. Electrodo de platno ntroducdo en una dsolucón contenendo el sstema Fe 3+ /Fe 2+ y electrodo de grafto en una dsolucón contenendo Ce 4+ /Ce 3+.
14 Claudo González Pérez 15 En la fgura se han representado las curvas ntensdad potencal de ambos sstemas sobre los electrodos correspondentes.. Fe 2+ Pt Fe 3+ Ce 3+ Ce 4+ grafto Pt grafto + E 1 E 2 E Fe 3+ /Fe 2+ Ce 4+ /Ce 3+ Fe 2+ Fe 3+ Ce 3+ Ce 4+ Fgura Curvas I E de Fe 3+ /Fe 2+ sobre platno y de Ce 4+ /Ce 3+ sobre grafto. Cuando se aplca entre los electrodos una dferenca de potencal, E 1, como las ntensdades que crculan por ambos electrodos tenen que ser guales, el electrodo de grafto se comporta como ánodo, tenendo lugar en él la oxdacón de Ce 3+, mentras que el electrodo de platno actúa de cátodo, y en él se reduce el Fe 3+. S se aplca una dferenca de potencal más pequeña, tal como E 2, en el electrodo de platno tene lugar la oxdacón del Fe 2+, mentras que en el de grafto se produce la reduccón del Ce 4+. Ejemplo 7.3. Dos electrodos déntcos (de grafto) ntroducdos en una dsolucón ácda de sulfato férrco y persulfato potásco. Las posbles reaccones de reduccón son: Fe 3+ > Fe 2+ E o = 0.78 V. S 2 O 8 2 > SO4 2 E o = 2.0 V. H + > H 2 E o = 0.0 V. K + > K E o = 2.92 V. y las de oxdacón, H 2 O > O 2 E o = 1.23 V.
15 Introduccón a los Métodos Electro-analítcos 16 SO 4 2 > S 2 O 8 2 E o = 2.01 V. La teoría smplfcada que se ha consderado en el apartado A), predce la reduccón del persulfato en el cátodo. Sn embargo, como el sstema S 2 O 8 2 /SO 4 2 es electro-químcamente lento, la poscón de las curvas ntensdad potencal es la mostrada en la fgura H 2 O SO 4 2 S 2 O 8 2 O 2. H + SO 2 4 Fe 3+ S 2 O 8 2 K + E E K H 2 K + H SO Fe 2+ S 2 O 8 2 Fe 3+ Fgura Curvas I E sobre electrodos de grafto. S se aplca entre los electrodos una dferenca de potencal E, en el ánodo tene lugar la oxdacón del agua, mentras que en el cátodo se producrá la reduccón de los ones férrcos, en lugar de hacerlo el persulfato. Ejemplo 7.4. Electrólss de una dsolucón acuosa de cloruro sódco con los compartmentos anódco y catódco separados. a) Anodo de grafto y cátodo de herro. Las reaccones posbles son: ánodo: 2 Cl 2 e > Cl 2 (g) 2 H 2 O 4 e > O 2 (g) + 4 H + cátodo: 2 H 2 O + 2 e > H 2 (g) + 2 OH Na + + e > Na(s) Las curvas ntensdad potencal se muestran en la fgura 7.12.
16 Claudo González Pérez 17 grafto C Fe Cl H 2 O Cl 2 O 2. + E E H 2 H 2 O Na Na + herro Fgura Curvas ntensdad potencal sobre grafto y sobre herro. Al aplcar una dferenca de potencal E, en el ánodo se produce cloro y en el cátodo hdrógeno. b) Anodo de herro y cátodo de grafto. Las reaccones posbles son: ánodo: 2 Cl 2 e > Cl 2 (g) 2 H 2 O 4 e > O 2 (g) + 4 H + Fe 2 e > Fe 2+ cátodo: 2 H 2 O + 2 e > H 2 (g) + 2 OH Na + + e > Na(s) Las curvas ntensdad potencal correspondentes se ndcan en la fgura grafto H2O C Fe Cl Cl 2 O 2. + Na Na + H 2 H 2 O E E herro Fgura Curvas I E sobre herro y sobre grafto
17 Introduccón a los Métodos Electro-analítcos 18 Cuando se aplca una dferenca de potencal, E, en el cátodo se desprende hdrógeno, como en el caso anteror, pero en el ánodo se oxda el propo electrodo de herro. c) Anodo de grafto y cátodo de mercuro. En el ánodo se obtenen las msmas curvas que en el apartado a), pero en el cátodo, la curva correspondente a la reduccón del agua se desplaza haca la zquerda, debdo a que la sobre-tensón catódca para el hdrógeno es mayor sobre el mercuro que sobre el herro. Además, la curva del sodo se desplaza en sentdo contraro, debdo a la formacón de amalgama. Según esto, las poscones relatvas de las dstntas curvas son como se muestra en la fgura grafto Cl H2O Cl 2 O2 + E E Na(Hg) Na + H 2 H2O mercuro Fgura Curvas I E sobre grafto y sobre mercuro. Al aplcar una dferenca de potencal, E, en el ánodo se produce cloro, y en el cátodo se obtene amalgama de sodo. C. Transporte de matera a velocdad fnta. Cuando se produce una reaccón electroquímca sobre un electrodo, se consume la sustanca electro-actva que está en sus proxmdades, de forma que la reaccón se detendría s no ntervnesen fenómenos de transporte encargados de reponer la matera consumda. La matera puede acercarse al electrodo de tres formas: mgracón, dfusón y conveccón. El transporte de matera por mgracón se produce por el movmento de una
18 Claudo González Pérez 19 espece cargada bajo la nfluenca de un campo eléctrco. Afecta, pues, a las especes óncas en dsolucón: desplazamento de anones y catones haca el electrodo postvo y negatvo respectvamente. La dfusón es el movmento de una espece bajo la nfluenca de un gradente de potencal químco; por ejemplo, un gradente de concentracón. La reaccón electroquímca produce una varacón de la concentracón de las especes electrolzadas en las proxmdades del electrodo, lo cual orgna el movmento de esas especes desde zonas más concentradas a zonas menos concentradas. Esta forma de transporte se presenta sempre en todo proceso electroquímco. La conveccón consste en el desplazamento de sustancas bajo la nfluenca de agtacón o cualquer otra forma de transporte hdrodnámco, como dferencas de densdad, de temperatura, choques, vbracones, etc. Todos estos fenómenos se ncluyen bajo la denomnacón de conveccón. Estas tres formas de transporte de matera a un electrodo están recogdas e la ecuacón de Nernst Planck, que para una transferenca de masa undrecconal a lo largo del eje x, es: J x= D δc x δx z F RT D C δφ x δx +C Vx dfusón mgracón conveccón donde, J (x) es el flujo de espece (en mol seg 1 cm 2 ) a una dstanca x de la superfce del electrodo, D es el coefcente de dfusón (cm 2 /seg), δc (x)/dx es el gradente de concentracón a la dstanca x, dφ/dx es el gradente de potencal, z y C son la carga y la concentracón, respectvamente, de la espece, y V(x) la velocdad (cm/seg) con la que un elemento de volumen de la dsolucón se mueve a lo largo del eje x. La resolucón rgurosa de esa ecuacón no es, generalmente, fácl, y los sstemas electroquímcos suelen dseñarse de manera que algunos térmnos sean desprecables. Régmen estaconaro Al comenzo de la electrólss, la dsolucón suele ser homogénea. Al aplcar un potencal, dstnto del de equlbro, se produce una reaccón electroquímca sobre el
19 Introduccón a los Métodos Electro-analítcos 20 electrodo, y, s no hubese transporte de espece electro-actva hasta él, la electrólss cesaría. Como esto no es así, se observa un perodo transtoro durante el cual se produce el ajuste de las concentracones en las proxmdades de los electrodos. La velocdad de transporte de sustancas electrolzadas camba hasta alcanzar un valor constante, e gual a la velocdad de electrólss. Después de ese perodo (que puede ser muy corto) se puede observar régmen estaconaro. En estas condcones puede establecerse la hpótess de que exste una capa de dfusón en la superfce del electrodo, y el espesor de esa capa permanece constante. Las especes electro-actvas son llevadas hasta esa capa por conveccón, y el transporte a través de ella es por dfusón, mentras que la mgracón afecta a la totaldad de la dsolucón, como se muestra en la fgura dfusón conveccón dfusón electrodo mgracón electrodo Fgura Mgracón, dfusón y conveccón. El estado estaconaro mplca una dstrbucón de las concentracones en la célula de electrólss nvarable con el tempo, lo cual supone que el consumo de espece electroactva es nulo. Segudamente se tratan algunos aspectos de nterés relaconados con los fenómenos de transporte anterormente menconados. Mgracón La velocdad de una reaccón electródca y, por consguente, la ntensdad de la corrente que crcula por el crcuto externo está controlada por la cantdad de sustanca electro-actva sobre la superfce del electrodo. En las proxmdades del electrodo, como se muestra en la fgura 7.15., la espece electro-actva es transportada por dfusón y por mgracón, por lo que la corrente total,, será la suma de las componentes dfusva y mgraconal: = d ± m donde m y d pueden tener la msma dreccón u opuesta, dependendo de la dreccón
20 Claudo González Pérez 21 del campo eléctrco y de la carga de las especes electro-actvas, como puede observarse en la fgura Fe e Fe Fe(CN) e Fe + 6 CN m d d Fe 2+ Fe(CN) 6 4 m = d + m = d m Fgura Dreccón de la corrente de mgracón y de dfusón. Se demuestra que, m =± n z A t A donde es la ntensdad de la corrente total, n el número de electrones que ntervene en la reaccón de electrólss del ón A, z A, su carga y t A su número de transporte. Por su parte, t A = A z A C A z C donde es la conductvdad equvalente del ón, z su carga y C su concentracón, representando el subíndce a cualquer ón presente en la dsolucón. En electro-análss, la forma de transporte por mgracón se consdera ndeseable, por lo que para mnmzar su efecto, lo que se hace es dsmnur el número de transporte, t A, operando con una relacón C A /C muy pequeña. Esto se consgue añadendo un exceso (unas 100 veces) de electrolto soporte, consttudo por especes no electro-actvas (normalmente, ntratos, sulfatos o percloratos alcalnos), como se lustra en los ejemplos sguentes: Ejemplo 7.5. Calcular la fraccón de la corrente de mgracón en la electrólss de una dsolucón contenendo Fe(ClO 4 ) M y Fe(ClO 4 ) M. Los ones presentes en la dsolucón son: Fe 3+ (10 3 M), Fe 2+ (10 3 M), ClO 4 (5x10 3 M) En el ánodo se produce la oxdacón del Fe 2+ (Fe 2+ e > Fe 3+ ) y en el cátodo la
21 Introduccón a los Métodos Electro-analítcos 22 reduccón del Fe 3+ (Fe 3+ + e > Fe 2+ ). Suponendo que las conductvdades equvalentes de todos los ones son aproxmadamente guales, los números de transporte del Fe 3+ y del Fe 2+ son: t Fe 3+ = t Fe 2+ = Fe 3+x 3 x 10 3 Fe 3+x 3 x Fe 2+x 2 x ClO4 x 1 x 5 x 10 3 = 3 10 Fe 2+x 2 x 10 3 Fe 3+x 3 x Fe 2+x 2 x ClO4 x 1 x 5 x 10 3 = 2 10 Las ntensdades de mgracón, para una corrente total equvalente a 10 electrones por undad de tempo, son: m Fe 3+ = n z A t A = 1 3 m Fe 2+ = n z A t A = = = 1 Según esto, la fraccón m / = 0.1, lo que sgnfca que el 10 % de la corrente se debe al proceso de mgracón. Ejemplo 7.6. Consderar la msma dsolucón del ejemplo anteror a la que se añade NaClO M como electrolto soporte. Las reaccones electródcas son las msmas que en el ejemplo anteror, y las concentracones de todas las especes en dsolucón son: Fe 3+ =10 3 M, Fe 2+ =10 3 M; ClO 4 = x10 3 = M; Na + =0.1 M Los números de transporte del Fe 3+ y del Fe 2+ son: (se consdera que las conductvdades equvalentes de todos los ones son aproxmadamente guales) t Fe 3+ = Fe 3+x 3 x 10 3 Fe 3+x 3 x Fe 2+x 2 x ClO4 x 1 x Na +x 1 x 0.1 = t Fe 2+ = 2+x Fe 2 x 10 3 = x Fe 3 x x Fe 2 x x ClO4 1 x x Na 1 x 0.1
22 Claudo González Pérez 23 Las ntensdades de mgracón, son: m Fe 3+ = x10 = m Fe 2+ = x10 = La fraccón m / es ahora , con lo que la corrente de mgracón es solo del 0.5 % aproxmadamente. Al operar en presenca de electrolto soporte se mnmza la contrbucón del transporte de sustanca electro-actva por mgracón, con lo que se smplfca el tratamento matemátco de los sstemas electroquímcos, y además, se faclta la conductvdad de la dsolucón al dsmnur la resstenca de la célula electroquímca, Asmsmo, puede colaborar a dsmnur o elmnar algunos efectos debdos a la matrz. Dfusón Consdérese un electrodo de un área determnada sumergdo en una dsolucón, carente de perturbacones térmcas o mecáncas (en reposo), y contenendo una espece electro-actva y sufcente concentracón de electrolto soporte para poder prescndr de la mgracón. Cuando se aplca un potencal adecuado, las especes electro-actvas que están sobre la superfce del electrodo se transforman y, s el potencal aplcado y la velocdad de transferenca de cargas son sufcentemente grandes, la concentracón de las especes electro-actvas sobre la superfce del electrodo se hace cero (fgura 7.17.a.). El gradente de concentracón es pronuncado al prncpo y la capa de dsolucón en la que tene lugar ese gradente es estrecha (capa de dfusón). A medda que transcurre el tempo, se ncrementa el espesor de la capa de dfusón, el gradente de concentracón se hace menos pronuncado y la velocdad de dfusón dsmnuye. En consecuenca, la ntensdad de la corrente dsmnuye con el tempo, como se muestra en la fgura 7.17.b., donde, además se muestran las curvas para dferentes concentracones de sustanca electro-actva y dstntas superfces del electrodo. El hábto de las curvas representadas en la fgura puede explcarse matemátcamente, admtendo que el transporte de matera hasta el electrodo es debdo al fenómeno de la dfusón, como consecuenca del gradente de concentracón establecdo entre la superfce del electrodo y el resto de la dsolucón.
23 Introduccón a los Métodos Electro-analítcos 24 Fgura 7.17.a. Perfles de concentracón para la dfusón en funcón del tempo. b. Varacón de la ntensdad con la concentracón y la superfce. Consderando la dfusón lneal de una sustanca A, en la poscón x y a un tempo t, la prmera ley de Fck establece que el flujo de A es proporconal al gradente de concentracón: J A x,t = D A δ C A x,t δx J A (x,t) representa el número de moles de A que pasan por una determnada poscón por segundo por cm 2 de área normal al eje de dfusón. D A es el coefcente de dfusón de A (cm 2 /seg). El valor de ese flujo es constante para unos determnados parámetros x y t. En otro nstante, o a otra dstanca, el flujo será dferente, puesto que varía el gradente de concentracón. El cambo en la concentracón entre dos seccones planas, como las representadas en la fgura 7.18., es: δ C A x,t δt = J A x,t J A x+dx,t dx dx J A (x,t) J A (x+dx,t) x x + dx Fgura Flujo entre dos seccones planas.
24 Claudo González Pérez 25 El flujo a x+dx puede expresarse por: con lo que, J A x+dx,t = J A x,t + δj A x,t δx δc A x,t δt = δj A x,t δx dx Susttuyendo J A (x,t) de la prmera ley de Fck, se obtene: δc A x,t δt = D A δ 2 C A x,t δx 2 que se conoce como segunda ley de Fck. La expresón general de la segunda ley de Fck para cualquer geometría es: δc A δt =D A δ 2 C A δx 2 + δ 2 C A δy 2 + δ 2 C A δz 2 La ntegracón de la segunda ley de Fck para un electrodo plano y crcular, entre t=0 y t>0, conduce a la expresón: C x,t =C o 2 π 0 z e y 2 dy donde C o es la concentracón de espece electro-actva antes de comenzar la electrolss, y es la varable de ntegracón y z es un número admensonal, x z= 2 D A t Al representar C(x,t)/C o en funcón de x para dstntos tempos de electrólss, se obtene una gráfca análoga a la de la fgura 7.12.a. Por otra parte, según la ley de Faraday, la ntensdad que crcula por el electrodo será funcón del flujo de sustanca en su superfce, es decr, t = n F S J A (0,t) donde n es el número de electrones transferdos, S el área, F el Faraday y J A (0,t) el flujo de sustanca sobre su superfce, es decr,
25 Introduccón a los Métodos Electro-analítcos 26 t =nfsd A δc A 0,t δx El térmno ley de Fck, δc A 0,t δx se obtene dferencando la ecuacón solucón de la segunda con lo que, δc A δx = C o D A t t = nfsc o D A π t que se conoce como ecuacón de Cottrell. De esta ecuacón se deduce que decrece con el tempo, lo cual justfca el hábto de las curvas de la fgura 7.17.b. Teórcamente, la ntensdad de la corrente se anularía para un valor de t nfnto. Esto sgnfca que la concentracón de espece electro-actva sobre la superfce del electrodo dsmnuye lentamente con el tempo hasta hacerse cero. Sn embargo, s la dsolucón está agtándose, la concentracón de sustanca electroactva en la superfce del electrodo alcanza un valor constante en un tempo relatvamente corto, como se muestra en la fgura 7.19.a. En estas condcones, se alcanza un régmen estaconaro, electrolzándose la sustanca a medda que llega al electrodo a través de la capa de dfusón, con un perfl de concentracones como el ndcado en la fgura 7.19.b. Fgura Fenómenos de dfusón y conveccón.
26 Claudo González Pérez 27 Relacón entre las ntensdades y el potencal aplcado Como ya se ha menconado, en régmen estaconaro, exste una capa de dfusón que rodea al electrodo. Las especes electro-actvas se acercan a esa capa por conveccón y el transporte a través de ella es por dfusón. Nernst consdera que dentro de la capa de dfusón el gradente de concentracones es constante y que el espesor, δ solo depende de la agtacón. Según esto, al varar el potencal, δ será el msmo, pero el gradente será dstnto y, en consecuenca, la ntensdad tambén. a) Oxdacón de un reductor. En la fgura 7.20.a. se ha representado la varacón del perfl de concentracones para dstntos potencales aplcados. A potencales nferores a E o, no se produce reaccón electródca y la concentracón en solucón es la msma que sobre la superfce del electrodo. Al aumentar el potencal aplcado, aumenta la velocdad de oxdacón, aumentando la ntensdad de la corrente y dsmnuyendo la concentracón de sustanca electro-actva sobre la superfce del electrodo (fgura 7.20.b.) [Red]el Eo o=0 [Red]s 3 1 E 1 2 E E3 δo x a Eo E1 E2 Fgura Oxdacón de un reductor. a. Perfles de concentracón. b. Curva I E. b E E3 b) Reduccón de un oxdante. El proceso de reduccón de un oxdante se ha representado en la fgura 7.21.
27 Introduccón a los Métodos Electro-analítcos 28 [Ox] el E 3 =0 3 [Ox] s 3 E o E 1 E 2 E 3 E 2 E E 1 1 o E o δ x o a b Fgura Reduccón de un oxdante. a. Perfles de concentracón. b. Curva I E. o c) Proceso global. Cuando los procesos de oxdacón del reductor y de reduccón del oxdante pertenecentes al msmo sstema se producen smultáneamente, a un determnado potencal, las ntensdades correspondentes a las oxdacones y a las reduccones se restarán, orgnando una ntensdad neta total, con lo que la curva ntensdad potencal es la representada en la fgura La máxma corrente en oxdacón se obtene para valores de potencal superores a E 4. En estas condcones, [Red] el =0. Análogamente, la máxma corrente en reduccón se obtene para valores de potencal nferores a E o, donde [Ox] el =0. E o E 1 E 2 E 3 E 4 E Fgura Proceso global. Curva I E.
28 Claudo González Pérez 29 La ntensdad de la corrente es, = ± n F S J A donde el sgno + corresponde, según la convencón adoptada, a oxdacones, y el sgno a reduccones. Según la prmera ley de Fck, y de acuerdo con Nernst, =±nfsd δc δx δc δx = C s C el δ o sendo C s la concentracón de espece electro-actva en la dsolucón y C el sobre el electrodo. Susttuyendo en la ecuacón anteror, se tene, =±nfsd C s C el δ o =±nd C s C el donde d=fsd δ, con lo que, Así, para la reduccón de un oxdante, y para la oxdacón de un reductor, C el = C s ± nd Ox el = Ox sol + Red el =Red sol nd ox nd red Los coefcentes d ox y d red son muy parecdos, debdo a que los coefcentes de dfusón de las especes químcas pertenecentes al msmo sstema redox son, en general, smlares. Por otra parte, δ es la msma y S tambén (msmo electrodo).
29 Introduccón a los Métodos Electro-analítcos 30 Corrente límte de dfusón Este parámetro corresponde al valor más elevado del gradente de concentracón, es decr, a C s _C el δ o = C s δ o (cuando C el =0) En este caso, la ntensdad de la corrente es proporconal a la concentracón de sustanca electro-actva en el seno de la dsolucón, ox = n d ox [Ox] sol red = n d red [Red] sol Estas ecuacones son de gran mportanca en los métodos analítcos cuanttatvos.
30 Claudo González Pérez 31 ECUACIONES DE LAS CURVAS INTENSIDAD POTENCIAL En este apartado, no se pretende hacer una deduccón completa y rgurosa de las ecuacones de las curvas I E en todos los casos posbles. Úncamente se ncdrá en algunos aspectos de nterés desde el punto de vsta práctco. 1. Sstemas rápdos. En este caso, la transferenca de carga se lleva a cabo con una velocdad nfntamente superor a la transferenca de masa, sendo la etapa de dfusón de la sustanca electro-actva el paso determnante de la velocdad global del proceso. En estas condcones, sempre exste equlbro entre el electrodo y la dsolucón en contacto con él, pudéndose aplcar la ecuacón de Nernst. Para el sstema redox, Ox + ne < > Red E=E o n log Ox el Red el =E o n log Ox sol + Red sol nd ox nd red Las concentracones de especes electro-actvas en el seno de la dsolucón están relaconadas con las ntensdades límtes por, por lo que, E=E o n log ox nd ox + red nd red ox = n d ox [Ox] sol red = n d red [Red] sol nd ox nd red o 0.06 = E + n log d red d ox n log ox red que es la ecuacón de la curva ntensdad potencal para un sstema rápdo. Un parámetro mportante es el potencal de sem-onda o de onda meda, que es el valor del potencal al que la ntensdad de la corrente es la semsuma algebraca de red +ox = las ntensdades límtes de oxdacón y de reduccón, 2 con lo que,
31 Introduccón a los Métodos Electro-analítcos 32 E 1/2 =E o n Como d red d ox, E 1/2 E o. red + ox log d red d ox n log 2 ox red = E o red ox n log d red d ox 2 El potencal de sem-onda concde con el punto de nflexón de la curva ntensdad potencal. Es mportante desde el punto de vsta cualtatvo, ya que al no depender de la concentracón, puede utlzarse para la caracterzacón de especes electro-actvas. 2. Caso general Cuando la velocdad de ntercambo de electrones es menor que la velocdad de dfusón, no se establece un equlbro entre el electrodo y la dsolucón. En este caso, no se puede aplcar la ecuacón de Nernst, sendo necesaro un tratamento cnétco, consderando las velocdades de oxdacón y de reduccón. Se obtene la sguente ecuacón general: = αnf red e RT K D E E o + ox e βnf RT K D E E o 1 K o + 1 αnf e RT E E o + 1 e βnf RT K D K D E E o donde K o es la llamada constante de velocdad estándar de ntercambo de electrones. Está relaconada con las constantes de velocdad de los procesos de oxdacón y de reduccón: Ox + n e k 1 Red v 1 = k 1 [Ox] el k 2 v 2 = k 2 [Red] el K D es la constante de velocdad de dfusón (D/δ). α y β son los denomnados coefcentes de transferenca de carga. Su valor es, en muchas ocasones, aproxmadamente, 0.5. Pueden consderarse varos casos: a) Cuando K o >> K D, es decr, cuando la velocdad de la reaccón electroquímca es mucho mayor que la velocdad de dfusón. En este caso, s α=β=0.5, la ecuacón
32 Claudo González Pérez 33 general se transforma en: E = E 1/2 + RT nf ln ox red que es la ecuacón correspondente a un sstema rápdo (fg curvas a). b) Cuando K o K D. Se obtenen curvas ntensdad potencal en las que las ondas de oxdacón y de reduccón presentan unas dferencas en el valor del potencal de sem-onda (fgura 7.23.curvas b). a b onda anódca c E 1/2 E 1/2 E 1/2 E 1/2 E c onda catódca b a o a) K >> K o b) K - K o D c) K << K D D Fgura Curvas I E para dferentes valores de K o y K D. c) Cuando K o << K D. Las ondas de oxdacón y de reduccón se desarrollan ndependentemente una de la otra (fgura curvas c).
33 Introduccón a los Métodos Electro-analítcos 34 DETERMINACION EXPERIMENTAL DE LAS CURVAS INTENSIDAD- POTENCIAL Para la obtencón expermental de las curvas ntensdad potencal es necesaro: unos electrodos, un crcuto eléctrco y una célula o recpente para llevar a cabo el proceso de electrólss. ELECTRODOS Los electrodos pueden clasfcarse según el cuadro sguente: Referenca E.N.H. Calomelanos Ag/AgCl Electrodos Indcadores Metálcos De 1ª espece De 2ª espece De 3ª espece Redox De membrana Un electrodo de referenca es aquél que adquere un valor de potencal constante cualquera que sea la composcón de la dsolucón, mentras que en un electrodo ndcador, el valor del potencal alcanzado proporcona nformacón sobre la concentracón o la naturaleza de las sustancas susceptbles de cambar electrones. Electrodos de referenca Los electrodos de referenca utlzan sstemas electroquímcos rápdos y con unas concentracones elevadas de sustancas electro-actvas. Electrodo normal de hdrógeno. Tene nterés hstórco, s ben en la práctca analítca ordnara no se utlza. Consste en una lámna de platno sobre la que se ha depostado una capa de platno fnamente dvddo ("platno platnado"), el cual consttuye una superfce catalítca sobre la cual el proceso 2H e < > H 2 procede de forma reversble. El electrodo está sumergdo en una dsolucón donde la actvdad de los ones H + es la undad, y por la que se hace burbujear H 2 a la presón de 1 atmósfera (fgura 7.24.). El potencal de equlbro depende de la actvdad del H + y de la presón parcal de
34 Claudo González Pérez 35 H 2, E eq =E o +0.03log a 2 H + ph 2 A E o se le asgna el valor cero, por lo que, como a H +=1 y p H2 =1, E eq tambén es cero. H (1 atm.) 2 puente salno Pt platnado + [H ] = 1 M. Fgura Electrodo normal de hdrógeno. Su prncpal nconvenente resde, fundamentalmente, en lo engorroso de su manejo. Otra desventaja es que su potencal es sensble a la presenca de oxdantes y reductores en la dsolucón, ya que perturba cualquer sustanca que pueda oxdar al H 2 o reducr a los H +. Además, la superfce (catalítca) del platno puede envenenarse por dversas sustancas, tales como As, CN, H 2 S, así como compuestos superfcalmente actvos, como las proteínas. Electrodo de calomelanos. Es de los más usados como electrodo de referenca. Consste el el sstema Hg 2 2+/Hg en presenca de cloruro potásco, como se muestra esquemátcamente en la fgura La sem-reaccón redox es: cuyo potencal se obtene por la expresón: Hg 2 Cl 2 (s) + 2 e < > 2 Hg(l) + 2 Cl o 1 E=E log ; E 0 Cl 2 1 = V.
35 Introduccón a los Métodos Electro-analítcos 36 donde E 1 o depende del potencal normal del sstema Hg 2 2+/Hg y del producto de solubldad del Hg 2 Cl 2.. Hg(l) pasta de Hg 2Cl 2 + Hg + KCl orfco dsolucón de KCl KCl sóldo fbra de asbesto (puente salno) Fgura Electrodo de calomelanos. Según lo expuesto anterormente, el potencal de equlbro del electrodo de calomelanos depende de la concentracón de cloruro (tabla 7.1.). Tabla 7.1. Potencales de los electrodos de calomelanos y de Ag/AgCl frente al E.N.H. CALOMELANOS Ag/AgCl 0.1M 3.5M sat. 3.5 M sat 20 ºC Cuando se utlza una dsolucón saturada de KCl, la denomnacón es electrodo de calomelanos saturado y se abreva frecuentemente por E.C.S. Es el más empleado en electro-análss, sobre todo por la facldad para percbr que la dsolucón de KCl permanece saturada (esto sucede mentras exste KCl sóldo en el fondo del tubo). El mayor nconvenente del E.C.S. es que su potencal camba bastante al hacerlo la temperatura, debdo a la varacón de la solubldad del cloruro potásco. Además, no puede usarse a temperaturas superores a 80 ºC, probablemente debdo a la dsmutacón del ón mercuroso es esas condcones.
36 Claudo González Pérez 37 Tambén puede usarse el sstema sulfato mercuroso/mercuro. Electrodo de plata/cloruro de plata. Se prepara recubrendo con una capa de AgCl, un hlo de plata metálca. El electrodo se ntroduce en una dsolucón de cloruro potásco de concentracón conocda, la cual tambén está saturada de AgCl (fgura 7.26.) La sem-reaccón redox es: AgCl(s)+ e < > Ag + Cl E o = V. Análogamente al electrodo de calomelanos, el potencal de equlbro está regdo por la concentracón de cloruro (tabla 7.1.). Este electrodo se utlza muy frecuentemente como electrodo de referenca nterno en electrodos de vdro para la medda del ph, así como en otros electrodos. Una ventaja es que puede mnaturzarse fáclmente, lo que hace que se utlce muy extensamente en campos tales como aplcacones bomédcas para estudos "n vvo" de fludos bológcos y meddas ntracelulares. Además, el electrodo es sufcentemente estable hasta temperaturas del orden de 270 ºC.. alambre de plata AgCl dsolucón acuosa de KCl y AgCl puente salno KCl(s) + AgCl(s). Fgura Electrodo de plata/cloruro de plata. Electrodos ndcadores La msón de los electrodos ndcadores que se tratarán aquí es úncamente servr
37 Introduccón a los Métodos Electro-analítcos 38 de vehículo para el ntercambo de electrones. Con este fn se utlzan especes conductoras, tales como Pt, Au, grafto, así como Hg ó Ag en medos poco oxdantes. Electrodo de platno. Es de los más comunes. Se utlza platno debdo a que es relatvamente nerte. En la fgura 7.27.a. se muestra el típco electrodo de punta de platno para usarlo como electrodo fjo. En este caso se agta la dsolucón mecáncamente, por ejemplo, medante un agtador magnétco. tubo de vdro. Hg. Pt a b c Fgura Electrodos de platno. Tambén puede utlzarse como electrodo gratoro (fgura 7.27.b.) o vbratoro (fgura 7.27.c.).En el prmer caso, la reproducbldad y la sensbldad son óptmas cuando la velocdad de rotacón es aproxmadamente 600 revolucones por mnuto. El platno en medo oxdante se recubre de óxdo, y en medo muy reductor de una película de hdrógeno. Para elmnar el recubrmento se pueden utlzar medos mecáncos (frotar con un papel esmerlado muy fno), químcos (tratamento oxdante con HNO 3 conc. o reductor con SnCl 2 en HCl 6 M) o electroquímcos (la película de óxdo se redsuelve a potencales nferores a 0.6 V.). En ocasones, se utlza un electrodo recuberto electrolítcamente de PtO 2. En muchos casos en los que el platno reaccona con la solucón electrolítca puede ser susttudo por un electrodo de oro, que es un metal más nerte que aquél.
Montajes para electrolisis
 Montajes para electrolss A e e A V V + + puente salno a b Doble capa lectrodo Solucón C C = q V ( ) (+) a b c Proceso electródco tapas del proceso electródco lectrodo Interfase Dsoluc lectrodo Interfase
Montajes para electrolss A e e A V V + + puente salno a b Doble capa lectrodo Solucón C C = q V ( ) (+) a b c Proceso electródco tapas del proceso electródco lectrodo Interfase Dsoluc lectrodo Interfase
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 5ª RELACIÓN DE PROBLEMAS.
 EPARTAMENTO E QUÍMCA ANALÍTCA Y TECNOLOGÍA E ALMENTOS FUNAMENTOS E ANÁLSS NSTRUMENTAL. 5ª RELACÓN E PROBLEMAS..- Calcular los números de transporte correspondentes a los ones Cl - y H : a) En una dsolucón
EPARTAMENTO E QUÍMCA ANALÍTCA Y TECNOLOGÍA E ALMENTOS FUNAMENTOS E ANÁLSS NSTRUMENTAL. 5ª RELACÓN E PROBLEMAS..- Calcular los números de transporte correspondentes a los ones Cl - y H : a) En una dsolucón
Capitalización y descuento simple
 Undad 2 Captalzacón y descuento smple 2.1. Captalzacón smple o nterés smple 2.1.1. Magntudes dervadas 2.2. Intereses antcpados 2.3. Cálculo de los ntereses smples. Métodos abrevados 2.3.1. Método de los
Undad 2 Captalzacón y descuento smple 2.1. Captalzacón smple o nterés smple 2.1.1. Magntudes dervadas 2.2. Intereses antcpados 2.3. Cálculo de los ntereses smples. Métodos abrevados 2.3.1. Método de los
Unidad I. 1. 1. Definición de reacción de combustión. 1. 2. Clasificación de combustibles
 2 Undad I.. Defncón de reaccón de combustón La reaccón de combustón se basa en la reaccón químca exotérmca de una sustanca (o una mezcla de ellas) denomnada combustble, con el oxígeno. Como consecuenca
2 Undad I.. Defncón de reaccón de combustón La reaccón de combustón se basa en la reaccón químca exotérmca de una sustanca (o una mezcla de ellas) denomnada combustble, con el oxígeno. Como consecuenca
METODOS VOLTAMPEROMETRICOS
 Métodos Voltamperométrcos 2 Tema 9 METODOS VOLTAMPEROMETRICOS Los métodos voltamperométrcos ncluyen un conjunto de métodos electroanalítcos en los que la nformacón sobre el analto se obtene a partr de
Métodos Voltamperométrcos 2 Tema 9 METODOS VOLTAMPEROMETRICOS Los métodos voltamperométrcos ncluyen un conjunto de métodos electroanalítcos en los que la nformacón sobre el analto se obtene a partr de
GUIAS DE ACTIVIDADES Y TRABAJO PRACTICO Nº 22
 DOCENTE: LIC.GUSTO DOLFO JUEZ GUI DE TJO PCTICO Nº 22 CES: POFESODO Y LICENCITU EN IOLOGI PGIN Nº 132 GUIS DE CTIIDDES Y TJO PCTICO Nº 22 OJETIOS: Lograr que el lumno: Interprete la nformacón de un vector.
DOCENTE: LIC.GUSTO DOLFO JUEZ GUI DE TJO PCTICO Nº 22 CES: POFESODO Y LICENCITU EN IOLOGI PGIN Nº 132 GUIS DE CTIIDDES Y TJO PCTICO Nº 22 OJETIOS: Lograr que el lumno: Interprete la nformacón de un vector.
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Undad III: ermodnámca del Equlbro Fugacdad Fugacdad para gases, líqudos y sóldos Datos volumétrcos 9/7/ Rafael Gamero Fugacdad ropedades con varables ndependentes y ln f ' Con la dfncón
ERMODINÁMICA AANZADA Undad III: ermodnámca del Equlbro Fugacdad Fugacdad para gases, líqudos y sóldos Datos volumétrcos 9/7/ Rafael Gamero Fugacdad ropedades con varables ndependentes y ln f ' Con la dfncón
CONCEPTOS GENERALES DEL CAMPO MAGNÉTICO
 CONCEPTOS GENERALES DEL CAMPO MAGNÉTICO 1 ÍNDICE 1. INTRODUCCIÓN 2. EL CAMPO MAGNÉTICO 3. PRODUCCIÓN DE UN CAMPO MAGNÉTICO 4. LEY DE FARADAY 5. PRODUCCIÓN DE UNA FUERZA EN UN CONDUCTOR 6. MOVIMIENTO DE
CONCEPTOS GENERALES DEL CAMPO MAGNÉTICO 1 ÍNDICE 1. INTRODUCCIÓN 2. EL CAMPO MAGNÉTICO 3. PRODUCCIÓN DE UN CAMPO MAGNÉTICO 4. LEY DE FARADAY 5. PRODUCCIÓN DE UNA FUERZA EN UN CONDUCTOR 6. MOVIMIENTO DE
Fisicoquímica CIBEX Guía de Trabajos Prácticos 2010. Trabajo Práctico N 7. - Medida de la Fuerza Electromotriz por el Método de Oposición-
 Fscoquímca CIBX Guía de Trabajos Práctcos 2010 Trabajo Práctco N 7 - Medda de la Fuerza lectromotrz por el Método de Oposcón- Objetvo: Medr la fuerza electromotrz (FM) de la pla medante el método de oposcón
Fscoquímca CIBX Guía de Trabajos Práctcos 2010 Trabajo Práctco N 7 - Medda de la Fuerza lectromotrz por el Método de Oposcón- Objetvo: Medr la fuerza electromotrz (FM) de la pla medante el método de oposcón
PROBLEMAS DE ELECTRÓNICA ANALÓGICA (Diodos)
 PROBLEMAS DE ELECTRÓNCA ANALÓGCA (Dodos) Escuela Poltécnca Superor Profesor. Darío García Rodríguez . En el crcuto de la fgura los dodos son deales, calcular la ntensdad que crcula por la fuente V en funcón
PROBLEMAS DE ELECTRÓNCA ANALÓGCA (Dodos) Escuela Poltécnca Superor Profesor. Darío García Rodríguez . En el crcuto de la fgura los dodos son deales, calcular la ntensdad que crcula por la fuente V en funcón
UNIVERSIDAD DE GUADALAJARA, CUCEI DEPARTAMENTO DE ELECTRÓNICA LABORATORIO DE ELECTRÓNICA II
 UNIVERSIDAD DE GUADALAJARA, CUCEI DEPARTAMENTO DE ELECTRÓNICA LABORATORIO DE ELECTRÓNICA II PRACTICA 11: Crcutos no lneales elementales con el amplfcador operaconal OBJETIVO: El alumno se famlarzará con
UNIVERSIDAD DE GUADALAJARA, CUCEI DEPARTAMENTO DE ELECTRÓNICA LABORATORIO DE ELECTRÓNICA II PRACTICA 11: Crcutos no lneales elementales con el amplfcador operaconal OBJETIVO: El alumno se famlarzará con
TEMA 6 AMPLIFICADORES OPERACIONALES
 Tema 6 Amplfcadores peraconales ev 4 TEMA 6 AMPLIFICADES PEACINALES Profesores: Germán llalba Madrd Mguel A. Zamora Izquerdo Tema 6 Amplfcadores peraconales ev 4 CNTENID Introduccón El amplfcador dferencal
Tema 6 Amplfcadores peraconales ev 4 TEMA 6 AMPLIFICADES PEACINALES Profesores: Germán llalba Madrd Mguel A. Zamora Izquerdo Tema 6 Amplfcadores peraconales ev 4 CNTENID Introduccón El amplfcador dferencal
Tema 1: Estadística Descriptiva Unidimensional Unidad 2: Medidas de Posición, Dispersión y de Forma
 Estadístca Tema 1: Estadístca Descrptva Undmensonal Undad 2: Meddas de Poscón, Dspersón y de Forma Área de Estadístca e Investgacón Operatva Lceso J. Rodríguez-Aragón Septembre 2010 Contendos...............................................................
Estadístca Tema 1: Estadístca Descrptva Undmensonal Undad 2: Meddas de Poscón, Dspersón y de Forma Área de Estadístca e Investgacón Operatva Lceso J. Rodríguez-Aragón Septembre 2010 Contendos...............................................................
FISICOQUÍMICA FARMACÉUTICA (0108) UNIDAD 1. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA
 FISICOQUÍMICA FARMACÉUTICA (008) UNIDAD. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA Mtra. Josefna Vades Trejo 06 de agosto de 0 Revsón de térmnos Cnétca Químca Estuda la rapdez de reaccón, los factores que
FISICOQUÍMICA FARMACÉUTICA (008) UNIDAD. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA Mtra. Josefna Vades Trejo 06 de agosto de 0 Revsón de térmnos Cnétca Químca Estuda la rapdez de reaccón, los factores que
De factores fijos. Mixto. Con interacción Sin interacción. No equilibrado. Jerarquizado
 Análss de la varanza con dos factores. Introduccón Hasta ahora se ha vsto el modelo de análss de la varanza con un factor que es una varable cualtatva cuyas categorías srven para clasfcar las meddas de
Análss de la varanza con dos factores. Introduccón Hasta ahora se ha vsto el modelo de análss de la varanza con un factor que es una varable cualtatva cuyas categorías srven para clasfcar las meddas de
COMPARADOR CON AMPLIFICADOR OPERACIONAL
 COMAADO CON AMLIFICADO OEACIONAL COMAADO INESO, COMAADO NO INESO Tenen como msón comparar una tensón arable con otra, normalmente constante, denomnada tensón de referenca, dándonos a la salda una tensón
COMAADO CON AMLIFICADO OEACIONAL COMAADO INESO, COMAADO NO INESO Tenen como msón comparar una tensón arable con otra, normalmente constante, denomnada tensón de referenca, dándonos a la salda una tensón
EXPERIMENTACIÓN COMERCIAL(I)
 EXPERIMENTACIÓN COMERCIAL(I) En un expermento comercal el nvestgador modfca algún factor (denomnado varable explcatva o ndependente) para observar el efecto de esta modfcacón sobre otro factor (denomnado
EXPERIMENTACIÓN COMERCIAL(I) En un expermento comercal el nvestgador modfca algún factor (denomnado varable explcatva o ndependente) para observar el efecto de esta modfcacón sobre otro factor (denomnado
DELTA MASTER FORMACIÓN UNIVERSITARIA C/ Gral. Ampudia, 16 Teléf.: 91 533 38 42-91 535 19 32 28003 MADRID
 DELTA MATE OMAÓN UNETAA / Gral. Ampuda, 6 8003 MADD EXÁMEN NTODUÓN A LA ELETÓNA UM JUNO 008 El examen consta de ses preguntas. Lea detendamente los enuncados. tene cualquer duda consulte al profesor. Todas
DELTA MATE OMAÓN UNETAA / Gral. Ampuda, 6 8003 MADD EXÁMEN NTODUÓN A LA ELETÓNA UM JUNO 008 El examen consta de ses preguntas. Lea detendamente los enuncados. tene cualquer duda consulte al profesor. Todas
DEFINICIÓN DE INDICADORES
 DEFINICIÓN DE INDICADORES ÍNDICE 1. Notacón básca... 3 2. Indcadores de ntegracón: comerco total de benes... 4 2.1. Grado de apertura... 4 2.2. Grado de conexón... 4 2.3. Grado de conexón total... 5 2.4.
DEFINICIÓN DE INDICADORES ÍNDICE 1. Notacón básca... 3 2. Indcadores de ntegracón: comerco total de benes... 4 2.1. Grado de apertura... 4 2.2. Grado de conexón... 4 2.3. Grado de conexón total... 5 2.4.
EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL
 EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL OBJETIVO El alumno obtendrá el punto azeotrópco para el sstema acetona-cloroformo, calculará los coefcentes de actvdad de cada componente a las composcones
EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL OBJETIVO El alumno obtendrá el punto azeotrópco para el sstema acetona-cloroformo, calculará los coefcentes de actvdad de cada componente a las composcones
Guía de Electrodinámica
 INSTITITO NACIONAL Dpto. de Físca 4 plan electvo Marcel López U. 05 Guía de Electrodnámca Objetvo: - econocer la fuerza eléctrca, campo eléctrco y potencal eléctrco generado por cargas puntuales. - Calculan
INSTITITO NACIONAL Dpto. de Físca 4 plan electvo Marcel López U. 05 Guía de Electrodnámca Objetvo: - econocer la fuerza eléctrca, campo eléctrco y potencal eléctrco generado por cargas puntuales. - Calculan
Trabajo y Energía Cinética
 Trabajo y Energía Cnétca Objetvo General Estudar el teorema de la varacón de la energía. Objetvos Partculares 1. Determnar el trabajo realzado por una fuerza constante sobre un objeto en movmento rectlíneo..
Trabajo y Energía Cnétca Objetvo General Estudar el teorema de la varacón de la energía. Objetvos Partculares 1. Determnar el trabajo realzado por una fuerza constante sobre un objeto en movmento rectlíneo..
Guía de ejercicios #1
 Unversdad Técnca Federco Santa María Departamento de Electrónca Fundamentos de Electrónca Guía de ejerccos # Ejercco Ω v (t) V 3V Ω v0 v 6 3 t[mseg] 6 Suponendo el modelo deal para los dodos, a) Dbuje
Unversdad Técnca Federco Santa María Departamento de Electrónca Fundamentos de Electrónca Guía de ejerccos # Ejercco Ω v (t) V 3V Ω v0 v 6 3 t[mseg] 6 Suponendo el modelo deal para los dodos, a) Dbuje
Equilibrio termodinámico entre fases fluidas
 CAPÍTULO I Equlbro termodnámco entre fases fludas El conocmento frme de los conceptos de la termodnámca se consdera esencal para el dseño, operacón y optmzacón de proyectos en la ngenería químca, debdo
CAPÍTULO I Equlbro termodnámco entre fases fludas El conocmento frme de los conceptos de la termodnámca se consdera esencal para el dseño, operacón y optmzacón de proyectos en la ngenería químca, debdo
CÁLCULO DE INCERTIDUMBRE EN MEDIDAS FÍSICAS: MEDIDA DE UNA MASA
 CÁLCULO DE INCERTIDUMBRE EN MEDIDAS FÍSICAS: MEDIDA DE UNA MASA Alca Maroto, Rcard Boqué, Jord Ru, F. Xaver Rus Departamento de Químca Analítca y Químca Orgánca Unverstat Rovra Vrgl. Pl. Imperal Tàrraco,
CÁLCULO DE INCERTIDUMBRE EN MEDIDAS FÍSICAS: MEDIDA DE UNA MASA Alca Maroto, Rcard Boqué, Jord Ru, F. Xaver Rus Departamento de Químca Analítca y Químca Orgánca Unverstat Rovra Vrgl. Pl. Imperal Tàrraco,
TERMODINÁMICA AVANZADA
 TERMODINÁMICA AVANZADA Undad III: Termodnámca del Equlbro Ecuacones para el coefcente de actvdad Funcones de eceso para mezclas multcomponentes 9/7/0 Rafael Gamero Funcones de eceso en mezclas bnaras Epansón
TERMODINÁMICA AVANZADA Undad III: Termodnámca del Equlbro Ecuacones para el coefcente de actvdad Funcones de eceso para mezclas multcomponentes 9/7/0 Rafael Gamero Funcones de eceso en mezclas bnaras Epansón
PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO
 PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO Concepto de equlbro físco Sstema Fase Componente Solubldad Transferenca Equlbro Composcón 2 Varables de mportanca en el equlbro de fases:
PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO Concepto de equlbro físco Sstema Fase Componente Solubldad Transferenca Equlbro Composcón 2 Varables de mportanca en el equlbro de fases:
TEMA 10. OPERACIONES PASIVAS Y OPERACIONES ACTIVAS.
 GESTIÓN FINANCIERA. TEMA 10. OPERACIONES PASIVAS Y OPERACIONES ACTIVAS. 1.- Funconamento de las cuentas bancaras. FUNCIONAMIENTO DE LAS CUENTAS BANCARIAS. Las cuentas bancaras se dvden en tres partes:
GESTIÓN FINANCIERA. TEMA 10. OPERACIONES PASIVAS Y OPERACIONES ACTIVAS. 1.- Funconamento de las cuentas bancaras. FUNCIONAMIENTO DE LAS CUENTAS BANCARIAS. Las cuentas bancaras se dvden en tres partes:
RESISTENCIAS EN SERIE Y LEY DE LAS MALLAS V 1 V 2 V 3 A B C
 RESISTENCIS EN SERIE Y LEY DE LS MLLS V V 2 V 3 C D Fgura R R 2 R 3 Nomenclatura: Suponemos que el potencal en es mayor que el potencal en, por lo tanto la ntensdad de la corrente se mueve haca la derecha.
RESISTENCIS EN SERIE Y LEY DE LS MLLS V V 2 V 3 C D Fgura R R 2 R 3 Nomenclatura: Suponemos que el potencal en es mayor que el potencal en, por lo tanto la ntensdad de la corrente se mueve haca la derecha.
OPERACIONES ARMONIZACION DE CRITERIOS EN CALCULO DE PRECIOS Y RENDIMIENTOS
 P L V S V LT R A BANCO DE ESPAÑA OPERACIONES Gestón de la Informacón ARMONIZACION DE CRITERIOS EN CALCULO DE PRECIOS Y RENDIMIENTOS El proceso de ntegracón fnancera dervado de la Unón Monetara exge la
P L V S V LT R A BANCO DE ESPAÑA OPERACIONES Gestón de la Informacón ARMONIZACION DE CRITERIOS EN CALCULO DE PRECIOS Y RENDIMIENTOS El proceso de ntegracón fnancera dervado de la Unón Monetara exge la
Circuito Monoestable
 NGENEÍA ELETÓNA ELETONA (A-0 00 rcuto Monoestable rcuto Monoestable ng. María sabel Schaon, ng. aúl Lsandro Martín Este crcuto se caracterza por presentar un únco estado estable en régmen permanente, y
NGENEÍA ELETÓNA ELETONA (A-0 00 rcuto Monoestable rcuto Monoestable ng. María sabel Schaon, ng. aúl Lsandro Martín Este crcuto se caracterza por presentar un únco estado estable en régmen permanente, y
Comparación entre distintos Criterios de decisión (VAN, TIR y PRI) Por: Pablo Lledó
 Comparacón entre dstntos Crteros de decsón (, TIR y PRI) Por: Pablo Lledó Master of Scence en Evaluacón de Proyectos (Unversty of York) Project Management Professonal (PMP certfed by the PMI) Profesor
Comparacón entre dstntos Crteros de decsón (, TIR y PRI) Por: Pablo Lledó Master of Scence en Evaluacón de Proyectos (Unversty of York) Project Management Professonal (PMP certfed by the PMI) Profesor
ACTIVIDADES INICIALES
 Soluconaro 7 Números complejos ACTIVIDADES INICIALES 7.I. Clasfca los sguentes números, dcendo a cuál de los conjuntos numércos pertenece (entendendo como tal el menor conjunto). a) 0 b) 6 c) d) e) 0 f)
Soluconaro 7 Números complejos ACTIVIDADES INICIALES 7.I. Clasfca los sguentes números, dcendo a cuál de los conjuntos numércos pertenece (entendendo como tal el menor conjunto). a) 0 b) 6 c) d) e) 0 f)
Análisis de Regresión y Correlación
 1 Análss de Regresón y Correlacón El análss de regresón consste en emplear métodos que permtan determnar la mejor relacón funconal entre dos o más varables concomtantes (o relaconadas). El análss de correlacón
1 Análss de Regresón y Correlacón El análss de regresón consste en emplear métodos que permtan determnar la mejor relacón funconal entre dos o más varables concomtantes (o relaconadas). El análss de correlacón
PRÁCTICA 4. INDUCCIÓN ELECTROMAGNÉTICA. A. Observación de la fuerza electromotriz inducida por la variación de flujo magnético
 A. Observacón de la fuerza electromotrz nducda por la varacón de flujo magnétco Objetvo: Observacón de la presenca de fuerza electromotrz en un crcuto que sufre varacones del flujo magnétco y su relacón
A. Observacón de la fuerza electromotrz nducda por la varacón de flujo magnétco Objetvo: Observacón de la presenca de fuerza electromotrz en un crcuto que sufre varacones del flujo magnétco y su relacón
Relaciones entre variables
 Relacones entre varables Las técncas de regresón permten hacer predccones sobre los valores de certa varable Y (dependente), a partr de los de otra (ndependente), entre las que se ntuye que exste una relacón.
Relacones entre varables Las técncas de regresón permten hacer predccones sobre los valores de certa varable Y (dependente), a partr de los de otra (ndependente), entre las que se ntuye que exste una relacón.
12-16 de Noviembre de 2012. Francisco Javier Burgos Fernández
 MEMORIA DE LA ESTANCIA CON EL GRUPO DE VISIÓN Y COLOR DEL INSTITUTO UNIVERSITARIO DE FÍSICA APLICADA A LAS CIENCIAS TECNOLÓGICAS. UNIVERSIDAD DE ALICANTE. 1-16 de Novembre de 01 Francsco Javer Burgos Fernández
MEMORIA DE LA ESTANCIA CON EL GRUPO DE VISIÓN Y COLOR DEL INSTITUTO UNIVERSITARIO DE FÍSICA APLICADA A LAS CIENCIAS TECNOLÓGICAS. UNIVERSIDAD DE ALICANTE. 1-16 de Novembre de 01 Francsco Javer Burgos Fernández
Histogramas: Es un diagrama de barras pero los datos son siempre cuantitativos agrupados en clases o intervalos.
 ESTADÍSTICA I. Recuerda: Poblacón: Es el conjunto de todos los elementos que cumplen una determnada propedad, que llamamos carácter estadístco. Los elementos de la poblacón se llaman ndvduos. Muestra:
ESTADÍSTICA I. Recuerda: Poblacón: Es el conjunto de todos los elementos que cumplen una determnada propedad, que llamamos carácter estadístco. Los elementos de la poblacón se llaman ndvduos. Muestra:
Determinación de Puntos de Rocío y de Burbuja Parte 1
 Determnacón de Puntos de Rocío y de Burbuja Parte 1 Ing. Federco G. Salazar ( 1 ) RESUMEN El cálculo de las condcones de equlbro de fases líqudo vapor en mezclas multcomponentes es un tema de nterés general
Determnacón de Puntos de Rocío y de Burbuja Parte 1 Ing. Federco G. Salazar ( 1 ) RESUMEN El cálculo de las condcones de equlbro de fases líqudo vapor en mezclas multcomponentes es un tema de nterés general
2.2 TASA INTERNA DE RETORNO (TIR). Flujo de Caja Netos en el Tiempo
 Evaluacón Económca de Proyectos de Inversón 1 ANTECEDENTES GENERALES. La evaluacón se podría defnr, smplemente, como el proceso en el cual se determna el mérto, valor o sgnfcanca de un proyecto. Este proceso
Evaluacón Económca de Proyectos de Inversón 1 ANTECEDENTES GENERALES. La evaluacón se podría defnr, smplemente, como el proceso en el cual se determna el mérto, valor o sgnfcanca de un proyecto. Este proceso
Clase 25. Macroeconomía, Sexta Parte
 Introduccón a la Facultad de Cs. Físcas y Matemátcas - Unversdad de Chle Clase 25. Macroeconomía, Sexta Parte 12 de Juno, 2008 Garca Se recomenda complementar la clase con una lectura cudadosa de los capítulos
Introduccón a la Facultad de Cs. Físcas y Matemátcas - Unversdad de Chle Clase 25. Macroeconomía, Sexta Parte 12 de Juno, 2008 Garca Se recomenda complementar la clase con una lectura cudadosa de los capítulos
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
MÉTODO DE LAS VELOCIDADES INICIALES
 MÉTODO DE LAS VELOCIDADES INICIALES OBJETIVO El alumno determnará los órdenes de reaccón respecto al yodo, la acetona y los ones hdrógeno de la reaccón de yodo con acetona, así como la constante de velocdad
MÉTODO DE LAS VELOCIDADES INICIALES OBJETIVO El alumno determnará los órdenes de reaccón respecto al yodo, la acetona y los ones hdrógeno de la reaccón de yodo con acetona, así como la constante de velocdad
CÁLCULO VECTORIAL 1.- MAGNITUDES ESCALARES Y VECTORIALES. 2.- VECTORES. pág. 1
 CÁLCL ECTRIAL 1. Magntudes escalares y vectorales.. ectores. Componentes vectorales. ectores untaros. Componentes escalares. Módulo de un vector. Cosenos drectores. 3. peracones con vectores. 3.1. Suma.
CÁLCL ECTRIAL 1. Magntudes escalares y vectorales.. ectores. Componentes vectorales. ectores untaros. Componentes escalares. Módulo de un vector. Cosenos drectores. 3. peracones con vectores. 3.1. Suma.
Universidad Simón Bolívar Conversión de Energía Eléctrica - Prof. José Manuel Aller
 Unversdad Smón Bolívar Conversón de Energía Eléctrca Prof José anuel Aller 41 Defncones báscas En este capítulo se estuda el comportamento de los crcutos acoplados magnétcamente, fjos en el espaco El medo
Unversdad Smón Bolívar Conversón de Energía Eléctrca Prof José anuel Aller 41 Defncones báscas En este capítulo se estuda el comportamento de los crcutos acoplados magnétcamente, fjos en el espaco El medo
FUNDAMENTOS QUIMICOS DE LA INGENIERIA
 FUNDAMENTOS QUIMICOS DE LA INGENIERIA (BLOQUE DE INGENIERIA QUIMICA) GUION DE PRACTICAS DE LABORATORIO ANTONIO DURÁN SEGOVIA JOSÉ MARÍA MONTEAGUDO MARTÍNEZ INDICE PRACTICA PAGINA BALANCE MACROSCÓPICO DE
FUNDAMENTOS QUIMICOS DE LA INGENIERIA (BLOQUE DE INGENIERIA QUIMICA) GUION DE PRACTICAS DE LABORATORIO ANTONIO DURÁN SEGOVIA JOSÉ MARÍA MONTEAGUDO MARTÍNEZ INDICE PRACTICA PAGINA BALANCE MACROSCÓPICO DE
ELECTROQUÍMICA. 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday.
 ELECTROQUÍMICA 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday. Química 2º bachillerato Electroquímica 1 0. CONOCIMIENTOS
ELECTROQUÍMICA 1. Procesos electroquímicos (pila). 2. Potenciales normales de electrodo. 3. Ecuación de Nernst. 4. Electrolisis. 5. Leyes de Faraday. Química 2º bachillerato Electroquímica 1 0. CONOCIMIENTOS
Cu +2 + Zn Cu + Zn +2
 Termodnámc. Tem 16 Sstems electroquímcos 1. Defncones Electrodo. Metl en contcto con un electrolto (Sstem físco donde se produce un semreccón redox) Un sstem electródco está consttudo por un conductor
Termodnámc. Tem 16 Sstems electroquímcos 1. Defncones Electrodo. Metl en contcto con un electrolto (Sstem físco donde se produce un semreccón redox) Un sstem electródco está consttudo por un conductor
16/07/2012 P= F A. Pascals. Bar
 El Estado Gaseoso El Estado Gaseoso Undad I Característcas de los Gases Las moléculas ndvduales se encuentran relatvamente separadas. Se expanden para llenar sus recpentes. Son altamente compresbles. enen
El Estado Gaseoso El Estado Gaseoso Undad I Característcas de los Gases Las moléculas ndvduales se encuentran relatvamente separadas. Se expanden para llenar sus recpentes. Son altamente compresbles. enen
Tema 3. Estadísticos univariados: tendencia central, variabilidad, asimetría y curtosis
 Tema. Estadístcos unvarados: tendenca central, varabldad, asmetría y curtoss 1. MEDIDA DE TEDECIA CETRAL La meda artmétca La medana La moda Comparacón entre las meddas de tendenca central. MEDIDA DE VARIACIÓ
Tema. Estadístcos unvarados: tendenca central, varabldad, asmetría y curtoss 1. MEDIDA DE TEDECIA CETRAL La meda artmétca La medana La moda Comparacón entre las meddas de tendenca central. MEDIDA DE VARIACIÓ
Unidad II: Análisis de la combustión completa e incompleta. 2. 1. Aire
 4 Undad II: Análss de la combustón completa e ncompleta. 1. Are El are que se usa en las reaccones de combustón es el are atmosférco. Ya se djo en la Undad I que, debdo a que n el N n los gases nertes
4 Undad II: Análss de la combustón completa e ncompleta. 1. Are El are que se usa en las reaccones de combustón es el are atmosférco. Ya se djo en la Undad I que, debdo a que n el N n los gases nertes
IES Menéndez Tolosa (La Línea) Física y Química - 1º Bach - Gráficas
 IES Menéndez Tolosa (La Línea) Físca y Químca - 1º Bach - Gráfcas 1 Indca qué tpo de relacón exste entre las magntudes representadas en la sguente gráfca: La gráfca es una línea recta que no pasa por el
IES Menéndez Tolosa (La Línea) Físca y Químca - 1º Bach - Gráfcas 1 Indca qué tpo de relacón exste entre las magntudes representadas en la sguente gráfca: La gráfca es una línea recta que no pasa por el
FISICOQUÍMICA DE SISTEMAS AMBIENTALES UNIDADES TEMÁTICAS
 FSCOQUÍMCA DE SSTEMAS HORAS DE TEORÍA 5 ASGNATURA AMBENTALES HORAS DE PRÁCTCA 4 SEMESTRE 4 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ LOS CONCEPTOS FSCOQUÍMCOS FUNDAMENTALES RELACONADOS CON EL ESTUDO DE
FSCOQUÍMCA DE SSTEMAS HORAS DE TEORÍA 5 ASGNATURA AMBENTALES HORAS DE PRÁCTCA 4 SEMESTRE 4 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ LOS CONCEPTOS FSCOQUÍMCOS FUNDAMENTALES RELACONADOS CON EL ESTUDO DE
Fugacidad. Mezcla de gases ideales
 Termodnámca del equlbro Fugacdad. Mezcla de gases deales rofesor: Alí Gabrel Lara 1. Fugacdad 1.1. Fugacdad para gases Antes de abarcar el caso de mezclas de gases, debemos conocer como podemos relaconar
Termodnámca del equlbro Fugacdad. Mezcla de gases deales rofesor: Alí Gabrel Lara 1. Fugacdad 1.1. Fugacdad para gases Antes de abarcar el caso de mezclas de gases, debemos conocer como podemos relaconar
MECÁNICA CLÁSICA MAESTRÍA EN CIENCIAS (FÍSICA) Curso de Primer Semestre - Otoño 2014. Omar De la Peña-Seaman. Instituto de Física (IFUAP)
 MECÁNICA CLÁSICA MAESTRÍA EN CIENCIAS (FÍSICA) Curso de Prmer Semestre - Otoño 2014 Omar De la Peña-Seaman Insttuto de Físca (IFUAP) Benemérta Unversdad Autónoma de Puebla (BUAP) 1 / Omar De la Peña-Seaman
MECÁNICA CLÁSICA MAESTRÍA EN CIENCIAS (FÍSICA) Curso de Prmer Semestre - Otoño 2014 Omar De la Peña-Seaman Insttuto de Físca (IFUAP) Benemérta Unversdad Autónoma de Puebla (BUAP) 1 / Omar De la Peña-Seaman
CANTIDADES VECTORIALES: VECTORES
 INSTITUION EDUTIV L PRESENTION NOMRE LUMN: RE : MTEMÁTIS SIGNTUR: GEOMETRÍ DOENTE: JOSÉ IGNIO DE JESÚS FRNO RESTREPO TIPO DE GUI: ONEPTUL - EJERITION PERIODO GRDO FEH DURION 3 11 JUNIO 3 DE 2012 7 UNIDDES
INSTITUION EDUTIV L PRESENTION NOMRE LUMN: RE : MTEMÁTIS SIGNTUR: GEOMETRÍ DOENTE: JOSÉ IGNIO DE JESÚS FRNO RESTREPO TIPO DE GUI: ONEPTUL - EJERITION PERIODO GRDO FEH DURION 3 11 JUNIO 3 DE 2012 7 UNIDDES
Tallerine: Energías Renovables. Fundamento teórico
 Tallerne: Energías Renovables Fundamento teórco Tallerne Energías Renovables 2 Índce 1. Introduccón 3 2. Conceptos Báscos 3 2.1. Intensdad de corrente................................. 3 2.2. Voltaje..........................................
Tallerne: Energías Renovables Fundamento teórco Tallerne Energías Renovables 2 Índce 1. Introduccón 3 2. Conceptos Báscos 3 2.1. Intensdad de corrente................................. 3 2.2. Voltaje..........................................
EL AMPLIFICADOR OPERACIONAL.
 Tema 6. El mplfcador peraconal. Tema 6 EL MPLIFICD PECINL.. Introduccón... Símbolos y termnales del amplfcador operaconal... El amplfcador operaconal como amplfcador de tensón..3. Conceptos báscos de realmentacón..4.
Tema 6. El mplfcador peraconal. Tema 6 EL MPLIFICD PECINL.. Introduccón... Símbolos y termnales del amplfcador operaconal... El amplfcador operaconal como amplfcador de tensón..3. Conceptos báscos de realmentacón..4.
CAPÍTULO 5 REGRESIÓN CON VARIABLES CUALITATIVAS
 CAPÍTULO 5 REGRESIÓN CON VARIABLES CUALITATIVAS Edgar Acuña Fernández Departamento de Matemátcas Unversdad de Puerto Rco Recnto Unverstaro de Mayagüez Edgar Acuña Analss de Regreson Regresón con varables
CAPÍTULO 5 REGRESIÓN CON VARIABLES CUALITATIVAS Edgar Acuña Fernández Departamento de Matemátcas Unversdad de Puerto Rco Recnto Unverstaro de Mayagüez Edgar Acuña Analss de Regreson Regresón con varables
APLICACIONES DE LOS SISTEMAS LINEALES 1. MODELACION DE POLINOMIOS CONOCIENDO UN NUMERO DETERMINADO DE PUNTOS DEL PLANO.
 APLICACIONES DE LOS SISTEMAS LINEALES 1. MODELACION DE POLINOMIOS CONOCIENDO UN NUMERO DETERMINADO DE PUNTOS DEL PLANO. Dado un numero n de puntos del plano ( a, b ) es posble encontrar una funcón polnómca
APLICACIONES DE LOS SISTEMAS LINEALES 1. MODELACION DE POLINOMIOS CONOCIENDO UN NUMERO DETERMINADO DE PUNTOS DEL PLANO. Dado un numero n de puntos del plano ( a, b ) es posble encontrar una funcón polnómca
Leyes de tensión y de corriente
 hay6611x_ch03.qxd 1/4/07 5:07 PM Page 35 CAPÍTULO 3 Leyes de tensón y de corrente CONCEPTOS CLAVE INTRODUCCIÓN En el capítulo 2 se presentaron la resstenca así como varos tpos de fuentes. Después de defnr
hay6611x_ch03.qxd 1/4/07 5:07 PM Page 35 CAPÍTULO 3 Leyes de tensón y de corrente CONCEPTOS CLAVE INTRODUCCIÓN En el capítulo 2 se presentaron la resstenca así como varos tpos de fuentes. Después de defnr
1. GENERALIDADES DEL ÁLGEBRA GEOMÉTRICA. Definición del álgebra geométrica del espacio-tiempo
 EL ÁLGEBRA GEOMÉTRICA DEL ESPACIO Y TIEMPO. GENERALIDADES DEL ÁLGEBRA GEOMÉTRICA Defncón del álgebra geométrca del espaco-tempo Defno el álgebra geométrca del espaco y tempo como el álgebra de las matrces
EL ÁLGEBRA GEOMÉTRICA DEL ESPACIO Y TIEMPO. GENERALIDADES DEL ÁLGEBRA GEOMÉTRICA Defncón del álgebra geométrca del espaco-tempo Defno el álgebra geométrca del espaco y tempo como el álgebra de las matrces
TEMA 8: PRÉSTAMOS ÍNDICE
 TEM 8: PRÉSTMOS ÍNDICE 1. CONCEPTO DE PRÉSTMO: SISTEMS DE MORTIZCIÓN DE PRÉSTMOS... 1 2. NOMENCLTUR PR PRÉSTMOS DE MORTIZCIÓN FRCCIOND... 3 3. CUDRO DE MORTIZCIÓN GENERL... 3 4. MORTIZCIÓN DE PRÉSTMO MEDINTE
TEM 8: PRÉSTMOS ÍNDICE 1. CONCEPTO DE PRÉSTMO: SISTEMS DE MORTIZCIÓN DE PRÉSTMOS... 1 2. NOMENCLTUR PR PRÉSTMOS DE MORTIZCIÓN FRCCIOND... 3 3. CUDRO DE MORTIZCIÓN GENERL... 3 4. MORTIZCIÓN DE PRÉSTMO MEDINTE
ELEMENTOS DE ELECTRICIDAD BASICA
 MODULO 1 ELEMENTOS DE ELECTRICIDAD BASICA A contnuacón se resumen algunos elementos de Electrcdad Básca que se supone son conocdos por los estudantes al ngresar a la Unversdad DESCUBRIMIENTO DE LA ELECTRICIDAD:
MODULO 1 ELEMENTOS DE ELECTRICIDAD BASICA A contnuacón se resumen algunos elementos de Electrcdad Básca que se supone son conocdos por los estudantes al ngresar a la Unversdad DESCUBRIMIENTO DE LA ELECTRICIDAD:
Tema 1. Conceptos Básicos de la Teoría de Circuitos
 Tema. Conceptos Báscos de la Teoría de Crcutos. Introduccón. Sstema de undades.3 Carga y corrente.4 Tensón.5 Potenca y energía.6 Ley de Ohm.7 Fuentes ndependentes.8 Leyes de Krchhoff.9 Dsores de tensón
Tema. Conceptos Báscos de la Teoría de Crcutos. Introduccón. Sstema de undades.3 Carga y corrente.4 Tensón.5 Potenca y energía.6 Ley de Ohm.7 Fuentes ndependentes.8 Leyes de Krchhoff.9 Dsores de tensón
Respuesta A.C. del FET 1/14
 espuesta A.C. del FET 1/14 1. Introduccón Una ez que se ubca al transstor dentro de la zona saturada o de corrente de salda constante, se puede utlzar como amplfcador de señales. En base a un FET canal
espuesta A.C. del FET 1/14 1. Introduccón Una ez que se ubca al transstor dentro de la zona saturada o de corrente de salda constante, se puede utlzar como amplfcador de señales. En base a un FET canal
ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 (6a)
 ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 Rcardo Ramírez Facultad de Físca, Pontfca Unversdad Católca, Chle 1er. Semestre 2008 Corrente eléctrca CORRIENTE ELECTRICA Corrente eléctrca mplca carga en movmento.
ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 Rcardo Ramírez Facultad de Físca, Pontfca Unversdad Católca, Chle 1er. Semestre 2008 Corrente eléctrca CORRIENTE ELECTRICA Corrente eléctrca mplca carga en movmento.
AMPLIFICADORES CON BJT.
 Tema 5 MPLIFICDORES CON BJT..- Introduccón...- Prncpo de Superposcón...- Nomenclatura..3.- Recta de Carga Estátca..4.- Recta de Carga Dnámca..- Modelo de pequeña señal del BJT...- El cuadrpolo y el modelo
Tema 5 MPLIFICDORES CON BJT..- Introduccón...- Prncpo de Superposcón...- Nomenclatura..3.- Recta de Carga Estátca..4.- Recta de Carga Dnámca..- Modelo de pequeña señal del BJT...- El cuadrpolo y el modelo
FENÓMENOS DE TRASPORTE EN METALURGIA EXTRACTIVA Clase 01/05 Transporte de Masa
 FENÓMENOS DE TRSPORTE EN METLURGI EXTRCTIV Clase 01/05 Transporte de Masa Prof. Leandro Vosn, MSc., Dr. cadémco Unversdad de Chle. Jefe del Laboratoro de Prometalurga. Investgador Senor - Tohoku Unversty,
FENÓMENOS DE TRSPORTE EN METLURGI EXTRCTIV Clase 01/05 Transporte de Masa Prof. Leandro Vosn, MSc., Dr. cadémco Unversdad de Chle. Jefe del Laboratoro de Prometalurga. Investgador Senor - Tohoku Unversty,
REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016
 REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016 1- Se lleva a cabo la electrolisis de una disolución acuosa de bromuro de sodio 1 M, haciendo pasar una corriente de 1,5 A durante 90 minutos. a) Ajuste
REACCIONES DE TRANSFERENCIA DE ELECTRONES MODELO 2016 1- Se lleva a cabo la electrolisis de una disolución acuosa de bromuro de sodio 1 M, haciendo pasar una corriente de 1,5 A durante 90 minutos. a) Ajuste
1. Introducción 2. El mercado de bienes y la relación IS 3. Los mercados financieros y la relación LM 4. El modelo IS-LM
 Tema 4 Los mercados de benes y fnanceros: el modelo IS-LM Estructura del Tema 1. Introduccón 2. El mercado de benes y la relacón IS 3. Los mercados fnanceros y la relacón LM 4. El modelo IS-LM 4.1 La polítca
Tema 4 Los mercados de benes y fnanceros: el modelo IS-LM Estructura del Tema 1. Introduccón 2. El mercado de benes y la relacón IS 3. Los mercados fnanceros y la relacón LM 4. El modelo IS-LM 4.1 La polítca
Física I Apuntes de Clase 2, Turno D Prof. Pedro Mendoza Zélis
 Físca I Apuntes de Clase 2, 2018 Turno D Prof. Pedro Mendoza Zéls Isaac Newton 1643-1727 y y 1 y 2 j O Desplazamento Magntudes cnemátcas: v m r Velocdad meda r r 1 r 2 r velocdad s x1 2 r1 x1 + r2 x2 +
Físca I Apuntes de Clase 2, 2018 Turno D Prof. Pedro Mendoza Zéls Isaac Newton 1643-1727 y y 1 y 2 j O Desplazamento Magntudes cnemátcas: v m r Velocdad meda r r 1 r 2 r velocdad s x1 2 r1 x1 + r2 x2 +
Física I. TRABAJO y ENERGÍA MECÁNICA. Apuntes complementarios al libro de texto. Autor : Dr. Jorge O. Ratto
 ísca I Apuntes complementaros al lbro de teto TRABAJO y ENERGÍA MECÁNICA Autor : Dr. Jorge O. Ratto Estudaremos el trabajo mecánco de la sguente manera : undmensonal constante Tpo de movmento varable bdmensonal
ísca I Apuntes complementaros al lbro de teto TRABAJO y ENERGÍA MECÁNICA Autor : Dr. Jorge O. Ratto Estudaremos el trabajo mecánco de la sguente manera : undmensonal constante Tpo de movmento varable bdmensonal
Créditos Y Sistemas de Amortización: Diferencias, Similitudes e Implicancias
 Crédtos Y Sstemas de Amortzacón: Dferencas, Smltudes e Implcancas Introduccón Cuando los ngresos de un agente económco superan su gasto de consumo, surge el concepto de ahorro, esto es, la parte del ngreso
Crédtos Y Sstemas de Amortzacón: Dferencas, Smltudes e Implcancas Introduccón Cuando los ngresos de un agente económco superan su gasto de consumo, surge el concepto de ahorro, esto es, la parte del ngreso
v i CIRCUITOS ELÉCTRICOS (apuntes para el curso de Electrónica)
 IUITOS EÉTIOS (apuntes para el curso de Electrónca) os crcutos eléctrcos están compuestos por: fuentes de energía: generadores de tensón y generadores de corrente y elementos pasos: resstores, nductores
IUITOS EÉTIOS (apuntes para el curso de Electrónca) os crcutos eléctrcos están compuestos por: fuentes de energía: generadores de tensón y generadores de corrente y elementos pasos: resstores, nductores
Tema 3. Trabajo, energía y conservación de la energía
 Físca I. Curso 2010/11 Departamento de Físca Aplcada. ETSII de Béjar. Unversdad de Salamanca Profs. Alejandro Medna Domínguez y Jesús Ovejero Sánchez Tema 3. Trabajo, energía y conservacón de la energía
Físca I. Curso 2010/11 Departamento de Físca Aplcada. ETSII de Béjar. Unversdad de Salamanca Profs. Alejandro Medna Domínguez y Jesús Ovejero Sánchez Tema 3. Trabajo, energía y conservacón de la energía
www.fisicaeingenieria.es
 2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA. 2.1.- Experencas de Joule. Las experencas de Joule, conssteron en colocar una determnada cantdad de agua en un calorímetro y realzar un trabajo, medante paletas
2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA. 2.1.- Experencas de Joule. Las experencas de Joule, conssteron en colocar una determnada cantdad de agua en un calorímetro y realzar un trabajo, medante paletas
Calorimetría - Soluciones. 1.- Cuántas calorías ceden 5 kg de cobre (c = 0,094 cal/g C) al enfriarse desde 36 o C hasta -4 C?
 Calormetría - Solucones 1.- Cuántas calorías ceden 5 kg de cobre () al enfrarse desde 3 o C hasta -4 C? m = 5 kg = 5.000 g T = 3 C T f = - 4 C = - T = - (T f T ) = - 5.000 g 0,094 cal/g C (-4 C 3 C) =
Calormetría - Solucones 1.- Cuántas calorías ceden 5 kg de cobre () al enfrarse desde 3 o C hasta -4 C? m = 5 kg = 5.000 g T = 3 C T f = - 4 C = - T = - (T f T ) = - 5.000 g 0,094 cal/g C (-4 C 3 C) =
Unidad Central del Valle del Cauca Facultad de Ciencias Administrativas, Económicas y Contables Programa de Contaduría Pública
 Undad Central del Valle del Cauca Facultad de Cencas Admnstratvas, Económcas y Contables Programa de Contaduría Públca Curso de Matemátcas Fnanceras Profesor: Javer Hernando Ossa Ossa Ejerccos resueltos
Undad Central del Valle del Cauca Facultad de Cencas Admnstratvas, Económcas y Contables Programa de Contaduría Públca Curso de Matemátcas Fnanceras Profesor: Javer Hernando Ossa Ossa Ejerccos resueltos
2.5 Especialidades en la facturación eléctrica
 2.5 Especaldades en la facturacón eléctrca Es necesaro destacar a contnuacón algunos aspectos peculares de la facturacón eléctrca según Tarfas, que tendrán su mportanca a la hora de establecer los crteros
2.5 Especaldades en la facturacón eléctrca Es necesaro destacar a contnuacón algunos aspectos peculares de la facturacón eléctrca según Tarfas, que tendrán su mportanca a la hora de establecer los crteros
Smoothed Particle Hydrodynamics Animación Avanzada
 Smoothed Partcle Hydrodynamcs Anmacón Avanzada Iván Alduán Íñguez 03 de Abrl de 2014 Índce Métodos sn malla Smoothed partcle hydrodynamcs Aplcacón del método en fludos Búsqueda de vecnos Métodos sn malla
Smoothed Partcle Hydrodynamcs Anmacón Avanzada Iván Alduán Íñguez 03 de Abrl de 2014 Índce Métodos sn malla Smoothed partcle hydrodynamcs Aplcacón del método en fludos Búsqueda de vecnos Métodos sn malla
Marcos Gutiérrez-Dávila marcosgd@ugr.es
 Marcos Gutérrez-Dávla marcosgd@ugr.es Introduccón: Relacón de la bomecánca con el deporte de competcón El gesto deportvo consttuye un patrón de movmento estable que se caracterza por el alto grado de efcenca
Marcos Gutérrez-Dávla marcosgd@ugr.es Introduccón: Relacón de la bomecánca con el deporte de competcón El gesto deportvo consttuye un patrón de movmento estable que se caracterza por el alto grado de efcenca
INSTITUTO POLITÉCNICO NACIONAL ESCUELA NACIONAL DE CIENCIAS BIOLÓGICAS INGENIERÍA EN SISTEMAS AMBIENTALES
 ASGNATURA FSCOQUÍMCA DE SSS HORAS DE TEORÍA 5 AMBENTALES HORAS DE PRÁCTCA 4 SEMESTRE 4 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ LOS CONCEPTOS FSCOQUÍMCOS FUNDAMENTALES RELACONADOS CON EL ESTUDO DE SSS
ASGNATURA FSCOQUÍMCA DE SSS HORAS DE TEORÍA 5 AMBENTALES HORAS DE PRÁCTCA 4 SEMESTRE 4 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ LOS CONCEPTOS FSCOQUÍMCOS FUNDAMENTALES RELACONADOS CON EL ESTUDO DE SSS
Balances de Energía. Balance general de energía. Acumulación Entrada Salida Adición neta Producción
 Balances de Energía Los balances macroscópcos de energía se pueden deducr a partr del prmer prncpo de la termodnámca. Éste, en dstntas formas de presentacón se puede defnr como: a) dq dw 0 c c O sea que
Balances de Energía Los balances macroscópcos de energía se pueden deducr a partr del prmer prncpo de la termodnámca. Éste, en dstntas formas de presentacón se puede defnr como: a) dq dw 0 c c O sea que
Ingeniería de Reacciones
 DEFINICIÓN La Ingenería de las Reaccones Químcas es la rama de la Ingenería que estuda las reaccones químcas a escala ndustral. Su objetvo es el dseño y funconamento adecuado de los reactores químcos.
DEFINICIÓN La Ingenería de las Reaccones Químcas es la rama de la Ingenería que estuda las reaccones químcas a escala ndustral. Su objetvo es el dseño y funconamento adecuado de los reactores químcos.
ALN - SVD. Definición SVD. Definición SVD (Cont.) 29/05/2013. CeCal In. Co. Facultad de Ingeniería Universidad de la República.
 9/05/03 ALN - VD CeCal In. Co. Facultad de Ingenería Unversdad de la Repúblca Índce Defncón Propedades de VD Ejemplo de VD Métodos para calcular VD Aplcacones de VD Repaso de matrces: Una matrz es Untara
9/05/03 ALN - VD CeCal In. Co. Facultad de Ingenería Unversdad de la Repúblca Índce Defncón Propedades de VD Ejemplo de VD Métodos para calcular VD Aplcacones de VD Repaso de matrces: Una matrz es Untara
Aplicación de la termodinámica a las reacciones químicas Andrés Cedillo Departamento de Química Universidad Autónoma Metropolitana-Iztapalapa
 Aplcacón de la termodnámca a las reaccones químcas Andrés Cedllo Departamento de Químca Unversdad Autónoma Metropoltana-Iztapalapa Introduccón Las leyes de la termodnámca, así como todas las ecuacones
Aplcacón de la termodnámca a las reaccones químcas Andrés Cedllo Departamento de Químca Unversdad Autónoma Metropoltana-Iztapalapa Introduccón Las leyes de la termodnámca, así como todas las ecuacones
PRÁCTICA Nº 5. CIRCUITOS DE CORRIENTE CONTINUA
 PÁCTICA Nº 5. CICUITOS DE COIENTE CONTINUA OBJETIVO Analzar el funconamento de dferentes crcutos resstvos empleando la Ley de Ohm y las Leyes de Krchhoff. FUNDAMENTO TEÓICO Corrente Eléctrca Una corrente
PÁCTICA Nº 5. CICUITOS DE COIENTE CONTINUA OBJETIVO Analzar el funconamento de dferentes crcutos resstvos empleando la Ley de Ohm y las Leyes de Krchhoff. FUNDAMENTO TEÓICO Corrente Eléctrca Una corrente
Dpto. Física y Mecánica
 Dpto. Físca y Mecánca Mecánca analítca Introduccón Notacón Desplazamento y fuerza vrtual Fuerza de lgadura Trabao vrtual Energía cnétca. Ecuacones de Lagrange Prncpode los trabaos vrtuales Prncpo de D
Dpto. Físca y Mecánca Mecánca analítca Introduccón Notacón Desplazamento y fuerza vrtual Fuerza de lgadura Trabao vrtual Energía cnétca. Ecuacones de Lagrange Prncpode los trabaos vrtuales Prncpo de D
Tema 4. Transistor Bipolar (BJT)
 Tema 4. Transstor polar (JT) Joaquín aquero López lectrónca, 2007 Joaquín aquero López 1 Transstor polar (JT): Índce 4.1) Introduccón a los elementos de 3 termnales 4.2) Transstor polar JT (polar Juncton
Tema 4. Transstor polar (JT) Joaquín aquero López lectrónca, 2007 Joaquín aquero López 1 Transstor polar (JT): Índce 4.1) Introduccón a los elementos de 3 termnales 4.2) Transstor polar JT (polar Juncton
Solución: Se denomina malla en un circuito eléctrico a todas las trayectorias cerradas que se pueden seguir dentro del mismo.
 1 A qué se denomna malla en un crcuto eléctrco? Solucón: Se denomna malla en un crcuto eléctrco a todas las trayectoras cerradas que se pueden segur dentro del msmo. En un nudo de un crcuto eléctrco concurren
1 A qué se denomna malla en un crcuto eléctrco? Solucón: Se denomna malla en un crcuto eléctrco a todas las trayectoras cerradas que se pueden segur dentro del msmo. En un nudo de un crcuto eléctrco concurren
PRÁCTICA 1. IDENTIFICACIÓN Y MANEJO DE MATERIAL DE LABORATORIO: PREPARACIÓN DE DISOLUCIONES Y MEDIDA DE DENSIDADES
 PRÁCTICA 1. IDENTIFICACIÓN Y MANEJO DE MATERIAL DE LABORATORIO: PREPARACIÓN DE DISOLUCIONES Y MEDIDA DE DENSIDADES OBJETIVOS ESPECÍFICOS 1) Identfcar y manejar el materal básco de laboratoro. ) Preparar
PRÁCTICA 1. IDENTIFICACIÓN Y MANEJO DE MATERIAL DE LABORATORIO: PREPARACIÓN DE DISOLUCIONES Y MEDIDA DE DENSIDADES OBJETIVOS ESPECÍFICOS 1) Identfcar y manejar el materal básco de laboratoro. ) Preparar
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA. Ingeniería Química
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA Ingenería Químca Undad I. Introduccón a los cálculos de Ingenería Químca
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA Ingenería Químca Undad I. Introduccón a los cálculos de Ingenería Químca
Índice de Precios de las Materias Primas
 May-15 Resumen Ejecutvo El objetvo del (IPMP) es sntetzar la dnámca de los precos de las exportacones de Argentna, consderando la relatva establdad en el corto plazo de los precos de las ventas externas
May-15 Resumen Ejecutvo El objetvo del (IPMP) es sntetzar la dnámca de los precos de las exportacones de Argentna, consderando la relatva establdad en el corto plazo de los precos de las ventas externas
ELECTRÓLISIS. Electrólisis de sales fundidas
 El proceso por el cual se produce una reacción química a partir de una energía eléctrica se denomina electrólisis. Y se lleva a cabo en un dispositivo que se conoce como cuba o celda electrolítica. Este
El proceso por el cual se produce una reacción química a partir de una energía eléctrica se denomina electrólisis. Y se lleva a cabo en un dispositivo que se conoce como cuba o celda electrolítica. Este
TERMÓMETROS Y ESCALAS DE TEMPERATURA
 Ayudantía Académca de Físca B EMPERAURA El concepto de temperatura se basa en las deas cualtatvas de calente (temperatura alta) y río (temperatura baja) basados en el sentdo del tacto. Contacto térmco.-
Ayudantía Académca de Físca B EMPERAURA El concepto de temperatura se basa en las deas cualtatvas de calente (temperatura alta) y río (temperatura baja) basados en el sentdo del tacto. Contacto térmco.-
Adsorción de agua en alimentos. Isoterma de adsorción de Guggenheim, Anderson y de Boer (GAB). Josefina Viades Trejo.
 Adsorcón de agua en almentos. Isoterma de adsorcón de Guggenhem, Anderson y de Boer (GAB). Josefna Vades Trejo. Semnaro de Investgacón: Fenómenos de Superfce, Postgrado en Cencas Químcas, Unversdad Naconal
Adsorcón de agua en almentos. Isoterma de adsorcón de Guggenhem, Anderson y de Boer (GAB). Josefna Vades Trejo. Semnaro de Investgacón: Fenómenos de Superfce, Postgrado en Cencas Químcas, Unversdad Naconal
PROPORCIONAR RESERVA ROTANTE PARA EFECTUAR LA REGULACIÓN PRIMARIA DE FRECUENCIA ( RPF)
 ANEXO I EVALUACIÓN DE LA ENERGIA REGULANTE COMENSABLE (RRmj) OR ROORCIONAR RESERVA ROTANTE ARA EFECTUAR LA REGULACIÓN RIMARIA DE FRECUENCIA ( RF) REMISAS DE LA METODOLOGÍA Las pruebas dnámcas para la Regulacón
ANEXO I EVALUACIÓN DE LA ENERGIA REGULANTE COMENSABLE (RRmj) OR ROORCIONAR RESERVA ROTANTE ARA EFECTUAR LA REGULACIÓN RIMARIA DE FRECUENCIA ( RF) REMISAS DE LA METODOLOGÍA Las pruebas dnámcas para la Regulacón
Problemas donde intervienen dos o más variables numéricas
 Análss de Regresón y Correlacón Lneal Problemas donde ntervenen dos o más varables numércas Estudaremos el tpo de relacones que exsten entre ellas, y de que forma se asocan Ejemplos: La presón de una masa
Análss de Regresón y Correlacón Lneal Problemas donde ntervenen dos o más varables numércas Estudaremos el tpo de relacones que exsten entre ellas, y de que forma se asocan Ejemplos: La presón de una masa
TRABAJO Y ENERGÍA INTRODUCCIÓN. requiere como varia la fuerza durante el movimiento. entre los conceptos de fuerza y energía mecánica.
 TRABAJO Y ENERGÍA INTRODUCCIÓN La aplcacón de las leyes de Newton a problemas en que ntervenen fuerzas varables requere de nuevas herramentas de análss. Estas herramentas conssten en los conceptos de trabajo
TRABAJO Y ENERGÍA INTRODUCCIÓN La aplcacón de las leyes de Newton a problemas en que ntervenen fuerzas varables requere de nuevas herramentas de análss. Estas herramentas conssten en los conceptos de trabajo
