Resolución de Mezclas de Noscapina y Morfina mediante Espectrofotometría UVIVisible
|
|
|
- María Ángeles Godoy Mora
- hace 8 años
- Vistas:
Transcripción
1 Acta Farm. Bonaerense 12 (2): 617 (1993) Recibido el 14 de junio de 1993 Aceptado el 26 de julio de 1993 Trabajos originales Resolución de Mezclas de Noscapina y Morfina mediante Espectrofotometría UVIVisible Yolanda C. MICALIZZI, Sonia E. BLANCO, Claudia ORTEGA, Man'a C. CHICO, Susana A. SALMERON * y Ferdinando H. FERRETTI Departamento de Farmacia, Facultad de Química, Bioquímica y Farmacia, Universidad Nacional de San Luis, 5700 San Luis, Argentina RESUMEN. Se desarrollaron procedimientos de fácil aplicación para resolver espectroscópicamente mezclas de noscapina (1) y morfina VI). Las absortividades molares de las bases anhidras de 1 y 11 se determinaron en metano1 a 285 y 312 nm, y en disoluciones acuosas a 284 y 314 nm la de los clorhidratos correspondientes. Se prepararon y analizaron disoluciones patrones conjuntas de 1 y 11 en diversas relaciones molares (1:l hasta 1:10), a 25 "C. Los resultados obtenidos en la resolución de mezclas de 1 y 11 (como bases y como clorhidratos), muestran una confiabilidad y exactitud satisfactoria. Las técnicas presentadas, caracterizadas por la simplicidad de las operaciones y de instrumental que requieren, son de fácil y rápida ejecución. SUMMARY. "Noscapine and Morphine Mixture Resolution by UVNisible Spectrometry". Procedures of simple application were developed for the spectroscopic resolution of noscapine (1) and morphine 01) mixtures. The molar absortivities were determined at 285 nm and 3 12 nm methanol for the anhydrous bases of 1 and 11, and at 281 nm in aqueous solutions for the corresponding hydrochlondes. Mixed standard dissolutions of 1 and 11 were prepared and analyzed in different molar relations (1:l to 1:10), at 25 "C. The results obtained in the 1 and 11 mixture resolutions (both as bases and as hydrochlondes), present satisfactory reliability and accurateness. The techniques developed, characterized by simplicity of both operation and type of instrumental required, are of easy and fast application. INTRODUCCION Morfina y noscapina figuran entre los alcaloides del opio más antiguamente conocidos. Actualmente, noscapina y su clorhidrato son muy utilizados por la potente actividad antitusígena que manifiestan, ofreciendo la ventaja adicional respecto de otras drogas con acciones similares, que en dosis terapéuticas no producen efectos adversos significativos 1. La morfina, de acuerdo con las numerosas y variadas acciones farmacológicas que ejerce, se usa como analgésico, coadyuvante de la anestesia, antitusígeno y antidiarreico inespecífico 2. Si se considera la gran importancia farmacéutica y medicinal de noscapina. y morfina, queda claro por qué desde décadas atrás, los métodos de caracterización * Autor a quien debe dirigirse la correspondencia. PALABRAS CLAVE: Noscapina; Morfina; Determinación. KEY U'ORDS: Noscapine; Morphine; Determination. ISSN
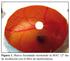
2 Micalizzi, Y.C., S.E. Blanco, C. Ortega, M.C. Chico, S.A. Salmerón y F.H. Ferretti y cuantificación de estas sustancias en diferentes vegetales, productos alimenticios y químicos, fluidos biológicos, etc., constituyen materia de continuas y dinámicas investigaciones. Los procedimientos analíticos específicos desarrollados son de naturaleza adsortiva 3, polarográfica 4, espectrométrica 5, cromatográfica 6, absortiva atómica 7, etc. En los últimos años, la utilización de técnicas de HPLC en la detección y cuantificación de noscapina y morfina S", ha experimentado un crecimiento notable. Es conocido que en los análisis cuantitativos de conjuntos numerosos de muestras, las técnicas espectroscópicas (caracterizadas por su simplicidad operativa y exactitud de las determinaciones) se emplean frecuentemente 12. En este trabajo, se realizaron diversas experiencias con el propósito de elaborar un procedimiento espectroscópico W simple y de fácil aplicación, de utilidad para resolver simultáneamente mezclas de noscapina y morfina, como bases anhidras o clorhidrato~. PARTE EXPERIMENTAL 'Clr En la Figura 1 se presentan las fórmulas de las sustancias utilizadas que fueron obtenidas directamente de productos comerciales. La purificación de 1 y 11 (como bases) se efectuó mediante reiteradas cristalizaciones H: N C H 2 por cambio de solvente (etanol y agua) y de (ih3 temperatura. El control de pureza de las sustancias se efectuó por medio de espectrosco MEO OME & CH& HO OH pía UV/Visible (metano1 y agua), cromatografía en capa delgada sobre cromatofolios de I II poliamida 11F 254, utilizando metanolagua Figura 1. Estructura de 10s empleados. 1. Noscapina. 11. Morfina ácido acético (18:1:1) como eluyente, y de terminaciones del punto de fusión. Los espectros W de las sustancias examinadas se registraron en agua y en metanol a 25 OC, utilizando un espectrómetro Spectronic 21. Las correspondientes absortividades molares de 1 y 11 se determinaron a 285 y 312 nm en metanol, y a 284 y 314 nm en agua. En la realización de las experiencias para resolver cuantitativamente mezclas de noscapina y morfina, se procedió del modo siguiente: a) Se prepararondisoluciones madres del orden de M de 1 y 11 como bases, en metanol, y también soluciones madres acuosas aproximadamente M de los clorhidratos de 1 y 11. b) Se pesaron cantidades convenientes de las disoluciones metanólicas madres de 1 y 11, para conseguir soluciones patronei con ambas drogas como solutos, en relaciones molares noscapina:morfina dentro del intervalo 1 : 1 a 1 : 10. c) Análogamente, se obtuvieron disoluciones patrones acuosas conteniendo los clorhidratos de 1 y 11 como solutos, en diversas relaciones molares de noscapina:morfina, dentro del intervalo antes precitado. d) Fracciones de 5 g a 8 g de las disoluciones metanólicas patrones de 1 y 11 se diluyeron con cantidades adecuadas de metanol (0,2 a 2,5 g) y se leyeron sus absorbapcias a 25 "C, a las longitudes de onda seleccionadas (285 y 312 nm). é) A cantidades variables (7 a 10 g) de las disoluciones patrones acuosas de 1
3 acrafarmacéutica bonaerense vol. 12 no 2 año 1993 y 11 se les adicionó de 0,5 a 2,5 g de agua destilada. Luego se leyeron las absorbancias de las diluciones obtenidas a 25 "C, a las longitudes de onda elegidas (284 y 314 nm). RESULTADOS Y DISCUSION Las absorbancias espectroscópicas de las disoluciones acuosas y metanólicas de los compuestos investigados (como solutos únicos o mezclados en diferentes relaciones molares), se analizaron en el intervalo de 240 a 300 nm. Los valores de las absortividades de 1 y 11 puras, determinados a las longitudes de onda seleccionadas, se informan en la Tabla 1. Absorüvidad molar Metano1 285 nm 312 nm Agua 284 nm 314 nm EN EM Tabla 1. Absortividades molares de noscapina (EN) y de morfina (EM) en metanol y agua a 25 OC. Los valores de EN y EM en l/(mol.cm), se determinaron en disoluciones con soluto único. Es conocido que, en general, el elevado punto de fusión (PF) de sustancias sólidas está vinculado a la baja solubilidad que ellas presentan en diversos solventes polares 13,14. ES razonable suponer, entonces, que las fuertes asociaciones homomoleculares que existen en un compuesto sólido persisten con cierto grado de importancia en medio líquido, oponiéndose a las interacciones solutosolvente que favorecen la solubilidad del mismo. En el caso de los fármacos analizados, los PF que caracterizan a sus bases anhidras son de magnitudes considerables 2J5, a saber: PF (1) = 175 OC PF (11) = 250 O C Estos valores de PF están en completo acuerdo con la bajísima solubilidad que noscapina y morfina exhiben en medios con permitividades altas. Por esto puede inferirse que en las drogas 1 y 11 en fase sólida existen fuerzas cohesivas que se oponen a la dispersión de las mismas en un disolvente polar dado, dificultando su disolución. Por otra parte, si se considera la apreciable diferencia de los valores de las constantes de disociación ácida de noscapina y morfina 16J7, pka(1) = 6,20 pka(ii)= 8,20 es razonable imaginar que en disoluciones que posean los dos compuestos como solutos, tengan lugar, además de las mencionadas anteriormente, otras importantes interacciones heteromoleculares de probable naturaleza ácidobase. Obviamente,. la concentración de 1 y 11 en una disolución de ambos fármacos constituye un fac. tor determinante de la naturaleza e intensidad de las interacciones moleculares totales que ocurran en la fase líquida. En consecuencia, queda claro que si se desea resolver mezclas de 1 y 11 disueltas en metanol (constante dieléctrica 32) o en agua (constante dieléctrica 791, se deben preparar disoluciones que posean la menor
4 Micalizzi, Y.C., S.E. Blanco, C. Ortega, M.C. Chico, S.A. Salmerón y F.H. Ferretti concentración posible de drogas. De esta forma, y conjuntamente con una selección adecuada de otras condiciones operativas de trabajo, se logra reducir la importancia de las interacciones moleculares que dificultan y limitan la aplicabilidad de leyes fisicoquímicas básicas. En particular, si se utilizan técnicas UV para cuantificar simultáneamente a 1 y 11 en mezclas de ambos fármacos 18, es necesario disponer de disoluciones del orden de 104 M a 105 M. En este intervalo de concentraciones, no puede desecharse la existencia de interacciones moleculares que compliquen las determinaciones espectroscópicas. Si la absorbancia de una disolución (que contenga a 1 y 11 como solutos) a una cierta longitud de onda se indica con AD y se utilizan celdas UV con paso Óptico de 1 cm, basados en la ley de Beer se puede formular que: AD = EN.CN + EM.CM [ll En esta expresión, EN y EM representan las absortívidades molares en l/(mol.cm) de noscapina y morfina en la disolución, en tanto que CN y CM simbolizan las molaridades (mol/l) de 1 y 11 en la solución referida. Si en la ecuación [ll se reordenan términos, se obtiene la relación (AD/ CM) = EN.(CN/CM) + EM [21 Si se grafican las cantidades (AD/CM) frente a (CN/CM), es posible calcular las absortividades molares EN y E, a partir de la pendiente y ordenada al origen de 13 recta resultante. En las figuras 2 y 3 se muestran las representaciones lineales de 13 ecuación [21 para noscapina y morfina en disoluciones metanólicas y acuosas. En la Tabla 2 se consignan los valores de las absortividades molares a 25 "C de noscapina (EN) y de morfina (EM), determinados en metano1 y agua, mediante la técnica gráfica descrita. " t O '!. E \ U 5 2#2 O? S \ V 1,4 1, ,2. 1,o 1,O 0, ,6. 2, 0 4,O CN/CM 2,0 4.0 CN/CM Figura 2. Determinación gráfica de las absorti Figura 3. Determinación gráfica de las absortividades molares de noscapina (EN) y morfina vidades molares de noscapina (EN) y rnurfin:~ (E& a 25 OC, en soluciones metanólicas con (EM) a 25 OC, en soluciones acuosas conjiin1:is juntas de ambos solutos. AD: absorbancia de la de ambos solutos. AD: absorbancia de la solusolución conjunta de morfina y noscapina; CN y ción acuosa de morfina y noscapina; CN y Chl: CM: molaridades de noscapina y morfina, res molaridades de noscapina y morfina, respectipectivamente; (a): 285 nm, (b): 312 m. vamente; (a): 284 m, (b): 314 m.
5 acta farmacéurica bonaerense vol. 12 no 2 año 1993 Absortividad molar EN EM Metano1 285 nm 312 nm APa 284 nm 314 nm Tabla 2. Absortividades molares de noscapina (EN) y de morfina (EM) en disoluciones conjuntas de ambos solutos en metanol y agua a 25 'C. 1: noscapina; 11: morfina. Los valores de EN y EM en l/(mol.cm), se determinaron en disoluciones con dos solutos (mezclas de 1 y 11 en relaciones molares variables). Si se cotejan los resultados informados en las Tablas 1 y 2, se observa que los valores de EN, determinados en disoluciones puras de noscapina en metanol y en agua, presentan diferencias pequeñas (1% a 3%) con respecto a los valores de EN establecidos en disoluciones conjuntas de noscapina y morfina, con idénticos solventes y longitudes de onda de trabajo. No sucede lo mismo con las absortividades molares de morfina (Ed, las cuales difieren significativamente entre sí, según sea la composición de las disoluciones empleadas en su determinación. Este hecho pone de manifiesto que de las dos sustancias investigadas y dentro de los intervalos de concentración ensayados, es morfina la que muestra mayores e importantes interacciones moleculares, tanto en disoluciones acuosas como en disoluciones metanólicas. Los resultados de las series de experiencias efectuadas para cuantificar simultáneamente noscapina y morfina en disoluciones patrones acuosas (clorhidratos de 1 y 11 corno solutos) y en disoluciones patrones metanólicas (bases anhidras de 1 y 11 como solutos), se especifican en las Tablas 3 y 4. Debe señalarse que las absortividades molares empleadas en el cálculo de las concentraciones molares de noscapina (CNC) y de morfina (Cm), son las informadas en la Tabla 2. Si se analizan los resultados obtenidos en las series de experiencias realizadas (Tablas 3 y 4), pueden efectuarse las siguientes observaciones: Noscapina CNE. 104 CNC. 104 EI?!o 1,298 1,296 0,2 Morfrila CME. 105 CMC. 105 El?? 7,798 7,738 0,8 I Tabla 3. Análisis espectroscópico simultáneo de disoluciones patrones acuosas de clorhidrato~ de noscapina y de morfina (25 OC, 284 y 314 m). CNE y CNC: molaridades experimental y calculada de noscapina en la solución acuosa patrón; CME y CMC: molaridades experimental y calculada de morfina en la disolución acuosa patrón; El??: error % en la concentración calculada respecto de la empírica; relaciones molares (CNEJCME) ensayadq:'f,67; 1,88; 2,33; 3,Ol; 3%); 5,45 y 8,73.
6 Micalizzi, Y.C., S.E. Blanco, C. Ortega, M.C. Chico, S.A. Salmerón y F.H. Ferretti Morfina CME 105 CMC. 105 E~~Yo Ke Tabla 4. Resolución es ctroscópica simultánea de disoluciones patrones metanólicas de noscapina y de mo ina a 25 "C (285 y 312 nm). CNE y CNC: molaridades experimental y calculada de noscapina en la solución metanólica patrón; CME y CMC: molaridades experimental y calculada de morfina en la disolución metanólica patrón; Er??: error % de la concentración calculada respecto de la empírica; relaciones molares (CNE/CME) usadas: 1,48; 1,86; 2,42; 3,00; 4,03; 5,66 y 8, El cálculo de las concentraciones de noscapina en las disoluciones patrones acuosas y metanólicas examinadas es bastante exacto, notándose en general que las diferencias entre los valores de CNc y C, son inferiores al 1%. 2. Los errores en la predicción de las concentraciones molares de morfina son mayores que los de noscapina. En las disoluciones patrones de clorhidratos de 1 y 11, las desviaciones de las magnitudes calculadas están por debajo del 2,5% respecto de los valores experimentales. En el caso de las disoluciones patrones de 1 y 11 como bases anhidras, los errores de cálculo oscilan entre un 2% y un 6% La magnitud de estos errores en la evaluación de CM, podrían ser debidos principalmente a las relativamente bajas concentraciones de morfina experimentadas, a los pequeños valores de absortividades molares que presenta la droga a las longitudes de onda escogidas y a interacciones moleculares de la sustancia, del tipo de las comentadas precedentemente. 3. Las desviaciones de los valores de concentración calculadas con respecto a los valores experimentales son positivas o negativas, azarosamente. Esto asegura que el procedimiento aplicado no proporciona resultados afectados sistemáticamente de errores positi;os o negativos, como ocurre con otras metodologías espectroscópicas empleadas por otros autores El grado de exactitud logrado en el cálculo de las concentraciones de 1 y 11 (CNC y CMC) como clorhidratos es bastante alentador, dada la simplicidad de los procedimientos y recufsos instrumentales utilizad'os. Los resultados logrados con noscapina y morfina como bases son menos satisfactorios que los anteriores, no obstante lo cual presentan una confiabilidad razonable. conclusiones Si las absortividades molares de noscapina y morfina se determinan mediante la representación gráfica o resolución numérica de la ecuación [21 (a longitudes de onda debidamente seleccionadas), es posible resolver mezclas de las drogas men
7 acta farmacéutica bonaerense vol. 12 no 2 año 1993 cionadas en disoluciones acuosas o metanólicas de manera fácil y rápida. La confiabilidad y exactitud de los resultados obtenidos con la simple metodología desarrollada, tanto del punto de vista operativo como del instrumental utilizado, es satisfactoria y comparable a la conseguida con otros procedimientos conocidos más elaborados. REFERENCIAS BIBLIOGRAFICAS 1. Swinyard, E.A. (1987) "Drogas respiratorias" en "Remington Farmacia", Edit. Médica Panamericana, 17a. ed., Bs. As., Vol. 1, pág Swinyard, E.A. (1987) "Analgésicos y Antipiréticos" en "Remington Farmacia': Edit. Médica Panamericana, 17a. ed., Bs. As., Vol. 2, págs Levi, G.R. y F. Castelli (1938) Gazz. Chim. Ital. 68: Kirkpatrick, H.F.W. (1945) Quart. J. Phamr~. and Pharniacol. 18: Berman, E. y H.N. Wright (1953) Arch. Ind. Hyg. and Occupational Med. 8: Jane, 1. y J.F. Taylor (1975) J. Chmmatogr. 109: Minamikawa, T. y K. Matsumara (1976) Yakugaki Zasshi 96: Umans, J.G., T.S.K. Chiu, R.A. Lipman, M.F. Schultz, S.U. Shin y C.E. Inturrisi (1982) J. Chmmatogr. 233: Nelson, P.E., S.L. Nolan y K.R. Bedford (1982) J. Cbmmatogr. 234: Huizer, H. (1983) J. Fowm. Sci. 28: Lucangioli, S.E., G. Fernández Otero, V. Rodríguez y C.N. Carducci (1993) VI Congreso Argentino de Farmacia y Bioquimica Industrial, Bs. As. 12. Andreetta, H.A., R.S. Rimada y N.T. Giménez (1989) Acta Farm. Bonaerense 8: Martin, A.N., J. Swarbrick y A. Cammarata (1969) "Physical Pharmacy", LeaFebiger, 2a. ed., USA, págs Sokoloski, T.D. (1987) "Soluciones y Equilibrios de Fases" en "Remingtorz Farmacia", Edit. Médica Panamericana, 17a. ed., Bs. As., Vol. 1, págs Clarke, E.G.C. (1986) "Isolation and Zdentflcation of Drugs", The Pharm. Press, 2a. ed., Londres, págs Higuchi, T. y E. BrochhmannHanssen (1961) 'Phamzaceutical Analysis", Interscience Publishers, N.Y., págs Albert, A. y E.P. Serjeant (1984) "The Determination of Ionization Comtants", Chapman and Hall, Londres, págs Rao, C.N. (1970) 'Espectmscopía Ultravioleta y Visible'; Edit. Alhambra, Madrid, págs. 1448
1. Fundamento teórico
 1 1. Fundamento teórico Los métodos espectroscópicos atómicos y moleculares figuran entre los métodos analíticos instrumentales más utilizados. La espectroscopia molecular basada en la radiación ultravioleta,
1 1. Fundamento teórico Los métodos espectroscópicos atómicos y moleculares figuran entre los métodos analíticos instrumentales más utilizados. La espectroscopia molecular basada en la radiación ultravioleta,
PRÁCTICA NO 7 CUANTIFICACIÓN DE CAFEÍNA POR ESPECTROFOTOMETRÍA
 PRÁCTICA NO 7 CUANTIFICACIÓN DE CAFEÍNA POR ESPECTROFOTOMETRÍA INTRODUCCIÓN Las técnicas espectroscópicas o espectrofotométricas se basan en la utilización de energía luminosa de cierta longitud de onda
PRÁCTICA NO 7 CUANTIFICACIÓN DE CAFEÍNA POR ESPECTROFOTOMETRÍA INTRODUCCIÓN Las técnicas espectroscópicas o espectrofotométricas se basan en la utilización de energía luminosa de cierta longitud de onda
Química Biológica I TP 1: ESPECTROFOTOMETRIA
 Química Biológica I TP 1: ESPECTROFOTOMETRIA OBJETIVOS: - Reforzar el aprendizaje del uso del espectrofotómetro. - Realizar espectro de absorción de sustancias puras: soluciones de dicromato de potasio.
Química Biológica I TP 1: ESPECTROFOTOMETRIA OBJETIVOS: - Reforzar el aprendizaje del uso del espectrofotómetro. - Realizar espectro de absorción de sustancias puras: soluciones de dicromato de potasio.
Espectroscopia de absorción visible-ultravioleta
 Práctica 6 Espectroscopia de absorción visible-ultravioleta Objetivo Parte A.- Comprobación de la Ley de Beer-Lambert y determinación del coeficiente de absorción molar para disoluciones acuosas de NiSO
Práctica 6 Espectroscopia de absorción visible-ultravioleta Objetivo Parte A.- Comprobación de la Ley de Beer-Lambert y determinación del coeficiente de absorción molar para disoluciones acuosas de NiSO
ESTUDIOS DE LOS ESPECTROS DE ABSORCION IDENTIFICACION Y DETERMINACION CUANTITATIVA DE SUSTANCIAS, EN PPM
 1. INTRODUCCION Por medio del estudio de los espectros de absorción de una sustancia así como la realización de una curva de Absorbancia en función de la concentración, se puede determinar cuantitativamente
1. INTRODUCCION Por medio del estudio de los espectros de absorción de una sustancia así como la realización de una curva de Absorbancia en función de la concentración, se puede determinar cuantitativamente
La selectividad en análisis químico
 La selectividad en análisis químico Ricard Boqué Grupo de Quimiometría y Cualimetría Universidad Rovira i Virgili (Tarragona) El concepto de selectividad en análisis químico ha sido objeto de una redefinición
La selectividad en análisis químico Ricard Boqué Grupo de Quimiometría y Cualimetría Universidad Rovira i Virgili (Tarragona) El concepto de selectividad en análisis químico ha sido objeto de una redefinición
Conductividad en disoluciones electrolíticas.
 Conductividad en disoluciones electrolíticas. 1.- Introducción 2.- Conductores 3.- Definición de magnitudes 3.1- Conductividad específica 3.2 Conductividad molar " 4. Variación de la conductividad (, ")
Conductividad en disoluciones electrolíticas. 1.- Introducción 2.- Conductores 3.- Definición de magnitudes 3.1- Conductividad específica 3.2 Conductividad molar " 4. Variación de la conductividad (, ")
Ac $ + H 3 O + (1) [c] i. =! i
![Ac $ + H 3 O + (1) [c] i. =! i Ac $ + H 3 O + (1) [c] i. =! i](/thumbs/17/103556.jpg) Laboratorio de Química Física 1 Grado en Química PRÁCTICA 1 Determinación conductimétrica de la constante de ionización de un electrolito débil (ác acético) Material 1 matraz aforado de 1000 ml compartido
Laboratorio de Química Física 1 Grado en Química PRÁCTICA 1 Determinación conductimétrica de la constante de ionización de un electrolito débil (ác acético) Material 1 matraz aforado de 1000 ml compartido
Práctica 1 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE UNA MEZCLA DE SUSTANCIAS
 Universidad de Granada Facultad de Farmacia. Departamento de Química Física. Práctica 1 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE UNA MEZCLA DE SUSTANCIAS Objetivo de la práctica: Determinar las concentraciones
Universidad de Granada Facultad de Farmacia. Departamento de Química Física. Práctica 1 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE UNA MEZCLA DE SUSTANCIAS Objetivo de la práctica: Determinar las concentraciones
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA.
 CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
Prácticas de Análisis Instrumental
 Prácticas de Análisis Instrumental Asignatura: Análisis Instrumental Alumno: Daniel González Mancebo Practica 1. DETERMINACIÓN DE CONSTANTES DE EQUILIBRIO MEDIANTE ESPECTROFOTOMETRÍA UV- VISIBLE. Lo primero
Prácticas de Análisis Instrumental Asignatura: Análisis Instrumental Alumno: Daniel González Mancebo Practica 1. DETERMINACIÓN DE CONSTANTES DE EQUILIBRIO MEDIANTE ESPECTROFOTOMETRÍA UV- VISIBLE. Lo primero
PRÁCTICA DE LABORATORIO DE QUÍMICA ANÁLISIS POR ESPECTROFOTOMETRÍA DE ABSORCIÓN
 PRÁCTICA DE LABORATORIO DE QUÍMICA ANÁLISIS POR ESPECTROFOTOMETRÍA DE ABSORCIÓN 1. OBJETIVOS. Conocer y aplicar la ley de Lambert - Beer Determinar la concentración de una solución por espectrofotometría.
PRÁCTICA DE LABORATORIO DE QUÍMICA ANÁLISIS POR ESPECTROFOTOMETRÍA DE ABSORCIÓN 1. OBJETIVOS. Conocer y aplicar la ley de Lambert - Beer Determinar la concentración de una solución por espectrofotometría.
Bolilla 7: Propiedades de los Líquidos
 Bolilla 7: Propiedades de los Líquidos 1 Bolilla 7: Propiedades de los Líquidos Estudiaremos propiedades de los líquidos, derivadas de las fuerzas de cohesión entre las moléculas que lo componen. Además
Bolilla 7: Propiedades de los Líquidos 1 Bolilla 7: Propiedades de los Líquidos Estudiaremos propiedades de los líquidos, derivadas de las fuerzas de cohesión entre las moléculas que lo componen. Además
DETERMINACIÓN ESPECTROFOTOMÉTRICA DE KMnO 4, CuSO 4 y K 2 Cr 2 O 7
 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE KMnO 4, CuSO 4 y K 2 Cr 2 O 7 El objetivo de esta investigación es la determinación cuantitativa de la concentración de KMnO 4 en una muestra problema mediante espectroscopía
DETERMINACIÓN ESPECTROFOTOMÉTRICA DE KMnO 4, CuSO 4 y K 2 Cr 2 O 7 El objetivo de esta investigación es la determinación cuantitativa de la concentración de KMnO 4 en una muestra problema mediante espectroscopía
PRACTICA No. 9 PREPARACION DE DISOLUCIONES
 1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 9 PREPARACION DE DISOLUCIONES INTRODUCCION:
1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 9 PREPARACION DE DISOLUCIONES INTRODUCCION:
Fracción másica y fracción molar. Definiciones y conversión
 Fracción másica y fracción ar. Definiciones y conversión Apellidos, nombre Atarés Huerta, Lorena (loathue@tal.upv.es) Departamento Centro Departamento de Tecnología de Alimentos ETSIAMN (Universidad Politécnica
Fracción másica y fracción ar. Definiciones y conversión Apellidos, nombre Atarés Huerta, Lorena (loathue@tal.upv.es) Departamento Centro Departamento de Tecnología de Alimentos ETSIAMN (Universidad Politécnica
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS.
 FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS. 1.- Para determinar el contenido en plomo en una muestra de leche contaminada, se toma 1.0 ml de la leche y se diluye a un volumen final
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS. 1.- Para determinar el contenido en plomo en una muestra de leche contaminada, se toma 1.0 ml de la leche y se diluye a un volumen final
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. Grupo: Equipo: Fecha: Nombre(s):
 CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA Laboratorio de equilibrio y cinética Grupo: Equipo: Fecha: Nombre(s): I. OBJETIVO GENERAL Conocer y aplicar los fundamentos
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA Laboratorio de equilibrio y cinética Grupo: Equipo: Fecha: Nombre(s): I. OBJETIVO GENERAL Conocer y aplicar los fundamentos
1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES 2. - REACCIONES ENTRE LOS ACIDOS Y LAS BASES CH 3 COOH + NH 3 CH 3 COO - + NH 4 H 2 O OH - + H +
 1 1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES Se define un ácido como cualquier ión o molécula capaz de ceder protones. Por lo contrario, una base es cualquier ión o molécula capaz de fijar protones.
1 1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES Se define un ácido como cualquier ión o molécula capaz de ceder protones. Por lo contrario, una base es cualquier ión o molécula capaz de fijar protones.
La Absorción del Agua
 La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
Solubilidad. y se representa por.
 Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Unidad II Sistemas Dispersos Elaborado por: Q.F.B. Guadalupe Echeagaray Herrera
 Química II (Química General y Orgánica) Unidad II Sistemas Dispersos Elaborado por: Sistemas Dispersos istemas Dispersos: Están constituidos por dos o más sustancias puras, unidas físicamente, (mezcladas).
Química II (Química General y Orgánica) Unidad II Sistemas Dispersos Elaborado por: Sistemas Dispersos istemas Dispersos: Están constituidos por dos o más sustancias puras, unidas físicamente, (mezcladas).
PRÁCTICA 17 ESTUDIO ESPECTROFOTOMÉTRICO DEL EQUILIBRIO. = E l c. A = log I I
 PRÁCTICA 17 ESTUDIO ESPECTROFOTOMÉTRICO DEL EQUILIBRIO 1.- FUNDAMENTO TEÓRICO. Si un haz de luz blanca pasa a través de una celda de vidrio que ha sido llenada con un líquido, la radiación emergente es
PRÁCTICA 17 ESTUDIO ESPECTROFOTOMÉTRICO DEL EQUILIBRIO 1.- FUNDAMENTO TEÓRICO. Si un haz de luz blanca pasa a través de una celda de vidrio que ha sido llenada con un líquido, la radiación emergente es
Laboratorio de Métodos Instrumentales I. Práctica No. 1 Determinación de fósforo en bebidas de cola por Espectrofotometría UV- Vis.
 Laboratorio de Métodos Instrumentales I Práctica No. 1 Determinación de fósforo en bebidas de cola por Espectrofotometría UV- Vis Equipo 1 Candy Lara Rentería Jessica Torres Gámez Salón 1 Mérida, Yucatán
Laboratorio de Métodos Instrumentales I Práctica No. 1 Determinación de fósforo en bebidas de cola por Espectrofotometría UV- Vis Equipo 1 Candy Lara Rentería Jessica Torres Gámez Salón 1 Mérida, Yucatán
EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE
 Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
Práctica de espectrofotometría UV-Visible (Cumplimiento de la Ley de Lambert-Beer y análisis de mezclas)
 Práctica de espectrofotometría UV-Visible (Cumplimiento de la Ley de Lambert-Beer y análisis de mezclas) FUNDAMENTO DE LA TÉCNICA Como es sabido, las técnicas espectroscópicas se basan en la interacción
Práctica de espectrofotometría UV-Visible (Cumplimiento de la Ley de Lambert-Beer y análisis de mezclas) FUNDAMENTO DE LA TÉCNICA Como es sabido, las técnicas espectroscópicas se basan en la interacción
Soluciones Amortiguadoras.
 Soluciones Amortiguadoras. En química es frecuente que necesitemos mantener la concentración de una determinada especie en los alrededores de un valor específico. Para lograr este propósito se utilizan
Soluciones Amortiguadoras. En química es frecuente que necesitemos mantener la concentración de una determinada especie en los alrededores de un valor específico. Para lograr este propósito se utilizan
3. Principios de medición de la calidad del aire
 3. Principios de medición de la calidad del aire 3.1. Medición. Medir es contar, comparar una unidad con otra, dar una valoración numérica, asignar un valor, asignar números a los objetos. Todo lo que
3. Principios de medición de la calidad del aire 3.1. Medición. Medir es contar, comparar una unidad con otra, dar una valoración numérica, asignar un valor, asignar números a los objetos. Todo lo que
10.8. Balances de carga y materia
 10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
LABORATORIO DE QUÍMICA ANALÍTICA INFORME PRESENTADO A LA PROF. ANGELA SIFONTE
 LABORATORIO DE QUÍMICA ANALÍTICA INFORME PRESENTADO A LA PROF. ANGELA SIFONTE TURBIDIMETRÍA INFORME N 9. PRESENTADO POR LOS BRS.: WILLIAM CHEN CHEN C.I.: 16.113.714 YUSMARY DE ABREU C.I.: 15.914.973 CARACAS,
LABORATORIO DE QUÍMICA ANALÍTICA INFORME PRESENTADO A LA PROF. ANGELA SIFONTE TURBIDIMETRÍA INFORME N 9. PRESENTADO POR LOS BRS.: WILLIAM CHEN CHEN C.I.: 16.113.714 YUSMARY DE ABREU C.I.: 15.914.973 CARACAS,
Todos los reactivos usados y solventes obtenidos de Sigma-Aldrich
 4- Materiales y Métodos 4.1- Reactivos Todos los reactivos usados y solventes obtenidos de Sigma-Aldrich Acido oxálico Formula molecular: HO 2 CCO 2 H Peso molecular: 90.03 Peroximonosulfato de potasio
4- Materiales y Métodos 4.1- Reactivos Todos los reactivos usados y solventes obtenidos de Sigma-Aldrich Acido oxálico Formula molecular: HO 2 CCO 2 H Peso molecular: 90.03 Peroximonosulfato de potasio
ESPECTROMETRÍA VISIBLE Y ULTRAVIOLETA
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 4 LECTURA N 6 ESPECTROMETRÍA VISIBLE Y ULTRAVIOLETA Bibliografía: SKOOG, D.A.; Leary J.J., Holler F. James; PRINCIPIOS DE ANÁLISIS INSTRUMENTAL,
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 4 LECTURA N 6 ESPECTROMETRÍA VISIBLE Y ULTRAVIOLETA Bibliografía: SKOOG, D.A.; Leary J.J., Holler F. James; PRINCIPIOS DE ANÁLISIS INSTRUMENTAL,
Destilación. Producto 1 más volátil que Producto 2 (P 0 1 > P0 2 ) Figura 1
 Destilación La destilación es una técnica que nos permite separar mezclas, comúnmente líquidas, de sustancias que tienen distintos puntos de ebullición. Cuanto mayor sea la diferencia entre los puntos
Destilación La destilación es una técnica que nos permite separar mezclas, comúnmente líquidas, de sustancias que tienen distintos puntos de ebullición. Cuanto mayor sea la diferencia entre los puntos
DETERMINACIÓN COLORIMÉTRICA DEL HIERRO
 DETERMINACIÓN COLORIMÉTRICA DEL HIERRO OBJETIVO Familiarizarse con los principios del análisis colorimétrico. INTRODUCCIÓN La base para lo que los químicos llaman análisis colorimétrico es la variación
DETERMINACIÓN COLORIMÉTRICA DEL HIERRO OBJETIVO Familiarizarse con los principios del análisis colorimétrico. INTRODUCCIÓN La base para lo que los químicos llaman análisis colorimétrico es la variación
Integrantes: Andrés Felipe Cárdenas Álvarez 2101302 Diana Katherine Carreño Moyano 2100993 Lorena Duarte Peña 2100968. Grupo: 4
 PRÁCTICA 8. DETERMINACIÓN DE CALCIO Y MAGNESIO EN UN LÁCTEO, LECHE ENTERA PARMALAT Integrantes: Andrés Felipe Cárdenas Álvarez 2101302 Diana Katherine Carreño Moyano 2100993 Lorena Duarte Peña 2100968
PRÁCTICA 8. DETERMINACIÓN DE CALCIO Y MAGNESIO EN UN LÁCTEO, LECHE ENTERA PARMALAT Integrantes: Andrés Felipe Cárdenas Álvarez 2101302 Diana Katherine Carreño Moyano 2100993 Lorena Duarte Peña 2100968
B Fig. 2. Ley de Lambert
 INTRODUCCION TEORICA FUNDAMENTOS DE ESPECTROFOTOMETRÍA Introducción : La espectrofotometría es uno de los métodos de análisis más usados, y se basa en la relación que existe entre la absorción de luz por
INTRODUCCION TEORICA FUNDAMENTOS DE ESPECTROFOTOMETRÍA Introducción : La espectrofotometría es uno de los métodos de análisis más usados, y se basa en la relación que existe entre la absorción de luz por
Covarianza y coeficiente de correlación
 Covarianza y coeficiente de correlación Cuando analizábamos las variables unidimensionales considerábamos, entre otras medidas importantes, la media y la varianza. Ahora hemos visto que estas medidas también
Covarianza y coeficiente de correlación Cuando analizábamos las variables unidimensionales considerábamos, entre otras medidas importantes, la media y la varianza. Ahora hemos visto que estas medidas también
UNIDAD 3: SOLUCIONES
 UNIDAD 3: SOLUCIONES 1 Las soluciones son mezclas homogéneas. Estas constan de dos o más componentes en una única fase, por ejemplo agua con sal de cocina, o azúcar en agua Para estudiar o trabajar con
UNIDAD 3: SOLUCIONES 1 Las soluciones son mezclas homogéneas. Estas constan de dos o más componentes en una única fase, por ejemplo agua con sal de cocina, o azúcar en agua Para estudiar o trabajar con
Introducción a la Espectroscopía de Absorción Molecular Ultravioleta, Visible e Infrarrojo Cercano
 ntroducción a la Espectroscopía de Absorción Molecular Ultravioleta, Visible e nfrarrojo Cercano ng. Carlos Brunatti Lic. Ana María Martín ntroducción Desde hace muchos años se ha usado el color como ayuda
ntroducción a la Espectroscopía de Absorción Molecular Ultravioleta, Visible e nfrarrojo Cercano ng. Carlos Brunatti Lic. Ana María Martín ntroducción Desde hace muchos años se ha usado el color como ayuda
Cuantificación de compuestos por cromatografía: Método del Patrón Externo
 Cuantificación de compuestos por cromatografía: Método del Patrón Externo Apellidos, nombre Departamento Centro Fernández Segovia, Isabel (isferse1@tal.upv.es) García Martínez, Eva (evgarmar@tal.upv.es)
Cuantificación de compuestos por cromatografía: Método del Patrón Externo Apellidos, nombre Departamento Centro Fernández Segovia, Isabel (isferse1@tal.upv.es) García Martínez, Eva (evgarmar@tal.upv.es)
Tema 7: Solubilidad. (Fundamentos de Química, Grado en Física) Equilibrio químico Enero Mayo, 2011 1 / 24
 Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE
 PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE MnO 4-1.- FUNDAMENTO TEÓRICO. 1.1.- Introducción Un método espectrofotométrico está basado en la medida directa de la absorción de radiación electromagnética
PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE MnO 4-1.- FUNDAMENTO TEÓRICO. 1.1.- Introducción Un método espectrofotométrico está basado en la medida directa de la absorción de radiación electromagnética
EFECTO DEL ANCHO DE BANDA ESPECTRAL Y DEL INTERVALO DE DATOS EN LA CALIBRACIÓN DE LA ESCALA DE LONGITUD DE ONDA DE ESPECTROFOTÓMETROS UV-VIS
 EFECTO DEL ANCHO DE BANDA ESPECTRAL Y DEL INTERVALO DE DATOS EN LA CALIBRACIÓN DE LA ESCALA DE LONGITUD DE ONDA DE ESPECTROFOTÓMETROS UV-VIS Guillermo Valencia L. Laboratorio de Caracterización Óptica
EFECTO DEL ANCHO DE BANDA ESPECTRAL Y DEL INTERVALO DE DATOS EN LA CALIBRACIÓN DE LA ESCALA DE LONGITUD DE ONDA DE ESPECTROFOTÓMETROS UV-VIS Guillermo Valencia L. Laboratorio de Caracterización Óptica
1. Cuál es la constante de acidez de un ácido monoprótico HA, sabiendo que una disolución 0,2 M está disociada un 1 %.
 Problemas 1. Cuál es la constante de acidez de un ácido monoprótico HA, sabiendo que una disolución 0,2 M está disociada un 1 %. (septiembre 95) 2. Cuál es la concentración molar de una disolución de ácido
Problemas 1. Cuál es la constante de acidez de un ácido monoprótico HA, sabiendo que una disolución 0,2 M está disociada un 1 %. (septiembre 95) 2. Cuál es la concentración molar de una disolución de ácido
Estudio de la evaporación
 Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
MEDICION DEL TRABAJO
 MEDICION DEL TRABAJO Habíamos dicho al comenzar el curso que habían 4 técnicas que permiten realizar una medición del trabajo 1 Técnicas Directas: - Estudio de tiempos con cronómetro - Muestreo del trabajo
MEDICION DEL TRABAJO Habíamos dicho al comenzar el curso que habían 4 técnicas que permiten realizar una medición del trabajo 1 Técnicas Directas: - Estudio de tiempos con cronómetro - Muestreo del trabajo
ESTADO LÍQUIDO 26/05/2011. Características. Dependen de la naturaleza y fuerza de las partículas que los constituyen
 ESTADO LÍQUIDO Dependen de la naturaleza y fuerza de las partículas que los constituyen Características Tienen densidades mayores que los gases Volumen definido sin forma propia Son poco compresibles Fluyen
ESTADO LÍQUIDO Dependen de la naturaleza y fuerza de las partículas que los constituyen Características Tienen densidades mayores que los gases Volumen definido sin forma propia Son poco compresibles Fluyen
Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base. Disoluciones reguladoras del ph
 Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base IES La Magdalena. Avilés. Asturias Disoluciones reguladoras del ph Si añadimos una pequeña cantidad de ácido o base a agua pura, el
Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base IES La Magdalena. Avilés. Asturias Disoluciones reguladoras del ph Si añadimos una pequeña cantidad de ácido o base a agua pura, el
CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS
 CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS Para el proceso de purificación del aceite, se pudo observar, en el momento del filtrado algunas partículas sólidas retenidas en los diferentes filtros
CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS Para el proceso de purificación del aceite, se pudo observar, en el momento del filtrado algunas partículas sólidas retenidas en los diferentes filtros
SEMINARIO 2 Parámetros del grado de perecibilidad de un alimento
 UNIVERSIDAD NACIONAL DEL CENTRO DE LA PROVINCIA DE BUENOS AIRES Facultad de Ingeniería Carrera: Licenciatura en Tecnología de los Alimentos Asignatura: Bioquímica de los Alimentos I. HUMEDAD SEMINARIO
UNIVERSIDAD NACIONAL DEL CENTRO DE LA PROVINCIA DE BUENOS AIRES Facultad de Ingeniería Carrera: Licenciatura en Tecnología de los Alimentos Asignatura: Bioquímica de los Alimentos I. HUMEDAD SEMINARIO
UNIVERSIDAD AUTONOMA DE CHIHUAHUA
 UNIVERSIDAD AUTONOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUIMICAS OPERACIONES UNITARIAS ll Ensayo Integrantes: Areli Prieto Velo 232644 Juan Carlos Calderón Villa 232654 Víctor Gutiérrez 245369 Fernando
UNIVERSIDAD AUTONOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUIMICAS OPERACIONES UNITARIAS ll Ensayo Integrantes: Areli Prieto Velo 232644 Juan Carlos Calderón Villa 232654 Víctor Gutiérrez 245369 Fernando
Facultad de Ciencias Experimentales Departamento de Ingeniería Química, Ambiental y de los Materiales. Cuaderno de prácticas de la asignatura
 UNIVERSIDAD DE JAÉN Facultad de Ciencias Experimentales Departamento de Ingeniería Química, Ambiental y de los Materiales Cuaderno de prácticas de la asignatura BASES DE LA INGENIERÍA AMBIENTAL Licenciatura
UNIVERSIDAD DE JAÉN Facultad de Ciencias Experimentales Departamento de Ingeniería Química, Ambiental y de los Materiales Cuaderno de prácticas de la asignatura BASES DE LA INGENIERÍA AMBIENTAL Licenciatura
MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE
 CAPÍTULO 8 MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE Fuente: National Geographic - Noviembre 2000 INTRODUCCIÓN La medición de los contaminantes sirve para varias funciones tales como: Provee un criterio
CAPÍTULO 8 MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE Fuente: National Geographic - Noviembre 2000 INTRODUCCIÓN La medición de los contaminantes sirve para varias funciones tales como: Provee un criterio
Extracción sólido-líquido
 Extracción sólido-líquido Objetivos de la práctica! Determinar la concentración de saturación del soluto en el disolvente en un sistema ternario arena-azúcar-agua, estableciendo la zona operativa del diagrama
Extracción sólido-líquido Objetivos de la práctica! Determinar la concentración de saturación del soluto en el disolvente en un sistema ternario arena-azúcar-agua, estableciendo la zona operativa del diagrama
FACULTAD: CIENCIAS DE LA SALUD CARRERA PROFESIONAL: FARMACIA Y BIOQUIMICA CENTRO ULADECH CATÓLICA: TRUJILLO NOMBRE DE LA ASIGNATURA: QUÍMICA ANALITICA
 FACULTAD: CIENCIAS DE LA SALUD CARRERA PROFESIONAL: FARMACIA Y BIOQUIMICA CENTRO ULADECH CATÓLICA: TRUJILLO NOMBRE DE LA ASIGNATURA: QUÍMICA ANALITICA CICLO ACADÉMICO: II NOMBRE DEL GRUPO: LOS POSITRONES
FACULTAD: CIENCIAS DE LA SALUD CARRERA PROFESIONAL: FARMACIA Y BIOQUIMICA CENTRO ULADECH CATÓLICA: TRUJILLO NOMBRE DE LA ASIGNATURA: QUÍMICA ANALITICA CICLO ACADÉMICO: II NOMBRE DEL GRUPO: LOS POSITRONES
ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO. Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara
 ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara 1. Objetivos 1.- Verificar la adsorción de las moléculas de un soluto en una disolución líquida
ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara 1. Objetivos 1.- Verificar la adsorción de las moléculas de un soluto en una disolución líquida
QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12. Lic. Ana María Martín
 QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12 Lic. Ana María Martín Lic. Ana María Martín Introducción SOLUCIONES REGULADORAS DE ph Muchas de las reacciones químicas que se producen en
QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12 Lic. Ana María Martín Lic. Ana María Martín Introducción SOLUCIONES REGULADORAS DE ph Muchas de las reacciones químicas que se producen en
TEMA 5 ESTUDIOS CORRELACIONALES.
 TEMA 5 ESTUDIOS CORRELACIONALES. 1. INTRODUCCIÓN. 2. CONCEPTO DE CORRELACIÓN. 3. CASOS EN LOS QUE SE UTILIZA LA INVESTIGACIÓN CORRELACIONAL. 4. LIMITACIONES DE LOS ESTUDIOS CORRELACIONALES 1 1. INTRODUCCIÓN.
TEMA 5 ESTUDIOS CORRELACIONALES. 1. INTRODUCCIÓN. 2. CONCEPTO DE CORRELACIÓN. 3. CASOS EN LOS QUE SE UTILIZA LA INVESTIGACIÓN CORRELACIONAL. 4. LIMITACIONES DE LOS ESTUDIOS CORRELACIONALES 1 1. INTRODUCCIÓN.
Int. Cl. 7 : G01N 33/04
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 144 36 21 k Número de solicitud: 009800009 1 k Int. Cl. 7 : G01N 33/04 A23C 11/10 k 12 SOLICITUD DE PATENTE A1 22 kfecha
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 144 36 21 k Número de solicitud: 009800009 1 k Int. Cl. 7 : G01N 33/04 A23C 11/10 k 12 SOLICITUD DE PATENTE A1 22 kfecha
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 1ª RELACIÓN DE PROBLEMAS.
 FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. ª RELACIÓN DE PROBLEMAS. PROBLEMAS BÁSICOS DE DISOLUCIONES.- Una disolución de ácido sulfúrico tiene una densidad de.8 g ml - y contiene 37.0 % en peso de H SO 4.
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. ª RELACIÓN DE PROBLEMAS. PROBLEMAS BÁSICOS DE DISOLUCIONES.- Una disolución de ácido sulfúrico tiene una densidad de.8 g ml - y contiene 37.0 % en peso de H SO 4.
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS ORBITALES ATÓMICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS Integrantes: Walter Bermúdez Lizbeth Sánchez Curso: Jueves 10:00 a 12:00 ORBITALES ATÓMICOS 1.- Definición de
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS Integrantes: Walter Bermúdez Lizbeth Sánchez Curso: Jueves 10:00 a 12:00 ORBITALES ATÓMICOS 1.- Definición de
MEDIDAS DE DISPERSIÓN EMPLEANDO EXCEL
 MEDIDAS DE DISPERSIÓN EMPLEANDO EXCEL Las medias de tendencia central o posición nos indican donde se sitúa un dato dentro de una distribución de datos. Las medidas de dispersión, variabilidad o variación
MEDIDAS DE DISPERSIÓN EMPLEANDO EXCEL Las medias de tendencia central o posición nos indican donde se sitúa un dato dentro de una distribución de datos. Las medidas de dispersión, variabilidad o variación
Cuál es tu temperatura favorita? Cuán brillante es el Sol? Educación en el cambio global Cambios en la atmósfera - Sección CA3-1
 Educación en el cambio global Cambios en la atmósfera - Sección CA3-1 CA3 Actividades Cuál es tu temperatura favorita? Si alguien te preguntase a qué temperatura te gustaría vivir, seguramente elegirías
Educación en el cambio global Cambios en la atmósfera - Sección CA3-1 CA3 Actividades Cuál es tu temperatura favorita? Si alguien te preguntase a qué temperatura te gustaría vivir, seguramente elegirías
PRÁCTICA 7 INSTRUMENTACIÓN BÁSICA EN QUÍMICA
 PRÁCTICA 7 INSTRUMENTACIÓN BÁSICA EN QUÍMICA OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con la instrumentación básica utilizada en química, haciendo especial hincapié en la
PRÁCTICA 7 INSTRUMENTACIÓN BÁSICA EN QUÍMICA OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con la instrumentación básica utilizada en química, haciendo especial hincapié en la
gsoluto %p/p = 100 gdedisolución
 I. Presentación de la guía: ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) TALLER N 3: CONCENTRACION DE DISOLUCIONES Competencia: El alumno será capaz de resolver problemas con disoluciones en unidades físicas
I. Presentación de la guía: ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) TALLER N 3: CONCENTRACION DE DISOLUCIONES Competencia: El alumno será capaz de resolver problemas con disoluciones en unidades físicas
UNIDAD 4. Reparto entre dos disolventes. Separaciones por Extracción
 UNIDAD 4 Reparto entre dos disolventes. Separaciones por Extracción Introducción En los análisis químicos es necesario, después de la toma de muestra y su disolución en el disolvente adecuado, aislar el
UNIDAD 4 Reparto entre dos disolventes. Separaciones por Extracción Introducción En los análisis químicos es necesario, después de la toma de muestra y su disolución en el disolvente adecuado, aislar el
Circuito RL, Respuesta a la frecuencia.
 Circuito RL, Respuesta a la frecuencia. A.M. Velasco (133384) J.P. Soler (133380) O.A. Botina (133268) Departamento de física, facultad de ciencias, Universidad Nacional de Colombia Resumen. Se estudia
Circuito RL, Respuesta a la frecuencia. A.M. Velasco (133384) J.P. Soler (133380) O.A. Botina (133268) Departamento de física, facultad de ciencias, Universidad Nacional de Colombia Resumen. Se estudia
TEMA 4 INTRODUCCIÓN AL ANÁLISIS VOLUMÉTRICO
 TEMA 4 INTRODUCCIÓN AL ANÁLISIS VOLUMÉTRICO Las valoraciones se emplean extensivamente en Química Analítica para la cuantificación de diversas especies químicas. En este tema se describen los principios
TEMA 4 INTRODUCCIÓN AL ANÁLISIS VOLUMÉTRICO Las valoraciones se emplean extensivamente en Química Analítica para la cuantificación de diversas especies químicas. En este tema se describen los principios
La electrólisis CONTENIDOS. Electrolitos. Iones. Carga eléctrica negativa. www.codelcoeduca.cl
 La electrólisis Las moléculas de ciertos compuestos químicos, cuando se encuentran en disolución acuosa, presentan la capacidad de separarse en sus estructuras moleculares más simples y/o en sus átomos
La electrólisis Las moléculas de ciertos compuestos químicos, cuando se encuentran en disolución acuosa, presentan la capacidad de separarse en sus estructuras moleculares más simples y/o en sus átomos
15/03/2010. Espectrofotometría INTRODUCCIÓN
 Espectrofotometría Daniel Olave Tecnología Médica 2007 INTRODUCCIÓN Espectrofotometría Es la medida de la cantidad de energía radiante absorbida por las moléculas a longitudes de onda específicas. La espectrofotometría
Espectrofotometría Daniel Olave Tecnología Médica 2007 INTRODUCCIÓN Espectrofotometría Es la medida de la cantidad de energía radiante absorbida por las moléculas a longitudes de onda específicas. La espectrofotometría
Qué es un espectrofotómetro?
 Qué es un espectrofotómetro? Un espectrofotómetro es un instrumento usado en el análisis químico que sirve para medir, en función de la longitud de onda, la relación entre valores de una misma magnitud
Qué es un espectrofotómetro? Un espectrofotómetro es un instrumento usado en el análisis químico que sirve para medir, en función de la longitud de onda, la relación entre valores de una misma magnitud
Trabajo Práctico N o 1
 1 Trabajo Práctico N o 1 Soluciones y diluciones OBJETIVOS - Conocer todas las formas de indicar la concentración química de una solución. - Ser capaz de calcular la concentración de una solución a partir
1 Trabajo Práctico N o 1 Soluciones y diluciones OBJETIVOS - Conocer todas las formas de indicar la concentración química de una solución. - Ser capaz de calcular la concentración de una solución a partir
EL ESTADO DE ORIGEN Y APLICACION DE FONDOS
 El estado de origen y aplicación de fondos EL ESTADO DE ORIGEN Y APLICACION DE FONDOS 1.- Introducción.- Como se indicó al tratar la cuenta de resultados, la misma es la expresión contable del movimiento
El estado de origen y aplicación de fondos EL ESTADO DE ORIGEN Y APLICACION DE FONDOS 1.- Introducción.- Como se indicó al tratar la cuenta de resultados, la misma es la expresión contable del movimiento
Bebes? Conduces? Reducción de riesgos asociados al consumo de alcohol y la conducción de vehículos en jóvenes que salen de marcha.
 Bebes? Conduces? Reducción de riesgos asociados al consumo de alcohol y la conducción de vehículos en jóvenes que salen de marcha. Claudio Vidal Giné claudiovidal@energycontrol.org María Isabel Pérez Ramírez
Bebes? Conduces? Reducción de riesgos asociados al consumo de alcohol y la conducción de vehículos en jóvenes que salen de marcha. Claudio Vidal Giné claudiovidal@energycontrol.org María Isabel Pérez Ramírez
ASOCIACIÓN LINEAL ENTRE VARIABLES CUANTITATIVAS: la correlación de Pearson
 ASOCIACIÓN LINEAL ENTRE VARIABLES CUANTITATIVAS: la correlación de Pearson 3datos 2011 Análisis BIVARIADO de variables cuantitativas OBJETIVO DETERMINAR 1º) si existe alguna relación entre las variables;
ASOCIACIÓN LINEAL ENTRE VARIABLES CUANTITATIVAS: la correlación de Pearson 3datos 2011 Análisis BIVARIADO de variables cuantitativas OBJETIVO DETERMINAR 1º) si existe alguna relación entre las variables;
Lección 16. INTRODUCCIÓN AL ANÁLISIS CUANTITATIVO.
 Lección 16. INTRODUCCIÓN AL ANÁLISIS CUANTITATIVO. Análisis cuantitativo: Conceptos básicos. Propiedades analíticas de interés. Trazabilidad. Materiales de referencia. Calibración instrumental y metodológica.
Lección 16. INTRODUCCIÓN AL ANÁLISIS CUANTITATIVO. Análisis cuantitativo: Conceptos básicos. Propiedades analíticas de interés. Trazabilidad. Materiales de referencia. Calibración instrumental y metodológica.
TEMA 1: DETERMINACIÓN DE LA FÓRMULA MOLECULAR Y DE LOS GRUPOS FUNCIONALES Introducción
 Introducción El número de compuestos orgánicos posibles es ilimitado, cada uno de los cuales posee una estructura definida y diferente, por lo que la determinación de la estructura debe llevar a establecer
Introducción El número de compuestos orgánicos posibles es ilimitado, cada uno de los cuales posee una estructura definida y diferente, por lo que la determinación de la estructura debe llevar a establecer
Determinación del equivalente eléctrico del calor
 Determinación del equivalente eléctrico del calor Julieta Romani Paula Quiroga María G. Larreguy y María Paz Frigerio julietaromani@hotmail.com comquir@ciudad.com.ar merigl@yahoo.com.ar mapaz@vlb.com.ar
Determinación del equivalente eléctrico del calor Julieta Romani Paula Quiroga María G. Larreguy y María Paz Frigerio julietaromani@hotmail.com comquir@ciudad.com.ar merigl@yahoo.com.ar mapaz@vlb.com.ar
pk A DE UN INDICADOR ÁCIDO-BASE
 pk A DE UN INDICADOR ÁCIDO-BASE OBJETIVO Determinar el pk a de un indicador ácido-base por espectroscopia visible. Descripción del Experimento Primero deben verificar la λ max de la forma con mayor absorbencia
pk A DE UN INDICADOR ÁCIDO-BASE OBJETIVO Determinar el pk a de un indicador ácido-base por espectroscopia visible. Descripción del Experimento Primero deben verificar la λ max de la forma con mayor absorbencia
Rosamil Rey, Ph.D. CHEM 4160
 Rosamil Rey, Ph.D. CHEM 4160 Los métodos analíticos se pueden clasificar en: Métodos Clásicos Métodos Instrumentales Métodos Clásicos Precipitación Extracción Destilación Medidas gravimétricas Medidas
Rosamil Rey, Ph.D. CHEM 4160 Los métodos analíticos se pueden clasificar en: Métodos Clásicos Métodos Instrumentales Métodos Clásicos Precipitación Extracción Destilación Medidas gravimétricas Medidas
Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor
 Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor 1. Generalidades 2. Qué se necesita para comenzar? 3. Qué hacer para sistemas opacos y translúcidos? 4. Qué hacer
Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor 1. Generalidades 2. Qué se necesita para comenzar? 3. Qué hacer para sistemas opacos y translúcidos? 4. Qué hacer
EMPLEO DEL CONTROL ESTADISTICO DE PROCESO COMO PARTE DE UN PLAN DE ASEGURAMIENTO DE LA CALIDAD Acosta, S. 1, Lewis, C. 2 RESUMEN
 EMPLEO DEL CONTROL ESTADISTICO DE PROCESO COMO PARTE DE UN PLAN DE ASEGURAMIENTO DE LA CALIDAD Acosta, S. 1, Lewis, C. 2 1,2 Autoridad Regulatoria Nuclear Buenos Aires, Argentina sacosta@arn.gob.ar RESUMEN
EMPLEO DEL CONTROL ESTADISTICO DE PROCESO COMO PARTE DE UN PLAN DE ASEGURAMIENTO DE LA CALIDAD Acosta, S. 1, Lewis, C. 2 1,2 Autoridad Regulatoria Nuclear Buenos Aires, Argentina sacosta@arn.gob.ar RESUMEN
VELOCIDAD DE REACCIÓN Y TEMPERATURA
 VELIDAD DE REAIÓN Y TEMPERATURA BJETIV El alumno determinará la constante de velocidad para la reacción de decoloración de la fenolftaleína en medio básico a tres temperaturas diferentes, calculará los
VELIDAD DE REAIÓN Y TEMPERATURA BJETIV El alumno determinará la constante de velocidad para la reacción de decoloración de la fenolftaleína en medio básico a tres temperaturas diferentes, calculará los
Completar: Un sistema material homogéneo constituido por un solo componente se llama.
 IES Menéndez Tolosa 3º ESO (Física y Química) 1 Completar: Un sistema material homogéneo constituido por un solo componente se llama. Un sistema material homogéneo formado por dos o más componentes se
IES Menéndez Tolosa 3º ESO (Física y Química) 1 Completar: Un sistema material homogéneo constituido por un solo componente se llama. Un sistema material homogéneo formado por dos o más componentes se
CORRELACIÓN Y PREDICIÓN
 CORRELACIÓN Y PREDICIÓN 1. Introducción 2. Curvas de regresión 3. Concepto de correlación 4. Regresión lineal 5. Regresión múltiple INTRODUCCIÓN: Muy a menudo se encuentra en la práctica que existe una
CORRELACIÓN Y PREDICIÓN 1. Introducción 2. Curvas de regresión 3. Concepto de correlación 4. Regresión lineal 5. Regresión múltiple INTRODUCCIÓN: Muy a menudo se encuentra en la práctica que existe una
LA MEDIDA Y SUS ERRORES
 LA MEDIDA Y SUS ERRORES Magnitud, unidad y medida. Magnitud es todo aquello que se puede medir y que se puede representar por un número. Para obtener el número que representa a la magnitud debemos escoger
LA MEDIDA Y SUS ERRORES Magnitud, unidad y medida. Magnitud es todo aquello que se puede medir y que se puede representar por un número. Para obtener el número que representa a la magnitud debemos escoger
Control de Calidad en la Industria Farmacéutica
 Área Análisis de Medicamentos Departamento de Química Orgánica Facultad de Ciencias Bioquímicas y Farmacéuticas Control de Calidad en la Industria Farmacéutica Dra. atricia M. Castellano DOSIS SOLA FACIT
Área Análisis de Medicamentos Departamento de Química Orgánica Facultad de Ciencias Bioquímicas y Farmacéuticas Control de Calidad en la Industria Farmacéutica Dra. atricia M. Castellano DOSIS SOLA FACIT
Tema 3. Medidas de tendencia central. 3.1. Introducción. Contenido
 Tema 3 Medidas de tendencia central Contenido 31 Introducción 1 32 Media aritmética 2 33 Media ponderada 3 34 Media geométrica 4 35 Mediana 5 351 Cálculo de la mediana para datos agrupados 5 36 Moda 6
Tema 3 Medidas de tendencia central Contenido 31 Introducción 1 32 Media aritmética 2 33 Media ponderada 3 34 Media geométrica 4 35 Mediana 5 351 Cálculo de la mediana para datos agrupados 5 36 Moda 6
Asignaturas antecedentes y subsecuentes
 PROGRAMA DE ESTUDIOS Análisis Instrumental Área a la que pertenece: AREA SUSTANTIVA PROFESIONAL Horas teóricas: 3 Horas practicas: 4 Créditos: 10 Clave: F0205 Ninguna. Asignaturas antecedentes y subsecuentes
PROGRAMA DE ESTUDIOS Análisis Instrumental Área a la que pertenece: AREA SUSTANTIVA PROFESIONAL Horas teóricas: 3 Horas practicas: 4 Créditos: 10 Clave: F0205 Ninguna. Asignaturas antecedentes y subsecuentes
UOP 603-13: Análisis de Trazas de CO y CO2 en H2 e Hidrocarburos Gaseosos Ligeros por GC
 UOP 603-13: Análisis de Trazas de CO y CO2 en H2 e Hidrocarburos Gaseosos Ligeros por GC Análisis Rápido en
UOP 603-13: Análisis de Trazas de CO y CO2 en H2 e Hidrocarburos Gaseosos Ligeros por GC Análisis Rápido en
PRÁCTICA 18 DIAGRAMA DE MISCIBILIDAD DEL SISTEMA AGUA-FENOL
 PRÁCTICA 18 DIAGRAMA DE MISCIBILIDAD DEL SISTEMA AGUA-FENOL OBJETIVOS Comprensión cualitativa del equilibrio líquido-líquido en un sistema binario con miscibilidad parcial. Observación de la separación
PRÁCTICA 18 DIAGRAMA DE MISCIBILIDAD DEL SISTEMA AGUA-FENOL OBJETIVOS Comprensión cualitativa del equilibrio líquido-líquido en un sistema binario con miscibilidad parcial. Observación de la separación
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503. GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN
 LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN I. EL PROBLEMA Dos líquidos completamente miscibles se pueden separar por métodos físicos llamados
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN I. EL PROBLEMA Dos líquidos completamente miscibles se pueden separar por métodos físicos llamados
ELECTROLISIS DE UNA DISOLUCIÓN DE YODURO DE POTASIO. PILA ELECTROLÍTICA
 VIII 1 PRÁCTICA 8 ELECTROLISIS DE UNA DISOLUCIÓN DE YODURO DE POTASIO. PILA ELECTROLÍTICA En esta práctica estudiaremos algunos aspectos prácticos de las reacciones de oxidación reducción que no son espontáneas.
VIII 1 PRÁCTICA 8 ELECTROLISIS DE UNA DISOLUCIÓN DE YODURO DE POTASIO. PILA ELECTROLÍTICA En esta práctica estudiaremos algunos aspectos prácticos de las reacciones de oxidación reducción que no son espontáneas.
DESARROLLO DE LA PROGRAMACIÓN PARA 4º ESO Opción B. Bloque 1. Contenidos comunes.
 DESARROLLO DE LA PROGRAMACIÓN PARA 4º ESO Opción B Contenidos mínimos según real decreto 1631/2006 Bloque 1. Contenidos comunes. o Planificación y utilización de procesos de razonamiento y estrategias
DESARROLLO DE LA PROGRAMACIÓN PARA 4º ESO Opción B Contenidos mínimos según real decreto 1631/2006 Bloque 1. Contenidos comunes. o Planificación y utilización de procesos de razonamiento y estrategias
EL ANÁLISIS DE LA VARIANZA (ANOVA) 1. Comparación de múltiples poblaciones
 EL ANÁLISIS DE LA VARIANZA (ANOVA) 1. Comparación de múltiples poblaciones Ricard Boqué, Alicia Maroto Grupo de Quimiometría y Cualimetría. Universitat Rovira i Virgili. Pl. Imperial Tàrraco, 1. 43005Tarragona
EL ANÁLISIS DE LA VARIANZA (ANOVA) 1. Comparación de múltiples poblaciones Ricard Boqué, Alicia Maroto Grupo de Quimiometría y Cualimetría. Universitat Rovira i Virgili. Pl. Imperial Tàrraco, 1. 43005Tarragona
PRÁCTICA 1. PREPARACIÓN DE DISOLUCIONES.
 PRÁCTICA 1. PREPARACIÓN DE DISOLUCIONES. OBJETIVOS 1.- Familiarizarse con el material de laboratorio. 2.- Aprender a preparar disoluciones de una concentración determinada. 3.- Manejar las distintas formas
PRÁCTICA 1. PREPARACIÓN DE DISOLUCIONES. OBJETIVOS 1.- Familiarizarse con el material de laboratorio. 2.- Aprender a preparar disoluciones de una concentración determinada. 3.- Manejar las distintas formas
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA
 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA PROGRAMA DE INGENIERIA DE ALIMENTOS 211612 TRANSFERENCIA DE MASA ACTIVIDAD 11 RECONOCIMIENTO UNIDAD 3 BOGOTA D.C. Extracción líquido - líquido La extracción líquido-líquido,
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA PROGRAMA DE INGENIERIA DE ALIMENTOS 211612 TRANSFERENCIA DE MASA ACTIVIDAD 11 RECONOCIMIENTO UNIDAD 3 BOGOTA D.C. Extracción líquido - líquido La extracción líquido-líquido,
Parte 7: Análisis de los datos
 Metodología de la investigación Curso 2008 Parte 7: Análisis de los datos Los ejemplos han sido tomados en su mayoría de la bibliografía recomendada para el curso Análisis de los datos El análisis de datos
Metodología de la investigación Curso 2008 Parte 7: Análisis de los datos Los ejemplos han sido tomados en su mayoría de la bibliografía recomendada para el curso Análisis de los datos El análisis de datos
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O. Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua
 C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
