ω = 1 2π E v = hω(v + 1/2)
|
|
|
- Celia Quintana García
- hace 8 años
- Vistas:
Transcripción
1 2 Espectroscopía vibracional 2.1 Bases físicas: vibraciones moleculares 2.2 Espectroscopías vibracionales 2.3 Modos normales y simetría 2.4 tros aspectos 2.5 Interpretación de espectros La espectroscopía vibracional es una técnica física ampliamente usada por los químicos inorgánicos desde los años 40, particularmente gracias al desarrollo de espectrómetros IR y Raman fiables y fáciles de usar. Es una técnica amplia en su aplicabilidad ya que cualquier muestra con enlaces covalentes tiene algún tipo de espectro vibracional, es fácil de estudiar tanto gases, como líquidos, sólidos o disoluciones, y los espectros se pueden registrar en condiciones extremas de temperatura o presión. 2.1 Bases físicas: vibraciones moleculares Moléculas diatómicas. Una molécula diatómica tiene 6 grados de libertad: 3 de traslación, 2 de rotación y 1 de vibración. Suponiendo un comportamiento de oscilador armónico, la fuerza vale F(x) = kx, donde k es la constante de fuerza y x es el desplazamiento desde el equilibrio. La frecuencia de vibración es ω = 1 2π donde µ es la masa reducida de los dos átomos. La energía de vibración está cuantizada: k µ E v = hω(v + 1/2) donde el número cuántico v = 0,1,2, En un vibrador armónico, los niveles de energía están igualmente espaciados (figura 2.1a). En realidad, un enlace químico no es verdaderamente un oscilador armónico, lo implica, entre otras cosas, que los niveles no están igualmente espaciados (figura 2.1b). E E (a) v = 6 v = 5 v = 4 v = 3 v = 2 v = 1 v = 0 hω hω hω 1/2hω hω hω hω x (b) v = v = 4 v = 3 v = 2 v = 1 v = 0 Energía de disociación x Figura 2.1. (a) Energía potencial para un oscilador armónico. Las rayas horizontales indican las energías permitidas. (b) Un enlace químico no es verdaderamente un oscilador armónico pues la energía potencial aumenta más cuando disminuimos la distancia por debajo de la del equilibrio que cuando la aumentamos. En un oscilador inarmónico los niveles de energía no están igualmente espaciados. Sólo a 0 K todas las moléculas están vibrando en el estado fundamental. A temperaturas mayores de 0 K, parte de las moléculas vibran en estados excitados. La ley de distribución de Boltzmann N i = e N ±(E i ± E j )/kt j predice que la ocupación de estados excitados es mayor cuando la temperatura es alta y cuando las diferencias de energía entre estados son pequeñas. El valor de kt a temperatura ambiente (0,026 ev, 200 cm 1 ) es similar a las diferencias de energía entre niveles vibratorios de moléculas diatómicas de átomos pesados como Br 2 o I 2 (del orden de 0,04 ev, 300 cm 1 ), por lo que sus estados excitados se encontrarán significativamente poblados. En cambio, las moléculas diatómicas ligeras (p. ej. 2, C, 2, Cl) vibran a mayores frecuencias (del orden de 0,4 ev, 3000 cm 1 ) por lo que únicamente el estado fundamental se encuentra a temperatura ambiente significativamente poblado. Moléculas poliatómicas y modos normales de vibración. Una molécula de N átomos tiene 3N grados de
2 Licenciatura en Química. Universidad de Alcalá Tema 2: Espectroscopía vibracional 13 libertad: 3 de traslación, 3 de rotación (2 si es lineal), 3N 6 de vibración (3N 5 si es lineal). Los movimientos de vibración de una molécula se pueden descomponer en oscilaciones en las que los átomos se mueven en fase y que se llaman modos normales de vibración, cada uno de los cuales tiene una frecuencia característica (figura 2.2). C ν 1 vibración de tensión (stretch) simétrica, Σ + g C ν 2a vibración de flexión (bend) degeneradas, Π u C C ν 3 ν 2b vibración de tensión (stretch) vibración de flexión (bend) asimétrica, Σ + u bsérvese que son modos puros de vibración en los que el centro de gravedad de la molécula no se traslada, pues el desplazamiento del carbono y oxígenos se compensa entre sí. Figura 2.2. Modos normales de vibración de la molécula de C 2. Dos son de tensión y otros dos de flexión. Normalmente, el número de vibraciones de tensión coincide con el de enlaces. La simetría de un modo normal de vibración es el de una representación irreducible. 2.2 Espectroscopías vibracionales Espectroscopía infrarroja (IR). Las vibraciones moleculares producen oscilaciones en las cargas eléctricas con frecuencias gobernadas por las frecuencias normales de vibración del sistema. Un dipolo molecular oscilante puede interaccionar directamente con una radiación electromagnética de la misma frecuencia, produciendo la absorción de energía por resonancia. Estas absorciones aparecen en el infrarrojo. Las reglas de selección para la espectroscopía infrarroja son: hν = hω v = 1 v = 0 Figura 2.3. El IR es una espectroscopía de resonancia. Una molécula con un modo normal de vibración de frecuencia ω y diferencia de energía entre niveles vibratorios hω absorbe un fotón de energía hν cuando ω =ν. La absorción representada en la figura corresponde a una banda fundamental (v = 0 v = 1). Regla de selección específica: Sólo están permitidas las transiciones entre estados vibracionales consecutivos: v = ±1. Al ser el IR una espectroscopía de absorción, y no de emisión, v = +1. La banda más importante de un modo de vibración es la debida a la transición entre el estado más poblado y el primer estado excitado: v = 0 v = 1 y recibe el nombre de banda fundamental. Regla de selección global: La vibración molecular tiene que producir un dipolo oscilante para que pueda absorber energía. Así las vibraciones del C 2 (figura 2.2) ν 2 y ν 3 son activas en el IR, mientras que ν 1 es inactiva. En moléculas más complejas es útil aplicar las propiedades de simetría de las vibraciones para determinar las que son activas. Una vibración molecular da lugar a una banda activa en el IR si, y sólo si, la simetría de la vibración es la misma que la de una o más coordenadas x, y, z. Espectroscopía Raman. Estudia la luz dispersada en lugar de la absorbida o emitida. Una molécula puede absorber un fotón si la energía de éste coincide con una diferencia entre niveles cuánticos. Pero la colisión entre fotón y molécula también puede dispersar el fotón, independientemente de la energía de éste. La mayoría de los fotones dispersados no sufren ningún cambio en su frecuencia y energía, pero una pequeña fracción intercambia energía con la molécula durante la colisión (efecto Raman, figura 2.4). Las líneas Raman son muy débiles ya que sólo un 0,001% de la radiación incidente se dispersa, y, de ésta, sólo 1% es radiación Raman. La dispersión Raman no es una interacción de resonancia. La interacción se produce entre la polarización de la nube electrónica y el vector oscilante de la radiación. La regla de selección global para esta espectroscopía dice que la vibración tiene que cambiar la polarizabilidad de la molécula para que sea activa. En términos de simetría, una vibración origina una
3 14 Determinación estructural de compuestos inorgánicos banda fundamental sí, y sólo sí, la simetría de la vibración es igual a al menos uno de los componentes del tensor de polarizabilidad α de la molécula (x 2, y 2, z 2, xy, xz, yz). Así las vibraciones ν 2 y ν 3 del C 2 son inactivas en el Raman, mientras que ν 1 es activa. a) b) ν0 hν0 h(ν0 ν) Muestra Detector lineas Stokes c) ν0 ν0 ν ν ν ν0 + ν Stokes anti Stokes hν hν0 h(ν0 + ν) v = 1 v = 0 anti Stokes Figura 2.4. a) Una radiación electromagnética de frecuencia ν o se dispersa parcialmente al interaccionar con una muestra. b) Efecto Raman. La energía de una parte de los fotones dispersados disminuye en hν debido a la transferencia de energía a la muestra en forma vibracional (líneas de Stokes). Si los niveles vibracionales excitados están suficientemente poblados, es posible observar también la dispersión de fotones cuya energía ha aumentado en hν (líneas de anti Stokes). c) En el detector se observa una banda intensa en ν o, debida a la luz dispersada sin efecto Raman, y otra banda (linea de Stokes) mucho más débil a una frecuencia ν o ν, donde ν corresponde a una frecuencia vibracional. A veces es posible observar, aunque mucho más débilmente, la línea anti Stokes a ν o +ν. Raman e infrarrojo. Raman e infrarrojo son técnicas complementarias a la hora de estudiar las frecuencias vibracionales de una molécula. Por ejemplo, en el C 2 la banda fundamental ν 1 sólo es observable en el Raman, mientras que las bandas fundamentales ν 2 y ν 3 sólo lo son en el IR. El Raman también tiene interés para el estudio de sustancias en disolución acuosa (p. ej. en medios biológicos) ya que el agua absorbe fuertemente en el IR, tapando otras bandas, pero no en el Raman. Por otra parte, es difícil técnicamente obtener espectros IR por debajo de 100 cm 1. En Raman, la frecuencia ν 0 no está relacionada con la diferencia de niveles y, de hecho, generalmente cae en el visible o ultra-violeta cercano. Por ello no existe problema en observar desplazamientos de Raman menores de 100 cm 1 y hasta 10 cm 1 (las bandas por debajo de esta frecuencia aparecen tapadas por la banda ν 0 ). 2.3 Modos normales y simetría Absorciones del 2. El número de bandas presentes en el IR y Raman para una especie aporta información sobre su simetría y, por tanto, sobre su estructura. En la figura 2.5 se muestran las vibraciones normales de la molécula de 2. En la tabla 2.1 se comparan las vibraciones de una molécula lineal como la de C 2 con otra angular como la de 2. Deducción sistemática de los modos normales. Es conveniente disponer de un método sistemático para determinar las vibraciones activas y racionalizar el estudio de moléculas más complejas. Podemos utilizar la teoría de grupos para hallar las representaciones irreducibles de los modos normales, siguiendo un método análogo al desarrollado en el tema 1 para las combinaciones de orbitales. Los 9 grados de libertad de la molécula de agua, se pueden representar situando tres vectores x, y, z, sobre cada átomo (figura 2.6), de forma que podemos determinar el comportamiento de simetría (la representación reducible) de los 9 vectores, y averiguar qué combinación de representaciones irreducibles da el mismo comportamiento: 1 Se determina la representación de simetría para los 9 vectores. Ello supone obtener el caracter de estos 9 vectores frente a cada clase de operación del grupo aplicando las siguientes reglas:
4 Licenciatura en Química. Universidad de Alcalá Tema 2: Espectroscopía vibracional 15 z x y ν 1 vibración de tensión simétrica A 1 ν 3 vibración de tensión asimétrica B 2 ν 2 vibración de flexión A 1 Figura 2.5. Modos normales de vibración de la molécula de 2. La molécula de agua tiene 9 grados de libertad, 3 de traslación, 3 de rotación y 3 de vibración. Al ser angular, tiene un modo más de rotación y uno menos de vibración que la molécula lineal de C 2. Dos de los modos de vibración son de tensión y el otro de flexión. Todos son activos en IR y Raman. Tabla 2.1. Modos normales y su actividad en IR y Raman para moléculas 2 Moléculas lineales, D h (ejemplo: C 2 gas) Moléculas angulares, C 2v (ejemplo: 2 líquida) Vibración Simetría Actividad ν(cm -1 ) (*) Vibración Simetría Actividad ν(cm -1 ) (*) ν 1 (tensión) Σ + g Raman 1388, 1285 (**) ν 1 (tensión) A 1 IR y Raman 3450 ν 2a (flexión) ν 2 (flexión) A 1 IR y Raman 1640 Π u IR 667 ν 2b (flexión) ( ) ν 3 (tensión) Σ + u IR 2349 ν 3 (tensión) B 2 IR y Raman 3615 * En espectroscopía vibracional, la posición de las bandas suele darse en números de onda por cm. El rango más habitual de registro es entre 4000 y 400 cm 1 (IR medio), aunque también hay absorciones a frecuencias mayores (IR lejano) o menores (IR cercano). ** Desdoblada debido a la resonancia de Fermi. *** El modo de flexión de una molécula lineal que queda perpendicular al plano molecular al pasar a una molécula angular, se convierte en modo de rotación. x z y Figura 2.6. Los 9 vectores de la molécula de agua. a) Los 3 vectores de un átomo aportan caracter nulo si cambia de posición al aplicarle una operación. b) Si el átomo no cambia de posición al aplicarle una operación, los 3 vectores de un átomo aportan: b-1) + 3, para la operación E. b-2) 3, para la operación i. b-3) + 1, para la operación σ. b-4) cosθ, para la operación C(θ). b-5) cosθ, para la operación S(θ). En nuestro ejemplo: C 2v E C 2 σ(xz) σ(yz) Γ Se determina la combinación de representaciones irreducibles que resulta en la representación determinada en el punto anterior. En nuestro ejemplo:
5 16 Determinación estructural de compuestos inorgánicos n(a 1 ) = (1/4) ( ( 1) ) = 3 n(a 2 ) = (1/4) ( ( 1) ( 1) ( 1)) = 1 n(b 1 ) = (1/4) ( ( 1) ( 1) ( 1)) = 2 n(b 2 ) = (1/4) ( ( 1) ( 1) ( 1) ) = 3 Por tanto: Γ = 3A 1 + A 2 + 2B 1 + 3B 2 Estas representaciones incluyen no sólo los modos vibracionales sino también los traslacionales y rotacionales. Buscando en la tabla de caracteres, el comportamiento de las coordenadas x, y, z y de los rotores R x, R y, R z : Γ tras = A 1 + B 1 + B 2 Γ rot = A 2 + B 1 + B 2 Por lo que: Γ vib = 2A 1 + B 2 Moléculas 3 planas y piramidales. Una molécula plana como la de BF 3 pertenece al grupo D 3h, mientras que una piramidal como el N 3 pertenece al grupo C 3v. Ambos tipos de moléculas tienen 12 grados de libertad, 3 de traslación, 3 de rotación y 6 de vibración. De estos últimos, 3 son de tensión (hay tres enlaces) y 3 de flexión. La representación reducible de los 12 grados de libertad es D 3h D 3h E 2C 3 3C 2 σ h 2S 3 3σ v Γ Γ = A 1 + A 2 + 3E + 2A 2 + E Γ tras = E + A 2 Γ rot = A 2 + E Γ vib = A 1 + 2E + A 2 tensión: A 1 + E flexión: A 2 + E C 3v C 3v E 2C 3 3σ v Γ Γ = 3A 1 + A 2 + 4E Γ tras = A 1 + E Γ rot = A 2 + E Γ vib = 2A 1 + 2E tensión: A 1 + E flexión: A 1 + E Los modos normales y su actividad en IR y Raman se recogen en la tabla 2.2. Reducción de la simetría. Los resultados obtenidos para moléculas 2 (tabla 2.1) o moléculas 3 (tabla 2.2) muestran que una reducción de simetría (de lineal a angular o de plana a piramidal) puede aumentar el número de bandas activas en el IR o Raman. El motivo es que la reducción de la simetría de una molécula también disminuye la de sus vibraciones, pudiendo desaparecer las razones de simetría por las que una vibración no modificaba el momento dipolar o la polarizabilidad de la molécula en la alta simetría. Así, por ejemplo, la vibración de tensión simétrica ν 1 de moléculas 3 no modifica el momento dipolar en geometrías planas (ver figuras en tabla 2.2), donde su simetría es A 1, pero modifica el momento en el eje z en una molécula piramidal, donde su simetría es A 1. La vibración ν 2 modifica la componente z del momento dipolar en ambas geometrías, y posee idéntica simetría que la ν 1 en la piramidal (A 1 ), pero distinta en la plana (A 2 y A 1 ). Esto se puede entender bien por teoría de grupos, observando la siguiente tabla: D 3h D 3h E 2C 3 3C 2 σ h 2S 3 3σ v A x 2 +y 2, z 2 A z C 3v C 3v E 2C 3 3σ v A z x 2 +y 2, z 2
6 Licenciatura en Química. Universidad de Alcalá Tema 2: Espectroscopía vibracional 17 Tabla 2.2. Modos normales y su actividad en IR y Raman para moléculas 3 Moléculas planas, D 3h (ejemplo: 10 BF 3 gas) Moléculas piramidales, C 3v (ejemplo:n 3 gas) Vibración Simetría Actividad ν(cm -1 ) Vibración Simetría Actividad ν(cm -1 ) ν 1 (tensión) A 1 Raman 888 ν 1 (tensión) A 1 IR y Raman 3337,5, 3335,9 (*) ν 2 (flexión) A 2 IR 718 ν 2 (flexión) A 1 IR y Raman 968,1, 931,6 (*) ν 3a (tensión) ν 3a (tensión) ν 3b (tensión) E IR y Raman 1505 ν 3b (tensión) E IR y Raman 3414 ν 4a (flexión) ν 4a (flexión) ν 4b (flexión) E IR y Raman 482 ν 4b (flexión) E IR y Raman 1627,5 ν 1 (A 1 ) tensión simétrica ν 2 (A 2 ) flexión fuera del plano ν 1 (A 1 ) tensión simétrica ν 2 (A 1 ) flexión simétrica ν 3 (E) tensión asimétrica ν 4 (E) flexión asimétrica ν 3 (E ) tensión asimétrica ν 4 (E ) flexión * Desdoblada debido a la resonancia de Fermi. Las representaciones A 1 y A 2 de un grupo D 3h se diferencian justamente en su comportamiento frente a las operaciones de simetría que distingue a este grupo del C 3v, por lo que en éste último grupo se agrupan en una única representación A 1. La correlación entre las representaciones irreducibles de un grupo y las de sus subgrupos se recogen en las Tablas de descenso de simetría. Un grupo de sim etría es subgrupo de otro cuando todas las operaciones de simetría del primero son operaciones de simetría del segundo. Una segunda razón por la que puede aumentar el número de bandas activas al disminuir la simetría es por desdoblamiento de modos normales degenerados. La tabla 2.3 muestra los modos normales de vibración de la molécula de metano. La tabla 2.4 correlaciona los modos normales de una molécula tetraédrica 4 (T d ) con los de moléculas derivadas de la sustitución de uno o más átomos de por Z. La gráfica que la acompaña compara dos modos de tensión de una molécula 4 con los análogos de una molécula 3 Z. En resumen, la reducción de simetría de una molécula puede aumentar el número de bandas activas por desdoblamiento de modos normales degenerados en la alta simetría pero no en la baja, y por aparición de bandas inactivas en la alta simetría pero no en la baja.
7 18 Determinación estructural de compuestos inorgánicos Tabla 2.3. Modos normales y su actividad en IR y Raman para moléculas tetraédricas, T d (ejemplo: C 4 gas) Vibración Simetría Actividad ν(cm -1 ) ν 1 (tensión) A 1 Raman 2917 ν 2a (flexión) ν 2b (flexión) E Raman 1534 ν 3a (tensión) ν 3b (tensión) T 2 IR y Raman 3019 ν 3c (tensión) ν 4a (flexión) ν 4b (flexión) T 2 IR y Raman 1306 ν 4c (flexión) ν 1 (A 1 ) tensión simétrica ν 2a (E) flexión ν 3a (T 2 ) tensión asimétrica ν 4a (T 2 ) flexión Tabla 2.4. Correlación de modos normales para moléculas tetraédricas 4 (T d ) 3 Z(C 3v ) 2 2 (C 2v ) Sim. Actividad Sim. Actividad Sim. Actividad A 1 Raman A 1 IR, Raman A 1 IR, Raman A 1 IR, Raman E Raman E IR, Raman A 2 Raman A 1 IR, Raman A 1 IR, Raman T 2 T 2 IR y Raman IR y Raman B 1 IR, Raman E IR, Raman B 2 IR, Raman A 1 IR, Raman A 1 IR, Raman E IR, Raman B 1 B 2 IR, Raman IR, Raman A 1, tensión simétrica inactiva T 2, tensión asimétrica 3 vibraciones degeneradas Z A 1, tensión simétrica activa Z A 1, tensión asimétrica vibración no degenerada Determinación parcial de las vibraciones. abitualmente desearemos determinar únicamente los modos de tensión, pues son generalmente los más informativos. Por otra parte, y como veremos más adelante, las vibraciones de algunos enlaces se acoplan poco con las del resto de enlaces de la molécula. Por ejemplo, las vibraciones de tensión C del carbonilo Mn(C) 5 Br se pueden considerar independientes de las del resto de la molécula y son las más informativas ya que son intensas y aparecen en una zona del espectro donde raramente aparecen otro tipo de vibraciones. Por ello nos interesa saber cómo se determinan los modos normales de tensión C de una molécula como la anterior. Para ello, debemos considerar el comportamiento de simetría de cinco vectores situados a lo largo de los enlaces C y que representan cada uno de ellos la vibración de tensión de cada enlace individual: Br C C Mn C C C C 4v Γtensión E 5 2C 4 C 2 Γtensión(C) = 2A 1 + B 1 + E 2σ v 2σ d Luego, en el IR esperamos observar tres bandas (2A 1 + E) debidas a las vibraciones de tensión C. El análisis de vibraciones es válido también para las vibraciones Mn C, por lo que para éstas esperamos también la observación de tres bandas de idénticas simetrías. Finalmente, en el espectro de IR de dicha molécula deberíamos observar una banda para la vibración de tensión Mn Br (su simetría sería A 1 pero el que sea activa en el IR se puede deducir simplemente de la asimetría del enlace).
8 Licenciatura en Química. Universidad de Alcalá Tema 2: Espectroscopía vibracional tros aspectos Intensidad de las señales. En el infrarrojo, la intensidad de una banda depende de la variación del momento dipolar con la coordenada del modo de vibración (dµ/dx). Las bandas en el infrarrojo varían ampliamente en intensidad, incluso entre las absorciones de una misma molécula. Es posible que no se observen bandas, no por estar prohibidas sino por ser muy débiles. Así, por ejemplo, la banda de tensión CN del CN no puede ser observada por métodos convencionales por ser muy débil. Los enlaces muy polares suelen dar señales intensas (p. ej., ). Una banda prohibida puede ser tan intensa como una permitida. En Raman, la intensidad de una banda depende de la variación de la polarizabilidad con la coordenada del modo de vibración (dα/dx). La intensidad en Raman depende más de la molécula que de la naturaleza de la propia banda. Para una misma molécula, las bandas permitidas suelen ser de parecida intensidad. Por ejemplo, disolventes como el benceno o el tetracloruro de carbono absorben fuertemente en el Raman, mientras que el agua tiene absorciones muy débiles. La ausencia de una banda en Raman indica con mayor probabilidad una regla de simetría que la ausencia de una banda en el infrarrojo. Las absorciones prohibidas dan bandas mucho más débiles que las permitidas de la misma molécula, por lo que son fácilmente diferenciables. Bandas no fundamentales. Además de las transiciones que dan lugar a las bandas fundamentales, se pueden observar otras transiciones que se resumen en la tabla 2.5. Las bandas calientes deberían aparecer exactamente a la misma frecuencia que la fundamental correspondiente en un oscilador armónico, pero ya hemos señalado que un enlace químico no lo es exactamente. La aportación de estas bandas puede ser Tabla 2.5. Tipos de transiciones vibracionales v 1 = 3 (d) (b) v 1 = 2 v 2 = 3 v 1 = 1 (d) (b) v 1 = 1, v 2 = 1 (c) (c) (d) (d) (b) (b) v 2 = 2 (a) (e) (f) (a) v 2 = 1 v 1 = 0, v 2 = 0 Transiciones formalmente permitidas ( ν i = ±1) Transiciones formalmente prohibidas ( ν i ±1) Nombre Símbolo Ejemplos Nombre Símbolo Ejemplos a) Banda fundamental ν i v 1 = 0 v 1 = 1 d) Sobretono (1º, 2º, ) 2ν i, 3ν i, v 1 = 0 v 1 = 2 v 2 = 0 v 2 = 1 v 2 = 0 v 2 = 3 b) Banda caliente (n+1)ν i nν i v 1 = 2 v 1 = 3 e) Banda de combinación ν i + ν j v 1 = 0, v 2 = 0 v 1 = 3 v 1 = 4 v 1 = 1, v 2 = 1 c) Banda caliente v 1 = 1, v 2 = 0 v 1 = 1, v 2 = 1 f) Banda de diferencia ν i ν j v 1 = 0, v 2 = 1 v 1 = 1, v 2 = 0
9 20 Determinación estructural de compuestos inorgánicos significativa para vibraciones de baja energía (hasta cm 1 ) en las que la ocupación de los estados excitados no es despreciable. Los sobretonos, bandas de combinación y de diferencia, formalmente prohibidas para un oscilador armónico, pueden observarse y ser confundidas con otras (principalmente en el IR por las razones señaladas anteriormente). La actividad de estas transiciones, una vez violada la regla fundamental v = ±1, es gobernada por las mismas reglas de selección de simetría que se aplican a las fundamentales. La representación de un sobretono o de una banda de combinación se obtiene haciendo el producto directo de las representaciones de las vibraciones combinadas, Γ = Γ i. Γ j. Por ejemplo, la simetría del primer sobretono de la vibración v 2 (A 2 ) de una molécula 3 plana (D 3h ) es Γ = A 2 A 2 = A 1 (este resultado puede ser obtenido a mano o utilizando las Tablas de productos directos ). Sobretonos y bandas de combinación pueden a veces dar lugar a bandas inusualmente fuertes en los espectros IR y Raman, compartiendo su intensidad con una banda fundamental cercana de la misma simetría (resonancia de Fermi, figura 2.7) cm 1 ν 1 fundamental, Σ + g 1334 cm 1 2ν 2 1º sobretono, Π u Π u = Σ + g 1388 cm cm 1 ν + ν 667 cm 1 inact. Raman, Π u ν 2 ν 2 niveles sin mezclar niveles resultantes (Resonancia de Fermi) Figura 2.7. Resonancia de Fermi. En el espectro Raman del C 2 se espera una única banda fundamental ν 1 debida a la vibración de tensión simétrica Σ + g. En su lugar, se observan dos bandas intensas a 1285 y 1388 cm 1. La explicación es que la banda fundamental debería aparecer a 1337 cm 1. Pero la vibración de flexión fundamental ν 2 (Π u ) está a 667 cm 1 y su segundo sobretono debería aparecer cerca de 1334 cm 1, próximo de ν 1. Como Π u Π u contiene Σ + g., este componente del sobretono se mezcla con la banda fundamental ν 1 dando lugar a dos bandas de intensidad similar, cada una aproximadamente 50% sobretono, 50% fundamental. El efecto de la fase en los espectros (figura 2.8). En un gas, la rotación de las moléculas está cuantizada, de forma que una transición vibracional puede ir simultáneamente acompañada del cambio en los modos rotatorios. Como en la rotación hay implicadas energías inferiores que en la vibración, el resultado es que cada banda vibracional consiste en varias líneas próximas por encima y por debajo de la de la transición que no implica cambios en el modo rotacional. En un aparato de baja resolución, únicamente se ve la envolvente de todo el conjunto de líneas, mientras que en un aparato de suficiente resolución podría observarse la estructura fina. Esta estructura no existe en fases condensadas ya que en ellas la rotación no está cuantizada. Como resultado, las bandas son más estrechas lo que tiene como ventajas una mayor intensidad y una menor probabilidad de solapamiento entre bandas. En líquidos y, sobre todo, en sólidos amorfos, las moléculas están bajo la influencia de entornos locales aleatorios. Como resultado de las diferencias entre las moléculas de la muestra, las bandas de aquellas vibraciones que interaccionen fuertemente con el entorno pueden ensancharse mucho. En un sólido cristalino, las moléculas están ordenadas y no existe el efecto de la aleatoriedad. Por ello, las señales son estrechas, sobre todo en Raman. En IR, las bandas de los sólidos pueden ensancharse por efectos de reflexión de superficie, aunque éstos se minimizan si se muele muy finamente la muestra en la preparación de ésta. El espectro de una muestra sólida puede presentar más bandas de las esperadas en base a la simetría molecular de una molécula aislada. Ello se debe a que la simetría de la molécula es reducida por el
10 Licenciatura en Química. Universidad de Alcalá Tema 2: Espectroscopía vibracional 21 entorno (figura 2.9). Una última complicación en un sólido cristalino es la aparición de modos de vibración de red, que suponen movimientos de las moléculas como tales en lugar de sus átomos. Estas Figura 2.8. Partes de los espectros de IR de una muestra (a) como gas, (b) como sólido amorfo, (c) como sólido cristalino, (d) aislada en una matriz de argón sólido. En fase gaseosa, las bandas son anchas, pero tienen formas distintivas. El sólido amorfo da señales ligeramente anchas (como también el líquido), pero el sólido cristalino tiene señales más estrechas y se observan desdoblamientos que dependen de la simetría del cristal. El espectro en matriz tiene líneas muy estrechas con pequeños desdoblamientos, que son efecto de la matriz. Las frecuencias para el gas y la matriz son aproximadamente iguales, pero las bandas están desplazadas en el resto de fases (Tomado de E. A. V. Ebsworth et al. Structural Methods in Inorganic Chemistry Blacwell Sientific Publications). Figura 2.9. Espectros IR del S 4 2 (a) en disolución y (b) en MgS cristalino. El modo que es inactivo en disolución (ν 1 ) se vuelve activo en sólido, a la vez que se rompe la triple degeneración de ν 3. (Tomado de E. A. V. Ebsworth et al. Structural Methods in Inorganic Chemistry Blacwell Sientific Publications.
11 22 Determinación estructural de compuestos inorgánicos vibraciones aparecen a bajas frecuencias (las interacciones entre moléculas son débiles) y pueden ser obviadas salvo en el caso de estudio del IR lejano. Sin embargo, podrían combinarse con modos de alta frecuencia complicando la interpretación de los espectros. Una muestra puede también prepararse en matrices de gas inerte (por ejemplo, argón) mediante congelación de soluto y gas inerte en proporción 1:500 a muy bajas temperaturas (10 15 K). En estas condiciones las moléculas están aisladas, como en el gas, pero no hay acoplamiento vibración rotación. Frecuencias de grupo. Se observa que las frecuencias de un grupo dado, sobre todo en el caso de las vibraciones de tensión, aparecen en rangos estrechos del espectro, independientemente de la molécula en la que el grupo se encuentra (p. ej cm 1 para tensiones C=). Estos rangos, recogidos en tablas de frecuencias de grupos (ver tablas de IR), son útiles a la hora de asignar las bandas de un espectro. Este concepto de frecuencias de grupo parece estar en contradicción con la idea expuesta anteriormente por la que las frecuencias se asignan a modos normales que implican al conjunto de la molécula. En la molécula de C 2, por ejemplo, cada uno de los dos modos normales de tensión implica al 50% a ambos enlaces C, vibrando en fase o fuera de fase, lo que explica las dos frecuencias observadas (dos vibraciones puras de dos enlaces C iguales absorberían a la misma frecuencia). Sin embargo, los dos enlaces de una molécula disimétrica Z pueden participan en proporción muy diferente en cada modo de tensión. Si los parámetros vibratorios de los enlaces e Z (masa y fuerza) difieren suficientemente, cada modo estará básicamente asociado con la vibración en un enlace. En otras palabras, si Z fuera mucho más ligero que, la vibración del enlace Z no afectaría ni sería afectada por la del resto de la molécula. Como norma general, se puede suponer que las vibraciones de cada grupo son independientes del resto de la molécula, sobre todo en el caso de grupos como, N, N 2, C 2, C 3, C, C halógeno, metal halógeno, etc. En ocasiones, deberemos tener en cuenta que la vibración de un grupo puede estar fuertemente acoplada con la del resto de la molécula. Así, por ejemplo, las vibraciones N B y B F en el complejo 3 N BF 3 están fuertemente acopladas. Las frecuencias de vibración de un grupo particular dependen de las masas de los átomos enlazados y de la constante de fuerza de los enlaces. Para las vibraciones de tensión, se pueden dar unas tendencias generales: Las frecuencias de tensión son menores para los átomos pesados. Las frecuencias de tensión son menores para los enlaces débiles. Las frecuencias de tensión varían muy poco en conjuntos de compuestos relacionados. Las frecuencias de las vibraciones de flexión son mucho más variables aunque también pueden aparecer en rangos característicos. Cuando existen varios modos posibles de coordinación de un ligando a un metal, las frecuencias de vibración permiten establecer en muchos casos el modo existente en un complejo dado. Así, los modos de coordinación nitro y nitrito del N 2 se distinguen porque las dos vibraciones de tensión N aparecen a frecuencias próximas en el complejo nitro pero distantes en el nitrito, donde una está asociada con la vibración del enlace sencillo N puente y la otra con el enlace doble N= terminal (tabla 2.6). Por otra parte, los dos modos más habituales de coordinación del grupo carbonilo se distinguen fácilmente por la frecuencia de sus vibraciones de tensión C: cm 1 para carbonilos terminales, cm 1 para carbonilos puente. Las vibraciones de tensión C son particularmente interesantes porque aparecen en una zona limpia del espectro, en la que otras vibraciones son muy poco frecuentes. La frecuencia de tensión de un carbonilo metálico se puede relacionar con la retrodonación π del metal al C: la retrodonación debilita el enlace C y, por tanto, hace descender la frecuencia de vibración.
12 Licenciatura en Química. Universidad de Alcalá Tema 2: Espectroscopía vibracional 23 Tabla 2.6. Vibraciones de tensión de complejos del N 2 Modo coordinación ν a (N, cm 1 ) ν s (N, cm 1 ) N 2 libre K 3 [Co(N 2 ) 6 ] M N nitro ν (N=, cm 1 ) ν (N, cm 1 ) [Co(N 3 ) 5 (N)] M N nitrito Efecto de los isótopos. La frecuencia de vibración es dependiente de la masa de los átomos, por lo que los diferentes isótopos dan señales a frecuencias diferentes. /D es el caso en el que la variación de la masa es proporcionalmente mayor y, por tanto, en el que se producen los máximos desplazamientos isotópicos (tabla 2.7). Tabla 2.7. Vibraciones de tensión del hidrógeno molecular Vibración 2 D D 2 ν (cm 1 ) 4395,2 3817,1 3118,5 El efecto isotópico es menor para los átomos del 2º período. Para los elementos del 3º y siguientes periodos, los desplazamientos isotópicos son menores de 1 2 cm 1. El efecto isotópico puede ser aprovechado para la identificación y asignación de bandas. Por ejemplo, de la comparación de los siguientes datos se deduce que la banda que aparece a 1934 cm 1 en [Co(C) 4 ] debe asignarse a la vibración Co. Complejo ν (C) y ν (Co o Co D) en cm 1 [Co(C) 4 ] 2121, 2062, 2043, 1934 [Co(C) 4 D] 2120, 2058, 2043, 1396 Bibliografía complementaria K. Nakamoto Infrared and Raman Spectra, Wiley Interscience, New ork, 4ªed., 1986, 484 páginas. I. S. Butler, J. F. arrod Química Inorgánica. Principios y aplicaciones, Addison Wesley Iberoamericana, 1992, 780 páginas, capítulo 6. Seminarios 2.1 Cuáles de los siguientes modos normales de vibración de una molécula bipiramidal trigonal M 5 son activos en el infrarrojo? Qué etiqueta corresponde a su comportamiento de simetría? M M M (a) (b) (c) 2.2 El espectro de Raman en estado vapor del ef 4 exhibe tres bandas a 554, 524 y 218 cm 1, mientras que en el infrarrojo se observan otras tres a 586, 291 y 123 cm 1. La geometría de esta molécula, es plano cuadrada o tetraédrica?
13 24 Determinación estructural de compuestos inorgánicos 2.3 Demuestra que los siguientes datos vibracionales para el [InCl 2 ] son congruentes con una geometría angular. IR y Raman: 328, 291 y 177 cm El complejo [PdCl 4 ] 2 presenta las siguientes bandas de tensión Pd Cl en el espectro vibracional: 321 (IR), 303 (Raman), 275 (Raman). az una propuesta sobre su geometría. 2.5 El espectro IR de agrupaciones M 2 n+ presenta en la zona de vibraciones de tensión M=: a) dos bandas para especies como V 2 +, Mo 2 2+ o W 2 2+ (en las zonas y cm 1 ), b) una banda para especies como U 2 2+, Np 2 2+, Pu 2 2+ o Am 2 2+ (en la zona cm 1 ). Señala las especies cis y las trans. 2.6 El complejo planocuadrado [PtCl 2 (N 3 ) 2 ] se puede presentar en dos formas isómeras. Las bandas asignadas a las vibraciones Pt-Cl de uno de los isómeros aparecen a 365 cm 1 (IR) y 318 cm 1 (Raman). Cuál es dicho isómero?. 2.7 Muestra como un estudio de los espectros IR y Raman de PF 4 en estado líquido puede servir para decidir entre las dos posibles estructuras basadas en una coordinación de bipirámide trigonal en torno al fósforo. 2.8 El espectro vibracional del pentacarbonilo de hierro en estado líquido presenta las siguientes absorciones la zona de ν(c): 2114 (Raman), 2031 (IR, Raman), 1994 (IR), 1984 (Raman) cm 1. az una propuesta sobre su geometría. 2.9 El tratamiento de Mn(C) 5 Br con Br produce el compuesto carbonilo aniónico octaédrico [Mn(C) 4 Br 2 ], que muestra cuatro picos ν(c) en su espectro de IR en una disolución de C 2 Cl 2. Cuál es la estructura de este complejo aniónico? 2.10 La simetría del ion nitrato se reduce a C 2v cuando se coordina monodentado a un metal. Qué efecto se observará en el espectro IR? 2.11 En el espectro del BF 3, las bandas IR que corresponden a vibraciones de tensión B F asimétricas muestran un desdoblamiento marcado debido a la presencia de cantidades significativas tanto de 10 B como de 11 B en el boro natural. Sin embargo, la banda Raman a 888 cm 1, que se asigna a la vibración de tensión simétrica B F no muestra tales efectos isotópicos. Por qué? Soluciones a los seminarios 2.1 Son activos (a) y (c). Grupo de simetría D 3h (a) A 2, (b) A 1, (c) A En la estructura tetraédrica (T d ), los 9 modos normales de vibración se distribuyen de la siguiente forma: A 1 (R) + E(R) + 2 T 2 (IR,R), mientras que en la estructura plano cuadrada (D 4h ), los modos son: A 1g (R) + B 1g (R) + B 2g (R) + A 2u (IR) + B 2u (-) + 2 E u (IR). Por ello, se propone la estructura plano cuadrada. 2.3 En una estructura A 2 angular (C 2v ), los 3 modos normales de vibración se distribuyen de la siguiente forma: 2 A 1 (IR,R) + B 2 (IR,R). Por tanto, los datos mostrados son coherentes con la estructura angular (3 bandas coincidentes en IR y Raman). 2.4 Para una estructura tetraédrica (T d ), los 4 modos normales de tensión Pd Cl se distribuyen de la siguiente forma: A 1 (R), T 2 (IR,R). Se esperaría 1 banda que aparecería únicamente en el Raman y 1 banda que aparecería tanto en IR como Raman. Para una estructura plano cuadrada (D 4h ), los 4 modos normales de tensión Pd Cl se distribuyen de la siguiente forma: A 1g (R), B 1g (R), E u (IR). Se esperarían 2 bandas que aparecerían únicamente en el Raman y 1 banda que aparecería únicamente en IR. Por ello se propone una estructura plano cuadrada. 2.5 Los dos modos normales de tensión de un grupo A 2 son el simétrico y la antisimétrico. Para una disposición lineal (D h ), el modo simétrico (Σ + g ) es inactivo en el IR, mientras que el simétrico (Σ+ u ) es activo. En una angular (C 2v ), tanto el simétrico (A 1 ) como el antisimétrico (B 2 ) son activos en IR. En (a), aparecen 2 bandas en IR, por lo que la disposición es angular, mientras que en (b), la presencia de una única banda parece indicar que se trata de una disposición lineal. 2.6 Se trata del isómero trans. 2.7 Para una estructura con el hidrógeno en posición axial (C 3v ) se espera: Bandas de tensión: 3A 1 (IR, R) + E(IR,R) Bandas de flexión A 1 (IR, R) + 3E(IR,R) Para una estructura con el hidrógeno en posición ecuatorial (C 2v ) se espera: Bandas de tensión: 3A 1 (IR, R) + B 1 (IR, R) + B 2 (IR,R) Bandas de flexión 2A 1 (IR, R) + A 2 (R) + 2B 1 (IR, R) + 2B 2 (IR,R) El número de bandas activas en IR y Raman difiere entre ambas estructuras posibles. 2.8 Estructura de pirámide de base cuadrada (C 4v ): 2A 1 (IR, R) + E(IR, R) + B 1 (R).
14 Licenciatura en Química. Universidad de Alcalá Tema 2: Espectroscopía vibracional 25 Estructura de bipirámide trigonal (D 3h ): 2A 1 (R) + E (IR, R) + A 2 (IR). Por ello, se propone la estructura de bipirámide trigonal (4 bandas: 2 activas sólo en Raman, 1 sólo en IR, y 1 en IR y R). 2.9 Pueden existir dos isómeros octaédricos, uno con los átomos de bromo en cis (C 2v ) y el otro en trans (D 4h ). Los 4 modos normales de vibración C presentan simetrías 2A 1 (IR, R) + B 1 (IR, R) + B 2 (IR,R) para la primera disposición (4 bandas C activas en el IR en total), y A 1g (R) + B 1g (R) + E u (IR) para la segunda (1 banda C activa en el IR). Por tanto, se trata del isómero cis Vibraciones de tensión y actividad en IR para una estructura plana 3 (D 3h ): A 1 inactiva, E activa. Por reducción de simetría a C 2v : A 1 A 1 (activa), E A 1 (activa) + B 2 (activa). Se pasa de una a tres bandas de tensión nitrógeno oxígeno activas en el IR La vibración de tensión simétrica, a diferencia de las antisimétricas (ver tabla 2.2), no supone desplazamiento del átomo central que, en este caso, es el boro. Por tanto, su frecuencia no es sensible a la masa de éste.
TEMA 5: INTRODUCCIÓN A LA SIMETRÍA MOLECULAR
 Tema 5 Simetría Molecular 1 TEMA 5: INTRODUCCIÓN A LA SIMETRÍA MOLECULAR La simetría de una molécula determina muchas de sus propiedades e incluso determina cómo se producen algunas reacciones. El estudio
Tema 5 Simetría Molecular 1 TEMA 5: INTRODUCCIÓN A LA SIMETRÍA MOLECULAR La simetría de una molécula determina muchas de sus propiedades e incluso determina cómo se producen algunas reacciones. El estudio
Espectroscopia de absorción visible-ultravioleta
 Práctica 6 Espectroscopia de absorción visible-ultravioleta Objetivo Parte A.- Comprobación de la Ley de Beer-Lambert y determinación del coeficiente de absorción molar para disoluciones acuosas de NiSO
Práctica 6 Espectroscopia de absorción visible-ultravioleta Objetivo Parte A.- Comprobación de la Ley de Beer-Lambert y determinación del coeficiente de absorción molar para disoluciones acuosas de NiSO
La radiación es el transporte o la propagación de energía en forma de partículas u
 La radiación es el transporte o la propagación de energía en forma de partículas u ondas. Si la radiación es debida a fuerzas eléctricas o magnéticas se llama radiación electromagnética. Pero la materia
La radiación es el transporte o la propagación de energía en forma de partículas u ondas. Si la radiación es debida a fuerzas eléctricas o magnéticas se llama radiación electromagnética. Pero la materia
La geometría molecular viene dada por la distribución de los átomos periféricos unidos al átomo central.
 Estructuras moleculares: Modelo VSPR (RPECV) Las estructuras de Lewis son útiles para establecer la distribución de los pares electrónicos en las moléculas pero no aportan nada sobre su previsible geometría.
Estructuras moleculares: Modelo VSPR (RPECV) Las estructuras de Lewis son útiles para establecer la distribución de los pares electrónicos en las moléculas pero no aportan nada sobre su previsible geometría.
1.-La Cristalografía. 2.-Simetría
 1.-La Cristalografía La Cristalografía es la ciencia que se ocupa de los sólidos cristalinos y describe su estructura interna, es decir, como están distribuidos los átomos en su interior. También estudia
1.-La Cristalografía La Cristalografía es la ciencia que se ocupa de los sólidos cristalinos y describe su estructura interna, es decir, como están distribuidos los átomos en su interior. También estudia
ANÁLISIS DEL ESTADO DE POLARIACIÓN
 SESIÓN 5: ANÁLISIS DEL ESTADO DE POLARIACIÓN TRABAJO PREVIO CONCEPTOS FUNDAMENTALES Luz natural Luz con el vector eléctrico vibrando en todas las direcciones del plano perpendicular a la dirección de propagación.
SESIÓN 5: ANÁLISIS DEL ESTADO DE POLARIACIÓN TRABAJO PREVIO CONCEPTOS FUNDAMENTALES Luz natural Luz con el vector eléctrico vibrando en todas las direcciones del plano perpendicular a la dirección de propagación.
El enlace covalente se explica mediante la Teoría del Orbital Molecular (TOM).(Bueno para moléculas sencillas, complicado para las complejas).
 . Aplicación de la Teoría de Grupos. Moléculas triatómicas lineales y angulares. Moléculas mono y bidimensionales. Moléculas poliédricas sencillas. Objetivos: Recordar los conceptos generales del enlace
. Aplicación de la Teoría de Grupos. Moléculas triatómicas lineales y angulares. Moléculas mono y bidimensionales. Moléculas poliédricas sencillas. Objetivos: Recordar los conceptos generales del enlace
ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR
 ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR INTRODUCCIÓN La fluorescencia es un proceso de emisión en el cual las moléculas son excitadas por la absorción de radiación electromagnética. Las especies excitadas
ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR INTRODUCCIÓN La fluorescencia es un proceso de emisión en el cual las moléculas son excitadas por la absorción de radiación electromagnética. Las especies excitadas
El espectro electromagnético y los colores
 Se le llama espectro visible o luz visible a aquella pequeña porción del espectro electromagnético que es captada por nuestro sentido de la vista. La luz visible está formada por ondas electromagnéticas
Se le llama espectro visible o luz visible a aquella pequeña porción del espectro electromagnético que es captada por nuestro sentido de la vista. La luz visible está formada por ondas electromagnéticas
TEMA 8 ESTRUCTURA CRISTALINA
 Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Tema 8. Estructura cristalina 1 TEMA 8 ESTRUCTURA CRISTALINA Los sólidos pueden clasificarse: 1.- Por su ordenación: 1a. Sólidos amorfos: tienen una estructura desordenada. Sus átomos o moléculas se colocan
Teoría de repulsión de pares electrónicos de la capa de Valencia
 Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
Tema 3. Medidas de tendencia central. 3.1. Introducción. Contenido
 Tema 3 Medidas de tendencia central Contenido 31 Introducción 1 32 Media aritmética 2 33 Media ponderada 3 34 Media geométrica 4 35 Mediana 5 351 Cálculo de la mediana para datos agrupados 5 36 Moda 6
Tema 3 Medidas de tendencia central Contenido 31 Introducción 1 32 Media aritmética 2 33 Media ponderada 3 34 Media geométrica 4 35 Mediana 5 351 Cálculo de la mediana para datos agrupados 5 36 Moda 6
Espectroscopía vibracional y rotacional
 Espectroscopía vibracional y rotacional Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Curso 015-016 Problema 1 En el espectro IR de 1 C 16 se observa una señal intensa a ν =
Espectroscopía vibracional y rotacional Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Curso 015-016 Problema 1 En el espectro IR de 1 C 16 se observa una señal intensa a ν =
Tema 4 Orbítales Moleculares. Hibridación
 Tema 4 Orbítales Moleculares Orbital atómico s, p (d y f) Los orbitales atómicos se mezclan para formar nuevos orbitales híbridos hibridación o hibridización orbitales híbridos sp 3, sp 2 y sp Se altera
Tema 4 Orbítales Moleculares Orbital atómico s, p (d y f) Los orbitales atómicos se mezclan para formar nuevos orbitales híbridos hibridación o hibridización orbitales híbridos sp 3, sp 2 y sp Se altera
POTENCIAL CRITICO: Energía mínima para hacer saltar un electrón desde su orbital normal al inmediato superior expresado en ev.
 MECANISMOS DE CONDUCCION ELECTRICA EN GASES Para estudiar el proceso de conducción en gases tenemos que considerar que el gas se encuentra contenido en una ampolla de vidrio, la cual está ocupada únicamente
MECANISMOS DE CONDUCCION ELECTRICA EN GASES Para estudiar el proceso de conducción en gases tenemos que considerar que el gas se encuentra contenido en una ampolla de vidrio, la cual está ocupada únicamente
MOLÉCULAS Y FUERZAS INTERMOLECULARES
 4 MLÉULAS Y UERZAS TERMLEULARES SLUES A LAS ATVDADES DE AL DE UDAD Método RPEV e hibridación 1 Las nubes electrónicas que se dibujan en torno al átomo central en el método RPEV, son una representación
4 MLÉULAS Y UERZAS TERMLEULARES SLUES A LAS ATVDADES DE AL DE UDAD Método RPEV e hibridación 1 Las nubes electrónicas que se dibujan en torno al átomo central en el método RPEV, son una representación
SIMETRÍA. http://www.chem.ox.ac.uk/courses/molecular_symmetry/part2.html http://www.chem.ox.ac.uk/vrchemistry/sym/splash.html
 SIMETRÍA Elementos y operaciones de simetría Grupos puntuales de simetría Modelo de repulsión de pares de electrones de la capa de valencia (VSEPR) Simetría de las moléculas Tablas de caracteres http://www.chem.ox.ac.uk/courses/molecular_symmetry/part2.html
SIMETRÍA Elementos y operaciones de simetría Grupos puntuales de simetría Modelo de repulsión de pares de electrones de la capa de valencia (VSEPR) Simetría de las moléculas Tablas de caracteres http://www.chem.ox.ac.uk/courses/molecular_symmetry/part2.html
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Solubilidad. y se representa por.
 Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Estudio de la evaporación
 Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
Estudio de la evaporación Volumen del líquido Tipo de líquido Superficie del recipiente Altura del recipiente Forma del recipiente Presencia de una sal disuelta Introducción Todos hemos observado que una
8.1. Introducción... 1. 8.2. Dependencia/independencia estadística... 2. 8.3. Representación gráfica: diagrama de dispersión... 3. 8.4. Regresión...
 Tema 8 Análisis de dos variables: dependencia estadística y regresión Contenido 8.1. Introducción............................. 1 8.2. Dependencia/independencia estadística.............. 2 8.3. Representación
Tema 8 Análisis de dos variables: dependencia estadística y regresión Contenido 8.1. Introducción............................. 1 8.2. Dependencia/independencia estadística.............. 2 8.3. Representación
1. Fundamento teórico
 1 1. Fundamento teórico Los métodos espectroscópicos atómicos y moleculares figuran entre los métodos analíticos instrumentales más utilizados. La espectroscopia molecular basada en la radiación ultravioleta,
1 1. Fundamento teórico Los métodos espectroscópicos atómicos y moleculares figuran entre los métodos analíticos instrumentales más utilizados. La espectroscopia molecular basada en la radiación ultravioleta,
Solución de los problemas del Capítulo 1
 Nota: los valores de las constantes que puede necesitar para los cálculos están dados en la bibliografía de referencia. Complete la siguiente tabla Qué información mínima se necesita para caracterizar
Nota: los valores de las constantes que puede necesitar para los cálculos están dados en la bibliografía de referencia. Complete la siguiente tabla Qué información mínima se necesita para caracterizar
Orbitales híbridos. Cajón de Ciencias
 Orbitales híbridos Cajón de Ciencias Los orbitales híbridos son aquellos que se forman por la fusión de otros orbitales. Estudiarlos es un paso básico para entender la geometría y la estructura de las
Orbitales híbridos Cajón de Ciencias Los orbitales híbridos son aquellos que se forman por la fusión de otros orbitales. Estudiarlos es un paso básico para entender la geometría y la estructura de las
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS ORBITALES ATÓMICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS Integrantes: Walter Bermúdez Lizbeth Sánchez Curso: Jueves 10:00 a 12:00 ORBITALES ATÓMICOS 1.- Definición de
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS ESPECTROSCOPICOS Integrantes: Walter Bermúdez Lizbeth Sánchez Curso: Jueves 10:00 a 12:00 ORBITALES ATÓMICOS 1.- Definición de
Corresponde a la operación que consiste en no hacer nada. Todos los objetos poseen al menos este elemento
 ELEMENTOS Y OPERACIONES DE SIMETRÍA Identidad (E) Corresponde a la operación que consiste en no hacer nada. Todos los objetos poseen al menos este elemento Eje de simetría (Cn) Eje que pasa por el objeto
ELEMENTOS Y OPERACIONES DE SIMETRÍA Identidad (E) Corresponde a la operación que consiste en no hacer nada. Todos los objetos poseen al menos este elemento Eje de simetría (Cn) Eje que pasa por el objeto
Fracción másica y fracción molar. Definiciones y conversión
 Fracción másica y fracción ar. Definiciones y conversión Apellidos, nombre Atarés Huerta, Lorena (loathue@tal.upv.es) Departamento Centro Departamento de Tecnología de Alimentos ETSIAMN (Universidad Politécnica
Fracción másica y fracción ar. Definiciones y conversión Apellidos, nombre Atarés Huerta, Lorena (loathue@tal.upv.es) Departamento Centro Departamento de Tecnología de Alimentos ETSIAMN (Universidad Politécnica
Tema 2: Propiedades y medición de la radiación electromagnética
 Tema 2: Propiedades y medición de la radiación electromagnética Espectro de la radiación electromagnética Conceptos básicos para la medición: Densidad de flujo Luminosidad Intensidad Brillo superficial
Tema 2: Propiedades y medición de la radiación electromagnética Espectro de la radiación electromagnética Conceptos básicos para la medición: Densidad de flujo Luminosidad Intensidad Brillo superficial
Tema 1. Operaciones y elementos de simetría. Objetivos:
 Tema 1. Operaciones y elementos de simetría. Objetivos: Reconocer los elementos de simetría de una molécula Enunciar las operaciones de simetría generadas por cada elemento de simetría Combinar dos operaciones
Tema 1. Operaciones y elementos de simetría. Objetivos: Reconocer los elementos de simetría de una molécula Enunciar las operaciones de simetría generadas por cada elemento de simetría Combinar dos operaciones
Lecturas previas a las clases del 14 y 20 de diciembre (Tema 20)
 Lecturas previas a las clases del 14 y 20 de diciembre (Tema 20) La lectura de los epígrafes que se indican y del resumen que sigue es indispensable para las clases magistrales del 14 y 20 de diciembre
Lecturas previas a las clases del 14 y 20 de diciembre (Tema 20) La lectura de los epígrafes que se indican y del resumen que sigue es indispensable para las clases magistrales del 14 y 20 de diciembre
Modelo corpuscular elemental de la materia
 Modelo corpuscular elemental de la materia Todo lo que es materia sean sólidos, líquidos o gases, está constituida por átomos y moléculas. Sin embargo el diferente aspecto que observamos de una misma sustancia,
Modelo corpuscular elemental de la materia Todo lo que es materia sean sólidos, líquidos o gases, está constituida por átomos y moléculas. Sin embargo el diferente aspecto que observamos de una misma sustancia,
Covarianza y coeficiente de correlación
 Covarianza y coeficiente de correlación Cuando analizábamos las variables unidimensionales considerábamos, entre otras medidas importantes, la media y la varianza. Ahora hemos visto que estas medidas también
Covarianza y coeficiente de correlación Cuando analizábamos las variables unidimensionales considerábamos, entre otras medidas importantes, la media y la varianza. Ahora hemos visto que estas medidas también
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio 2, Opción B Reserva 2, Ejercicio 2, Opción A Reserva, Ejercicio 2, Opción A Reserva, Ejercicio, Opción B
CARACTERIZACIÓN DE ISÓMEROS ÓPTICOS POR POLARIMETRÍA
 CARACTERIZACIÓN DE ISÓMEROS ÓPTICOS POR POLARIMETRÍA OBJETIVO Caracterizar los diastereoisómeros puros del complejo [Co(en) 3 ]. 3 I 3 previamente sintetizado por medio de la medición de su actividad óptica
CARACTERIZACIÓN DE ISÓMEROS ÓPTICOS POR POLARIMETRÍA OBJETIVO Caracterizar los diastereoisómeros puros del complejo [Co(en) 3 ]. 3 I 3 previamente sintetizado por medio de la medición de su actividad óptica
Soluciones Problemas Capítulo 3: Mecánica cuántica I. λ (nm)
 Soluciones Problemas Capítulo 3: Mecánica cuántica I ) (a) La distribución espectral viene dada por R(λ) (/4)cu(λ), donde u(λ) es la densidad de energía radiada que a su vez viene dada por la ley de Planck:
Soluciones Problemas Capítulo 3: Mecánica cuántica I ) (a) La distribución espectral viene dada por R(λ) (/4)cu(λ), donde u(λ) es la densidad de energía radiada que a su vez viene dada por la ley de Planck:
CAPÍTULO 20 ESPECTROMETRÍA DE MASAS. Rosamil Rey, Ph.D. CHEM 4160
 CAPÍTULO 20 ESPECTROMETRÍA DE MASAS Rosamil Rey, Ph.D. CHEM 4160 INTRODUCCIÓN La espectrometría de masas no es una espectroscopia de absorción como IR, RMN y UV. Es el registro gráfico que sufre una molécula
CAPÍTULO 20 ESPECTROMETRÍA DE MASAS Rosamil Rey, Ph.D. CHEM 4160 INTRODUCCIÓN La espectrometría de masas no es una espectroscopia de absorción como IR, RMN y UV. Es el registro gráfico que sufre una molécula
Divisibilidad y números primos
 Divisibilidad y números primos Divisibilidad En muchos problemas es necesario saber si el reparto de varios elementos en diferentes grupos se puede hacer equitativamente, es decir, si el número de elementos
Divisibilidad y números primos Divisibilidad En muchos problemas es necesario saber si el reparto de varios elementos en diferentes grupos se puede hacer equitativamente, es decir, si el número de elementos
FICHA DE CONSULTA DE EXCURSIÓN POR LA RED ELÉCTRICA
 FICHA DE CONSULTA Sumario 1. Glosario 1.1. Siglas 3 1.2. Términos 3 2. Paneles solares 2.1. Qué es un panel solar? 4 2.2. Cómo funciona un panel solar? 6 2 1. Glosario 1.1. Siglas 1.2. Términos W/m² Watts
FICHA DE CONSULTA Sumario 1. Glosario 1.1. Siglas 3 1.2. Términos 3 2. Paneles solares 2.1. Qué es un panel solar? 4 2.2. Cómo funciona un panel solar? 6 2 1. Glosario 1.1. Siglas 1.2. Términos W/m² Watts
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA
 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA PROGRAMA DE INGENIERIA DE ALIMENTOS 211612 TRANSFERENCIA DE MASA ACTIVIDAD 11 RECONOCIMIENTO UNIDAD 3 BOGOTA D.C. Extracción líquido - líquido La extracción líquido-líquido,
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA PROGRAMA DE INGENIERIA DE ALIMENTOS 211612 TRANSFERENCIA DE MASA ACTIVIDAD 11 RECONOCIMIENTO UNIDAD 3 BOGOTA D.C. Extracción líquido - líquido La extracción líquido-líquido,
CONDENSACIÓN DE BOSE-EINSTEIN EN UN POTENCIAL ARMÓNICO
 CONDENSACIÓN DE BOSE-EINSTEIN EN UN POTENCIAL ARMÓNICO ÍNDICE ÍNDICE... 2 CONDENSACIÓN DE BOSE-EINSTEIN EN UN POTENCIAL ARMÓNICO... 3 INTRODUCCIÓN... 3 FUNDAMENTO TEÓRICO... 3 RESULTADOS OBTENIDOS... 5
CONDENSACIÓN DE BOSE-EINSTEIN EN UN POTENCIAL ARMÓNICO ÍNDICE ÍNDICE... 2 CONDENSACIÓN DE BOSE-EINSTEIN EN UN POTENCIAL ARMÓNICO... 3 INTRODUCCIÓN... 3 FUNDAMENTO TEÓRICO... 3 RESULTADOS OBTENIDOS... 5
UNIDAD 1 CONCEPTOS BÁSICOS PARA EL ESTUDIO DE ARMONÍA
 UNIDAD 1 CONCEPTOS BÁSICOS PARA EL ESTUDIO DE ARMONÍA Armonía es una parte integrante de la Teoría Musical, cuyo objetivo es el estudio de los acordes (simultaneidad de tres o más sonidos) y las relaciones
UNIDAD 1 CONCEPTOS BÁSICOS PARA EL ESTUDIO DE ARMONÍA Armonía es una parte integrante de la Teoría Musical, cuyo objetivo es el estudio de los acordes (simultaneidad de tres o más sonidos) y las relaciones
CARACTERÍSTICAS DE LA MATERIA
 LA MATERIA CARACTERÍSTICAS DE LA MATERIA - Todo lo que existe en el universo está compuesto de Materia. - La Materia se clasifica en Mezclas y Sustancias Puras. - Las Mezclas son combinaciones de sustancias
LA MATERIA CARACTERÍSTICAS DE LA MATERIA - Todo lo que existe en el universo está compuesto de Materia. - La Materia se clasifica en Mezclas y Sustancias Puras. - Las Mezclas son combinaciones de sustancias
FICHEROS Y BASES DE DATOS (E44) 3º INGENIERÍA EN INFORMÁTICA. Tema 9. Reglas de Integridad
 FICHEROS Y BASES DE DATOS (E44) 3º INGENIERÍA EN INFORMÁTICA Tema 9. Reglas de Integridad 1.- Introducción. 2.- Claves Primarias. 3.- Regla de Integridad de Entidades. 4.- Claves Ajenas. 5.- Regla de Integridad
FICHEROS Y BASES DE DATOS (E44) 3º INGENIERÍA EN INFORMÁTICA Tema 9. Reglas de Integridad 1.- Introducción. 2.- Claves Primarias. 3.- Regla de Integridad de Entidades. 4.- Claves Ajenas. 5.- Regla de Integridad
Introducción al calor y la luz
 Introducción al calor y la luz El espectro electromagnético es la fuente principal de energía que provee calor y luz. Todos los cuerpos, incluído el vidrio, emiten y absorben energía en forma de ondas
Introducción al calor y la luz El espectro electromagnético es la fuente principal de energía que provee calor y luz. Todos los cuerpos, incluído el vidrio, emiten y absorben energía en forma de ondas
MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE
 CAPÍTULO 8 MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE Fuente: National Geographic - Noviembre 2000 INTRODUCCIÓN La medición de los contaminantes sirve para varias funciones tales como: Provee un criterio
CAPÍTULO 8 MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE Fuente: National Geographic - Noviembre 2000 INTRODUCCIÓN La medición de los contaminantes sirve para varias funciones tales como: Provee un criterio
TEMA 1: NOCIONES DE ESTADO SÓLIDO. La importancia de la estructura, el enlace y los estados electrónicos sobre las propiedades del material
 TEMA 1: NOCIONES DE ESTADO SÓLIDO La importancia de la estructura, el enlace y los estados electrónicos sobre las propiedades del material Sólido: Substancias elásticas rígidas, es decir, substancias que
TEMA 1: NOCIONES DE ESTADO SÓLIDO La importancia de la estructura, el enlace y los estados electrónicos sobre las propiedades del material Sólido: Substancias elásticas rígidas, es decir, substancias que
1.1. Introducción y conceptos básicos
 Tema 1 Variables estadísticas Contenido 1.1. Introducción y conceptos básicos.................. 1 1.2. Tipos de variables estadísticas................... 2 1.3. Distribuciones de frecuencias....................
Tema 1 Variables estadísticas Contenido 1.1. Introducción y conceptos básicos.................. 1 1.2. Tipos de variables estadísticas................... 2 1.3. Distribuciones de frecuencias....................
CAPÍTULO VI PREPARACIÓN DEL MODELO EN ALGOR. En este capítulo, se hablará acerca de los pasos a seguir para poder realizar el análisis de
 CAPÍTULO VI PREPARACIÓN DEL MODELO EN ALGOR. En este capítulo, se hablará acerca de los pasos a seguir para poder realizar el análisis de cualquier modelo en el software Algor. La preparación de un modelo,
CAPÍTULO VI PREPARACIÓN DEL MODELO EN ALGOR. En este capítulo, se hablará acerca de los pasos a seguir para poder realizar el análisis de cualquier modelo en el software Algor. La preparación de un modelo,
Capitulo 8 Fuerzas intermoleculares.
 Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Fuerzas intermoleculares 97 Capitulo 8 Fuerzas intermoleculares. En este tema se estudian las propiedades físicas de las sustancias moleculares en base a la magnitud de las fuerzas intermoleculares: fuerzas
Aproximación local. Plano tangente. Derivadas parciales.
 Univ. de Alcalá de Henares Ingeniería de Telecomunicación Cálculo. Segundo parcial. Curso 004-005 Aproximación local. Plano tangente. Derivadas parciales. 1. Plano tangente 1.1. El problema de la aproximación
Univ. de Alcalá de Henares Ingeniería de Telecomunicación Cálculo. Segundo parcial. Curso 004-005 Aproximación local. Plano tangente. Derivadas parciales. 1. Plano tangente 1.1. El problema de la aproximación
Espectroscopia de UV-Vis y Espectroscopia de Infrarrojo
 Espectroscopia de UV-Vis y Espectroscopia de Infrarrojo Double-click MARCIA Double-click BALAGUERA-GELVES here here to to edit edit text. text. Gisela León Colón Ph. D. UPR-Bayamón Espectroscopia y el
Espectroscopia de UV-Vis y Espectroscopia de Infrarrojo Double-click MARCIA Double-click BALAGUERA-GELVES here here to to edit edit text. text. Gisela León Colón Ph. D. UPR-Bayamón Espectroscopia y el
FUNDAMENTOS FÍSICOS DE LA RADIOASTRONOMÍA. CAPÍTULO 1. Propiedades de la radiación electromagnética
 Página principal El proyecto y sus objetivos Cómo participar Cursos de radioastronomía Material Novedades FUNDAMENTOS FÍSICOS DE LA RADIOASTRONOMÍA Índice Introducción Capítulo 1 Capítulo 2 Capítulo 3
Página principal El proyecto y sus objetivos Cómo participar Cursos de radioastronomía Material Novedades FUNDAMENTOS FÍSICOS DE LA RADIOASTRONOMÍA Índice Introducción Capítulo 1 Capítulo 2 Capítulo 3
4 Localización de terremotos
 513430 - Sismología 27 4 Localización de terremotos 4.1 Localización de sismos locales Fig 27: Gráfico de la ruptura en la superficie de una falla. La ruptura se propaga desde el punto de la nucleación,
513430 - Sismología 27 4 Localización de terremotos 4.1 Localización de sismos locales Fig 27: Gráfico de la ruptura en la superficie de una falla. La ruptura se propaga desde el punto de la nucleación,
CAPÍTULO II. FUENTES Y DETECTORES ÓPTICOS. Uno de los componentes clave en las comunicaciones ópticas es la fuente de
 CAPÍTULO II. FUENTES Y DETECTORES ÓPTICOS. 2.1 INTRODUCCIÓN. Uno de los componentes clave en las comunicaciones ópticas es la fuente de luz monocromática. En sistemas de comunicaciones ópticas, las fuentes
CAPÍTULO II. FUENTES Y DETECTORES ÓPTICOS. 2.1 INTRODUCCIÓN. Uno de los componentes clave en las comunicaciones ópticas es la fuente de luz monocromática. En sistemas de comunicaciones ópticas, las fuentes
INTRODUCCIÓN A LA TERMODINÁMICA QUÍMICA. La mecánica cuántica estudia la estructura atómica, los enlaces en moléculas y la espectroscopia.
 INTRODUCCIÓN A LA TERMODINÁMICA QUÍMICA 1. Qué es la Química Física? "La química física estudia los principios que gobiernan las propiedades el comportamiento de los sistemas químicos" El estudio de los
INTRODUCCIÓN A LA TERMODINÁMICA QUÍMICA 1. Qué es la Química Física? "La química física estudia los principios que gobiernan las propiedades el comportamiento de los sistemas químicos" El estudio de los
1. INTRODUCCIÓN 1.1 INGENIERÍA
 1. INTRODUCCIÓN 1.1 INGENIERÍA Es difícil dar una explicación de ingeniería en pocas palabras, pues se puede decir que la ingeniería comenzó con el hombre mismo, pero se puede intentar dar un bosquejo
1. INTRODUCCIÓN 1.1 INGENIERÍA Es difícil dar una explicación de ingeniería en pocas palabras, pues se puede decir que la ingeniería comenzó con el hombre mismo, pero se puede intentar dar un bosquejo
Gráfica 5.2 Acetato de cobalto 0.01M de 190 a 800nm con una absorbancia de 3.344 y λ 198.8 nm
 5- Resultados 5.1- Espectrofotometría UV/Vis de los reactivos Gráfica 5.1 Peroximonosulfato de potasio 0.01M de 190 a 800nm con una absorbancia de 365 y λ 193 nm Gráfica 5.2 Acetato de cobalto 0.01M de
5- Resultados 5.1- Espectrofotometría UV/Vis de los reactivos Gráfica 5.1 Peroximonosulfato de potasio 0.01M de 190 a 800nm con una absorbancia de 365 y λ 193 nm Gráfica 5.2 Acetato de cobalto 0.01M de
GEOMETRÍA MOLECULAR. Lic. Lidia Iñigo
 GEOMETRÍA MOLECULAR Lic. Lidia Iñigo Hemos dicho al estudiar uniones químicas que un enlace covalente es polar cuando existe cierta diferencia de electronegatividad entre los átomos que se unen. La magnitud
GEOMETRÍA MOLECULAR Lic. Lidia Iñigo Hemos dicho al estudiar uniones químicas que un enlace covalente es polar cuando existe cierta diferencia de electronegatividad entre los átomos que se unen. La magnitud
Docente: Carla De Angelis Curso: T.I.A. 5º
 POLARIMETRIA La polarimetría es una técnica que se basa en la medición de la rotación óptica producida sobre un haz de luz linealmente polarizada al pasar por una sustancia ópticamente activa. La actividad
POLARIMETRIA La polarimetría es una técnica que se basa en la medición de la rotación óptica producida sobre un haz de luz linealmente polarizada al pasar por una sustancia ópticamente activa. La actividad
No hay resorte que oscile cien años...
 No hay resorte que oscile cien años... María Paula Coluccio y Patricia Picardo Laboratorio I de Física para Biólogos y Geólogos Depto. de Física, FCEyN, UBA - 1999 Resumen: En el presente trabajo nos proponemos
No hay resorte que oscile cien años... María Paula Coluccio y Patricia Picardo Laboratorio I de Física para Biólogos y Geólogos Depto. de Física, FCEyN, UBA - 1999 Resumen: En el presente trabajo nos proponemos
ESTRUCTURAS CRISTALINAS (P2)
 ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
ESTRUCTURAS CRISTALINAS (P2) Objetivos - Visualización de estructuras de sólidos mediante el uso de modelos - Estudio de redes cristalinas basadas en ordenamientos de esferas de igual tamaño - Identificación
3.1. Tabla periódica. Para entender el comportamiento del plomo es necesario, conocer su ubicación en la tabla periódica
 III. FUNDAMENTOS TEORICOS DEL PLOMO 3.1. Tabla periódica. Para entender el comportamiento del plomo es necesario, conocer su ubicación en la tabla periódica 3.1.2. Componentes de la familia IVA de la tabla
III. FUNDAMENTOS TEORICOS DEL PLOMO 3.1. Tabla periódica. Para entender el comportamiento del plomo es necesario, conocer su ubicación en la tabla periódica 3.1.2. Componentes de la familia IVA de la tabla
TEMA 5: INTROD. AL ESTADO SÓLIDO
 ESTADO SÓLIDO Figuras p1143 y p1146, Tipler 5ª Ed SEMICONDUCTORES Figuras p1141 y p1160, Tipler 5ª Ed DISPOSITIVOS http://axxon.com.ar/zap/c-zapping0127.htm Enlace químico: fuerza que mantiene unidos los
ESTADO SÓLIDO Figuras p1143 y p1146, Tipler 5ª Ed SEMICONDUCTORES Figuras p1141 y p1160, Tipler 5ª Ed DISPOSITIVOS http://axxon.com.ar/zap/c-zapping0127.htm Enlace químico: fuerza que mantiene unidos los
Potencial eléctrico. du = - F dl
 Introducción Como la fuerza gravitatoria, la fuerza eléctrica es conservativa. Existe una función energía potencial asociada con la fuerza eléctrica. Como veremos, la energía potencial asociada a una partícula
Introducción Como la fuerza gravitatoria, la fuerza eléctrica es conservativa. Existe una función energía potencial asociada con la fuerza eléctrica. Como veremos, la energía potencial asociada a una partícula
TIPO DE CAMBIO, TIPOS DE INTERES Y MOVIMIENTOS DE CAPITAL
 TIPO DE CAMBIO, TIPOS DE INTERES Y MOVIMIENTOS DE CAPITAL En esta breve nota se intentan analizar las relaciones existentes en el sector español entre tipo de cambio, tasa de inflación y tipos de interés,
TIPO DE CAMBIO, TIPOS DE INTERES Y MOVIMIENTOS DE CAPITAL En esta breve nota se intentan analizar las relaciones existentes en el sector español entre tipo de cambio, tasa de inflación y tipos de interés,
Cap. 24 La Ley de Gauss
 Cap. 24 La Ley de Gauss Una misma ley física enunciada desde diferentes puntos de vista Coulomb Gauss Son equivalentes Pero ambas tienen situaciones para las cuales son superiores que la otra Aquí hay
Cap. 24 La Ley de Gauss Una misma ley física enunciada desde diferentes puntos de vista Coulomb Gauss Son equivalentes Pero ambas tienen situaciones para las cuales son superiores que la otra Aquí hay
Aula Banca Privada. La importancia de la diversificación
 Aula Banca Privada La importancia de la diversificación La importancia de la diversificación La diversificación de carteras es el principio básico de la operativa en mercados financieros, según el cual
Aula Banca Privada La importancia de la diversificación La importancia de la diversificación La diversificación de carteras es el principio básico de la operativa en mercados financieros, según el cual
Definición de vectores
 Definición de vectores Un vector es todo segmento de recta dirigido en el espacio. Cada vector posee unas características que son: Origen: O también denominado Punto de aplicación. Es el punto exacto sobre
Definición de vectores Un vector es todo segmento de recta dirigido en el espacio. Cada vector posee unas características que son: Origen: O también denominado Punto de aplicación. Es el punto exacto sobre
CAPÍTULO 7 7. CONCLUSIONES
 CAPÍTULO 7 7. CONCLUSIONES 7.1. INTRODUCCIÓN 7.2. CONCLUSIONES PARTICULARES 7.3. CONCLUSIONES GENERALES 7.4. APORTACIONES DEL TRABAJO DE TESIS 7.5. PROPUESTA DE TRABAJOS FUTUROS 197 CAPÍTULO 7 7. Conclusiones
CAPÍTULO 7 7. CONCLUSIONES 7.1. INTRODUCCIÓN 7.2. CONCLUSIONES PARTICULARES 7.3. CONCLUSIONES GENERALES 7.4. APORTACIONES DEL TRABAJO DE TESIS 7.5. PROPUESTA DE TRABAJOS FUTUROS 197 CAPÍTULO 7 7. Conclusiones
CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION
 CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION Como hemos dicho anteriormente, los instrumentos de medición hacen posible la observación de los fenómenos eléctricos y su cuantificación. Ahora
CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION Como hemos dicho anteriormente, los instrumentos de medición hacen posible la observación de los fenómenos eléctricos y su cuantificación. Ahora
ESTADOS DE AGREGACIÓN DE LA MATERIA
 ESADOS DE AGREGACIÓN DE LA MAERIA. Propiedades generales de la materia La materia es todo aquello que tiene masa y volumen. La masa se define como la cantidad de materia de un cuerpo. Se mide en kg. El
ESADOS DE AGREGACIÓN DE LA MAERIA. Propiedades generales de la materia La materia es todo aquello que tiene masa y volumen. La masa se define como la cantidad de materia de un cuerpo. Se mide en kg. El
TEMA 1: DETERMINACIÓN DE LA FÓRMULA MOLECULAR Y DE LOS GRUPOS FUNCIONALES Introducción
 Introducción El número de compuestos orgánicos posibles es ilimitado, cada uno de los cuales posee una estructura definida y diferente, por lo que la determinación de la estructura debe llevar a establecer
Introducción El número de compuestos orgánicos posibles es ilimitado, cada uno de los cuales posee una estructura definida y diferente, por lo que la determinación de la estructura debe llevar a establecer
Química Biológica I TP 1: ESPECTROFOTOMETRIA
 Química Biológica I TP 1: ESPECTROFOTOMETRIA OBJETIVOS: - Reforzar el aprendizaje del uso del espectrofotómetro. - Realizar espectro de absorción de sustancias puras: soluciones de dicromato de potasio.
Química Biológica I TP 1: ESPECTROFOTOMETRIA OBJETIVOS: - Reforzar el aprendizaje del uso del espectrofotómetro. - Realizar espectro de absorción de sustancias puras: soluciones de dicromato de potasio.
La Absorción del Agua
 La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
P9: ENSAYO DE VACÍO Y CORTOCIRCUITO DEL TRANSFORMADOR MONOFÁSICO FUNDAMENTOS DE TECNOLOGÍA ELÉCTRICA
 ESCUELA UNIVERSITARIA DE INGENIERÍA TÉCNICA INDUSTRIAL (BILBAO) Departamento de Ingeniería Eléctrica INDUSTRI INGENIARITZA TEKNIKORAKO UNIBERTSITATE-ESKOLA (BILBO) Ingeniaritza Elektriko Saila ALUMNO P9:
ESCUELA UNIVERSITARIA DE INGENIERÍA TÉCNICA INDUSTRIAL (BILBAO) Departamento de Ingeniería Eléctrica INDUSTRI INGENIARITZA TEKNIKORAKO UNIBERTSITATE-ESKOLA (BILBO) Ingeniaritza Elektriko Saila ALUMNO P9:
Empresa de Transmisión Eléctrica S. A. Gerencia de Hidrometeorología Cambio Climático
 Empresa de Transmisión Eléctrica S. A. Gerencia de Hidrometeorología Cambio Climático ESTÁ AMENAZADO NUESTRO PLANETA? LA ATMÓSFERA TERRESTRE Es una mezcla de varios gases y aerosoles (partículas sólidas
Empresa de Transmisión Eléctrica S. A. Gerencia de Hidrometeorología Cambio Climático ESTÁ AMENAZADO NUESTRO PLANETA? LA ATMÓSFERA TERRESTRE Es una mezcla de varios gases y aerosoles (partículas sólidas
Guía para el docente
 Guía para el docente Descripción curricular: - Nivel: 4.º Medio - Subsector: Ciencias físicas - Unidad temática: - Palabras clave: cargas en movimiento, ondas electromagnéticas, espectro electromagnético
Guía para el docente Descripción curricular: - Nivel: 4.º Medio - Subsector: Ciencias físicas - Unidad temática: - Palabras clave: cargas en movimiento, ondas electromagnéticas, espectro electromagnético
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
UNA APROXIMACION EXPERIMENTAL PARA EL ESTUDIO DE LA RADIACIÓN TERMICA DE LOS SÓLIDOS
 UNA APROXIMACION EXPERIMENTAL PARA EL ESTUDIO DE LA RADIACIÓN TERMICA DE LOS SÓLIDOS Diana Reina, Frank Mendoza, Nelson Forero 1 Universidad Distrital Francisco José de Caldas RESUMEN Se ha diseñado y
UNA APROXIMACION EXPERIMENTAL PARA EL ESTUDIO DE LA RADIACIÓN TERMICA DE LOS SÓLIDOS Diana Reina, Frank Mendoza, Nelson Forero 1 Universidad Distrital Francisco José de Caldas RESUMEN Se ha diseñado y
El H solo necesita 2 electrones en su capa de valencia como el He.
 Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Tema II. Enlace químico Concepto de enlace químico y modelos de enlace Un enlace químico se caracteriza por una situación de mínima energía, respecto a los átomos de partida que lo forman, de ahí que la
Espectrometría de Radiación gamma
 Espectrometría de Radiación gamma B.C. Paola Audicio Asistente de Radiofarmacia, CIN Fundamento La espectrometría gamma consiste en la obtención del espectro de las radiaciones gamma emitidas por los radionucleidos.
Espectrometría de Radiación gamma B.C. Paola Audicio Asistente de Radiofarmacia, CIN Fundamento La espectrometría gamma consiste en la obtención del espectro de las radiaciones gamma emitidas por los radionucleidos.
RELOJ SOLAR HORIZONTAL Esteban Esteban Atrévete con el Universo
 RELOJ SOLAR HORIZONTAL Esteban Esteban Atrévete con el Universo Características y ventajas de este tipo de reloj Está claro que si se va a trabajar en la escuela con relojes solares, el primer paso debe
RELOJ SOLAR HORIZONTAL Esteban Esteban Atrévete con el Universo Características y ventajas de este tipo de reloj Está claro que si se va a trabajar en la escuela con relojes solares, el primer paso debe
Bolilla 7: Propiedades de los Líquidos
 Bolilla 7: Propiedades de los Líquidos 1 Bolilla 7: Propiedades de los Líquidos Estudiaremos propiedades de los líquidos, derivadas de las fuerzas de cohesión entre las moléculas que lo componen. Además
Bolilla 7: Propiedades de los Líquidos 1 Bolilla 7: Propiedades de los Líquidos Estudiaremos propiedades de los líquidos, derivadas de las fuerzas de cohesión entre las moléculas que lo componen. Además
Destilación. Producto 1 más volátil que Producto 2 (P 0 1 > P0 2 ) Figura 1
 Destilación La destilación es una técnica que nos permite separar mezclas, comúnmente líquidas, de sustancias que tienen distintos puntos de ebullición. Cuanto mayor sea la diferencia entre los puntos
Destilación La destilación es una técnica que nos permite separar mezclas, comúnmente líquidas, de sustancias que tienen distintos puntos de ebullición. Cuanto mayor sea la diferencia entre los puntos
Fundamentos de Materiales - Prácticas de Laboratorio Práctica 9. Práctica 9 DETERMINACIÓN DEL ÍNDICE DE REFRACCIÓN DE MATERIALES TRANSPARENTES
 Práctica 9 DETERMINACIÓN DEL ÍNDICE DE REFRACCIÓN DE MATERIALES TRANSPARENTES 1. Objetivos docentes Familiarizarse con las propiedades ópticas de refracción y reflexión de materiales transparentes. 2.
Práctica 9 DETERMINACIÓN DEL ÍNDICE DE REFRACCIÓN DE MATERIALES TRANSPARENTES 1. Objetivos docentes Familiarizarse con las propiedades ópticas de refracción y reflexión de materiales transparentes. 2.
Cuál es tu temperatura favorita? Cuán brillante es el Sol? Educación en el cambio global Cambios en la atmósfera - Sección CA3-1
 Educación en el cambio global Cambios en la atmósfera - Sección CA3-1 CA3 Actividades Cuál es tu temperatura favorita? Si alguien te preguntase a qué temperatura te gustaría vivir, seguramente elegirías
Educación en el cambio global Cambios en la atmósfera - Sección CA3-1 CA3 Actividades Cuál es tu temperatura favorita? Si alguien te preguntase a qué temperatura te gustaría vivir, seguramente elegirías
Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción. Ajuste de reacciones de oxidación-reducción.
 Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción Concepto de oxidación-reducción Número de oxidación Ajuste de reacciones de oxidación-reducción. Estequiometría Electroquímica
Unidad 7. Reacciones de transferencia de electrones. Oxidación- Reducción Concepto de oxidación-reducción Número de oxidación Ajuste de reacciones de oxidación-reducción. Estequiometría Electroquímica
Química I. Objetivos de aprendizaje del tema
 Tema 3 Estados de la materia Objetivos de aprendizaje del tema Al finalizar el tema serás capaz de: Distinguir los estados físicos de la materia. Explicar los cambios de la materia en estado gaseoso identificando
Tema 3 Estados de la materia Objetivos de aprendizaje del tema Al finalizar el tema serás capaz de: Distinguir los estados físicos de la materia. Explicar los cambios de la materia en estado gaseoso identificando
Análisis de componentes principales
 Capítulo 2 Análisis de componentes principales 2.1. INTRODUCCIÓN El Análisis de componentes principales trata de describir las características principales de un conjunto de datos multivariantes, en los
Capítulo 2 Análisis de componentes principales 2.1. INTRODUCCIÓN El Análisis de componentes principales trata de describir las características principales de un conjunto de datos multivariantes, en los
Introducción a la Resonancia Magnética Nuclear. Química Orgánica III Primer Semestre 2014
 Introducción a la Resonancia Magnética Nuclear Química Orgánica III Primer Semestre 2014 Referencias empleadas en esta presentación: McMurry, John. Química Orgánica. 8ª. Edición. CENGAGE. Wade, L.J. Química
Introducción a la Resonancia Magnética Nuclear Química Orgánica III Primer Semestre 2014 Referencias empleadas en esta presentación: McMurry, John. Química Orgánica. 8ª. Edición. CENGAGE. Wade, L.J. Química
DIRECTRICES Y ORIENTACIONES GENERALES PARA LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD
 Curso Asignatura 2014/2015 MATEMÁTICAS II 1º Comentarios acerca del programa del segundo curso del Bachillerato, en relación con la Prueba de Acceso a la Universidad La siguiente relación de objetivos,
Curso Asignatura 2014/2015 MATEMÁTICAS II 1º Comentarios acerca del programa del segundo curso del Bachillerato, en relación con la Prueba de Acceso a la Universidad La siguiente relación de objetivos,
Geometría Tridimensional
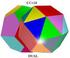 Capítulo 4 Geometría Tridimensional En dos dimensiones trabajamos en el plano mientras que en tres dimensiones trabajaremos en el espacio, también provisto de un sistema de coordenadas. En el espacio,
Capítulo 4 Geometría Tridimensional En dos dimensiones trabajamos en el plano mientras que en tres dimensiones trabajaremos en el espacio, también provisto de un sistema de coordenadas. En el espacio,
Sobre la estructura periódica de los sólidos elementales
 Sobre la estructura periódica de los sólidos elementales Gonzalo Gutiérrez * gonzalo@fisica.ciencias.uchile.cl 3 Agosto 2004 Las diferentes propiedades de los materiales se reflejan con mucha claridad
Sobre la estructura periódica de los sólidos elementales Gonzalo Gutiérrez * gonzalo@fisica.ciencias.uchile.cl 3 Agosto 2004 Las diferentes propiedades de los materiales se reflejan con mucha claridad
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 4: Vectores
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 4: Vectores Universidad Politécnica de Madrid 5 de marzo de 2010 2 4.1. Planificación
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 4: Vectores Universidad Politécnica de Madrid 5 de marzo de 2010 2 4.1. Planificación
35 Facultad de Ciencias Universidad de Los Andes Mérida-Venezuela. Potencial Eléctrico
 q 1 q 2 Prof. Félix Aguirre 35 Energía Electrostática Potencial Eléctrico La interacción electrostática es representada muy bien a través de la ley de Coulomb, esto es: mediante fuerzas. Existen, sin embargo,
q 1 q 2 Prof. Félix Aguirre 35 Energía Electrostática Potencial Eléctrico La interacción electrostática es representada muy bien a través de la ley de Coulomb, esto es: mediante fuerzas. Existen, sin embargo,
Isomería estructural o constitucional
 TEMA 7.- Estereoisomería. Isomería: constitucional y estereoisomería. Isomería óptica. Quiralidad y enantiomería. Configuraciones absoluta y relativa. Moléculas con dos o más estereocentros: diastereoisomería
TEMA 7.- Estereoisomería. Isomería: constitucional y estereoisomería. Isomería óptica. Quiralidad y enantiomería. Configuraciones absoluta y relativa. Moléculas con dos o más estereocentros: diastereoisomería
DPSS DIODE-PUMPED SOLID-STATE LASER GONZALEZ-BARBA DAVID UGALDE-ONTIVEROS JORGE ALBERTO
 DPSS DIODE-PUMPED SOLID-STATE LASER GONZALEZ-BARBA DAVID UGALDE-ONTIVEROS JORGE ALBERTO Agenda que atenderemos Breve Introducción Qué son los DPSS? Operación del DPSS Por qué el uso del diodo láser? Generación
DPSS DIODE-PUMPED SOLID-STATE LASER GONZALEZ-BARBA DAVID UGALDE-ONTIVEROS JORGE ALBERTO Agenda que atenderemos Breve Introducción Qué son los DPSS? Operación del DPSS Por qué el uso del diodo láser? Generación
E 1 E 2 E 2 E 3 E 4 E 5 2E 4
 Problemas resueltos de Espacios Vectoriales: 1- Para cada uno de los conjuntos de vectores que se dan a continuación estudia si son linealmente independientes, sistema generador o base: a) (2, 1, 1, 1),
Problemas resueltos de Espacios Vectoriales: 1- Para cada uno de los conjuntos de vectores que se dan a continuación estudia si son linealmente independientes, sistema generador o base: a) (2, 1, 1, 1),
ESTRUCTURA DE LA MATERIA QCA 09 ANDALUCÍA
 1.- Considere el elemento cuya configuración electrónica es 1s 2 2s 2 2p 6 3s 2 3p 4. a) De qué elemento se trata? b) Justifique el periodo y el grupo del sistema periódico a los que pertenece. c) Cuál
1.- Considere el elemento cuya configuración electrónica es 1s 2 2s 2 2p 6 3s 2 3p 4. a) De qué elemento se trata? b) Justifique el periodo y el grupo del sistema periódico a los que pertenece. c) Cuál
Subespacios vectoriales en R n
 Subespacios vectoriales en R n Víctor Domínguez Octubre 2011 1. Introducción Con estas notas resumimos los conceptos fundamentales del tema 3 que, en pocas palabras, se puede resumir en técnicas de manejo
Subespacios vectoriales en R n Víctor Domínguez Octubre 2011 1. Introducción Con estas notas resumimos los conceptos fundamentales del tema 3 que, en pocas palabras, se puede resumir en técnicas de manejo
