independiente de la cantidad de masa y es propio de cada sustancia c =.
|
|
|
- Emilio Camacho Acosta
- hace 8 años
- Vistas:
Transcripción
1 Tema 7 Termodinámia 7.. Calorimetría y ambios de fase Capaidad alorífia y alor espeífio. La temperatura de un uerpo aumenta uando se añade alor o disminuye uando el uerpo desprende alor. (Por el ontrario, la temperatura de un uerpo permanee onstante durante los ambios de fase). = C ΔT = m ΔT [] donde C es la apaidad alorífia o térmia y es el alor espeífio. Este último es C independiente de la antidad de masa y es propio de ada sustania =. m Dependiendo de las unidades utilizadas para medir el alor, el alor espeífio de un uerpo se mide en al/gc ó en el sistema internaional en J/kgK (o bien J/kgC ya que el grado kelvin es igual de grande que el grado entígrado). El alor espeífio molar se define omo la apaidad alorífia por mol: C m ' = = = M siendo M la masa moleular. n n En la tabla se observa que todos los metales tienen aproximadamente el mismo alor espeífio molar (ver..) Unidades de medida del alor. Puesto que el alor es una forma de energía, en el sistema internaional se mide en julios. El alor también se puede medir en alorías. Una aloría es el alor neesario para aumentar en un grado Celsius la temperatura de un gramo de agua. Siendo más
2 preisos, la aloría se define omo el alor neesario para aumentar un gramo de agua desde 4.5ºC asta 5.5ºC a nivel del mar. al = 4.84 J 0.4 al = J Cabe destaar que el valor alório de los alimentos se mide en Cal (on mayúsula, Cal = kal) y que se determina quemando los alimentos en una bomba de alor. El Btu (Britis termal unit) es el alor neesario para aumentar un grado Fareneit una libra de agua. Btu = 5 al. Es muy importante reordar que el alor espeífio del agua es al/gc. Esta antidad equivale a 484 J/kgK en el sistema internaional. El alor espeífio del agua es muy elevado en omparaión on otras muas sustanias. El elevado alor espeífio del agua ae que ésta neesite grandes antidades de alor para ambiar su temperatura. Por ello, los mares pueden eder (en invierno) o absorber (en verano) grandes antidades de alor variando muy poo su temperatura Cambios de fase y alor latente. Los ambios de fase referentes al estado de la materia son: Solidifiaión: líquido a sólido. Fusión: sólido a líquido. aporizaión: líquido a gas (la evaporaión es una vaporizaión lenta) Condensaión: (gas a líquido) Sublimaión: sólido a gas o de gas a sólido (sin pasar por líquido) Existen muos tipos de ambios de fase relaionados on ualquier araterístia. Así existen ambios de fase ristalina, ambios de fase en el estado de propagaión de un líquido (turbulento-laminar),. En general, los ambios de fase no transurren de forma abrupta y su estudio (nuleaión) es omplejo. La temperatura permanee onstante durante un ambio de fase termodinámio y depende de la presión a la que tiene lugar el ambio de fase. El alor f neesario para fundir una sustania depende de su masa m y del llamado alor latente de fusión L f propio de ada sustania: f = ml f []
3 Para el agua a atm, L f =.5 kj/kg = 79 kal/kg. Igualmente, el alor v neesario para vaporizar una sustania depende de su masa m y del llamado alor latente de vaporizaión L v propio de ada sustania: v = ml v [] Para el agua a atm, L v = J/kg = 540 kal/kg Debido a su elevado alor espeífio y a su elevado alor latente de vaporizaión, el agua tiene una gran apaidad para absorber muo alor y por eso se usa para apagar inendios (otros extintores polvo, espumas, CO no son tan efiaes omo el agua pero son menos pesados y de deben usar uando existe peligro elétrio) Calorimetría La alorimetría onsiste en la mediión del alor que sale o entra de los uerpos, así omo en la determinaión del alor espeífio de un uerpo. Para ello se utiliza un alorímetro que básiamente es omo un termo on un termómetro en el que las paredes son de vidrio y está reubierto por un material de baja ondutividad térmia (aire, oro, et). Supongamos que queremos determinar el alor espeífio de una sustania de masa m onoida. Para ello vertemos en el alorímetro ierta antidad de agua de masa onoida m a y enfriamos el onjunto asta una temperatura T fría que medimos on el termómetro. Se supone que también onoemos la masa m y el alor espeífio del alorímetro. Calentamos aora la sustania desonoida asta una temperatura T alie por enima de la temperatura ambiente y la eamos dentro del agua del alorímetro.
4 Esperamos asta que se alane la temperatura de equilibrio T eq. Entones, la sustania abrá edido ierto alor ed que abrá sido absorbido abs por el agua y el alorímetro. Se umple que: agua. ed = abs siendo ed abs = m Es deir: ( Talie Teq ) ( T T ) + m ( T T ) = m donde a es el alor espeífio del m eq fría a a eq fría ( T T ) = m ( T T ) + m ( T T ) alie [4] eq De la eua. [4] podríamos despejar el alor espeífio desonoido. El llamado equivalente en agua M k de un alorímetro determinado representa la masa en gramos de agua que tendría el mismo efeto térmio que el alorímetro real. Conoer el equivalente en agua del alorímetro simplifia los álulos en la eua. [4] ya que m podrá ser sustituido por M k (multipliado por a que vale para el agua si trabajamos en gramos y alorías). eq fría a a eq fría Ejemplo 9.4 Tipler: Tenemos una botella de limonada a ºC y se ean 0.4 kg de ésta en un vaso y ubitos de ielo (m ubito = 0.05 kg a 0ºC) a) Cuál es la temperatura de equilibrio de la limonada? b) Si se ubieran eado 6 ubitos Cuál ubiera sido la temperatura de equilibrio de la limonada? a) El alor perdido por la limonada será: perdido = m lim lim ( T T ) Consideraremos que el alor espeífio de la limonada lim es omo el del agua, es deir, lim = a = 4.8 kj/kgc. La temperatura iniial aliente de la limonada es T i = ºC. El alor ganado por los ielos y por el agua (que resulta al fundirse los ubitos de ielo) será: i eq ( T 0) ganado = mielol f + mielo( agua) a eq donde L f =.5 kj/kg (alor latente de fusión del ielo) a = 4.8 kj/kgc
5 m ielo = m ielo agua ( ) = 0.05 = 0.05 kg. Igualando = podemos despejar T =. 5 ºC perdido ganado eq b) Si ubiéramos eado 6 ubitos m = = 0. 5 kg, sustituiríamos este valor en la euaión del alor ganado ielo ( T 0) ganado = mielol f + mielo( agua) a eq y si suponemos que se funde todo el ielo m = kg ielo = m ielo ( agua) = De nuevo igualaríamos = pero al despejar la temperatura de equilibrio perdido ganado obtendríamos: T = 0 ºC. Esto es imposible ya que no podríamos tener la mezla eq ielo-limonada más fría que los ubitos originalmente (0ºC). Lo que ourre es que, uando eamos 6 ubitos, no se funde todo el ielo, es deir, la mezla quedará a 0ºC on parte de ielo sin fundir. En esta situaión la limonada se enfriará asta un temperatura de equilibrio de 0ºC on lo que perderá un alor dado por: perdido = mlimlim i ( T 0 ) =. kj que ará que se ayan fundido: perdido 0. m ielo = = 0. kg, es deir, = 4 ubitos de los 6 que abíamos eado. L 0.05 f Aunque ubiéramos puesto más ielo a 0ºC, sólo se fundirían 4 ubitos y en la mezla siempre quedarían ubitos de ielo sin fundir. Los 0.4 kg de limonada a ºC sólo son apaes de fundir 4 ubitos a 0ºC. (En todo este problema siempre se a supuesto que el ambiente no influye para nada y que sólo ay interambio de alor entre la limonada y los ubitos, lo ual nuna ourre en la realidad). 7.. Calor y trabajo: er Prinipio de la Termodinámia. Supongamos que alentamos un pistón que ontiene gas. Si el émbolo puede expansionarse lo ará, realizará un trabajo y la temperatura del gas subirá poo en el interior del pistón. Por el ontrario, si no dejamos que el émbolo se expansione (realie trabajo), la temperatura del gas subirá enormemente. Reordamos por la e. [5] del Cap. 0 que aumentar la temperatura signifia aumentar la energía inétia de las moléulas de un gas. Esta energía inétia representa la llamada energía interna del gas.
6 Por tanto, el er prinipio de la termodinámia establee que el alor añadido a un sistema es igual a la variaión de su energía interna ΔU más el trabajo W realizado por el sistema. = ΔU + W [5] 7... Convenio de signos. El alor es positivo si se introdue en el sistema (lo ual ourre en un alentamiento). El alor es negativo si se saa o se desprende del sistema (lo ual ourre en un enfriamiento). El trabajo W es negativo si se ae sobre el sistema (lo ual ourre uando omprimimos un gas). El trabajo W es positivo si lo realiza el sistema (lo ual ourre en una expansión). 7.. Proesos térmios en un gas ideal Diagramas P-. Supongamos que tenemos un gas que se expansiona dentro de un pistón. Si sabemos que el pistón tiene un área A y se desplaza una distania dx, entones si onoemos en ada momento la presión P del gas, el trabajo dw realizado por el gas vendrá dado por: dw = F dx = PA dx = P d siendo d el inremento de volumen del gas. El trabajo total realizado en un desplazamiento determinado desde un volumen asta un volumen vendrá dado por el área bajo la urva P-: W P d = Debemos onoer ómo varía la presión durante la expansión, es deir debemos onoer el diagrama P- del gas. Es importante realar que el produto presión por volumen de un gas (P), representa una energía. De este modo, existe una onversión entre atmósfera por litros y julios: atm L = (0. 0 N/m ) (0 m )= 0. J
7 7... Transformaiones isóbaras, isóoras e isotermas.. Supongamos que tenemos un gas en un estado iniial P que puede llegar a un estado P mediante tres aminos distintos: ) El gas se alienta a presión onstante P aumentando su volumen asta (transformaión isóbara por el amino A) y después se enfría a volumen onstante y su presión desiende asta P (transformaión isóora). En la transformaión isóbara, la presión P se mantiene onstante de modo que el trabajo W realizado por el gas es: = P ( ) W isobário En la transformaión isóora no ay variaión de volumen y, por tanto, el gas no realiza trabajo. ) Primero se enfría el gas a volumen onstante (transformaión isóora) asta que su presión sea P y después se alienta a presión onstante P (transformaión isóbara por el amino B) y su volumen aumenta asta. En la transformaión isóora no se realiza trabajo (volumen onstante W = 0 ) y en la transformaión isóbara el trabajo W realizado por el isoório gas es: W isobário = P ( ) y omo P es muo menos que P, el trabajo realizado por el gas por el amino B es también menor que el realizado por el amino A. (según puede verse en las áreas sombreadas de ada figura.).
8 ) La expansión del gas a través del amino C, tiene la peuliaridad de que la temperatura del gas se mantiene onstante en todo el proeso que se denomina isotermo. Todos los puntos P por los que el gas pasa umplen P = nrt = te. Tendremos que nrt P =. De este modo: nrt dw = P d = d y el trabajo realizado por el gas para ir desde asta será: W isotermo = P d = nrt d y omo este proeso es isotermo T = te que puede salir de la integral: W isotermo = nrt = P d = d = nrt d nrt ln [6] que es el trabajo realizado en una expansión isoterma. En los aminos, el estado final es el mismo y, por tanto, su temperatura es la misma y su energía interna (que depende sólo de la temperatura) también es la misma. Como el trabajo en los aminos es diferente, también lo será el alor neto (absorbido o edido) en ada amino.
9 7... Capaidades alorífias de los gases. Los sólidos y los líquidos se dilatan poo de modo que la apaidad alorífia es independiente de este eo. Sin embargo, omo los gases se dilatan muo, su apaidad alorífia depende muo de la dilataión ya que al dilatarse realizan un trabajo. En un gas que se alienta a volumen onstante, su apaidad alorífia se designa por C. Si se alienta el gas y se deja que se dilate a presión onstante, su apaidad alorífia se designa por C P y será mayor que C ya que se debe ontabilizar el alor neesario para realizar el trabajo de expansión. Si llamamos al alor añadido a volumen onstante, por definiión de apaidad alorífia a volumen onstante, se umple: = C ΔT Cuando se añade alor a un gas a volumen onstante, éste no realiza trabajo, de modo que el alor añadido se emplea simplemente en aumentar su energía interna: = ΔU + W = ΔU = C ΔT y para ambios temperaturas pequeños se umple: du C = [7] dt Si añadimos alor a presión onstante entones ( P se denomina entalpía): = C ΔT y omo P P P = ΔU + W = ΔU + P Δ, es deir, ΔT = ΔU + P Δ que para ambios de temperaturas pequeños se esribe omo: Como C P dt = du + P d que on [7] resulta en: C dt = C dt + P d. C P P = nrt para presión onstante P d = nr dt : C P dt = C dt + nr dt y dividiendo entre dt tenemos: C P = C nr [8] P + que onfirma que C P es mayor C. Sabemos que la energía interna del gas es la energía inétia. Si el gas es monoatómio (gases nobles) esta energía inétia es sólo traslaional y viene dada por la e. [5] del Cap. 0. y la apaidades térmias serán: U = nrt
10 du 5 C = = nr y CP = C + nr = nr [9] dt Para gases diatómios la energía interna no es sólo energía inétia traslaional ya que las moléulas pueden rotar entorno a dos ejes que pasan por el entro de masas de la moléula y la energía interna es mayor ( grados de libertad traslaionales y rotaionales): 5 U = nrt De este modo, la apaidad alorífia a volumen onstante para un gas diatómio será: 5 C = nr y la apaidad alorífia a presión onstante será: C P = C 7 + nr = nr Para los sólidos vimos en.. que tienen todos el mismo alor espeífio molar y su valor es ' = R = 4. 9 J/mol K. Esto se onoe omo la ley de Dulong-Petit y se debe a que los átomos en los sólidos tienen 6 grados de libertad ( traslaionales y vibraionales).
11 7..4. Transformaiones adiabátias. En los proesos térmios estudiados en.. se permitía que entrara o saliera alor del sistema. Existen otro tipo de proesos que se denominan adiabátios en los que el sistema está aislado térmiamente. En un proeso adiabátio no ay interambio de alor, d = 0. El trabajo que se realiza en una expansión adiabátia, el gas lo obtiene de su energía interna y, por tanto, disminuye su temperatura. Los puntos de un gas unidos por una línea adiabátia no umplen P = te (aso isotermo) sino que umplen, omo veremos, la llamada euaión de Poisson. Por el primer prinipio de la Termodinámia: d = du + dw = C dt + P d = 0 y on P = nrt : nrt dt nr d C dt + d = 0 + = 0 T C Ya que C nr CP C CP C nr = = = γ, resulta: C C C P = Integrando, tenemos: ( γ ) te dt T γ + d ( γ ) = 0 ln T + ln = ln ( T ) = te, es deir: y omo P T = nr γ T = te [0] γ P = te que se onoe omo euaión de Poisson y difiere de la ley de Boyle [0 ] P = te para proesos no adiabátios isotermos. En una expansión adiabátia el trabajo realizado por el gas, ya que no ay transferenia de alor (d = 0), se obtiene de la energía interna: d = du + dw = 0 dw = du = C dt, entones:
12 W adiabátio T ( T T ) = C ( T T )= = C dt = C ΔT = C v T P P C P P = C = ( P P ) = [] nr nr C C γ P Ejemplo 9.8 Tipler: Sea 0. moles de un gas ideal monoatómio on C = nr que oupa. L a.4 atm y ourren los siguientes proesos desde A: ) Calentamiento a P = te asta 4.4 L en B. ) Enfriamiento a =te asta. atm en C. ) Compresión isoterma asta A. Enontrar: a) Temperatura en A, B y C Soluión: b) Determinar W,, y ΔU en ada amino y para el ilo entero. a) Usando P = nrt on n = 0. mol y R = 0.08 atm L/mol K se despeja la temperatura en ada punto: TA = TC = 0 K ; T B = 40 K b) Proeso (de A a B) expansión isobária (alentamiento): ( 4.4.) = 5.8 atm L 55 J = P Δ =.4 = W te P se a utilizado que atm L = 0. J 5 = C ΔT = nr = ( 40 0) 7 J on n = 0, mol y R = 8.4 J/mol K Δ U = W = 80 J que también se podía aber alulado omo Proeso (de B a C) transformaión isoória (enfriamiento): W = 0 ya que Δ = 0 = C ΔT = nr ( 0 40) = 80 J Δ U = 80 J ya que = ΔU + W y W = 0 C ΔT = nr ΔT
13 Proeso (de C a A) ompresión isoterma: W = nrt ln A = C 7 J donde se a utilizado la e. [6] ΔU = 0 ya que ΔT = 0 = 7 J ya que = ΔU + W e ΔU = 0 Para el ilo entero: W total total Δ U total + ( 7 J ) 64 J ( 80 J ) + ( 7 J ) 64 J J + ( 80 J ) = W + W + W = 55 J + 0 = = + + = 7 J + = = ΔU = 80 + ΔU + ΔU = En ualquier proeso ílio, al ser iguales la temperatura iniial y final, la variaión de energía interna es nula. Por este motivo, el trabajo realizado por el sistema es igual al alor neto interambiado. Este trabajo orresponde al área bajo la urva AB menos el área bajo la urva AC, esto es, el área de la figura ompleta. Existen muos ilos termodinámios que se emplean en máquinas térmias omo los motores de ombustión interna. Dada su importania para ursos posteriores, menionamos el ilo Otto en gasolina, el ilo Diesel, y el ilo de Stirling que atualmente se vuelve a emplear en motores térmios que generan eletriidad a partir de energía solar. Un sistema DISTAL I en operaión en la Plataforma Solar de Almería
14 7.4. Entropía. º Prinipio de la Termodinámia Entropía y desorden. La entropía es una medida del desorden. Cuando existen muos estados aesibles al sistema entones existe una mayor entropía, ya que el sistema tenderá a oupar todos los estados que le sean aesibles. Por ejemplo, en una lase el aire llena toda el aula y es imposible que todas las moléulas de gas se loalizaran espontáneamente en una mitad del aula quedando la otra son aire (en realidad no es imposible pero es tan improbable que nuna podría ourrir). Matemátiamente, el ambio de entropía S de un sistema umple T ds = d Reversibilidad. Los proesos siempre ourren en el sentido de oupar la mayor antidad de estados, aumentando la entropía. Un vaso que se rompe es un proeso irreversible ya que nuna ourre que los trozos rotos se puedan reomponer espontáneamente en el vaso original. El vaso roto tiene un mayor desorden. Una máquina que genera trabajo es un proeso irreversible, es deir, no puede ourrir que del trabajo reado se obtenga la misma antidad de ombustible de la que se partió. La entropía en un proeso reversible se mantiene onstante pero, en la prátia, la entropía siempre ree porque no ay proesos absolutamente reversibles. Es fáil onvertir todo el trabajo meánio en alor pero no es posible onvertir íliamente todo el alor de un uerpo en trabajo meánio. En un proeso isotermo ideal existe una interonversión total entre alor y trabajo mientras la energía interna se mantiene onstante. En la prátia, nuna es posible obtener un proeso isotérmio totalmente reversible en el que el ambio de entropía del sistema sea igual al ambio de entropía del resto del Universo. Por otra parte, un proeso adiabátio ideal es un proeso térmiamente aislado de modo que existe una interonversión total entre la energía interna y el trabajo. La entropía en un proeso adiabátio se mantiene onstante (proeso isentrópio). Tampoo es posible obtener un proeso adiabátio totalmente reversible. Mediante la ombinaión de proesos isotermos y adiabátios en el llamado ilo de Carnot, se enontrará un proeso ílio teóriamente reversible e ideal Enuniados del º Prinipio de la Termodinámia. Enuniado de Kelvin: Es imposible extraer alor de un sistema a una sola temperatura y onvertirlo en trabajo meánio sin influir en el sistema.
15 Enuniado de Clausius: No es posible que ourra un proeso espontáneo en el que pase alor de un uerpo a otro on más temperatura. En realidad, veremos que estos dos enuniados son equivalentes Máquinas térmias Esquema de una máquina térmia. Una máquina térmia es un dispositivo que trabaja en modo ílio tomando alor de un foo térmio aliente, realizando un trabajo, expulsando alor a un foo térmio frío y volviendo al estado iniial Conepto de foo térmio. Un foo térmio es una reserva (reservoir) ideal, muy grande, de la ual se puede saar o meter alor indefinidamente y sin variar su temperatura. Por esta razón, uando la máquina térmia omplete un ilo, se enontrará en un estado que tendrá la misma temperatura de la que abía partido y, por tanto, la variaión de la energía interna del ilo ompleto será nula ΔU = 0. Por el primer prinipio de la Termodinámia = ΔU + W, tendremos que = W, esto es, el trabajo eo por la máquina en un ilo será igual al alor neto interambiado (absorbido menos edido) por la máquina Trabajo y Rendimiento. El trabajo eo por una máquina térmia es igual al alor que entra del foo aliente (ot) menos el alor que sale aia el foo frío (old): W = [] Según el riterio de signos, el alor que sale de la máquina aia el foo frío es negativo, por lo ual lo emos tomado omo en [].
16 Se define rendimiento ε de una máquina térmia omo: W ε = = = [] En la prátia no resulta posible obtener máquinas térmias on rendimientos superiores al 50%. Si el rendimiento fuera del 00% (ε = ), todo el alor absorbido del foo aliente se onvertiría en trabajo sin expulsar ningún alor al foo frío. Es imposible onstruir una máquina térmia on un rendimiento del 00%. Esta propiedad de una máquina térmia es otra forma de enuniar el º Prinipio de la Termodinámia equivalente al enuniado de Kelvin Refrigeradores. Un refrigerador el esenialmente una máquina térmia funionando en sentido inverso. Esto es, un refrigerador extrae alor de un foo frío mediante el onsumo de un trabajo y lo expulsa al foo aliente. Se define el oefiiente de efiaia η de un refrigerador omo: η = [4] W Cuando mayor es la efiaia mejor es el refrigerador. Los refrigeradores omunes tienen efiaias del orden de 5 ó 6. Si la efiaia fuera infinita el refrigerador sería perfeto y no se neesitaría ningún onsumo de trabajo (W = 0) para extraer el alor del foo frío. Pero es imposible que un refrigerador extraiga alor del foo frío y lo expulse en el aliente sin onsumir trabajo. Este enuniado es equivalente al de Clausius.
17 Ambos enuniados (de Kelvin y de Clausius) son equivalentes ya que un refrigerador ordinario (a) que se pusiera entre dos foos a trabajar onjuntamente on una máquina térmia perfeta (b) produiría el mismo efeto que un refrigerador perfeto trabajando entre esos mismos foos (). Esto es, la existenia de (b) impliaría la existenia de () o vieversa pero ninguno de los dos puede existir en la realidad Cilo y Teorema de Carnot. En 84, el ingeniero franés Niolas Léonard Sadi Carnot enunió el siguiente teorema que lleva su nombre: Si una máquina térmia que trabaja entre dos foos es reversible entones no puede existir una máquina térmia on un rendimiento más elevado y que trabaje entre esos mismos foos. Este enuniado implia que si una máquina térmia trabaja entre dos foos y es reversible, entones tiene el máximo rendimiento posible Condiiones de reversibilidad. Para rear un ilo errado reversible, todos sus proesos se deben mantener lo más era posible del equilibrio (proesos quasi-estátios). Por otro lado, para que un proeso sea reversible uando ay transferenias de alor, no debe aber diferenias de temperatura (si ubiera ambios de temperatura, para que ubiera reversibilidad, en algún momento se neesitaría pasar alor de un uerpo frío a uno aliente de forma espontánea lo ual es imposible según el enuniado de Clausius). Esto implia que los
18 interambios de alor deben ser isotermos. Para errar el ilo también neesitaremos proesos sin interambio de alor (adiabátios). Entones, un ilo de Carnot onstará de los siguientes proesos:. Una absorión de alor isoterma y quasi-estátia de un foo aliente (expansión).. Una expansión adiabátia y quasi-estátia aia una temperatura más baja.. Una esión de alor isoterma y quasi-estátia a un foo frío (ompresión). 4. Una ompresión adiabátia y quasi-estátia asta volver al estado iniial Rendimiento de Carnot. Una máquina que funiona en ilo de Carnot es reversible y por tanto, funiona on el máximo rendimiento posible. eremos que el rendimiento Carnot viene limitado por la temperatura de los foos térmios entre los que trabaja la máquina. El rendimiento Carnot es útil porque proporiona el rendimiento máximo alanzable por una máquina térmia en ondiiones ideales (sin friión ni otras pérdidas irreversibles). El rendimiento viene dado por []: En los proesos isotermos ε = = W expansión isoterma a T de asta viene dado por [6]: =, es deir, el alor absorbido durante la nrt ln Igualmente, el alor edido en la ompresión isoterma a T desde asta 4 será:
19 (donde se a utilizado Tenemos: = nrt ln en lugar de 4 4 = ln 4 ln por que > 0 ) T T ln ln ( 4 ) ( ) los volúmenes y temperaturas están relaionados por las expresiones de Poisson [0] para proesos adiabátios: Para la expansión de a : T γ = T γ Para la ompresión de 4 a : γ T = T γ 4 Dividiendo miembro a miembro: γ = 4 γ = 4 ln = ln 4 T = y finalmente: T T ε = [5] T que úniamente depende de las temperaturas de los foos (atenión: las temperaturas en [5] deben estar expresadas en grados kelvin).
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
Electricidad y calor. Temario. Temario. Webpage: http://paginas.fisica.uson.mx/qb
 Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
Electricidad y calor Webpage: http://paginas.fisica.uson.mx/qb 2007 Departamento de Física Universidad de Sonora Temario A. Termodinámica 1. Temperatura y Ley Cero. (3horas) 1. Equilibrio Térmico y ley
ENERGÍA INTERNA DE UN SISTEMA
 ENERGÍA INTERNA DE UN SISTEMA Definimos energía interna U de un sistema la suma de las energías cinéticas de todas sus partículas constituyentes, más la suma de todas las energías de interacción entre
ENERGÍA INTERNA DE UN SISTEMA Definimos energía interna U de un sistema la suma de las energías cinéticas de todas sus partículas constituyentes, más la suma de todas las energías de interacción entre
Energía útil: segundo P pio de la termodinámica.
 Energía útil: segundo P pio de la termodinámia. Físia Ambiental. ema 3. ema 3. FA (Pro. RAMOS) ema 3.- " Energía útil: segundo P pio de la termodinámia" Conversión alor-trabajo. Máquinas térmias y rigoríias.
Energía útil: segundo P pio de la termodinámia. Físia Ambiental. ema 3. ema 3. FA (Pro. RAMOS) ema 3.- " Energía útil: segundo P pio de la termodinámia" Conversión alor-trabajo. Máquinas térmias y rigoríias.
λ fus + λ vap = λ sub
 Cambios De Fase Ecuacion De Clasius V : diferencia de volumen entre ambas fases. λ = T(s f s i ) se denomina calor latente o entalpia de transición. Se considera normalmente como constante. Además se cumple
Cambios De Fase Ecuacion De Clasius V : diferencia de volumen entre ambas fases. λ = T(s f s i ) se denomina calor latente o entalpia de transición. Se considera normalmente como constante. Además se cumple
Tema 2: Elección bajo incertidumbre
 Tema : Eleión bajo inertidumbre Ref: Capítulo Varian Autor: Joel Sandonís Versión:..0 Javier López Departamento de Fundamentos del Análisis Eonómio Universidad de Aliante Miroeonomía Intermedia Introduión
Tema : Eleión bajo inertidumbre Ref: Capítulo Varian Autor: Joel Sandonís Versión:..0 Javier López Departamento de Fundamentos del Análisis Eonómio Universidad de Aliante Miroeonomía Intermedia Introduión
ÁCIDO BASE QCA 09 ANDALUCÍA
 ÁCIDO BASE QCA 9 ANDALUCÍA.- El ph de L de disoluión auosa de hidróxido de litio es. Calule: a) Los gramos de hidróxido que se han utilizado para prepararla. b) El volumen de agua que hay que añadir a
ÁCIDO BASE QCA 9 ANDALUCÍA.- El ph de L de disoluión auosa de hidróxido de litio es. Calule: a) Los gramos de hidróxido que se han utilizado para prepararla. b) El volumen de agua que hay que añadir a
Transformación de trabajo en calor y calor en trabajo. Motores y Frigoríficos.
 Transformación de trabajo en calor y calor en trabajo Motores y Frigoríficos. De lo expuesto, se debe concluir que cualquier sistema que este expuesto al intercambio de trabajo y calor con el exterior
Transformación de trabajo en calor y calor en trabajo Motores y Frigoríficos. De lo expuesto, se debe concluir que cualquier sistema que este expuesto al intercambio de trabajo y calor con el exterior
CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA:
 CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA: 1.1.. Introducción: El concepto de temperatura está muy relacionado con el diario vivir. Tenemos un concepto intuitivo de algo
CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA: 1.1.. Introducción: El concepto de temperatura está muy relacionado con el diario vivir. Tenemos un concepto intuitivo de algo
masa densidad M V masa densidad COLEGIO NTRA.SRA.DEL CARMEN_TECNOLOGÍA_4º ESO EJERCICIOS DEL PRINCIPIO DE ARQUÍMEDES.-
 1.Explia el prinipio de Arquímedes y ita dos ejemplos, de la vida real, en los que se ponga de manifiesto diho prinipio. El prinipio de Arquímedes india que un uerpo sumergido en un fluido experimenta
1.Explia el prinipio de Arquímedes y ita dos ejemplos, de la vida real, en los que se ponga de manifiesto diho prinipio. El prinipio de Arquímedes india que un uerpo sumergido en un fluido experimenta
Tema 9: Calor, Trabajo, y Primer Principio
 1/34 Tema 9: Calor, Trabajo, y Primer Principio Fátima Masot Conde Ing. Industrial 2007/08 Tema 9: Calor, Trabajo, Primer Principio 2/34 Índice: 1. Introducción. 2. Capacidad calorífica. Calor específico.
1/34 Tema 9: Calor, Trabajo, y Primer Principio Fátima Masot Conde Ing. Industrial 2007/08 Tema 9: Calor, Trabajo, Primer Principio 2/34 Índice: 1. Introducción. 2. Capacidad calorífica. Calor específico.
TERMOMETRÌA Y CALORIMETRÌA
 TERMOMETRÌA Y CALORIMETRÌA Termómetros Basados en alguna propiedad física de un sistema que cambia con la temperatura: Volumen de un líquido Longitud de un sólido Presión de un gas a volumen constante
TERMOMETRÌA Y CALORIMETRÌA Termómetros Basados en alguna propiedad física de un sistema que cambia con la temperatura: Volumen de un líquido Longitud de un sólido Presión de un gas a volumen constante
LOS GASES Y SUS LEYES DE
 EMA : LOS GASES Y SUS LEYES DE COMBINACIÓN -LAS LEYES DE LOS GASES En el siglo XII comenzó a investigarse el hecho de que los gases, independientemente de su naturaleza, presentan un comportamiento similar
EMA : LOS GASES Y SUS LEYES DE COMBINACIÓN -LAS LEYES DE LOS GASES En el siglo XII comenzó a investigarse el hecho de que los gases, independientemente de su naturaleza, presentan un comportamiento similar
PROBLEMAS DE TRNSMISIÓN DE CALOR
 TEMODINAMIA Departamento de Física - UNS arreras: Ing. Industrial y Mecánica POBLEMAS DE TNSMISIÓN DE ALO Ejemplo. Pérdida de calor a través de una pared plana onsidere una pared gruesa de 3 m de alto,
TEMODINAMIA Departamento de Física - UNS arreras: Ing. Industrial y Mecánica POBLEMAS DE TNSMISIÓN DE ALO Ejemplo. Pérdida de calor a través de una pared plana onsidere una pared gruesa de 3 m de alto,
FÍSICA Y QUÍMICA 3º E.S.O. - Repaso 3ª Evaluación GAS LÍQUIDO SÓLIDO
 Nombre echa de entrega ÍSICA Y QUÍMICA 3º E.S.O. - Repaso 3ª Evaluación. El aire, es materia? Por qué? Las propiedades fundamentales de la materia son la masa (cantidad de materia, expresada en kg en el
Nombre echa de entrega ÍSICA Y QUÍMICA 3º E.S.O. - Repaso 3ª Evaluación. El aire, es materia? Por qué? Las propiedades fundamentales de la materia son la masa (cantidad de materia, expresada en kg en el
CARGAS TÉRMICAS DE REFRIGERACIÓN
 CARGAS TÉRMICAS DE REFRIGERACIÓN INTRODUCCIÓN Por cálculo de cargas se entiende el proceso de determinar la cantidad de calor que hay que extraer o aportar a un local de unas determinadas características,
CARGAS TÉRMICAS DE REFRIGERACIÓN INTRODUCCIÓN Por cálculo de cargas se entiende el proceso de determinar la cantidad de calor que hay que extraer o aportar a un local de unas determinadas características,
El balance de energía. Aplicaciones de la primera ley de la termodinámica. Ejercicios.
 TERMODINÁMICA (0068) PROFR. RIGEL GÁMEZ LEAL El balance de energía. Aplicaciones de la primera ley de la termodinámica. Ejercicios. 1. Suponga una máquina térmica que opera con el ciclo reversible de Carnot
TERMODINÁMICA (0068) PROFR. RIGEL GÁMEZ LEAL El balance de energía. Aplicaciones de la primera ley de la termodinámica. Ejercicios. 1. Suponga una máquina térmica que opera con el ciclo reversible de Carnot
Ing. Gerardo Sarmiento CALOR Y TEMPERATURA
 Ing. Gerardo Sarmiento CALOR Y TEMPERATURA Como se mide y transporta el calor La cantidad de calor (Q) se expresa en las mismas unidades que la energía y el trabajo, es decir, en Joule. Otra unidad es
Ing. Gerardo Sarmiento CALOR Y TEMPERATURA Como se mide y transporta el calor La cantidad de calor (Q) se expresa en las mismas unidades que la energía y el trabajo, es decir, en Joule. Otra unidad es
GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero).
 UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero). Gases - Primera ley de la Termodinámica Ley Cero. 1. Se mantiene
UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero). Gases - Primera ley de la Termodinámica Ley Cero. 1. Se mantiene
TEMA 10: EQUILIBRIO QUÍMICO
 TEMA : EQUILIBRIO QUÍMICO. Conepto de equilibrio químio: reaiones reversibles. Existen reaiones, denominadas irreversibles, que se araterizan por transurrir disminuyendo progresivamente la antidad de sustanias
TEMA : EQUILIBRIO QUÍMICO. Conepto de equilibrio químio: reaiones reversibles. Existen reaiones, denominadas irreversibles, que se araterizan por transurrir disminuyendo progresivamente la antidad de sustanias
ESTADOS DE AGREGACIÓN DE LA MATERIA
 ESADOS DE AGREGACIÓN DE LA MAERIA. Propiedades generales de la materia La materia es todo aquello que tiene masa y volumen. La masa se define como la cantidad de materia de un cuerpo. Se mide en kg. El
ESADOS DE AGREGACIÓN DE LA MAERIA. Propiedades generales de la materia La materia es todo aquello que tiene masa y volumen. La masa se define como la cantidad de materia de un cuerpo. Se mide en kg. El
FISICA Y QUÍMICA 4º ESO 1.- TRABAJO MECÁNICO.
 1.- TRABAJO MECÁNICO. Si a alguien que sostiene un objeto sin moverse le preguntas si hace trabajo, probablemente te responderá que sí. Sin embargo, desde el punto de vista de la Física, no realiza trabajo;
1.- TRABAJO MECÁNICO. Si a alguien que sostiene un objeto sin moverse le preguntas si hace trabajo, probablemente te responderá que sí. Sin embargo, desde el punto de vista de la Física, no realiza trabajo;
Para aprender Termodinámica resolviendo problemas
 GASES REAES. Fator de ompresibilidad. El fator de ompresibilidad se define omo ( ) ( ) ( ) z = real = real y es funión de la presión, la temperatura y la naturaleza de ada gas. Euaión de van der Waals.
GASES REAES. Fator de ompresibilidad. El fator de ompresibilidad se define omo ( ) ( ) ( ) z = real = real y es funión de la presión, la temperatura y la naturaleza de ada gas. Euaión de van der Waals.
DRAFT. Trabajo, Calor y Primer Principio de la Termodinámica.
 DRAFT Trabajo, Calor y Primer Principio de la Termodinámica. J.V. Alvarez Departmento de Fisica de la Materia Condensada, Universidad Autonoma de Madrid. 28049 Madrid, Spain. (Dated: October 10, 2007)
DRAFT Trabajo, Calor y Primer Principio de la Termodinámica. J.V. Alvarez Departmento de Fisica de la Materia Condensada, Universidad Autonoma de Madrid. 28049 Madrid, Spain. (Dated: October 10, 2007)
LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO
 LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO 1. Trabajo mecánico y energía. El trabajo, tal y como se define físicamente, es una magnitud diferente de lo que se entiende sensorialmente por trabajo. Trabajo
LEYES DE CONSERVACIÓN: ENERGÍA Y MOMENTO 1. Trabajo mecánico y energía. El trabajo, tal y como se define físicamente, es una magnitud diferente de lo que se entiende sensorialmente por trabajo. Trabajo
ENERGÍA INTERNA PARA GASES NO IDEALES.
 DEPARTAMENTO DE FISICA UNIERSIDAD DE SANTIAGO DE CHILE ENERGÍA INTERNA PARA GASES NO IDEALES. En el caso de los gases ideales o cualquier cuerpo en fase no gaseosa la energía interna es función de la temperatura
DEPARTAMENTO DE FISICA UNIERSIDAD DE SANTIAGO DE CHILE ENERGÍA INTERNA PARA GASES NO IDEALES. En el caso de los gases ideales o cualquier cuerpo en fase no gaseosa la energía interna es función de la temperatura
MEDIDA DEL CALOR ESPECÍFICO
 Laboratorio de Física General Primer Curso (Termodinámica) MEDIDA DEL CALOR ESPECÍFICO Fecha: 07/02/05 1. Objetivo de la práctica Familiarizarse con las medidas calorimétricas mediante la medida del calor
Laboratorio de Física General Primer Curso (Termodinámica) MEDIDA DEL CALOR ESPECÍFICO Fecha: 07/02/05 1. Objetivo de la práctica Familiarizarse con las medidas calorimétricas mediante la medida del calor
Bloque II: Principios de máquinas
 Bloque II: Principios de máquinas 1. Conceptos Fundamentales A. Trabajo En términos de la física y suponiendo un movimiento rectilíneo de un objeto al que se le aplica una fuerza F, se define como el producto
Bloque II: Principios de máquinas 1. Conceptos Fundamentales A. Trabajo En términos de la física y suponiendo un movimiento rectilíneo de un objeto al que se le aplica una fuerza F, se define como el producto
CALOR. Q = c m (Tf - Ti) (1) Q será positivo si la temperatura final es mayor que la inicial (Tf > Ti) y negativo en el caso contrario (Tf < Ti).
 1. CANTIDADES DE CALOR CALOR Aun cuando no sea posible determinar el contenido total de energía calorífica de un cuerpo, puede medirse la cantidad que se toma o se cede al ponerlo en contacto con otro
1. CANTIDADES DE CALOR CALOR Aun cuando no sea posible determinar el contenido total de energía calorífica de un cuerpo, puede medirse la cantidad que se toma o se cede al ponerlo en contacto con otro
Agentes para la conservación de la energía mecánica
 Agentes para la conservación de la energía mecánica Para levantar un cuerpo verticalmente a velocidad constante, es necesario que algún agente externo realice trabajo y hemos demostrado que este trabajo
Agentes para la conservación de la energía mecánica Para levantar un cuerpo verticalmente a velocidad constante, es necesario que algún agente externo realice trabajo y hemos demostrado que este trabajo
P cabeza Sca 5 1 0 6 m 2 2 10 6 Pa. beza. 6 m 2 10 8 Pa unta
 Pág. 1 16 Ejercemos una fuerza de 10 N sobre un clavo. Si la superficie de su cabeza es de 5 mm y la de la punta 0,1 mm, qué presión se ejercerá al aplicar la fuerza sobre uno u otro de sus extremos? La
Pág. 1 16 Ejercemos una fuerza de 10 N sobre un clavo. Si la superficie de su cabeza es de 5 mm y la de la punta 0,1 mm, qué presión se ejercerá al aplicar la fuerza sobre uno u otro de sus extremos? La
INTERCAMBIADORES DE CALOR. Mg. Amancio R. Rojas Flores
 INTERCAMBIADORES DE CALOR Mg. Amancio R. Rojas Flores INTRODUCCIÓN Los intercambiadores de calor son aparatos que facilitan el intercambio de calor entre dos fluidos que se encuentran a temperaturas diferentes
INTERCAMBIADORES DE CALOR Mg. Amancio R. Rojas Flores INTRODUCCIÓN Los intercambiadores de calor son aparatos que facilitan el intercambio de calor entre dos fluidos que se encuentran a temperaturas diferentes
CAPITULO 3 LA TEMPERATURA
 CAPITULO 3 LA TEMPERATURA 1. CONCEPTO: La temperatura de un cuerpo indica en qué dirección se desplazará el calor al poner en contacto dos cuerpos que se encuentran a temperaturas distintas, ya que éste
CAPITULO 3 LA TEMPERATURA 1. CONCEPTO: La temperatura de un cuerpo indica en qué dirección se desplazará el calor al poner en contacto dos cuerpos que se encuentran a temperaturas distintas, ya que éste
CAMBIO DE FASE : VAPORIZACIÓN
 CAMBIO DE FASE : VAPORIZACIÓN Un líquido no tiene que ser calentado a su punto de ebullición antes de que pueda convertirse en un gas. El agua, por ejemplo, se evapora de un envase abierto en la temperatura
CAMBIO DE FASE : VAPORIZACIÓN Un líquido no tiene que ser calentado a su punto de ebullición antes de que pueda convertirse en un gas. El agua, por ejemplo, se evapora de un envase abierto en la temperatura
Transformación de calor en trabajo: el motor de Stirling
 Práctica Nº 1 ransformación de calor en trabajo: el motor de Stirling 1. Conceptos implicados Primera y segunda ley de la termodinámica, calor, trabajo, máquinas térmicas, transformación de la energía.
Práctica Nº 1 ransformación de calor en trabajo: el motor de Stirling 1. Conceptos implicados Primera y segunda ley de la termodinámica, calor, trabajo, máquinas térmicas, transformación de la energía.
Colegio Alexander von Humboldt - Lima. Tema: La enseñanza de la matemática está en un proceso de cambio
 Refo 07 2004 15 al 19 de noviembre 2004 Colegio Alexander von Humboldt - Lima Tema: La enseñanza de la matemática está en un proceso de cambio La enseñanza de la matemática debe tener dos objetivos principales:
Refo 07 2004 15 al 19 de noviembre 2004 Colegio Alexander von Humboldt - Lima Tema: La enseñanza de la matemática está en un proceso de cambio La enseñanza de la matemática debe tener dos objetivos principales:
ASPECTOS GENERALES PARA LA SOLUCIÓN DE PROBLEMAS RELACIONADOS CON LA CONDUCCIÓN TRANSITORIA.
 CONDUCCIÓN TRANSITORIA Aquí encontrarás Los métodos gráficos y el análisis teórico necesario para resolver problemas relacionados con la transferencia de calor por conducción en estado transitorio a través
CONDUCCIÓN TRANSITORIA Aquí encontrarás Los métodos gráficos y el análisis teórico necesario para resolver problemas relacionados con la transferencia de calor por conducción en estado transitorio a través
Calor: energía transferida debida únicamente a diferencias de temperatura
 TERMODINÁMICA La termodinámica estudia la energía y sus transformaciones. Energía: capacidad para realizar trabajo. Formas de energía Energía radiante Energía térmica Energía química Energía potencial
TERMODINÁMICA La termodinámica estudia la energía y sus transformaciones. Energía: capacidad para realizar trabajo. Formas de energía Energía radiante Energía térmica Energía química Energía potencial
1.2. PROPIEDADES DE LA MATERIA.
 1.2. PROPIEDADES DE LA MATERIA. Toda la materia tiene unas propiedades que nos permiten distinguirla de las cosas inmateriales. Se las llama propiedades generales. Otras propiedades nos permiten diferenciar
1.2. PROPIEDADES DE LA MATERIA. Toda la materia tiene unas propiedades que nos permiten distinguirla de las cosas inmateriales. Se las llama propiedades generales. Otras propiedades nos permiten diferenciar
Capítulo 18: Entropía, energía libre y equilibrio
 Capítulo 18: Entropía, energía libre y equilibrio Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM-3002 Quimica general II, Entropía, energía
Capítulo 18: Entropía, energía libre y equilibrio Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM-3002 Quimica general II, Entropía, energía
INTERCAMBIADORES DE CALOR
 INERCAMBIADORES DE CALOR 1 EMA 4. INERCAMBIADORES 1. Interambaidores (2h Indie Interambiadores de alor. Utilidad. ipos Estudio térmio de los interambiadores de alor. Coeiiente global de transmision de
INERCAMBIADORES DE CALOR 1 EMA 4. INERCAMBIADORES 1. Interambaidores (2h Indie Interambiadores de alor. Utilidad. ipos Estudio térmio de los interambiadores de alor. Coeiiente global de transmision de
Soluciones Problemas Capítulo 1: Relatividad I
 Soluiones Problemas Capítulo 1: Relatividad I 1) (a) La distania, d, a la que se enuentra el ohete de la Tierra viene dada por t 1 = 2s = 2d d = t 1 2 = 3 11 m = 3 1 7 km. (b) El tiempo que tarda la primera
Soluiones Problemas Capítulo 1: Relatividad I 1) (a) La distania, d, a la que se enuentra el ohete de la Tierra viene dada por t 1 = 2s = 2d d = t 1 2 = 3 11 m = 3 1 7 km. (b) El tiempo que tarda la primera
Capítulo 2 Energía 1
 Capítulo 2 Energía 1 Trabajo El trabajo realizado por una fuerza constante sobre una partícula que se mueve en línea recta es: W = F L = F L cos θ siendo L el vector desplazamiento y θ el ángulo entre
Capítulo 2 Energía 1 Trabajo El trabajo realizado por una fuerza constante sobre una partícula que se mueve en línea recta es: W = F L = F L cos θ siendo L el vector desplazamiento y θ el ángulo entre
TEMA 11 LA MATERIA EN EL UNIVERSO
 TEMA 11 LA MATERIA EN EL UNIVERSO TEMA 11 LA MATERIA EN EL UNIVERSO QUÉ ES LA MATERIA? Materia es todo aquello que tiene volumen (ocupa un espacio) y que tiene una determinada masa (por tanto, pesa). QUÉ
TEMA 11 LA MATERIA EN EL UNIVERSO TEMA 11 LA MATERIA EN EL UNIVERSO QUÉ ES LA MATERIA? Materia es todo aquello que tiene volumen (ocupa un espacio) y que tiene una determinada masa (por tanto, pesa). QUÉ
PROBLEMAS RESUELTOS. Grupo A: APLICACIÓN DE LAS ECUACIONES GENERALES DE LOS GASES IDEALES
 PROBLEMAS RESUELOS Grupo A: APLICACIÓN DE LAS ECUACIONES GENERALES DE LOS GASES IDEALES A-01 -.- El "hielo seco" es dióxido de carbono sólido a temperatura inferior a -55 ºC y presión de 1 atmósfera. Una
PROBLEMAS RESUELOS Grupo A: APLICACIÓN DE LAS ECUACIONES GENERALES DE LOS GASES IDEALES A-01 -.- El "hielo seco" es dióxido de carbono sólido a temperatura inferior a -55 ºC y presión de 1 atmósfera. Una
Ciencias Naturales 5º Primaria Tema 7: La materia
 1. La materia que nos rodea Propiedades generales de la materia Los objetos materiales tienes en común dos propiedades, que se llaman propiedades generales de la materia: Poseen masa. La masa es la cantidad
1. La materia que nos rodea Propiedades generales de la materia Los objetos materiales tienes en común dos propiedades, que se llaman propiedades generales de la materia: Poseen masa. La masa es la cantidad
Unidad Didáctica. Transformadores Trifásicos
 Unidad Didáctica Transformadores Trifásicos Programa de Formación Abierta y Flexible Obra colectiva de FONDO FORMACION Coordinación Diseño y maquetación Servicio de Producción Didáctica de FONDO FORMACION
Unidad Didáctica Transformadores Trifásicos Programa de Formación Abierta y Flexible Obra colectiva de FONDO FORMACION Coordinación Diseño y maquetación Servicio de Producción Didáctica de FONDO FORMACION
PROCESO: el sistema cambia de estado
 UNIVERSO UNIVERSO ENTORNO SISTEMA estado A PROCESO: el sistema cambia de estado ENTORNO SISTEMA estado B La energía total del universo no cambia durante el proceso, pero generalmente habrá un INTERCAMBIO
UNIVERSO UNIVERSO ENTORNO SISTEMA estado A PROCESO: el sistema cambia de estado ENTORNO SISTEMA estado B La energía total del universo no cambia durante el proceso, pero generalmente habrá un INTERCAMBIO
Tema 7 : Trabajo, Energía y Calor
 Tema 7 : Trabajo, Energía y Calor Esquema de trabajo: 7. Trabajo. Concepto. Unidad de medida. 8. Energía. Concepto 9. Energía Cinética 10. Energía Potencial Gravitatoria 11. Ley de Conservación de la Energía
Tema 7 : Trabajo, Energía y Calor Esquema de trabajo: 7. Trabajo. Concepto. Unidad de medida. 8. Energía. Concepto 9. Energía Cinética 10. Energía Potencial Gravitatoria 11. Ley de Conservación de la Energía
Tema 8. Termodinámica
 Física I. Curso 2010/11 Departamento de Física Aplicada. ETSII de Béjar. Universidad de Salamanca Profs. Alejandro Medina Domínguez y Jesús Ovejero Sánchez Tema 8. Termodinámica Índice 1. Conceptos básicos
Física I. Curso 2010/11 Departamento de Física Aplicada. ETSII de Béjar. Universidad de Salamanca Profs. Alejandro Medina Domínguez y Jesús Ovejero Sánchez Tema 8. Termodinámica Índice 1. Conceptos básicos
LEY DE BOYLE: A temperatura constante, el volumen (V) que ocupa una masa definida de gas es inversamente proporcional a la presión aplicada (P).
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
CAPITULO 13. CALOR Y LA PRIMERA LEY DE LA TERMODINAMICA.
 CAPITULO 13. CALOR Y LA PRIMERA LEY DE LA TERMODINAMICA. La termodinámica es la rama de la física que estudia los procesos donde hay transferencia de energía en forma de calor y de trabajo. Cuando dos
CAPITULO 13. CALOR Y LA PRIMERA LEY DE LA TERMODINAMICA. La termodinámica es la rama de la física que estudia los procesos donde hay transferencia de energía en forma de calor y de trabajo. Cuando dos
Segundo Principio de la Termodinámica
 ermodinámia. ema 4 Segundo Prinipio de la ermodinámia. Segundo Prinipio de la ermodinámia Enuniado de Kelvin-Plank en 85: No es posible onstruir una máuina térmia de funionamiento ílio ue permita extraer
ermodinámia. ema 4 Segundo Prinipio de la ermodinámia. Segundo Prinipio de la ermodinámia Enuniado de Kelvin-Plank en 85: No es posible onstruir una máuina térmia de funionamiento ílio ue permita extraer
EXPRESIONES ALGEBRAICAS. POLINOMIOS
 EXPRESIONES ALGEBRAICAS. POLINOMIOS 1. EXPRESIONES ALGEBRAICAS. Estas expresiones del área son expresiones algebraicas, ya que además de números aparecen letras. Son también expresiones algebraicas: bac,
EXPRESIONES ALGEBRAICAS. POLINOMIOS 1. EXPRESIONES ALGEBRAICAS. Estas expresiones del área son expresiones algebraicas, ya que además de números aparecen letras. Son también expresiones algebraicas: bac,
Examen de TERMODINÁMICA II Curso 1997-98
 ESCUELA SUPERIOR DE INGENIEROS INDUSTRIALES Universidad de Navarra Examen de TERMODINÁMICA II Curso 997-98 Obligatoria centro - créditos de agosto de 998 Instrucciones para el examen de TEST: Cada pregunta
ESCUELA SUPERIOR DE INGENIEROS INDUSTRIALES Universidad de Navarra Examen de TERMODINÁMICA II Curso 997-98 Obligatoria centro - créditos de agosto de 998 Instrucciones para el examen de TEST: Cada pregunta
TERMODINAMICA INTRODUCCION. CALOR Y TRABAJO
 TERMODINAMICA INTRODUCCION. La termodinámica puede definirse como el tema de la Física que estudia los procesos en los que se transfiere energía como calor y como trabajo. Al hablar de termodinámica, con
TERMODINAMICA INTRODUCCION. La termodinámica puede definirse como el tema de la Física que estudia los procesos en los que se transfiere energía como calor y como trabajo. Al hablar de termodinámica, con
Eduardo Kido 26-Mayo-2004 ANÁLISIS DE DATOS
 ANÁLISIS DE DATOS Hoy día vamos a hablar de algunas medidas de resumen de datos: cómo resumir cuando tenemos una serie de datos numéricos, generalmente en variables intervalares. Cuando nosotros tenemos
ANÁLISIS DE DATOS Hoy día vamos a hablar de algunas medidas de resumen de datos: cómo resumir cuando tenemos una serie de datos numéricos, generalmente en variables intervalares. Cuando nosotros tenemos
Actividad: Qué es la anomalía del agua?
 Nivel: 1º Medio Subsector: Ciencias químicas Unidad temática: El agua Actividad: Seguramente ya has escuchado sobre la anomalía del agua. Sabes en qué consiste y qué es algo anómalo? Se dice que algo es
Nivel: 1º Medio Subsector: Ciencias químicas Unidad temática: El agua Actividad: Seguramente ya has escuchado sobre la anomalía del agua. Sabes en qué consiste y qué es algo anómalo? Se dice que algo es
C()n()cer- el C()WP()rtamient() del air-e pe..-mite aplicar- cñteñ()s C()r-r-ect()s de manej() en el ac()ndici()namient() y almacenaie..
 C()n()cer- el C()WP()rtamient() del air-e pe..-mite aplicar- cñteñ()s C()r-r-ect()s de manej() en el ac()ndici()namient() y almacenaie.. Ricardo Muñoz C. Ingeniero Agrónomo M.S. Sicrometría, en términos
C()n()cer- el C()WP()rtamient() del air-e pe..-mite aplicar- cñteñ()s C()r-r-ect()s de manej() en el ac()ndici()namient() y almacenaie.. Ricardo Muñoz C. Ingeniero Agrónomo M.S. Sicrometría, en términos
Polo positivo: mayor potencial. Polo negativo: menor potencial
 CORRIENTE ELÉCTRICA Es el flujo de carga a través de un conductor Aunque son los electrones los responsables de la corriente eléctrica, está establecido el tomar la dirección de la corriente eléctrica
CORRIENTE ELÉCTRICA Es el flujo de carga a través de un conductor Aunque son los electrones los responsables de la corriente eléctrica, está establecido el tomar la dirección de la corriente eléctrica
Problemas de Fundamentos de Química (1º Grado en Física) Tema 2. FUERZAS INTERMOLECULARES
 Problemas de Fundamentos de Química (1º Grado en Física) Tema 2. FUERZAS INTERMOLECULARES 2.1. Calcula la presión que ejerce 1 mol de Cl 2 (g), de CO 2 (g) y de CO (g) cuando se encuentra ocupando un volumen
Problemas de Fundamentos de Química (1º Grado en Física) Tema 2. FUERZAS INTERMOLECULARES 2.1. Calcula la presión que ejerce 1 mol de Cl 2 (g), de CO 2 (g) y de CO (g) cuando se encuentra ocupando un volumen
1 cal = 4,18 J. 1 kwh = 1000 Wh = 1000 W 3600 s/h = 3600 1000 J = 3 6 10 6 J
 Energía Se define la energía, como la capacidad para realizar un cambio en forma de trabajo. Se mide en el sistema internacional en Julios (J), que se define como el trabajo que realiza una fuerza de 1N
Energía Se define la energía, como la capacidad para realizar un cambio en forma de trabajo. Se mide en el sistema internacional en Julios (J), que se define como el trabajo que realiza una fuerza de 1N
Tema : MOTORES TÉRMICOS:
 Tema : MOTORES TÉRMICOS: 1.1CARACTERÍSTICAS DE LOS MOTORES Se llama motor a toda máquina que transforma cualquier tipo de energía en energía mecánica. Según sea el elemento que suministra la energía tenemos
Tema : MOTORES TÉRMICOS: 1.1CARACTERÍSTICAS DE LOS MOTORES Se llama motor a toda máquina que transforma cualquier tipo de energía en energía mecánica. Según sea el elemento que suministra la energía tenemos
III. DIFUSION EN SOLIDOS
 Metalografía y Tratamientos Térmicos III - 1 - III. DIFUSION EN SOLIDOS III.1. Velocidad de procesos en sólidos Muchos procesos de producción y aplicaciones en materiales de ingeniería están relacionados
Metalografía y Tratamientos Térmicos III - 1 - III. DIFUSION EN SOLIDOS III.1. Velocidad de procesos en sólidos Muchos procesos de producción y aplicaciones en materiales de ingeniería están relacionados
Termodinámica de la atmósfera. Ana Lage González http://www.meteogalicia.es
 Termodinámica de la atmósfera. Ana Lage González http://www.meteogalicia.es La composición del aire seco es bastante uniforme y la composición relativa de los gases se mantiene casi cte. hasta unos 90
Termodinámica de la atmósfera. Ana Lage González http://www.meteogalicia.es La composición del aire seco es bastante uniforme y la composición relativa de los gases se mantiene casi cte. hasta unos 90
PROPORCIONALIDAD - teoría
 PROPORCIONALIDAD RAZÓN: razón de dos números es el cociente indicado de ambos. Es decir, la razón de los dos números a y b es a:b, o lo que es lo mismo, la fracción b a. PROPORCIÓN: es la igualdad de dos
PROPORCIONALIDAD RAZÓN: razón de dos números es el cociente indicado de ambos. Es decir, la razón de los dos números a y b es a:b, o lo que es lo mismo, la fracción b a. PROPORCIÓN: es la igualdad de dos
Contenidos Didácticos
 INDICE --------------------------------------------------------------------------------------------------------------------------------------------- 1 FUERZA...3 2 TRABAJO...5 3 POTENCIA...6 4 ENERGÍA...7
INDICE --------------------------------------------------------------------------------------------------------------------------------------------- 1 FUERZA...3 2 TRABAJO...5 3 POTENCIA...6 4 ENERGÍA...7
Capítulo 6 Acciones de control
 Capítulo 6 Aiones de ontrol 6.1 Desripión de un bule de ontrol Un bule de ontrol por retroalimentaión se ompone de un proeso, el sistema de mediión de la variable ontrolada, el sistema de ontrol y el elemento
Capítulo 6 Aiones de ontrol 6.1 Desripión de un bule de ontrol Un bule de ontrol por retroalimentaión se ompone de un proeso, el sistema de mediión de la variable ontrolada, el sistema de ontrol y el elemento
Física y Química 4º ESO Apuntes de Dinámica página 1 de 5 CONCEPTO DE ENERGÍA
 Física y Química 4º ESO Apuntes de Dinámica página 1 de 5 CONCEPTO DE ENERGÍA Antes se definía la energía como la capacidad de un cuerpo o sistema para realizar un trabajo. Vamos a ver una explicación
Física y Química 4º ESO Apuntes de Dinámica página 1 de 5 CONCEPTO DE ENERGÍA Antes se definía la energía como la capacidad de un cuerpo o sistema para realizar un trabajo. Vamos a ver una explicación
TERMODINÁMICA Tema 10: El Gas Ideal
 TERMODINÁMICA Tema 10: El Gas Ideal Fundamentos Físicos de la Ingeniería 1 er Curso Ingeniería Industrial Dpto. Física Aplicada III 1 Índice Introducción Ecuación de estado Experimento de Joule Capacidades
TERMODINÁMICA Tema 10: El Gas Ideal Fundamentos Físicos de la Ingeniería 1 er Curso Ingeniería Industrial Dpto. Física Aplicada III 1 Índice Introducción Ecuación de estado Experimento de Joule Capacidades
CHOQUE.(CANTIDAD DE MOVIMIENTO )
 APUNTES Materia: Tema: Curso: Física y Química Momento Lineal 4º ESO CHOQUE.(CANTIDAD DE MOVIMIENTO ) CANTIDAD DE MOVIMIENTO Si un cuerpo de masa m se está moviendo con velocidad v, la cantidad de movimiento
APUNTES Materia: Tema: Curso: Física y Química Momento Lineal 4º ESO CHOQUE.(CANTIDAD DE MOVIMIENTO ) CANTIDAD DE MOVIMIENTO Si un cuerpo de masa m se está moviendo con velocidad v, la cantidad de movimiento
TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones.
 Esquema: TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones. TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones....1 1.- Introducción...1 2.- Máquina frigorífica...1
Esquema: TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones. TEMA 4: Circuito frigorífico y bomba de calor: elementos y aplicaciones....1 1.- Introducción...1 2.- Máquina frigorífica...1
Termometría Ley de enfriamiento de Newton
 Termometría Ley de enfriamiento de Newton Objetivo Estudio del enfriamiento y el calentamiento de cuerpos y líquidos. Uso de distintos métodos de medición y análisis de los datos. Introducción El tiempo
Termometría Ley de enfriamiento de Newton Objetivo Estudio del enfriamiento y el calentamiento de cuerpos y líquidos. Uso de distintos métodos de medición y análisis de los datos. Introducción El tiempo
Actividad V.53 Transiciones de fases Calor latente de transformación
 Actividad V.53 Transiciones de fases Calor latente de transformación Objetivo Estudio de transiciones de fase líquido vapor y sólido líquido. Medición de los calores latentes de evaporación y de fusión
Actividad V.53 Transiciones de fases Calor latente de transformación Objetivo Estudio de transiciones de fase líquido vapor y sólido líquido. Medición de los calores latentes de evaporación y de fusión
1. Montar un modelo de máquina térmica, 2. Poner a funcionar el modelo para levantar un objeto, 3. Describir y explicar el funcionamiento del modelo
 Experimento 11 GAS IDEAL Objetivos 1. Montar un modelo de máquina térmica, 2. Poner a funcionar el modelo para levantar un objeto, 3. Describir y explicar el funcionamiento del modelo Teoría La termodinámica
Experimento 11 GAS IDEAL Objetivos 1. Montar un modelo de máquina térmica, 2. Poner a funcionar el modelo para levantar un objeto, 3. Describir y explicar el funcionamiento del modelo Teoría La termodinámica
Bases Físicas del Medio Ambiente. Propiedades y Procesos Térmicos
 Bases Físicas del Medio Ambiente Propiedades y Procesos Térmicos Programa IX. PROPIEDADES Y PROCESOS TÉRMICOS. (1h) Introducción. Dilatación térmica. Fases. Cambios de fase. Calores latentes. Superficies
Bases Físicas del Medio Ambiente Propiedades y Procesos Térmicos Programa IX. PROPIEDADES Y PROCESOS TÉRMICOS. (1h) Introducción. Dilatación térmica. Fases. Cambios de fase. Calores latentes. Superficies
Guía de compra de aire acondicionado
 Guía de compra de aire acondicionado Comprar un nuevo sistema de aire acondicionado es una decisión importante. Esta Guía le puede ayudar a tomar la decisión correcta, para ahorrar energía y dinero. COMPRE
Guía de compra de aire acondicionado Comprar un nuevo sistema de aire acondicionado es una decisión importante. Esta Guía le puede ayudar a tomar la decisión correcta, para ahorrar energía y dinero. COMPRE
Comparación entre curvas de calentamiento teóricas y experimentales
 Comparación entre curvas de calentamiento teóricas y experimentales Práctica no pautada de Laboratorio, Física experimental II, 9 Larregain, Pedro pedrolarregain@yahoo.com Machado, Alejandro machado.alejandro@yahoo.com
Comparación entre curvas de calentamiento teóricas y experimentales Práctica no pautada de Laboratorio, Física experimental II, 9 Larregain, Pedro pedrolarregain@yahoo.com Machado, Alejandro machado.alejandro@yahoo.com
DEFINICIONES BÁSICAS ELEMENTOS PARTICIPANTES TETRAEDRO DEL FUEGO
 DEFINICIONES BASICA EXTINTORES CP DEFINICIONES BÁSICAS FUEGO: Fenómeno químico exotérmico, con desprendimiento de calor y luz, es el resultado de la combinación de: COMBUSTIBLE, CALOR Y OXIGENO. INCENDIO:
DEFINICIONES BASICA EXTINTORES CP DEFINICIONES BÁSICAS FUEGO: Fenómeno químico exotérmico, con desprendimiento de calor y luz, es el resultado de la combinación de: COMBUSTIBLE, CALOR Y OXIGENO. INCENDIO:
TEMA 2. CIRCUITOS ELÉCTRICOS.
 TEMA 2. CIRCUITOS ELÉCTRICOS. 1. INTRODUCCIÓN. A lo largo del presente tema vamos a estudiar los circuitos eléctricos, para lo cual es necesario recordar una serie de conceptos previos tales como la estructura
TEMA 2. CIRCUITOS ELÉCTRICOS. 1. INTRODUCCIÓN. A lo largo del presente tema vamos a estudiar los circuitos eléctricos, para lo cual es necesario recordar una serie de conceptos previos tales como la estructura
PRÁCTICA NÚMERO 1 DENSIDAD DE UNA SUSTANCIA. I. Objetivo Determinar la densidad de un líquido y un sólido midiendo su masa y su volumen.
 PRÁCTICA NÚMERO DENSIDAD DE UNA SUSTANCIA I. Objetivo Determinar la densidad de un líquido y un sólido midiendo su masa y su volumen. II. Material. Una balanza granataria de 0. gramo.. Una probeta de 0-00
PRÁCTICA NÚMERO DENSIDAD DE UNA SUSTANCIA I. Objetivo Determinar la densidad de un líquido y un sólido midiendo su masa y su volumen. II. Material. Una balanza granataria de 0. gramo.. Una probeta de 0-00
TERMODINÁMICA y FÍSICA ESTADÍSTICA I
 TERMODINÁMICA y FÍSICA ESTADÍSTICA I Tema 5 - LAS MÁUINAS TÉRMICAS Y EL SEGUNDO PRINCIPIO DE LA TERMODINÁMICA Transormaión de trabajo en alor y vieversa. Cilo de Otto. Cilo de Diesel. Cilo de Rankine.
TERMODINÁMICA y FÍSICA ESTADÍSTICA I Tema 5 - LAS MÁUINAS TÉRMICAS Y EL SEGUNDO PRINCIPIO DE LA TERMODINÁMICA Transormaión de trabajo en alor y vieversa. Cilo de Otto. Cilo de Diesel. Cilo de Rankine.
La Comercialización De Los Productos Varios
 La Competencia La Comercialización De Los Productos Varios Somos una tienda de venta al menudeo (retail). Es cierto que por sobre todas las cosas somos una casa de empeño, pero también somos competencia
La Competencia La Comercialización De Los Productos Varios Somos una tienda de venta al menudeo (retail). Es cierto que por sobre todas las cosas somos una casa de empeño, pero también somos competencia
PROBLEMAS RESUELTOS EQUILIBRIO TERMICO. Para cualquier inquietud o consulta escribir a: quintere@hotmail.com quintere@gmail.com quintere2006@yahoo.
 PROBLEMAS RESUELTOS EQUILIBRIO TERMICO Para cualquier inquietud o consulta escribir a: quintere@hotmail.com quintere@gmail.com quintere2006@yahoo.com Erving Quintero Gil Ing. Electromecánico Bucaramanga
PROBLEMAS RESUELTOS EQUILIBRIO TERMICO Para cualquier inquietud o consulta escribir a: quintere@hotmail.com quintere@gmail.com quintere2006@yahoo.com Erving Quintero Gil Ing. Electromecánico Bucaramanga
Elección de refrigerante: Un nuevo informe revela la eficacia ecológica de los sistemas de refrigeración de los supermercados
 Elección de refrigerante: Un nuevo informe revela la eficacia ecológica de los sistemas de refrigeración de los supermercados Desde que la Unión Europea se comprometió a reducir las emisiones de gases
Elección de refrigerante: Un nuevo informe revela la eficacia ecológica de los sistemas de refrigeración de los supermercados Desde que la Unión Europea se comprometió a reducir las emisiones de gases
El corazón, al tener paredes musculares, puede dilatarse y contraerse, lo que le permite bombear la sangre.
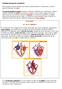 Fisiología del aparato circulatorio El corazón, al tener paredes musculares, puede dilatarse y contraerse, lo que le permite bombear la sangre. El corazón bombea la sangre de forma continua, mediante dos
Fisiología del aparato circulatorio El corazón, al tener paredes musculares, puede dilatarse y contraerse, lo que le permite bombear la sangre. El corazón bombea la sangre de forma continua, mediante dos
LÍNEAS DEL DIAGRAMA DE MOLLIER
 DIAGRAMA DE MOLLIER El refrigerante cambia de estado a lo largo del ciclo frigorífico como hemos visto en el capítulo anterior. Representaremos sobre el diagrama de p-h las distintas transformaciones que
DIAGRAMA DE MOLLIER El refrigerante cambia de estado a lo largo del ciclo frigorífico como hemos visto en el capítulo anterior. Representaremos sobre el diagrama de p-h las distintas transformaciones que
Calor específico Calorimetría
 Calor espeíio Calorimetría Físia II Lieniatura en Físia 2003 Autores: Andrea Fourty María de los Angeles Bertinetti Adriana Foussats Calor espeíio y alorimetría Cátedra Físia II (Lieniatura en Físia) 1.-
Calor espeíio Calorimetría Físia II Lieniatura en Físia 2003 Autores: Andrea Fourty María de los Angeles Bertinetti Adriana Foussats Calor espeíio y alorimetría Cátedra Físia II (Lieniatura en Físia) 1.-
Centro de Investigaciones de Tecnología Pesquera y Alimentos Regionales (INTI - CITEP - Centro Regional Sur)
 Ing. Alicia S. Ciarlo Ing. Alejandro C. Booman Centro de Investigaciones de Tecnología Pesquera y Alimentos Regionales (INTI - CITEP - Centro Regional Sur) La mitad de la producción mundial de alimentos
Ing. Alicia S. Ciarlo Ing. Alejandro C. Booman Centro de Investigaciones de Tecnología Pesquera y Alimentos Regionales (INTI - CITEP - Centro Regional Sur) La mitad de la producción mundial de alimentos
TEMA 8 CAMPO ELÉCTRICO
 TEMA 8 CAMPO ELÉCTRICO INTERACCIÓN ELECTROSTÁTICA Los antiguos griegos ya sabían que el ámbar frotado con lana adquiría la propiedad de atraer cuerpos ligeros. Todos estamos familiarizados con los efectos
TEMA 8 CAMPO ELÉCTRICO INTERACCIÓN ELECTROSTÁTICA Los antiguos griegos ya sabían que el ámbar frotado con lana adquiría la propiedad de atraer cuerpos ligeros. Todos estamos familiarizados con los efectos
Módulo 3: Fluidos. Fluidos
 Módulo 3: Fluidos 1 Fluidos Qué es un fluido? En Física, un fluido es una sustancia que se deforma continuamente (fluye) bajo la aplicación de una tensión tangencial, por muy pequeña que sea. Es decir,
Módulo 3: Fluidos 1 Fluidos Qué es un fluido? En Física, un fluido es una sustancia que se deforma continuamente (fluye) bajo la aplicación de una tensión tangencial, por muy pequeña que sea. Es decir,
Experimento de Calentamiento Global
 Nombre Experimento de Calentamiento Global Pregunta: Cómo mantiene la tierra un rango de temperatura que puede aguantar la vida? Qué provee a la tierra de calor? Qué evita que la tierra se caliente en
Nombre Experimento de Calentamiento Global Pregunta: Cómo mantiene la tierra un rango de temperatura que puede aguantar la vida? Qué provee a la tierra de calor? Qué evita que la tierra se caliente en
NÚMEROS NATURALES Y NÚMEROS ENTEROS
 NÚMEROS NATURALES Y NÚMEROS ENTEROS Los números naturales surgen como respuesta a la necesidad de nuestros antepasados de contar los elementos de un conjunto (por ejemplo los animales de un rebaño) y de
NÚMEROS NATURALES Y NÚMEROS ENTEROS Los números naturales surgen como respuesta a la necesidad de nuestros antepasados de contar los elementos de un conjunto (por ejemplo los animales de un rebaño) y de
PRÁCTICA 5. CALORIMETRÍA
 PRÁCTICA 5. CALORIMETRÍA INTRODUCCIÓN Al mezclar dos cantidades de líquidos a distinta temperatura se genera una transferencia de energía en forma de calor desde el más caliente al más frío. Dicho tránsito
PRÁCTICA 5. CALORIMETRÍA INTRODUCCIÓN Al mezclar dos cantidades de líquidos a distinta temperatura se genera una transferencia de energía en forma de calor desde el más caliente al más frío. Dicho tránsito
Estabilidad dinámica Introducción
 Figura 127: Varada Si el momento de asiento unitario del barco, en las condiciones de desplazamiento en las que se encuentra, es M u, tendremos que la alteración producida al bajar la marea de forma que
Figura 127: Varada Si el momento de asiento unitario del barco, en las condiciones de desplazamiento en las que se encuentra, es M u, tendremos que la alteración producida al bajar la marea de forma que
CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION
 CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION Como hemos dicho anteriormente, los instrumentos de medición hacen posible la observación de los fenómenos eléctricos y su cuantificación. Ahora
CAPITULO II CARACTERISTICAS DE LOS INSTRUMENTOS DE MEDICION Como hemos dicho anteriormente, los instrumentos de medición hacen posible la observación de los fenómenos eléctricos y su cuantificación. Ahora
mecánica estadística Principios Fundamentales Capítulo 1
 mecánica estadística Principios Fundamentales Capítulo 1 2014 Objetivo de la mecánica estadística Predecir el comportamiento macroscópico de un sistema, en base de las propiedades microscópicas de las
mecánica estadística Principios Fundamentales Capítulo 1 2014 Objetivo de la mecánica estadística Predecir el comportamiento macroscópico de un sistema, en base de las propiedades microscópicas de las
La energía natural. eficiencia.y.ahorro
 76 La energía natural 77 78 energíanatural Introducción los recursos y limitación de su consumo). Existen técnicas para obtener importantes ahorros de energía. Las fundamentales son: Cogeneración. Generación
76 La energía natural 77 78 energíanatural Introducción los recursos y limitación de su consumo). Existen técnicas para obtener importantes ahorros de energía. Las fundamentales son: Cogeneración. Generación
