PROBLEMARIO DE QUÍMICA ANALÍTICA II. Espectrometría UV-Visible
|
|
|
- Vicenta Cruz Herrero
- hace 7 años
- Vistas:
Transcripción
1 UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DEPARTAMENT DE QUIMICA UNIDAD ACADÉMICA DE QUÍMICA ANALÍTICA MATERIA: QUÍMICA ANALÍTICA II PRBLEMARI DE QUÍMICA ANALÍTICA II Espectrometría UV-Visible Elaborado por: Prof. Dr. Gerson Chávez Narváez Febrero 2008
2 CUESTINARI: 1.- Definir: - Radiación coherente - Transparencia - Dispersión - Efecto fotoeléctrico - Excitación electrónica - Cuerpo Negro - Fluorescencia - Fosforescencia - Absortividad - Numero de onda - Relajación - Longitud de onda - Intensidad de radiación - Potencia de radiación - Energía radiante 2.- Definir: - Fluorescencia - Fosforescencia - Fluorescencia de resonancia - Estado singulete - Estado triplete - Relajación vibracional - Conversión interna - Conversión externa - Cruce entre sistemas - Predisociación - Disociación - Rendimiento cuántico - Quimioluminiscencia 3.- Explicar por qué la espectrofluorometría es potencialmente más sensible que la espectrofotometría. 4.- Explicar en qué disolvente es de esperar que presente más fluorescencia el naftaleno: 1-cloropropano, 1-bromopropano o 1-yodopropano. PRBLEMAS: 1.- Calcular la frecuencia (en hertzios), la energía (en joulios) y la energía (en e-voltios) de un fotón con longitud de onda de 2,70 Å. 2.- Calcular la velocidad, la frecuencia, la energía y la longitud de onda de un fotón que tiene tres veces más energía que otro fotón cuya longitud de onda es 500 nm. 3.- La energía de enlace del yoduro de plata es aproximadamente 255 KJ/mol. Calcular la longitud de onda más larga capaz de romper este enlace. 4.- Transformar los siguientes datos de absorbancia en porcentaje de transmitancia: a) 0,375 b) 1,325 c) 0,012 d) 0,188 e) 0,663 f) 0, Transformar los siguientes datos de porcentaje de transmitancia en absorbancia: a) 33,6 b) 92,1 c) 1,75 d) 16,8 e) 46,1 f) 0,8 6.- Una disolución de 4,14 x 10-3 M de un compuesto presentó una transmitancia de 0,126 cuando se midió en una celda de 2,00 cm. Calcular la concentración del compuesto necesaria para que la transmitancia aumente tres veces cuando se utiliza una celda de 1,00 cm. 7.- Un compuesto tiene una absortividad molar de 2,17 x 10 3 L cm -1 mol -1. Calcular la concentración del compuesto necesaria para obtener una transmitancia de 8,42 % en una celda de 2,50 cm. 8.- Una disolución que contiene 4,48 ppm de KMn 4 presenta una transmitancia de 0,309 en una cubeta de 1,00 cm a 520 nm. Calcular la absortividad molar del KMn 4.
3 9.- Una disoluci n que contiene 3,75 mg/100 ml de un compuesto (220 g/mol) presenta una transmitancia de 39,6 % en una cubeta de 1,5 cm a 480 nm. Calcular la absortividad molar del compuesto El complejo FeSCN +2, cuya longitud de onda de máxima absorción es 580 nm, tiene una absortividad molar de 7,00 x 10 3 L/cm.mol. Calcular: (a) la absorbancia y transmitancia a 580 nm de una solución del complejo 2,50 x 10-5 M si se mide en una cubeta de 1,00 cm; (b) la absorbancia y transmitancia de una solución del complejo cuya concentración es el doble de la anterior; (c) una alícuota de 2,5 ml de una solución que contiene 3,8 ppm de Fe +3 se trata con un exceso de KSCN y se diluye hasta 50,0 ml, calcular la absorbancia de la solución resultante a 580 nm si se mide en una cubeta de 2,5 cm Se realizaron diluciones de un patrón de hierro y los datos se presentan en la tabla. Posteriormente se obtuvo el complejo de Fe +2 /1,10-fenantrolina en alícuotas de 25,0 ml de estas disoluciones y seguidamente se diluyeron hasta 50,0 ml. Se leyeron las siguientes absorbancias a 510 nm: Concentración de Fe +2, ppm Absorbancia (cubeta 1 cm) 2,0 0,164 4,0 0,425 8,0 0,628 12,0 0,951 16,0 1,260 20,0 1,582 (a) Construir la curva de calibrado a partir de estos datos. (b) btener la ecuación de la recta por mínimos cuadrados, y calcular la desviación estándar del intercepto y la pendiente. (c) Determinar la concentración de hierro de un patrón cuya absorbancia fue de 0,711 luego de realizar el tratamiento descrito arriba. (d) Calcular la desviación estándar de la concentración determinada. (e) El método descrito se aplicó en la determinación rutinaria de hierro en alícuotas de 25,0 ml de aguas naturales. Determinar la concentración (en ppm de Fe) de muestras que dieron absorbancias de 0,107; 0,721 y 1,538, en cubetas de 1,0 cm. Calcular la desviación estándar para las concentraciones calculadas Una alícuota de 25,0 ml de una solución acuosa de quinina se diluyó hasta 50,0 ml y se encontró una absorbancia de 0,832 a 348 nm, cuando se midió en una cubeta de 2,00 cm. Una segunda alícuota de 25,0 ml se mezcló con 10,0 ml de una solución que contenía 23,4 ppm de quinina. Después de diluir hasta 50,0 ml esta solución presentó una absorbancia de 1,220 en una cubeta de 2,0 cm. Calcular la concentración (en ppm) de quinina en la muestra.
4 13.- La determinación simultánea de cobalto y níquel se puede basar en la absorción de sus respectivos complejos con 8-hidroxiquinolinol. Las absortividades molares correspondientes a sus máximos de absorción son las siguientes: Absortividad molar, ε 365 nm 700 nm Co Ni Calcular la concentración molar de níquel y cobalto en cada una de las siguientes soluciones, basándose en los siguientes datos: Absorbancia 365 nm 700 nm A 0,598 0,039 B 0,902 0, Cuando se midió, en una cubeta de 1,00 cm, una solución 8,50 x 10-5 M de la especia A, presentó absorbancias de 0,129 y 0,764 a 475 y 700 nm respectivamente. Una solución 4,65 x 10-5 M de la especie B dio absorbancias de 0,567 y 0,083 bajo las mismas condiciones. Calcular las concentraciones de A y B en solcuiones que dieron los siguientes resultados de absorbancias en una cubeta de 1,25 cm: (a) 0,502 a 475 nm y 0,912 a 700 nm; (b) 0,675 a 475 nm y 0,696 a 700 nm La forma reducida del nucleótido de adenina y nicotinamida (NADH) es una importante coenzima y altamente fluorescente. Tiene un máximo de absorción a 340 nm y un máximo de emisión a 465 nm. Unas disoluciones patrón de NADH dieron las siguientes intensidades de fluorescencia: NADH (μmol/l) Intensidad relativa, I 0,100 2,24 0,200 4,74 0,300 6,59 0,400 8,98 0,500 10,93 0,600 14,01 0,700 15,49 0,800 18,02 (a) Construir la curva de calibrado para el NADH. (b) btener la ecuación de la recta por mínimos cuadrados, y calcular la desviación estándar del intercepto y la pendiente. (c) Una solución problema presenta una fluorescencia relativa de 12,16. Calcular la concentración de NADH. (d) Calcular la desviación estándar de la concentración determinada.
5 Absorbancia 16.- Los iones de Fe(II) catalizan la reacción del luminol con H 2 2. Se ha comprobado que la intensidad de quimioluminiscencia resultante aumenta linealmente con la concentración del hierro(ii) desde a 10-8 M. A una alícuota de 2,00 ml de una solución problema de Fe(II) se adicionaron 1,00 ml de agua, seguidos de 2,00 ml de una solución diluida de H 2 2 y 1,00 ml de una solución alcalina de luminol. La señal quimioluminiscente de la mezcla se integró durante un período de 10,0 s y se encontró un valor de 16,1. A una segunda alícuota de 2,00 ml de la muestra se adicionaron 1,00 ml de una disolución de Fe(II) 4,75 x 10-5 M seguido del mismo volumen de H22 y luminol. La intensidad integrada fue 29,6. Calcular la concentración molar del Fe(II) en la muestra Se conoce que cierto compuesto corresponde a una amina saturada o una amina insaturada. El espectro del compuesto se proporciona a continuación. A cuál es la estructura que corresponde?, indicar las longitudes de onda máxima y qué transiciones están involucradas Longitud de onda (nm) 18.- La max para el etileno es aproximadamente 185 nm, mientras que para el 1,3-butadieno es 217 nm. Utilizando un diagrama de energía, explique por qué existe hay un desplazamiento de max entre estos compuestos Para las estructuras que se muestran a continuación, explique cuál de los compuestos tendrá un espectro desplazado hacia la región del azul. CH Para las estructuras que se muestran a continuación, explique cuál de los compuestos tendrá un espectro desplazado hacia la región del rojo.
6 Energía Energía 20.- Cuál de los siguientes compuestos es de esperarse que absorba radiación de mayor o menor longitud de onda?. Explique realizando un diagrama de energía para cada compuesto. CH En el diagrama de energía que se muestra a continuación, indique los cambios relativos de energía que origina un solvente apolar y uno polar. Explique. π* π 22.- En el diagrama de energía que se muestra a continuación, indique los cambios relativos de energía que origina un solvente polar prótico y uno aprótico. Explique. π* n π 23.- Calcule las λ máx de las siguientes estructuras y compare los valores de ε en L/mol.cm para las estructuras similares. S λ máx = 239 nm λ máx = 235 nm λ máx = 275 nm λ máx = 268 nm ε = ε = ε = ε =
7 CH 2 C λ máx = 241 nm λ máx = 235 nm ε = ε = A continuación se presentan tres estructuras orgánicas con sus valores respectivos de max y absortividad molar (ε). Compare los valores y explique qué efecto origina estas diferencias. S λ máx = 239 nm; ε = λ máx = 235 nm; ε = λ máx = 268 nm; ε = Calcule las λ máx de las siguientes estructuras, compare con los valores experimentales encontrados: Br CH H H H 2 N λ máx = 254 nm λ máx = 278 nm λ máx = 288 nm 26.- Calcule las λ máx de las siguientes estructuras, los valores calculados se presentan ente paréntesis: H 3 C CH C CH( ) 2 λ máx = 238 nm (239) λ máx = 235 nm (234) λ máx = 273 nm (278)
8 H 3 C CH Cl CH 2 CH( ) 2 H 3 C H λ máx = 238 nm (239) λ máx = 276 nm (274) λ máx = 257 nm (256) H 3 C H C C H 3 C C λ máx = 237 nm (239) λ máx = 232 nm (237) λ máx = 243 nm (249) λ máx = 254 nm (254) λ máx = 225 nm (227) λ máx = 241 nm (242) Cl H CCH 2 CH( ) 2 λ máx = 254 nm (254) λ máx = 225 nm (227) λ máx = 241 nm (242) H λ máx = 294 nm (299) λ máx = 313 nm (315) λ máx = 278 nm (289)
9 H 3 C CH CH( ) 2 λ máx = 356 nm (353) 27.- Los siguientes compuestos presentaron λ máx a 241 nm (ε = 4.700), 254 nm (ε = 9.550) y 259 nm (ε = ), en etanol. A cuál estructura corresponde? Los siguientes compuestos presentaron λ máx a 231 nm (ε = ), 236 nm (ε = ), 245 nm (ε = ), 265 nm (ε = 6.400) y 282 nm (ε = ) en etanol. A cuál estructura corresponde?. CH 2
10 29.- Los siguientes compuestos presentaron λ máx a 306 nm (ε = ), 315 nm (ε = ), y 355 nm (ε = ) en etanol. A cuál estructura corresponde?. H 3 CC H 3 CC 30.- Los siguientes compuestos presentaron λ máx a 284 nm (ε = ), 315 nm (ε = 7.000), y 348 nm (ε = ) en etanol. A cuál estructura corresponde? Los siguientes estructuras correspondan a reactivos fluorimétricos para especies inorgánicas. Se indica la longitud de onda de excitación ( exc ) y la intensidad de fluorescencia relativa (I). Explicar a qué se deben las diferencias en la fluorescencia?. H H H N H N N 8-hidroxiquinolina Alizarina R exc = 370 nm exc = 470 nm I = 580 I = 500 S 3 Na 32.- Los siguientes estructuras correspondan a reactivos fluorimétricos para especies inorgánicas. Se indica la longitud de onda de excitación ( exc ) y la intensidad de fluorescencia relativa (I). Explicar a qué se deben las diferencias en la fluorescencia?. Flavanol H Benzoína exc = 370 nm exc = 470 nm I = 580 I = 500 H
11 33.- Cuál de los siguientes compuestos se espera una mayor sensibilidad en la determinación fluorimétrica?. Explicar. H H CH CH Fenolftaleína Fluoresceína 34.- Dentro del grupo de las vitaminas B, la B 2 presenta fluorescencia nativa mientras que la B 1 necesita una transformación previa por oxidación para la determinación fluorimétrica. Explique a qué se debe este hecho. Vitamina B2 (riboflavina) Vitamina B1 (tiamina) 35.- Se prepararon soluciones con cantidades variables de aluminio, se añadió 8-quinolinol y el complejo fue extraído con cloroformo. Todos los extractos de cloroformo se diluyeron a 50 ml y se compararon con un fluorómetro. Las lecturas fueron las siguientes: Aluminio (μg/50 ml) Intensidad relativa, I Construya la curva de calibración correspondiente y explique si la misma cumple la relación de la Ley de Beer para la fluorescencia. Qué intervalo de concentración es el adecuado para la determinación?. Determinar la concentración de aluminio en una muestra que arrojó una intensidad de 22 luego de la extracción con cloroformo El verde de oregon, un ácido carboxílico de la fluoresceína, es un fluoróforo muy utilizado en bioquímica. Su empleo depende de la intensidad de fluorescencia que se desea.
12 Cuando los grupos R 2 y R 3 están sustituidos por Cl el compuesto posee un espectro de fluorescencia con máximo a 535 nm, pero cuando los grupos R 1 y R 2 están sustituidos por un grupo metoxi el máximo se desplaza a 557 nm y la intensidad es mayor que el compuesto anterior. Explique este hecho. R 1 R 1 H R 2 R 2 R 3 CH R La ninhidrina es un compuesto que reacciona con los aminoácidos originando un producto púrpura no fluorescente. En presencia de Zn +2 es inducida una alta fluorescencia. Explique (a) Porqué la ninhidrina disociada no se comporta como fluoróforo; (b) Porqué la presencia del metal induce la fluorescencia molecular. - N
de una disolución estándar de NaF que contenía 10.0 ppb de fluoruro.
 Absorcion atomica PROBLEMAS 1.-Se pipetean los siguientes volumenes (0.0, 4.0, 8.0 y 12.0 ml) de una disolucion que contenia 1.1ppm de Cinc(II). Estas disoluciones se llevaron a embudos de decantación
Absorcion atomica PROBLEMAS 1.-Se pipetean los siguientes volumenes (0.0, 4.0, 8.0 y 12.0 ml) de una disolucion que contenia 1.1ppm de Cinc(II). Estas disoluciones se llevaron a embudos de decantación
Lección 4: Aplicación de la espectrometría de absorción Molecular UV- Visible
 Lección 4: Aplicación de la espectrometría de absorción Molecular UV- Visible La espectrometría UV-Vis es una técnica eficaz para identificar o asignar una estructura a los compuestos químicos (orgánicos
Lección 4: Aplicación de la espectrometría de absorción Molecular UV- Visible La espectrometría UV-Vis es una técnica eficaz para identificar o asignar una estructura a los compuestos químicos (orgánicos
Resolución de los Ejercicios Propuestos (2), 2006
 Resolución de los Ejercicios Propuestos (2), 2006 Dr. L. J. Rodríguez 18 de mayo de 2006 1. Se obtuvieron los siguientes datos de transmitancia para disoluciones acuosas de oxihemoglobina (M: 66 500 g/mol)
Resolución de los Ejercicios Propuestos (2), 2006 Dr. L. J. Rodríguez 18 de mayo de 2006 1. Se obtuvieron los siguientes datos de transmitancia para disoluciones acuosas de oxihemoglobina (M: 66 500 g/mol)
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 2º RELACIÓN DE PROBLEMAS.
 FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. º RELACIÓN DE PROBLEMAS. 1.- Evalúe las cantidades restantes de la tabla adjunta. Cuando sea necesario use 00 como masa molecular del analito. ε a B c A % T L mol
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. º RELACIÓN DE PROBLEMAS. 1.- Evalúe las cantidades restantes de la tabla adjunta. Cuando sea necesario use 00 como masa molecular del analito. ε a B c A % T L mol
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA.
 CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
TRABAJO PRÁCTICO N 3. Análisis Espectrofotométrico de la Riboflavina
 TRABAJO PRÁCTICO N 3 Análisis Espectrofotométrico de la Riboflavina 1. Introducción La espectrofotometría es una de las técnicas empleadas con mayor asiduidad en los laboratorios de análisis químico. Esta
TRABAJO PRÁCTICO N 3 Análisis Espectrofotométrico de la Riboflavina 1. Introducción La espectrofotometría es una de las técnicas empleadas con mayor asiduidad en los laboratorios de análisis químico. Esta
DEPARTAMENTO DE QUÍMICA ANALÍTICA Y TECNOLOGÍA DE ALIMENTOS ANALISIS INSTRUMENTAl I
 PRIMERA RELACIÓN DE PROBLEMAS. CALIBRACIÓN EN QUÍMICA ANALÍTICA 1.- En la determinación de una especie X por un método instrumental en el que la señal analítica se define como P = kc x, se obtuvieron los
PRIMERA RELACIÓN DE PROBLEMAS. CALIBRACIÓN EN QUÍMICA ANALÍTICA 1.- En la determinación de una especie X por un método instrumental en el que la señal analítica se define como P = kc x, se obtuvieron los
TEMA 5 METODOS COLORIMETRICOS
 TEMA 5 METODOS COLORIMETRICOS 1. Cuál será la concentración molar de una solución, la cual tiene un coeficiente de absorción de 10.000 y da una lectura de absorción de 0,05 en celdas de 2 cm? Respuesta:
TEMA 5 METODOS COLORIMETRICOS 1. Cuál será la concentración molar de una solución, la cual tiene un coeficiente de absorción de 10.000 y da una lectura de absorción de 0,05 en celdas de 2 cm? Respuesta:
1.Exprese las siguientes absorbancias en función de porcentaje de transmitancia: a)0.038 b)0.958 c)0.399 d)0.241 e)0.435 f)0.692
 Química Analítica Instrumental I M. en C. Silvia Citlalli Gama González Segunda serie de Ejercicios 1.Exprese las siguientes absorbancias en función de porcentaje de transmitancia: a)0.038 b)0.958 c)0.399
Química Analítica Instrumental I M. en C. Silvia Citlalli Gama González Segunda serie de Ejercicios 1.Exprese las siguientes absorbancias en función de porcentaje de transmitancia: a)0.038 b)0.958 c)0.399
Química Biológica TP 1: ESPECTROFOTOMETRIA.
 TP 1: ESPECTROFOTOMETRIA. Introducción Al observar una solución acuosa de un colorante a trasluz, observamos una leve coloración, la cual se debe a la interacción entre las moléculas del colorante y la
TP 1: ESPECTROFOTOMETRIA. Introducción Al observar una solución acuosa de un colorante a trasluz, observamos una leve coloración, la cual se debe a la interacción entre las moléculas del colorante y la
Guía de Problemas. Espectrofotometría: Técnicas de Muestreo, Análisis e Interpretación de Datos Ingeniería Ambiental
 Guía de Problemas Espectrofotometría: 1- La absortividad molar de una solución del complejo formado por Bi(III) y tiourea es 9,32x10 3 L/mol x cm a 470 nm. Cuál es la absorbancia de una solución 3,79x10-5
Guía de Problemas Espectrofotometría: 1- La absortividad molar de una solución del complejo formado por Bi(III) y tiourea es 9,32x10 3 L/mol x cm a 470 nm. Cuál es la absorbancia de una solución 3,79x10-5
UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION
 UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION En este laboratorio utilizaremos el método de la espectrofotometría
UNIVERSIDAD TECNOLÓGICA METROPOLITANA INGENIERIA EN QUIMICA LABORATORIO ANALISIS INSTRUMENTAL. INFORME N 1: ESPECTROFOTOMETRÍA UV VISIBLE INTRODUCCION En este laboratorio utilizaremos el método de la espectrofotometría
Problemas de Espectro:
 Absorbancia Problemas de Espectro: 1. Un investigador evalúa el contenido de Mn presente en un alambrón con el objeto de poder usar este en el proceso productivo de fabricación de electrodos celulósicos,
Absorbancia Problemas de Espectro: 1. Un investigador evalúa el contenido de Mn presente en un alambrón con el objeto de poder usar este en el proceso productivo de fabricación de electrodos celulósicos,
MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA
 MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA y EL VISIBLE La espectroscopia de absorción molecular en el ultravioleta y visible se emplea en el análisis cuantitativo y es
MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA y EL VISIBLE La espectroscopia de absorción molecular en el ultravioleta y visible se emplea en el análisis cuantitativo y es
Espectrometría de luminiscencia molecular Cap.15
 Espectrometría de luminiscencia molecular Cap.15 Luz cuyo origen no radica exclusivamente en las altas temperaturas Se da en sustancias que pueden absorber energía, excitándose a niveles mayores y emitirla
Espectrometría de luminiscencia molecular Cap.15 Luz cuyo origen no radica exclusivamente en las altas temperaturas Se da en sustancias que pueden absorber energía, excitándose a niveles mayores y emitirla
Tema 7.- Principios de fotoquímica
 Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Espectroscopia ultravioleta-visible (temas complementarios)
 1 Espectroscopia ultravioleta-visible (temas complementarios) Ley de Lambert y Beer Cuando se hace incidir radiación electromagnética en un medio, la energía dependerá de la longitud de onda de la radiación
1 Espectroscopia ultravioleta-visible (temas complementarios) Ley de Lambert y Beer Cuando se hace incidir radiación electromagnética en un medio, la energía dependerá de la longitud de onda de la radiación
Laboratorio 10. Constante de disociación ácida de un tinte
 Objetivo Laboratorio 10. Constante de disociación ácida de un tinte Determinar la constante de equilibrio de la disociación de un indicador visual ácido-base (rojo de metilo) utilizando medidas espectrofotométricas.
Objetivo Laboratorio 10. Constante de disociación ácida de un tinte Determinar la constante de equilibrio de la disociación de un indicador visual ácido-base (rojo de metilo) utilizando medidas espectrofotométricas.
PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA
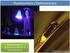 Práctica 3: Espectroscopia de Fluorescencia PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA Objetivos. La práctica se divide en dos partes. En la primera, se registran los espectros de absorción, fluorescencia
Práctica 3: Espectroscopia de Fluorescencia PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA Objetivos. La práctica se divide en dos partes. En la primera, se registran los espectros de absorción, fluorescencia
PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA
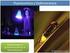 PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA Objetivos. La práctica se divide en dos partes. En la primera, se registran los espectros de absorción, fluorescencia y excitación de un conjunto de colorantes
PRACTICA 3: ESPECTROSCOPIA DE FLUORESCENCIA Objetivos. La práctica se divide en dos partes. En la primera, se registran los espectros de absorción, fluorescencia y excitación de un conjunto de colorantes
ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR. Introducción Principios teóricos Instrumentación Aplicaciones
 ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR Introducción Principios teóricos Instrumentación Aplicaciones Introducción: Fenómenos luminiscentes moleculares emisión de radiación por parte de determinadas
ESPECTROSCOPÍA DE FLUORESCENCIA MOLECULAR Introducción Principios teóricos Instrumentación Aplicaciones Introducción: Fenómenos luminiscentes moleculares emisión de radiación por parte de determinadas
FOTOLUMINISCENCIA MOLECULAR
 FOTOLUMINISCENCIA MOLECULAR El término luminiscencia lo introdujo por primera vez el físico e historiador científico alemán Eilhard Wiedemann en el año 1888 Luminescencia es la emisión de luz de una sustancia
FOTOLUMINISCENCIA MOLECULAR El término luminiscencia lo introdujo por primera vez el físico e historiador científico alemán Eilhard Wiedemann en el año 1888 Luminescencia es la emisión de luz de una sustancia
Prácticas. Práctica 1: Estudio cinético de la decoloración de la fenolftaleína en medio básico (18/05/09 16:00 horas)
 Prácticas Práctica 1: Estudio cinético de la decoloración de la fenolftaleína en medio básico (18/05/09 16:00 horas) Práctica 2: Determinación espectrofotométrica del pk de un indicador (20/05/09 16:00
Prácticas Práctica 1: Estudio cinético de la decoloración de la fenolftaleína en medio básico (18/05/09 16:00 horas) Práctica 2: Determinación espectrofotométrica del pk de un indicador (20/05/09 16:00
Informe breve: Equilibrio químico. Estudio espectrofotométrico Código Tema
 1. Tema El objetivo del presente trabajo fue determinar el valor de la constante de un equilibrio químico, concretamente la constante del equilibrio que se establece en disolución acuosa, entre el ión
1. Tema El objetivo del presente trabajo fue determinar el valor de la constante de un equilibrio químico, concretamente la constante del equilibrio que se establece en disolución acuosa, entre el ión
INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA
 INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA Objetivos Al finalizar el trabajo práctico los estudiantes estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento
INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA Objetivos Al finalizar el trabajo práctico los estudiantes estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento
Espectro Electromagnético
 1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
1.- Espectroscopía UV-Vis. 1.1.- Interacción de la luz con la materia
 1.- Espectroscopía UV-Vis 1.1.- nteracción de la luz con la materia Figura tomada de: -ALBELLA, J.M.; CNTAS, A.M.; MRANDA, T. y SERRATOSA, J.M.: "ntroducción a la ciencia de materiales". C.S..C., 1993.
1.- Espectroscopía UV-Vis 1.1.- nteracción de la luz con la materia Figura tomada de: -ALBELLA, J.M.; CNTAS, A.M.; MRANDA, T. y SERRATOSA, J.M.: "ntroducción a la ciencia de materiales". C.S..C., 1993.
Espectroscopía Clase integradora
 Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
ESTUDIOS DE LOS ESPECTROS DE ABSORCION IDENTIFICACION Y DETERMINACION CUANTITATIVA DE SUSTANCIAS, EN PPM
 1. INTRODUCCION Por medio del estudio de los espectros de absorción de una sustancia así como la realización de una curva de Absorbancia en función de la concentración, se puede determinar cuantitativamente
1. INTRODUCCION Por medio del estudio de los espectros de absorción de una sustancia así como la realización de una curva de Absorbancia en función de la concentración, se puede determinar cuantitativamente
Práctica 5. Espectroscopia UV-Vis de compuestos de coordinación Tarea previa
 Laboratorio de Química de Coordinación Parte II: Las técnicas Práctica 5. Espectroscopia UV-Vis de compuestos de coordinación Tarea previa 1.- Leer los fundamentos teóricos de la práctica 2.- Dibujar el
Laboratorio de Química de Coordinación Parte II: Las técnicas Práctica 5. Espectroscopia UV-Vis de compuestos de coordinación Tarea previa 1.- Leer los fundamentos teóricos de la práctica 2.- Dibujar el
3. MATERIALES Y MÉTODOS
 3. MATERIALES Y MÉTODOS 3.1. Diseño Experimental. Recientemente, en el Departamento de Investigación en Polímeros y Materiales (DIPM) de la Universidad de Sonora se sintetizaron una serie de ligantes biscromofóricos
3. MATERIALES Y MÉTODOS 3.1. Diseño Experimental. Recientemente, en el Departamento de Investigación en Polímeros y Materiales (DIPM) de la Universidad de Sonora se sintetizaron una serie de ligantes biscromofóricos
PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA
 PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo
PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo
QUÍMICA FÍSICA BIOLÓGICA - QUIMICA FISICA I TRABAJO PRACTICO N 3
 QUÍMICA FÍSICA BIOLÓGICA - QUIMICA FISICA I TRABAJO PRACTICO N 3 TEMA: EQUILIBRIO QUÍMICO. OBJETO: Determinación de la constante de equilibrio de disociación del rojo de metilo (indicador visual ácido-base)
QUÍMICA FÍSICA BIOLÓGICA - QUIMICA FISICA I TRABAJO PRACTICO N 3 TEMA: EQUILIBRIO QUÍMICO. OBJETO: Determinación de la constante de equilibrio de disociación del rojo de metilo (indicador visual ácido-base)
Qué es espectrofotometría?
 espectrofotometría Qué es espectrofotometría? Método de ánalisis físico-químico, que permite determinar la concentración de un analito, en función a la cantidad de energía radiante absorbida o emitida.
espectrofotometría Qué es espectrofotometría? Método de ánalisis físico-químico, que permite determinar la concentración de un analito, en función a la cantidad de energía radiante absorbida o emitida.
PRUEBA DE ACCESO A LA UNIVERSIDAD
 PRUEBA DE ACCESO A LA UNIVERSIDAD CONVOCATORIA DE SEPTIEMBRE DE 2013 EJERCICIO DE: QUÍMICA TIEMPO DISPONIBLE: 1 hora 30 minutos PUNTUACIÓN QUE SE OTORGARÁ A ESTE EJERCICIO: (véanse las distintas partes
PRUEBA DE ACCESO A LA UNIVERSIDAD CONVOCATORIA DE SEPTIEMBRE DE 2013 EJERCICIO DE: QUÍMICA TIEMPO DISPONIBLE: 1 hora 30 minutos PUNTUACIÓN QUE SE OTORGARÁ A ESTE EJERCICIO: (véanse las distintas partes
PRACTICO N 1: ESPECTROFOTOMETRIA
 UNIVERSIDAD MAYOR FACULTAD DE MEDICINA ESCUELA DE TECNOLOGIA MEDICA BIOQUIMICA PRACTICO N 1: ESPECTROFOTOMETRIA 1.- INTRODUCCIÓN Utilizando términos quizás excesivamente simplistas puede definirse la espectrofotometría
UNIVERSIDAD MAYOR FACULTAD DE MEDICINA ESCUELA DE TECNOLOGIA MEDICA BIOQUIMICA PRACTICO N 1: ESPECTROFOTOMETRIA 1.- INTRODUCCIÓN Utilizando términos quizás excesivamente simplistas puede definirse la espectrofotometría
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO I)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO I) Las preguntas de este tipo constan de un enunciado y de cuatro posibilidades de respuesta entre la cuales debe escoger la que considere correcta.
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO I) Las preguntas de este tipo constan de un enunciado y de cuatro posibilidades de respuesta entre la cuales debe escoger la que considere correcta.
INTRODUCCION A LA ESPECTROSCOPIA DE ABSORCION MOLECULAR UV/VIS Y DE INFRARROJO CERCANO. Cap. 13
 INTRODUCCION A LA ESPECTROSCOPIA DE ABSORCION MOLECULAR UV/VIS Y DE INFRARROJO CERCANO Cap. 13 Medición de la absorbancia y la transmitancia Recipiente produce pérdidas por: reflexión (aire/pared, pared/solución)
INTRODUCCION A LA ESPECTROSCOPIA DE ABSORCION MOLECULAR UV/VIS Y DE INFRARROJO CERCANO Cap. 13 Medición de la absorbancia y la transmitancia Recipiente produce pérdidas por: reflexión (aire/pared, pared/solución)
TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN
 TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN Absorción de radiación y concentración. Ley de Beer. La espectroscopia de absorción molecular se basa en la medida de la transmitancia T o de la absorbancia
TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN Absorción de radiación y concentración. Ley de Beer. La espectroscopia de absorción molecular se basa en la medida de la transmitancia T o de la absorbancia
]3- / [Fe(CN)6 ]4-0.36
![]3- / [Fe(CN)6 ]4-0.36 ]3- / [Fe(CN)6 ]4-0.36](/thumbs/86/93518944.jpg) Predicción de reacciones REDOX y potenciales de celda Considera los siguientes valores de potencial normal (a ph=0): Cr 3+ / Cr 2+ : -0.41 [Fe(CN) 6 ]3- / [Fe(CN)6 ]4-0.36 V 3+ / V 2+ : -0.26 V 4+ / V
Predicción de reacciones REDOX y potenciales de celda Considera los siguientes valores de potencial normal (a ph=0): Cr 3+ / Cr 2+ : -0.41 [Fe(CN) 6 ]3- / [Fe(CN)6 ]4-0.36 V 3+ / V 2+ : -0.26 V 4+ / V
a) 2, 2, 1, +1/2 b) 4, 0, 2, -1/2 c) 1, 0, 0, +1/2 d) 3, -1, 0, -1/2 (P-Junio 2000)
 ESTRUCTURA DE LA MATERIA. PROBLEMAS P.A.U. 1. Dadas las siguientes configuraciones electrónicas de átomos neutros: X: 1s 2 2s 2 2p 6 3s 2 3p 6 y Y: 1s 2 2s 2 2p 6 3s 2 3p 5 4s 1 Justificar la validez o
ESTRUCTURA DE LA MATERIA. PROBLEMAS P.A.U. 1. Dadas las siguientes configuraciones electrónicas de átomos neutros: X: 1s 2 2s 2 2p 6 3s 2 3p 6 y Y: 1s 2 2s 2 2p 6 3s 2 3p 5 4s 1 Justificar la validez o
Estados singulete y triplete
 Fluorescencia Estados singulete y triplete π* π* π* Singulete fundamental π π π Singulete excitado Triplete excitado Niveles de energía moleculares Fluoreno y bifenilo fluoreno bifenilo Fluoresceína y
Fluorescencia Estados singulete y triplete π* π* π* Singulete fundamental π π π Singulete excitado Triplete excitado Niveles de energía moleculares Fluoreno y bifenilo fluoreno bifenilo Fluoresceína y
Laboratorio 10. Constante de disociación ácida de un tinte
 Objetivo Laboratorio 10. Constante de disociación ácida de un tinte Determinar la constante de equilibrio de la disociación de un indicador visual ácido-base (rojo de metilo) utilizando medidas espectrofotométricas.
Objetivo Laboratorio 10. Constante de disociación ácida de un tinte Determinar la constante de equilibrio de la disociación de un indicador visual ácido-base (rojo de metilo) utilizando medidas espectrofotométricas.
LISTA DE FIGURAS. 1 Estructura de los primeros quimiosensores fluorescentes reportados para cationes metálicos... 3
 LISTA DE FIGURAS Fig. Pág. 1 Estructura de los primeros quimiosensores fluorescentes reportados para cationes metálicos... 3 2 Representación esquemática de un quimiosensor fluorescente.. 4 3 Estructura
LISTA DE FIGURAS Fig. Pág. 1 Estructura de los primeros quimiosensores fluorescentes reportados para cationes metálicos... 3 2 Representación esquemática de un quimiosensor fluorescente.. 4 3 Estructura
CAPITULO 5. Resultados
 CAPITULO 5 Resultados 5.1 Cálculos Se sintetizaron ocho complejos, dos por cada sal metálica en reacciones 1:1 y 2:1 (D:M). Tabla 5.1 Complejos sintetizados Complejo Reacción Diclofenaco -ZnCl 2 2:1 Diclofenaco
CAPITULO 5 Resultados 5.1 Cálculos Se sintetizaron ocho complejos, dos por cada sal metálica en reacciones 1:1 y 2:1 (D:M). Tabla 5.1 Complejos sintetizados Complejo Reacción Diclofenaco -ZnCl 2 2:1 Diclofenaco
Aplicar un método espectrofotométrico para medir la concentración de una proteína.
 Objetivos Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas y espectrofotómetros. Construir curvas de calibración y comprender su importancia
Objetivos Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas y espectrofotómetros. Construir curvas de calibración y comprender su importancia
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA
 REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
3. Determinación de Colorantes en Bebidas Profesor: Lucas Blandón
 Universidad de Antioquia F.Q.F. Ingeniería de Alimentos Lab. Análisis Instrumental 3. Determinación de Colorantes en Bebidas Profesor: Lucas Blandón Deymer Gómez Emilson León Florian PRÁCTICA 3: Determinación
Universidad de Antioquia F.Q.F. Ingeniería de Alimentos Lab. Análisis Instrumental 3. Determinación de Colorantes en Bebidas Profesor: Lucas Blandón Deymer Gómez Emilson León Florian PRÁCTICA 3: Determinación
QUÍMICA ORGÁNICA SERIE DE EJERCICIOS Nº3 HALUROS DE ALQUILO,MÉTODOS DE ESTUDIO MOLÉCULAS, COMPUESTOS AROMÁTICOS
 QUÍMICA ORGÁNICA SERIE DE EJERCICIOS Nº3 HALUROS DE ALQUILO,MÉTODOS DE ESTUDIO MOLÉCULAS, COMPUESTOS AROMÁTICOS 1. Considerando que la reacción de 1-yodo-2-metilbutano cn CN - es de tipo SN2, indicar cómo
QUÍMICA ORGÁNICA SERIE DE EJERCICIOS Nº3 HALUROS DE ALQUILO,MÉTODOS DE ESTUDIO MOLÉCULAS, COMPUESTOS AROMÁTICOS 1. Considerando que la reacción de 1-yodo-2-metilbutano cn CN - es de tipo SN2, indicar cómo
Fundamentos de Espectroscopía UV-Visible
 Fundamentos de Espectroscopía UV-Visible Cátedra de Química Orgánica I Facultad de Farmacia y Bioquímica UBA 2016 Teórico dictado por Dra. Isabel Perillo 1 Especto electromagnético Unidades de l usadas:
Fundamentos de Espectroscopía UV-Visible Cátedra de Química Orgánica I Facultad de Farmacia y Bioquímica UBA 2016 Teórico dictado por Dra. Isabel Perillo 1 Especto electromagnético Unidades de l usadas:
ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN INTRODUCCIÓN
 Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
Otras marcas comerciales de proteinsuccinilato férrico serían Ferplex y Ferrocur.
 1. INTRODUCCIÓN Para empezar hemos considerado oportuno explicar brevemente la composición del objeto de estudio así como sus aplicaciones en el mercado. Lactoferrina, de laboratorios Chiesi, es el nombre
1. INTRODUCCIÓN Para empezar hemos considerado oportuno explicar brevemente la composición del objeto de estudio así como sus aplicaciones en el mercado. Lactoferrina, de laboratorios Chiesi, es el nombre
PRÁCTICA 17 ESTUDIO ESPECTROFOTOMÉTRICO DEL EQUILIBRIO. = E l c. A = log I I
 PRÁCTICA 17 ESTUDIO ESPECTROFOTOMÉTRICO DEL EQUILIBRIO 1.- FUNDAMENTO TEÓRICO. Si un haz de luz blanca pasa a través de una celda de vidrio que ha sido llenada con un líquido, la radiación emergente es
PRÁCTICA 17 ESTUDIO ESPECTROFOTOMÉTRICO DEL EQUILIBRIO 1.- FUNDAMENTO TEÓRICO. Si un haz de luz blanca pasa a través de una celda de vidrio que ha sido llenada con un líquido, la radiación emergente es
PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS
 PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS OBJETIVOS Preparar soluciones acuosas a partir de la medición directa de reactivos sólidos y líquidos. Preparar soluciones acuosas por dilución. I. ASPECTOS
PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS OBJETIVOS Preparar soluciones acuosas a partir de la medición directa de reactivos sólidos y líquidos. Preparar soluciones acuosas por dilución. I. ASPECTOS
QUÍMICA 2º BACHILLERATO
 DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Modelo 2005/2006 PRIMERA PARTE
 1 PAU Química. Modelo 2005/2006 PRIMERA PARTE Cuestión 1. Para el elemento alcalino del tercer periodo y para el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones electrónicas.
1 PAU Química. Modelo 2005/2006 PRIMERA PARTE Cuestión 1. Para el elemento alcalino del tercer periodo y para el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones electrónicas.
ESTUDIO ESPECTROFOTOMÉTRICO
 EQUILIBRIO QUÍMICO ESTUDIO ESPECTROFOTOMÉTRICO Concurso Si eres original, eres de libro Equipo de trabajo: Los alquimistas Índice 1 Objetivo... Pág. 3 2 Qué es un equilibrio químico?... Pág.3 3 Qué es
EQUILIBRIO QUÍMICO ESTUDIO ESPECTROFOTOMÉTRICO Concurso Si eres original, eres de libro Equipo de trabajo: Los alquimistas Índice 1 Objetivo... Pág. 3 2 Qué es un equilibrio químico?... Pág.3 3 Qué es
ESPOL / ICQA / II TERMINO 2010/ 1era EVALUACIÓN QUÍMICA GENERAL I
 ESPOL / ICQA / II TERMINO 2010/ 1era EVALUACIÓN QUÍMICA GENERAL I NOMBRES APELLIDOS No. en LISTA PARALELO NOTA: PARA ESTA EVALUACIÓN EL SIGNO COMA (,) SE TOMARÁ PARA REPRESENTAR MILES, EJEMPLO: 10 +3 =
ESPOL / ICQA / II TERMINO 2010/ 1era EVALUACIÓN QUÍMICA GENERAL I NOMBRES APELLIDOS No. en LISTA PARALELO NOTA: PARA ESTA EVALUACIÓN EL SIGNO COMA (,) SE TOMARÁ PARA REPRESENTAR MILES, EJEMPLO: 10 +3 =
Técnicas Espectroscópicas. Dr. Jorge A. Palermo
 Técnicas Espectroscópicas Dr. Jorge A. Palermo Espectro Electromagnético E = hν ν = c/λ Espctroscopía UV: cromóforos Espectroscopía IR: grupos funcionales rayos γ rayos x UV VIS IR µ-ondas radio 10-10
Técnicas Espectroscópicas Dr. Jorge A. Palermo Espectro Electromagnético E = hν ν = c/λ Espctroscopía UV: cromóforos Espectroscopía IR: grupos funcionales rayos γ rayos x UV VIS IR µ-ondas radio 10-10
Espectrofotometría de Absorción Visible-UV: Complejos de Cobre [Cu(H 2 O) 4 ] 2+ y [Cu(NH 3 ) 4 ] 2+
![Espectrofotometría de Absorción Visible-UV: Complejos de Cobre [Cu(H 2 O) 4 ] 2+ y [Cu(NH 3 ) 4 ] 2+ Espectrofotometría de Absorción Visible-UV: Complejos de Cobre [Cu(H 2 O) 4 ] 2+ y [Cu(NH 3 ) 4 ] 2+](/thumbs/39/19278349.jpg) Espectrofotometría vis-uv EXPERIMENTACIÓN EN QUÍMICA EUITIG INGENIERO TÉCNICO EN QUÍMICA INDUSTRIAL PRÁCTICA Nº 17 Apellidos y Nombre: Grupo:. Apellidos y Nombre: Pareja:. Espectrofotometría de Absorción
Espectrofotometría vis-uv EXPERIMENTACIÓN EN QUÍMICA EUITIG INGENIERO TÉCNICO EN QUÍMICA INDUSTRIAL PRÁCTICA Nº 17 Apellidos y Nombre: Grupo:. Apellidos y Nombre: Pareja:. Espectrofotometría de Absorción
Prueba escrita de recuperación ordinaria de Física y Química 1º Bachillerato. Junio 2014.
 Prueba escrita de recuperación ordinaria de Física y Química 1º Bachillerato. Junio 2014. Nombre: Primer Trimestre: 1. Señala la respuesta correcta. La densidad de una sustancia depende: a) De su masa
Prueba escrita de recuperación ordinaria de Física y Química 1º Bachillerato. Junio 2014. Nombre: Primer Trimestre: 1. Señala la respuesta correcta. La densidad de una sustancia depende: a) De su masa
3.1 Espectros UV-visible e infrarrojo de los reactivos individuales.
 3 RESULTADOS 3.1 Espectros UV-visible e infrarrojo de los reactivos individuales. De la Gráfica 3.1 a la Gráfica 3.12 se muestran los espectros que fueron obtenidos con el fin de caracterizar a los compuestos
3 RESULTADOS 3.1 Espectros UV-visible e infrarrojo de los reactivos individuales. De la Gráfica 3.1 a la Gráfica 3.12 se muestran los espectros que fueron obtenidos con el fin de caracterizar a los compuestos
QUÍMICA 2º BACHILLERATO
 DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
DISOLUCIONES: CONCENTRACIÓN DE LAS MISMAS 1.-/ Se disuelven 7 g de cloruro de sodio en 43 g de agua. Determine la concentración centesimal de la disolución, así como la fracción molar de cada componente
Práctica 1 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE UNA MEZCLA DE SUSTANCIAS
 Universidad de Granada Facultad de Farmacia. Departamento de Química Física. Práctica 1 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE UNA MEZCLA DE SUSTANCIAS Objetivo de la práctica: Determinar las concentraciones
Universidad de Granada Facultad de Farmacia. Departamento de Química Física. Práctica 1 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE UNA MEZCLA DE SUSTANCIAS Objetivo de la práctica: Determinar las concentraciones
OPCIÓN A mol. Moles de NO formados: tantos como moles disociados de NOCl = 0.47 M
 OPCIÓN A Pregunta 1 (a, 1.5 puntos) Concentración molar de NOCl en el equilibrio: [NOCl] = 2.50 (1 0.28) mol 1.5 L = 1.20 M Moles de NO formados: tantos como moles disociados de NOCl [NO] = 2.50 0.28 mol
OPCIÓN A Pregunta 1 (a, 1.5 puntos) Concentración molar de NOCl en el equilibrio: [NOCl] = 2.50 (1 0.28) mol 1.5 L = 1.20 M Moles de NO formados: tantos como moles disociados de NOCl [NO] = 2.50 0.28 mol
QUIMICA ORGANICA DE BIOPROCESOS. CEBI_A3_ 4: Espectroscopía (1º parte)
 CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A3 QUIMICA ORGANICA DE BIOPROCESOS Docente a cargo: Dra. Silvia Flores CEBI_A3_ 4: Espectroscopía (1º parte)
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A3 QUIMICA ORGANICA DE BIOPROCESOS Docente a cargo: Dra. Silvia Flores CEBI_A3_ 4: Espectroscopía (1º parte)
PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE
 PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE MnO 4-1.- FUNDAMENTO TEÓRICO. 1.1.- Introducción Un método espectrofotométrico está basado en la medida directa de la absorción de radiación electromagnética
PRÁCTICA 2 DETERMINACIÓN ESPECTROFOTOMÉTRICA DE MnO 4-1.- FUNDAMENTO TEÓRICO. 1.1.- Introducción Un método espectrofotométrico está basado en la medida directa de la absorción de radiación electromagnética
XXIX OLIMPIADA DE QUÍMICA Fase Local EXTREMADURA Nombre:
 TEST DE PREGUNTAS MULTIRRESPUESTA (4 puntos) Se deberá marcar con una cruz en la HOJA de RESPUESTAS (al final del test) la respuesta correcta de cada pregunta (sólo hay una respuesta válida en cada pregunta).
TEST DE PREGUNTAS MULTIRRESPUESTA (4 puntos) Se deberá marcar con una cruz en la HOJA de RESPUESTAS (al final del test) la respuesta correcta de cada pregunta (sólo hay una respuesta válida en cada pregunta).
ESPECTROSCOPíA INFRARROJA
 ESPECTROSCOPíA INFRARROJA Química Orgánica 1 Facultad de Farmacia y Bioquímica UBA 2016 Autor: Dra. Isabel Perillo 1 Espectro electromagnético Unidades de l usadas: para UV-visible: nm (mm): 10-9 m para
ESPECTROSCOPíA INFRARROJA Química Orgánica 1 Facultad de Farmacia y Bioquímica UBA 2016 Autor: Dra. Isabel Perillo 1 Espectro electromagnético Unidades de l usadas: para UV-visible: nm (mm): 10-9 m para
MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES PREGUNTAS
 MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES a. El examen de química consistirá en 30 preguntas de tipo test b. La duración del examen será de 1,5 horas. c. Sólo hay que elegir una respuesta por
MODELO DE EXAMEN DE QUIMICA (25 AÑOS) INSTRUCCIONES a. El examen de química consistirá en 30 preguntas de tipo test b. La duración del examen será de 1,5 horas. c. Sólo hay que elegir una respuesta por
Universidad Iberoamericana
 Universidad Iberoamericana Ingeniería Química Laboratorio de Química General Grupo R Equipo 1 : Soluciones por Arlette Mayela Canut Noval y Francisco José Guerra Millán Prof. Celia Margarita del Valle
Universidad Iberoamericana Ingeniería Química Laboratorio de Química General Grupo R Equipo 1 : Soluciones por Arlette Mayela Canut Noval y Francisco José Guerra Millán Prof. Celia Margarita del Valle
Realización de la prueba escrita: jueves 12 de abril de 2018 a las 16:30.
 El alumnado de 2º de Bachillerato que tengan pendiente la asignatura Física y Química de 1º de Bachillerato deberá realizar al menos una prueba escrita. Ésta estará dividida en dos partes: Química y Física,
El alumnado de 2º de Bachillerato que tengan pendiente la asignatura Física y Química de 1º de Bachillerato deberá realizar al menos una prueba escrita. Ésta estará dividida en dos partes: Química y Física,
Resolución ejercicios del Práctico 8
 Resolución ejercicios del Práctico 8 1- a) Un mol de C 2 H 2 contiene 6.022 x 10 23 moléculas, entonces Nº moléculas = 0.150 mol. 6.022 x 10 23 moléculas/mol = 9.03 x 10 22 moléculas b) Primero se debe
Resolución ejercicios del Práctico 8 1- a) Un mol de C 2 H 2 contiene 6.022 x 10 23 moléculas, entonces Nº moléculas = 0.150 mol. 6.022 x 10 23 moléculas/mol = 9.03 x 10 22 moléculas b) Primero se debe
HOJA DE TRABAJO No. 10 DISOLUCIONES PESO EQUIVALENTE
 HOJA DE TRABAJO No. 10 DISOLUCIONES PESO EQUIVALENTE 1. Realice los cálculos necesarios para llenar el siguiente cuadro (asuma neutralización completa para ácidos y bases): HNO 2 H 4 P 2 O 7 Al(OH) 3 Ba(OH)
HOJA DE TRABAJO No. 10 DISOLUCIONES PESO EQUIVALENTE 1. Realice los cálculos necesarios para llenar el siguiente cuadro (asuma neutralización completa para ácidos y bases): HNO 2 H 4 P 2 O 7 Al(OH) 3 Ba(OH)
Laboratorio de Termodinámica II
 Plan de Actividades Laboratorio de Termodinámica II semana actividad 1 Presentación del curso 2 Densidad de un líquido 3 Disoluciones I 4 Disoluciones II 5 Discusión 6 Equilibrio de fases I 7 Equilibrio
Plan de Actividades Laboratorio de Termodinámica II semana actividad 1 Presentación del curso 2 Densidad de un líquido 3 Disoluciones I 4 Disoluciones II 5 Discusión 6 Equilibrio de fases I 7 Equilibrio
PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera
 Universidad Nacional Experimental del Táchira Departamento de Química San Cristóbal, Estado Táchira-Venezuela Soluciones. PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera 1. Calcule la molaridad de
Universidad Nacional Experimental del Táchira Departamento de Química San Cristóbal, Estado Táchira-Venezuela Soluciones. PROBLEMARIO: Segundo Parcial Prof. Juan Pablo Herrera 1. Calcule la molaridad de
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA. 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué?
 REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
SEMINARIO FORMATIVO SOBRE PREPARACIÓN DE SOLUCIONES
 UNIVERSIDAD LAICA ELOY ALFARO DE MANABÍ DEPARTAMENTO CENTRAL DE INVESTIGACIÓN SEMINARIO FORMATIVO SOBRE PREPARACIÓN DE SOLUCIONES Preparado por: Dr. Julio César Marín L. Prometeo-SENESCYT Manta, septiembre
UNIVERSIDAD LAICA ELOY ALFARO DE MANABÍ DEPARTAMENTO CENTRAL DE INVESTIGACIÓN SEMINARIO FORMATIVO SOBRE PREPARACIÓN DE SOLUCIONES Preparado por: Dr. Julio César Marín L. Prometeo-SENESCYT Manta, septiembre
EL MÉTODO DE JOB OBJETIVO
 EL MÉTODO DE JOB OBJETIVO Identificar las diferentes especies que se forman en solución usando el método de las variaciones continuas (Método de Job) en el sistema níquel etilendiamina. INTRODUCCIÓN En
EL MÉTODO DE JOB OBJETIVO Identificar las diferentes especies que se forman en solución usando el método de las variaciones continuas (Método de Job) en el sistema níquel etilendiamina. INTRODUCCIÓN En
PAU Química. Septiembre 2008 PRIMERA PARTE
 1 PAU Química. Septiembre 2008 PRIMERA PARTE Cuestión 1. A las siguientes especies: X, Y y Z +, les corresponden los números atómicos 17, 18 y 19, respectivamente. a) Escriba la configuración electrónica
1 PAU Química. Septiembre 2008 PRIMERA PARTE Cuestión 1. A las siguientes especies: X, Y y Z +, les corresponden los números atómicos 17, 18 y 19, respectivamente. a) Escriba la configuración electrónica
Compuesto Kps Ca(OH) CaCO CaF
 XXXI OLIMPIADA QUÍMICA ARAGÓN 2018 1.- Indique la serie en la que los iones están dispuestos en orden creciente del radio iónico. a) Mg 2+ < K + < Ca 2+ < S 2 < Cl b) Mg 2+ < Ca 2+ < K + < Cl < S 2 c)
XXXI OLIMPIADA QUÍMICA ARAGÓN 2018 1.- Indique la serie en la que los iones están dispuestos en orden creciente del radio iónico. a) Mg 2+ < K + < Ca 2+ < S 2 < Cl b) Mg 2+ < Ca 2+ < K + < Cl < S 2 c)
Introducción. Compuestos químicos. Reacciones químicas
 Introducción Compuestos químicos Reacciones químicas Metales Alcalinos Tabla Periódica Gases Nobles Alcalino-térreos Halógenos Grupo Principal Metales de transición Grupo Principal Lantanidos y Actinidos
Introducción Compuestos químicos Reacciones químicas Metales Alcalinos Tabla Periódica Gases Nobles Alcalino-térreos Halógenos Grupo Principal Metales de transición Grupo Principal Lantanidos y Actinidos
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 2011-2012 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 2011-2012 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN
XXVII OLIMPIADA DE QUÍMICA Fase Local EXTREMADURA Nombre:
 EXTREMADURA - 014 TEST DE PREGUNTAS MULTIRRESPUESTA (4 puntos) Se deberá marcar con una cruz en la HOJA de RESPUESTAS (al final del test) la respuesta correcta de cada pregunta (sólo hay una respuesta
EXTREMADURA - 014 TEST DE PREGUNTAS MULTIRRESPUESTA (4 puntos) Se deberá marcar con una cruz en la HOJA de RESPUESTAS (al final del test) la respuesta correcta de cada pregunta (sólo hay una respuesta
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS ELIJA UNA DE LAS DOS OPCIONES QUÍMICA. CÓDIGO 114
 PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS. 2011 ELIJA UNA DE LAS DOS OPCIONES QUÍMICA. CÓDIGO 114 Opción A 1. Para la molécula CO 2 a) Represente su estructura de Lewis. (0,75 puntos)
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS. 2011 ELIJA UNA DE LAS DOS OPCIONES QUÍMICA. CÓDIGO 114 Opción A 1. Para la molécula CO 2 a) Represente su estructura de Lewis. (0,75 puntos)
LOGO. Soluciones. M. C. Rita Paz Samaniego
 LOGO Soluciones M. C. Rita Paz Samaniego Contenido Qué es una solución Terminología de solubilidad Solubilidad de compuestos Unidades de concentración de soluciones Qué es una solución? Una solución es
LOGO Soluciones M. C. Rita Paz Samaniego Contenido Qué es una solución Terminología de solubilidad Solubilidad de compuestos Unidades de concentración de soluciones Qué es una solución? Una solución es
Determinación de las concentraciones de una mezcla de permanganato y dicromato en una solución.
 Trabajo Práctico Nº 2: Espectrofotometría ultravioleta visible Objetivo Ilustrar sobre los principios de la fotometría, las formas de operación práctica de los equipos, las características de absorción
Trabajo Práctico Nº 2: Espectrofotometría ultravioleta visible Objetivo Ilustrar sobre los principios de la fotometría, las formas de operación práctica de los equipos, las características de absorción
COLORIMETRÍA: ANÁLISIS ESPECTROFOTOMÉTRICO DE LA RIBOFLAVINA
 COLORIMETRÍA: ANÁLISIS ESPECTROFOTOMÉTRICO DE LA RIBOFLAVINA INTRODUCCION La colorimetría es una de las técnicas empleadas con mayor asiduidad en los laboratorios de Bioquímica. Esta técnica suministra
COLORIMETRÍA: ANÁLISIS ESPECTROFOTOMÉTRICO DE LA RIBOFLAVINA INTRODUCCION La colorimetría es una de las técnicas empleadas con mayor asiduidad en los laboratorios de Bioquímica. Esta técnica suministra
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
XI OLIMPIADA METROPOLITANA DE QUÍMICA
 XI LIMPIADA METRPLITANA DE QUÍMIA Examen final Problemas abiertos Instrucciones: Este fue el último examen aplicado como parte de la XI limpiada Metropolitana de Química. La duración del examen fue de
XI LIMPIADA METRPLITANA DE QUÍMIA Examen final Problemas abiertos Instrucciones: Este fue el último examen aplicado como parte de la XI limpiada Metropolitana de Química. La duración del examen fue de
Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA
 Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA 1. Objetivo Familiarizarse con los fundamentos de la identificación de moléculas a partir de su espectro de absorción infrarrojo.
Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA 1. Objetivo Familiarizarse con los fundamentos de la identificación de moléculas a partir de su espectro de absorción infrarrojo.
CINÉTICA DE LA REACCIÓN DEL COLORANTE AZUL BRILLANTE CON HIPOCLORITO DE SODIO
 Página: 1/5 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 6: CINÉTICA DE LA REACCIÓN DEL COLORANTE AZUL BRILLANTE CON HIPOCLORITO DE SODIO Bibliografía: Química General, Quinta Edición, K. Whitten, R. Davis, M.
Página: 1/5 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 6: CINÉTICA DE LA REACCIÓN DEL COLORANTE AZUL BRILLANTE CON HIPOCLORITO DE SODIO Bibliografía: Química General, Quinta Edición, K. Whitten, R. Davis, M.
EXAMEN DE ADMISIÓN QUÍMICA GENERAL
 EXAMEN DE ADMISIÓN QUÍMICA GENERAL QUÍMICA ANALÍTICA 1. Qué volumen debe retirarse de una disolución 0.5 N de NaOH contenida en un matraz volumétrico de un litro para que al llevar al aforo nuevamente
EXAMEN DE ADMISIÓN QUÍMICA GENERAL QUÍMICA ANALÍTICA 1. Qué volumen debe retirarse de una disolución 0.5 N de NaOH contenida en un matraz volumétrico de un litro para que al llevar al aforo nuevamente
Investigación Espectrofométrica de la interacción de Yodo con Hidrocarburos A romáticos
 Investigación Espectrofométrica de la interacción de Yodo con Hidrocarburos A romáticos Alicia Castro (200718024), Carlos García (200911158), Byron Pérez (201013499) Departamento de Fisicoquímica, Facultad
Investigación Espectrofométrica de la interacción de Yodo con Hidrocarburos A romáticos Alicia Castro (200718024), Carlos García (200911158), Byron Pérez (201013499) Departamento de Fisicoquímica, Facultad
PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO
 PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO OBJETIVOS Comprobar la perturbación en un sistema en equilibrio de complejos de cobalto (II), cuando se modifican la concentración de las sustancias implicadas y la temperatura.
PRÁCTICA Nº 6 EQUILIBRIO QUÍMICO OBJETIVOS Comprobar la perturbación en un sistema en equilibrio de complejos de cobalto (II), cuando se modifican la concentración de las sustancias implicadas y la temperatura.
DEPARTAMENTO DE QUÍMICA ANALÍTICA Y TECNOLOGÍA DE ALIMENTOS ANALISIS INSTRUMENTAL I
 SEGUNDA RELACIÓN DE PROLEMAS. ESPECTROFOTOMETRÍA DE ASORICIÓN MOLECULAR ULTRAVIOLETA-VISILE 1.- Una disolución de concentración C tiene una transmitancia del 8%. Determinar el porcentaje de transmitancia
SEGUNDA RELACIÓN DE PROLEMAS. ESPECTROFOTOMETRÍA DE ASORICIÓN MOLECULAR ULTRAVIOLETA-VISILE 1.- Una disolución de concentración C tiene una transmitancia del 8%. Determinar el porcentaje de transmitancia
1. Fundamento teórico
 1 1. Fundamento teórico Los métodos espectroscópicos atómicos y moleculares figuran entre los métodos analíticos instrumentales más utilizados. La espectroscopia molecular basada en la radiación ultravioleta,
1 1. Fundamento teórico Los métodos espectroscópicos atómicos y moleculares figuran entre los métodos analíticos instrumentales más utilizados. La espectroscopia molecular basada en la radiación ultravioleta,
EFECTO SOLVENTE. Los espectros de emisión de algunos fluoróforos son muy sensibles al ambiente circundante, incluyendo al solvente
 EFECTO SOLVENTE EFECTO SOLVENTE Los espectros de emisión de algunos fluoróforos son muy sensibles al ambiente circundante, incluyendo al solvente A partir de los espectros de emisión de estos fluoróforos
EFECTO SOLVENTE EFECTO SOLVENTE Los espectros de emisión de algunos fluoróforos son muy sensibles al ambiente circundante, incluyendo al solvente A partir de los espectros de emisión de estos fluoróforos
REACCIONES DE TRANSFERENCIA DE PROTONES
 QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACCIONES DE TRANSFERENCIA DE PROTONES 1. PAU-16M A. Un vinagre que contiene un 5 % en masa de ácido acético tiene un ph de 2,4. Calcule: a) La concentración molar
QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACCIONES DE TRANSFERENCIA DE PROTONES 1. PAU-16M A. Un vinagre que contiene un 5 % en masa de ácido acético tiene un ph de 2,4. Calcule: a) La concentración molar
