PAAU (LOXSE) Setembro 2007
|
|
|
- Nicolás Sosa Macías
- hace 9 años
- Vistas:
Transcripción
1 PAAU (LOXSE) Setembro 27 Código: 3 QUÍMICA CALIICACIÓN: CUESTIONES =2 PUNTOS CADA UNA; PROBLEMAS: 2 PUNTOS CADA UNO; PRÁCTICA: 2 PUNTOS CUESTIONES (Responda SOLAMENTE a DOS de las siguientes cuestiones). Dado el siguiente equilibrio 2 S (g) 2 (g) + S (s) indique si la concentración de sulfuro de hidrógeno aumentará, disminuirá o no se modificará si: (a) Se añade 2 (g) (b) Disminuye el volumen del recipiente 2. De las siguientes moléculas: trifluoruro de boro y amoníaco. (a) Indique la geometría molecular. (b) Polaridad de cada molécula. Razone las respuestas. 3. Explique razonadamente qué sucederá si en una disolución, M de sulfato de cobre(ii) [tetraoxosulfato(vi) de cobreii)] introducimos: (a) Una varilla de Zn (b) Una varilla de plata. Datos: Eº (Cu 2+ /Cu)= +,34 V; Eº (Ag + /Ag)= +,8 V; Eº (Zn 2+ /Zn)= -,76 V PROBLEMAS (Responda SOLAMENTE a DOS de los siguientes problemas). Para saber el contenido en carbonato de calcio[trioxocarbonato(iv) de calcio(ii)] de una caliza impura se hacen reacciona 4 g de la caliza con ácido clorhídrico del 3% en peso y de densidad,5 g/ml, obteniéndose cloruro de calcio, agua y dióxido de carbono. Sabiendo que las impurezas no reaccionan con ácido clorhídrico y que se gastan 25 ml del ácido, calcule: (a) El porcentaje de carbonato de calcio en la caliza (b) El volumen de dióxido de carbono, medido en condiciones normales, que se obtiene en la reacción. Dato: R=,82 atm L/K mol 2. Calcule, a 25 ºC: (a) La solubilidad en mg/l del AgCl en agua. (b) La solubilidad en mg/l del AgCl en una disolución acuosa que tiene una concentración de ión cloruro de, M. Dato: El producto de solubilidad del AgCl a 25 ºC es K s =, La entalpía de formación del tolueno gas (C 7 8 ) es de 49,95 kj/mol y las entalpías de formación del CO 2 (g) y del 2 O (l) son, respectivamente, -393,4 y -285,56 kj/mol. (a) Calcule la entalpía de combustión del tolueno, gas. (b) Cuántos kj se desprenden en la combustión completa de 23 g de tolueno? PRÁCTICAS (Responda SOLAMENTE a UNA de las siguientes prácticas). Se desea preparar L de una disolución M de hidróxido de sodio (NaO) a partir del producto comercial en el que se indica que la pureza es del 98%. Indique el procedimiento a seguir, describa el material a utilizar y determine los gramos de producto comercial que se deben tomar. 2. Se quiere determinar la entalpía del proceso de disolución de un compuesto iónico AB. Indique el procedimiento a seguir y el material a utilizar. Si al disolver,2 moles de dicha sustancia en 5 ml de agua se produce un incremento de temperatura de 2 ºC Cuál es el valor de, en J/mol, para dicho proceso de disolución?. Datos: C e (disolución) = C e (agua)= 4,8 J/g ºC. Densidad del agua = g/ml; Masa de disolución=masa de agua
2 CUESTIONES Soluciones. Dado el siguiente equilibrio 2S (g) 2 (g) + S (s) indique si la concentración de sulfuro de hidrógeno aumentará, disminuirá o no se modificará si: (a) Se añade 2 (g) (b) Disminuye el volumen del recipiente Rta.: a) Aumenta, para mantener el mismo valor de la constante: K c = [ 2 ] / [ 2 S] = n( 2 ) / n( 2 S) b) Aumenta la concentración. No varía la cantidad n( 2 S) de gas pero disminuye el volumen. 2. De las siguientes moléculas: trifluoruro de boro y amoníaco. (a) Indique la geometría molecular. (b) Polaridad de cada molécula. Razone las respuestas. Rta.: a) trifluoruro de boro: triangular plana; apolar; amoníaco: piramidal achatada; polar. a) La teoría de repulsión de los electrones de valencia dice que los pares de enlace σ y los pares no enlazantes se disponen alrededor de un átomo de forma que la repulsión entre ellos sea mínima. molécula B 3 N 3 átomo central B N conf. electr. fundamental 2s 2 2p x 2s 2 2p x 2p y 2p z conf. electr. excitada 2s 2p x 2p y 2s 2 2p x 2p y 2p z diagrama de Lewis pares B σ 3 3 π N 3. Explique razonadamente qué sucederá si en una disolución, M de sulfato de cobre(ii) [tetraoxosulfato(vi) de cobreii)] introducimos: (a) Una varilla de Zn (b) Una varilla de plata. Datos: Eº (Cu 2+ /Cu)= +,34 V; Eº (Ag + /Ag)= +,8 B V; Eº (Zn 2+ /Zn)= -,76 V Rta.: a) Reacciona (es espontánea ya que ΔE =, V >, y por tanto ΔG <); b) No reacciona a) El potencial de electrodo E está relacionado con la variación de energía libre de Gibbs ΔG por ΔG = - z E donde z es el número de electrones intercambiados y es araday, la carga de mol de electrones. Si el potencial de reducción es negativo, la variación de energía libre de Gibbs es positiva y el proceso de reducción no será espontáneo. De los datos de los potenciales de reducción: Cu e Cu E = +,34 V Zn e Zn E =,76 V Se pueden combinar para una oxidación-reducción: oxidación: Zn 2 e Zn 2+ E =,76 V reducción: Cu e Cu E = +,34 V N
3 Cu 2+ + Zn Cu + Zn 2+ E =, V da un potencial de reacción positivo, por lo que el proceso será espontáneo. b) Combinando los datos de la plata y el cobre: oxidación: Cu Cu e E =,34 V reducción: 2 Ag + + 2e 2 Ag E = +,8 V Cu 2+ + Zn Cu + Zn 2+ E =,46 V se ve que el potencial de reacción positivo, para que el proceso sea espontáneo, corresponde a la reacción en la que el ión plata se reduce y el cobre metálico se oxida. Por tanto, la oxidación de la plata por el ión cobre(ii) no es un proceso espontáneo. PROBLEMAS. Para saber el contenido en carbonato de calcio[trioxocarbonato(iv) de calcio(ii)] de una caliza impura se hacen reacciona 4 g de la caliza con ácido clorhídrico del 3% en peso y de densidad,5 g/ml, obteniéndose cloruro de calcio, agua y dióxido de carbono. Sabiendo que las impurezas no reaccionan con ácido clorhídrico y que se gastan 25 ml del ácido, calcule: a) El porcentaje de carbonato de calcio en la caliza. b) El volumen de dióxido de carbono, medido en condiciones normales, que se obtiene en la reacción. Dato: R =,82 atm L/K mol Rta.: a) 84% CaCO 3 en la caliza; b) V = 2,6 dm 3 M : masa molar. (CaCO 3 ) = g/mol (Cl) = 36,5 g/mol (CaCl 2 ) = g/mol Datos Cifras significativas: 2 gas: presión (normal) P =, atm temperatura (normal) disolución Cl: volumen masa del mineral T = C = 273 K V = 25 ml riqueza r = 3% densidad constante de los gases ideales Incógnitas ρ =,5 g/ml m = 4 g porcentaje de carbonato de calcio en la caliza r' (CaCO 3 ) volumen de CO 2 obtenido Ecuaciones cantidad (número de moles) ecuación de estado de los gases ideales R =,82 atm L/K mol n = m / M P V = n R T a) La ecuación ajustada de la reacción entre el carbonato de calcio y el ácido clorhídrico es: La cantidad de Cl que ha reaccionado es: CaCO 3 (s) + 2 Cl (aq) CaCl 2 (aq) + CO 2 (g) + 2 O (l) n Cl =25 ml D,5 g D ml D 3 gcl g D mol Cl =,24 mol Cl 36,5g Cl
4 La masa de carbonato de calcio que ha reaccionado es: m CaCO 3 =,24 mol Cl mol CaCO 3 2mol Cl gcaco 3 mol CaCO 3 =2g CaCO 3 Si sólo ha reaccionado el carbonato de calcio de la muestra, hay 2 g de CaCO 3 en cada 4 g de caliza, lo que supone una riqueza de: b) La cantidad de dióxido de carbono obtenida es: Suponiendo comportamiento ideal para el gas, r' (CaCO 3 ) = 2 g de CaCO 3 / 4 g de caliza =,84 = 84% n CO 2 =,24 mol Cl mol CO 2 2 mol Cl =,2 mol CO 2 V CO 2 =,2[mol CO ],82[ atm L mol 2 K ] 273[K ] =2,6 L CO,[atm] 2 en c.n. 2. Calcule, a 25 ºC: a) La solubilidad en mg/l del AgCl en agua. b) La solubilidad en mg/l del AgCl en una disolución acuosa que tiene una concentración de ión cloruro de, M. Dato: El producto de solubilidad del AgCl a 25 ºC es K s=,7 - Rta.: a) s' =,9 mg/l; b) s 2 ' = 2,4-4 mg/l M : masa molar. (AgCl) = 43 g/mol Datos Cifras significativas: 2 producto de solubilidad del AgCl K s =,7 - temperatura concentración de la disolución del Cl Incógnitas solubilidad (mg/l) del AgCl en agua solubilidad (mg/l) del AgCl en Cl, M s' 2 Otros símbolos concentración (moles/l) en de AgCl en agua y en Cl, M s, s 2 Ecuaciones producto de solubilidad del equilibrio: B b A a (s) b B a+ (aq) + a A b- (aq) a) El equilibrio de solubilidad es AgCl (s) Ag + (aq) + Cl (aq) T = 25 C = 298 K [Cl ] =, M s' K s = [A b- ] a [B a+ ] b La constante de equilibrio K s es: AgCl Ag + Cl [ ] eq mol/l s s K s = [Ag + ] [Cl ] = s s = s 2 =,7 - s=,7 =,3 5 mol AgCl/ L D
5 s' =,3-5 mol/l 43 g/mol =,9-3 g AgCl / L D =,9 mg/l D b) AgCl Ag + Cl [ ] mol/l, [ ] d mol/l s 2 s 2 s 2 [ ] eq mol/l s 2, + s 2 La constante de equilibrio K s es: K s = [Ag + ] [Cl ] = s 2 (, + s 2 )=,7 - En primera aproximación, podemos considerar s 2 despreciable s frente a,, (s 2 <<,). Entonces:, s 2,7 - s 2,7 - /, =,7-9 mol/l que es despreciable frente a,. s' 2 =,7-9 mol/l 43 g/mol = 2,4-7 g AgCl / L D = 2,4-4 mg/l D menor que la solubilidad en agua (efecto del ión común). 3. La entalpía de formación del tolueno gas (C 7 8) es de 49,95 kj/mol y las entalpías de formación del CO 2 (g) y del 2O (l) son, respectivamente, -393,4 y -285,56 kj/mol. a) Calcule la entalpía de combustión del tolueno, gas. b) Cuántos kj se desprenden en la combustión completa de 23 g de tolueno? Rta.: a) c º =-3944 kj/mol b) Q = -986 kj M : masa molar. (C 7 8 ) = 92, g/mol Datos Cifras significativas: 5 7 C (graf.) (g) C 7 8 (g) Δ f (C 7 8 ) = +49,95 kj/mol C (graf.) + O 2 (g) CO 2 (g) 2 (g) + ½ O 2 (g) 2 O (l) masa de tolueno m = 23 g C 7 8 Incógnitas entalpía de combustión del tolueno Δ c (C 7 8 ) cuántos kj se desprenden en la combustión completa de 23 g de tolueno Otros símbolos cantidad de sustancia (número de moles) Ecuaciones ley de ess a) Ecuación de combustión del tolueno: C 7 8 (g) + 9 O 2 (g) 7 CO 2 (g) O (g) Δ c Ecuaciones de formación: 7 C (graf.) +4 2 (g) C 7 8 (g) Δ f (C 7 8 ) = +49,95 kj/mol Δ f (CO 2 ) = 393,4 kj/mol Δ f ( 2 O) = 285,56 kj/mol Q n Δ = Δ PRODUC Δ REACTIV
6 C (graf.) + O 2 (g) CO 2 (g) 2 (g) + ½ O 2 (g) 2 O (l) Δ f (CO 2 ) = 393,4 kj/mol Δ f ( 2 O) = 285,56 kj/mol Por la ley de ess, Δ c (C 7 8 ) = 7 Δ f (CO 2 ) + 4 Δ f ( 2 O) (Δ f (C 7 8 ) + 9 Δ f (O 2 ) ) Δ c (C 7 8 ) = (7 [mol CO 2 ] ( 393,4 [kj/mol CO 2 ] + 4 [mol 2 O] ( 285,56 [kj/mol 2 O])) (49,95 [kj]) Δ c (C 7 8 ) = 3 944,7 kj/mol C 7 8 b) En la combustión de 23 g de tolueno se desprenden Q=23[g C 7 8 ] [mol C 7 8 ] 92,[gC 7 8 ] 3944,7[kJ ] =985 kj [mol C 7 8 ] PRÁCTICAS. Se desea preparar L de una disolución M de hidróxido de sodio (NaO) a partir del producto comercial en el que se indica que la pureza es del 98%. Indique el procedimiento a seguir, describa el material a utilizar y determine los gramos de producto comercial que se deben tomar. Cálculos: Suponiendo 2 cifras significativas. En, L de disolución, M de NaO hay que pesan: n (NaO) =, [mol NaO / dm 3 D], [dm 3 D]=, mol NaO m (NaO) =, [mol NaO] 4 [g NaO / mol NaO] = 4 g NaO El producto comercial tiene una pureza del 98%. abría que pesar: m (comercial) = 4 [g NaO] [g comercial] / 98 [g NaO] = 4 g NaO comercial. Como la concentración de la disolución es aproximada (el hidróxido de sodio en el aire se hidrata rápidamente y se carbonata en parte, por lo que su masa siempre será aproximada), se utiliza material de medida no demasiado preciso. Procedimiento: En un vaso de precipitados de cm 3 se vierte más de la mitad de agua. En una balanza granataria se tara un vidrio de reloj y se pesan 4 g de hidróxido de sodio comercial del 98%, procurando que no entre en contacto con la piel (es cáustico) y usando una espátula para manejar la sustancia. Se vuelca el vidrio de reloj sobre el agua del vaso de precipitados y se enjuaga el vidrio con un frasco lavador. Se agita con una varilla de vidrio el contenido del vaso de precipitados hasta que se completa la disolución. Se vierte en una probeta de L y se añade agua hasta completar el volumen, procurando que el menisco del líquido esté enrasado con la línea de cm 3. Se pasa la disolución obtenida a una frasco de L, se tapa y se voltea varias veces para homogeneizar. Se etiqueta el frasco con NaO M y la fecha. Se lava la probeta de L. Material: Probeta de cm 3 (), balanza granataria, vidrio de reloj (), espátula (), vaso de precipitados de cm 3 (), varilla de vidrio (), frasco lavador (), frasco de L con tapón () y etiquetas. Probeta: cilindro graduado con base, para medir volúmenes de líquidos/disoluciones de forma aproximada. Vidrio de reloj: casquete esférico de vidrio, para evitar que los productos químicos toquen los platillos de la balanza. Espátula: especie de cucharilla metálica para tomar cantidades de productos químicos. Vaso de precipitados: vaso de vidrio contenedor de líquidos/disoluciones.
7 2. Se quiere determinar la entalpía del proceso de disolución de un compuesto iónico AB. Indique el procedimiento a seguir y el material a utilizar. Si al disolver,2 moles de dicha sustancia en 5 ml de agua se produce un incremento de temperatura de 2 ºC Cuál es el valor de, en J/mol, para dicho proceso de disolución? Datos: C e (disolución) = C e (agua)= 4,8 J/g ºC. Densidad del agua = g/ml; Masa de disolución = Masa de agua En una probeta de 5 cm 3, se miden 5 cm 3 de agua y se vierten en un calorímetro. Se esperan unos minutos y se mide la temperatura con un termómetro. En una balanza granataria, se tara un vidrio de reloj, y, con un varilla, se echa la masa del compuesto iónico AB que corresponde a los,2 moles. Se echa el sólido iónico en el calorímetro y se agita con una varilla, comprobando la temperatura. Se anota el valor máximo y se resta del valor inicial de la del agua. Al ser el calorímetro un sistema aislado, el proceso es adiabático, y Q (cedido en la disolución) + Q D (ganado por la disolución) + Q C (ganado por el calorímetro) = El calor Q D ganado por la disolución es aproximadamente igual al ganado por el agua: Q D = m(agua) c e (agua) Δt = 5 g 4,8 J/g C 2 C = 4,2 3 J El calor Q C ganado por el calorímetro se supone despreciable Q (cedido en la disolución) = 4,2 3 J d = 4,2 3 [ J],2mol AB = 2 4 J / mol AB Cuestiones y problemas de las Pruebas de Acceso a la Universidad (P.A.U.) en Galicia. Respuestas y composición de Alfonso J. Barbadillo Marán, [email protected], I.E.S. Elviña, La Coruña
Química 2º Bacharelato
 Química 2º Bacharelato DEPARTAMENTO DE FÍSICA E QUÍMICA Termodinámica química 13/12/07 Nombre: Problemas 1. a) Calcula qué calor se desprende en la combustión de 20,0 cm 3 de etanol líquido a presión atmosférica
Química 2º Bacharelato DEPARTAMENTO DE FÍSICA E QUÍMICA Termodinámica química 13/12/07 Nombre: Problemas 1. a) Calcula qué calor se desprende en la combustión de 20,0 cm 3 de etanol líquido a presión atmosférica
QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos
 1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
PAAU (LOXSE) SETEMBRO 2004 QUÍMICA
 PAAU (LOXSE) SETEMBRO 24 Código: 31 QUÍMICA CALIFICACIÓN: CUESTIÓN 1=2,5 P.; CUESTIÓN 2=2,5 P.; CUESTIÓN 3=3 P. Y CUESTIÓN 4=2 P. OPCIÓN 1 1.1. De cada una de las siguientes parejas de elementos: Li y
PAAU (LOXSE) SETEMBRO 24 Código: 31 QUÍMICA CALIFICACIÓN: CUESTIÓN 1=2,5 P.; CUESTIÓN 2=2,5 P.; CUESTIÓN 3=3 P. Y CUESTIÓN 4=2 P. OPCIÓN 1 1.1. De cada una de las siguientes parejas de elementos: Li y
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría
 1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1010 DEPARTAMENTO DE FÍSICA Y QUÍMICA 2º Bachillerato QUÍMICA
 1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
1.- La constante de equilibrio, K p, para la siguiente reacción química: C 2 H 4 (g) + H 2 (g) C 2 H 6 (g), vale 5 x 10 17, a 25º C. Calcula, a la misma temperatura, el valor de K c. Solución: K c = 1,22
Resolución de Cuestiones
 La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
H2SO4 (aq)+ NaOH (aq) Na2SO4 (aq)+ H2O (líq)
 1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2010. Fase general OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
1 PAU Química. Septiembre 2010. Fase general OPCIÓN A Cuestión 1A. Considerando el elemento alcalinotérreo del tercer periodo y el segundo elemento del grupo de los halógenos: a) Escriba sus configuraciones
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO PUEDAS, CON UNA ONG.
 SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
HOJA Nº 6. REACCIONES QUÍMICAS (II)
 HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA
 Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. La combustión del acetileno (C 2H 2 (g)) produce dióxido de carbono y agua. a) Escriba la ecuación química correspondiente al proceso.
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. La combustión del acetileno (C 2H 2 (g)) produce dióxido de carbono y agua. a) Escriba la ecuación química correspondiente al proceso.
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Modelo 2007/2008 PRIMERA PARTE
 1 PAU Química. Modelo 2007/2008 PRIMERA PARTE Cuestión 1. Para cada uno de los elementos con la siguiente configuración electrónica en los niveles de energía más externos: A=2s 2 2p 4 ; B=2s 2 ; C= 3s
1 PAU Química. Modelo 2007/2008 PRIMERA PARTE Cuestión 1. Para cada uno de los elementos con la siguiente configuración electrónica en los niveles de energía más externos: A=2s 2 2p 4 ; B=2s 2 ; C= 3s
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar:
 1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
de una reacción n en la cual, tanto reactivos como productos están n en condiciones estándar (p = 1 atm; ; T = 298 K = 25 ºC;
 Entalpía a estándar de la reacción Es el incremento entálpico de una reacción n en la cual, tanto reactivos como productos están n en condiciones estándar (p = 1 atm; ; T = 298 K = 25 ºC; conc.. = 1 M).
Entalpía a estándar de la reacción Es el incremento entálpico de una reacción n en la cual, tanto reactivos como productos están n en condiciones estándar (p = 1 atm; ; T = 298 K = 25 ºC; conc.. = 1 M).
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
UNA ONG ESPERA TU RESPUESTA, ATIÉNDELA PARA QUE PUEDA AYUDAR A OTROS OPCIÓN A
 UNA ONG ESPERA TU RESPUESTA, ATIÉNDELA PARA QUE PUEDA AYUDAR A OTROS OPCIÓN A CUESTIÓN.- Cuál de las siguientes reacciones nunca será espontánea independientemente del valor de la temperatura?, cuál será
UNA ONG ESPERA TU RESPUESTA, ATIÉNDELA PARA QUE PUEDA AYUDAR A OTROS OPCIÓN A CUESTIÓN.- Cuál de las siguientes reacciones nunca será espontánea independientemente del valor de la temperatura?, cuál será
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Septiembre,
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva,
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA
 ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
ENERGÍA DE LAS REACCIONES QUÍMICAS. TERMOQUÍMICA Problemas 1. El calor de combustión del ácido acético(l) es 874 kj/mol. Sabiendo que las entalpías de formación estándar del CO 2 (g), H 2 O(l) son respectivamente:
PROCESOS DE OXIDACIÓN-REDUCCIÓN. ELECTROQUÍMICA.
 PROCESOS DE OXIDACIÓN-REDUCCIÓN. ELECTROQUÍMICA. Ajustar las reacciones: MnO - 4 + Fe 2+ + H + Mn 2+ + Fe 3+ + H 2 O - MnO 4 + I - + H 2 O I 2 + MnO 2 + OH - ClO - 3 + Co 2+ + H + Cl - + Co 3+ + H 2 O
PROCESOS DE OXIDACIÓN-REDUCCIÓN. ELECTROQUÍMICA. Ajustar las reacciones: MnO - 4 + Fe 2+ + H + Mn 2+ + Fe 3+ + H 2 O - MnO 4 + I - + H 2 O I 2 + MnO 2 + OH - ClO - 3 + Co 2+ + H + Cl - + Co 3+ + H 2 O
Refuerzo Modelos atómicos
 Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
EJERCICIOS DE SELECTIVIDAD 99/00
 EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
EJERCICIOS DE SELECTIVIDAD 99/00 1. Tres elementos tienen de número atómico 25, 35 y 38, respectivamente. a) Escriba la configuración electrónica de los mismos. b) Indique, razonadamente, el grupo y periodo
Calor de Reacción. Departamento de Química. Facultad de Ciencias. Universidad de Los Andes. Mérida. Venezuela
 Calor de Reacción Objetivos 1. Estudiar el calor de reacción de tres tipos de reacciones: Hidratación de un ácido. Disolución de una sal. Neutralización de un ácido 2. Determinar el calor involucrado en
Calor de Reacción Objetivos 1. Estudiar el calor de reacción de tres tipos de reacciones: Hidratación de un ácido. Disolución de una sal. Neutralización de un ácido 2. Determinar el calor involucrado en
Formas de expresar la concentración de disoluciones. Química General II 2011
 Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
CUADRO ESTADÍSTICO DE CALIFICACIONES DE QUÍMICA EN SELECTIVIDAD 2014. JUNIO (5,49±0.2) desviación de las medias, no de la población) ALMERÍA 5,41 3,39
 CUADRO ESTADÍSTICO DE CALIFICACIONES DE QUÍMICA EN SELECTIVIDAD 214 DISTRITO UNIVERSITARIO JUNIO (5,49±.2) desviación de las medias, no de la población) SEPTIEMBRE ( ALMERÍA 5,41 3,39 CÁDIZ 5,31 3,9 CÓRDOBA
CUADRO ESTADÍSTICO DE CALIFICACIONES DE QUÍMICA EN SELECTIVIDAD 214 DISTRITO UNIVERSITARIO JUNIO (5,49±.2) desviación de las medias, no de la población) SEPTIEMBRE ( ALMERÍA 5,41 3,39 CÁDIZ 5,31 3,9 CÓRDOBA
(g) CO 2. (g) + 2 H 2. Procediendo en la misma forma con la segunda ecuación, obtenemos: (g) 3 CO 2. (g) + 4 H 2
 Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA
 Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. El naftaleno (C₁₀H₈) es un compuesto aromático sólido que se vende para combatir la polilla. La combustión completa de este compuesto
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. El naftaleno (C₁₀H₈) es un compuesto aromático sólido que se vende para combatir la polilla. La combustión completa de este compuesto
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2013 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B Reserva
Butano(g) -124,7 Dióxido de carbono(g) -393 Agua(l) -286
 1.- Dada la reacción de combustión del butano: Butano(g) + oxígeno (g) ======== dióxido de carbono(gas) + agua (gas) Sabiendo que es una reacción exotérmica, indica si a la misma temperatura, el calor
1.- Dada la reacción de combustión del butano: Butano(g) + oxígeno (g) ======== dióxido de carbono(gas) + agua (gas) Sabiendo que es una reacción exotérmica, indica si a la misma temperatura, el calor
Estequiometría. En química, la estequiometría (del griego "στοιχειον"
 Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 7: REACCIONES REDOX
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio, Opción B
QUÍMICA 2º Bachillerato Ejercicios: Reacciones de Oxidación Reducción (II)
 1(10) Ejercicio nº 1 El KCl reacciona con KMnO 4, en medio ácido sulfúrico, para dar cloro gaseoso, sulfato de manganeso (II), agua y sulfato de potasio. a) Iguale la ecuación molecular por el método del
1(10) Ejercicio nº 1 El KCl reacciona con KMnO 4, en medio ácido sulfúrico, para dar cloro gaseoso, sulfato de manganeso (II), agua y sulfato de potasio. a) Iguale la ecuación molecular por el método del
PROBLEMAS EQUILIBRIO ÁCIDO BASE
 PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 15 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 6, Opción A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 15 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio 6, Opción A Reserva 3,
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
GUÍA N 1: Unidades de medida y Leyes Ponderales. 1.- Convierta las siguientes unidades de temperatura en C, F y K según corresponda:
 1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
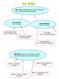 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
ÁCIDO BASE. SELECTIVIDAD UCLM 2ºBACH
 1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
1. Escribe una ecuación que muestre la reacción del ácido nítrico, HNO 3, como un ácido de Brönsted-Lowry, con agua. Cuál es el papel del agua en la reacción? Junio 2001 2. Un ácido débil HA tiene una
( kj / mol) -1268 0-393,5-285,8
 Apellidos y Nombre Grupo 1. (1 punto) En un experimento se disuelve una barra de aluminio (sólido) en 100,00 ml de una disolución de HCl 1,50 M. 2 Al(s) + 6 HCl(ac) 2 AlCl 3 (ac) + 3 H 2 (g) Cuando termina
Apellidos y Nombre Grupo 1. (1 punto) En un experimento se disuelve una barra de aluminio (sólido) en 100,00 ml de una disolución de HCl 1,50 M. 2 Al(s) + 6 HCl(ac) 2 AlCl 3 (ac) + 3 H 2 (g) Cuando termina
EJERCICIOS DE TERMODINÁMICA
 EJERCICIOS DE TERMODINÁMICA. La descomposición del tetraóxido de nitrógeno ( N O 4 NO4( NO( ocurre espontáneamente a temperaturas altas. Los datos termodinámicos a 98ºK se incluyen en la tabla adjunta.
EJERCICIOS DE TERMODINÁMICA. La descomposición del tetraóxido de nitrógeno ( N O 4 NO4( NO( ocurre espontáneamente a temperaturas altas. Los datos termodinámicos a 98ºK se incluyen en la tabla adjunta.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
2
 1 2 3 4 5 6 7 8 9 10 11 12 13 EJERCICIOS TERMOQUÍMICA TEORÍA 1. a) Define energía interna (U). b) Qué es una variable de estado. c) Qué es una variable intensiva y extensiva. 2. a) Que es la entalpía.
1 2 3 4 5 6 7 8 9 10 11 12 13 EJERCICIOS TERMOQUÍMICA TEORÍA 1. a) Define energía interna (U). b) Qué es una variable de estado. c) Qué es una variable intensiva y extensiva. 2. a) Que es la entalpía.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 01 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA. 1. Igualar las siguientes ecuaciones mediante el método algebraico.
 1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
M; ph =2,88; b. α = 1,33.10
 EJERCICIOS DE ÁCIDO BASE. 1º. Tenemos 100cc de agua destlada. Calcular: a. su ph b. si le añadimos una gota (0,05 cc) de HCl 0,1M, calcular el ph de la disolución resultante b. calcular el ph de la disolución
EJERCICIOS DE ÁCIDO BASE. 1º. Tenemos 100cc de agua destlada. Calcular: a. su ph b. si le añadimos una gota (0,05 cc) de HCl 0,1M, calcular el ph de la disolución resultante b. calcular el ph de la disolución
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 9 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 9 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS QUÍMICA. (Proyecto integrado)
 PROBLEMAS QUÍMICA. (Proyecto integrado) CONCEPTOS FUNDAMENTALES 1. Razone qué cantidad de las siguientes sustancias tiene mayor nº de átomos: a) 0 5 moles de SO 2 b) 14 gramos de nitrógeno molecular. c)
PROBLEMAS QUÍMICA. (Proyecto integrado) CONCEPTOS FUNDAMENTALES 1. Razone qué cantidad de las siguientes sustancias tiene mayor nº de átomos: a) 0 5 moles de SO 2 b) 14 gramos de nitrógeno molecular. c)
TERMODINÁMICA QUÍMICA
 TERMODINÁMICA QUÍMICA GBZA 1. INTRODUCCIÓN. CONCEPTOS ELEMENTALES. 2. PRIMER PRINCIPIO DE LA TERMODINÁMICA. 3. ECUACIONES TERMODINÁMICAS. 4. ENTALPÍA DE REACCIÓN. LEY DE HESS. 5. DIAGRAMAS DE ENTALPÍA.
TERMODINÁMICA QUÍMICA GBZA 1. INTRODUCCIÓN. CONCEPTOS ELEMENTALES. 2. PRIMER PRINCIPIO DE LA TERMODINÁMICA. 3. ECUACIONES TERMODINÁMICAS. 4. ENTALPÍA DE REACCIÓN. LEY DE HESS. 5. DIAGRAMAS DE ENTALPÍA.
Química 2º Bachillerato. Dº de Física y Química. IES Atenea. S. S. Reyes 1. Equilibrio químico
 Química 2º Bachillerato. Dº de Física y Química. IES Atenea. S. S. Reyes 1 Equilibrio químico 1. En un matraz de 1 L se introducen 0,1 moles de PCl 5 y se calienta hasta 300 C, disociándose según: PCl
Química 2º Bachillerato. Dº de Física y Química. IES Atenea. S. S. Reyes 1 Equilibrio químico 1. En un matraz de 1 L se introducen 0,1 moles de PCl 5 y se calienta hasta 300 C, disociándose según: PCl
TRABAJO PRÁCTICO N 2 DETERMINACIÓN DE DENSIDADES
 0 TRABAJO PRÁCTICO N 2 DETERMINACIÓN DE DENSIDADES a) Determinación de la densidad de hidrógeno Objetivos Determinar la densidad de un gas Conceptos Gases ideales, presión de vapor, rendimiento, pureza,
0 TRABAJO PRÁCTICO N 2 DETERMINACIÓN DE DENSIDADES a) Determinación de la densidad de hidrógeno Objetivos Determinar la densidad de un gas Conceptos Gases ideales, presión de vapor, rendimiento, pureza,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
PROGRAMA DE QUÍMICA ESTRUCTURA ATÓMICA Y CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS
 PROGRAMA DE QUÍMICA La asignatura se ajustará al programa oficial (Decreto 115/2008, de 6 de junio, por el que se establece el currículo de Bachillerato en Extremadura- DOE, nº 117, de 18 de junio de 2008-).
PROGRAMA DE QUÍMICA La asignatura se ajustará al programa oficial (Decreto 115/2008, de 6 de junio, por el que se establece el currículo de Bachillerato en Extremadura- DOE, nº 117, de 18 de junio de 2008-).
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
Química 2º Bachillerato Termoquímica
 I. E. S. Atenea. Departamento de Física y Química 1 Química 2º Bachillerato Termoquímica 1. Calcular la variación de energía interna para la reacción de combustión del benceno (C 6 H 6 ) si el proceso
I. E. S. Atenea. Departamento de Física y Química 1 Química 2º Bachillerato Termoquímica 1. Calcular la variación de energía interna para la reacción de combustión del benceno (C 6 H 6 ) si el proceso
, que no está formado por moléculas, sino por una red cristalina en la que hay una proporción de dos átomos de flúor por cada átomo de calcio.
 7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
CONCENTRACIÓN MOLAR Y NORMAL
 PROBLEMAS INICIALES DE PRÁCTICA CONCENTRACIÓN MOLAR Y NORMAL Pregunta 1 Qué significa una disolución con una concentración 0.3 M? Respuesta: 0.3 moles de una sustancia en 1 litro de disolución. Pregunta
PROBLEMAS INICIALES DE PRÁCTICA CONCENTRACIÓN MOLAR Y NORMAL Pregunta 1 Qué significa una disolución con una concentración 0.3 M? Respuesta: 0.3 moles de una sustancia en 1 litro de disolución. Pregunta
JMLC - Chena IES Aguilar y Cano - Estepa
 Termodinámica es la parte de la física que estudia los intercambios de calor y trabajo que acompañan a los procesos fisicoquímicos. Si estos son reacciones químicas, la parte de ciencia que los estudia
Termodinámica es la parte de la física que estudia los intercambios de calor y trabajo que acompañan a los procesos fisicoquímicos. Si estos son reacciones químicas, la parte de ciencia que los estudia
Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros 1
 Departamento de Ingeniería Química y Química Inorgánica Universidad de Cantabria (SPAIN) Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros
Departamento de Ingeniería Química y Química Inorgánica Universidad de Cantabria (SPAIN) Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros
PRUEBA DE ACCESO A LA UNIVERSIDAD
 PRUEBA DE ACCESO A LA UNIVERSIDAD CONVOCATORIA DE JUNIO DE 2014 EJERCICIO DE: QUÍMICA TIEMPO DISPONIBLE: 1 hora 30 minutos PUNTUACIÓN QUE SE OTORGARÁ A ESTE EJERCICIO: (véanse las distintas partes del
PRUEBA DE ACCESO A LA UNIVERSIDAD CONVOCATORIA DE JUNIO DE 2014 EJERCICIO DE: QUÍMICA TIEMPO DISPONIBLE: 1 hora 30 minutos PUNTUACIÓN QUE SE OTORGARÁ A ESTE EJERCICIO: (véanse las distintas partes del
Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la
 Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
OPCIÓN A. b) Falsa. Siendo S la solubilidad molar del compuesto poco soluble, su producto de solubilidad
 OPCIÓN A CUESTIÓN 3.- El hidróido de cadmio (II) es una sustancia cuyo producto de solubilidad es 7, 10 15 a 5 ºC, y aumenta al aumentar la temperatura. Justifica si son verdaderas o falsas las siguientes
OPCIÓN A CUESTIÓN 3.- El hidróido de cadmio (II) es una sustancia cuyo producto de solubilidad es 7, 10 15 a 5 ºC, y aumenta al aumentar la temperatura. Justifica si son verdaderas o falsas las siguientes
Reactivos limitantes UNIDAD 3: ESTEQUIOMETRÍA
 Reactivos limitantes En muchos procesos industriales la cantidad de productos que se obtenga dependerá de la cantidad de materias iniciales con las que se cuente. Por ejemplo, si deseas fabricar bicicletas,
Reactivos limitantes En muchos procesos industriales la cantidad de productos que se obtenga dependerá de la cantidad de materias iniciales con las que se cuente. Por ejemplo, si deseas fabricar bicicletas,
REPASO SOBRE CÁLCULOS EN QUÍMICA
 REPASO SOBRE CÁLCULOS EN QUÍMICA 1. LA MEDIDA DE LA MASA EN QUÍMICA. 1.1 La masa de un átomo y de una molécula. Tanto si se trata de elementos químicos como de compuestos, la materia está formada por átomos;
REPASO SOBRE CÁLCULOS EN QUÍMICA 1. LA MEDIDA DE LA MASA EN QUÍMICA. 1.1 La masa de un átomo y de una molécula. Tanto si se trata de elementos químicos como de compuestos, la materia está formada por átomos;
SOLUCIONARIO A LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD PROPUESTAS POR LAS UNIVERSIDADES ANDALUZAS
 QUÍMICA PRUEBA DE ACCESO A LA UNIVERSIDAD QUÍMICA (09) CEUTA Y MELILLA Instrucciones: a) Duración: 1 hora y 30 minutos b) Elija y desarrolle una opción completa, sin mezclar cuestiones de ambas. Indique,
QUÍMICA PRUEBA DE ACCESO A LA UNIVERSIDAD QUÍMICA (09) CEUTA Y MELILLA Instrucciones: a) Duración: 1 hora y 30 minutos b) Elija y desarrolle una opción completa, sin mezclar cuestiones de ambas. Indique,
1 Hd + H ionización + H afinidad = 437 89,24 122 418,9 + 349 =
 QUÍMICA GENERAL OPCIÓN A CUESTIÓN 1.- Construye el ciclo de Born-Haber y calcula la energía de red ( Hred) del KCl(s) a partir de los siguientes datos: entalpía estándar de formación del KCl(s), H f =
QUÍMICA GENERAL OPCIÓN A CUESTIÓN 1.- Construye el ciclo de Born-Haber y calcula la energía de red ( Hred) del KCl(s) a partir de los siguientes datos: entalpía estándar de formación del KCl(s), H f =
1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml.
 ESTEQUIOMETRÍA,DISOLUCIONES: ACTIVIDADES DE SELECTIVIDAD. 1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml. a) Qué volumen de esta disolución se
ESTEQUIOMETRÍA,DISOLUCIONES: ACTIVIDADES DE SELECTIVIDAD. 1. Se dispone de una disolución acuosa de ácido sulfúrico del 98% de riqueza en masa y densidad 1,84 g/ml. a) Qué volumen de esta disolución se
EJERCICIOS DE EQUILIBRIO QUÍMICO.
 EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
EJERCICIOS DE EQUILIBRIO QUÍMICO. 1º. A partir de 150 g de acético se desean obtener 166 g de acetato de etilo. Calcular los gramos de etanol que se necesitan sabiendo que la K c de la reacción de esterificación
] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH -
![] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH - ] = s = 1'5 10-5 M. a) El equilibrio de ionización del compuesto es: Al(OH) 3 Al 3+ + 3 OH -](/thumbs/40/21798534.jpg) 1. Se disuelve hidróxido de cobalto(ii) en agua hasta obtener una disolución saturada a una temperatura dada. Se conoce que la concentración de iones OH - es 3 10-5 M. Calcule: a) La concentración de iones
1. Se disuelve hidróxido de cobalto(ii) en agua hasta obtener una disolución saturada a una temperatura dada. Se conoce que la concentración de iones OH - es 3 10-5 M. Calcule: a) La concentración de iones
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción
Ejercicios 3 (Soluciones) 2) Determinar el peso de 400 ml de ácido clorhídrico cuya densidad es de 1,16 g/ml R: 464 g
 Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97
 REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule los
REACCIONES DE TRANSFERENCIA DE PROTONES EJERCICIOS DE SELECTIVIDAD 96/97 1. a) Cuántos gramos de hidróxido de potasio se necesitan para preparar 250 ml de una disolución acuosa de ph = 13? b) Calcule los
EJERCICIOS REACCIONES REDOX
 EJERCICIOS REACCIONES REDOX 1. En disolución acuosa y medio ácido del ion permanganato oxida al ion hierro(ii) a ion hierro(iii). En este proceso el ion permanganato se reduce a ion manganeso(ii). a) Ajuste
EJERCICIOS REACCIONES REDOX 1. En disolución acuosa y medio ácido del ion permanganato oxida al ion hierro(ii) a ion hierro(iii). En este proceso el ion permanganato se reduce a ion manganeso(ii). a) Ajuste
NÚCLEO ATÓMICO Profesor: Juan T. Valverde
 6 1.- Deduce la masa atómica del litio a partir de sus isótopos Li con una abundancia del 7 7,5% y Li con una abundancia del 92,5%. http://www.youtube.com/watch?v=8vvo-xqynea&feature=youtu.be 2.- Calcula
6 1.- Deduce la masa atómica del litio a partir de sus isótopos Li con una abundancia del 7 7,5% y Li con una abundancia del 92,5%. http://www.youtube.com/watch?v=8vvo-xqynea&feature=youtu.be 2.- Calcula
GUÍA DE PROBLEMAS. Cinética Química
 GUÍA DE PROBLEMAS 1) Deduzca las ecuaciones matemáticas que representan la cinética química para las reacciones de cero, primer y segundo orden. Asimismo, establezca la ecuación para cuando la concentración
GUÍA DE PROBLEMAS 1) Deduzca las ecuaciones matemáticas que representan la cinética química para las reacciones de cero, primer y segundo orden. Asimismo, establezca la ecuación para cuando la concentración
TEMA 6.- Reacciones de trans- ferencia de protones
 TEMA 6.- Reacciones de trans- ferencia de protones CUESTIONES 51.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más débil es un ácido menor es el ph de sus
TEMA 6.- Reacciones de trans- ferencia de protones CUESTIONES 51.- Razone la veracidad o falsedad de las siguientes afirmaciones: a) A igual molaridad, cuanto más débil es un ácido menor es el ph de sus
TEMA 6 EQUILIBRIO QUÍMICO
 TEMA 6 EQUILIBRIO QUÍMICO ÍNDICE 1. Equilibrio químico homogéneo y heterogéneo 2. Concentraciones en equilibrio 3. Constante de equilibrio K c 4. Constantes de equilibrio K p y K c 5. Cociente de reacción
TEMA 6 EQUILIBRIO QUÍMICO ÍNDICE 1. Equilibrio químico homogéneo y heterogéneo 2. Concentraciones en equilibrio 3. Constante de equilibrio K c 4. Constantes de equilibrio K p y K c 5. Cociente de reacción
EJERCICIO DE EXAMEN DE FISICOQUÍMICA
 EJERCICIO DE EXAMEN DE FISICOQUÍMICA 1) En un recipiente de volumen fijo, se tienen los gases ideales 1 y 2 a una presión total P. Si en estas condiciones se introduce un gas ideal manteniendo la presión
EJERCICIO DE EXAMEN DE FISICOQUÍMICA 1) En un recipiente de volumen fijo, se tienen los gases ideales 1 y 2 a una presión total P. Si en estas condiciones se introduce un gas ideal manteniendo la presión
T(K) 298 400 600 800 1000 Kp 2,82 10-25 1,78 10-16 1,98 10-8 1,29 10-3 2,642 10 1
 EQUILIBRIO QUÍMICO : ACTIVIDADES DE SELECTIVIDAD Curso 13-14 1.- En un matraz de 2 l se introducen 12 g de PCl 5 y se calienta hasta 300 º C. En el equilibrio de disociación; PCl 5 (g) PCl 3 (g) + Cl 2
EQUILIBRIO QUÍMICO : ACTIVIDADES DE SELECTIVIDAD Curso 13-14 1.- En un matraz de 2 l se introducen 12 g de PCl 5 y se calienta hasta 300 º C. En el equilibrio de disociación; PCl 5 (g) PCl 3 (g) + Cl 2
MODELO DE RESPUESTAS
 1/6 UNIVERSIDAD NACIONAL ABIERTA VICERRECTORADO ACADEMICO AREA: INGENIERÍA CARRERA: INGENIERIA INDUSTRIAL S ASIGNATURA: QUIMICA CÓDIGO: 209 MOMENTO: VERSION: 1 FECHA DE APLICACIÓN: 09/07/2011 LAPSO: Prof.
1/6 UNIVERSIDAD NACIONAL ABIERTA VICERRECTORADO ACADEMICO AREA: INGENIERÍA CARRERA: INGENIERIA INDUSTRIAL S ASIGNATURA: QUIMICA CÓDIGO: 209 MOMENTO: VERSION: 1 FECHA DE APLICACIÓN: 09/07/2011 LAPSO: Prof.
REACCIONES ÁCIDO-BASE
 9 REACCINES ÁCID-BASE SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Escribe las reacciones de disociación de las siguientes sustancias, indicando cuál o cuáles de ellas son ácidos o
9 REACCINES ÁCID-BASE SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Escribe las reacciones de disociación de las siguientes sustancias, indicando cuál o cuáles de ellas son ácidos o
