GUÍA DE APRENDIZAJE Nº 6 para 1º MEDIO TEMA: ESTEQUIOMETRIA 2ª parte. Subsector: QUÍMICA Docente: Liduvina Campos A. Nombre alumno: Curso: Fecha:
|
|
|
- Gerardo García Pérez
- hace 7 años
- Vistas:
Transcripción
1 Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Estequiometría. GUÍA DE APRENDIZAJE Nº 6 para 1º MEDIO TEMA: ESTEQUIOMETRIA 2ª parte Objetivo General: Aplicación de cálculos estequiométricos para explicar las relaciones cuantitativas entre cantidad de sustancia y masa. Contenidos: Masa Atómica, masa formular. Mol y masa molar. Subsector: QUÍMICA Docente: Liduvina Campos A. Nombre alumno: Curso: Fecha: Instrucciones: A continuación encontrarás una serie de actividades que deberás desarrollar a fin de prepararte para rendir Examen Final. Como les había señalado en la guía anterior. La estequiometría tiene por finalidad establecer aquellas relaciones entre reactantes y productos en una reacción química. TÉRMINOS DE ESTEQUIOMETRÍA. A continuación les presento algunos términos muy usados para explicar la relación entre reactantes y productos. UNIDAD DE MASA ATOMICA ( uma) Para asignar las masas atómicas se define la uma que es la doceava parte del peso del 12 C. 1uma = x g y 1g = x uma Ejemplo: - Calcular la masa del átomo de aluminio (Al) en gramos, sabiendo que presenta 26,98 uma. 1 uma 1, g 26,98 uma X g X = 26,98 uma 1, g = 44, g 1 uma 1. Calcula la masa del átomo de calcio (Ca) sabiendo que presenta 40 uma. 2. Determinar la uma, si la masa del átomo de sodio (Na) es 3,81 x gramos (g)
2 MASAS ATOMICAS Y FORMULAR La masa formular ( MF) no es mas que la suma de las masas atómicas de cada uno de los átomos de la formula química. Por ejemplo el ácido sulfúrico tiene una masa formular de 98,0 uma calculado considerando las masas atómicas (MA) de cada átomo que conforma su formula química, como se muestra en el siguiente ejemplo: Los subíndices indican el numero de átomos con que cada uno participa en la molécula H 2 SO 4 2 de hidrógeno 4 de oxigeno 1 de azufre ( al igual que en matemática el 1 no se escribe) Así se obtiene que la masa formular sera: MF = 2( MA de H) + 1 (MA de S) + 4 (MA de O) MF = 2 (1 uma) + 1(32 uma) + 4 ( 16 uma) = 98,0 uma 1. Determine la masa formular de los siguientes compuestos: a) CH 4 b) HCl c) HNO 3 d) HClO 4 Datos: MA de C=12 uma ; MA de H = 1 uma ; MA de Cl = 35 uma ; MA de N = 14 uma ; MA de O = 16 uma. EL NÚMERO DE AVOGADRO ( NA ) Mediante diversos experimentos científicos se ha determinado que el número de átomos que hay en 12g de 12 C es Este número recibe el nombre de número de Avogadro. En síntesis: un mol contiene el número de Avogadro ( ) de unidades de materia físicas reales ( átomos, moléculas o iones) El número de Avogadro es tan grande que es difícil imaginarlo. Por ejemplo: Si esparciéramos 6.02 x bolitas sobre toda la superficie terrestre, formaríamos una capa de casi 5 Km de espesor!
3 MOL Los químicos han determinado, luego de muchos años de investigación, que la magnitud que mejor se ajusta a las necesidades de la química es la cantidad de sustancia representada por la letra ene minúscula y cursiva ( n ), cuya unidad de medida es el mol. Qué es el mol y como se relaciona con el número de Avogadro? El término mol proviene del latín moles, que significa una masa Se define mol como la cantidad de sustancia que contiene la misma cantidad de partículas que átomos hay en 12 g de carbono -12 ( 12 6 C ) Los científicos han determinado que el número de átomos que hay en 12 g de carbono-12 es 6,02 x CONSTANTE DE AVOGADRO. Es la constante que establece una relación entre el numero de entidades y la cantidad de sustancia. Su valor es: 6,02 x mol -1 En general podemos decir que el concepto de mol y la constante de Avogadro están estrechamente relacionados. Así, un mol de entidades ( átomos, moléculas o iones) equivale a decir que hay 6,02 x de estas entidades. Cuando decimos: Entonces: Ejemplo: 1 docena = 12 unidades 1 resma = 500 hojas 1 mol = 6,02 x entidades elementales 1mol de átomos = 6,02 x átomos 1 mol de moléculas = 6,02 x moléculas 1 mol de iones = 6,02 x iones - Calcular el numero de átomos que hay en 2,3 moles de Zn ( zinc) 1 mol 6,02 x átomos 2,3 mol X átomos X= 1,38 x átomos de zinc Es decir, en 2,3 moles de Zn hay 1,38 x átomos de zinc MASA MOLAR DE ÁTOMOS Para determinar la masa molar de un elemento se convierten las unidades de masa atómica que aparecen en la tabla periódica en gramos. Por ejemplo: el azufre ( S ) tiene una masa atómica de 32,07 uma, así que un mol de azufre tiene una masa atómica de 32,07 g y contiene 6,02 x átomos de azufre. Elemento Masa atómica Masa molar Numero de átomos H 1,008 uma 1,008 g 6,02 x He 4,003 uma 4,003 g 6,02 x Mg 24,31 uma 24,31 g 6,02 x S 32,07 uma 32,07 g 6,02 x Conociendo el número de avogadro y la masa atómica de un elemento, es posible calcular la masa de cada átomo individual. También el número de átomos en una muestra pesada de cualquier elemento.
4 Ejemplo 1: Cuando se añade selenio (Se) al vidrio, éste adquiere un brillante color rojo. Tomando el número de Avogadro como 6,02 x 10 23, calculemos: a) la masa de un átomo de selenio. b) El número de átomos de selenio en una muestra de 1,000 gramos (g) del elemento. 1. Asociamos el conocimiento La masa atómica del selenio (Se) tomada de la tabla periódica es 32,07 uma. Con lo que 1 átomo de selenio tiene una masa atómica de 32,07 g y contiene 6,02 x átomos de selenio. 2. Solución a) masa del átomo de selenio Sabemos que 6,02 x átomos de selenio presentan una masa equivalente a 76,96 g por lo tanto: 76,96 g 6,02 x átomos de Se X 1 átomo de Se X = 1 átomo de Se x 76,96 g 6,02 x átomos de Se X = 1,311 x gramos de selenio b) El número de átomos de selenio en una muestra de 1,000 g del elemento 76,96 g 6,02 x átomos de Se 1,000 g X átomos de Se X = 1,000 g de Se 6,02 x átomos de Se 76,96 g de Se X = 7,627 x átomos de selenio En 1,000 g de selenio existen 7, átomos ( Para resolver estos ejercicios obtener las masas atómicas de tabla periódica) 1. Qué cantidad de átomos de hierro existe en 25 gramos de hierro puro (Fe)? 2. Qué masa en gramos de carbono hay en un átomo de carbono (C)? 3. Cuál es la masa de 3, átomos de sodio (Na)? MASA MOLAR DE LOS COMPUESTOS (M) M = g n g = gramos de sustancia n = moles de sustancia La masa molar de los compuestos se define como la masa en gramos de un mol de una sustancia, y se puede determinar al conocer la formula del mismo gracias a la suma consecutiva de todos sus componentes, al igual como se explico para calcular la masa formular. Ejemplo 1: Para el agua la masa molar será: H 2 O 2 átomos de H 1 átomo de O
5 Luego M = 2 (1,008 g) + 1 (16,00 g) = 18,02 g es la masa molar del agua. Ejemplo 2: Calculo de la masa molar del hidróxido de calcio Ca(OH) 2 Ca(OH) 2 M = Nº de átomos Ca x MA del calcio + Nºde átomos de O x MA del oxigeno + Nº de átomos de H x MA del Hidrógeno (MA = masa atómica) Reemplazando: M = 1 x (40,08 g) + 2 ( 16,00 g ) + 2 ( 1,008 g) M = 74,10 g es la masa molar del hidróxido de calcio Ca(OH) 2 En resumen podemos conocer la masa molar de un átomo, molécula o ion y para ello se requiere saber los datos de la masa atómica y la cantidad de átomos. 1 mol = 6,02 x átomos o moleculas = masa molar (M) o masa atómica (MA) Relaciones H ( hidrógeno) Cl (cloro) HCl (ácido clorhídrico) Numero de entidades elementales 6,02 x Átomos de H 6,02 x Átomos de Cl 6,02 x moléculas de HCl Cantidad de sustancia Masa atómica del H y el Cl y masa molar del HCl Semejanzas 1 mol de átomos de H 1 mol de átomos de Cl 1 mol de moléculas de HCl 1,008 g 35,45 g 36,46 g 1 masa molar de átomos de H 1 masa molar de átomos de Cl 1 masa molar de moléculas de HCl EJERCICIOS: 1. Define masa molar y explica cual es su importancia. 2. Establece la relación que existe entre masa molar, moles y numero de avogadro. Cita a lo menos dos ejemplos. 3. El pigmento que le da el color verde a las plantas y que es responsable de la fotosíntesis y el O 2 que respiramos, se llama clorofila y tiene la siguiente estructura: C 55 H 72 MgN 4 O 5 Calcule la masa molar ( M) de la clorofila (obtenga las masas atómicas de la tabla periódica) 4. Determina la masa molar de los siguientes compuestos: (obtenga las masas atómicas de la tabla periódica) a) Fe 2 O 3 b) NaOH c) CO 2 d) HNO 3
TIPOS DE REACCIONES QUIMICAS
 Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
Liceo Polivalente Juan Antonio Ríos Quinta Normal Unidad temática: Disoluciones Químicas. GUÍA DE APRENDIZAJE Nº 6 2º MEDIO SOLUCIONES 2ª parte Objetivo General:Conocer conceptos de las disoluciones en
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
SESIÓN 1 CÁLCULOS QUÍMICOS
 SESIÓN 1 CÁLCULOS QUÍMICOS I. CONTENIDOS: 1. Nomenclatura química. 2. atómica. 3. molecular. 4. Concepto mol. 5. El número de Avogadro. II. OBJETIVOS: Al término de la Sesión, el alumno: Recordará las
SESIÓN 1 CÁLCULOS QUÍMICOS I. CONTENIDOS: 1. Nomenclatura química. 2. atómica. 3. molecular. 4. Concepto mol. 5. El número de Avogadro. II. OBJETIVOS: Al término de la Sesión, el alumno: Recordará las
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio,
CONCENTRACIÓN MOLAR Y NORMAL
 PROBLEMAS INICIALES DE PRÁCTICA CONCENTRACIÓN MOLAR Y NORMAL Pregunta 1 Qué significa una disolución con una concentración 0.3 M? Respuesta: 0.3 moles de una sustancia en 1 litro de disolución. Pregunta
PROBLEMAS INICIALES DE PRÁCTICA CONCENTRACIÓN MOLAR Y NORMAL Pregunta 1 Qué significa una disolución con una concentración 0.3 M? Respuesta: 0.3 moles de una sustancia en 1 litro de disolución. Pregunta
El mol. Chema Martín, 3º ESO. 2016
 El mol Chema Martín, 3º ESO. 2016 El mol Es el concepto fundamental de la química. Todos los cálculos que haremos a partir de ahora se basarán en él, por eso es muy importante entenderlo correctamente
El mol Chema Martín, 3º ESO. 2016 El mol Es el concepto fundamental de la química. Todos los cálculos que haremos a partir de ahora se basarán en él, por eso es muy importante entenderlo correctamente
Las ecuaciones químicas
 Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
Las reacciones químicas se representan escribiendo las fórmulas de los reactivos en el primer miembro de una ecuación y las de los productos en el segundo. El signo igual se sustituye por una flecha (
TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA
 TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA FUNDAMENTO TEÓRICO La estequiometría es el área de la química que estudia las cantidades de reactivos y productos que intervienen en una reacción química,
TEÓRICO-PRÁCTICO N 2: ESTEQUIOMETRÍA DE LA MOLÉCULA FUNDAMENTO TEÓRICO La estequiometría es el área de la química que estudia las cantidades de reactivos y productos que intervienen en una reacción química,
Unidades de masa atómica
 Unidades de masa atómica La estructura química y las fórmulas químicas sirven para estudiar las relaciones de masa de átomos y moléculas. Estas relaciones ayudan a explicar la composición de los compuestos
Unidades de masa atómica La estructura química y las fórmulas químicas sirven para estudiar las relaciones de masa de átomos y moléculas. Estas relaciones ayudan a explicar la composición de los compuestos
GUÍA N 1: Unidades de medida y Leyes Ponderales. 1.- Convierta las siguientes unidades de temperatura en C, F y K según corresponda:
 1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
1 PRIMERA PARTE: Ejercicios de desarrollo. GUÍA N 1: Unidades de medida y Leyes Ponderales. Considerando las siguientes tablas de conversión de unidades del SISTEMA INTERNACIONAL DE UNIDADES (S.I.), desarrolla
GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA. 1. Igualar las siguientes ecuaciones mediante el método algebraico.
 1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
1 GUÍA DE EJERCICIOS DE ESTEQUIOMETRÍA 1. Igualar las siguientes ecuaciones mediante el método algebraico. a) P 4 + KOH + H 2 O KH 2 PO 2 + PH 3 b) Co 2+ + NH 4 + + NH 3 + O 2 H 2 O + (Co(NH 3 ) 6 ) 3+
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva 1, Ejercicio 4, Opción
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]
![Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1]](/thumbs/40/20756584.jpg) Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
Ejercicios de QUÍMICA (2ºBachillerato) Tema 0. REVISIÓN DE CONCEPTOS BÁSICOS [1] [1]. Calcula: (a) La masa de un átomo de potasio. (b) El número de átomos de fósforo que hay en 2 g de este elemento. (c)
QUÍMICA 2º Bachillerato Ejercicios: Cálculos en Química
 1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
1(8) Ejercicio nº 1 Se dispone de tres recipientes que contienen 1 litro de metano gas, dos litros de nitrógeno gas y 1,5 litros de ozono gas, respectivamente, en las mismas condiciones de presión y temperatura.
Formas de expresar la concentración de disoluciones. Química General II 2011
 Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
Formas de expresar la concentración de disoluciones Química General II 2011 Concentración de las disoluciones Es la cantidad de soluto presente en cierta cantidad de disolución. Fracción que se busca Porcentaje
UNIDAD: 7 ESTEQUIOMETRÍA
 UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
UNIDAD: 7 ESTEQUIOMETRÍA CONCEPTOS BÁSICOS DE ESTEQUIOMETRÍA RECOPILÓ: QUIM. GABRIEL JIMENEZ ZERON TOMADO DEL TEMA ESTEQUIOMETRIA www.wikipedia.org Estequiometría El termino estequiometría proviene del
MASA ATÓMICA MASA MOLECULAR. Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1
 Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1 MASA ATÓMICA Al igual que ocurre en la materia ordinaria (piensa en las distintas variedades de panes en tamaño, composición y peso,
Física y Química 4º E.S.O. MASA ATÓMICA, MASA MOLECULAR Y MOLES Pág. 1 MASA ATÓMICA Al igual que ocurre en la materia ordinaria (piensa en las distintas variedades de panes en tamaño, composición y peso,
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Sistemas Físicos y Químicos
 1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
1(7) Ejercicio nº 1 Una muestra de sulfuro de hierro de 60,5 g contiene 28 g de azufre. Cuál es la fórmula empírica de dicho compuesto? Ejercicio nº 2 150 g de un compuesto contienen 45,65 g de nitrógeno
ESTEQUIOMETRÍA I. ÁTOMO Mínima porción de materia que posee aún las propiedades del elemento.
 ESTEQUIOMETRÍA I Preparado por: José del c. Mondragón C. El término estequiometría deriva del griego steicheion, que significa primer principio o elemento y de metron, que significa medida. La estequiometría
ESTEQUIOMETRÍA I Preparado por: José del c. Mondragón C. El término estequiometría deriva del griego steicheion, que significa primer principio o elemento y de metron, que significa medida. La estequiometría
Tema 2. Estequiometría
 Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
Tema 2. Estequiometría Masas Atómicas Escala del carbono 12 Masas atómicas relativas Concepto de mol Relaciones de masa de las fórmulas químicas Composición centesimal Fórmula empírica. Fórmula molecular
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 6, Opción A Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción
Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la
 Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
Prof.- Juan Sanmartín 4º E.S.O ESO 1 3 Ley de conservación de la masa (Ley de Lavoisier) La suma de las masas de los reactivos es igual a la suma de las masas de los productos de la reacción, es decir,
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría
 1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
1(7) Ejercicio nº 1 El acetileno o etino (C 2 H 2 ) arde en el aire con llama muy luminosa. a) Qué volumen de acetileno, medido en c.n. será preciso utilizar si en esta reacción se han obtenido 100 litros
Ejercicios de repaso
 Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
Ejercicios de repaso 1. (2001) Tenemos 250 ml de una disolución de KOH 0 2 M. a) Cuántos moles de KOH hay disueltos? b) Cuántos gramos de KOH hay disueltos? c) Describa el procedimiento e indique el material
GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA
 Liceo Juan Antonio Ríos Quinta Normal GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA Unidad temática: Estructura atómica Objetivo General:Comprender el comportamiento de los electrones
Liceo Juan Antonio Ríos Quinta Normal GUIA DE APRENDIZAJE QUIMICA 1º MEDIO TEMA : CONFIGURACIÓN ELECTRÓNICA Unidad temática: Estructura atómica Objetivo General:Comprender el comportamiento de los electrones
si con 24 g de magnesio reaccionan 6 g de oxígeno pues con 6 g reaccionarán x
 Hoja número 1. 1) Si 24 g de magnesio se combinan exactamente con 16 g de oxígeno para formar óxido de magnesio, a) cuántos gramos de óxido se habrán formado?; b) a partir de 6 g de magnesio cuántos gramos
Hoja número 1. 1) Si 24 g de magnesio se combinan exactamente con 16 g de oxígeno para formar óxido de magnesio, a) cuántos gramos de óxido se habrán formado?; b) a partir de 6 g de magnesio cuántos gramos
Licenciatura en Nutrición. Curso Introductorio. Introducción a la Bioquímica Módulo 1 Leccion 2
 Licenciatura en Nutrición Curso Introductorio Introducción a la Bioquímica Módulo 1 Leccion 2 1 MOLÉCULAS Y COMPUESTOS Objetivos Describir los dos tipos fundamentales de enlaces químicos. Describir las
Licenciatura en Nutrición Curso Introductorio Introducción a la Bioquímica Módulo 1 Leccion 2 1 MOLÉCULAS Y COMPUESTOS Objetivos Describir los dos tipos fundamentales de enlaces químicos. Describir las
EL MOL. MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas
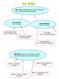 EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
EL MOL MOL: cantidad de materia que tiene 6,022.10 23 partículas, es decir, el número de Avogadro de partículas MOL DE ATOMOS: 6,022.10 23 átomos MOL DE MOLÉCULAS 6,022.10 23 moléculas 1 mol de átomos
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar:
 1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
1.- Se disuelven 180 gramos de NaOH en 400 gramos de agua, resultando un volumen de 432,836 ml. Determinar: a. La densidad de la disolución b. La concentración de NaOH en gramos por litro c. La concentración
Pureza y rendimiento en reacciones
 Pureza y rendimiento en reacciones En este documento vamos a ver cómo se resuelven problemas de estequiometría que incluyan cálculos sobre pureza de un elemento o rendimiento de una reacción. Pero primero
Pureza y rendimiento en reacciones En este documento vamos a ver cómo se resuelven problemas de estequiometría que incluyan cálculos sobre pureza de un elemento o rendimiento de una reacción. Pero primero
SEMANA 9 CONCENTRACIÓN DE SOLUCIONES II Elaborado por: Licda. Edda García
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2013 SEMANA 9 CONCENTRACIÓN DE SOLUCIONES II Elaborado por: Licda. Edda
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2013 SEMANA 9 CONCENTRACIÓN DE SOLUCIONES II Elaborado por: Licda. Edda
Todo lo que puedas imaginar está compuesto por átomos.
 Todo lo que puedas imaginar está compuesto por átomos. El átomo es la partícula más pequeña de un elemento químico (materia formada por átomos iguales) y posee las características del mismo. Cuando se
Todo lo que puedas imaginar está compuesto por átomos. El átomo es la partícula más pequeña de un elemento químico (materia formada por átomos iguales) y posee las características del mismo. Cuando se
Reactivos limitantes UNIDAD 3: ESTEQUIOMETRÍA
 Reactivos limitantes En muchos procesos industriales la cantidad de productos que se obtenga dependerá de la cantidad de materias iniciales con las que se cuente. Por ejemplo, si deseas fabricar bicicletas,
Reactivos limitantes En muchos procesos industriales la cantidad de productos que se obtenga dependerá de la cantidad de materias iniciales con las que se cuente. Por ejemplo, si deseas fabricar bicicletas,
Estequiometría. En química, la estequiometría (del griego "στοιχειον"
 Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
Estequiometría En química, la estequiometría (del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métron, (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el
Refuerzo Modelos atómicos
 Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
Refuerzo Modelos atómicos 1 1. Completa la siguiente tabla: CARGA MASA UBICACIÓN EN EL ÁTOMO DESCUBRIDOR AÑO DE DESCUBRIMIENTO Electrón Protón Neutrón. Resume en la tabla siguiente los distintos modelos
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
UNIDAD 1: ATOMOS Y MOLÉCULAS
 UNIDAD 1: ATOMOS Y MOLÉCULAS 1 Se define átomo como la menor porción de un elemento que se puede intercambiar por medio de una reacción química. Se define molécula como la menor porción de materia que
UNIDAD 1: ATOMOS Y MOLÉCULAS 1 Se define átomo como la menor porción de un elemento que se puede intercambiar por medio de una reacción química. Se define molécula como la menor porción de materia que
TEMA Nº 14. MOL, NÚMERO DE AVOGADRO
 TEMA Nº 14. MOL, NÚMERO DE AVOGADRO 1.- Define la Unidad de Masa Atómica (u) Respuesta: Es la totalidad de masa de los protones y neutrones pertenecientes a un único átomo en estado de reposo. La masa
TEMA Nº 14. MOL, NÚMERO DE AVOGADRO 1.- Define la Unidad de Masa Atómica (u) Respuesta: Es la totalidad de masa de los protones y neutrones pertenecientes a un único átomo en estado de reposo. La masa
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES
 GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Química Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Química Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento
UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA
 UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda
UNIDAD DIDÁCTICA 2: ESTRUCTURA DE LA MATERIA 1. Qué explica el modelo atómico de Dalton? a) La materia está constituida por átomos b) Los átomos tienen un núcleo muy pequeño donde se concentra casi toda
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 8
 UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 8 NOMBRE DE LA ASIGNATURA TÍTULO DURACIÓN BIBLIOGRAFÍA SUGERIDA DOCENTES Química General UNIDADES QUÍMICAS Y ESTEQUIOMETRÍA
UNIVERSIDAD LIBRE FACULTAD DE INGENIERÌA DEPARTAMENTO DE CIENCIAS BÁSICAS GUIA DE CLASE No 8 NOMBRE DE LA ASIGNATURA TÍTULO DURACIÓN BIBLIOGRAFÍA SUGERIDA DOCENTES Química General UNIDADES QUÍMICAS Y ESTEQUIOMETRÍA
UNIDADES DE CONCENTRACIÓN
 Colegio San Esteban Diácono Departamento de Ciencias Química IIº Medio Prof. Juan Pastrián / Sofía Ponce de León UNIDADES DE CONCENTRACIÓN 1. Porcentaje masa/masa (%m/m) Cantidad en masa (g) de un componente
Colegio San Esteban Diácono Departamento de Ciencias Química IIº Medio Prof. Juan Pastrián / Sofía Ponce de León UNIDADES DE CONCENTRACIÓN 1. Porcentaje masa/masa (%m/m) Cantidad en masa (g) de un componente
Resolución de Cuestiones
 La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
La cantidad en Química 1 Cuestión 1 Resolución de Cuestiones Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, conteste razonadamente a las siguientes cuestiones: a) Qué ocupará más
GUÍA Nº 1: Preparación de Soluciones I parte
 1 Produce una inmensa tristeza pensar que la naturaleza habla mientras el género humano no la escucha. Victor Hugo I parte Preparar soluciones porcentuales soluto y la cantidad de solvente. La concentración
1 Produce una inmensa tristeza pensar que la naturaleza habla mientras el género humano no la escucha. Victor Hugo I parte Preparar soluciones porcentuales soluto y la cantidad de solvente. La concentración
PROBLEMAS EQUILIBRIO ÁCIDO BASE
 PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PROBLEMAS EQUILIBRIO ÁCIDO BASE 1.- a) Aplicando la teoría de Brönsted-Lowry, explique razonadamente, utilizando las ecuaciones químicas necesarias, si las siguientes especies químicas se comportan como
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 25 AÑOS PRUEBA ESPECÍFICA QUÍMICA
 PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
PRUEBA DE ACCESO A LA UNIVERSIDAD PARA MAYORES DE 5 AÑOS QUÍMICA 1.- Cómo se nombra este compuesto? Seleccione la respuesta correcta a) -in-propano b) butano c) butino d) 1-in-propano CH C CH CH.- Una
GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN. Subsector: QUÍMICA Docente: Liduvina Campos A. Nombre alumno: Curso: Fecha:
 Liceo Polivalente Juan Antonio Ríos Quinta Normal GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN Unidad temática: Ejercicios de contenidos Guías 0 a 6 Objetivo General: Repaso de contenidos guías 0 a 6 Contenidos:
Liceo Polivalente Juan Antonio Ríos Quinta Normal GUIA DE REPASO 1º MEDIO PREPARACION EXAMEN Unidad temática: Ejercicios de contenidos Guías 0 a 6 Objetivo General: Repaso de contenidos guías 0 a 6 Contenidos:
Pegatina del Estudiante
 Examen 2015-16 Plan: [G25] ACCESO A GRADO PARA MAYORES DE 25 Asignatura: [558] Química Profesor: Lucas Castro Martínez Fecha: 28/04/2016 Horario peninsular 9:00-10:30 Pegatina del Estudiante Espacio para
Examen 2015-16 Plan: [G25] ACCESO A GRADO PARA MAYORES DE 25 Asignatura: [558] Química Profesor: Lucas Castro Martínez Fecha: 28/04/2016 Horario peninsular 9:00-10:30 Pegatina del Estudiante Espacio para
Cantidad de sustancia. Gases. Disoluciones.
 1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
1. ÁTOMOS Y MOLÉCULAS. MOLES 1.1. En 68 gramos de amoniaco, calcular: a) el número de moléculas de amoniaco; b) el número de átomos que hay en total; c) el número de moléculas de hidrógeno y nitrógeno.
LEYES PONDERALES Y ESTEQUIOMETRIA- ESTEQUIOMETRIA (ejercicios)
 LEYES PONDERALES Y ESTEQUIOMETRIA- ESTEQUIOMETRIA (ejercicios) ESTEQUIOMETRIA DE REACCIONES Indicadores de Evaluación: Representan reacciones químicas en una ecuación de reactantes y productos. Formulan
LEYES PONDERALES Y ESTEQUIOMETRIA- ESTEQUIOMETRIA (ejercicios) ESTEQUIOMETRIA DE REACCIONES Indicadores de Evaluación: Representan reacciones químicas en una ecuación de reactantes y productos. Formulan
CONCEPTOS BÁSICOS DE QUÍMICA
 CONCEPTOS BÁSICOS DE QUÍMICA IES La Magdalena. Avilés. Asturias Los átomos de distintos elementos pueden unirse mediante un enlace (iónico o covalente) formando un compuesto. Cuando se forma un compuesto
CONCEPTOS BÁSICOS DE QUÍMICA IES La Magdalena. Avilés. Asturias Los átomos de distintos elementos pueden unirse mediante un enlace (iónico o covalente) formando un compuesto. Cuando se forma un compuesto
H2SO4 (aq)+ NaOH (aq) Na2SO4 (aq)+ H2O (líq)
 1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
1. Calcular la pureza (en %) de una muestra de carburo de calcio (CaC 2) sabiendo que al tratar 2,056 g de éste con agua se obtiene hidróxido de calcio y 656 ml de acetileno (C2H2) medidos a 22º C y 730
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES
 GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
HOJA Nº 6. REACCIONES QUÍMICAS (II)
 HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
HOJA Nº 6. REACCIONES QUÍMICAS (II) 1. El cobre reacciona con el ácido sulfúrico para producir sulfato de cobre (II), dióxido de azufre y agua. Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a.
Estequiometría. 1. MASA ATÓMICA DE UN ELEMENTO. UNIDAD DE MASA ATÓMICA (u.m.a).
 Estequiometría 1 Estequiometría 1. MASA ATÓMICA DE UN ELEMENTO. UNIDAD DE MASA ATÓMICA (u.m.a). Dalton afirmó que cada átomo tiene una masa propia y diferente de la de cualquier otro átomo. Por otra parte,
Estequiometría 1 Estequiometría 1. MASA ATÓMICA DE UN ELEMENTO. UNIDAD DE MASA ATÓMICA (u.m.a). Dalton afirmó que cada átomo tiene una masa propia y diferente de la de cualquier otro átomo. Por otra parte,
B. Cuál es su número atómico y másico? Di cuántos protones y neutrones hay en el núcleo y electrones en la corteza.
 Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
Problema nº 0 Los isótopos del boro se representan así: B 5 5 B. Cuál es su número atómico másico? Di cuántos protones neutrones ha en el núcleo electrones en la corteza. El número atómico es Z = 5, el
GUÍA DE REFUERZO PRUEBA DE SÍNTESIS II SEMESTRE (1ª parte)
 Firma Apoderado GUÍA DE REFUERZO PRUEBA DE SÍNTESIS II SEMESTRE (1ª parte) Nombre: Curso: 10 th Grade Subsector: Química Fecha: Entrega 12 de noviembre Objetivos: Evaluar los contenidos y habilidades desarrollados
Firma Apoderado GUÍA DE REFUERZO PRUEBA DE SÍNTESIS II SEMESTRE (1ª parte) Nombre: Curso: 10 th Grade Subsector: Química Fecha: Entrega 12 de noviembre Objetivos: Evaluar los contenidos y habilidades desarrollados
Director de Curso Francisco J. Giraldo R.
 Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
Director de Curso Francisco J. Giraldo R. REACCIONES QUÍMICAS Evidencia de las reacciones químicas Cambio físico la composición química de una sustancia permanece constante. Fundir hielo Cambio químico
Tema 0. Conceptos Básicos en Química. Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones
 Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
Tema 0. Conceptos Básicos en Química Química Átomo: números másicos y atómicos Mol Fórmulas Reacciones químicas Gases Disoluciones Qué es la Química? Ciencia que trata de la composición y propiedades de
PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN
 PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN 1) Razona si los procesos siguientes son físicos o químicos: a. La fermentación del azúcar. b. Formación de hielo. c. Destrucción de la
PENDIENTES 3ºE.S.O. FÍSICA Y QUÍMICA ACTIVIDADES DE RECUPERACIÓN 1) Razona si los procesos siguientes son físicos o químicos: a. La fermentación del azúcar. b. Formación de hielo. c. Destrucción de la
La uma, por ser una unidad de masa, tiene su equivalencia en gramos:
 UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
SOLUCIONES. Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva Santiago (Concepción)
 SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
SOLUCIONES Dr. José Francisco Acuña Elgueta Docente de Química Facultad de Agronomía Universidad de Concepción Lic. Sandra Williams Pinto Profesora de Química Colegio Instituto de Humanidades Alfredo Silva
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS
 PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
PIU SABATINO SERIE I QUÍMICA COORDINACIÓN DE QUÍMICA Y LABORATORIOS 1. De acuerdo a la posición de los elementos en la tabla periódica, cuál de los siguientes compuestos será el más iónico? a) NaCl b)
Estequiometría a de Solución
 Estequiometría a de Solución Universidad de Puerto Rico Recinto de Mayagüez Curso Química General I Dra. Jessica Torres 1 Temas: Preparando una solución Molaridad Iones en solución Dilución Estequiometría
Estequiometría a de Solución Universidad de Puerto Rico Recinto de Mayagüez Curso Química General I Dra. Jessica Torres 1 Temas: Preparando una solución Molaridad Iones en solución Dilución Estequiometría
TRANSFORMACIONES QUÍMICAS 1.- SUSTANCIAS PURAS, ELEMENTOS Y COMPUESTOS
 TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
TRANSFORMACIONES QUÍMICAS - Sustancias puras, elementos y compuestos. - Leyes ponderales de la Química. - Teoría atómica de Dalton. - Hipótesis de Avogadro. - Masas atómica y molecular. Mol. - Leyes de
1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F. 4 - Expresa en moles: 4,5 g de agua; 0,3 g de hidrógeno; 440 g de dióxido de carbono
 ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
ÁTOMOS, MOLÉCULAS Y MOLES 1- Calcula la masa de los siguientes átomos: Al; Mg; Ca; N y F 2- Calcula la masa de las siguientes moléculas: HNO 3 ; PH 3 ; Cl 2 O; N 2 O 5 y CCl 4 3 - Cuantos moles de oxígeno
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO PUEDAS, CON UNA ONG.
 SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
SI TODOS AYUDAMOS CONSEGUIREMOS UN MUNDO MEJOR. COLABORA, COMO UEDAS, CON UNA ONG. OIÓN A CUESTIÓN.- Justifica si cada una de las siguientes afirmaciones es verdadera o falsa: a) En la reacción S + O SO,
Capítulo 3 Relaciones de masa en las reacciones químicas
 Capítulo 3 Relaciones de masa en las reacciones químicas En este capítulo se estudian los conceptos de conservación de masa con el objeto de ayudar al estudiante a comprender los cambios químicos. Al terminar
Capítulo 3 Relaciones de masa en las reacciones químicas En este capítulo se estudian los conceptos de conservación de masa con el objeto de ayudar al estudiante a comprender los cambios químicos. Al terminar
6. ELEMENTOS Y COMPUESTOS
 6. ELEMENTOS Y COMPUESTOS 1. Cuáles son metales y cuáles no metales de los siguientes elementos: carbono, azufre, cobre y aluminio? Por qué? Son metales el cobre y el aluminio, y son no metales el carbono
6. ELEMENTOS Y COMPUESTOS 1. Cuáles son metales y cuáles no metales de los siguientes elementos: carbono, azufre, cobre y aluminio? Por qué? Son metales el cobre y el aluminio, y son no metales el carbono
TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos.
 Física y Química Curso 2012/13 3º E.S.O. TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A
Física y Química Curso 2012/13 3º E.S.O. TEMA 3: La materia. Propiedades eléctricas y el átomo. 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A
Ejemplo de resolución de problemas sobre masa molecular relativa, masa molecular absoluta y masa de un mol de sustancia *
 Ejemplo de resolución de problemas sobre masa molecular relativa, masa molecular absoluta y masa de un mol de sustancia * Profesor Eduardo Abraham Escárcega Pliego 19 de julio de 2002 Índice 1. Introducción
Ejemplo de resolución de problemas sobre masa molecular relativa, masa molecular absoluta y masa de un mol de sustancia * Profesor Eduardo Abraham Escárcega Pliego 19 de julio de 2002 Índice 1. Introducción
DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I)
 COLEGIO HISPANO-INGLÉS DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I) NOMBRE: DPTO.FÍSICA-QUÍMICA CURSO:1º DE BACH A y B 1.- Un hidrocarburo gaseoso contenido en un matraz de 500 ml en condiciones normales
COLEGIO HISPANO-INGLÉS DIVERTIDISIMOS EJERCICIOS PARA NAVIDAD (I) NOMBRE: DPTO.FÍSICA-QUÍMICA CURSO:1º DE BACH A y B 1.- Un hidrocarburo gaseoso contenido en un matraz de 500 ml en condiciones normales
Iniciación a la Química 315. Tema 6. Reacciones de transferencia de electrones. 6.1.- Reacciones de oxidación reducción
 Iniciación a la Química 315 Tema 6 Reacciones de transferencia de electrones 6.1.- Reacciones de oxidación reducción Aspectos teóricos: Ajuste de reacciones redox 6.1.1 Concepto de óxido reducción El concepto
Iniciación a la Química 315 Tema 6 Reacciones de transferencia de electrones 6.1.- Reacciones de oxidación reducción Aspectos teóricos: Ajuste de reacciones redox 6.1.1 Concepto de óxido reducción El concepto
Estequiometria estequio metría
 La estequiometria es el concepto usado para designar a la parte de la química que estudia las relaciones cuantitativas de las sustancias y sus reacciones. En su origen etimológico, se compone de dos raíces,
La estequiometria es el concepto usado para designar a la parte de la química que estudia las relaciones cuantitativas de las sustancias y sus reacciones. En su origen etimológico, se compone de dos raíces,
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS
 UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
UNIDAD 5: LOS ÁTOMOS Y LAS MOLÉCULAS Lee atentamente: 1. LA MISMA SUSTANCIA EN LOS TRES ESTADOS Todos los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc. Todas
(g) CO 2. (g) + 2 H 2. Procediendo en la misma forma con la segunda ecuación, obtenemos: (g) 3 CO 2. (g) + 4 H 2
 Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
Para ajustar el oxígeno, escribiremos otro dos delante de la molécula de oxígeno gaseoso en los reactivos. De este modo, la ecuación ajustada del primer proceso es: CH (g) + 2 O 2 (g) CO 2 (g) + 2 H 2
RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I)
 RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I) 1. Es un problema de estequiometría básico. Sustancia dato: CO 2. Sustancia problema: C 2 H 2 Reacción ajustada: C 2 H 2 + 1/2O 2 2CO 2 + H 2 O a) Calculo
RESOLUCIÓN DE PROBLEMAS DE ESTEQUIOMETRÍA (I) 1. Es un problema de estequiometría básico. Sustancia dato: CO 2. Sustancia problema: C 2 H 2 Reacción ajustada: C 2 H 2 + 1/2O 2 2CO 2 + H 2 O a) Calculo
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 7: REACCIONES REDOX Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 5, Opción A Reserva, Ejercicio, Opción A Reserva,
REACCIONES QUÍMICAS. Conceptos fundamentales:
 REACCIONES QUÍMICAS Conceptos fundamentales: Una molécula de una determinada sustancia pura constituye el representante elemental de dicha sustancia, es decir, la cantidad más pequeña de ella que posee
REACCIONES QUÍMICAS Conceptos fundamentales: Una molécula de una determinada sustancia pura constituye el representante elemental de dicha sustancia, es decir, la cantidad más pequeña de ella que posee
QUÍMICA 2º Bachillerato Ejercicios: Reacciones de Oxidación Reducción (II)
 1(10) Ejercicio nº 1 El KCl reacciona con KMnO 4, en medio ácido sulfúrico, para dar cloro gaseoso, sulfato de manganeso (II), agua y sulfato de potasio. a) Iguale la ecuación molecular por el método del
1(10) Ejercicio nº 1 El KCl reacciona con KMnO 4, en medio ácido sulfúrico, para dar cloro gaseoso, sulfato de manganeso (II), agua y sulfato de potasio. a) Iguale la ecuación molecular por el método del
COLEGIO SAN JOSÉ - Hijas de María Auxiliadora C/ Emilio Ferrari, 87 - Madrid Departamento de Ciencias Naturales
 TEMA 4. CÁLCULOS QUÍMICOS SOLUCIONES 3. Concepto de mol 1. Cuánto pesan 1,5 moles de óxido de hierro (III)? Datos de masa atómica: O = 16 u, Fe = 55,85 u - Peso Molecular Fe 2 O 3 = (2 55,85) + (3 16)
TEMA 4. CÁLCULOS QUÍMICOS SOLUCIONES 3. Concepto de mol 1. Cuánto pesan 1,5 moles de óxido de hierro (III)? Datos de masa atómica: O = 16 u, Fe = 55,85 u - Peso Molecular Fe 2 O 3 = (2 55,85) + (3 16)
Departamento de Física y Química Adaptaciones 3º E.S.O.
 Los elementos químicos se ordenan en la Tabla de los elementos (Tabla periódica) siguiendo el criterio de número atómico creciente, es decir, según el número de protones que tienen en el núcleo. El primer
Los elementos químicos se ordenan en la Tabla de los elementos (Tabla periódica) siguiendo el criterio de número atómico creciente, es decir, según el número de protones que tienen en el núcleo. El primer
REACCIONES QUÍMICAS MASA MOLES MOLÉCULAS ÁTOMOS ÁTOMOS. Factor de conversión N A = 6, partículas/mol
 REACCIONES QUÍMICAS CANTIDAD DE MATERIA La cantidad de sustancia se puede expresar en gramos (masa), en moles, moléculas o átomos. Podemos pasar de unas unidades a otras utilizando el siguiente esquema:
REACCIONES QUÍMICAS CANTIDAD DE MATERIA La cantidad de sustancia se puede expresar en gramos (masa), en moles, moléculas o átomos. Podemos pasar de unas unidades a otras utilizando el siguiente esquema:
CANTIDAD DE SUSTANCIA. EL MOL. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 CANTIDAD DE SUSTANCIA. EL MOL Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Es fácil contar los garbanzos que hay en un puñado de esta legumbre. Hay que tener más paciencia para contar
CANTIDAD DE SUSTANCIA. EL MOL Física y Química 3º de E.S.O. IES Isidra de Guzmán Introducción Es fácil contar los garbanzos que hay en un puñado de esta legumbre. Hay que tener más paciencia para contar
Estequiometría. Química General I 2013
 Estequiometría Química General I 2013 Estequiometría Es el estudio cuantitativo de reactivos y productos en una reacción química. Conceptos importantes Masa atómica Mol Peso molecular Masa atómica En química
Estequiometría Química General I 2013 Estequiometría Es el estudio cuantitativo de reactivos y productos en una reacción química. Conceptos importantes Masa atómica Mol Peso molecular Masa atómica En química
, que no está formado por moléculas, sino por una red cristalina en la que hay una proporción de dos átomos de flúor por cada átomo de calcio.
 7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
7 El mol y las reacciones químicas Contenidos Índice 1 2 3 4 Masa molecular y composición centesimal El mol y el número de Avogadro Las reacciones químicas Tipos de reacciones químicas 5 Estequiometría
Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros 1
 Departamento de Ingeniería Química y Química Inorgánica Universidad de Cantabria (SPAIN) Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros
Departamento de Ingeniería Química y Química Inorgánica Universidad de Cantabria (SPAIN) Fundamentos de Química 1er Curso de los Grados en Ingeniería de los Recursos Energéticos y de los Recursos Mineros
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 5, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 6, Opción
Ejercicios 3 (Soluciones) 2) Determinar el peso de 400 ml de ácido clorhídrico cuya densidad es de 1,16 g/ml R: 464 g
 Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
Profesor Bernardo Leal Química %p/p; %v/v, %p/v y densidad: Ejercicios 3 (Soluciones) 1) Cuantos gramos de azúcar deben ser diluidas en 140 g de agua para que la solución resultante tenga una concentración
Concepto de mol. Concepto de mol. Número de Avogadro
 Concepto de mol Concepto de mol. Número de Avogadro La masa de los átomos es muy pequeña. Si se toma como ejemplo el átomo de calcio, cuyo radio es de 2.10-8 cm, para completar una distancia de un centímetro
Concepto de mol Concepto de mol. Número de Avogadro La masa de los átomos es muy pequeña. Si se toma como ejemplo el átomo de calcio, cuyo radio es de 2.10-8 cm, para completar una distancia de un centímetro
En este curso abordamos la clasificación de las reacciones químicas tomando en cuenta los siguientes aspectos:
 IV. LA REACCIÓN QUÍMICA Ejemplos de Clasificación de la Reacción Química Aún cuando en la bibliografía más utilizada en los cursos de Química General se habla constantemente de la reacción química, en
IV. LA REACCIÓN QUÍMICA Ejemplos de Clasificación de la Reacción Química Aún cuando en la bibliografía más utilizada en los cursos de Química General se habla constantemente de la reacción química, en
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Estequiometría I: leyes y conceptos de la estequiometría Nº Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema
Programa Técnico Profesional QUÍMICA Estequiometría I: leyes y conceptos de la estequiometría Nº Ejercicios PSU Para la solución de algunos de los ejercicios propuestos, se adjunta una parte del sistema
INSTITUTO FRANCISCO POSSENTI, A.C
 INSTITUTO FRANCISCO POSSENTI, A.C Per crucem ad lucem BACHILLERATO TECNOLÓGICO EN INFORMÁTICA (BTCININ07) GUÍA PARA EL EXAMEN EXTRAORDINARIO DE QUÍMICA II SEGUNDO SEMESTRE TEMA I: ESTEQUIOMETRÍA Contesta
INSTITUTO FRANCISCO POSSENTI, A.C Per crucem ad lucem BACHILLERATO TECNOLÓGICO EN INFORMÁTICA (BTCININ07) GUÍA PARA EL EXAMEN EXTRAORDINARIO DE QUÍMICA II SEGUNDO SEMESTRE TEMA I: ESTEQUIOMETRÍA Contesta
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II HOJAS DE TRABAJO UNIDAD IV DISOLUCIONES Libros a utilizar:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II HOJAS DE TRABAJO UNIDAD IV DISOLUCIONES Libros a utilizar:
Relaciones de masa en las reacciones químicas
 Relaciones de masa en las reacciones químicas Capítulo 3 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Micro-mundo Átomos y moléculas Macro-mundo gramos La
Relaciones de masa en las reacciones químicas Capítulo 3 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Micro-mundo Átomos y moléculas Macro-mundo gramos La
Problemas de Química (1ero Grado de Química). Tema 1.
 Problemas de Química (1ero Grado de Química). Tema 1. CÁLCULOS BÁSICOS 1. Expresa en notación científica, indicando en cada caso el número de cifras significativas: a) 258292 b) 1804, 5289 c) 0, 48 d)
Problemas de Química (1ero Grado de Química). Tema 1. CÁLCULOS BÁSICOS 1. Expresa en notación científica, indicando en cada caso el número de cifras significativas: a) 258292 b) 1804, 5289 c) 0, 48 d)
Solución: Serie problemas para entregar ÁCIDO-BASE
 Solución: Serie problemas para entregar ÁCIDO-BASE 1.- El ácido metanoico, HCOOH, es un ácido débil porque en disolución acuosa no está totalmente disociado. Al disolver 4,6 g de ácido metanoico en 1 litro
Solución: Serie problemas para entregar ÁCIDO-BASE 1.- El ácido metanoico, HCOOH, es un ácido débil porque en disolución acuosa no está totalmente disociado. Al disolver 4,6 g de ácido metanoico en 1 litro
Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p
 1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
1s Los números indican los niveles de energía. 2s 2p Las letras la forma del orbital. 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p Diagrama de orbitales: Consiste en dibujar los orbitales como cuadrados
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva 2, Ejercicio 5,
LA ESTRUCTURA ATÓMICA
 LA ESTRUCTURA ATÓMICA Esta constituye una clave importante en la comprensión de la química moderna. El conocimiento de la estructura atómica nos proporciona una idea clara de cómo está constituida la materia
LA ESTRUCTURA ATÓMICA Esta constituye una clave importante en la comprensión de la química moderna. El conocimiento de la estructura atómica nos proporciona una idea clara de cómo está constituida la materia
